ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 5, с. 711-716
УДК 547.241.547.497.1
ВЗАИМОДЕЙСТВИЕ ТРИЭТИЛФОСФОНАЦЕТАТА,
ДИЭТИЛАЦЕТАЛЯ БРОМУКСУСНОГО АЛЬДЕГИДА И
ДИЭТОКСИФОСФОРИЛУКСУСНОГО АЛЬДЕГИДА С
ТИОМОЧЕВИНОЙ И (ТИО)СЕМИКАРБАЗИДОМ
© 2023 г. Г. Э. Аллахвердиева1, В. М. Исмаилова2, И. А. Мамедов2, Н. Н. Юсубов2,*
1 Гянджинский государственный университет, Гянджа, AZ-2000 Азербайджан
2 Бакинский государственный университет, ул. З. Халилова 23, Баку, АZ-1148 Азербайджан
*е-mail: yniftali@gmail.com
Поступило в редакцию 29 сентября 2022 г.
После доработки 3 апреля 2023 г.
Принято к печати 5 апреля 2023 г.
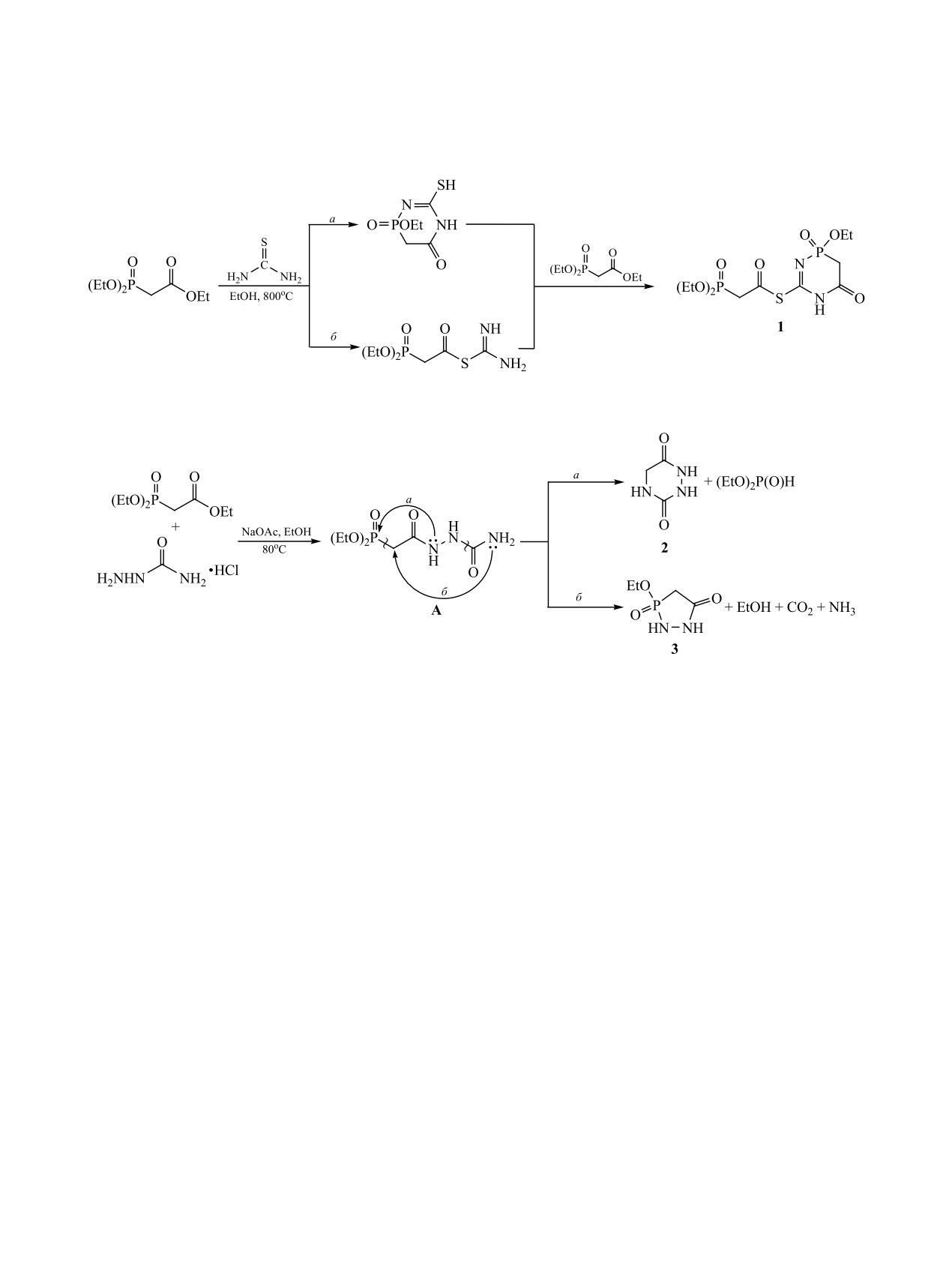
Установлено, что конденсация тиокарбамида с триэтилфосфонацетатом приводит к S-фосфорилирован-
ному 2-этокси-4-оксо-3,4,5-тригидро-1,5,2-диазафосфинин-2-оксиду, изостеру тиобарбитурата. В анало-
гичных условиях триэтилфосфонацетат реагирует с семикарбазидом с промежуточным образованием
2-(диэтоксифосфорилацетил)гидразин-1-карбоксамида, который при расщеплении связи Р-С образует
триазин, а при расщеплении связи C-N - 1,2,3-фосфадиазол. В аналогичных условиях конденсация
триэтилфосфонацетата с тиосемикарбазидом протекает с разрывом связи Р-С и гетероциклизацией с
образованием производного 1,3,4-тиадиазина. При конденсации диэтилацеталя бромацетальдегида с
тиосемикарбазидом образуется 4Н-1,3,4-тиaдиазин-2-амин. (Диэтоксифосфорил)ацетальдегид реагирует
с тиосемикарбазидом в этих же условиях в соотношении 1:2, образуя линейный продукт - тиофосфато-
иминогидразон (диэтоксифосфорил)ацетальдегида.
Ключевые слова: триэтилфосфонацетат, (диэтоксифосфорил)ацетальдегид, диэтилацеталь бромаце-
тальдегида, (тио)семикарбазиды, фосфaдиазин, тиадиазин
DOI: 10.31857/S0044460X23050062, EDN: DBUOJE
Одним из подходов к созданию многофункци-
Ранее было показано, что взаимодействием
ональных лекарственных препаратов широкого
фосфонацетатов с мочевиной в присутствии ал-
спектра действия является синтез новых типов со-
коголятов были получены первые представители
единений, содержащих в своей структуре фосфор-
фосфорных аналогов барбитуратa [14]. В насто-
и азотсодержащие группы [1-4].
ящей работе приводятся результаты изучения ре-
Изучен широкий спектр реакций карбониль-
акций триэтилфосфонацетата, ацеталя бромаце-
тальдегида и (диэтоксифосфорил)ацетальдегида с
ных соединений с азот-, серо- и фосфорсодержа-
тиомочевиной, семикарбазидом и тиосемикарба-
щими основаниями приводящий к образованию
зидом.
фосфорных и серных аналогов барбитуратa, азот-,
фосфор- и серосодержащих гетероциклических
Конденсацию триэтилфосфонацетата с тио-
соединений [5-8], представляющих интерес в ка-
карбамидом проводили при температуре 80-90°С
честве компонентов ингибиторов коррозии [9, 10],
в течение 6-8 ч при мольном соотношении реаген-
инсектицидов [11], фармакологических и химио-
тов 2:1. Было установлено, что продуктом реакции
терапевтических средств [12, 13]
является S-(2-этокси-2-оксидо-4-оксо-3,4,5-три-
711
712
АЛЛАХВЕРДИЕВА и др.
Схема 1.
Схема 2.
гидро-1,5,2-диазафосфинин-6-ил)-2-(диэтокси-
Конденсация фосфонацетата с гидрохлоридом
фосфорил)этантиоат 1, образование которого воз-
семикарбазида в присутствии ацетата натрия при
можно по двум направлениям (схема 1). В первом
80°С в этаноле протекает с образованием соответ-
варианте допускается конденсация фосфонацетата
ствующего амида, который в дальнейшем распада-
с тиомочевиной с образованием фосфонбарбиту-
ется по связи Р-С с образованием триазина 2, ко-
рата, который в дальнейшем конденсируется со
торый описан в работе [15], и расщеплением связи
второй молекулой фосфонацетата, образуя соеди-
С-N с образованием производного 1,2,3-фосфади-
нение 1. Во втором варианте предполагается, что
зола 3 в соотношении 4:1 (схема 2). В аналогичных
за счет конденсации взятых компонентов образу-
условиях реакция фосфонацетата с гидрохлоридом
ется тиоэфир, который в дальнейшем реагирует со
тиосемикарбазида также протекает с разрывом
второй молекулой фосфонацетата с образованием
связи и образованием производного тиадиазина 4
соединения 1.
(схема 3). Видимо, на начальной стадии реакции
фосфонацетата с тиосемикарбазидом образуется
В спектре ЯМР 1Н соединения 1 наличие ду-
тиоурониевое производное, которое в результате
блета в области 2.65 м. д. с 3JНР 20.7 Гц и двух
гетероциклизации с разрывом связи Р-С превра-
этоксигрупп при фосфоре с химическими сдвига-
щается в соединение 4.
ми δ 1.0-1.05 (6Н, 3JHH 6.9 Гц) и 3.9-4.1 м. д. (4Н)
характеризует экзоциклический фосфорный фраг-
В спектре ЯМР 1Н соединения 4 уширенные
мент. Этоксигруппа у фосфора в цикле проявляет-
сигналы при 7.15 и 7.6 м. д. следует отнести к
ся сигналами в области 1.20-1.30 и 3.15 м. д. (2JHP
протонам у атома азота. Узкий синглет в области
21.6 Гц). Протону при атоме азота соответствует
8.6 м. д. соответствует иминогруппе. Сигнал в
уширенный сигнал в области 9.85 м. д.
области 3.6 м. д. относится к метиленовой груп-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
ВЗАИМОДЕЙСТВИЕ ТРИЭТИЛФОСФОНАЦЕТАТА
713
Схема 3.
O
O
(EtO)2P
O
O
OEt
O
O
NH2
+
NaOAc, EtOH
(EtO)2P
S
S
SH
80oC
S
N
HN
HN
N
NH2
N
NH
HCl
NH2
H2NHN
NH2
H
4
Схема 4.
OEt
Br
OEt
OEt
+
NaOAc, EtOH-H2O
H2O
S
S
OEt
S
O
S
N
S
NH
30-80oC
-H2O
N
N
N
N
HCl
H2NHN
NH2
H2N
NH2
H2N
NH2
H2N
H2N
5
Схема 5.
O
(EtO)2P
O
O
O
+
NaOAc, EtOH
H
H
S
(EtO)2P
N NH2
(EtO)2P
N NH
80oC
N
N
HCl
S
SH
H2NHN
NH2
O
O
O
(EtO)2P
H
OEt
H
O
OEt
(EtO)
N S
OEt
(EtO)2P
N S
+
2P
-H
N
P
-CH
N
P
2CH2O
O
OEt
NH
NH
O
6
O
пе. В спектре ЯМР 13С сигналы при 56, 157.9 и
которая в дальнейшем в результате внутримолеку-
187 м. д. отнесены к углеродным атомам мети-
лярной гетероциклизации образует продукт 5.
леновой, имино- и карбонильной групп соответ-
Сигналы в спектре ЯМР 1Н соединения 5 в
ственно.
области 6.7 (дублет, 3JHH 10.0 Гц) и 7.05-7.2 м. д.
Изучена также конденсация диэтилацеталя
(два дублета, 3JHH 10.0, 3JHNH 8.0 Гц) подтвержда-
бромуксусного и фосфонуксусного альдегида с
ют цис-строение и наличие структурного фрагмен-
тиосемикарбазидом в водно-спиртовой фазе. В
та S-CH=CH-NH. Присутствие групп NH и NH2
результате реакции указанного ацеталя с тиосе-
характеризуется наличием уширенных сигналов в
микарбазидом получено производное тиадиазина
области 4.85 и 5.25 м. д.
5 (схема 4). Следует полагать, что на начальной
В аналогичных условиях тиосемикарбазон, по-
стадии этой реакции образуется тиурониевая соль,
лученный на основе реакции фосфонуксусного
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
714
АЛЛАХВЕРДИЕВА и др.
альдегида с тиосемикарбазидом, в дальнейшем ре-
1,2,4-Триазинан-3,6-дион
(2). Смесь
5 г
агирует с молекулой фосфонуксусного альдегида
гидрохлорида семикарбазида, 3.7 г ацетата натрия и
с участием атома тиольной серы c последующим
9 мл триэтилфосфонацетата в 25 мл этилового
распадом по связи Р-С, образуя 2-[2-(диэтоксифос-
спирта постепенно нагревали до 80°С и переме-
форил)этилиден]гидразин-1-карбамид(диэтил-
шивали в течение 8 часов, затем охлаждали до
фосфорид)тиоангидрид 6 (схема 5).
5-8°С. Полученную смесь разбавляли водой, вы-
павший осадок отфильтровали и сушили. Выход
В спектре ЯМР 1Н соединения 6 присутству-
ет дублет в области 2.86 м. д. с 2JНР 20.0 Гц, со-
4.2 г (73%), т. пл. 260°С [15]. Из водной фазы через
ответствующий группе РСН2. Химический сдвиг
72 ч выпадали белые кристаллы 3-этокси-1,2,3-ди-
фосфора данного фрагмента составляет 18.2 м. д.,
аза-фосфолидин-5-он-3-оксида (3). Выход 1.2 г
что характерно для фосфонатной структуры. Тио-
(17%), т. пл. 110°С. Cпектр ЯМР 1Н (ДМСО-d6), δ,
фосфатному фосфору следует отнести сигнал в
м. д.: 1.23 т (3Н, СН3, 3JHH 6.9 Гц), 2.8 д (2Н, РСН2,
области -2 м. д. В спектре ЯМР 1Н уширенные
2JHP 21.0 Гц), 3.84-4.13 м (2Н, СН2О, 3JHH 6.9 Гц),
сигналы в области 7.34 и 7.56 м. д. соответствуют
8.34 с (Н, NH), 8.37 c (H, NH). Найдено, %: С 30.45;
водородные атомы при азотах.
Н 6.03; N 17.65; P 18.43. C4H9N2O3P. Вычислено,
%: C 29.26; H 5.48; N 17.07; P 18.90.
Таким образом, в реакции α-замещенных кар-
бонильных соединений с семикарбазидом атаку-
2-Имино-1,3,4-тиадиазинан-6-он (4). К рас-
ющим атомом является атом азота гидразинового
твору 5.6 г гидрохлорида тиосемикарбазида, 3.6 г
фрагмента, а в реакции с тиомочевиной и тиосе-
ацетата натрия в 30 мл этилового спирта добавля-
микарбазидом - сера. Полученные S-, N- и Р- со-
ли 10 г триэтилфосфонацетата. Смесь постепенно
держащие гетероциклы могут быть компонентами
нагревали до 80°С и выдерживали в течение 8 ч,
биологически активных веществ.
затем выливали в охлажденную воду. Осадок от-
фильтровывали и сушили. Выход 3.5 г (68%), т. пл.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
134°С. Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 3.43 с
(2H, CH2), 7.17 уш. с (1H, NH), 7.63 уш. с (1H, NH),
Спектр ЯМР 1Н и 13С записывали на спектроме-
8.61 с (1H, NH=). Спектр 13С (ДМСО-d6), δC, м. д.:
тре Bruker AV-300 [300 (1H) и 75 (13С) МГц], вну-
56.0 (СН2), 157.9 (NH), 187 (C=O). Найдено, %: C
тренний стандарт - ТМС. Температуру плавления
30.12; H 4.09; N 12.43; S 26.64. C3H5N3OS. Вычис-
определяли на приборе SMP 30 Stuart.
лено, %: C 30.25; H 4.20; N 12.64; S 26.89.
S-(2-Этокси-2-оксидо-4-оксо-3,4,5-триги-
4Н-1,3,4-Тиадиазин-2-амин (5). К смеси 2.5 г
дро-1,5,2-диазафосфинин-6-ил)-2-(диэтоксифос-
гидрохлорида тиосемикарбазида, 1.66 г ацетата
форил)этантиоат (1). Смесь 1.25 г тиокарбами-
натрия, растворенного в 20 мл воды, и 20 мл эти-
да и 5 мл триэтилфосфонацетата в 20 мл этанола
лового спирта при перемешивании добавляли 4 г
постепенно нагревали до 80°С и перемешивали в
бромацеталя диэтилуксусного альдегида. Смесь
течение 8 ч. Легкокипящие компоненты удаляли
перемешивали 1 ч при комнатной температуре,
в вакууме. Выход 2.47 г (70%), т. пл. 135-137°С.
затем 3 ч при 30-40°С и 2 ч при 80°С. После ох-
Cпектр ЯМР 1H (ДМСО-d6), δ, м. д.: 1.15 т (6H,
лаждения осадок отфильтровывали и сушили.
СН3СН2О, 3JHH 7.2 Гц), 1.23 т (3H, СН3СН2О, 3JHH
Выход 1.5 г (67%), т. пл. 150°С. Спектр ЯМР 1H
6.9 Гц), 2.65 д (2H, PCH2, 2JPH 20.7 Гц), 3.15 д (2H,
(ДМСО-d6), δ, м. д.: 4.85 уш. с (1H, NH), 5.25 уш. с
PCH2, 2JРН 21.7 Гц), 3.77-3.86 м (6H, CH2O, 3JHH
(2H, NH2), 6.7 д (1Н, SCН=, 3JНН 10.0 Гц), 7.13 д. д
7.2 Гц), 9.02 с (1H, NH). Спектр ЯМР 13C (ДМ-
(1Н, =СНNH, 3JHH 10.0, 3JHNH 8.0 Гц). Найдено, %:
СО-d6), δС, м. д.: 14.28, 14.36, 14.47, 16.42, 16.50,
C 31.06; H 4.05; N 36.34; S 27.67. C3H5N3S Вычис-
16.79, 16.88, 24.82, 32.99 д (РСН2, 2JCP 130.5),
лено, % : C 31.30; H 4.34; N 36.52; S 27.82.
35.31, 36.88 д (PCН2 2JCP 117.6), 39.81, 60.27, 60.37,
61.20, 62.35, 62.43, 166.03, 168.37(COS), 169.72
2-[2-(Диэтоксифосфорил)этилиден]гидра-
(CONH). Найдено, %: C 35.08; H 5.47; N 6.73; P
зинкарбамидо(диэтоксифосфорил)тиоангидрид
16.65; S 7.72. C11H20O7N2P2S. Вычислено, %: C
(6). К раствору 1 мл фосфонуксусного альдегида
34.19; H 5.18; N 7.25; P 16.06; S 8.29.
в 20 мл этилового спирта добавляли 1.5 г ацета-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
ВЗАИМОДЕЙСТВИЕ ТРИЭТИЛФОСФОНАЦЕТАТА
715
та натрия, растворенного в 20 мл воды. Получен-
5.
Матвеева Е.Д., Подругина Т.А., Колесникова И.Н.,
ную смесь нагревали на водяной бане до полного
Присяжной М.В., Каратеев Г.Г., Зефиров Н.С. //
Изв. РАН. Cер. хим. 2010. Т. 59. № 2. С. 409;
растворения. К полученной смеси добавляли 0.52
Matveeva E.D., Podrugina T.A., Kolesnikova I.N.,
г гидрохлорида тиосемикарбазида, затем посте-
Prisyazhnoi M.V., Karateev G.G., Zefirov N.S. // Russ.
пенно нагревали до 80°С и выдерживали в тече-
Chem. Bull. 2010. Vol. 59. N 2. P. 418. doi 10.1007/
ние 6 ч. После охлаждения смесь обрабатывали
s1172-010-0095-2
диэтиловым эфиром. Кристаллы, образовавшиеся
6.
Матвеева Е.Д., Подругина Т.А., Колесникова И.Н.,
из эфирной вытяжки, отфильтровывали и сушили.
Зефиров Н.С. // Изв. РАН. Cер. хим. 2010. Т. 59. № 2.
Выход 1 г (82%), т. пл. 165°С. Спектр ЯМР 1Н (ДМ-
С. 403; Matveeva E.D., Podrugina T.A., Kolesniko-
СО-d6), δ, м. д.: 1.24-1.2.6 м (12H, CH3, 3JHH 7.2 Гц),
va I.N., Zefirov N.S. // Russ. Chem. Bull. 2010. Vol. 59.
2.85 к (2H, PCH2, 2JHP 20.0 Гц), 3.92-4.03 м (8H,
N 2. P. 411. doi 10.1007/s1172-010-0094-3
CН2O, 3JHH 7.2 Гц), 7.28 д (1H, CH=, 3JHH 13.0, 3JHP
7.
Mатвеева Е.Д., Подругина Т.А., Шарутин И.В.,
11.0 Гц), 7.34 с (1H, NH), 7.56 с (1H, =NH). Спектр
Зефиров Н.С. // Изв. РАН. Cер. хим. 2012. Т. 61. № 2.
С. 384; Matveeva E.D., Podrugina T.A., Sharution I.V.,
ЯМР 13C (ДМСО-d6), δС, м. д.: 16.54, 16.61, 16.78,
Zefirov N.S. // Russ. Chem. Bull. 2012. Vol. 61. N 2 P.
17.21, 19.09, 29.91 д (РСН2, 2JСP 130.2), 31.69,
386. doi 10.1007/s11172-012-0054-1
61.21, 61.30 (ОСН2, 3JCP 10.0 Гц), 62.10, 62.19,
8.
Певзнер Л.М., Ремизов Ю.О., Петров М.Л. // ЖОХ.
138.49, 138.61, 162.36, 178.27 (N=C-S). Найде-
2015. T. 85. № 1. С. 67; Pevzner L.M., Remizov Yu.O,
но, %: C 34.58; H 6.97; N 9.43; S 7.76; P 15.03.
Petrov М.L. // Russ. J. Gen. Chem. 2015. Vol. 85. N 1.
C11H25O6N3SP2. Вычислено, %: C 33.93; H 6.42; N
P. 61. doi 10.1134/S1070363215010119
10.79; S 8.22; P 15.93.
9.
Аюбова М.Р., Аллахвердиева Г.Э., Исмаилов В.М. //
Молодой ученый. 2020. № 4(94). С. 1.
КОНФЛИКТ ИНТЕРЕСОВ
10.
Pat. US 11547712.2023.B2
11.
Bosch J., Salas M., Amat M., Alvares M., Adrover B. //
Авторы заявляют об отсутствии конфликта
Tetrahedron. 1991. Vol. 47. N 28. P. 5269. doi
интересов.
10.1016/50040-4020(01087138-6
12.
Rabasso N., Fadel A. // Synthesis. 2008. Vol. 15.
СПИСОК ЛИТЕРАТУРЫ
P. 2353. doi 10.1055/s-2008-1067130
1. Diel P., Maier L.
// Phosphorus, Sulfur,
13.
Соколов В.Б., Аксиненко А.Ю., Горева Т.В., Епиши-
Silicon, Relat. Elem. 1988. Vol. 36. P. 85. doi
на Т.А., Габрельян А.В., Григорьев В.В. // ЖОХ.
10.1080/03086648808079002
2020. Т. 90. № 1. С. 42; Sokolov V.B., Aksienko A.Yu.,
2. Kafarski P., Lejczak B. // Phosphorus, Sulfur,
Coreva T.V., Epishina T.A., Gabrel’yan A.B., Grigo-
Silicon, Relat. Elem. 1991. Vol. 63. P. 193. doi
riev V.V. // Russ. J. Gen. Chem. 2020. Vol. 90. N 1.
10.1080/104265091080029443
Р. 32. doi 10.1134/S1070363220010053
3. Antipin I.S., Stoikov I.I., Konovalov A.I. // Phosphorus,
14.
Шабан Радван, Исмаилов В.М., Юсубов Н.Н.,
Sulfur, Silicon, Relat. Elem. 1999. Vol. 144. P. 347. doi
Гулиев А.Н. // III Республиканская конференция
10.1080/10426509908546252
молодых ученых-химиков. Баку, 1988. C. 196.
4. Ahluwalia V.K., Aggarwae R. // Proc. Indian Nat. Sci.
15.
Schman T.J. // J. Heterocycl. Chem. 1983. Vol. 20. N 3.
Acad. 1996. Vol. 5. N 5. P. 369.
Р. 547. doi 10.1002/jhet.5570200312
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023
716
АЛЛАХВЕРДИЕВА и др.
Reactions of Triethyl Phosphonoacetate,
Bromoacetaldehyde Diethyl Acetal,
and (Diethoxyphosphoryl)acetaldehyde with Thiourea
and (Thio)semicarbazide
G. E. Allahverdiyevaa, V. M. Ismailovb, I. A. Mamedovb, and N. N. Yusubovb,*
a Ganja State University, Gandja, AZ-2000 Azerbaijan
b Baku State University, Baku, AZ-1148 Azerbaijan
*e-mail: yniftali@gmail.com
Received September 29, 2022; revised April 3, 2023; accepted April 5, 2023
Condensation of thiocarbamide with triethyl phosphonoacetate leads to S-phosphorylated 2-ethoxy-4-oxo-
3,4,5-trihydro-1,5,2-diazaphosphinine-2-oxide, an isostere of thiobarbiturate. Under similar conditions, triethyl
phosphonoacetate reacts with semicarbazide with the intermediate formation of 2-(diethoxyphosphorylacetyl)
hydrazine-1-carboxamide, which forms a triazine upon cleavage of the P-C bond and 1,2,3-phosphadiazole
upon cleavage of the C-N bond. Under analogous conditions, the condensation of triethyl phosphonoacetate
with thiosemicarbazide proceeds with cleavage of the Р-С bond and heterocyclization with the formation of the
1,3,4-thiadiazine derivative. Upon condensation of bromoacetaldehyde diethyl acetal with thiosemicarbazide,
4H-1,3,4-thiadiazine-2-amine was formed. (Diethoxyphosphoryl)acetaldehyde reacts with thiosemicarbazide
under the same conditions in a ratio of 1:2, forming a linear product, thiophosphatoiminohydrazone of (diethoxy-
phosphoryl)acetaldehyde.
Keywords: triethyl phosphonoacetate, (diethoxyphosphoryl)acetaldehyde, bromoacetaldehyde diethylacetal,
(thio)semicarbazides, phosphadiazine, thiadiazine
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 5 2023