ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 6, с. 840-857
УДК 544.12/15/18;547.781
ВНУТРИМОЛЕКУЛЯРНЫЕ НЕКОВАЛЕНТНЫЕ
ВЗАИМОДЕЙСТВИЯ В ДИКАТИОНАХ
БИСИМИДАЗОЛИЯ С КОРОТКИМИ
АЛИФАТИЧЕСКИМИ МОСТИКАМИ
© 2023 г. О. М. Заречная1, В. А. Михайлов1,*
1 Институт физико-органической химии и углехимии имени Л. М. Литвиненко,
ул. Р. Люксембург, 70, Донецк, 283050 Россия
*e-mail: v_mikhailov@yahoo.com
Поступило в редакцию 12 марта 2023 г.
После доработки 7 мая 2023 г.
Принято к печати 12 мая 2023 г.
Конформационный анализ бисимидазолиевых дикатионов с короткими алифатическими (С1-С4) и
гидроксилзамещенным (-СН2-СНОН-СН2-) мостиками выявил предпочтительность структур с макси-
мально вытянутой трансоидной конфигурацией алкильных фрагментов. Молекулярный электростати-
ческий потенциал в дикатионах распределен неравномерно, с максимумами в области С2Н имидазола
и мостиковых атомов водорода для α,ω-алкенильных, и в области гидроксильного атома водорода для
гидроксипропанового мостиков. Внутримолекулярные водородные связи С-Н···ОН вносят свой вклад
в существенно больший (по сравнению с полиметиленовыми) барьер вращения по связи С1-С2 в дика-
тионах с гидроксипропановым мостиком.
Ключевые слова: бисимидазолиевые соли, молекулярный электростатический потенциал, внутримо-
лекулярные водородные связи
DOI: 10.31857/S0044460X23060033, EDN: FKASGI
Дикатионные бисимидазолиевые соли привлек-
стей [18], ионных жидких кристаллов [19] и ионных
ли значительное внимание как класс первоначаль-
пластичных кристаллов [20, 21]. В последние годы
но в качестве предшественников гетероцикличе-
возростает интерес к апротонным ионным жидко-
ских карбенов [1-9] и металлоциклов на их основе
стям (ИЖ) [22], ионным жидким кристаллам [23] и
с комплексом уникальных каталитических свойств
ионным пластичным кристаллам [24, 25], что свя-
[10, 11], хотя синтез отдельных представителей
зано с успешным применением в катализе [26, 27] и
этой группы был осуществлен гораздо раньше [12].
с перспективами использования в устройствах по-
Впоследствии длинноцепочечные производные
лучения [28, 29], хранения [30] и преобразования
бисимидазолиевых солей в водных растворах про-
[31] энергии; соответственно, возрастает запрос на
явили свойства поверхностно активных веществ
новые вещества со свойствами ионных жидкостей
(ПАВ) с высоким поверхностным давлением
и ионных кристаллов. Дикатионные бисимидазо-
[13, 14], агрегатообразователей с очень низкими
лиевые соли, как корневая структура, предоставля-
критическими концентрациями мицеллообразо-
ют наиболее широкие синтетические возможности
вания и разнообразной морфологией ассоциатов
для структурных изменений (в сравнении с моно-
[15, 16], бактерицидной, фунгицидной и антипро-
катионными имидазолиевыми, а также аммоние-
лиферативной активностью [17], ионных жидко-
выми и фосфониевыми), необходимых для направ-
840
ВНУТРИМОЛЕКУ
ЛЯРНЫЕ НЕКОВАЛЕНТНЫЕ ВЗАИМОДЕЙСТВИЯ
841
Схема 1.
N
N
NH NH
N
N
N
N
N
N
N
N
1
2
3
1
3
2'
1'
1'
2'
2
3'
3'
N
N
N
N
N
N
N
N
HN
NH
N
N
O
5'
4'
O H
H
4
5
6
C9H21
-
N
N
N
2Br
C9H21
C9H21
2Br-
N
N
NH NH
N
C9H21
8
7
O
N
N
N
N
C9H21
N
N
C9H21
2X
HN
NH
O
O
OH
OH
2
OH
9, 10
11
X = Cl (9), Br (10).
ленной модификации ионных жидкостей [32, 33].
и применение расчетных методов более высокого
Подобная направленность модификации ониевых
уровня может оказаться полезным для понимания
ионных жидкостей достижима только при ясном
процессов и действующих сил. Перспективным
понимании движущих сил и структурных моти-
представлялось провести расчеты структурных и
вов надмолекулярной организации ионных жид-
энергетических характеристик дикатионов биси-
костей (нано- [32] и микроструктуризации [34] в
мидазолиевых солей на уровне DFT с использова-
жидкой фазе), и самоассоциации ПАВ в растворах
нием функционала, ориентированного на оценку
[13, 15, 16]. Между тем некоторые особенности
нековалентных взаимодействий, с последующим
строения дикатионных бисимидазолиевых со-
анализом распределения электронной плотности
лей не вполне ясны даже на внутримолекулярном
и молекулярного электростатического потенциала.
уровне, как, например, преимущественно тран-
Для оценки структурных отнесений на основе дан-
соидная (максимально вытянутая) конформация
ных ЯМР представлялось полезным [45] сравнить
алифатического мостика [35-38] в твердой фазе
расчетные и экспериментальные спектры моле-
и в растворе [39], при том, что барьеры вращения
кул в разных растворителях, как это было сдела-
вокруг ординарных углерод-углеродных и угле-
но ранее применительно к имидазолиевым солям
род-азотных связей в простых молекулах крайне
[46, 47] и вторичным спиртам [48].
невелики [40-42], и в жидкой фазе предполагает-
Объекты исследования. Особенности строе-
ся существенный вклад изогнутых конформаций.
ния дикатионов 1-6 изучены с применением рас-
Для решения этих структурных задач в ряде случа-
четных методов, результаты расчетов сопоставле-
ев эффективным оказалось применение расчетных
ны с экспериментальными данными для дибромидa
квантово-химических методов, преимущественно
бис(3′-нонилимидазолий-1′-ил)метана
7, дибро-
полуэмпирических [43, 44], и молекулярной ме-
мидa
1,2-бис(3′-нонилимидазолий-1′-ил)этана
8,
ханики [39]. Расширение круга объектов расчета
дихлорида
1,3-бис(3′-нонилимидазол-1′-ил)-2-ги-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
842
ЗАРЕЧНАЯ, МИХАЙЛОВ
Таблица 1. Электронные энергии Etot, термические поправки к энергии Гиббса Gcorr, энергии Гиббса G наиболее ста-
бильных конформеров дикатионов бисимидазолиевых солей и их относительная стабильность ∆Gi (уровень ωB97X/
def2-SVP, газовая фаза)
Конформер
Etot, а. е.
Gcorr, а. е.
G, а. е.
∆Gi, кДж/моль
1 M01
-569.277215
0.198419
-569.078796
0
1 M02
-569.276031
0.198139
-569.077892
2.37
2 M01
-608.575626
0.225607
-608.350019
0
2 M02
-608.575650
0.225630
-608.350020
0.00
3. M01
-647.869758
0.252765
-647.616994
0
3 M02
-647.869628
0.252736
-647.616892
0.27
3 M03
-647.865882
0.253000
-647.612882
10.81
3 M04
-647.866571
0.253031
-647.613539
9.07
4 M01
-687.160381
0.279949
-686.880433
0
4 M02
-687.160336
0.279961
-686.880375
0.15
4 M03
-687.156490
0.280091
-686.876399
10.60
5 M01
-723.013186
0.257561
-722.755626
0
5 M02
-723.013104
0.257522
-722.755582
0.12
5 M03
-723.012643
0.257515
-722.755128
1.31
дроксипропана
9, дибромида
1,3-бис(3′-нонил-
3′ расположен таким образом, что одна из С-Н
имидазол-1′-ил)-2-гидроксипропана 10, диоксала-
связей находится в плоскости имидазолиевого
та 1,3-бис(имидазол-1′-ил)-2-гидроксипропана 11.
кольца (в заслоненной конформации); такая кон-
Структуры солей 1-11 и нумерация атомов приве-
фигурация характерна и для основного состояния
дены на схеме 1.
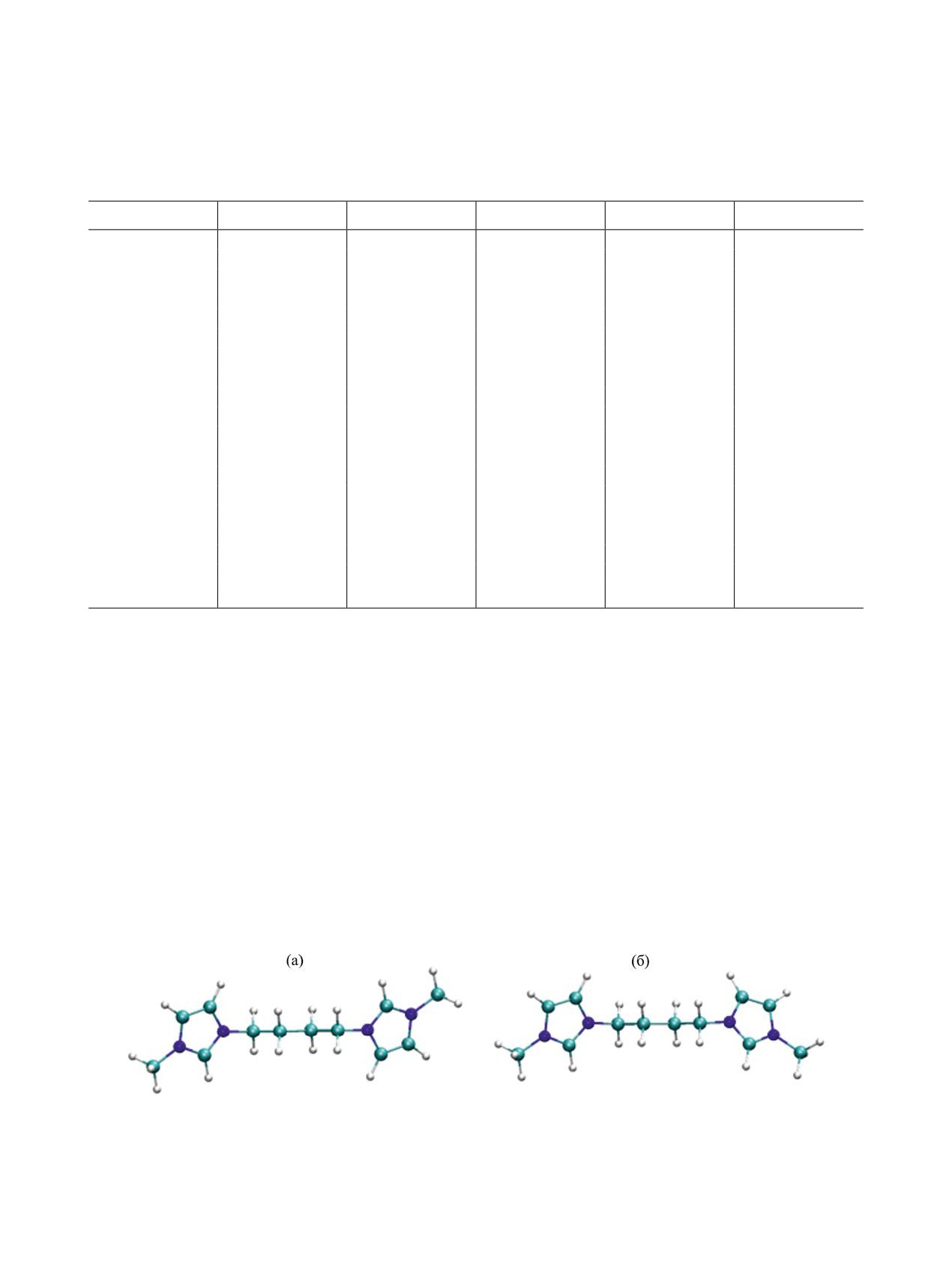
простейшего N-метилимидазола [42]. Атомы угле-
Геометрия и энергетические характеристи-
рода полиметиленовых мостиков (с числом ато-
ки дикатионов. Все приведенные в табл. 1 тер-
мов углерода n = 2, 3, 4) и присоединенные к ним
мохимические результаты (электронные энергии,
атомы азота имидазолиевых циклов образуют пло-
энергии Гиббса, распределение конформеров) от-
скость во всех наиболее устойчивых конформерах
носятся к стандартным условиям (298 K, 1 атм).
2-4, отклоняясь от этой плоскости менее чем на
0.003 Å; при этом циклы располагаются на мак-
Расчетные энергии испытывают заметное вли-
симально возможном (в рамках углеродного ске-
яние не только уровня приближения (ωB97X/
лета) удалении друг от друга. Плоскости имидазо-
def2-SVP или ωB97M-V/def2-TZVPP), но и вир-
лиевых циклов 1-4 почти перпендикулярны этой
туальной среды (табл. 2). Это, в свою очередь,
оказывает влияние на соотношение конформеров
плоскости центрального фрагмента. Наиболее
стабильные конформеры М01 и М02 одного и того
и величину усредненных расчетных химических
сдвигов в спектрах ЯМР.
же дикатиона отличаются главным образом ори-
ентацией метильного заместителя относительно
Межатомные расстояния и углы между связя-
плоскости центрального фрагмента: в конформе-
ми во всех расчетных структурах соответствуют
рах М02 метильные заместители расположены по
типичным значениям для органических соедине-
одну сторону этой плоскости (супрафациально), в
ний углерода и азота [49], отличия не превышают
конформерах М01 - по разные стороны (антарафа-
0.01 Å. В расчетных структурах дикатионов 1-4 с
циально) (рис. 1, на примере дикатиона 4).
нефункционализованными алкиленовыми мости-
ками -(CH2)n- выявлены как общие структурные
Экспериментальные структуры известны толь-
особенности, так и специфические для отдельных
ко для бисимидазолиевых солей с алкиленовыми
групп конформеров. Во всех без исключения кон-
мостиками -(СН2)n-. В ряде случаев расчетные
формерах метильный заместитель в положении
геометрии дикатионов близки к эксперименталь-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
ВНУТРИМОЛЕКУ
ЛЯРНЫЕ НЕКОВАЛЕНТНЫЕ ВЗАИМОДЕЙСТВИЯ
843
Таблица 2. Расчетные одноточечные энергии Etot, (ωB97M-V/def2-TZVPP//ωB97X/def2-SVP), термические поправки
к энергии Гиббса Gcorr (ωB97X/def2-SVP), энергии Гиббса G (ωB97M-V/def2-TZVPP//ωB97X/def2-SVP) и относи-
тельное содержание конформеров в различных средах
Среда
Конформер
Etot, а. е.
Gcorr, а. е.
G, а. е.
fBolz
1 M01
-569.811843
0.198419
-569.613424
0.73
Газ
1 M02
-569.810621
0.198139
-569.612482
0.27
1 M01
-570.083273
0.199087
-569.884186
0.53
Вода
1 M02
-570.082858
0.198776
-569.884082
0.47
1 M01
-570.029755
0.198889
-569.830866
0.59
CHCl3
1 M02
-570.029144
0.198631
-569.830513
0.41
2 M01
-609.138535
0.225607
-608.912928
0.50
Газ
2 M02
-609.138561
0.225630
-608.912931
0.50
2 M01
-609.345582
0.225511
-609.120071
0.57
CHCl3
2 M02
-609.345489
0.225687
-609.119802
0.43
5 M01
-723.697149
0.257561
-723.439588
0.39
Газ
5 M02
-723.696951
0.257522
-723.439429
0.33
5 M03
-723.696794
0.257515
-723.439279
0.28
5 M01
-723.950100
0.257738
-723.692362
0.31
H2O
5 M02
-723.950264
0.257487
-723.692777
0.49
5 M03
-723.949717
0.257779
-723.691938
0.20
5 M01
-723.898344
0.256966
-723.641378
0.11
CHCl3
5 M02
-723.900375
0.257337
-723.643038
0.65
5 M03
-723.899428
0.257284
-723.642144
0.24
но установленным для кристаллических структур.
энергетические предпочтения, найденные в расче-
На рис. S1 и S2 (см. Дополнительные материалы)
те (табл. 1).
сопоставлены расчетные и экспериментальные
Во всех энергетически выгодных конформерах
структуры. Как видно из рис. S1 и S2, энергети-
гидроксилсодержащего дикатиона 5 гидроксиль-
чески выгодная расчетная структура может прева-
ный атом водорода антиперипланарен метиновому
лировать и в эксперименте (в кристалле). С дру-
атому водорода относительно связи С-О. В род-
гой стороны, гибкость полиметиленовой цепочки
ственной структуре 2-пропанола более выгодной
позволяет реализовываться и другим конформа-
считается синклинальная гош-конфигурация [41].
циям. Очевидно, влияние противоаниона и эф-
фекты упаковки важны для выбора конформации
Центральный фрагмент дикатиона 5 (три углерод-
в кристалле. Для условно свободной молекулы (в
ных атома мостика и два атома имидазолиевых
газовой фазе, в растворе) можно рассчитывать на
циклов) представляет собой слегка искаженную
Рис. 1. Различия в ориентации метильных заместителей в конформерах дикатиона 4 М01 (а) и М02 (б).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
844
ЗАРЕЧНАЯ, МИХАЙЛОВ
Рис. 2. Сопоставление структур 5 М01 (а) и 6 М01 (б).
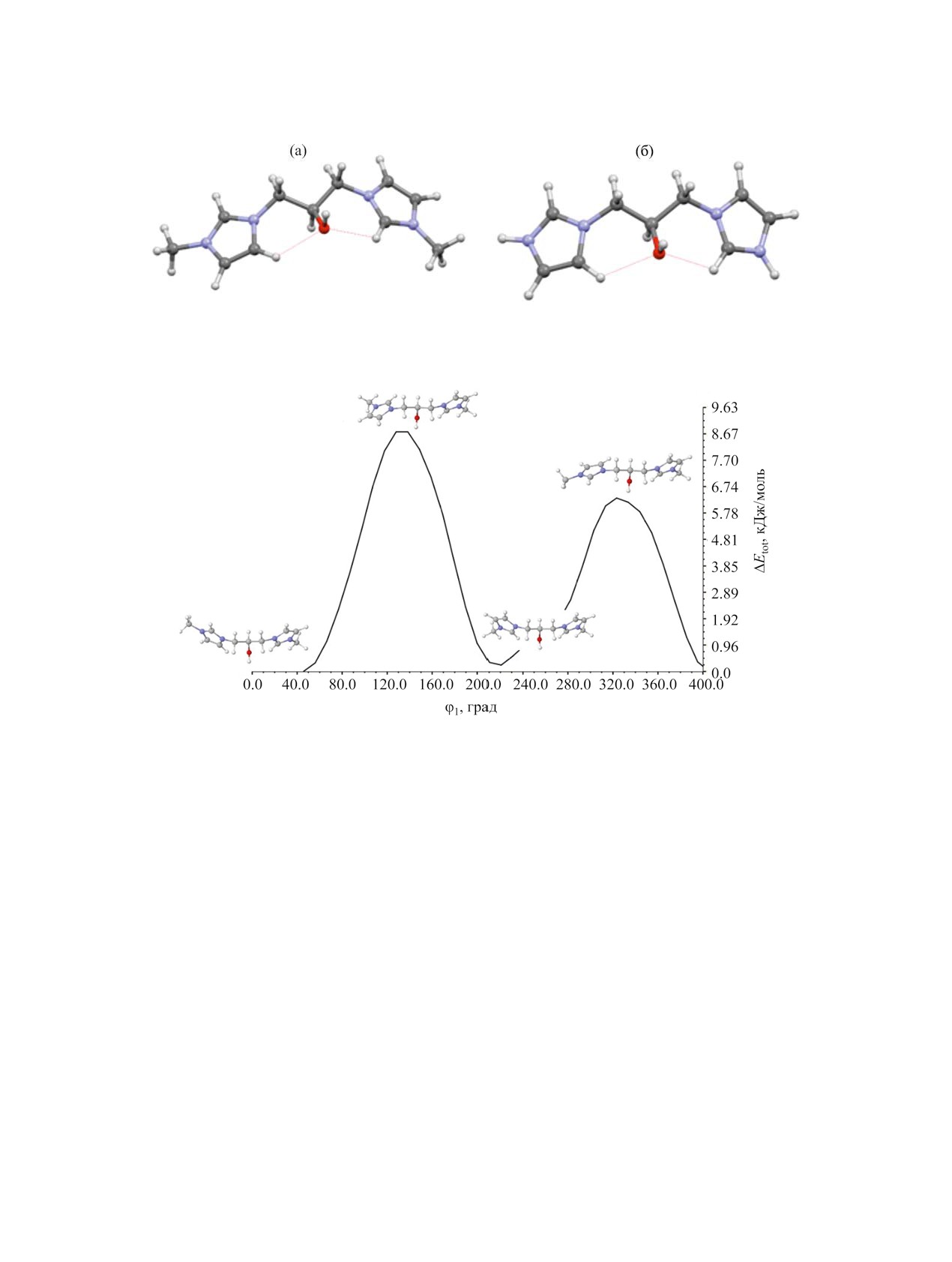
Рис. 3. Зависимость относительной энергии ΔEtot от двугранного угла φ1 C5′N1′С1С2 в дикатионе 5.
плоскость (двугранный угол N1′C1C2C3 превышает
Как следует из результатов табл. 1, разность
167°, максимальное отклонение от средней пло-
энергий конформеров дикатионов бисимидазоли-
скости 0.17 Å), по отношению к которой имидазо-
евых солей невелика, и в случае невысоких по-
льные циклы наклонены под углом 38-46°. В этой
тенциальных барьеров перехода между ними они
конфигурации атом водорода из положения 2′ или
будут составлять смесь, состав которой зависим
5′ каждого имидазолиевого цикла приближается к
от внешних условий и среды. Мы оценили барье-
гидроксильному атому кислорода на расстояние
ры отдельных конформационных переходов для
менее суммы [50-52] ван-дер-ваальсовых ради-
дикатиона 5 в рамках теории переходного состо-
усов (рис. 2, табл. ST1, см. Дополнительные ма-
яния. Взаимопревращение конформеров М01 и
териалы) для расчетных структур в газовой фазе.
М02 достигается при вращении имидазольного
Это межатомное расстояние увеличивается в ус-
цикла вокруг ординарной связи N1′-C1. Энерге-
ловных конденсированных средах (табл. ST1). Оп-
тический профиль этого процесса представлен на
тимизированные геометрии конформеров дикати-
рис. 3, где ΔEtot - относительная к Etot(M01) энер-
она 6 (деметилированного аналога 5) очень близки
гия. Потенциальная энергия Etot определялась на
структуре соответствующих конформеров 5 (рис.
уровне ωB97X/def2-SVP в зависимости от варьи-
2, пример для конформеров М01).
рования двугранного угла φ1 C5′N1′С1С), начиная
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
ВНУТРИМОЛЕКУ
ЛЯРНЫЕ НЕКОВАЛЕНТНЫЕ ВЗАИМОДЕЙСТВИЯ
845
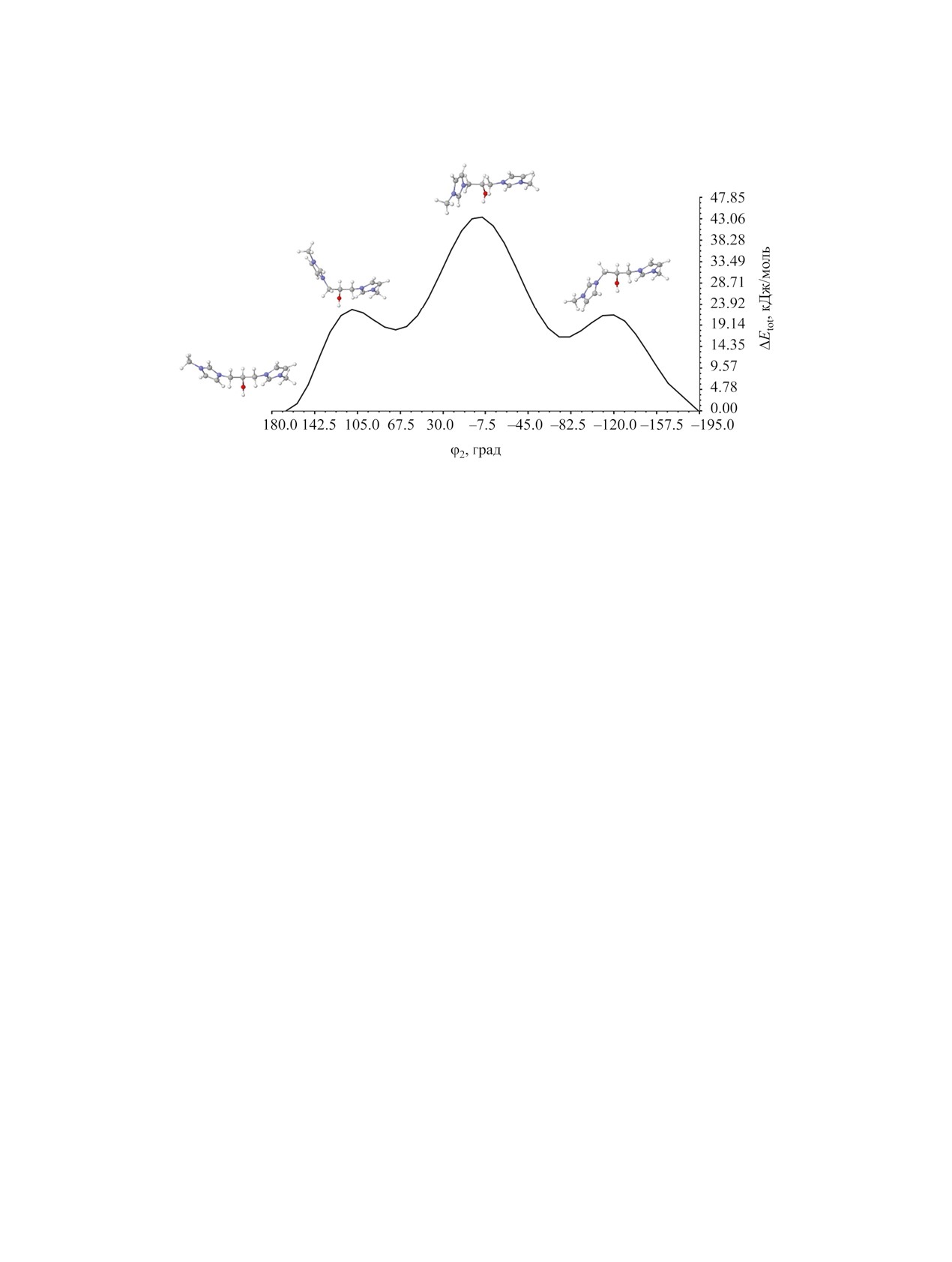
Рис. 4. Зависимость относительной энергии ΔEtot от двугранного угла φ2 N1′С1С2С3 в дикатионе 5.
от оптимальной геометрии дикатиона 5 M01 с ша-
го угла φ2 (N1′С1С2О) для вращения фрагмента
гом 10° (в диапазоне 360°), с релаксацией осталь-
ImCH2(СH-) вокруг связи C1-С2 в мостике дика-
ных геометрических параметров на каждом шаге
тиона 5 и соответствующий максимальный вра-
сканирования. Затем, для лучшей аппроксимации
щательный барьер (рис. 4). Локализация ПС и
величины вращательного барьера, структура, со-
расчет колебательных частот в районе экстрему-
ответствующая максимуму на потенциальной
ма показал одну мнимую колебательную частоту
кривой, была оптимизирована как переходное со-
(76i см-1). Рассчитанная величина ΔE≠tot = 43.68 и
стояние (ПС). Соответствие полученной структу-
37.68 кДж/моль для уровней ωB97X/def2-SVP и
ры седловой точке 1-го порядка подтверждалось
ωB97M-V/def2-TZVPP//ωB97X/def2-SVP соответ-
расчетом колебательных частот в гармоническом
ственно, что существенно выше, чем в случае вра-
приближении на том же уровне (получена одна
щения имидазольных циклов вокруг связи N1′-C1.
мнимая колебательная мода, 34i см-1). Величи-
Невысокие барьеры вращения (< 16 кДж/моль)
ну барьера оценивали как разницу энергий ΔE≠tot
были идентифицированы ранее для бисимидазо-
между энергиями минимально-энергетического
лиевых солей с алифатическими [43] и функцио-
конформера и соответствующего ПС. Конформер
нально замещенными [47] мостиками. В экспери-
М01 переходит в М02, преодолевая максималь-
менте незатрудненное (в масштабе времени ЯМР)
ный барьер ΔE≠tot = 8.83 кДж/моль. Уточнение ΔE≠tot
вращение вокруг ординарных С-С и С-N связей
на уровне ωB97M-V/def2-TZVPP//ωB97X/def2-
наблюдалось для бисимидазолиевых солей с али-
SVP приводит к уменьшению высоты барьера до
фатическими мостиками -(СН2)n- [44], в отличие
4.58 кДж/моль. В любом случае, предсказанные
от солей с мостиком -CH2CHOHCH2-. Барьер
величины барьеров незначительно превышают те-
~40 кДж/моль не может служить основанием для
пловую энергию [RT(298) ≈ 2.5 кДж/моль], что го-
ворит о довольно слабо заторможенном внутрен-
затрудненного вращения при обычных условиях,
которое наблюдается для солей с дикатионами 5
нем вращении имидазольных циклов вокруг связи
N1′-C1 и легкости конформационных переходов
и 6; очевидно, проведенный расчет не учитывает
М01↔М02 в дикатионе 5 при нормальных усло-
неких существенных обстоятельств.
виях. Вероятно, барьеры вращения имидазольных
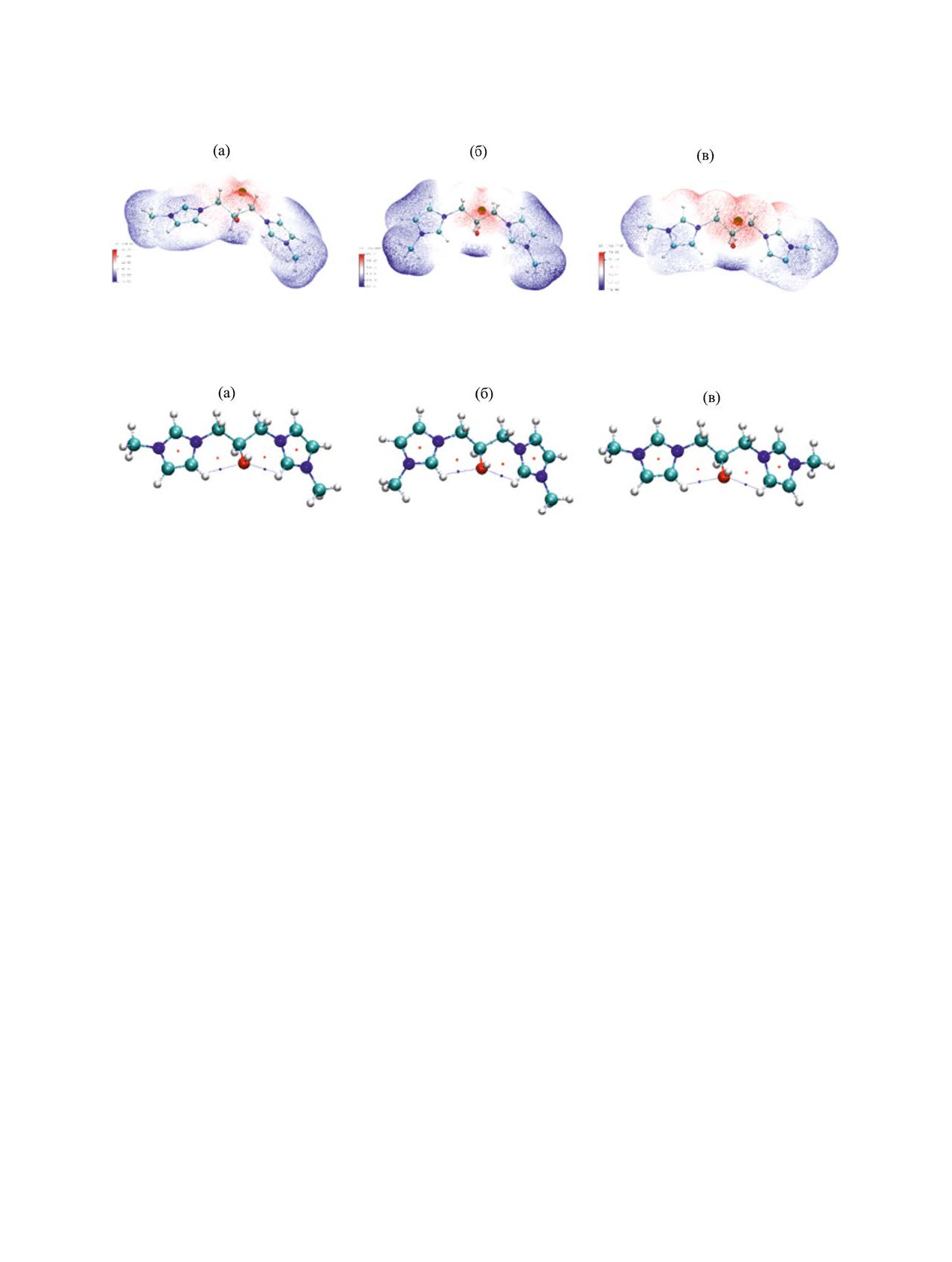
Распределение молекулярного электроста-
циклов в остальных дикатионах также невелики.
тического потенциала в дикатионах. Во всех
Аналогичным образом были получены зави-
дикатионах молекулярный электростатический
симость потенциальной энергии от диэдрально-
потенциал (МЭП) для изоповерхности электрон-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
846
ЗАРЕЧНАЯ, МИХАЙЛОВ
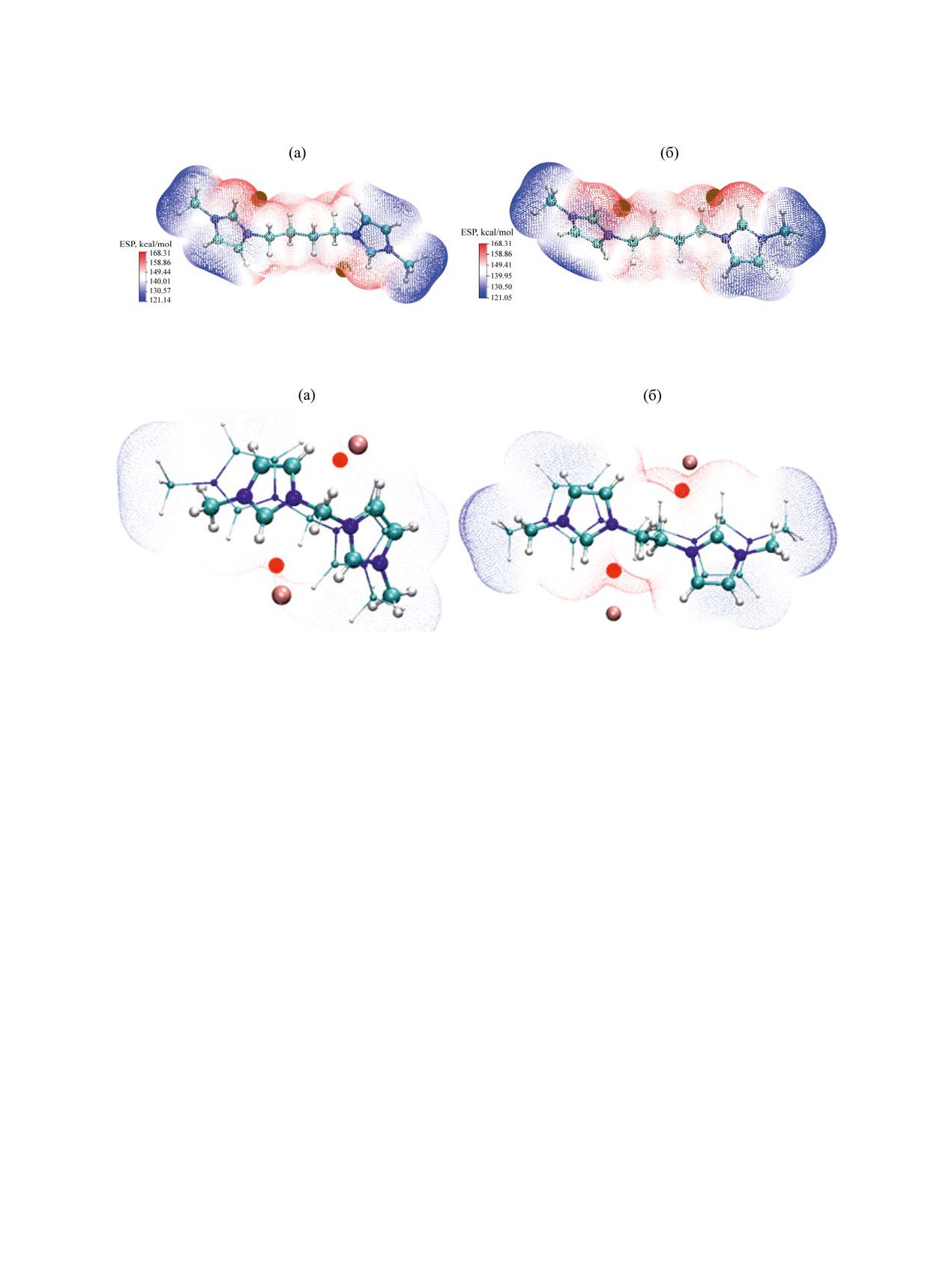
Рис. 5. Распределение молекулярного электростатического потенциала в дикатионе 3. (а) конформеры М01, (б) М02. Ко-
ричневые точки - область наибольшего положительного потенциала.
Рис. 6. Сопоставление расчетной структуры конформера 1 М02 с реальной кристаллической структурой дибромида
бис(3-метилимидазолий-1-ил)метана [53] (а), расчетной структуры конформера 2 М02 с реальной кристаллической структу-
рой дибромида бис(3′-метилимидазолий-1-ил)этана [54] (б). Красным выделены области наибольшего МЭП, коричневым -
анионы брома.
ной плотности 0.001 а. е. положительный, однако
от друга (тем самым вытягивая мостик в трансо-
распределен неравномерно (рис. 5); различия в по-
идную конфигурацию) и поворачиваться перпен-
тенциале отдельных участков молекулы составля-
дикулярно плоскости N-C…C-N для структур 2-4
ют десятки килокалорий на моль. С увеличением
с мостиками длиннее одного метилена.
длины мостика различия в потенциале отдельных
Отличающееся распределение найдено в ди-
участков молекулы (рис. S3-S5, см. Дополнитель-
катионах 5. Для этой структуры максимум поло-
ные материалы) уменьшаются. В кристаллах солей
жительного потенциала локализован вблизи атома
бисимидазолия сфероподобные галогенид-анионы
водорода гидроксила и метиленовых атомов водо-
тяготеют к размещению вблизи максимумов МЭП
рода мостика (рис. 7).
(рис. 6).
В виртуальных средах с большей полярно-
Как видно из рис. 5, 6, S3-S5, в расчетных струк-
стью различия в поверхностном потенциале раз-
турах 1-4 с нефункционализованными мостиками
ных участков дикатиона 5 усиливаются (рис. S6,
-(СН2)n- наибольший положительный потенциал
см. Дополнительные материалы). В конформерах
сосредоточен вблизи атомов водорода С2Н ими-
дикатиона 6 МЭП распределен аналогичным об-
дазолиевых колец и ближайших атомов водорода
разом (пример для конформера М01 приведен на
мостиковых метиленовых групп. Вероятно, это
рис. S6); максимум положительного потенциала
один из факторов, вынуждающих имидазолиевые
размещается вблизи атомов водорода гидроксила
циклы располагаться максимально удаленно друг
и метиленов мостика.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
ВНУТРИМОЛЕКУ
ЛЯРНЫЕ НЕКОВАЛЕНТНЫЕ ВЗАИМОДЕЙСТВИЯ
847
Рис. 7. Распределение молекулярного электростатического потенциала в дикатионе 5 в условном вакууме: М01 (а), М02
(б), М03 (в).
Рис. 8. Критические точки и пути связывания в конформерах 5 М01 (а), М02 (б), М03 (в). Синим цветом выделены атом
азота, пути связывания и критические точки связывания (3,-1) для внутримолекулярных водородных связей С-Н···ОН;
красным цветом выделены атомы кислорода и циклические критические точки (3,+1).
Распределение электронной плотности и
как сходная с ван-дер-ваальсовым (очень слабым)
связывающие взаимодействия в дикатионах.
аттрактивным взаимодействием (рис. S8). В дика-
Распределение электронной плотности в дика-
тионах 5 отчетливо проявляются нековалентные
тионах 1-4 типично для ковалентно связанных
взаимодействия С-Н···ОH (рис. 8), с участием
соединений; для всех связей С-Н и С-N выявле-
атома кислорода гидроксила и фрагментов имида-
ны пути связывания и критические точки связы-
золиевых циклов С2Н и С5Н (внутримолекулярные
вания с сигнатурой (3,-1), для имидазолиевых
водородные связи).
циклов - циклические критические точки с сиг-
Анализ другими методами (RDG) также вы-
натурой (3,+1) (см. пример на рис. S7, см. Допол-
являет внутримолекулярные водородные связи
нительные материалы). Среди дикатионов 1-4 с
С-Н···ОН (пример для конформера М01 дикати-
нефункционализованными мостиками призна-
она и 5, рис. S9, см. Дополнительные материалы).
ки дополнительных нековалентных взаимодей-
Аналогичное распределение электронной плотно-
ствий выявлены только в конформере М02 дика-
сти выявлено в конформерах дикатиона 6; на рис.
тиона 1, в котором электронная плотность между
S10 приведен пример для конформера М01 дика-
близкорасположенными атомами водорода двух
тиона 6 (см. Дополнительные материалы).
смежных имидазолиевых циклов (С5′-H…H-C5′
Плотность электронов ρ(r) в критических точ-
2.856Å) очень невелика (в минимуме 2.3×10-3 а. е.,
ках связывания (3,-1) для внутримолекулярных
рис. S7), но распределение электронной плотности
связей в дикатионах 5 и 6 на порядок выше, чем
между атомами типично для пути связывания (рис.
для слабой диводородной связи Н···Н в конфор-
S8, см. Дополнительные материалы), и вторая ком-
мере М02 дикатиона 1, однако на полтора порядка
понента гессиана плотности отрицательна. Это
ниже соответствующих величин для типичных ко-
взаимодействие аналогично взаимодействию двух
валентных связей; лапласиан электронной плотно-
ковалентно связанных атомов водорода [55, 56].
сти∇ρ2(r) положителен, отношение |V|/G близко к
В рамках концепции редуцированного градиента
единице (табл. ST2, см. Дополнительные материа-
плотности (RDG) [57, 58] эта область проявляется
лы). Такие значения типичны для взаимодействия
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
848
ЗАРЕЧНАЯ, МИХАЙЛОВ
закрытых оболочек [59]. Вклад этих внутримоле-
расчетных подходов не самоочевидна и требует
кулярных связей в энергию образования можно
обоснования.
оценить по приближенному уравнению [60]:
Спектры ЯМР дикатионов 1 и 2: расчет и
эксперимент. Для проверки эффективности ис-
E (хартри) = 1/2V(r).
(1)
пользуемого подхода (расчет и сопоставление с
Результаты для дикатиона 5 приведены в табл.
экспериментом) был произведен расчет спектров
ST3 (см. Дополнительные материалы); эти оценки
дикатионов с моно- и диметиленовым мостиком 1
пересчитаны в кДж/моль для удобства сравнения.
и 2; спектры реальных бисимидазолиевых солей
Другая оценка основана на корреляции энергии
с такими дикатионами наиболее просты, и их ин-
образования и плотности электронов в критиче-
терпретация не вызывает сомнений. В табл. SТ4
ской точке связывания [61] для всего набора водо-
(см. Дополнительные материалы) представлены
родно-связанных комплексов:
расчетные (для воды и хлороформа) конформа-
ционно усредненные химические сдвиги ядер с
E (ккал/моль) = -357.73ρ(r) + 2.6182.
(2)
полуцелыми спинами дикатионов 1 с эксперимен-
Для выборки комплексов с участием несущих
тально определенными в различных растворите-
зарядов [61] доноров (акцепторов):
лях химическими сдвигами протонов дибромида
7. Расчетные значения химических сдвигов 1H и
E (ккал/моль) = -332.34ρ(r) - 1.0661.
(3)
13C мало отличаются для воды и хлороформа, хотя
Численные значения величины Е
(29.6-
эти растворители резко отличаются по диэлектри-
51.6 кДж/моль) приведены в табл. ST3 (см. Допол-
ческой проницаемости/полярности и способности
нительные материалы). Расчет энергии внутримо-
сольватировать ионные частицы. По этой причи-
лекулярных водородных связей по другим прибли-
не расчет спектров ЯМР дикатиона 2 произведен
женным уравнениям [62] дает сходные численные
только для хлороформа. В табл. SТ5 (см. Допол-
величины (~ 30 кДж/моль), разброс которых также
нительные материалы) результаты сопоставлены
достаточно велик. Оценки по уравнениям (1)-(3)
с экспериментальными данными для дибромида
не отличаются высокой точностью [60, 61], но по-
8. Как видно из данных табл. SТ4 и SТ5, расчет-
зволяют отнести эти взаимодействия к водород-
ные химические сдвиги 1H дикатионов 1 и 2 в
ным связям средней силы, пренебрегать которыми
условном хлороформе близки к эксперименталь-
нет оснований. Эти водородные связи «скручива-
ным значениям для атомов водорода в положени-
ют» молекулу дикатионов 5 и 6 в конформации,
ях 4 и 5 имидазолиевых циклов в сильно диссо-
отличные от характерных для дикатионов 2-4, с
циирующих растворителях (диметилсульфоксид,
их перпендикулярной ориентацией имидазольных
вода); наибольшие отличия наблюдаются как раз
циклов относительно плоскости углеродных ато-
для реального хлороформа. Вероятно, это связано
мов мостика (см. выше). Из-за них же, по-види-
с преимущественной координацией галогенид-
мому, максимум МЭП смещен от имидазолиевых
аниона в областях наибольшего положительно-
атомов водорода к гидроксильному (рис. 7).
го потенциала (рис. 6), сосредоточенного вблизи
Спектры ЯМР. Спектры ЯМР 1H солей 7-10
C2H и водородов мостика (для этих дикатионов).
выглядят необычно сложными для системы из
Расчетные химические сдвиги 13C для имидазоли-
небольшого числа атомов, и отнесение сигналов
евых атомов углерода выглядят явно завышенны-
может быть поставлено под сомнение; в таких
ми, тогда как для алкильных фрагментов вполне
случаях может оказаться полезным сопоставить
правдоподобны; отличия от экспериментальных
теоретически рассчитанные спектры с экспери-
сопоставимы с разбросом собственно экспери-
ментальными. Расчет спектров ЯМР достаточно
ментальных, обусловленным разными условиями
широко применяется при анализе сложных спино-
записи спектра. Это обстоятельство позволяет рас-
вых систем [45], однако примеров использования
считывать на правдоподобную оценку (в расчете)
расчета применительно к бисимидазолиевым со-
химических сдвигов в солях с гидроксилсодержа-
лям в литературе очень мало [47]; эффективность
щим мостиком (кроме самого гидроксила).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
ВНУТРИМОЛЕКУ
ЛЯРНЫЕ НЕКОВАЛЕНТНЫЕ ВЗАИМОДЕЙСТВИЯ
849
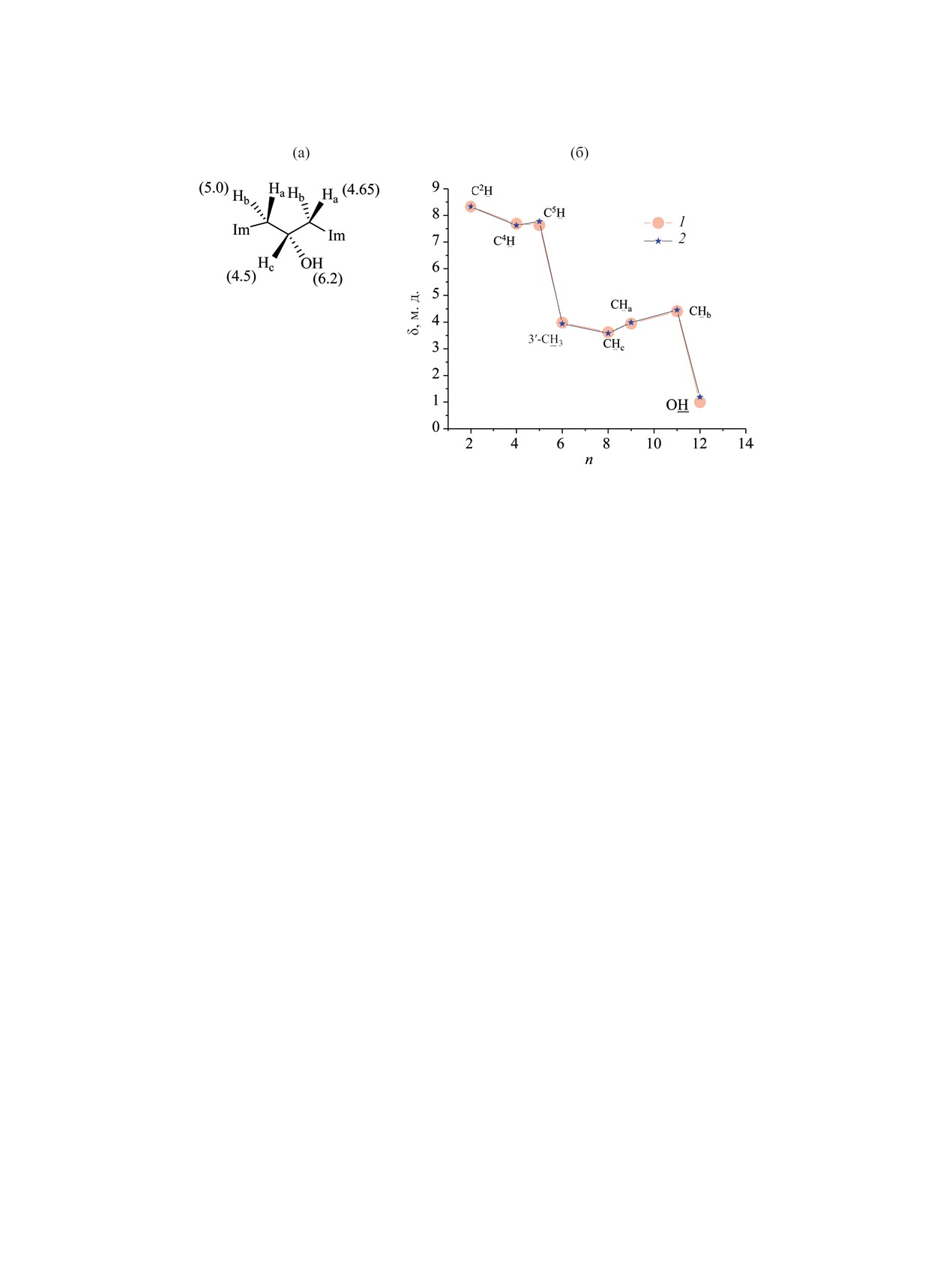
Рис. 9. Отнесение сигналов мостиковых протонов в спектре ЯМР 1H дихлорида 9 в CDCl3 (а) и сопоставление расчетных
химических сдвигов 1H дикатиона 5 (усредненные по трем изомерам М01, М02 и М03) в хлороформе и воде (б). 1 - СDCl3
расчет, 2 - D2O эксперимент.
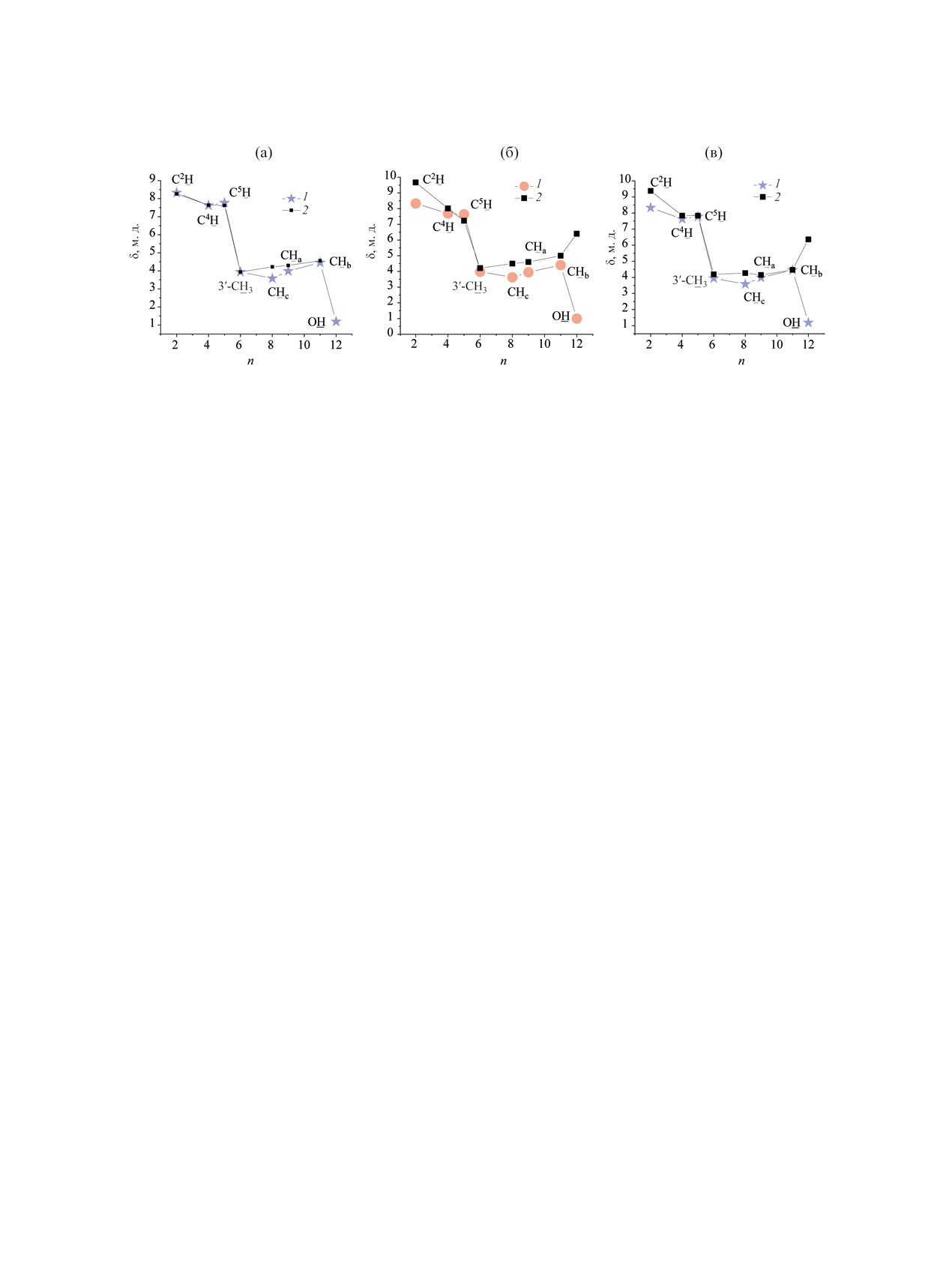
Сравнение расчетных и экспериментальных
ции с противоанионом и другими нуклеофилами
спектров ЯМР для солей с 2-гидроксипропановым
- компонентами среды - не имеет смысла. Столь
мостиком. Для солей с 2-гидроксипропановым
малая чувствительность по отношению к вирту-
мостиком кристаллические структуры неизвест-
альной среде позволяет сравнивать эксперимен-
ны, поэтому результаты непрямых структурных
тальные спектры в хлороформе и ДМСО с рас-
методов (спектральных, расчетных) представ-
четными спектрами в воде. Отличия для ДМСО
ляют наибольший интерес. Рассчитанные для
весьма существенны, однако для хлороформа они
свободных дикатионов 5 спектры ЯМР 1Н и 13C
еще больше (рис. 10).
в воде и хлороформе сопоставлены (табл. SТ6,
Различия расчетных и экспериментальных хи-
см. Дополнительные материалы) со спектрами
мических сдвигов 1H в воде гораздо меньше (рис.
реальных дихлоридов
1,3-бис(3′-нонилимида-
10). Хорошее соответствие расчетных и экспери-
зол-1′-ил)-2-гидроксипропана 9 и 1,3-бис(3′-ок-
ментально определенных химических сдвигов 1H
тилимидазол-1′-ил)-2-гидроксипропана
12
[63],
для дикатиона 5 и дихлорида 9 в D2O (несколько
а также дибромида
1,3-бис(3′-додецилимида-
худшее - для CDCl3 и ДМСО-d6) позволяет сде-
зол-1′-ил)-2-гидроксипропана 13 [64]. Отнесение
лать вывод, что в воде состояние дихлоридов в
сигналов приведено на рис. 9.
наибольшей степени приближается к свободным
Рассчитанные величины химических сдвигов
ионам. Вероятно, в малополярном хлороформе эти
СН для условных хлороформа и воды (среды, рез-
соли существуют в виде ионных агрегатов, подоб-
ко отличающиеся по диэлектрической проницае-
но многим другим солям имидазолия [32, 34, 50].
мости, полярности и склонности стабилизировать
Координация противоанионов наиболее вероятна
ионные частицы) незначительно отличаются друг
по гидроксилу и С2Н. Результаты расчета не про-
от друга (рис. 9, табл. SТ6); вероятно, так же не-
тиворечат ранее сделанным отнесениям сигналов
значительно они отличаются и для ДМСО. Хими-
мостиковых протонов для бисимидазолиевых со-
ческий сдвиг гидроксильного протона в расчете
лей с 2-гидроксипропановым мостиком (дихло-
резко отличается от экспериментального; по-ви-
рида 12 [63] и дибромида 13 [64), основанным на
димому, расчет резонанса ОН без учета координа-
анализе мультиплетности протонных резонансов,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
850
ЗАРЕЧНАЯ, МИХАЙЛОВ
Рис. 10. Сопоставление расчетных (хлороформ, 1) и экспериментально определенных (2) химических сдвигов 1H для ди-
катиона 5 и дихлорида 9 в ДМСО-d6 (а) и CDCl3 (б), сопоставление расчетных (1) и экспериментально определенных (2)
химических сдвигов 1H для дикатиона 5 и дихлорида 9 в D2O (в).
однако позволяют сделать серьезные уточнения
атому водорода Hc, рис. 9) отчетливо различим как
относительно структуры дикатионов и состояния
дублет (в воде) или дублет дублетов (в ДМСО) в
их солей в растворе.
слабом поле относительно других водородов мо-
стика (рис. S14, см. Дополнительные материалы).
Спектры ЯМР 13С в ДМСО-d6 дихлорида 9 и
дибромида 10 практически неотличимы (рис. S11,
В хлороформе все протоны мостика резонируют
как отдельно стоящие мультиплеты (рис. S14), и
см. Дополнительные материалы). Надо полагать,
влияние противоаниона на скелет тяжелых атомов
все константы спин-спинового взаимодействия
(геометрию молекулы) в растворе невелико. Спек-
легко определить без применения специальных
тры ЯМР 13С дихлорида 9 в хлороформе, ДМСО
процедур. Двумерные спектры HSQC подтвержда-
и воде различаются (рис. S12, см. Дополнитель-
ют отнесение сигналов всех ядер мостика (рис.
ные материалы) незначительно. Вероятно, скелет
S15, см. Дополнительные материалы). Во всех
и, возможно, преимущественная конфигурация
растворителях химические сдвиги ядер 13С возрас-
сохраняются в этих сильно различающихся рас-
тают в порядке CH2, хвост < CH2, мостик < CH(OH);
творителях. Спектры ЯМР 1H дихлорида 9 в хло-
в воде и ДМСО они смещены в сильное поле по
роформе, ДМСО и воде различаются в большей
сравнению с хлороформом, как и сигналы соответ-
степени (рис. S13, см. Дополнительные материа-
ствующих атомов водорода. Менее определенные
лы). Сигнал гидроксильного протона не регистри-
выводы следуют из анализа спектров имидазоли-
руется в воде вследствие быстрого дейтерообмена
евых фрагментов. Совершенно однозначно и во
с растворителем, но отчетливо виден как дублет в
всех растворителях регистрируются только сигна-
CDCl3 и ДМСО-d6 (рис. S14, см. Дополнительные
лы углерода и водорода С2(Н)-фрагмента, наиболее
материалы). Судя по ширине этого сигнала в хло-
слабопольные. В расчете порядок возрастания хи-
роформе (>20 Гц на полувысоте), он представляет
мического сдвига (смещение в слабое поле) С5(Н)
собой суперпозицию нескольких (или множества)
< C4(H) как для углерода, так и для водорода. Это
обменивающихся форм. Напротив, в ДМСО этот
соответствует литературным данным по отнесе-
узкий дублет расколот почти до нулевой линии,
нию сигналов в спектрах бисимидазолиевых солей
при не очень большой 3J 6 Гц. Сигналы мости-
[12]. Результаты двумерной спектроскопии HSQC
ковых протонов в воде и ДМСО накладываются
не противоречат такому выводу (рис. S16, см. До-
на сигналы α-метиленовых протонов алкильного
полнительные материалы). Записанные в идентич-
хвоста, что препятствует анализу тонкой структу-
ных условиях (тяжелая вода, 24оС) спектры ЯМР
ры всех резонансов. Однако сигнал водорода Hb
1H дигалогенидов 9 и 10 и диоксалата 1,3-бис(и-
(син-перипланарного по отношению к метиновому
мидазол-1′-ил)-2-гидроксипропана 11 отличаются
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
ВНУТРИМОЛЕКУ
ЛЯРНЫЕ НЕКОВАЛЕНТНЫЕ ВЗАИМОДЕЙСТВИЯ
851
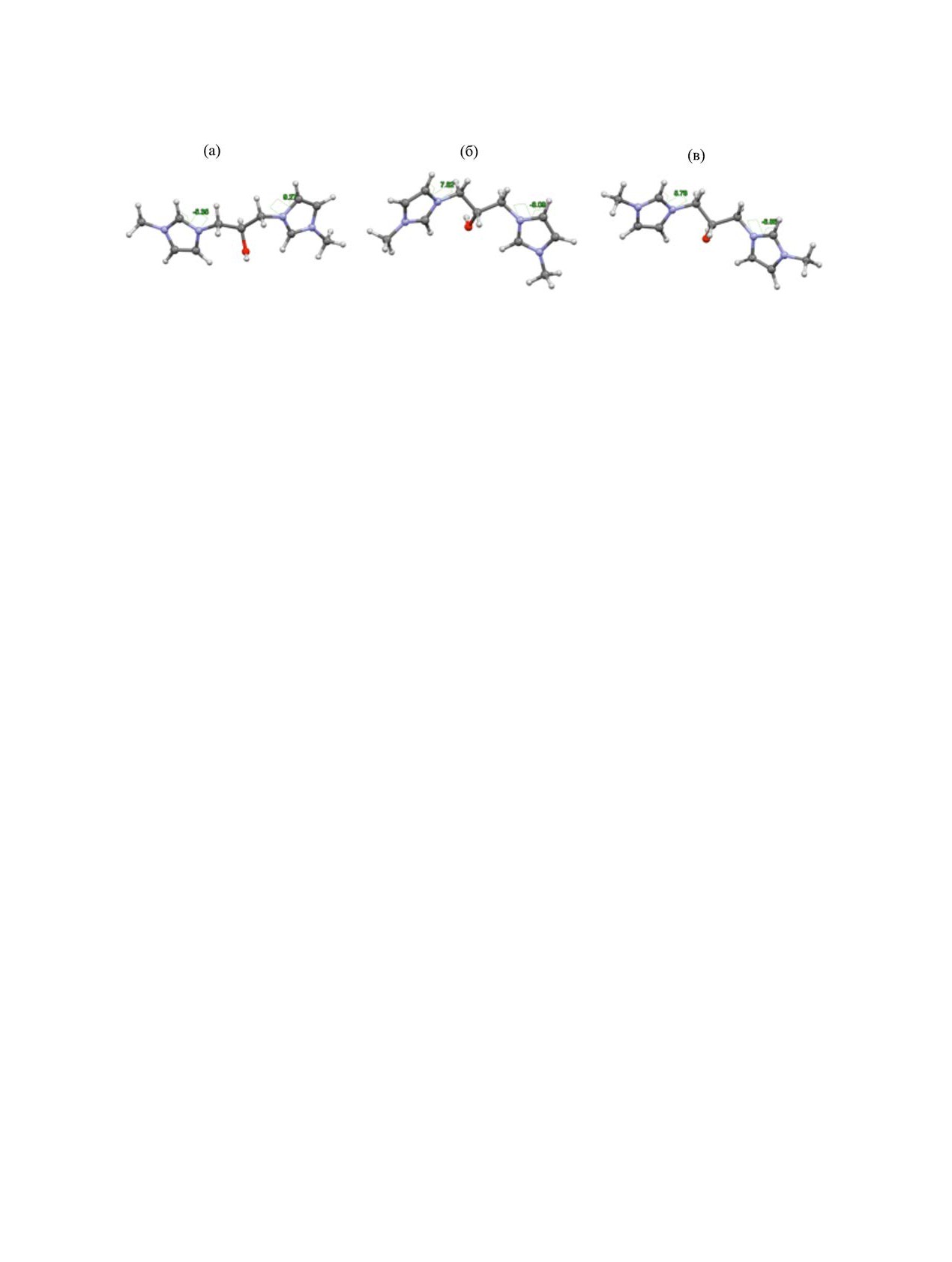
Рис. 11. Двугранные углы водородов Hb (син-перипланарных по отношению к метиновому атому водорода) метиленовых
групп дикатиона 5 по отношению к имидазолиевым кольцам (а) М01, (б) М02, (в) М03.
очень мало в области сигналов мостика (рис. S17,
лярные водородные связи С-Н···ОН были выяв-
см. Дополнительные материалы). Рассмотрение
лены ранее в дикатионах бис-1,3-(3′-метилимида-
спектров ЯМР дигалогенидов 9 и 10 в различных
зол-1′-ил)-2-гидроксиминопропана [47]; вероятно,
растворителях (рис. S11-S17, см. Дополнительные
склонность к подобным взаимодействиям являет-
материалы) и сопоставление со спектрами диокса-
ся общим свойством бисимидазолиевых солей, со-
лата 11 (рис. S17) не оставляет сомнений в том, что
держащих гетероатомные функциональные заме-
центральный фрагмент этих соединений устроен
стители в мостике.
очень близким (или идентичным) образом (рис. 9).
Образование цикла вообще можно рассматри-
Из анализа спектров ЯМР бисимидазолиевых со-
вать как фактор повышения жесткости конструк-
лей с 2-гидроксипропановым мостиком однознач-
ции (уменьшения лабильности полиметиленовой
но следует, что центральная часть молекулы пред-
цепочки) в соединениях бисимидазолия. Прото-
ставляет собой жесткую конструкцию (в отличие
ны каждого метиленового звена магнитно экви-
от солей с полиметиленовыми мостиками). В от-
валентны в бисимидазолилалканах, бисимидазо-
сутствие свободного вращения энантиотопные ато-
лиевых солях с полиметиленовым мостиком, и в
мы водорода Ha и Hb метиленовых групп мостика
бискарбенах (продуктах депротонирования по по-
(рис. 11) становятся магнитно неэквивалентными
ложению 2 имидазольного цикла), как и в двухъ-
и резонируют при различающейся напряженности
ядерном комплексе бискарбена [65] с диметил-
поля. Синперипланарный (по отношению к мети-
(триметилфосфин)никелем. Однако в цикличе-
новому атому водорода) атом водорода Hb метиле-
ских моноядерных комплексах бискарбенов эта
новой группы попадает в зону действия кольцево-
эквивалентность нарушается очень часто [66, 7],
го тока π-системы имидазола (этот протон лежит в
что объясняют ограничением подвижности ме-
плоскости имидазолиевого кольца, рис. 11), и его
тиленовых звеньев; температуры коалесценции и
сигнал смещается в слабое поле. Как следствие,
барьеры конформационных переходов варьируют
различия в химических сдвигах атомов водорода,
в широких пределах [7].
принадлежащих одной метиленовой группе, могут
Отличия в распределении МЭП дикатионов
превышать 100 Гц.
помогают объяснить различия в реакционной спо-
Жесткость конструкции, как это следует из
собности мицеллярных систем, построенных на их
расчета и сопоставления спектров дигалогени-
основе. В щелочном гидролизе сложных эфиров
дов 9 и 10 и диоксалата 11, является внутренним
бисимидазолиевые соли с гидроксилсодержащим
свойством
бисимидазолил-2-гидроксипропа-
мостиком проявляют более высокую каталитиче-
нового скелета, а не следствием координации с
скую активность [14], нежели бисимидазолиевые
противоанионом, как это предполагалось ранее
соли с алифатическим мостиком [26]. Возможно,
[63, 64]. Эта жесткость в некоторой степени об-
это обусловлено более высокой сорбцией нукле-
условлена внутримолекулярными водородными
офила (HO-) в мицеллярную псевдофазу за счет
связями С-Н···ОН. Аналогичные внутримолеку-
гидроксильной группы с высоким положитель-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
852
ЗАРЕЧНАЯ, МИХАЙЛОВ
ным потенциалом (рис. 7). Если регулярность и
родные связи поддерживают жесткую конфигу-
предсказуемость размещения анионов в структуре
рацию 2-гидроксипропанового мостика, с затруд-
бисимидазолиевых солей (рис. 6) сохраняется и в
ненным (в масштабе времени ЯМР) вращением
расплаве, это открывает возможность использова-
вокруг ординарных связей. Затрудненное враще-
ния их в качестве электролита для источников тока
ние в производных 1,3-бисимидазолил-2-гидрок-
с анионной проводимостью [67], характеризую-
сипропана является внутренним свойством 2-ги-
щихся возможностью тонкой регулировки разме-
дроксипропилен-1,3-ового скелета, не связанным
щения носителей тока в пространстве, их подвиж-
с влиянием противоаниона.
ности и в целом электропроводности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Выявленные в расчете и эксперименте особен-
ности строения бисимидазолиевых катионов под-
Рутинные спектры 1Н и 13С записаны на спек-
держивают выдвинутую ранее концепцию суще-
трометре Bruker Avance II (9.4 Т, 400 МГц для
ственно разной организации длинноцепочечных
протонов) с использованием стандартного набора
бисимидазолиевых солей как строительных бло-
параметров при 24°С. Внутренний стандарт - те-
траметилсилан (для CDCl3). Для растворов в D2O
ков [44] для надмолекулярных агрегатов в водных
и (CD3)2SO в качестве стандарта использован сиг-
растворах и в расплавах: бисимидазолиевые соли
нал остаточных протонов растворителя. Двумер-
с нечетным числом атомов углерода в мостике
ные эксперименты HSQC и COSY проведены с
склонны образовывать U- и V-образные подструк-
использованием стандартных процедур hsqcgpph
туры, тогда как бисимидазолиевые соли с четным
и cosygpqf из библиотеки программ TopSpin 2.0,
числом атомов углерода в мостике тяготеют к об-
обработка сигналов спада свободной индукции - в
разованию Z-образных подструктур (конформеров).
TopSpin 3.6.1.
Расчеты в приближении ωB97Х/def2SVP адек-
Коммерчески доступные органические раство-
ватно воспроизводят геометрию бис-имидазоли-
рители использовали без дополнительной очист-
евых дикатионов с короткими алифатическими
ки. Воду для финальных операций дважды перего-
мостиками. Выявленные в расчете наиболее энер-
няли, ее характеристики приведены в [44]. Синтез
гетически выгодные конформации дикатионов
и очистка вспомогательных реагентов и промежу-
правдоподобно передают совокупность конформа-
точных продуктов описаны в [68]. Синтез, выделе-
ционных предпочтений в растворе.
ние и характеристики дигалогенидов бисимидазо-
Найденное в расчете распределение молеку-
лия 7-10 подробно описаны в работе [44].
лярного электростатического потенциала успешно
Диоксалат
1,3-бис(имидазол-1-ил)-2-гид-
предсказывает локализацию сферических анионов
роксипропана (11). Навеску имидазола (2.70 г,
в кристаллах солей. Это же распределение МЭП
4.0×10-2 моль) растворяли в смеси ДМСО (12 мл)
ответственно за преимущественно вытянутую
и грубо растертого едкого кали (2.70 г, 4.8×
(трансоидную) конфигурацию алкиленовых мо-
10-2 моль) при перемешивании и легком на-
стиков в растворе и твердой фазе.
гревании. К остывшей смеси приливали 2 мл
α,ω-Алкиленовые мостики бисимидазолиевых
1,3-дихлорпропан-2-ола (2.68 г, 2.08×10-2 моль)
солей конформационно подвижны; в жидкой фазе
порциями по 0.5-1 мл при перемешивании в тече-
вращение вокруг ординарных С-С и С-N связей
ние 15 мин. Смесь при этом разогревается до 54°С,
происходит быстро в шкале времени ЯМР. Напро-
и температура начинает снижаться. Через полчаса
тив, 2-гидроксипропилен-1,3-овый мостик ведет
реакционную массу нагревали до 70°С, и оставля-
себя как жесткая структура. Распределение элек-
ли на сутки. Остывшую вязкую массу растирали
тронной плотности в
1,3-бисимидазолил-2-ги-
с ацетонитрилом (40 мл) при нагревании до 50°С,
дроксипропановом дикатионе однозначно указы-
отделившийся осадок отфильтровывали через
вает на существование двух внутримолекулярных
складчатый фильтр, промывали ацетонитрилом
водородных связей С-Н···ОН с участием кислоро-
(2×10 мл). К бледно-желтому фильтрату прилива-
да гидроксила и С-Н фрагментов имидазолиевых
ли раствор дигидрата щавелевой кислоты (5.22 г,
циклов. Вероятно, эти внутримолекулярные водо-
4.14×10-2 моль) в метаноле (10 мл). Выпавший оса-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
ВНУТРИМОЛЕКУ
ЛЯРНЫЕ НЕКОВАЛЕНТНЫЕ ВЗАИМОДЕЙСТВИЯ
853
док отфильтровывали через стеклянный фильтр,
относительного содержания конформеров соглас-
промывали метанолом (2×10 мл), сушили на воз-
но распределению Больцмана, были получены на
духе. Выход 4.08 г (55%), белый тонкий порошок.
основе одноточечных расчетов (включая соответ-
Для очистки перекристаллизовывали из уксусной
ствующий неявный растворитель, модель C-PCM)
кислоты (20 мл), осадок промывали метанолом
электронных энергий более высокого уровня
(5 мл), сушивали при нагревании до 110°С в су-
ωB97M-V/def2-TZVPP и термических поправок
шильном шкафу. Спектр ЯМР 1Н (D2O), δ, м. д.:
из соответствующих ωB97X/def2SVP-расчетов
8.66 уш. с (2Н), 7.41 т (J 1.7 Гц), 7.37 т (J 1.7 Гц),
(Табл. 2). Гибридный функционал ωB97M-V [77]
4.44 д. д (J 2.6, 14.1 Гц), 4.25 т. т (J 2.6, 8.8 Гц), 4.13
с разделением по диапазонам и поправкой на дис-
д. д (J 8.8, 14.1 Гц). Спектр ЯМР 13С (D2O), δС, м. д.:
персию VV10 [78] рекомендован в исследовании
164.92, 134.65, 121.66, 119.21, 67.55, 51.09. Спектр
[79] как один из лучших для общей термохимии,
ЯМР HSQC (D2O), δ, м. д.: кросс-пики 8.6-134.6,
внутри- и межмолекулярных нековалентных вза-
7.4-121.6, 7.3-119.2, 4.4-51, 4.1-51, 4.2-67.5. Най-
имодействий, включая также галогеновые связи и
дено, %: С 42.01; H 4.15; N 15.01. C13H15N4O9. Вы-
взаимодействия с ионными частицами на основе
числено, %: C 42.05; H 4.07; N 15.09.
тестирования обширной эталонной базы данных
GMTKN55. В этих расчетах использовали тре-
Свободное
основание
1,3-бис(имида-
хэкспоненциальный валентно-расщепленный ос-
зол-1-ил)-2-гидроксипропана выделяли из ди-
новной базис def2-TZVPP с добавлением поляри-
оксалата реакцией с водным раствором щелочи.
зационных функций [71, 72]. Для аппроксимации
Желтое масло; получить в чистом виде пока не
кулоновских и обменных интегралов применялось
удалось. Спектр ЯМР 1Н (D2O), δ, м. д.: 7.53 уш. с
приближение RIJCOSX с соответствующим до-
(2Н), 7.04 уш. с (2Н), 6.90 уш. с (2Н), 4.14-4.04 м
полнительным базисом [80, 81].
(3Н), 3.86 д. д (J 8.5, 15.1 Гц).
Относительное
содержание
конформе-
Все расчеты в рамках теории функциона-
ров в смеси при 298 K оценено по уравнению
ла плотности выполнены с пакетом ORCA 5.0.1
Больцмана (4).
[73]. Предварительный конформационный поиск
устойчивых конформеров дикатионов бисимида-
золиевых солей на полуэмпирическом уровне PM6
был описан в работе [44]. Равновесные геометри-
(4)
ческие параметры наиболее стабильных конфор-
меров оптимизировали в основном состоянии, в
газовой фазе, с использованием гибридного функ-
ционала ωB97X [70], основного и вспомогатель-
где ∆Gi - разность энергий Гиббса i-го и наибо-
ного базисных наборов def2-SVP и def2/J [71, 72]
лее стабильного конформера, Σj - суммирование
и приближения Split-RI-J [73] для аппроксимации
по всем членам ансамбля; T - температура, K;
кулоновских интегралов (табл. 1). Геометрия кон-
R - универсальная газовая постоянная.
формеров 1-6 была оптимизирована также с уче-
Теоретические расчеты спектров ЯМР прове-
том влияния виртуальных растворителей (вода,
дены в приближении GIAO [82, 84], с использова-
ε 80.4, хлороформ, ε 4.9), применяя континуаль-
нием функционала ωB97M-V и базисного набора
ную модель сольватации C-PCM [74] со схемой
pcSseg-2, разработанного для расчетов химических
гауссовского заряда и ван-дер-ваальсовым типом
сдвигов [84], в сочетании с моделью сольватации
полости (GVDW) [75, 76]. Для всех оптимизиро-
C-PCM на основе геометрии конформеров дика-
ванных структур на том же уровне были рассчи-
таны частоты гармонических колебаний в целях
тионов бисимидазолиевых солей, оптимизирован-
подтверждения истинности минимумов потен-
ных с включением соответствующего неявного
циальной энергии (отрицательных значений не
растворителя (вода, хлороформ) на уровне ωB97X\
обнаружено) и определения термических попра-
def2SVP. Для определения химических сдвигов в
вок к энергии Гиббса (G). Величины свободной
качестве эталона использованы усредненные зна-
энергии Гиббса, необходимые для определения
чения экранирования соответствующих атомов
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
854
ЗАРЕЧНАЯ, МИХАЙЛОВ
тетраметилсилана как стандарта, рассчитанные
6.
Ahrens S., Zeller A., Taige M., Strassner T. //
на том же уровне и той же виртуальной среде,
Organometallics. 2006. Vol. 25. N 22. P. 5409. doi
10.1021/om060577a
что и для бисимидазолиевых солей. Последую-
7.
Scherg T., Schneider S.K., Frey G.D., Schwarz J.,
щее усреднение сигнала эквивалентных протонов
Herdtweck E., Herrmann W.A. // Synlett. 2006. Vol. 18.
проводили с учетом больцмановского распределе-
P. 2894. doi 10.1055/s-2006-951539
ния конформеров. Конформационно-взвешенные
8.
Cebollada A., Vellé A., Sanz Miguel P.J. // Acta
спектры ЯМР генерированы с помощью пакета
Crystallogr. (C). 2016. Vol. 72. P. 456. doi 10.1107/
Multiwfn v.3.8 [85]. В этом же пакете рассчитаны
S2053229616006781
распределение молекулярного электростатическо-
9.
Wang C., Liu J., Tian Z., Tian M., Tian L., Zhao W.,
Liu Z. // Dalton Trans. 2017. Vol. 46. P. 6870. doi
го потенциала [86]), локализованы критические
10.1039/C7DT00575J
точки и пути связывания в рамках теории Бэйдера
10.
Charra V., Frémont P., Braunstein P. // Coord. Chem.
[87], а также области нековалентного взаимодей-
Rev. 2017. Vol. 341. P. 53. doi 10.1016/j.ccr.2017.03.007
ствия в рамках концепции редуцированного гради-
11.
Zhao Q., Meng G., Nolan S.P., Szostak M. // Chem.
ента плотности RDG [88].
Rev. 2020. Vol. 120. P. 1981. doi 10.1021/acs.
chemrev.9b00634
Для визуального представления результатов ис-
12.
Claramunt R.M., Elguero J., Meco T. // J. Heterocycl.
пользованы приложения Jmol [89] и VMD [90].
Chem. 1983. Vol. 20. P. 1245. doi 10.1002/
jhet.5570200519
ИНФОРМАЦИЯ ОБ АВТОРАХ
13.
Bhadani A., Misono T., Singh S., Sakai K., Sakai H., Abe
Михайлов Василий Александрович, ORCID:
M. // Adv. Coll. Interface Sci. 2016. Vol. 231. P. 36. doi
10.1016/j.cis.2016.03.005
14.
Кушназарова Р.А., Миргородская А.Б., Михай-
КОНФЛИКТ ИНТЕРЕСОВ
лов В.А., Белоусова И.А., Зубарева Т.М., Проко-
пьева Т М., Волошина А.Д., Амерханова С.К., За-
Авторы заявляют об отсутствии конфликта
харова Л.Я. // ЖОХ. 2022. Т. 92. С. 630-639. doi
интересов.
10.31857/S0044460X22040072; Kushnazarova R.A.,
Mirgorodskaya A.B., Mikhailov V.A., Belousova
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
I.A., Zubareva T.M., Prokop’eva T.M., Voloshina
A.D., Amerhanova S.K., Zakharova L.Ya. // Russ.
Дополнительные материалы для этой статьи
J. Gen. Chem. 2022. Vol. 92. P. 659. doi 10.1134/
доступны по doi
10.31857/S0044460X23060033
S1070363222040077
для авторизованных пользователей.
15.
El Seoud O.A., Keppeler N., Malek N.I., Galgano P.D. //
Polymers. 2021. Vol. 13. P. 1100. doi 10.3390/
СПИСОК ЛИТЕРАТУРЫ
polym13071100
16.
Buettner C.S., Cognigni A., Schröder C., Bica-
1. Albrecht M., Miecznikowski J.R., Samuel A., Faller J.W.,
Schröder K. // J. Mol. Liq. 2022. Vol. 347. Art. 118160.
Crabtree R.H. // Organometallics 2002. Vol. 21 P. 3596.
doi 10.1016/j.molliq.2021.11816
doi 10.1021/om020338x
17.
Voloshina A.D., Gumerova S.K., Sapunova А.S.,
2. Okuyama K., Sugiyama J., Nagahata R., Asai M., Ueda M.,
Kulik N.V., Mirgorodskaya A.B., Kotenko A.A.,
Takeuchi K. // J. Mol. Catal. (A). 2003. Vol. 203. N 1-2.
Prokopyeva T.M., Mikhailov V.A., Zakharova L.Ya,
P. 21. doi 10.1016/S1381-1169(03)00281-4
Sinyashin O.G. // BBA Gen. Sub. 2020. Vol. 1864.
3. Mata J.A., Chianese A.R., Miecznikowski J.R.,
Art. 129728. doi 10.1016/j.bbagen.2020.129728
Poyatos M., Peris E., Faller J.W., Crabtree R.H. //
18.
Guglielmero L., Mezzetta A., Guazzelli L., Pomelli C.S.,
Organometallics. 2004. Vol. 23. P. 1253. doi 10.1021/
D’Andrea F., Chiappe C. // Front. Chem. 2018. Vol. 6,
om034240+
art. 612. doi 10.3389/fchem.2018.00612
4. Lee H.M., Lu C.Y., Chen C.Y., Chen W.L., Lin H.C.,
19.
Yang M., Stappert K., Mudring A.-V. // J. Mater. Chem.
Chiu P.L., Cheng P.Y. // Tetrahedron. 2004. Vol. 60.
(C). 2014. Vol. 2. P. 458. doi 10.1039/C3TC31368A
N 27. P. 5807. doi 10.1016/j.tet.2004.04.070
20.
Lee M., Choi U.H., Wi S., Slebodnick C., Colby R.H.,
5. Jin C.-M., Twamley B., Shreeve J.M. // Organometallics.
Gibson H.W. // J. Mater. Chem. 2011. Vol. 21. P. 12280.
2005. Vol. 24. N 12. P. 3020. doi 10.1021/om050210q
doi 10.1039/C1JM10995B
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
ВНУТРИМОЛЕКУ
ЛЯРНЫЕ НЕКОВАЛЕНТНЫЕ ВЗАИМОДЕЙСТВИЯ
855
21.
Chae H., Lee Y.-H., Yang M., Yoon W.-J., Yoon D.K.,
40.
Mo Y. // WIREs Comp. Mol. Sci. 2011. Vol. 1. P. 164.
Jeong K.-U., Song Y.H., Choi U.H., Lee M. // RSC Adv.
doi 10.1002/wcms.22
2019. Vol. 9. P. 3972. doi 10.1039/C8RA09208G
41.
Kirschner K.N., Heiden W., Reith D. // ACS Omega.
22.
Hammond O.S., Mudring A.-V. // Chem. Commun. 2022.
2018. Vol. 3. P. 419. doi 10.1021/acsomega.7b01367
Vol. 58. P. 3865. doi 10.1039/d1cc06543b
42.
Gougoula E., Medcraft C., Heitkämper J., Walker N.R. //
23.
Goossens K., Lava K., Bielawski C.W., Binnemans K. //
J. Chem. Phys. 2019. Vol. 151. Art. 144301. doi
Chem. Rev. 2016. Vol. 116. P. 4643. doi 10.1021/
10.1063/1.5119997
cr400334b
43.
Leclercq L., Schmitzer A.R. // Cryst. Growth Des. 2011.
24.
Kapernaum N., Lange A., Ebert M., Grunwald M.A.,
Vol. 11. P. 3828. doi org/10.1021/cg200381f
Haege C., Marino S., Zens A., Taubert A., Giessel-
44.
Zabolotniy A.A., Trush E.N., Zarechnaya O.M.,
mann F., Laschat S. // ChemPlusChem. 2022. Vol. 87.
Mikhailov V.A. // J. Ionic Liq. 2022. Vol. 2. Art. 100045.
Art. e202100397. doi 10.1002/cplu.202100397
doi 10.1016/j.jil.2022.100045
25.
Sirigiri N., Chen F., Forsyth C.M., Yunis R., O’Dell L.,
45.
Nazarski R.B. // Tetrahedron Lett. 2021. Vol. 71.
Pringle J.M., Forsyth M. // Mater. Today Phys. 2022.
Art. 152548. doi 10.1016/j.tetlet.2020.152548
Vol. 22. Art. 100603. doi 10.1016/j.mtphys.2022.100603
46.
Sun H., Zhang D., Liu C., Zhang C. // J. Mol. Struct.
26.
Prokop’eva T.M., Mirgorodskaya A.B., Belousova I.A.,
THEOCHEM. 2009. Vol. 900. P. 37. doi 10.1016/j.
Zubareva T.M., Turovskaya M.K., Razumova N.G.,
theochem.2008.12.024
Gaidash T.S., Mikhailov V.A. // Chem. Safety. 2021.
47.
Заречная О.М., Гребенюк С.А., Хилько С.Л., Ми-
Vol. 5. P. 8. doi 10.25514/CHS.2021.2.20001
хайлов В.А. // В сб: Структура и динамика молеку-
27.
Pandolfi F., Bortolami M., Feroci M., Fornari A.,
лярных систем. М.: ИФХЭ РАН, 2017. Вып. XXIV.
Scarano V., Rocco D. // Materials. 2022. Vol. 15. art.
С. 111.
866. doi 10.3390/ma15030866
48.
Martins F.A., Zeoly L.A., Cormanich R.A., Freitas M.P. //
28.
Lee M., Lee Y.-H., Park J.H., Choi U.H. // Org.
Tetrahedron. 2018. Vol. 74. P. 880. doi 10.1016/j.
Electronics. 2017. Vol. 48. P. 241. doi 10.1016/j.
tet.2018.01.008
orgel.2017.06.004
49.
Allen F.H., Watson D.G., Brammer L., Orpen A.G.,
29.
Ray A., Saruhan B. // Materials. 2021. Vol. 14. art. 2942.
Taylor R. // Int. Tables Cryst. 2006. Vol. C. P. 790. doi
doi 10.3390/ma14112942
10.1107/97809553602060000621
30.
Kim E., Han J., Ryu S., Choi Y., Yoo J. // Materials.
50.
Bent H.A. // Chem. Rev. 1968. Vol.68. p. 587. doi:
2021. Vol. 14. Art. 4000. doi 10.3390/ma14144000
10.1021/cr60255a003
31.
Zhou W., Zhang M., Kong X., Huang W., Zhang Q. //
51.
Зефиров Ю.В., Зоркий П.М. // Усп. хим. 1995.
Adv. Sci. 2021. Vol. 8. Art. 2004490. doi 10.1002/
Т. 64. С. 446; Zefirov Yu.V., Zorkii P.M. // Russ.
advs.202004490
Chem. Rev. 2007. Vol. 64. P. 415. doi 10.1070/
32.
Hayes R., Warr G.G., Atkin R. // Chem. Rev. 2015.
RC1995v064n05ABEH000157
Vol. 115. P. 6357. doi 10.1021/cr500411q
52.
Rowland R. S., Taylor R. // J. Phys. Chem. 1996.
33.
Philippi F., Welton T. // Phys. Chem. Chem. Phys. 2021.
Vol. 100. P. 7384 doi 10.1021/jp953141+
Vol. 23. P. 6993 doi 10.1039/D1CP00216C
53.
Liu J., Wei X., Wei Z., Liu J., Zheng L. // Acta
34.
Wang Y.-L., Li B., Sarman S., Mocci F., Lu Z.-Y., Yuan J.,
Crystallogr. (E). 2009. Vol. 65. P. o2027. doi 10.1107/
Laaksonen A., Fayer M.D. // Chem. Rev. 2020. Vol. 120.
S1600536809028967
P. 5798. doi 10.1021/acs.chemrev.9b00693
54.
Chen Y., Song W., Xu J., Cui R., Tian D. // Acta
35.
Mandai T., Masu H., Seki H., Nishikawa K. // Bull.
Chem. Soc. Japan. 2012. Vol. 85. P. 599. doi 10.1246/
Crystallogr. (E). 2009. Vol. 65. P. o2454. doi 10.1107/
bcsj.20120018
S1600536809036009
55.
Matta C.F., Hernández-Trujillo J., Tang T.-H.,
36.
Tadesse H., Blake A.J., Champness N.R., Warren J.E.,
Rizkallah P.J., Licence P. // CrystEngComm. 2012.
Bader R.F.W. // Chemistry. 2003. Vol. 9. P. 1940. doi
Vol. 14. P. 4886. doi 10.1039/c2ce25106j
10.1002/chem.200204626
37.
Huang R.T.W., Rondla R., Wang W.-J., Lin I.J.B. //
56.
Della Porta P., Zanasi R., Monaco G. // J. Comput.
J. Mol. Liq. 2017. Vol. 242. P. 1285. doi 10.1016/j.
Chem. 2015. Vol. 36. P. 707. doi 10.1002/jcc.23841
molliq.2017.07.088
57.
Johnson E.R., Keinan S., Mori-Sánchez P., Contreras-
38.
Majhi D., Dvinskikh S.V. // Sci. Rep. 2021. Vol. 11.
García J., Cohen A.J., Yang W. // J. Am. Chem.
Art. 5985. doi 10.1038/s41598-021-85021-y
Soc.2010. Vol. 132. P. 64. doi 10.1021/ja100936w
39.
Serva A., Migliorati V., Lapi A., Aquilanti G., Arcovito A.,
58.
Boto R.A., Piquemal JP., Contreras-García J. // Theor.
D’Angelo P. // Phys. Chem. Chem. Phys. 2016. Vol. 18.
Chem. Acc. 2017. Vol. 36. P. 139. doi 10.1007/s00214-
P. 16544. doi 10.1039/c6cp01557c
017-2169-9
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
856
ЗАРЕЧНАЯ, МИХАЙЛОВ
59.
Koch U., Popelier P. // J. Phys. Chem. 1995. Vol. 99.
75.
York D.M., Karplus M. // J. Phys. Chem. (A). 1999.
P. 9747. doi 10.1021/j100024a016
Vol 103. P. 11060. doi 10.1021/jp992097l
60.
Espinosa E., Molins E., Lecomte C. // Chem. Phys.
76.
Garcia-Ratés M., Neese F. // J. Comput. Chem. 2020.
Lett. 1998. Vol. 285. P. 170. doi 10.1016/S0009-
Vol. 41. P. 922. doi 10.1002/jcc.26139
2614(98)00036-0
77.
Mardirossian N., Head-Gordon M. // Phys. Chem.
61.
Emamian S., Lu T., Kruse H., Emamian H. // J. Comput.
Chem. Phys. 2014. Vol. 16. P. 9904. doi 10.1039/
Chem. 2019. Vol. 40. P. 2868. doi 10.1002/jcc.26068
62.
Mata I., Alkorta I., Espinosa E., Molins E. // Chem.
C3CP54374A
Phys. Lett. 2011. Vol. 507. P. 185. doi 10.1016/j.
78.
Vydrov O.A., Van Voorhis T. // J. Chem. Phys. 2010.
cplett.2011.03.055
Vol. 133. Art. 244103. doi 10.1063/1.3521275
63.
Wang L., Liu J., Huo S., Deng Q., Yan T., Ding L.,
79.
Goerigk L., Hansen A., Bauer C., Ehrlich S., Najibi A.,
Zhang C., Meng L., Lu Q. // J. Surf. Deterg. 2014.
Grimme S. // Phys. Chem. Chem. Phys. 2017. Vol. 19.
Vol. 17. P. 1107. doi 10.1007/s11743-014-1615-0
P. 32184. doi 10.1039/C7CP04913G
64.
Shaheen A., Mir A.W., Arif R., Wani A.L. // Coll. Interf.
80.
Neese F., Wennmohs F., Hansen A., Becker U. //
Sci. Commun. 2020. Vol. 36. art. 100257. doi 10.1016/j.
colcom.2020.100257
Chem. Phys. 2009. Vol. 356. P. 98. doi 10.1016/j.
65.
Douthwaite R.E., Green M.L.H., Silcock P.J.,
chemphys.2008.10.036
Gomes P.T. // Organometallics. 2001. Vol. 20. P. 2611.
81.
Izsák R., Neese F. // J. Chem. Phys. 2011. Vol. 135. Art.
doi 10.1021/om010139y
144105. doi 10.1063/1.3646921
66.
Ofele K., Herrmann W. A., Mihalios D., Elison M.,
82.
Ditchfield R. // Mol. Phys. 1974. Vol. 27. P. 789. doi
Herdtweck E., Priermeier T., Kiprof P. // J. Organometal.
10.1080/00268977400100711
Chem. 1995. Vol. 498. P. 1. doi 10.1016/0022-
83.
Wolinski K., Hinton J.F., Pulay P. // J. Am. Chem. Soc.
328X(94)05261-9
67.
Wang Y., Yang X., Zhang Z., Hu X., Meng Y., Wang X.,
1990. Vol 112. P. 8251. doi 10.1021/ja00179a005
Zhou D., Liu H., Li B., Wang G. // eScience. 2022. doi
84.
Jensen F.J. // Chem. Theory Comput. 2015. Vol. 11.
10.1016/j.esci.2022.10.003
P. 132. doi 10.1021/ct5009526
68.
Zarechnaya O.M., Mikhailov V.A. // Vestn. DonNU Ser.
85.
Lu T., Chen F. // J. Comput. Chem. 2012. Vol. 33. P. 580.
A. 2021. P. 35.
doi 10.1002/jcc.22885
69.
Neese F., Wennmohs F., Becker U., Riplinger C. //
86.
Zhang J., Lu T. // Phys. Chem. Chem. Phys. 2021.
J. Chem. Phys. 2020. Vol. 152. Art. 224108. doi
Vol. 23. P. 20323. doi 10.1039/D1CP02805G
10.1063/5.0004608
70.
Chai J.-D., Head-Gordon M. // J. Chem. Phys. 2008.
87.
Bader R.F.W. Atoms in Molecules: A Quantum Theory.
Vol. 128. Art. 084106. doi 10.1063/1.2834918
Oxford: Clarendon Press, 1990.
71.
Weigend F., Ahlrichs R. // Phys. Chem. Chem. Phys.
88.
Johnson E.R., Keinan S., Mori-Sánchez P., Contreras-
2005. Vol. 7. P. 3297. doi 10.1039/B508541A
García J., Cohen A. J., Yang W. // J. Am. Chem. Soc.
72.
Weigend F. // Phys. Chem. Chem. Phys. 2006. Vol. 8.
2010. Vol. 132. P. 6498. doi 10.1021/ja100936w
P. 1057. doi 10.1039/B515623H
89.
Jmol: an open-source Java viewer for chemical
73.
Neese F. // J. Comput. Chem. 2003. Vol. 24. P. 1740. doi
10.1002/jcc.10318
74.
Barone V., Cossi M. // J. Phys. Chem. (A). 1998.
90.
Humphrey W., Dalke A., Schulten K. // J. Mol. Graphics.
Vol. 102. P.1995. doi 10.1021/jp9716997
1996. Vol. 14. P. 33. doi 10.1016/0263-7855(96)00018-5
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023
ВНУТРИМОЛЕКУ
ЛЯРНЫЕ НЕКОВАЛЕНТНЫЕ ВЗАИМОДЕЙСТВИЯ
857
Intramolecular Noncovalent Interactions
in Bis-Imidazolium Dications with Short Aliphatic Spacers
O. M. Zarechnayaa and V. A. Mikhailova,*
a L. M. Litvinenko Institute of Physical Organic and Coal Chemistry, Donetsk, 83114 Ukraine
*e-mail: v_mikhailov@yahoo.com
Received March 12, 2023; revised May 7, 2023; accepted May 12, 2023
Stretched all-trans conformations were found preferable in computed structures of bis-imidazolium dications
with short aliphatic (С1-С4) and hydroxyl substituted -СН2-СНОН-СН2- spacers. Maxima of molecular
electrostatic potential were established near С2Н imidazolium and spacer hydrogens, for α,ω-alkenyl spacers,
and close to hydroxyl hydrogen for hydroxypropane spacer. Sufficiently higher rotational barrier around С1-C2
bond in -СН2-СНОН-СН2- spacer compared with polymethylene is supported with intramolecular hydrogen
bonds С-Н···О-Н between imidazolium hydrogens and hydroxyl oxygen.
Keywords: bis-imidazolium salts, molecular electrostatic potential, intramolecular hydrogen bonds
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 6 2023