ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 9, с. 1343-1350
УДК 547.914.2:547.831.1
СИНТЕЗ И СПЕКТРАЛЬНЫЕ ХАРАКТЕРИСТИКИ
ХИНОЛИНОВЫХ ПРОИЗВОДНЫХ
МАЛЕОПИМАРОВОЙ КИСЛОТЫ
© 2023 г. Г. Ф. Вафина1,*, О. В. Акчурина1, А. Н. Лобов1
1 Уфимский институт химии, Уфимский федеральный исследовательский центр Российской академии наук,
пр. Октября 71, Уфа, 450054 Россия
*e-mail: vafina@anrb.ru; ms.vafina@mail.ru
Поступило в редакцию 6 июля 2023 г.
После доработки 18 июля 2023 г.
Принято к печати 29 июля 2023 г.
Взаимодействием малеопимаровой кислоты и ее хлорангидрида с 3-, 6- и 8-аминохинолинами с высоки-
ми выходами синтезированы хинолинсодержащие малеопимаримиды и карбоксамиды соответственно.
Методами спектроскопии ЯМР 1Н, 13С, 1H-13C HSQC, 1H-13C HMBC, COSY, NOESY, 1Н-15N HMBC
определена структура синтезированных соединений.
Ключевые слова: малеопимаровая кислота, малеопимаримид, карбоксамид, хинолин
DOI: 10.31857/S0044460X23090044, EDN: WXSUTM
Синтетические трансформации соединений
для этих препаратов расширился спектр фармако-
природного происхождения - одна из бурно раз-
логической активности: лечение артритов, кожных
вивающихся областей медицинской химии. Ма-
фотодерматитов, красной волчанки, системного
леопимаровая кислота
1
- продукт диенового
склероза, астмы, амебиаза, аритмии, нарушений
синтеза малеинового ангидрида и растительного
обмена порфирина и билирубина [5]. Другие пре-
метаболита левопимаровой кислоты, широко рас-
параты на основе 8-аминохинолина - примахин,
пространенной в живице хвойных деревьев. Среди
хиноцид также используются в лечении малярии
производных малеопимаровой кислоты найдены
и для химиопрофилактики [5]. Следует также от-
соединения обладающие антивирусными (грипп
метить оксихинолины - синтетические противо-
A/PuertoRico/8/34, H1N1), противомикробными,
микробные средства широкого спектра действия
противовоспалительными и противоязвенными
(нитроксолин, хинозол, энтеросептол, хиниофон,
свойствами [1-3].
оксолиновая кислота). Совокупность перечислен-
ных данных показывает перспективность введе-
Еще в средние века измельченную кору хин-
ния хинолинового цикла в молекулу малеопима-
ного дерева использовали для лечения малярии.
ровой кислоты для последующего скрининга на
Позднее из коры хинного дерева был выделен ос-
биологическую активность.
новной алкалоид - хинин, в структуре которого
содержится хинолин. Этот алкалоид использовали
Малеопимаровая кислота имеет две активные
в качестве основного лекарственного средства для
функциональные группы и поэтому введение
лечения малярии до второй мировой войны, по-
фрагментов хинолина в ее молекулу возможно по
сле которой начали использовать менее токсичные
двум направлениям: через карбоксильную группу
синтетические препараты на основе 4-аминохино-
с выходом на карбоксамиды или через ангидрид-
лина (хлорохин, гидроксихлорохин) [4]. Позднее
ную часть молекулы с выходом на малеопимари-
1343
1344
ВАФИНА и др.
Схема 1.
14
O
O
H
H
1
10
12
RNH2, DCM,
9
11a O
20°C
O
13
3a
9b
3
93-99%
9a
5a
4
H
O
H O
6
5
COCl
NH
2
O R
3-5
5'
3'
6'
6'
4a'
R =
(3),
(4),
(5).
8a'
7'
8'
2'
N
N
N
8'
Схема 2.
14
O
O
H
H
1
10
12
RNH2, ДМФА,
11a O
N
R
9
∆
13
3a
9b
3
74-88%
9a
H
H
5a
4
O
O
6
5
COOH
COOH
1
6-8
6'
3'
6'
R =
(6),
(7),
(8).
8'
N
N
N
миды. И в том, и в другом случае для решения этой
дами 74-88% (схема 2). Соединения 6 и 7 выделе-
проблемы мы использовали 3-, 6- и 8-аминохино-
ны кристаллизацией из хлороформа.
лины.
Следует отметить, что в литературе уже описа-
Для получения карбоксамидов малеопимаро-
но получение малеопимаримида 8 и его метило-
вой кислоты использовали «хлорангидридный»
вого эфира. Так, в работе [7] описано получение
метод: хлорангидрид малеопимаровой кислоты 2
N-(хинолин-8-ил)малеопимаримида 8 при кипя-
[6] вводили в реакцию с аминопроизводными хи-
чении канифольно-малеинового аддукта и 8-ами-
нолина с получением соответствующих карбокс-
нохинолина в растворе толуола в течении 35 ч.
амидов 3-5 с выходами 93-99% (схема 1).
Согласно этой работе образуется смесь 2 атропои-
Конъюгацию аминохинолинов по ангидридной
зомеров (в работе приведен спектр ЯМР 1Н только
части молекулы малеопимаровой кислоты 1 про-
мажорного атропоизомера). В работе [8] описано
водили кипячением с соответствующими амино-
получение метилового эфира N-(хинолин-8-ил)ма-
производными хинолина в ДМФА. В результате
леопимаримида при кипячении метилового эфира
реакции получены малеопимаримиды 6-8 с выхо-
малеопимаровой кислоты и 8-аминохинолина в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023
СИНТЕЗ И СПЕКТР
АЛЬНЫЕ ХАРАКТЕРИСТИКИ ХИНОЛИНОВЫХ ПРОИЗВОДНЫХ
1345
растворе триэтиламина с эквимолярным количе-
производных хинолина к ангидридной части мо-
ством ГМДС в течение 4 ч также с образованием
лекулы малеопимаровой кислоты.
смеси атропоизомеров. Однако в нашем случае
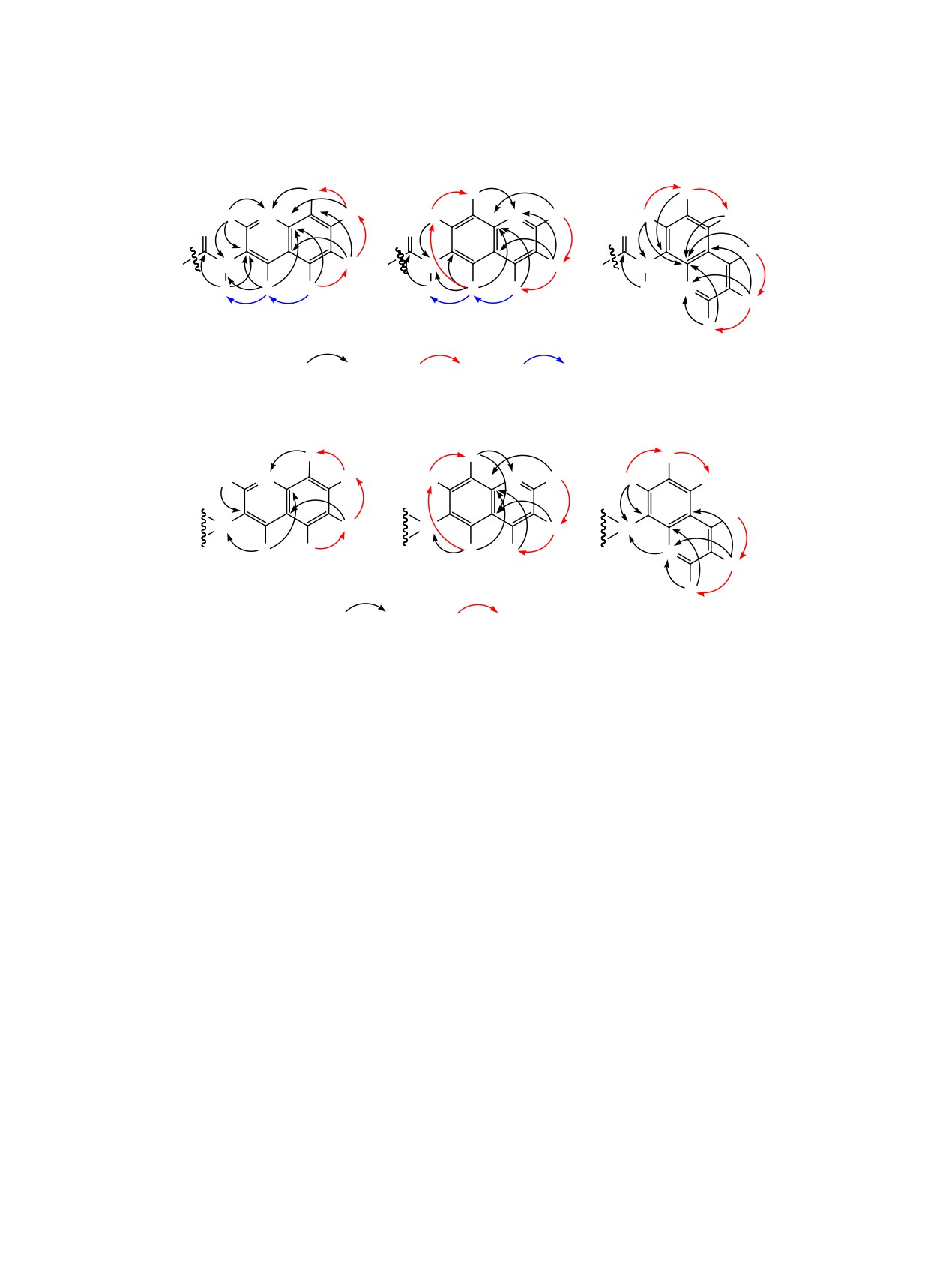
Отдельно стоит рассмотреть вопрос отнесе-
мы не наблюдали образования атропоизомеров,
ния сигналов атомов хинолиновой части синте-
что, возможно, связано с условиями проведения
зированных соединений в спектрах ЯМР. Так,
реакции малеопимаровой кислоты с 8-аминохино-
для соединения 3 (схема 3) узловой атом углерода
лином (кипячение в ДМФА). ДМФА был выбран
С4а′ имеет химический сдвиг δС 128.24 м. д., что
в качестве растворителя из-за того, что в толуоле
следует из наличия для него корреляций с прото-
реакция идет очень медленно.
нами химических сдвигов H2′ (δН 8.77 м. д.) и H6′
(δН 7.54 м. д.). Отнесение сигнала при 145.04 м. д.
Строение и состав синтезированных соеди-
ко второму узловому атому углерода С8а′ следует
нений установлено на основании данных ЯМР,
из наличия для него корреляций с атомами H2′ (δН
масс-спектрометрии и элементного анализа. Для
8.77 м. д.), H5′ (δН 7.80 м. д.) и H7′ (δН 7.63 м. д.)
точного отнесения сигналов каркасных атомов
соответственно. От всех перечисленных прото-
зарегистрированы спектры в режимах 1Н, 13С,
нов атом С8а′ отстоит на 3 химические связи. По-
1H-13C HSQC, 1H-13C HMBC, COSY, NOESY, а
следний из неотнесенных сигналов четвертичных
также 1H-15N HSQC, 1H-15N HMBC. На основании
атомов углерода соответствует атому углерода С3′,
спектров HSQC установлены химические сдвиги
связанному с карбоксамидной группой. Это сле-
протонов соответствующих углеродных атомов.
дует из наличия для него корреляции с протоном
Данные спектроскопии COSY подтверждают вза-
Н2′ (δН 8.77 м. д.), и протоном при азоте, имеющим
имодействие геминальных и вицинальных про-
химический сдвиг δН 7.93 м. д. Кроме того, между
тонов, в спектрах HMBC наблюдается дальнее
вышеперечисленными протонами есть ядерный
взаимодействие протонов с геминальными и вици-
эффект Оверхаузера, что позволяет точно отнести
нальными углеродными атомамии атомами азота.
химический сдвиг δН 8.77 м. д. к протону Н2′.
Анализ спектров ЯМР 13C карбоксамидов 3-5
В спектре 1Н-13С HMBC карбоксамида 4 сигна-
показывает отсутствие сигнала карбоксильной
лу атома углерода С4а′ соответствует химический
группы (δC 185.00 м. д. для малеопимаровой кис-
сдвиг 128.88 м. д. что подтверждается наличием
лоты) и появление карбоксамидных сигналов (δC
корреляции с протонами Н3′ (δН 7.41 м. д.), Н8′ (δН
177 м. д.), 9 дополнительных сигналов в области
8.07 м. д.) через три химические связи. О принад-
ароматических атомов углерода (δC 124-145 м. д.
лежности атому углерода С8а′ химического сдвига
для соединения 3, δC 116-149 м. д. для соединения
δС 145.01 м. д. говорит наличие его корреляций с
4 и δC 116-148 м. д. для соединения 5), а также на-
протонами Н2′ (δН 8.84 м. д.), Н4′ (δН 8.15 м. д.), Н5′
личие в спектрах 1Н-15N HMBC корреляций атома
(δН 8.44 м. д.) и Н7′ (δН 7.59 м. д.). Четвертично-
азота CONH-группы в области δN 120-125 м. д. с
му атому углерода С6′ соответствует химический
протонами в спектре ЯМР 1Н говорит об образова-
сдвиг δС 135.91 м. д., о чем свидетельствует его
нии карбоксамидов малеопимаровой кислоты.
корреляция с протоном при азоте (δН 7.88 м. д.).
Аналогичный анализ спектров ЯМР 13C малео-
Дополнительным подтверждением структуры со-
пимаримидов 6-8 показывает сдвиг сигналов С=О
единения 4 является наличие ядерного эффекта
атомов углерода δС 170.82 (С1) и 172.68 (С3) м. д.,
Оверхаузера в спектрах NOESY (схема 3).
характерных для малеопимаровой кислоты, в об-
Структура хинолиновой части соединения 5
ласть слабого поля [δС 178-182 (С1) и 176-179 (С3)
также представлена на схеме 3. Основополагаю-
м. д.], характерного для имидного фрагмента. По-
щими в определении значения химического сдвига
мимо этого, в спектрах ЯМР 13C соединений 6-8
138.88 м. д. для узлового атома углерода С8а′ явля-
имеются 9 дополнительных сигналов в области
ются наличие его корреляций с протонами Н2′ (δН
ароматических атомов углерода (δC 121-145 м. д.
8.83 м. д.) и Н5′ (δН 7.52 м. д.). Корреляция протона
для соединения 6, δC 123-150 м. д. для соединения
H3′ через три химические связи с узловым атомом
7 и δC 122-151 м. д. для соединения 8). Вышеска-
углерода С4а′ позволяет отнести к химическому
занное свидетельствует о присоединении амино-
сдвигу последнего значение δС 127.99 м. д.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023
1346
ВАФИНА и др.
Схема 3.
H
H
H
8'
8'
6'
H
2'
N
8a'
H
H
7'
8a'
N
H
H
7'
H
O
7'
O
2'
O
5'
3'
6'
4'
5'
8'
4'
H
4a'
6'
4a'
3'
4a'
N
H
N
H
N
5'
4'
8a'
H H H
H
H H
H
N
3'
2'
H
3
4
5
H
HMBC
COSY
NOE
Схема 4.
H
H
H
8'
8'
6'
H
2'
N
8a'
H
H
7'
8a'
N
H
H
7'
H
7'
2'
5'
3'
6'
4'
5'
8'
H
4a'
6'
4a'
3'
4a'
4'
N
H
N
H
N
5'
4'
8a'
H H
H H
N
3'
2'
H
6
7
8
H
HMBC
COSY
Наибольший интерес и изменения наблюдают-
В хинолиновом фрагменте соединения
7
ся в хинолиновой части малеопимаримидов 6-8
(схема 4) в спектре 1Н-13С HMBC, наблюдают-
(схема 4). Кроме того, малеопимаримиды 6 и 7
ся кросс-пики протонов Н3′ (δH 8.23 м. д.), Н8′ (δH
выпадали из хлороформа, не растворялись даже
8.49 м. д.) с атомом углерода С4а′, что подтверждает
в ДМСО, поэтому спектральные характеристики
значение химического сдвига, равное 131.15 м. д.
и углы оптического вращения сняты в трифторук-
Наличие корреляции протонов Н7′ (δH 8.07 м. д.),
сусной кислоте. Так, в спектре ЯМР 13С соедине-
Н2′ (δH 9.30 м. д.), Н4′ (δH 9.26 м. д.) c четвертич-
ния 6 наблюдаются сигналы 3 четвертичных ато-
ным атомом углерода С8а′ свидетельствует о при-
мов углерода (C3′, C4a′, C8a′), которые представляют
надлежности ему химического сдвига 138.55 м. д.
спорный момент в интерпретации сигналов хино-
В спектре 1Н-15N HMBC отмечены корреля-
линового фрагмента. В спектре 1Н-13С HMBC на-
ции протонов Н3′, Н2′, Н8′ с атомом азота N1′ (δN
блюдается корреляция протона H8′ (δН 8.18 м. д.) с
186.55 м. д.), что подтверждает присоединение
атомом углерода С4а′ и наличие сигнала кросс-пи-
хинолина к молекуле малеопимаровой кислоты в
ка протона H4′ (δН 8.93 м. д.) с атомом углерода
положение 6′.
С8a′ через три химические связи, подтверждающие
В спектре HMBC малеопимаримида 8 наблюда-
принадлежность сигнала при 130.68 м. д. к атому
ются кросс-пики протонов H7′ (δН 7.27 м. д.), H6′
С4а′ и 127.42 м. д. к атому С8а′. В спектре 1Н-15N
(δН 7.59 м. д.), H4′ (δН 8.27 м. д.), H3′ (δН 7.52 м. д.),
HMBC наблюдаются кросс-пики сигналов прото-
H2′ (δН 9.40 м. д.) с четвертичным атомом углеро-
на H8′ с атомом азота N1′ (δN 187.83 м. д.) и про-
да С8а′, которому принадлежит химический сдвиг
тона H4′ c атомом азота N2 (δN 184.15 м. д.), что
δC 142.79 м. д. (схема 4). Характеристичным в
доказывает присоединение молекулы хинолина по
определении атома углерода С4а′ является наличие
положению 3′ (схема 4).
кросс-пиков протонов H3′ и H5′, а для атома угле-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023
СИНТЕЗ И СПЕКТР
АЛЬНЫЕ ХАРАКТЕРИСТИКИ ХИНОЛИНОВЫХ ПРОИЗВОДНЫХ
1347
рода С8′ (δC 129.10 м. д.) - наличие кросс-пиков с
хлороформ-метанол (10:1, 5:1). Колоночную хро-
протонами H7′ и H6′. В спектре 1Н-15N HMBC на-
матографию выполняли на стандартном силикаге-
блюдается корреляция протона H7′ с атомом азота
ле 60 (0.063-0.2 мм, 70-230 меш) (MACHEREY-
N2 (δN 188.9 м. д.) и протонов H3′, Н2′ c атомом азо-
NAGEL, Germany).
та N1′ (δN 277.6 м. д.), что также свидетельствует
Исходная малеопимаровая кислота 1 [9] и ее
о присоединении молекулы хинолина по положе-
хлорангидрид 2 [6] синтезирована по ранее опи-
нию 8′ к малеопимаровой кислоте.
санным методика. Все физические и спектральные
Таким образом, с высокими выходами синтези-
характеристики соединений 1 и 2 совпадали с ли-
рованы хинолинсодержащие карбоксамиды мале-
тературными данными.
опимаровой кислоты и малеопимаримиды. С по-
Общая методика синтеза карбоксамидов ма-
мощью двумерной спектроскопии ЯМР доказано
леопимаровой кислоты 3-5. К раствору 0.28 г
строение синтезированных соединений.
(1.9 ммоль) аминохинолина в 25 мл безводного
CHCl3 при комнатной температуре прибавляли
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
порциями 0.74 г (1.77 ммоль) хлорангидрида ма-
Спектры ЯМР 1Н и 13С сняты на приборе Bruker
леопимаровой кислоты
2. Реакционную смесь
Avance III 500 (500.13 и 125.75 М Гц), в 10-20%-
перемешивали 10 ч. По окончании реакции от-
ных растворах дейтерорастворителя, внутренний
фильтровывали осадок, растворитель упаривали,
стандарт - сигнал дейтерорастворителя или ТМС.
остаток при необходимости очищали с помощью
Двумерные корреляционные спектры зарегистри-
колоночной хроматографии на SiO2, элюент - хло-
рованы с использованием стандартной библио-
роформ-МеОН, 50:1.
теки импульсных последовательностей прибора.
(3aR,3bS,5aR,6R,9аR,9bR,11R,11aR)-12-
ИК спектры сняты на приборе Shimadzu в тонком
Изопропил-6,9а-диметил-1,3-диоксо-N-хино-
слое или в суспензии в нуйоле. Элементный ана-
лин-3-илтетрадекагидро-1Н-3b,11-этенофе-
лиз проведен на анализаторе Euro EA 3000. Углы
нантро[1,2-с]фуран-6-карбоксамид
(3). Выход
оптического вращения измерены на поляриметре
97%, т. пл. 238-240°С, [α]20 -77° (c 2.2, CHCl3).
PerkinElmer 341 (λ 589 нм) при 20°С. Масс-спек-
ИК спектр, ν, см-1: 3169, 3115, 1838, 1776, 1682,
тры химической ионизации при атмосферном
1574, 1537, 1462, 1377, 1362, 1236, 1088, 947, 924,
давлении получены на ВЭЖХ-масс-спектрометре
907. Спектр ЯМР 1H (CDCl3), δ, м. д.: 0.63 с (3H,
LCMS-2010 EV (Shimadzu) (прямой шприцевой
9а-CH3), 0.92-1.02 м (1Н, 9-Hax), 0.98 д (3H, 14-
ввод образца, раствор образца в метаноле, подвиж-
CH3, 3J 6.8 Гц), 0.99 д (3H, 14-CH3, 3J 6.8 Гц), 1.20-
ная фаза - метанол-вода, 95:5) в режиме регистра-
1.28 м (1Н, 10-Нexo), 1.36 c (3H, 6-CH3), 1.32-1.47
ции положительных и отрицательных ионов при
м (4Н, 5,8,9-Нeq, 9b-H), 1.48-1.58 м (2Н, 5,8-Hax),
напряжении ионизирующего игольчатого электро-
1.58-1.71 м (3Н, 4,10-Hax, 7-Heq), 1.89 д (1H, 5а-H, J
да коронного разряда 4.5 и -3.5 кВ соответственно
11.2 Гц), 1.93 т. д (1H, 7-Hах, 2J 12.4, 3J7ах-8eq 6.4 Гц),
[скорость потока подвижной фазы - 0.1 мл/мин,
2.25 септет (1H, 14-H, 3J 6.8 Гц), 2.49 д. т (1H,
температура интерфейса - 250°С, напряжение на
4-Heq, 2J 13.5, 3J4eq-5 3.8 Гц), 2.67 д (1H, 3а-H, 3J3a-11a
капилляре интерфейса - 5÷-5 В соответственно,
8.6 Гц), 3.08 д. д (1H, 11а-H, 3J11а-3а 8.6, 3J11а-11
температура нагревателя - 200°С, температура ис-
3.0 Гц), 3.10 уш. с (1H, 11-H), 5.51 с (1H, 13-Н),
парителя - 230°С, скорость потока распыляющего
7.54 д. д (1H, 6′-H, J6′-5′ 8.1, J6′-7′ 7.1 Гц), 7.63 д. д
газа (азот) - 2.5 л/мин]. Температуры плавления
(1H, 7′-H, J7′-8′ 8.3, J7′-6′ 7.1 Гц), 7.80 д (1H, 5′-H,
определяли на аппарате Boetius и не корректировали.
J5′-6′ 8.1 Гц), 7.93 с (1Н, NH), 8.03 д (1H, 8′-H, J8′-7′
Контроль за ходом реакции осуществляли ме-
8.3 Гц), 8.77 д (1H, 2′-H, J2′-4′ 2.2 Гц), 8.81 д (1H, 4′-
тодом ТСХ на пластинках Сорбфил ПТСХ-АФ-А,
H, J4′-2′ 2.2 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
вещества обнаруживали с помощью опрыскива-
15.66 (9а-CH3), 17.08 (6-CH3), 17.10 (С8), 19.97 (14-
ния пластинок 5%-ным раствором H2SO4 с после-
CH3), 20.58 (14-CH3), 21.37 (С5), 27.21 (С10), 32.77
дующим нагреванием до 100-120°С. В качестве
(С14), 34.77 (С4), 35.67 (С11), 37.10 (С7), 37.71 (С9),
элюента использовали систему растворителей
37.77 (С9а), 40.35 (С3b), 45.63 (С11а), 47.86 (С6),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023
1348
ВАФИНА и др.
49.81 (С5а), 53.04 (С3а), 53.23 (С9b), 124.77 (С4′),
лин-8-илтетрадекагидро-1Н-3b,11-этенофенан-
125.09 (С13), 127.36 (С6′), 127.84 (С5′), 128.24 (С4a′),
тро[1,2-с]фуран-6-карбоксамид (5). Выход 99%.
128.48 (С7′), 128.69 (С8′), 131.50 (С3′), 144.29 (С2′),
ИК спектр, ν, см-1: 3362, 3213, 1841, 1778, 1715,
145.04 (С8a′), 148.19 (С12), 170.95 (С3), 172.74 (C1),
1669, 1632, 1596, 1554, 1528, 1464, 1379, 1325,
177.70 (СОNH). Спектр ЯМР 15N, δN, м. д.: 120.63
1232, 1146, 1086, 947. Спектр ЯМР 1H, (CDCl3), δ,
(NH), 306.81 (N1′). Масс-спектр, m/z (Iотн, %): 527.4
м. д.: 0.68 с (3H, 9a-CH3), 1.00 д (3H, 14-CH3, 3J
(100) [M + 1]+. Найдено, %: C 75.32; H 7.37; N 5.15.
6.4 Гц), 1.01 д (3H, 14-CH3, 3J 6.4 Гц), 1.07 т. д (1Н,
C33H38N2O4. Вычислено, %: C 75.26; H 7.27; N 5.32.
9-Нах, 2J 12.9, 3J 4.3 Гц), 1.29 д. д. д (1Н, 10-Hexo, 2J
13.4, 3J 5.2, 3J 3.1 Гц), 1.42-1.50 м (3H, 5-Hax, 9-Heq,
(3aR,3bS,5aR,6R,9аR,9bR,11R,11aR)-12-
9b-H), 1.49 c (3H, 6-CH3), 1.52-1.64 м (3H, 8-Hax,
Изопропил-6,9а-диметил-1,3-диоксо-N-хино-
5,8-CHeq), 1.65-1.77 м (3H, 10-Hendo, 4-Hax, 7-Heq),
лин-6-илтетрадекагидро-1Н-3b,11-этенофенан-
1.96 д. д (1H, 5a-H, J 11.7, J 2.1 Гц), 2.00 т. д (1Н,
тро[1,2-с]фуран-6-карбоксамид (4). Выход 93%,
7-Нах, 2J 13.1, 3J 4.9 Гц), 2.26 септет (1H, 14-H, 3J
т. пл. 135-138°С, [α]20 -61° (c 1.017, CHCl3). ИК
6.4 Гц), 2.48 д. т (1H, 4-Heq, 2J 13.9, 3J4eq-5 3.1 Гц),
спектр, ν, см-1: 3364, 1842, 1771, 1667, 1624, 1599,
2.72 д (1H, 3а-H, J3а-11а 8.6 Гц), 3.11 д. д (1H, 11а-H,
1537, 1497, 1379, 1360, 1277, 1229, 1086, 1003, 947,
J11а-3а 8.6, J11а-11 3.1 Гц), 3.13 уш. с (1H, 11-H),
922, 907. Спектр ЯМР 1H (CDCl3), δ, м. д.: 0.63 с
5.53 с (1H, 13-Н), 7.47 д. д (1H, 3′-H, J3′-4′ 8.3, J3′-2′
(3H, 9а-CH3), 0.96 д. д. д (1Н, 9-Hax,2J 13.2, 3J9ax-8ax
4.2 Гц), 7.52 д. д (1H, 5′-H, J5′-6′ 8.2, J5′-7′ 1.4 Гц),
9.7, 3J9ax-8eq 7.4 Гц), 0.98 д (3H, 14-CH3, 3J 6.8 Гц),
7.56 д. д (1H, 6′-H, J6′-5′ 8.2, J6′-7′ 7.6 Гц), 8.18 д. д
0.99 д (3H, 14-CH3, 3J 6.8 Гц), 1.20-1.24 м (1Н, 10-
(1H, 4′-H, J4′-3′ 8.3, J4′-2′ 1.6 Гц), 8.81 д. д (1H, 7′-
Нexo), 1.35 c (3H, 6-CH3), 1.32-1.44 м (3Н, 5,8,9-
CH, J7′-6′ 7.6, J7′-5′ 1.4 Гц), 8.83 д. д (1H, 2′-H, J2′-3′
Нeq), 1.45-1.58 м (3Н, 5,8-Нax, 9b-H), 1.57-1.72 м
4.2, J2′-4′ 1.6 Гц), 10.43 с (1Н, NH). Спектр ЯМР 13С
(3Н, 4-Hax, 10-Hendo, 7-CHeq), 1.89 д. д (1Н, 5а-H, 2J
(CDCl3), δC, м. д.: 15.72 (9a-CH3), 17.10 (6-CH3),
12.0, J5а-5eq 2.1 Гц), 1.93 д. д. д (1Н, 7-Нах, 2J 11.9,
17.26 (С8), 19.97 (14-CH3), 20.58 (14-CH3), 21.30
3J7ax-8ax 12.3, 3J7ax-8eq 6.6 Гц), 2.24 септет (1H, 14-H,
(С5), 27.28 (С10), 32.77 (С14), 34.84 (С4), 35.73 (С11),
3J14-Ме 6.8 Гц), 2.49 д. т (1H, 4-Heq, 2J 13.7, 3J4eq-5ax
3.2 Гц), 2.67 д (1H, 3а-H, 3J3a-11a 8.7 Гц), 3.08 д. д
37.14 (С7), 37.91 (С9а), 37.97 (С9), 40.46 (С3b), 45.67
(С11а), 48.32 (С6), 49.94 (С5а), 53.12 (С3а), 53.39
(1H, 11а-H, 3J11a-3a 8.7, 3J11a-11 3.0 Гц), 3.11 уш. с
(С9b), 116.51 (С7′), 121.50 (С5′), 121.58 (С3′), 125.28
(1H, 11-H), 5.50 с (1H, 13-Н), 7.41 д. д (1H, 3′-H,
(С13), 127.51 (С6′), 127.99 (С4a′), 134.45 (С8′), 136.49
3J3′-4′ 8.3, 3J3′-2′ 4.3 Гц), 7.59 д. д (1H, 7′-H, 3J7′-8′ 9.0,
(С4′), 138.88 (С8a′), 148.03 (С12), 148.22 (С2′), 170.88
4J7′-5′ 2.5 Гц), 7.88 с (1Н, NH), 8.07 д (1H, 8′-H, 3J8′-7′
(C3), 172.81 (С1), 177.26 (СОNH). Спектр ЯМР 15N,
9.0 Гц), 8.15 д (1H, 4′-H, 3J3′-4′ 8.4, 4J4′-2′ 1.8 Гц),
δN, м. д.: 120.60 (NН), 289.78 (N1′). Масс-спектр,
8.44 д (1H, 5′-H, 4J5′-7′ 2.5 Гц), 8.84 д. д (1H, 2′-H,
m/z (Iотн, %): 527.4(100) [M + 1]+. Найдено, %: C
3J2′-3′ 4.4, 4J2′-4′ 1.7 Гц). Спектр ЯМР 13С (CDCl3),
75.30; H 7.22; N 5.46. C33H38N2O4. Вычислено, %:
δС, м. д.: 15.65 (9a-CH3), 17.07 (С8), 17.13 (6-CH3),
C 75.26; H 7.27; N 5.32.
19.97 (14-CH3), 20.58 (14-CH3), 21.33 (С5), 27.20
(С10), 32.76 (С14), 34.79 (С4), 35.67 (С11), 37.05 (С7),
Общая методика получения малеопимар-
37.77 (С9), 37.78 (С9a), 40.36 (С3b), 45.63 (С11а),
имидов 6-8. Смесь 0.7 г (1.74 ммоль) малеопима-
47.78 (С6), 49.78 (С5а), 53.06 (С3а), 53.26 (С9b),
ровой кислоты 1 и 0.29 г (2 ммоль) аминохинолина
116.79 (С5′), 121.70 (С3′), 124.04 (С7′), 125.11 (С13),
кипятили в 50 мл безводного ДМФА. Ход реакции
128.88 (С4a′), 129.51 (С8′), 135.91 (С6′), 136.42 (С4′),
контролировали методом ТСХ. По окончании ре-
145.01 (С8a′), 148.17 (С12), 149.04 (С2′), 170.96 (С3),
акции растворитель отгоняли при пониженном
172.75 (C1), 177.31 (СОNH). Спектр ЯМР 15N, δN,
давлении, при необходимости остаток очищали
м.д.: 126.21 (NН), 300.00 (N1′). Масс-спектр, m/z
с помощью колоночной хроматографии на SiO2,
(Iотн, %): 527.4(100) [M + 1]+. Найдено, %: C 75.27;
элюент - хлороформ-МеОН, 200:1.
H 7.31; N 5.26. C33H38N2O4. Вычислено, %: C 75.26;
(3aR,3bS,5aR,6R,9аR,9bR,11R,11aR)-12-
H 7.27; N 5.32.
Изопропил-6,9а-диметил-1,3-диоксо-2-хино-
(3aR,3bS,5aR,6R,9аR,9bR,11R,11aR)-12-
лин-3-илгексадекагидро-3b,11-этенонафто-
Изопропил-6,9а-диметил-1,3-диоксо-N-хино-
[2,1-e]изоиндол-6-карбоновая кислота
(6).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023
СИНТЕЗ И СПЕКТР
АЛЬНЫЕ ХАРАКТЕРИСТИКИ ХИНОЛИНОВЫХ ПРОИЗВОДНЫХ
1349
Выход 76%, т. пл. 269-270°С (СНСl3), [α]20 -92.2°
13-Н), 8.07 д. д (1H, 7′-H, J7′-8′ 9.1, J7′-5′ 1.3 Гц),
(c 0.95, CF3COOH). ИК спектр, ν, см-1: 3216, 1775,
8.23 д. д (1H, 3′-H, J3′-4′ 8.4, J3′-2′ 5.4 Гц), 8.31 уш.
1715, 1694, 1603, 1499, 1462, 1375, 1325, 1254, 1190,
с (1H, 5′-H), 8.49 д (1H, 8′-H, J8′-7′ 9.1 Гц), 9.27 д
1167, 1071. Спектр ЯМР 1H, (CF3COOH + C6D6),
(1H, 4′-H, J4′-3′ 8.4 Гц), 9.30 д (1H, 2′-H, J2′-3′ 5.4 Гц).
м. д.: 0.67 с (3H, 9а-CH3), 0.97-1.04 м (1Н, 9-Hax),
Спектр ЯМР 13С [CF3COOH + (CD3)2СO], δC, м. д.:
1.03 д (3H, 14-CH3, 3J 6.7 Гц), 1.05 д (3H, 14-CH3, 3J
16.50 (9а-CH3), 17.13 (6-CH3), 18.12 (С8), 20.79 (14-
6.7 Гц), 1.26 c (3H, 6-CH3), 1.34-1.42 м (2Н, 5-Heq,
CH3), 21.39 (14-CH3), 23.24 (С5), 28.84 (С10), 34.51
10-Нexo), 1.44-1.50 м (2Н, 9b-Н, 9-Нeq), 1.51-1.86
(С14), 36.65 (С4), 38.19 (С7), 38.30 (С11), 39.30 (С9а),
м (6Н, 8-Heq, 4,5,7,8-Hax, 10-Hendo), 1.71 д. т (1H,
39.39 (С9), 43.13 (С3b), 47.20 (С11а), 48.94(С6),50.86
7-Heq, 2J 13.5, 3J 3.5 Гц), 1.89 д. д (1Н, 5а-H, J 12.2,
(С5а), 54.62 (С3а), 55.81 (С9b), 123.44 (С8′), 124.19
J 1.5 Гц), 2.29 септет (1H, 14-H, J 6.7 Гц), 2.57 д. т
(С3′), 126.34 (С13), 128.67 (С5′), 131.15 (С4а′), 134.95
(1H, 4-Heq, 2J 13.4, 3J4eq-5 3.5 Гц), 2.82 д (1H, 3а-H,
(С6′), 135.55 (С7′), 138.55 (С8a′), 146.99 (С2′), 149.76
J3a-11a 7.0 Гц), 3.21-3.27 м (2H, 11,11а-H), 5.65 с (1H,
(С12), 150.36 (С4′), 179.90 (С3), 182.36 (C1), 187.98
13-Н), 7.86 т (1H, 6′-H, 3J6′-7′ 7.8, 3J6′-5′ 7.8 Гц), 8.05 д
(СООH). Спектр ЯМР 15N, δN, м. д.: 183.60 (N2),
(1H, 5′-H, 3J5′-6′ 7.8 Гц), 8.06 д. д (1H, 7′-H, 3J7′-6′ 7.8,
186.55 (N1′). Масс-спектр, m/z (Iотн, %): 527.3 (100)
3J7′-8′ 8.6 Гц), 8.18 д (1H, 8′-H, 3J8′-7′ 8.6 Гц), 8.93 уш.
[M + 1]+. Найдено, %: C 75.41; H 7.44; N 5.27.
с (1H, 4′-H), 9.11 уш. с (1H, 2′-H). Спектр ЯМР 13С
C33H38N2O4. Вычислено, %: C 75.26; H 7.27; N 5.32.
(CF3COOH + C6D6), δC, м. д.: 16.54 (9a-CH3), 17.13
(3aR,3bS,5aR,6R,9аR,9bR,11R,11aR)-12-
(6-CH3), 18.14 (С8), 20.96 (14-CH3), 21.48 (14-CH3),
Изопропил-6,9а-диметил-1,3-диоксо-2-хино-
23.32 (С5), 28.91 (С10), 34.73 (С14), 36.65 (С4), 38.35
лин-8-илгексадекагидро-3b,11-этенонафто-
(С11), 38.45 (С7), 39.38 (С9), 39.41(С9а), 43.37 (С3b),
[2,1-e]изоиндол-6-карбоновая кислота
(8).
47.48 (С11а), 49.26 (С6), 50.85 (С5а), 54.90 (С3а),
Выход 99%, [α]20 -61° (c 1.02, CHCl3). ИК спектр,
55.76 (С9b), 121.91 (С8′), 126.55 (С13),127.42(С8а′),
ν, см-1: 3327, 1842, 1778, 1653, 1516, 1456, 1377,
130.68 (С4a′), 131.23 (С5′), 133.43 (С6′), 138.31 (С3′),
1231,
1086,
1001,
947,
922. Спектр ЯМР
1H
138.97 (С7′), 142.97 (С2′), 145.51 (С4′), 150.15 (С12),
(CDCl3 + MeOD), δ, м. д.: 0.69 с (3H, 9a-CH3), 0.87-
179.38 (С3), 182.09 (C1), 189.23 (СООH). Спектр
0.98 м (1Н, 9-Hax), 1.07 д (3H, 14-CH3, 3J 6.8 Гц), 1.11
ЯМР 15N, δN, м. д.: 184.15 (N2), 187.83 (N1′). Масс-
д (3H, 14-CH3, 3J 6.8 Гц), 1.18 c (3H, 6-CH3),1.37 д
спектр, m/z (Iотн, %): 527.4 (100) [M + 1]+. Найдено,
(1Н, 5-Нeq, 3J 13.6 Гц), 1.45 т. д (1Н, 10-Нexo, 2J 13.5,
%: C 75.31; H 7.29; N 5.40. C33H38N2O4. Вычисле-
3J10exo-9b 4.3 Гц),1.52-1.68 м (6Н, 7,8,9-Heq, 5,8-Hax,
но, %: C 75.26; H 7.27; N 5.32.
9b-CH), 1.72-1.92 м (3Н, 7-Hax,10-Hendo, 5a-H), 2.37
(3aR,3bS,5aR,6R,9аR,9bR,11R,11aR)-12-
септет (1H, 14-H, J 6.8 Гц), 2.70 д. т (1H, 4-Heq,
Изопропил-6,9а-диметил-1,3-диоксо-2-хи-
2J 14.2 Гц, 3J4eq-5 2.7 Гц), 3.06 д (1H, 3а-H, J3а-11а
нолин-6-илгексадекагидро-3b,11-этено-
8.0 Гц),3.29 уш. с (1H, 11-H), 3.48 д. д (1H, 11а-H,
нафто[2,1-e]изоиндол-6-карбоновая кислота (7).
J
8.0, J11а-11 2.8 Гц), 5.65 с (1H, 13-Н), 7.27 д. д
11а-3а
Выход 74%, т. пл. 180-182°С (СНСl3), [α]20 -77.1°
(1H, 7′-H, J7′-6′ 7.5, J7′-5′ 1.2 Гц), 7.52 д. д (1H, 3′-H,
(c 0.82, CF3COOH). ИК спектр, ν, см-1: 1771, 1699,
J3′-4′ 8.2, J3′-2′ 4.6 Гц), 7.59 д. д (1H, 6′-H, J6′-5′ 8.2, J6′-7′
1506, 1456, 1387, 1375, 1246, 1177. Спектр ЯМР 1H
7.5 Гц), 7.91 д. д (1H, 5′-H, J5′-6′ 8.2, J5′-7′ 1.2 Гц),
[CF3COOH + (CD3)2СO], δ, м. д.: 0.77 с (3H, 9a-
8.18 д. д (1H, 4′-H, J4′-3′ 8.2, J4′-2′ 1.5 Гц), 9.40 д. д
CH3), 1.06-1.13 м (1Н, 9-Hax), 1.07 д (3H, 14-CH3,
(1H, 2′-H, J2′-3′ 4.6, J2′-4′ 1.5 Гц). Спектр ЯМР 13С
3J 6.4 Гц), 1.08 д (3H, 14-CH3, 3J 6.4 Гц), 1.29 c (3H,
(CDCl3 + MeOD), δС, м. д.: 15.85 (9a-CH3), 16.94
6-CH3), 1.42 д. т (1H, 5-Нах, J 12.6, J 3.7 Гц,), 1.48
(6-CH3), 17.23 (С8), 20.09 (14-CH3), 20.69 (14-CH3),
д. д. д (1Н, 10-Нexo, 2J 13.2, 3J 5.4, 3J 3.4 Гц), 1.53-
21.77 (С5), 27.90 (С10), 32.80 (С14), 35.80 (С4), 35.97
1.61 м (1Н, 9-Нeq), 1.63-1.78 м (5Н, 7,8-Heq, 5,8-Hax,
(С11), 37.02 (С7), 37.98 (С9а), 39.48 (С9), 41.55 (С3b),
9b-H), 1.82-1.92 м (3H, 4,7-Hax, H-10endo), 1.95 д (1H,
46.55 (С11а), 47.01 (С6), 50.28 (С5а), 53.44 (С3а),
H-5a, J 11.7 Гц), 2.37 септет (1H, 14-H, J 6.4 Гц),
55.74 (С9b), 122.22 (С3′), 124.60 (C13), 126.63 (С6′),
2.65 д. т (1H, 4-Heq, 3J 13.6, 3J4eq-5 3.0 Гц), 3.00 д
129.10 (С8′), 129.56 (С4a′), 129.99 (С5′), 130.61 (С7′),
(1H, 3а-H, J3a-11a 7.6 Гц), 3.30 уш. с (1H, 11-H), 3.41
138.08 (С4′), 142.79 (C8a′), 147.36 (С12), 151.32 (С2′),
д. д (1H, 11а-H, J11a-3a 7.6, J11a-11 2.4 Гц), 5.74 с (1H,
176.62(С1), 178.22 (C3), 180.49 (СОOH). Спектр
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023
1350
ВАФИНА и др.
ЯМР 15N, δN, м. д.: 188.67 (N2), 277.60 (N1′). Масс-
хвойных России. Химия, фармакология. Новоси-
спектр, m/z (Iотн, %): 527.4 (100) [M + 1]+. Найдено,
бирск: Гео, 2011. 395 с.
%:C 76.32; H 8.11; N 2.96. C33H38N2O4. Вычислено,
2.
Вафина Г.Ф., Ханова М.Д., Мещерякова С.А., Булга-
%: C 75.26; H 7.27; N 5.32.
ков А.К. // ХПС. 2019. Т. 55. № 5. С. 746; Vafina G.F.,
Khanova M.D., Meshcheryakova S.A., Bulgakov A.K. //
ИНФОРМАЦИЯ ОБ АВТОРАХ
Chem. Nat. Compd. 2019.Vol. 55. P. 868. doi 10.1007/
s10600-019-02835-z
3.
Вафина Г.Ф., Ханова М.Д., Есаулкова Я.Л., Си-
org/0000-0002-9985-7711
негубова Е О., Слита А.В., Зарубаев В.В. // ХПС.
Акчурина Оксана Владиковна, ORCID: http://
2021. Т. 57. № 2. С. 276; Vafina G.F., Khanova M.D.,
doi.org/0000-0002-8605-1532
Esaulkova Ya.L., Sinegubova E.O., Slita A.V., Zaruba-
Лобов Александр Николаевич, ORCID: http://
ev V.V. // Chem. Nat. Compd. 2021. Vol. 57. N 2. P. 323.
doi.org/0000-0002-9223-508X
doi 10.1007/s10600-021-03341-х
4.
Wallace D.J. // Lupus. 1996. Vol. 5 (suppl. 1). Р. S2.
ФИНАНСОВАЯ ПОДДЕРЖКА
5.
Машковский М.Д. Лекарственные средства. М.:
Работа выполнена в рамках государственного
Новая волна, 2012. C. 897, 901
задания (№ 1021062311395-6-1.4.1, «Синтез био-
6.
Schuller W.H., Lawrence R.V. // J. Chem. Eng. Data.
логически активных веществ на основе природ-
1967. Vol. 12. P. 267. doi 10.1021/je60033a030
ных соединений. Создание экологически чистых
7.
Бей М.П., Ювченко А.П., Поткин В.И., Петке-
материалов и технологий»).
вич С.К. // Весці Нац. акад. навук Беларусі. Сер. хім.
навук. 2021. Т. 57. № 4. С. 423. doi 10.29235/1561-
КОНФЛИКТ ИНТЕРЕСОВ
8331-2021-57-4-424-430.
Авторы заявляют об отсутствии конфликта
8.
Yao G., Li Y., Zhu Y., Pan Y., Huang F., Wang H.,
интересов.
Liao Zh. // New J. Chem. 2014. Vol. 38. P. 693. doi
10.1039/c3nj01194a.
СПИСОК ЛИТЕРАТУРЫ
9.
Рогоза Л.Н., Салахутдинов Н.Ф., Толстиков С.Е.,
1. Толстиков Г.А., Толстикова Т.Г., Шульц Э.Э.,
Толстиков Г.А. Препаративная химия терпеноидов.
Толстиков С.Е., Хвостов М.В. Смоляные кислоты
Новосибирск: Академиздат, 2013. C. 277.
Synthesis and Spectral Characteristics of Quinoline Derivatives
of Maleopimaric Acid
G. F. Vafinaa,*, O. V. Akchurinaa, and A. N. Lobova
a Ufa Institute of Chemistry, Ufa Federal Research Centre of the Russian Academy of Sciences, Ufa, 450054 Russia
*e-mail: vafina@anrb.ru
Received July 6, 2023; revised July 18, 2023; accepted July 29 2023
The reaction of maleopimaric acid and its acid chloride with 3-, 6-, and 8-aminoquinolines afforded quinoline
containing maleopimarimides and carboxamides, respectively. Structure of the synthesized compounds was
determined by 1Н, 13С, 1H-13C HSQC, 1H-13C HMBC, COSY, NOESY, and 1Н-15N HMBC NMR spectros-
copy methods.
Keywords: maleopimaric acid, maleopimarimide, carboxamide, quinoline
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 9 2023