ВВЕДЕНИЕ
Накопление биомассы у древесных растений происходит благодаря деятельности латеральной меристемы – камбия. Стволовые клетки камбия дают начало тканям сосудистой системы растений – ксилеме, откладывающейся внутрь от камбия, и флоэме, откладывающейся наружу (Fischer et al., 2019). Флоэма является основным транспортным маршрутом для фотоассимилятов, сигнальных молекул и некоторых минеральных веществ по всему растению; ксилема обеспечивает транспорт воды и растворенных минеральных веществ, поглощаемых корнями, выполняет механическую функцию. Конечный этап дифференциации производных камбия в сосуды, волокна, трахеиды ксилемы – это программируемая клеточная смерть (ПКС), эти структурные элементы состоят только из клеточных стенок, формирующих основную биомассу ствола древесных растений. В отличие от них, слабо дифференцированные паренхимные клетки ксилемы сохраняют протопласт, они участвуют в транспорте, запасании питательных веществ, в различных биосинтетических процессах. Внешнюю часть древесины, содержащую живые клетки лучевой и аксиальной паренхимы, называют заболонной древесиной (sapwood, SW). По мере старения SW происходит гибель клеток паренхимы, накопление в них большого количества вторичных метаболитов и образование физиологически неактивной ядровой древесины (heartwood, HW). Переходная зона (transition zone, TZ), расположенная между SW и HW, согласно данным литературы, характеризуется активной транскрипцией генов, кодирующих различные ферменты, в том числе синтеза вторичных метаболитов, а также связанных с ПКС у растений (Lim et al., 2016). Сосна обыкновенная (Pinus sylvestris L.), благодаря четкой границе между SW и HW, относится к модельным древесным растениям для изучения закономерностей формирования HW.
В настоящее время для изучения процессов формирования тканей ствола древесных растений активно применяются молекулярно-генетические методы, в частности, метод полимеразной цепной реакции (ПЦР). Метод ПЦР в режиме реального времени (ПЦР-РВ) широко используется для количественной оценки уровня экспрессии генов и имеет ряд преимуществ: простота реализации, высокая чувствительность, специфичность и повторяемость. Однако работа с хвойными древесными растениями в качестве объекта исследований сопряжена с рядом трудностей при выполнении молекулярно-генетического анализа. Наличие прочных вторичных клеточных стенок и высокое содержание вторичных метаболитов, частичная деградация РНК в SW затрудняют получение высокочистых, целостных препаратов тотальной РНК, пригодных для использования в качестве матрицы в реакции обратной транскрипции и дальнейшего ПЦР анализа. Значительные изменения в строении и составе тканей по мере продвижения от периферии ствола (зона камбиального роста) к центру (формирующаяся HW) усложняют выбор универсального эталонного гена для нормализации данных количественной ПЦР во всех изучаемых тканях. В настоящее время в литературе имеются данные об использовании Actin, Histone, upLOC, PGK1 для анализа экспрессии генов у разных видов сосны в качестве генов-нормализаторов (Chen et al., 2016; Lim et al., 2016; Mo et al., 2019), однако работы по оценке стабильности экспрессии референсных генов в различных тканях ствола взрослых деревьев Pinus sylvestris ранее не проводилось.
В настоящее время существует ряд публикаций, представляющих собой практические рекомендации, касающиеся выделения РНК, постановки реакции обратной транскрипции, постановки, анализа и публикации данных ПЦР-РВ (Bustin et al., 2009, 2010; Taylor et al., 2010).
В данной работе описана отработка различных этапов проведения анализа экспрессии генов в тканях ствола P. sylvestris L. по радиальному вектору: “проводящая флоэма/камбиальная зона – дифференцирующаяся ксилема – внешняя часть SW (1–2 кольца) – внутренняя часть SW (1–2 кольца перед TZ) – TZ (2 кольца перед HW)” для получения воспроизводимых данных ПЦР-РВ.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал и отбор образцов
Отбор образцов для анализа стабильности экспрессии референсных генов проводили в период активного камбиального роста (конец июня) с разновозрастных (30, 70–80, 180 лет) деревьев Pinus sylvestris L., произрастающих в средней (заповедник “Кивач”, республика Карелия) и северной (Калевальский район, Карелия; заповедник “Пасвик”, Печенгский район Мурманской области) подзоне тайги. Для отбора тканей с южной стороны ствола на высоте 1.5 м делали “окошки” и отделяли кору от древесины. Со стороны коры скальпелем снимали слой тканей, включающий камбиальную зону, проводящую флоэму и небольшую порцию непроводящей флоэмы (фракция “флоэма”). Со стороны ствола соскабливали слой дифференцирующейся ксилемы, содержащей клетки ксилемы на стадии растяжения и формирования вторичной клеточной стенки (фракция “ксилема”). Далее с “окошек” отбирали керны. Все ткани сразу замораживали в жидком азоте и хранили в нем и/или в низкотемпературной морозильной камере (New Brunswick Premium ‒86°C Freezers, Eppendorf, Великобритания) до проведения анализа. В лабораторных условиях керны подсвечивали в ультрафиолетовом свете для определения границы ядровой древесины и отбирали образцы транзитной зоны (TZ) (2 годичных кольца на границе с ядровой древесиной), внутренней заболони (SWint) (2 годичных кольца после TZ) и внешней заболони (SWext) (1 годичное кольцо – ксилема текущего года).
Выделение и очистка тРНК
Состав экстракционного ЦТАБ-буфера: 10 мМ Tris-HCl (pH 8.0), 25 мМ ЭДТА, 2 М NaCl, 2% ЦТАБ, 2% PVP-40, довести до pH 5.0. Состав ДДС буфера: 10 мМ Tris-HCl (pH 8), 1 мМ ЭДТА (pH 8), 1% SDS, 1 М NaCl, довести до pH 5.0.
Навеску растительной ткани (200 мг) растирали в жидком азоте и добавляли 2 мл предварительно разогретого до 65°С ЦТАБ-буфера и 20 мкл 2%-меркаптоэтанола, полученную смесь инкубировали в течение 15 мин при 65°С периодически встряхивая, затем центрифугировали при 12 000 g (Microfuge 20R, Beсkman Coulter, Россия) и комнатной температуре в течение 15 мин, отбирали надосадочную жидкость и добавляли равный объем смеси хлороформ/изоамиловый спирт (24 : 1). Центрифугировали при 12 000 g в течение 30 мин при температуре 4°С. К водной фазе добавляли 1 V изопропанола и осаждали в течение 2–3 ч при –70°С. Центрифугировали при 12 000 g при комнатной температуре в течение 30 мин, осадок промывали 70% этанолом (центрифугирование при 9200 g 2 мин при комнатной температуре). Осадок растворяли в стерильной, свободной от РНКаз воде. При необходимости, для лучшей очистки препарата РНК, совместно с хлороформ-изоамиловой смесью использовали фенол (соотношение фенол : хлороформ : изоамиловый спирт составляло 25 : 24 : 1). При использовании в протоколе дополнительной экстракции ДДС-буфером изопропиловый спирт для осаждения РНК после первого этапа выделения заменяли на 10М хлорид лития (добавляли 1/4 объема LiCl и осаждали в течение ночи при 4°С). Осадок РНК повторно растворяли в 600 мкл ДДС-буфера, добавляли хлороформ-изоамиловую смесь и осаждали РНК из водной фазы изопропиловым спиртом, так же как в первом варианте протокола. После проверки качества выделенную РНК сразу использовали в реакции обратной транскрипции для получения кДНК.
Постановка реакции обратной транскрипции и оценка качества нуклеиновых кислот
Перед проведением реакции обратной транскрипции полученный препарат инкубировали с ДНКазой в течение часа при 37°С. Реакцию обратной транскрипции (ОТ) проводили с помощью термоциклера “T100 Thermal cycler” (“BioRad”, США) c набором реактивов MMLV RT (Евроген, Россия). Для реакции ОТ в реакционную смесь добавляли 5 мкл матрицы РНК (∼500 нг), 1 мкл 20 мкМ Oligo(dT)15-primer, 1 мкл 20 мкМ (Random (dN)10-primer, 2 мкл деионизованной свободной от нуклеаз воды, затем прогревали смесь 10 мин до 70°С для инактивации ДНКазы и расплавления вторичных структур РНК. Затем добавляли 11 мкл заранее подготовленной реакционной смеси (4 мкл 5× буфера для синтеза первой цепи, 2 мкл смеси dNTP (10 мМ каждого), 2 мкл DTT (20 мМ), 1 мкл MMLV ревертазы (100 ед.)), инкубировали 50 мин при 37°С, а затем прогревали смесь в течение 10 мин при 70°С для остановки реакции. Качество и количество выделенной РНК и синтезированной кДНК проверяли спектрофотометрически (планшетный спектрофотометр SPECTROstar NANO, “BMG Labtech”, Германия) и при помощи электрофореза в 1% агарозном геле (система горизонтального гель-электрофореза Sub-Cell GT Agarose Gel, Bio-Rad, США). Полученные препараты кДНК сразу использовали для проведения анализа или хранили при –80°С не более 1 мес. Для контроля примеси геномной ДНК проводили ПЦР-РВ со специфическими для референсных генов праймерами с препаратом тотальной РНК, а также с использованием в качестве матрицы реакционной смеси для синтеза кДНК, прошедшей все стадии инкубации и инактивации, но без добавления обратной транскриптазы.
Поиск генов в геноме P. sylvestris и дизайн праймеров для постановки ПЦР-РВ
Поиск белков P. sylvestris, кодируемых потенциальными референсными генами, проводили с использованием базы данных GymnoPLAZA (https://bioinformatics.psb.ugent.be/plaza/versions/ gymno-plaza/). С этой целью были получены аминокислотные последовательности актина, тубулина (Zhu et al., 2019), убиквитина (UBQ) (Chen et al., 2016) Pinus massoniana, частичные аминокислотные последовательности NAD-зависимой глицеральдегид-3-фосфат дегидрогеназы Pinus sylvestris L. (accesions AAL73356.1, AAL73355.1, BAH58080.1), депонированные в NCBI и последовательности белков Actin, Tubulin, EF1a1-4, GAPDH, UBQ Arabidopsis thaliana из базы данных UniProt/SwissProt (https://www.uniprot.org).
Предсказание структуры белков сосны обыкновенной было выполнено с использованием ресурса National Center for Biotechnology Information (NCBI) (http://www.ncbi.nlm.nih.gov/Structure/cdd/ cdd.shtml) (Marchler-Bauer, Bryant, 2004) и инструмента ScanProSite (https://prosite.expasy.org/ scanprosite/) (de Castro et al., 2006). Филогенетический анализ проводили с помощью программы MEGA 7 (Kumar et al., 2016). Множественное выравнивание потенциальных белков сосны обыкновенной и других организмов было выполнено с помощью ClustalW. Филогенетические деревья были построены с использованием метода присоединения ближайшего соседа (Neighbor-Joining method) на основе модели коррекции Пуассона с 1000 повторами bootstrap (Saitou, Nei, 1987). Определение процента идентичности/сходства белков P. sylvestris, P. massoniana и A. thaliana было выполнено в EMBOSS Needle (https://www.ebi.ac.uk/ Tools/psa/emboss_needle/).
Постановка ПЦР-РВ
Амплификацию образцов проводили в термоциклере (амплификаторе) CFX96 (“BioRad”, США), используя наборы для амплификации с интеркалирующим красителем SYBR Green (Евроген, Россия). ПЦР-РВ проводили в реакционной смеси объемом 25 мкл, содержащей 5 мкл qPCRmix-HS SYBR, по 1 мкл прямого и обратного праймера (0.4 мкМ) (Синтол, Россия), 2 мкл матрицы кДНК, 16 мкл деионизированной, свободной от нуклеаз воды. Конечное содержание кДНК в реакционной среде для всех образцов составляло ∼100 нг, согласно рекомендации протокола производителя. ПЦР проводили при следующих условиях: 95°C в течение 5 мин, затем 40 циклов: денатурация (95°C, 15 с), отжиг (53.9–60.9°С, 30 с), элонгация (72°С, 30 с). Для каждой пары праймеров применяли отрицательный контроль – постановка ПЦР в отсутствие матрицы кДНК.
Специфичность полученных продуктов ПЦР оценивали с помощью кривых плавления. Относительный уровень транскриптов генов (RQ) вычисляли по формуле:
и выражали в относительных единицах (отн. ед.) (Pfaffl, 2001). Для определения эффективности (Е) ПЦР-амплификацию проводят c каждой парой праймеров на серии 10-кратных разведений (10–1, 10–2, 10–3, 10–4) кДНК. C помощью программного обеспечения Excel строят график зависимости Сt от Lg [концентрация кДНК] и, используя значения наклона кривой (slope, k), вычисляют эффективность по формуле E = 101/–k, для расчета значения эффективности в %, использовали формулу: E = (10–1/k – 1) × 100 (Chang et al., 2012). Также эффективность амплификации оценивали индивидуально в каждой реакции на основе необработанных данных флуоресценции амплификации при помощи программного обеспечения LinRegPCR (Ramakers et al., 2003).
Оценка стабильности референсных генов
Для выбора подходящего референсного гена с помощью двух пакетов программ NormFinder и BestKeeper анализировали стабильность экспрессии каждого претендента на эту роль. Исходные значения Ct переводили в формат, необходимый для анализа в NormFinder. Максимальный уровень экспрессии (наименьшее значение Ct) принимали равным 1. Относительные уровни экспрессии рассчитывали, используя формулу: 2–ΔgCt, в которой ΔgCt – это наименьшее значение Ct, вычтенное из соответствующего значения Ct для каждого гена и каждого образца. При помощи программы BestKeeper потенциальные референсные гены анализировали используя непреобразованные значения Сt и значения эффективности амплификации.
Статистическая обработка данных
Статистическая обработка данных осуществлялась с использованием пакетов программ Miscrosoft Excel 2010 и Past 4.03. Средние значения пороговых циклов и относительной экспрессии генов рассчитывали на основе 5–6 биологических повторностей. Нормальность распределения проверяли с использованием критерия Шапиро–Уилка. Распределение не являлось нормальным, поэтому для оценки различий использовали критерий Манна–Уитни. Статистически значимыми считали различия при р < 0.05.
РЕЗУЛЬТАТЫ
Фракции “ксилема” и “флоэма”
Поскольку ранее апробированные на древесных тканях наборы для выделения тотальной РНК на основе гуанидин-изотиоцианата – TRIzol (Invitrogen, США), реагент ExtractRNA (Евроген, Россия), PureZOL (Bio-Rad, США) не дали возможности выделения достаточного количества качественной суммарной РНК, в данной работе мы использовали метод выделения тотальной РНК с применением ЦТАБ-буфера, который, по данным литературы, является более успешным для получения качественных препаратов РНК из древесных тканей, богатых вторичными метаболитами и полисахаридами. Использование данного метода дало неплохие результаты при выделении РНК из фракции “ксилема”: наблюдался достаточно высокий выход РНК, значения соотношений А260/A280, А260/A230 (табл. 1) свидетельствовали об отсутствии примесей белка и вторичных метаболитов. В случае выделения тотальной РНК из фракции “флоэма” буфером на основе ЦТАБ наблюдали достаточно низкий выход РНК и низкие значения соотношений А260/A280, А260/A230 (табл. 1), которые свидетельствуют о наличии примесей, низком качестве полученной РНК и непригодности использования полученного препарата для дальнейшего анализа методом ПЦР-РВ. В дальнейшем протокол экстракции тотальной РНК был дополнен применением фенола для лучшей очистки от белков и этапом дополнительной экстракции ДДС-буфером, как описано в работе Су с соавт. (Су и др., 2009) с некоторыми изменениями (см. методику). Качество полученной РНК была оценено спектрофотометрически и при помощи метода гель-электрофореза. Электрофорез в 1% агарозном геле показал четкое разделение полос 28S и 18S рРНК (рис. 1, 1, 2), а спектрофотометрические характеристики препарата свидетельствовали об отсутствии загрязнения (табл. 1). При постановке ПЦР-РВ со специфическими для референсных генов праймерами в качестве отрицательного контроля использовали реакционную смесь без матрицы, препарат тотальной РНК, а также реакционную смесь для синтеза кДНК, прошедшую все стадии инкубации и инактивации, но без добавления фермента для обратной транскрипции. Ни в одном из вариантов отрицательного контроля не было обнаружено продуктов амплификации после 40 циклов реакции.
Таблица 1.
Спектрофотометрические показатели качества и количества РНК, выделенной из тканей ствола Pinus sylvestris L. c применением ЦТАБ-буфера (ЦТАБ) и ЦТАБ-буфера с дополнительной экстракцией ДДС (ЦТАБ/ДДС). ±SD (N = 15)
| Фракция | ЦТАБ | ЦТАБ/ДДС | ||||
|---|---|---|---|---|---|---|
| выход РНК, мкг/г сырого веса |
А260/А230 | А260/А280 | выход РНК, мкг/г сырого веса |
А260/А230 | А260/А280 | |
| Фракция “Ксилема” | 130.66 (±12.1) | 2.12 (±0.01) | 1.87 (±0.008) | 121.2 (±9.3) | 2.01 (±0.009) | 1.96 (±0.007) |
| Фракция “Флоэма” | 55.99 (±3.2) | 1.56 (±0.009) | 1.32 (±0.008) | 144.25 (±11.4) | 2.06 (±0.008) | 1.98 (±0.009) |
| Внешняя заболонь (SWext) | 3.65 (±0.09) | 1.15 (±0.02) | 1.21 (±0.08) | 9.6 (±1.2) | 1.93 (±0.009) | 1.92 (±0.008) |
| Внутренняя заболонь (SWint) | 4.59 (±0.1) | 1.35 (±0.08) | 1.25 (±0.07) | 12.35 (±0.9) | 1.97 (±0.001) | 1.95 (±0.09) |
| Транзитная зона (TZ) | 6.89 (±0.21) | 1.25 (±0.02) | 1.34 (±0.09) | 13.4 (±1.9) | 1.99 (±0.006) | 1.96 (±0.008) |
Рис. 1.
Электрофорез в 1% агарозном геле тотальной РНК, выделенной из: фракции “флоэма” (1), фракции “ксилема” (2), транзитной зоны (3), суммарной навески заболонной древесины (SW) (4), внутренней (SWint) (5) и внешней (SWext) (6) части заболони Pinus sylvestris L., с применением экстракционного ЦТАБ-буфера и дополнительной экстракцией ДДС-буфером.
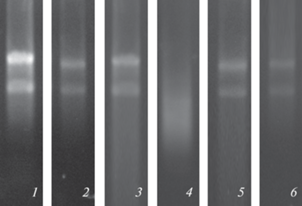
Таким образом, применение метода выделения РНК при помощи экстракционного буфера на основе ЦТАБ с дополнительной экстракцией ДДС-буфером позволило получить пригодные для дальнейшего ПЦР анализа препараты тотальной РНК.
Заболонная древесина и транзитная зона
Выделение РНК из SW и TZ было также более успешным, если в протоколе применялся фенол, а также использовалась дополнительная экстракция ДДС-буфером. В данном случае увеличивался выход РНК и наблюдались более высокие значения соотношений А260/A280, А260/A230, свидетельствующих о чистоте полученного препарата (табл. 1). Было также показано, что в TZ древесины, по сравнению с SW, выше общий выход РНК. Электрофореграммы РНК, полученной из TZ, показывали четкое разделение полос субъединиц рРНК (рис. 1, 3).
Анализ спектров поглощения РНК показал сдвиг максимума поглощения на 270 нм в препаратах, полученных из общей навески SW (Дополнительные материалы, рис. 1а), что, вероятно, свидетельствует о загрязнении и/или частичной деградации РНК в этой ткани. О деградации РНК свидетельствует также электрофорез полученного препарата в агарозном геле (рис. 1, 4). Для получения качественного препарата РНК в дальнейшем мы разделили SW на внутреннюю (SWint), среднюю и внешнюю части (SWext). Было показано, что сдвиг максимума поглощения характерен для РНК, полученной из средней части SW, поэтому она была исключена из дальнейшего исследования. РНК, полученная из SWint и SWext, имела максимум поглощения на 260 нм (Дополнительные материалы, рис. 1б, 1в), а электрофореграммы свидетельствовали о целостности препарата (рис. 1, 5, 6). Спектрофотометрические показатели качества и количества РНК, полученной из SWint и SWext, приведены в табл. 1. Использование отрицательных контролей при постановке ПЦР-РВ свидетельствовало об отсутствии контаминации и загрязнения препарата геномной ДНК.
Поиск последовательностей потенциальных референсных генов в геноме P. sylvestris и дизайн праймеров для постановки ПЦР-РВ
Глицеральдегид-3-фосфатдегидрогеназа (GAPDH)
Поиск по геному сосны обыкновенной выявил 4 гена, кодирующих белковые последовательности, гомологичные GAPDH сосны, описанным ранее. Анализ структуры белков показал, что все 4 последовательности содержат домены, типичные для глицеральдегид-3-фосфатдегидрогеназ. Сравнительный эволюционный анализ показал, что 1 потенциальный GAPDH ген сосны обыкновенной (PSY00009485) входит в кладу, образованную цитоплазматическими глицеральдегид-3-фосфатдегидрогеназами других видов (Дополнительные материалы, рис. 2г). Доля идентичных аминокислот в последовательностях белков PSY00009485 и цитоплазматических глицеральдегид-3-фосфатдегидрогеназ Arabidopsis thaliana составил 86.2%.
Рис. 2.
Зависимость порогового цикла (Сt), полученного в ходе ПЦР для каждого референсного гена, от логарифма концентрации ДНК матрицы (LogC). Точками обозначены средние значения пороговых циклов по трем повторам. На графике показано уравнение зависимости, коэффициент корреляции (R2) и эффективность реакции ПЦР (Е).

Факторы элонгации 1а (EF1a)
Поиск по геному сосны обыкновенной выявил 4 гена, кодирующих белковые последовательности, гомологичные факторам элонгации 1а A. thaliana. Структурный анализ белков показал, что все 4 последовательности содержат домены, характерные для факторов элонгации 1а. Сравнительный эволюционный анализ подтвердил, что выявленные последовательности сосны входят в одну кладу с факторами элонгации 1а A. thaliana (Дополнительные материалы, рис. 2б). Все 4 белка продемонстрировали сходство с факторами элонгации 1а A. thaliana (доля идентичных аминокислот в белках – 70.2–87.1%), ближайшим гомологом был белок, кодируемый геном PSY00004289.
Актин (Actin1)
Поиск по геному сосны обыкновенной выявил 6 генов, кодирующих белковые последовательности, гомологичные актинам Pinus massoniana Lamb. Структурный анализ белков показал, что все последовательности содержат домены, характерные для актинов. Сравнительный эволюционный анализ показал, что ближайшим гомологом Actin-1 P. massoniana является последовательность PSY00006852 (Дополнительные материалы, рис. 2а). Данный белок имел наиболее высокий процент идентичных аминокислот с последовательностями Actin-1 A. thaliana и P. massoniana (95.8 и 100.0% соответственно).
Тубулин (Tubulin)
Поиск по геному сосны обыкновенной выявил 10 генов, кодирующих белковые последовательности, гомологичные тубулину P. massoniana Lamb. Структурный анализ белков показал, что все последовательности содержат домены, характерные для α- и β-Tubulin. Сравнительный эволюционный анализ показал, что 8 последовательностей сосны обыкновенной кластеризуются с последовательностями генов β-Tubulin A. thaliana и P. massoniana и 2 последовательности гомологичны генам α-Tubulin (Дополнительные материалы, рис. 2в). Белок, кодируемый геном PSY00000513, имел наиболее высокий процент идентичных аминокислот с последовательностями α-Tubulin-2 A. thaliana и α-Tubulin P. massoniana (96.7 и 99.6% соответственно). Белок, кодируемый геном PSY00020389, имел наиболее высокий процент идентичных аминокислот с последовательностями β-Tubulin-8 A. thaliana и β-Tubulin P. massoniana (95.3 и 100.0% соответственно).
Полиубиквитин (UBQ)
Поиск по геному сосны обыкновенной выявил 13 генов, кодирующих белковые последовательности, гомологичные UBQ P. massoniana. Структурный анализ белков показал, что все последовательности очень близки по структуре и содержат несколько убиквитиновых повторов, наибольшее количество которых содержал белок, кодируемый геном PSY00000253.
На основе филогенетического анализа из каждого семейства были выбраны подходящие гены, и сконструированы специфичные пары праймеров для дальнейшей постановки ПЦР-РВ (Дополнительные материалы, табл. 1).
Эффективность и специфичность амплификации потенциальных референсных генов
До этапа оценки стабильности экспрессии потенциальных референсных генов, мы оценивали эффективность реакции амплификации (Е) и специфичность продуктов, полученных в ходе ПЦР-РВ. Наиболее часто используемым методом оценки эффективности ПЦР является постановка амплификации на серии последовательных десятикратных разбавлений матрицы ДНК, каждое из которых анализируется в трех повторах. Эффективность амплификации для потенциальных референсных генов, рассчитанная на основе серии последовательных десятикратных разведений в диапазоне концентраций от 0.5 до 500 нг ДНК на реакцию, составила 2.05–2.11 (105–111%), т.е. составила >100% для всех исследуемых генов (рис. 2). Использование такого метода расчета эффективности ПЦР дает только одно для всех используемых концентраций ДНК значение эффективности. Очевидно, что данный метод оценки эффективности является упрощенным подходом, поскольку значение Е значительно варьирует при изменении концентрации ДНК, используемой в реакции. В связи с этим, нашим следующим этапом было индивидуальное измерение эффективности с использованием кинетики реакции одного образца на основе необработанных данных флуоресценции амплификации при помощи программного обеспечения LinRegPCR (Ramakers et al., 2003). Средние по трем повторам значения эффективности ПЦР для каждой точки разведения представлены в табл. 2. Показано, что при использовании высоких концентраций ДНК матрицы эффективность ПЦР показывает низкие значения, что, вероятно, связано с влиянием ингибиторов ПЦР и ослаблением их эффекта по мере разбавления образца. Использование значений Ct, полученных при использовании в ПЦР высоких концентраций кДНК, сильно искажает наклон стандартной кривой и приводит к искажению рассчитанных по методу стандартных разведений значений эффективности. Таким образом, использование данного метода возможно только в более узком диапазоне концентраций при исключении точек, соответствующих высоким концентрациям кДНК.
Таблица 2.
Эффективность амплификации потенциальных референсных генов при использовании различных концентраций кДНК. Указаны средние по трем повторам значения эффективности ± SD
| Ген | Количество кДНК (нг/реакцию) | |||
|---|---|---|---|---|
| 500 | 50 | 5 | 0.5 | |
| Actin1 | 1.94 ± 0.005 | 1.98 ± 0.006 | 1.99 ± 0.005 | 1.98 ± 0.005 |
| α-Tubulin | 1.92 ± 0.007 | 1.97 ± 0.003 | 1.99 ± 0.004 | 1.98 ± 0.005 |
| β-Tubulin | 1.92 ± 0.006 | 1.98 ± 0.003 | 1.99 ± 0.005 | 1.98 ± 0.005 |
| Ef1a | 1.93 ± 0.005 | 1.99 ± 0 | 1.99 ± 0.004 | 1.98 ± 0.003 |
| GAPDH | 1.95 ± 0.003 | 1.99 ± 0 | 1.99 ± 0.0008 | 1.98 ± 0.003 |
| UBQ | 1.9 ± 0.007 | 1.92 ± 0.004 | 1.99 ± 0.003 | 1.98 ± 0.004 |
Постановка ПЦР с последовательными разведениями ДНК (серия двукратных разведений) в более узком диапазоне концентраций (1–100 нг ДНК на реакцию, диапазон концентраций ДНК, рекомендуемый протоколом производителя) показывает более успешные результаты: эффективность амплификации при такой постановке реакции составила от 1.98 до 2.0. В дальнейшем для расчета относительной экспрессии мы использовали средние на ампликон значения эффективности, рассчитанной индивидуально в каждой реакции при помощи программы LinRegPCR.
Оценку специфичности амплификации потенциальных референсных генов проводили при помощи анализа кривых плавления продуктов ПЦР и гель-электрофореза в 8% акриламидном геле.
По кривым плавления продуктов ПЦР с каждой парой праймеров мы выявили, что в случае использования праймеров UBQ в ходе ПЦР амплифицируются неспецифичные продукты реакции, на основании чего данный ген был исключен из дальнейшего анализа. В случае генов Actin1, α-Tubulin, β-Tubulin, Ef1a, GapDH был выявлен один пик плавления и не обнаружено неспецифических продуктов реакции (рис. 3). В ходе оценки специфичности ПЦР при помощи гель-электрофореза в 8% акриламидном геле для выбранных генов были обнаружены ампликоны ожидаемой длины и показано отсутствие димеров праймеров.
Оценка стабильности экспрессии потенциальных референсных генов
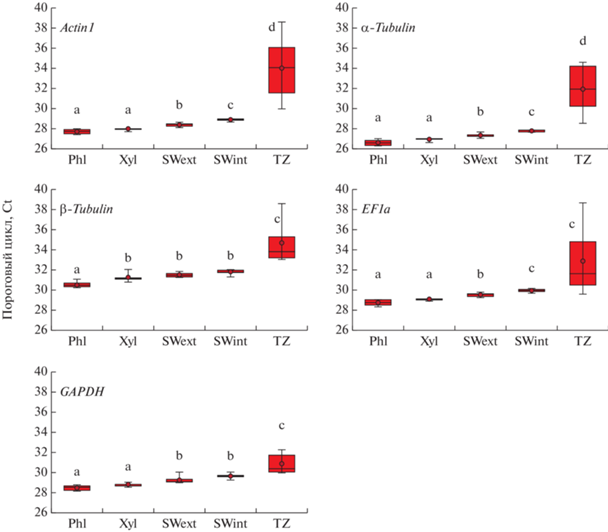
Полученные для потенциальных референсных генов средние значения пороговых циклов (Ct) находились в диапазоне от 26 до 34 циклов. Максимальные значения экспрессии для всех потенциальных референсных генов показаны для флоэмы, минимальные – для транзитной зоны. В целом, наиболее высокая экспрессия (минимальные средние значения Ct) была показана для гена α‑Tubulin, хуже всего экспрессировался ген β-Tubulin (рис. 4).
Рис. 4.
Экспрессия потенциальных референсных генов (выраженная в виде значений Сt). Линия в прямоугольниках – медиана. Точка – средние значения по 6 биологическим повторностям. Прямоугольниками показаны 25-й и 75-й перцентили. Бары – максимальные и минимальные значения. Буквами указаны значимые различия между исследуемыми образцами.
Анализ пригодности потенциальных референсных генов с помощью программы BestKeeper основан на оценке средних значений Ct и значений стандартного отклонения (SD). Гены, имеющие значения SD > 1, исключаются из дальнейшего анализа. Ранжирование генов, в данном случае происходит в соответствии с коэффициентом корреляции Пирсона (r). Референсный ген с высокой стабильностью экспрессии имеет близкие к 1 значения r.
В нашем исследовании мы проводили анализ стабильности экспрессии референсных генов в пределах одной ткани и на общем массиве данных, полученных на всех исследуемых тканях. Для анализа были взяты ткани: фракция “флоэма”, фракция “ксилема”, внешняя заболонь (SWext), внутренняя заболонь (SWint), транзитная зона (TZ). Средние значения Ct для референсных генов в каждой ткани были получены на разновозрастных растениях P. sylvestris (30 лет, 70–80 лет, 180 лет). В результате анализа BestKeeper было показано, что коэффициент корреляции Пирсона для различных генов и тканей варьировал от 0.69 до 1.0. Было выявлено, что в “ксилеме”, “флоэме” и SW все референсные гены имеют SD < 1 (табл. 3). Отличительной особенностью транзитной зоны было то, что в данной ткани в значительной степени увеличивались значения SD для генов Actin1, α-Tubulin, β-Tubulin, EF1a (диапазон значений от 1.62 до 2.85). При расчете показателей стабильности экспрессии на общий массив данных (для всех исследуемых тканей) также было показано, что для вышеперечисленных генов значения SD > 1 (табл. 3), что делает их непригодными для нормализации данных ПЦР. Таким образом, было показано, что единственным геном, который может использоваться в нормализации данных ПЦР является GAPDH (значения SD для него составили 0.87 для TZ и 0.77 для общего массива данных по всем тканям, коэффициент корреляции Пирсона в обоих случаях составил 0.97).
Таблица 3.
Показатели стабильности экспрессии потенциальных референсных генов, рассчитанные с помощью программы BestKeeper (Pfaffl, 2004)
| Actin1 | α-Tubulin | β-Tubulin | EF1a | GAPDH | ||
|---|---|---|---|---|---|---|
| Phl | Pearson correlation coefficient (r) | 0.99 | 1.0 | 0.91 | 0.96 | 0.95 |
| p-value | 0.001 | 0.001 | 0.011 | 0.002 | 0.004 | |
| Standard deviation (SD) | 0.23 | 0.27 | 0.26 | 0.29 | 0.22 | |
| Xyl | Pearson correlation coefficient (r) | 0.96 | 0.88 | 0.95 | 0.97 | 0.98 |
| p-value | 0.003 | 0.021 | 0.003 | 0.001 | 0.001 | |
| Standard deviation (SD) | 0.08 | 0.10 | 0.27 | 0.05 | 0.12 | |
| SWext | Pearson correlation coefficient (r) | 0.96 | 0.99 | 0.98 | 0.96 | 0.98 |
| p-value | 0.002 | 0.001 | 0.001 | 0.002 | 0.001 | |
| Standard deviation (SD) | 0.16 | 0.15 | 0.19 | 0.18 | 0.26 | |
| SWint | Pearson correlation coefficient (r) | 0.69 | 0.74 | 0.91 | 0.90 | 0.96 |
| p-value | 0.130 | 0.093 | 0.011 | 0.014 | 0.002 | |
| Standard deviation (SD) | 0.16 | 0.09 | 0.18 | 0.30 | 0.21 | |
| TZ | Pearson correlation coefficient (r) | 0.75 | 0.84 | 0.85 | 0.95 | 0.97 |
| p-value | 0.083 | 0.037 | 0.034 | 0.004 | 0.002 | |
| Standard deviation (SD) | 2.80 | 2.17 | 1.62 | 2.85 | 0.87 | |
| Все ткани | Pearson correlation coefficient (r) | 0.94 | 0.96 | 0.95 | 0.95 | 0.97 |
| p-value | 0.001 | 0.001 | 0.001 | 0.001 | 0.001 | |
| Standard deviation (SD) | 1.85 | 1.52 | 1.12 | 1.19 | 0.77 |
Другая программа NormFinder оценивает стабильность экспрессии на основе статистической и математической модели, которая рассчитывает общую вариацию экспрессии генов кандидатов для идентификации оптимального гена нормализации (Chi et al., 2012). Данная программа на основе их меж- и внутригрупповой вариации рассчитывает значение стабильности (stability value), на основании которого ранжирует исследуемые гены. Наиболее стабильно экспрессирующийся ген имеет минимальное значение показателя стабильности. В нашем исследовании мы проанализировали стабильность экспрессии потенциальных референсных генов у деревьев P. sylvestris L. трех возрастных групп (30 лет, 70–80 лет, 180 лет). Каждая группа включала в себя образцы фракции “ксилемы”, “флоэмы”, SWint, SWext, TZ. На основании оценки NormFinder ген GAPDH имел самый низкий коэффициент стабильности и был определен как наиболее стабильно экспрессирующийся (рис. 5). Таким образом, на основании данных, полученных при помощи двух пакетов программ, нами сделан вывод о том, что наилучшим геном для нормализации данных ПЦР в исследуемых тканях (фракция “ксилема”, фракция “флоэма”, SWint, SWext, TZ) P. sylvestris является ген GAPDH.
Нормализация данных количественной ПЦР с использованием гена GAPDH
В тканях ствола расчет относительного уровня экспрессии с использованием референсного гена GAPDH проводили для генов PXY и PAL.
Ген PXY является участником TDIF/CLE41-TDR/PXY – сигнального пути, регулирующего деление сосудистых клеток, организацию сосудов и дифференцировку ксилемы. Из данных литературы известно, что максимум экспрессии гена PXY у древесных растений в период активного камбиального роста приходится на ксилемную сторону камбиальной зоны. В нашем исследовании было показано значимое преобладание уровня экспрессии PXY в “ксилеме”, по сравнению с “флоэмой” при использовании в качестве нормализатора для расчета относительной экспрессии гена GAPDH (рис. 6а).
Рис. 6.
Расчет относительной экспрессии рецептор-подобной киназы TDR (PXY) в тканях ствола разновозрастных деревьев Pinus sylvestris (заповедник “Кивач”) (а) и фенилаланинаммиаклиазы (PAL) во внутренней заболони и транзитной зоне 70–80-летних деревьев (б) (1 – Калевала, 2 – заповедник “Пасвик”) c использованием в качестве референсного гена GAPDH. Phl – фракция “флоэма”, Xyl – фракция “ксилема”, SWint – внутренняя заболонь, TZ – транзитная зона. Бары – стандартное отклонение, рассчитанное на основании пяти биологических повторностей. Буквами указаны значимые различия между исследуемыми образцами.
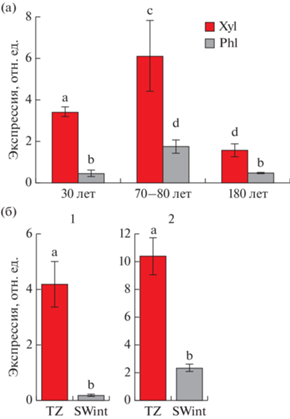
Из данных литературы известно, что транзитная зона характеризуется активной транскрипцией генов, кодирующих ферменты синтеза вторичных метаболитов (Lim et al., 2016). Ген PAL кодирует фенилаланинаммиаклиазу – ключевой фермент биосинтеза вторичных метаболитов. При расчете относительной экспрессии гена PAL с использованием в качестве референсного гена GAPDH было показано почти десятикратное ее увеличение в транзитной зоне по сравнению с SWint (рис. 6б).
ОБСУЖДЕНИЕ
Высококачественная очищенная РНК имеет решающее значение для получения точных, воспроизводимых результатов в ходе проведения количественной ПЦР-РВ. Поэтому при проведении процедуры экстракции тотальной РНК необходимо позаботиться о предотвращении деградации препарата РНКазами и удалении загрязняющих веществ. Выделение и очистка тотальной РНК из тканей ствола Pinus sylvestris сопряжена с рядом трудностей, в частности, высокое содержание вторичных метаболитов в этих тканях затрудняет экстракцию нуклеиновых кислот и требует дополнительного этапа очистки от возможных примесей.
Преобладающее число используемых для экстракции РНК протоколов предполагают использование в качестве одного из компонентов системы изоляции РНК соли гуанидина (Lal et al., 2001), которые являются сильным белковым денатурантом и ингибитором РНКаз. Однако во многих источниках литературы имеются сведения о том, что применение экстракционных смесей на основе солей гуанидина не эффективно при работе с тканями, богатыми вторичными метаболитами (Ghawana et al., 2007). К тому же, использование гуанидина может способствовать образованию сложного комплекса, который будет еще больше ингибировать выделение РНК (Ghawana et al., 2007). В связи с этим, в нашем исследовании мы использовали для выделения тотальной РНК экстракционную смесь на основе ЦТАБ-буфера. Стандартный протокол выделения с применением ЦТАБ-буфера оказался успешным только в случае получения препарата РНК из “ксилемы”, экстракция из “флоэмы” оказалась весьма затруднительной (наблюдался низкий выход РНК, спектрофотометрические показатели свидетельствовали о загрязнении препарата). В ранее проведенной работе (Lim et al., 2016) для экстракции РНК авторы также использовали протокол выделения с использованием ЦТАБ-буфера (Chang et al., 1993), однако при использовании данного метода для большинства тканей были показаны низкие значения соотношений А260/A280 и A260/A230. Образцы тканей ствола P. sylvestris для экстракции отбирали в период активного камбиального роста (июнь). Ранее на растениях сосны обыкновенной было показано, что в июне во флоэмной части камбия, по сравнению с ксилемной, почти в 2 раза выше содержание органических кислот и фенольных соединений (Antonova, Stasova, 1997). Известно, что фенолы легко окисляются и необратимо связываются с нуклеиновыми кислотами, затрудняя их экстракцию (Chen et al., 2003). Также причиной, снижающей эффективность экстракции РНК из “флоэмы”, может является загрязнение полисахаридами, затрудняющее осаждение РНК и искажающее спектрофотометрические характеристики (Chan et al., 2007). Применение в протоколе экстракции РНК осаждения LiCl, добавление фенола и дополнительная экстракция ДДС-буфером позволила увеличить выход тотальной РНК при экстракции из “флоэмы” и добиться получения чистого препарата, пригодного для дальнейшего его использования в молекулярно-генетических исследованиях. Такой вариант протокола выделения РНК оказался также более успешным при экстракции из TZ, SWint, SWext P. sylvestris. Особенностью данных тканей, помимо содержания большого количества вторичных метаболитов является низкое содержание нуклеиновых кислот и возможная частичная деградация РНК. Высокие концентрации хлорида лития позволяют избирательно осаждать РНК отдельно от ДНК, а также осаждают только продукты транскрипции большой длины, что, вероятно, является плюсом при работе с частично деградированными препаратами РНК.
Следующим важным шагом к получению точных воспроизводимых данных количественной ПЦР является выбор оптимального метода нормализации данных. Наиболее часто используемым методом нормализации данных при проведении ПЦР является использование в качестве нормализатора одного или нескольких референсных генов. Выбор подходящего референсного гена при работе с тканями ствола хвойных пород древесных растений затруднен сильным изменением строения, состава и функций изучаемых тканей по мере продвижения от периферии ствола (непроводящая и проводящая флоэма, камбиальная зона) к формирующейся ядровой древесине. Ранее оценка стабильности экспрессии различных референсных генов была проведена в корнях, молодых стеблях, хвое и шишках Pinus massoniana, показано, что наиболее стабильными генами в данных тканях являются ACT (Chen et al., 2016; Mo et al., 2019) и upLOC (Mo et al., 2019). Исследуемый ген PGK1 стабильно экспрессировался только в молодых стеблях (Mo et al., 2019). На растениях взрослых деревьев Pinus sylvestris L. для исследования экспрессии генов в тканях ствола в качестве генов-нормализаторов использовали гены, кодирующие актин и гистон (Lim et al., 2016), при этом исследований стабильности экспрессии потенциальных референсных генов в этих тканях ранее не проводилось. В нашем исследовании мы выбрали в качестве потенциальных референсных генов актин (Actin1), тубулин (α-,β-Tubulin) (относящиеся к группе структурных генов), глицеральдегид-3-фосфат дегидрогеназа (GAPDH), убиквитин (UBQ) (гены регуляции метаболизма) и Ef1a (ген, участвующий в трансляции) (Han et al., 2012; Niu et al., 2015). Для вышеперечисленных генов была проведена работа по оценке специфичности и эффективности амплификации. Было показано, что при работе с изучаемыми тканями постановка ПЦР c высокой концентрацией кДНК приводит к получению завышенных значений эффективности ПЦР, рассчитанной по методу стандартных разведений (рис. 2). Расчетная величина эффективности реакции более 100% может наблюдаться при наличии в смеси ПЦР различных ингибиторов (Svec et al., 2015). Таким образом, даже получение целостного препарата РНК с требуемыми значениями спектрофотометрических показателей, не исключают возможность наличия различных примесей в смеси ПЦР, искажающих результаты анализа. Использование метода расчета эффективности ПЦР индивидуально в каждой реакции (Ramakers et al., 2003) и соблюдение рекомендуемых соотношений концентрации кДНК и других компонентов смеси позволяет получать достоверные, воспроизводимые данные при помощи ПЦР-РВ.
Оценка стабильности потенциальных референсных генов показала сходные результаты при использовании двух пакетов программ – BestKeeper и NormFinder. При анализе BestKeeper в “ксилеме” и “флоэме” все изученные гены имели SD < 1, что говорит об их стабильной экспрессии в этих тканях. В ходе исследования было показано, что по мере продвижения к центру ствола, стабильность экспрессии большинства изученных референсных генов снижается: в SWint гены Actin1, α-Tubulin, β-Tubulin, Ef1a имели низкие значения r (от 0.69 до 0.91) (табл. 3), а в TZ анализ BestKeeper оценил ген GAPDH (SD = 0.87, r = 0.97) как единственный стабильно экспрессирующийся ген. Расчет относительной экспрессии целевых генов – PXY и PAL в тканях ствола разновозрастных деревьев P. sylvestris с применением в качестве нормализатора гена GAPDH показал значимые различия между тканями ствола в уровнях относительной экспрессии (рис. 6).

