ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, Том 55, № 1, с. 100-110
УДК 547.944/945 + 547.94 + 547.235
ПИРИДИН-АЗЕПИНОВАЯ СТРУКТУРНАЯ
МОДИФИКАЦИЯ АЛКАЛОИДА
3,4-ДИГИДРО-НОР-изо-ГАРМИНА
© 2019 г. А. А. Зубенкоa, А. С. Морковникb, *, Л. Н. Диваеваb, В. Г. Карцевc,
А. А. Анисимовd, К. Ю. Супоницкийe
a ГНУ Северо-Кавказский зональный научно-исследовательский ветеринарный институт (ГНУ СКЗНИВИ
Россельхозакадемии), 346421, Россия, Ростовская обл., г. Новочеркасск, ул. Ростовское ш. 0
b НИИ Физической и органической химии Южного федерального университета,
344090, Россия, г. Ростов-на-Дону, пр. Стачки 194/2
*e-mail: asmork2@ipoc.rsu.ru
c Акционерное общество “ИНТЕР-БИО-СКРИН”,
142432, Россия, Московская область, г. Черноголовка, , Институтский просп. 7
d ФГБОУ ВО «Российский химико-технологический университет имени Д. И. Менделеева,
125047, Россия, г. Москва, Миусская пл. 9
e ФГБУН Институт элементоорганических соединений им. А.Н. Несмеянова РАН (ИНЭОС РАН),
119334, Россия, г. Москва, ул. Вавилова 28
Поступила в редакцию 20 июня 2018 г.
После доработки 9 июля 2018 г.
Принята к публикации 24 июля 2018 г.
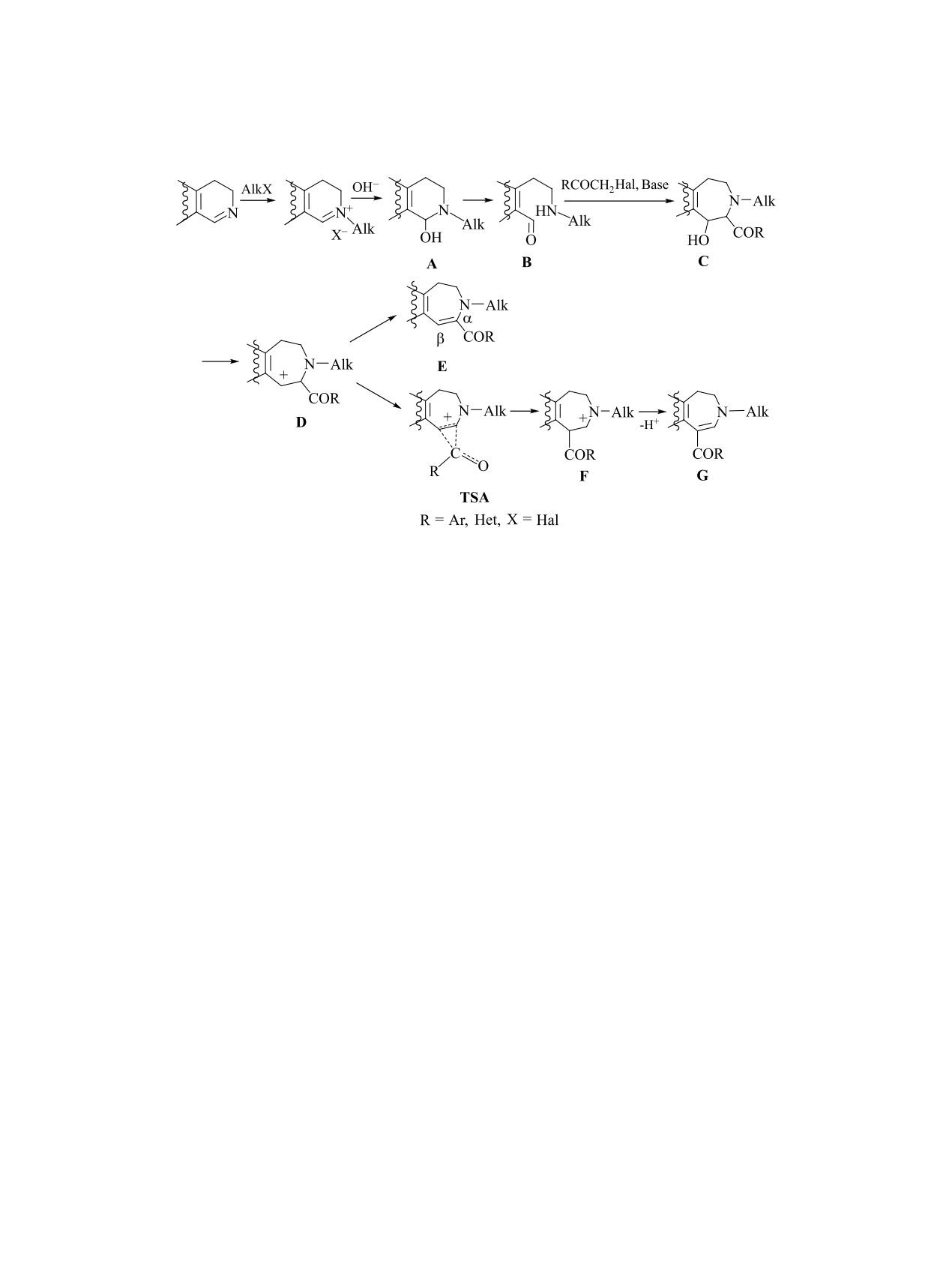
С использованием двухстадийной реакции, включающей индуцируемую ацилметилгалогенидами пири-
дин-азепиновую рециклизацию кватернизованной формы исходного субстрата, проведена структурная
модификация 3,4-дигидро-нор-изо-гармина с заменой гидрированного пиридинового цикла на дигидроа-
зепиновый. Показано, что процесс рециклизации может сопровождаться 1,2-ацильной перегруппировкой,
что приводит к образованию наряду с обычными продуктами реакции, 4-ацил-3-метил-9-метокси-1,2-ди-
гидроазепино[4,5-b]индолами, их 5-ацилсодержащих изомеров. Проанализированы факторы, влияющие
на направление рециклизации и соотношение изомеров.
Ключевые слова: 3,4-дигидро-нор-изо-гармин, рециклизация, 1,2-ацильная перегруппировка,
4(5)-ацил-3-метил-9-метокси-1,2-дигидроазепино[4,5-b]индолы.
DOI: 10.1134/S0514749219010087
Структурная модификация природных соеди-
дные с активированной метиленовой группой, из
нений представляет собой весьма перспективную
которых наиболее изучены ацилметилгалогениды,
область органической химии, прежде всего в пла-
RCOCH2Hal [2-8]. Они, однако, обладают особой
реакционной способностью, так как могут индуци-
не нахождения новых фармакологически активных
ровать не только обычный RE-вариант реакции, но
веществ и создания на их основе современных ле-
и более сложную (RE + AR)-рециклизацию с допол-
карственных препаратов [1]. Применительно к
нительной стадией скелетной перегруппировки, об-
алкалоидам с аннелированным 2,3-дигидропири-
условленной 1,2-C→C-миграцией ацильной груп-
диновым циклом и их производным интересным
пы (RE - ring expansion, AR - acyl rearrangement).
ее вариантом является замена этого цикла на ди-
Первая из реакций приводит к образованию α-ацил-
гидроазепиновый, которая может быть осущест-
производных конденсированных дигидроазепинов
влена путем пиридин-азепиновой рециклизации
E, а вторая - к их β-ацилизомерам G, причем, обе
четвертичных солей исходных субстратов.
рециклизации могут протекать и как самостоятель-
Эффективными реагентами для такой рецикли-
ные, и как конкурирующие реакции, дающие смеси
зации могут служить галогенметильные произво-
продуктов E и G (схема 1).
100
ПИРИДИН-АЗЕПИНОВАЯ СТРУКТУРНАЯ МОДИФИКАЦИЯ АЛКАЛОИДА
101
Схема 1.
Более общим путем рециклизации является
посредством внутрикарбокатионной 1,2-миграции
RE-реакция. Для одной группы субстратов, таких,
ацильной группы, их изомеры G.
как 9-бромкотарнин [2, 3] и перхлорат 8,9,11,12-те-
Весомым аргументом в пользу такого механиз-
траметокси-3,4-дигидронафто[2,1-f]изохиноли-
ма сопутствующей ацильной перегруппировки
ния [4, 5], она представляет собой единственный
могут служить данные предварительных кванто-
вариант превращения, а для другой, включающей
вохимических исследований, проведенных для
котарнин [6-8] и иодид 3,4-дигидро-β-карболи-
рециклизации котарнина [8]. Они показывают,
ния [9], реализуется наряду с альтернативным
что изомерные карбокатионы типа D и F действи-
(RE+AR)-вариантом. При двухвариантной ре-
тельно являются энергетическими минимумами
циклизации ее направление в каждом конкрет-
на поверхностях потенциальной энергии и в этом
ном случае контролируется реагентом, точнее,
отношении отличаются от некоторых аналогич-
электронными эффектами его заместителя R. Ха-
ных по структуре, но более простых ацилсодер-
рактер этого электронного контроля таков, что
жащих карбокатионов, которые из-за склонности
электроноакцепторные заместители R блокируют
к безбарьерному отщеплению ацильных карбо-
сопутствующую перегруппировку и ориентируют
катионов, такого рода минимумами не являются
реакцию в RE-направлении, а электронодонорные,
[8]. Движущей силой ацильной перегруппировки,
оказывающие противоположное влияниие, пере-
служит значительно большая термодинамическая
ключают реакцию, частично, либо полностью в
стабильность перегруппированных карбокатио-
(RE+AR)-режим.
нов F по сравнению с неперегруппированными
Начальный этап реакции в обоих случаях
изомерами D. Из этих данных также следует, что
одинаков и представляет собой своеобразный
для котарнина переходное состояние (ПС) TS вну-
ANRORC-процесс, приводящий к образованию
трикарбокатионной ацилотропии является весьма
псевдоосновных карбинолов C, и далее, в качестве
низкобарьерным. В целом же основанный на этих
продуктов их гетеролиза и ключевых интермеди-
результатах квантовохимический прогноз для
атов, карбокатионов D. Они-то и создают потен-
ацильной перегруппировки рассматриваемых азе-
циал двухвариантности, поскольку могут образо-
пиновых систем состоит в том, что уже на уровне
вывать как обычные ацилпроизводные E, так и,
ее элементарного ацилотропного акта данная пе-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 1 2019
102
ЗУБЕНКО и др.
Таблица
1.
Характеристики пиридин-азепиновой
факторов, определяющих направление пиридин-
рециклизации соли 2
азепиновых рециклизаций, идущих с участием
ацилметилгалогенидов.
Среда
Реагент
Продукты
Выход, %
реакции
Активацию алкалоида 1 по отношению к пи-
ридин-азепиновой рециклизации проводили по-
3аa
Водн. этанол
4a + 5a (4 : 1)
80
3а
CHCl3
4a
66
средством его кватернизации иодистым метилом,
3bб
Водн. этанол
4b + 5b (1 : 1)
77
которая протекала с практически количественным
образованием соответствующей четвертичной
3b
CHCl3
4b
66
соли 2 [10]. Далее ее вводили в реакцию с ацилме-
3c
Водн. этанол
4c
68
тилгалогенидами 3a-3i (R = Ar, Hetaryl). Процесс
3d
Водн. этанол
4d
95
3e
Водн. этанол
4e
95
проводили в типичных для рассматриваемых ре-
циклизаций условиях, а именно, при кипячении
3f
Водн. этанол
4f + 5f (2 : 3)
74
раствора эквимольных количеств субстрата и ре-
3g
Водн. этанол
5g
42
агента в водном спирте (1 : 3 v/v) в присутствии
3h
Водн. этанол
5h
69
избытка NaHCO3. Как оказалось, данные условия
5i
Водн. этанол
5i
73
вполне подходят и для соли 2, которая, как и ро-
a Выходы изомеров определены после хроматографического
доначальник ряда 3,4-дигидро-β-карболиниевых
разделения смеси на колонке с окисью алюминия в хлоро-
субстратов [9], проявляет ярко выраженную двух-
форме.
вариантную реакционную способность, которая,
б Соотношения изомеров 4b и 5b, 4f и 5f определены методом
спектроскопии ЯМР 1Н по сигналам протонов Н4 и Н5.
как и в других случаях, эффективно контролиру-
ется присутствующим в реагенте заместителем R.
регруппировка при обычных условиях является
Продуктами RE- и (RE+AR)-рециклизаций явля-
весьма малообратимым процессом. Судя по полу-
ются изомерные 4- (4) и 5- (5) ацил-3-метил-9-ме-
ченным результатам, ярко выраженное влияние за-
токси-1,2-дигидроазепино[4,5-b]индолы (схема 2),
местителей R на направление двухвариантной ре-
образующиеся, с суммарными выходами в преде-
циклизации связано с прямым влиянием электрон-
лах от 65 до 95 % (табл. 1), несколько большими
ных эффектов этих заместителей на активацион-
для RE-реакции, как имеющей более простой ме-
ные барьеры элементарного ацилотропного акта,
ханизм.
т.е. внутрикарбокатионной миграции ацильной
Структура азепиноиндолов 4 и 5 подтверждена
группы. Причиной такого влияния является зна-
методами РСА и ЯМР 1H, 13С. В частности, мето-
чительно большая зарядовая поляризация ПС TS
дом РСА были исследованы простейшие изомер-
по сравнению с исходными карбокатионами типа
ные продукты, бензоилпроизводные 4a и 5a (см.
D, обусловленная перетоком электронной плотно-
рисунок).
сти с мигрирующей ацильной группы на осталь-
Анализ полученных данных показывает, что
ную часть карбокатиона. Это находит свое под-
дигидроазепиновый цикл в обоих изомерах силь-
тверждение и в обсуждаемой далее зависимости
но неплоский, причем, по одной и той же при-
расчетных активационных барьеров ацилотроп-
чине - из-за значительного вывода атома С6 из
ной изомеризации карбокатионных интермедиатов
общей плоскости остальных атомов цикла. В со-
от природы заместителя R для кватернизованной
единении 5a оба атома азота тригонально-гибри-
формы субстрата, рассматриваемого в настоящей
дизованы, тогда как в его изомере 4a такую гибри-
работе.
дизацию имеет лишь атом N2. Явная и, очевидно,
Целью данной работы явилось исследование
достаточно прочная внутримолекулярная Н-связь
пиридин-азепиновой структурной модификации
присутствует только в соединении 5a. Она обра-
3,4-дигидронор-изо-гармина (1), как возможного
зована между иминной и карбонильной группа-
пути к новым производным малоизученной
ми [N2-H, 0.92(2) Å; N2…O2, 2.658(2) Å; H…O2,
1,2-дигидроазепино[4,5-b]индольной системы [8],
2.03(2) Å, < NHO, 124.4(12)°] и эффективно “втя-
а также как объекта для дополнительного анализа
гивает” бензоильную группу в плоскость π-систе-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 1 2019
ПИРИДИН-АЗЕПИНОВАЯ СТРУКТУРНАЯ МОДИФИКАЦИЯ АЛКАЛОИДА
103
Схема 1.
R = Ph (a), 4-i-PrC6H4(b), 4-FC6H4 (c), 4-BrC6H4 (d), 3-NO2C6H4 (e), 3,4-(MeO)2C6H3 (f), 1H-индол-3-ил (g),
1,2-Me2-1H-индол-3-ил (h), 1,2-Me2-5-MeO-1H -индол-3-ил (i).
мы соединения 5a, чего не происходит в изомере
DFT [M05-2X/6-311G(df,pd)], что указывает на
4a. На различия в ориентации бензоильной груп-
внутримолекулярные взаимодействия как на ос-
пы также может, впрочем, оказывать влияние и об-
новной фактор, определяющий строение двух мо-
разование центросимметричных Н-связанных ди-
лекул в кристаллах. Из этих данных также следует,
меров в кристалле соединения 4a [N2-H2…O2 (-x,
что каждый из изомеров имеет по одной критиче-
-y, 1-z); N-H, 0.91(2) Å; N…O, 2.853(2) Å; H…O,
ской точке связи (КТС), образованной за счет не-
1.98(2) Å; NHO, 159.7(14)°], в то время как в кри-
ковалентного связывания. Эти КТС соответствуют
сталле соединения 5a сильные межмолекулярные
вышеуказанной H-связи соединения 5a (ее расчет-
взаимодействия отсутствуют.
ная энергия 7.7 ккал/моль) и довольно-таки нео-
Экспериментальные конформации обоих изо-
жиданной связи водородного типа в структуре 4a
меров близки к расчетным, полученным методом
между атомами N1 и H17. Последняя связь имеет
(б)
(a)
C13
C13
C5
C6
C1
C2
C14
O1
C3 C4
O1
C5 C6
N1
C1
C2
C14
C3
C4
C12
C7
N1
C10
C9
С17
С18
C11
N2
C8
C12
C15
С17
С19
C10
C9
C
7
C15
C11
С16
С18
C8
С16
N2
O2
С20
С21
С21
19
С
O2
С20
Молекулярная структура изомерных ацилазепиноиндолов 4a (a) и 5a (б) в представлении атомов эллипсоидами с 50% ве-
роятностью.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 1 2019
104
ЗУБЕНКО и др.
довольно-таки существенную энергию, около 3.0
Последняя протекает одновременно по двум на-
ккал/моль, хотя, на первый взгляд, должна быть
правлениям, так, что образуется смесь изомеров
весьма невыгодной из-за большого межъядерного
4a и 5a с примерным составом 4 : 1, которая была
расстояния N…H (2.542 Å) и сильно нелинейного
разделена с помощью колоночной хроматографии.
угла C17-H17-N1 (108.7°). Собственно ее наличие
При переходе к 3-нитрофенацилбромиду (3e) ин-
и обеспечивает перегибридизацию атома N1 в мо-
дуктивное влияние мета-нитрофенильного заме-
лекуле 4a с потерей тригонального состояния.
стителя снова переключает реакцию в режим чи-
стой RE-рециклизации.
При определении строения остальных ацилазе-
пиноиндолов 4 и 5 ключевую роль сыграли данные
Эти результаты согласуются с данными кван-
метода ЯМР, который в данном случае ценен тем,
товохимического расчета газофазных свободных
что позволяет достаточно легко и надежно опре-
энергий активации внутрикарбокатионной аци-
делять принадлежность продуктов рециклизации
лотропии для четырех рассмотренных выше систем
к тому или иному изомерному ряду благодаря при-
2-3a, 3c-3e. Из них следует, что именно незаме-
щенная бензоильная группа проявляет наиболь-
сущей α- и β-ацилдигидроазепинам E и G значи-
шую миграционную способность в карбокатионах
тельной разнице в химических сдвигах двух ядер
типа D. Для указанных реакций величины ΔG≠calc
циклической =CH-группы азепинового цикла [8].
составляют: 2.0 (3a), 3.3 (3c), 3.9 (3d) и 4.8 (3e) ккал/
Наблюдающийся в описываемой рециклиза-
моль. Это подтверждает вывод о том, что влияние
ции электронный контроль механизма и направ-
заместителей R на направление рециклизации свя-
ления реакции со стороны заместителей R носит
зано именно с облегчением ацилотропного процес-
вполне закономерный характер, хотя для 4-фтор- и
са, а не является результатом влияния на легкость
4-бром- и 3,4-диметоксифенильной групп ацил-
депротонирования карбокатионов типа D.
метилгалогенидов 3с, 3d, 3f ситуация, на первый
Аналогичным образом важнейшим фактором
взгляд, и кажется несколько нелогичной. Так, для
индуктивное влияние оказывается и при рецикли-
4-галогенфенильных групп в силу значительной
зации соли 2 3,4-диметоксифенацилбромидом (3f),
удаленности атомов галогена от реакционного
где благодаря совместному -I-эффекту двух атомов
центра ацилотропии логично было бы ожидать
кислорода метоксигрупп имеет место неполное
значительного затухания влияния
-I-эффекта,
блокирование RE-пути энергичным +M-эффектом
тем более, что он ослабляется противоположно
4-метоксигруппы. В результате и в этом случае в ре-
направленным +M-эффектом указанных атомов.
акции образуется смесь изомеров, но уже с преоб-
И, тем не менее, в плане влияния на направление
ладанием перегруппированного продукта (по дан-
реакции явно доминирует именно индуктивный
ным ЯМР, соотношение с 4f : 5f составляет 2 : 3).
эффект 4-галогенфенильных групп, что, впрочем,
Остальные рециклизующие реагенты - 4-изо-
согласуется со сравнительными данным по кон-
пропилфенацилбромид (3b) и 3-галогенацетилин-
стантам σI для 4-фторфенильной (0.52) и фениль-
долы 3g-3i ведут себя вполне предсказуемым об-
ной групп (0.1) [11]. Столь большая разница в их
разом. Первый, благодаря слабоэлектронодонор-
константах, возможно, отчасти связана с тем, что
ным свойствам изопропилфенильной группы дает
оба типа электронных эффектов атомов галогена в
смесь азепиноиндолов 4b и 5b с несколько боль-
4-галогенфенильных группах, как можно предпо-
шим соотношением неперегруппированного и пе-
ложить, не являются взаимонезависимыми и один
регруппированного продуктов (примерно 1 : 1, по
из эффектов усиливается за счет ослабления дру-
данным ЯМР 1H), чем в случае фенацилбромида
гого. Так или иначе, из-за влияния 4-галогенфе-
3a. Остальные же реагенты 3g-3i из-за мощного
нильных групп рециклизация соли 2 4-галогенфе-
и ничем некомпенсируемого +M-эффекта 3-ин-
нацилгалогенидами 3c, 3d идет с полным блоки-
долильных групп реагируют с солью 2 исключи-
тельно посредством (RE+AR)-рециклизации (см.
рованием ее (RE + AR)-пути, что делает реакцию
табл. 1).
селективным RE-процессом. В этом отношении
она принципиально отличается от рециклизации
Важная особенность соли 2 - рекордно снижен-
субстрата незамещенным фенацилбромидом (3a).
ный порог ацильной перегруппировки, что нахо-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 1 2019
ПИРИДИН-АЗЕПИНОВАЯ СТРУКТУРНАЯ МОДИФИКАЦИЯ АЛКАЛОИДА
105
дит свое отражение в том факте, что лишь в случае
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
этой соли перегруппировка частично имеет место
и для незамещенного фенацилбромида 3a. Такое
Исходные соединения были предоставлены
поведение субстрата 2 связано с совместным про-
фирмой InterBioscreen Ltd (Россия) и использо-
мотирующим влиянием азепиноиндольного кар-
ваны без дополнительной очистки. Растворители
каса и метоксигруппы, поскольку аналогичный,
очищены по стандартным процедурам. Cпектры
но не содержащей этой группы субстрат в тех же
1H-ЯМР и 13C-ЯМР синтезированных соединений
самых условиях реагирует с бромидом 3a без пе-
зарегистрированы на спектрометре Bruker Avance
регруппировки [9].
600 (600 МГц) в DMSO-d6 при 25°С. Химические
сдвиги ядер 1H и 13C (δ, м.д.) даны относительно
Соль 2 явилась также первым объектом, на при-
остаточных сигналов дейтерорастворителя (δ =
мере которого удалось показать, что пиридин-азе-
2.49 м.д. для протонов и 39.5 м.д. для ядер углеро-
пиновую рециклизацию вполне успешно можно
да). Температуры плавления определены на при-
проводить и малополярной среде, не склонной
боре Fisher-Johns Melting Point Apparatus (Fisher
к образованию водородных связей. Основными
Scientific) (США). Элементный анализ проведен
трудностями для такой рециклизации является вы-
классическим методом микроанализа. Протекание
бор, как самой этой среды, так и основного катали-
реакций и чистоту полученных соединений кон-
затора, поскольку обычный катализатор реакции,
тролировали методом ТСХ (пластинки с Al2O3 III
NaHCO3, в данном случае малопригоден из-за его
степени активности, элюент CHCl3, проявление
практической нерастворимости в малополярных
парами иода во влажной камере).
средах. Как оказалось, эффективной комбинацией
Экспериментальные интенсивности отражений
для реакции может служить сольвентно-катали-
измеряли на дифрактометре SMART APEX2 CCD
тическая пара хлороформ / диизо-пропилэтила-
[l(MoKα] = 0.71073 Å, графитовый монохроматор,
мин (DIPEA). Дополнительным осложнением для
w-сканирование). Обработку исходных масси-
проведения реакции с солью 2, впрочем, явилась
вов измеренных интенсивностей проводили с ис-
ее низкая растворимость в хлороформе. Для того,
пользованием программного пакета APEX2 [12].
чтобы обойти это препятствие, действием водного
Структуры расшифрованы прямым методом и
поташа ее предварительно превращали в псевдоос-
уточнены полноматричным МНК в анизотропном
новную форму и именно с ней, без дополнительной
приближении для неводородных атомов по F2hkl.
очистки, далее и проводили реакцию. В качестве
Атомы водорода помещали в геометрически рас-
реагентов были использованы фенацилгалогениды
считанные положения и уточняли с использовани-
3a, 3b, преимуществами которых в данном случае
ем модели наездника, за исключением водородов
была неселективность их реакции в водно-спирто-
при атомах азота, положения которых локализо-
вой среде. Это давало возможность наиболее легко
вали из разностного синтеза электронной плотно-
определить характер возможного влияния мало-
сти и затем уточняли в изотропном приближение.
полярной среды на селективность рециклизации.
Расшифровку и уточнение структур проводили
Как оказалось, такое влияние действительно имеет
по программам OLEX и SHELXTL [13,14]. Ко-
место, причем оно проявляется через относитель-
ординаты атомов и температурные факторы де-
ное замедление (RE+AR)-пути реакции по сравне-
понированы в Кембриджской базе структурных
нию с водно-спиртовой средой. Эффект выражен в
данных (CCDC) № 1580670 и 1580671 для 4a и 5a,
такой степени, что привел к трансформации обеих
соответственно. Кристаллографические данные и
неселективных в водно-спиртовой среде реакций
параметры рентгеноструктурных экспериментов
в чистые RE-рециклизации (см. табл. 1). Таким
приведены в табл. 2.
образом, полярность среды пиридин-азепиновой
Квантовохимическая оптимизация геометрии
рециклизации является еще одним важным пара-
изомерных молекул 4a, 5a проводилась для трех-
метром, варьирование которого дает еще одну воз-
мерных координат атомов, полученных методом
можность управления селективностью двухвари-
РСА в приближении M052X/6-311G(df,pd), кото-
антных пиридин-азепиновых рециклизаций.
рое успешно использовалось для описания стро-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 1 2019
106
ЗУБЕНКО и др.
Таблица 2. Кристаллографические данные и параметры рентгеноструктурного эксперимента для соединений 2415
и 2415а
Параметр
4a
5a
Брутто-формула
C21H20N2O2
C21H20N2O2
Молекулярная масса
332.39
332.39
Цвет кристалла
светло-оранжевый
темно-желтый
Форма кристалла
призмы
призмы
Размеры кристалла, мм
0.34 × 0.28 × 0.20
0.26 × 0.18 × 0.14
T, К
120(2)
200(2)
Кристаллическая система
Моноклинная
Триклинная
Пространственная группа
P21/c
P-1
a, Å
9.4789(4)
7.2378(5)
b, Å
28.6215(11)
10.3213(7)
c, Å
6.3992(2)
11.9551(9)
α, град
90
90.628(2)
β, град
101.4010(10)
93.036(2)
g, град
90
104.3940(10)
V, Å3
1701.85(11)
863.57(11)
Z
4
2
dвыч, г см-3
1.297
1.278
Коэффициент поглощения m, мм-1
0.084
0.083
F(000)
704
352
Интервал сканирования по q, град
2.19-28.00
1.70-29.31
Число измеренных отражений
32502
17774
Число независимых отражений
4116
4703
Rint
0.0209
0.0233
Количество уточняемых параметров
232
232
Количество отражений с I ≥ 2σ(I)
3796
3807
Полнота массива отражений, %
100
99.6
GOOF
1.041
1.033
Сходимость уточнения (R1(F))a по отражениям c I ≥ 2σ(I)
0.0382
0.0424
Сходимость уточнения по всем отражениям (wR2(F2)b
0.0998
0.1189
Остаточный минимум/максимум, e/Å3
0.365/-0.197
0.320/-0.199
a R1 = å|Fo - |Fc||/å(Fo); b wR2 = (å[w(Fo2 - Fc2)2]/å[w(Fo2)2 ]1/2
ения азотсодержащих гетероциклических систем
ного комплекса Firefly 8.0 [25]. Валидация энер-
и ранее [15-17]. Полученное распределение элек-
гетических минимумов и переходных состояний
тронной плотности анализировали в рамках топо-
проводилась с помощью расчета гессианов.
логической теории “Атомы в молекулах” по про-
6-Метокси-2-метил-4,9-дигидро-3Н-пири-
грамме AIMALL [18, 19]. Энергии найденных вну-
до-[3,4-b]индол-2-ия иодид (2). Раствор 2.01 г
тримолекулярных невалентных взаимодействий
(10
ммоль)
6-метокси-4,9-дигидро-3H-пири-
оценивали по корреляции между энергией и плот-
до[3,4-b]индола (1) в 20 мл CH2Cl2 и 1.56 г
ностью потенциальной энергии в критической
(0.67 мл, 11 ммоль) CH3J кипятили 1 ч, охлажда-
точке связи (КТС) [20, 21]. Адекватность данного
ли и образовавшийся осадок отфильтровывали,
подхода была продемонстрирована ранее на при-
промывали 10 мл CH2Cl2. Для очистки соедине-
мерах различных типов взаимодействий [22-24].
ния 2 его обрабатывали ацетоном. Выход 3.3 г
Расчеты активационных энергий ΔG≠0 для вну-
(97%), т.пл. 227-230°С. Спектр ЯМР 1H, δ, м.д.:
трикарбокатионной ацилотропии выполнены ме-
2.50 c (2H, CH2, наложение на остаточные сигна-
тодом B3LYP/6-31** с использованием программ-
лы ДМСО), 3.70 c (1H, NCH3), 3.80 c (1H, OCH3),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 1 2019
ПИРИДИН-АЗЕПИНОВАЯ СТРУКТУРНАЯ МОДИФИКАЦИЯ АЛКАЛОИДА
107
4.04 т (2H, CH2, J 9.0 Гц), 7.10 д.д (1H, H8, J 9.1,
(9-Метокси-3-метил-1,2,3,6-тетрагидроазе-
2.5 Гц), 7.16 д (1H, H5, J 2.5 Гц), 7.46 д.д (1H,
пино[4,5-b]индол-4-ил)(фенил)метанон
(4a)
H7, J 9.1, 0.45 Гц), 8.94 c (1H, H1), 12.11 c (1H,
и
(9-метокси-3-метил-1,2,3,6-тетрагидроазепи-
NH). Спектр ЯМР 13С ЯМР, δ, м.д.: 18.95, 46.12,
но[4,5-b]индол-5-ил)(фенил)метанон (5a). По ме-
50.36, 55.38, 100.36, 114.53, 121.11, 121.22, 124.06,
тоду А из 6-метокси-2-метил-4,9-дигидро-3H-пи-
125.49, 137.03, 154.66,154.90. Найдено, %: С 45.26;
ридо[3,4-b]индол-2-ия иодида и
2-бром-1-фе-
Н 4.20; I 37.46; N 8.36. С13H15IN2O. Вычислено, %:
нилэтан-1-она получали смесь изомеров 4a и 5a,
которую разделяли на колонке с Al2O3 III степени
C 45.63; H 4.42; I 37.09; N 8.19.
активности в хлороформе, Rf 4a - 03, 5a - 06.
Общая методика синтеза 9-метокси-3-метил-
(9-Метокси-3-метил-1,2,3,6-тетрагидроазе-
1,2,3,6-тетрагидроазепино[4,5-b]индол-4(5)-ил)
пино[4,5-b]индол-4-ил)(фенил)метанон
(4a).
метанонов 4a-4f и 5a, 5b, 5f-5i. Метод А. Смесь
Выход 64%, красные кристаллы, т.пл. 211-213°C
1.37 г (4 ммоль) 6-метокси-2-метил-4,9-дигидро-
(EtOAc). Спектр ЯМР 1H, δ, м.д.: 2.58 с (3Н, Me),
3H-пиридо[3,4-b]индол-2-ия иодида (2), 4 ммоль
2.98-2.99 м (2Н, СН2), 3.14 т (2Н, СН2, J 4.4 Гц),
ацетилметилгалогенида
3 и
1.2 г
(14 ммоль)
3.74 с (1Н, ОСН3), 6.17 с (1Н, Н5), 6.69 д.д (1Н,
NaHCO3 в 15 мл EtOH и 5 мл H2O кипятили при
Н8, J 8.7, 2.3 Гц), 6.95 д (1Н, Н10, J 2.4 Гц), 7.12 д
перемешивании 1-3 ч, контролируя протекание
(1H, H7, J 8.6 Гц), 7.48-7.50 м (2Н, Н3',5'), 7.59 т
реакции с помощью тонкослойной хроматографии
(1Н, Н4', J 7.6 Гц), 7.77 д (2Н, Н2', 6', J 8.2 Гц),
на пластинах с окисью алюминия в хлороформе.
10.70 с (1Н, NН). Спектр ЯМР 13С, δ, м.д.: 24.70,
По окончании реакции смесь обрабатывали 30 мл
41.02, 51.00, 55.29, 99.62, 108.51, 111.32, 111.99,
воды, образовавшийся осадок отфильтровывали,
114.94,
128.29,
128.64,
129.04,
131.24,
132.17,
промывали водой
(3
×
20 мл), высушивали
132.84, 138.48, 145.13, 153.25, 193.70. Найдено, %:
и перекристаллизовывали из подходящего
С 75.49; Н 6.19; N 8.16. С21H20N2O2. Вычислено,
растворителя. В этих условиях соль 2 с 2-бром-1-
%: C 75.88; H 6.06; N 8.43.
фенилэтан-1-оном, 2-хлор-1[4-(пропан-2-ил)фенил]
этан1-оном и 2-бром-1-(3,4-диметоксифенил)этан-
В условиях метода Б получен только изомер
1-оном образует смесь изомеров 4 и 5.
4a с выходом 66%.
Общая методика синтеза
9-метокси-3-ме-
(9-Метокси-3-метил-1,2,3,6-тетрагидроазе-
тил-1,2,3,6-тетрагидроазепино[4,5-b]индол-5-
пино[4,5-b]индол-5-ил)(фенил)метанон
(5a).
ил)метанонов 4a, 4b. Метод Б. К нагретой до
Выход 16%, желтые кристаллы, т.пл. 161-163°C
35°C суспензии 1.5 г (12 ммоль) 6-метокси-2-ме-
(EtOAc : MeCN 6 : 1). Спектр ЯМР 1H, δ, м.д.:
тил-4,9-дигидро-3H-пиридо[3,4-b]индол-2-ия ио-
3.05 т (2Н, СН2, J 4.5 Гц), 3.08 с (3Н, Me), 3.54 (т,
2Н, СН2, J 4.5 Гц), 3.10 с (1Н, ОСН3), 6.59 д.д (1Н,
дида 2 в 20 мл H2O добавляли 5 мл насыщенно-
Н8, J 8.6, 2.4 Гц), 6.87 д (1Н, Н10, J 2.3 Гц), 7.18 с
го раствора K2CO3 и перемешивали 30 мин при
(1Н, Н4), 7.31 д (1H, H7, J 8.7 Гц), 7.41-7.48 м (5Н,
35°C. Образующийся осадок
6-метокси-2,9-ди-
Н2'-6'), 11.16 с (1Н, NН). Спектр ЯМР 13С, δ, м.д.:
метил-2,3,4,9-тетрагидро-1H-пиридо[3,4-b]ин-
24.79, 48.03, 53.26, 55.27, 98.49, 102.26, 108.74,
дол-1-ола отфильтровывали, промывали водой
109.78,
111.75,
127.24,
128.24,
128.27,
129.15,
и тщательно высушивали при комнатной темпе-
129.61, 132.51, 141.63, 153.13, 155.76, 194.29. Най-
ратуре. Выход 0.75 г (74%), т.пл. 191–195°C. Да-
дено, %: С 75.54; Н 5.89; N 8.24. С21H20N2O2. Вы-
лее его вводили в реакцию без дополнительной
числено, %: C 75.88; H 6.06; N 8.43.
очистки. Смесь 0.93 г (4 ммоль) 6-метокси-2,9-ди-
метил-2,3,4,9-тетрагидро-1H-пиридо[3,4-b]ин-
(4-Изопропилфенил)(9-метокси-3-ме-
дол-1-ола, 0.57 г (0.77 мл, 4.5 ммоль) ди-изо-про-
тил-1,2,3,6-тетрагидроазепино[4,5-b]индол-4-
пилэтиламин (DIPEA) и 4 ммоль ацетилметил-
ил)метанон (4b) Получен по методу Б из 6-ме-
галогенида 3a, 3b в 15 мл CHCl3 кипятили 1.5 ч,
токси-2-метил-4,9-дигидро-3H-пиридо[3,4-b]
охлаждали, добавляли 50 мл петролейного эфира,
индол-2-ия иодида и
2-хлор-1-[4-(пропан-2-ил)
образующийся осадок отфильтровывали, промы-
фенил]этан-1-она с выходом 66%. Бежевые кри-
вали петролейным эфиром и водой. Выход 4a -
сталлы, т.пл. 206-208°C. Спектр ЯМР 1H, δ, м.д.:
66%, 4b - 65%.
1.23 с (3H, CH3), 1.24 с (3H, CH3), 2.61 с (3Н,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 1 2019
108
ЗУБЕНКО и др.
N-Me), 2.97-3.02 м (3Н, CH, СН2), 3.17 т (2Н,
(4e). Получен по методу А из 6-метокси-2-ме-
СН2, J 4.4 Гц), 3.77 с (1Н, ОСН3), 6.15 с (1Н, Н5),
тил-4,9-дигидро-3H-пиридо[3,4-b]индол-2-ия
6.71 д.д (1Н, Н8, J 8.7, 2.5 Гц), 6.97 д (1Н, Н10,
иодида и
2-бром-1-[3-нитрофенил]этан-1-она.
J 2.4 Гц), 7.14 д (1H, H7, J 8.7 Гц), 7.38-7.39 м
Выход 95%, красные кристаллы, т.пл. 188-190°C
(2Н, Н3',5'), 7.74-7.76 м (2Н, Н2', 6'), 10.70 с (1Н,
(DMF:CH3CN 1 : 1). Спектр ЯМР 1H, δ, м.д.:
NН). Спектр ЯМР 13С, δ, м.д.: 23.48, 24.77, 33.43,
2.62 с (3Н, N-Me), 3.03-3.04 м (2Н, СН2), 3.17 т
41.03, 51.09, 55.30, 99.59, 107.61, 111.25, 111.79,
(2Н, СН2, J 4.5 Гц), 3.77 с (1Н, ОСН3), 6.35 с (1Н,
114.59,
126.27,
128.66,
129.41,
131.17,
132.95,
Н5), 6.74 д.д (1Н, Н8, J 8.7, 2.4 Гц), 7.00 д (1Н,
136.08, 145.29, 153.15, 153.23, 193.25. Найдено, %:
Н10, J 2.5 Гц), 7.18 д (1H, H7, J 8.7 Гц), 7.81 т (1Н,
С 76.64; Н 6.71; N 7.12. С24H26N2O2. Вычислено,
H4', J 8.1 Гц), 8.20-8.21 с (1Н, Н5'), 8.44-8.46 м
%: C 76.98; H 7.00; N 7.48.
(1Н, Н6'), 8.50-8.51 м (1H, H2'), 10.78 с (1Н, NН).
(4-Фторфенил)(9-метокси-3-метил-1,2,3,6-те-
Спектр ЯМР 13С, δ, м.д.: 24.47, 40.98, 50.70,
трагидроазепино[4,5-b]индол-4-ил)метанон
55.30, 99.72, 111.13, 111.54, 112.65, 116.11, 123.48,
(4c). Получен по методу А из 6-метокси-2-ме-
126.30, 128.55, 130.10, 131.47, 132.46, 135.20,
тил-4,9-дигидро-3H-пиридо[3,4-b]индол-2-ия
139.83, 144.17, 147.50, 153.33, 191.39. Найдено, %:
иодида и 2-бром-1-[4-фторфенил]этан-1-она 68%.
С 66.52; Н 4.80; N 11.00. С21H19N3O4. Вычислено,
Оранжевые кристаллы, т.пл. 227-229°C (DMF :
%: C 66.83; H 5.07; N 11.13.
CH3CN 1 : 1). Спектр ЯМР 1H, δ, м.д.: 2.59 с
(3,4-Диметоксифенил)(9-метокси-3-ме-
(3Н, N-Me), 3.01-3.02 м (2Н, СН2), 3.17 т (2Н,
тил-1,2,3,6-тетрагидроазепино[4,5-b]индол-4-
СН2, J 4.4 Гц), 3.77 с (1Н, ОСН3), 6.20 с (1Н, Н5),
ил)метанон (4f) и (3,4-диметоксифенил)(9-ме-
6.72 д.д. (1Н, Н8, J 8.7, 2.4 Гц), 6.98 д (1Н, Н10,
токси-3-метил-1,2,3,6-тетрагидроазепино[4,5-b]
J 2.4 Гц), 7.16 д (1H, H7, J 8.7 Гц), 7.33-7.36 м (2Н,
индол-5-ил)метанон (5f). Получены в виде сме-
Н3', 5'), 7.87-7.90 м (2Н, Н2', 6'), 10.73 с (1Н, NН).
си по методу А из
6-метокси-2-метил-4,9-ди-
Спектр ЯМР 13С, δ, м.д.: 24.60, 41.02, 50.90, 55.29,
гидро-3H-пиридо[3,4-b]индол-2-ия иодида и
99.62, 108.42, 111.33, 112.03, 115.01, 115.23, 115.39,
2-бром-1-[3,4-диметоксифенил]этан-1-она с об-
128.61, 131.23, 131.87, 131.93, 132.78, 134.93,
щим выходом 74% в виде ярко желтых кристал-
134.95, 144.92, 153.25, 163.56, 165.22, 192.23. Най-
лов. Соотношение изомеров 4f : 5f 2 : 3 (табл. 1).
дено, %: N 7.69. С21H19FN2O2. Вычислено, %:
В спектре ЯМР 1H сигнал протона Н5 для соедине-
N 8.00.
4
ния 4f находится при 6.11 м.д., а сигнал протона Н
(4-Бромфенил)(9-метокси-3-метил-1,2,3,6-те-
для изомера 5f - 7.25 м.д.
трагидроазепино[4,5-b]индол-4-ил)метанон
(4d). Получен по методу А из 6-метокси-2-ме-
(1H-Индол-3-ил)(9-метокси-3-метил-1,2,3,6-
тил-4,9-дигидро-3H-пиридо[3,4-b]индол-2-ия
тетрагидроазепино[4,5-b]индол-5-ил)метанон
иодида и
2-бром-1-[4-бромфенил]этан-1-она.
(5g). Получены по методу А из 6-метокси-2-ме-
Выход 95%, красные кристаллы, т.пл. 218-220°C
тил-4,9-дигидро-3H-пиридо[3,4-b]индол-2-ия
(CH3CN). Спектр ЯМР 1H, δ, м.д.: 2.60 с (3Н,
иодида и 2-бром-1-(1Н-индол-3)этан-1-она. Вы-
N-Me), 3.00-3.02 м (2Н, СН2), 3.15 т (2Н, СН2,
ход 42%, бежевые кристаллы, т.пл. 173-175°C
J 4.4 Гц), 3.77 с (1Н, ОСН3), 6.23 с (1Н, Н5),
(EtOAc). Спектр ЯМР 1H, δ, м.д.: 3.08-3.10 м (2Н,
6.73 д.д (1Н, Н8, J 8.7, 2.4 Гц), 6.98 д (1Н, Н10,
СН2), 3.16 с (3Н, N-Me), 3.57-3.58 м (2Н, СН2),
J 2.5 Гц), 7.16 д (1H, H7, J 8.7 Гц), 7.72 с (4Н, Н2',
3.76 с (1Н, ОСН3), 6.60 д.д (1Н, Н8, J 8.6, 2.4 Гц),
3', 5', 6'), 10.74 с (1Н, NН). Спектр ЯМР 13С, δ, м.д.:
6.88 д (1Н, Н10, J 2.4 Гц), 7.14-7.19 м (2H, Н5',6'),
24.57, 40.98, 50.88, 55.28, 99.64, 109.45, 111.38,
7.32 д (1H, H7, J 8.6 Гц), 7.47-7.48 м (1Н, Н7'), 7.58 с
112.22,
115.36,
125.99,
128.58,
131.03,
131.32,
(1H, H4), 7.78 с (1H, H-2'), 8.04 д (1Н, H4', J 7.7 Гц),
132.68, 137.57, 144.71, 153.27, 192.63. Найдено, %:
11.15 с (1Н, NН), 11.66 (с, 1H, NH). Спектр ЯМР
С 61.10; Н 4.28; Br 19.60; N 6.49. С21H19BrN2O2.
13С, δ, м.д.: 25.13, 47.02, 52.93, 55.28, 98.48, 103.63,
Вычислено, %: C 61.33; H 4.66; Br 19.43; N 6.81.
108.27,
109.36,
111.51,
111.86,
116.88,
120.47,
(9-Метокси-3-метил-1,2,3,6-тетрагидроазе-
121.05, 122.15, 126.83, 127.67, 129.14, 131.21,
пино[4,5-b]индол-4-ил)(3-нитрофенил)метанон
133.31, 136.42, 152.61, 153.06, 188.94. Найдено, %:
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 1 2019
ПИРИДИН-АЗЕПИНОВАЯ СТРУКТУРНАЯ МОДИФИКАЦИЯ АЛКАЛОИДА
109
С 74.18; Н 5.38; N 11.06. С23H21N3O2. Вычислено,
циклизации и скелетные перегруппировки в ряду
%: C 74.37; H 5.70; N 11.31.
природных полуаминалей и их аналогов в синтезе
перспективных биологически активных веществ”
(1,2-Диметил-1H-индол-3-yl)(9-меток-
и проводилась с использованием оборудования
си-3-метил-1,2,3,6-тетрагидроазепино[4,5-b]ин-
ЦКП “Молекулярная спектроскопия” Южного фе-
дол-5-ил)метанон (5h). Получены по методу А из
дерального университета.
6-метокси-2-метил-4,9-дигидро-3H-пиридо[3,4-b]-
индол-2-ия иодида и 2-бром-1-(1,2-диметил-1Н-
Рентгеноструктурное исследование соедине-
индол-3-этан-1-она. Выход 69%, бежевые кристал-
ний 2415 и 2415а было проведено с использовани-
лы, т.пл. 200-203°C (EtOAc). Спектр ЯМР 1H, δ,
ем оборудования Центра исследования строения
м.д.: 2.52 с (3Н, N-Me), 3.07 с (3H, C-CH3), 3.11 т
молекул ИНЭОС РАН.
(2Н, СН2, J 4.6 Гц), 3.60 уш.т (2Н, СН2), 3.74 с (3H,
КОНФЛИКТ ИНТЕРЕСОВ
N-Me), 3.76 с (1Н, ОСН3), 6.60 д.д (1Н, Н8, J 8.6,
2.4 Гц), 6.89 д (1Н, Н10, J 2.4 Гц), 7.08 т (1H, H5',
Авторы заявляют об отсутствии конфликта ин-
J 7.5 Гц), 7.15 т (1H, H6', J 7.6 Гц), 7.33 д (1H, H7,
тересов.
J 8.6 Гц), 7.37 с (1H, H4), 7.48 д (1H, H4', J 8.2 Гц),
СПИСОК ЛИТЕРАТУРЫ
7.61 д (1Н, Н7', J 7.9 Гц), 11.26 с (1Н, NН). Спектр
ЯМР 13С, δ, м.д.: 12.04, 25.02, 29.52, 47.27, 53.08,
1.
Hong Yao, Junkai Liu, Shengtao Xu, Zheying Zhu and
55.28, 98.42, 103.85, 108.13, 109.39, 109.63, 111.58,
Jinyi Xu, Expert Opinion on Drug Discovery. 2016, 12,
113.93, 119.41, 120.20, 121.00, 126.96, 127.51, 129.05,
121.
133.15, 136.03,140.32, 153.08, 154.18, 189.67. Найде-
2.
Зубенко А.А., Диваева Л.Н., Морковник А.С., Кар-
но, %: С, 75.00; Н, 6.11; N, 10.32. С25H25N3O2 . Вы-
цев В.Г., Дробин Ю.Д., Сербиновская Н.М., Фети-
числено, %: C, 75.16; H, 6.31; N, 10.52.
сов Л.Н., Бодряков А.Н., Бодрякова М.А., Лящен-
ко Л.А. Биоорг. химия. 2017, 43, 311. [Zubenko A.A.,
(5-Метокси-1,2-диметил-1H-индол-3-ил)-
Divaeva L.N., Morkovnik A.S., Kartsev V.G., Drobin
(9-метокси-3-метил-1,2,3,6-тетрагидроазепи-
Y.D., Serbinovskaya N.M., Fetisov L.N., Bodryakov
но[4,5-b]индол-5-ил)метанон
(5i).
Получены
A.N., Bodryakova M.A., Lyashenko L.A. Russ. J.
по методу А из
6-метокси-2-метил-4,9-диги-
Bioorg. Chem. 2017, 43, 311.]
дро-3H-пиридо[3,4-b]индол-2-ия иодида и 2-бром-
3.
Зубенко А.А., Диваева Л.Н., Морковник А.С., Кар-
1-(5-метокси-1,2-диметил-1Н-индол-3-этан-1-она.
цев В.Г., Дробин Ю.Д., Сербиновская Н.М., Фети-
Выход 73%, бежевые кристаллы, т.пл. 217-222°C
сов Л.Н., Бодряков А.Н., Бодрякова М.А., Лящен-
(EtOAc). Спектр ЯМР 1H, δ, м.д.: 2.50 с (3Н, N-
ко Л.А., Клименко А.И. Биоорг. химия. 2017, 43,
Me, наложение на остаточные сигналы ДМСО),
555. [Zubenko A.A., Divaeva L.N., Morkovnik A.S.,
3.10-3.11 м (5Н, С-CH3, СН2), 3.60 уш.т (2Н, СН2),
Kartsev V.G., Drobin Y.G., Serbinovskaya N.M.,
3.70 с (3H, N-CH3), 3.72 с (1Н, ОСН3), 3.76 с (3H,
Fetisov L.N., Bodryakov A.N., Bodryakova M.A.,
Lyashenko L.A., Klimenko A.I. Russ. J. Bioorg. Chem.
OCH3), 6.60 д.д (1Н, Н8, J 8.6, 2.4 Гц), 6.78 д.д
2017, 43, 555.]
(1H, Н6', J 8.8, 2.5 Гц), 6.88 д (1Н, Н10, J 2.4 Гц),
4.
Zubenko A.A., Morkovnik A.S., Divaeva L.N.,
7.13 д (1H, H4', J 2.4 Гц), 7.33 д (1H, H7, J 8.6 Гц),
Kartsev V.G., Suponitsky K.Yu., Klimenko A.I.
7.35 с (1H, H4), 7.37 д (1Н, Н7', J 8.8 Гц), 11.25 с
Mendeleev Commun. 2018, 28, 320.
(1Н, NН). Спектр ЯМР 13С, δ, м.д.: 12.19, 25.08,
5.
Zubenko A.A., Morkovnik A.S., Divaeva L.N.,
29.62, 47.17, 53.06, 55.16, 55.29, 98.43, 101.55,
Kartsev V.G., Kuzmina L.G., Borodkin G.S.,
103.66,
108.09,
109.35,
110.36,
110.82,
111.57,
Klimenko A.I. Mendeleev Commun., 2018, 28, 58.
113.79,
127.50,
127.55,
129.08,
131.19,
133.18,
6.
Kartsev V.G., Zubenko A.A., Morkovnik A.S.,
140.86, 153.09, 153.95, 154.32, 189.66. Найдено, %:
Divaeva L.N. Tetrahedron Lett. 2015, 56, 6988.
С 72.49; Н 6.18; N 10.06. С26H27N3O3. Вычислено,
7.
Zubenko A.A., Kartsev V.G., Morkovnik A.S., Divae-
%: C 72.71; H 6.34; N 9.78.
va L.N., Alexeenko D.V., Borodkin G.S., Suponitsky K.Y.,
Klimenko A.I. Tetrahedron Lett. 2017, 58, 1233.
ФОНДОВАЯ ПОДДЕРЖКА
8.
Zubenko A.A., Kartsev V.G., Morkovnik A.S.,
Работа выполнена при финансовой поддержке
Divaeva L.N., Suponitsky K.Yu. ChemistrySelect,
гранта РФФИ, проект №16-03-00828 “Новые ре-
2016, 1, 2560.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 1 2019
110
ЗУБЕНКО и др.
9. Zubenko A.A., Morkovnik A.S., Divaeva L.N.,
tin V.G., Sheremetev A.B., RSC Adv., 2016, 6, 104325.
Kartsev V.G., Borodkin G.S., A.I. Klimenko, Mendeleev
18. Bader R.F.W. Atoms in Molecules. A Quantum Theory,
Commun. 2018, 28, 83.
Clarendon Press, Oxford, 1990.
10. Pachter I.J., Mohrbacher R.J., Zacharias D.E. J. Am.
19. Keith T.A.
2014, AIMAll, Version
14.11.23. TK
Chem. Soc., 1961, 83, 635.
Gristmill Software, Overland Park KS, USA.
11. Shatenshteîn A.I. Adv. Phys. Org. Chem., 1963, 1, 187.
20. Espinosa E., Molins E., Lecomte C. Chem. Phys. Lett.
12. APEX2, Bruker AXS Inc., Madison, Wisconsin, USA,
1998, 285, 170.
2009.
21. Espinosa E., Alkorta I., Rozas I., Elguero J., Molins E.
13. Dolomanov, O.V., Bourhis, L.J., Gildea, R.J,
Chem. Phys. Lett. 2001, 336, 457.
Howard, J.A.K. Puschmann, H. J. Appl. Cryst. 2009,
22. Lyssenko K.A. Mendeleev Commun. 2012, 22, 1.
42, 339.
23. Suponitsky K.Yu., Burakov N.I., Kanibolotsky A.L.,
14. Sheldrick G.M. Acta Cryst. 2008, A64, 112.
Mikhailov V.A., J. Phys. Chem. A, 2016, 120, 417.
15. Dalinger I.L., Shakhnes A.Kh., Monogarov K.A.,
24. Дмитриенко A.O., Карноухова В.А., Потем-
Suponitsky K.Yu., Sheremetev A.B. Mendeleev
кин А.A., Стручкова М.И., Кряжевских И.А., Супо-
Commun., 2015, 25, 429.
ниц-кий К.Ю. Химия гетероцикл. соединений. 2017,
16. Sheremetev A.B., Korolev V.L., Potemkin A.A.,
53, 532. [Dmitrienko A.O., Karnoukhova V.A., Pote-
Aleksandrova N.S., Palysaeva N.V., Hoang T.H.,
mkin A.A., Struchkova M.I., Kryazhevskikh I.A., Supo-
Sinditskii V.P, Suponitsky K.Yu. Asian J. Org. Chem.,
nitsky K.Yu. Chem. Heterocycl. Compd. 2017, 53, 532.]
2016, 5, 1388.
17. Gidaspov A.A., Bakharev V.V., Suponitsky K.Yu., Niki-
gamess/index.html.
Pyridine-Azepine Structural Modification
of 3,4-Dihydro-nor-iso-harmine
A. A. Zubenkoa, A. S. Morkovnikb, * L. N. Divaevab, V. G. Kartsevc,
A. A. Anisimovd, and K. Yu. Suponitskye
a North-Caucasian Zonal Scientific Veterinary Institute, 346406, Russia, Rostov region, Novocherkassk, ul. Rostov sh. 0
b Institute of Physical and Organic Chemistry, Southern Federal University,
344090, Russia, Rostov-on-Don, pr. Stachki 194/2
*e-mail: asmork2@ipoc.rsu.ru
c “InterBioScreen Ltd.,” 142432, Russia, Moscow region, Chernogolovka, Institutskiy prosp. 7
d D. Mendeleyev University of Chemical Technology of Russia (D. Mendeleyev University, MUCTR),
125047, Russia, Moscow, Miusskaya pl. 9
e A.N. Nesmeyanov Institute of Organoelement Compounds RAS (INEOS RAS),
X-ray Crystallography Center, 119334, Russia, Moscow, ul. Vavilova 28
Received June 20, 2018
Revised June 26, 2018
Accepted July 4, 2018
The structural modification of 3,4-dihydro-nor-iso-harmine with replacement of the hydrogenated pyridine ring by
dihydroazepine is described. Two-step reaction sequence involving the acylmethyl halide-induced pyridine-azepine
recyclization of the quaternized form of the substrate, was used for carrying out this modification. 4-Acyl-3-methyl-
9-methoxy-1,2-dihydroazepino [4,5-b] indoles or their 5-acyl isomers were formed as final modification products.
For the formation of latter unsual 1,2-acyl rearrangement is responsible. The most important factors influencing the
direction of the two-directed recyclization and the ratio of isomeric products are considered.
Keywords: 3,4-dihydro-nor-iso-hramine, recyclization, 1,2-acyl rearrangement, 4(5)-acyl-3-methyl-9-methoxy-1,2-
dihydroazepino[4,5-b]indoles
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 1 2019