ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, Том 55, № 1, с. 145-148
УДК 547.914.47
О НЕКОТОРЫХ ОСОБЕННОСТЯХ РЕАКЦИИ
ВОССТАНОВЛЕНИЯ
ДИ- И ТРИХЛОРЦИКЛОПЕНТЕНОНОВ
© 2019 г. В. А. Егоров, Л. С. Хасанова, Ф. А. Гималова*,
И. А. Загреева, М. С. Мифтахов
ФГБУН Уфимский Институт химии РАН (УфИХ РАН), 450054, Россия, Республика Башкортостан,
г. Уфа, проспект Октября, 71
*e-mail: bioreg@anrb.ru
Поступила в редакцию 25 июля 2018 г.
После доработки 9 августа 2018 г.
Принята к публикации 22 августа 2018 г.
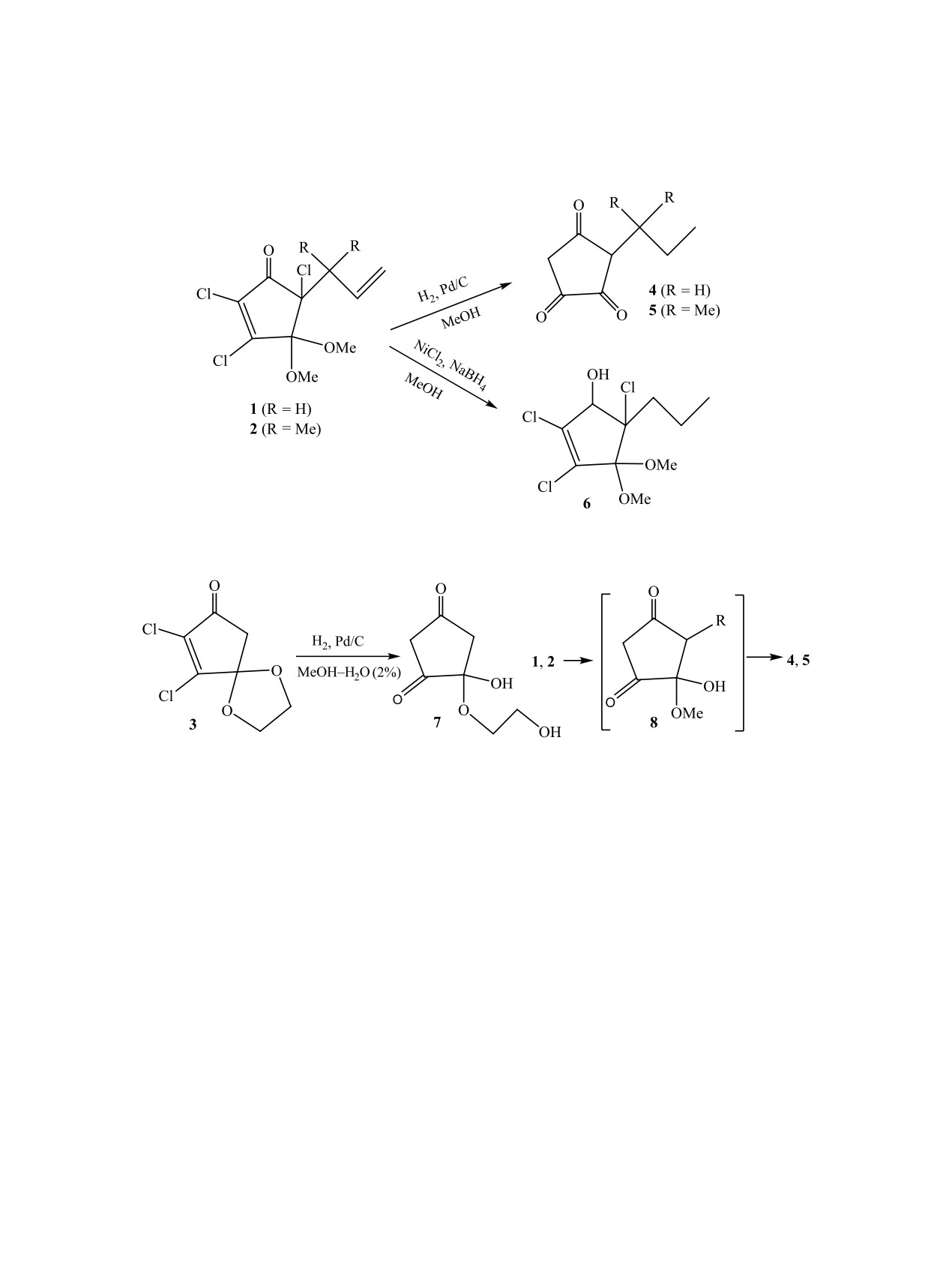
При гидрировании 5-аллил- и 5-(1,1-диметил-2-пропенил)-2,3,5-трихлорциклопентенонов в метаноле в
присутствии 10% Pd/C получены продукты гидрирования и исчерпывающего дехлорирования - 3-про-
пил- и 3-(1,1-диметилпропил)циклопентан-1,2,4-трионы.
Ключевые слова: ди- и трихлорциклопентеноны, гидрирование, дехлорирование, гидролиз, циклопен-
тан-1,2,4-трионы.
DOI: 10.1134/S0514749219010142
В продолжение работ по исследованию хими-
условиях действием системы Zn-NH4Cl-MeOH
ческих свойств ранее полученных ди- и трихлор-
или Zn-AcOH и при нагревании [4, 5].
циклопентенонов 1-3 [1, 2] в данной работе нами
В отличие от соединений 1 и 2 для дихлорци-
изучены их восстановительные превращения. Так,
клопентенона 3 в аналогичных условиях (H2, 10%
восстановление соединений 1 и 2 в метаноле с
Pd/C) наблюдалось восстановительное дехлори-
использованием 10% Pd/C и перемешиванием в
рование с раскрытием диоксаланового цикла и
атмосфере водорода в течение 30-36 ч протекало
образованием полуацеталя 7 (схема 2). В данном
необычно: кроме ожидаемого гидрирования двой-
случае диоксолановая защитная группа 3, видимо,
ной связи наблюдалось исчерпывающее дехлори-
более устойчива в условиях реакции, чем анало-
рование и гидролиз ацетальной защитной группы
гичные легкогидролизуемые интермедиаты 8 из
с образованием трионов 4 и 5.
соединений 1 и 2 [6].
Соединения 4 и 5 существуют частично в еноль-
Работа
выполнена
по теме
ААА-
ной форме, о чем свидетельствуют наличие уши-
А-А17-117011910032-4 госзадания. Анализы вы-
ренных полос поглощения ОН-групп в ИК-спек-
полнены на оборудовании ЦКП “Химия” УфИХ
тре в области ~3430-3200 см-1. Синтез триона 4
УФИЦ РАН.
ранее был описан в статье И.В. Торгова с сотр. [3].
3-Пропилциклопентан-1,2,4-трион (4). К рас-
Восстановление соединения 1 боридом нике-
твору 0.1 г (0.35 ммоль) соединения 1 в 5 мл MeOH
ля, in situ генерируемым в системе NiCl2-NaBH4,
привело к ожидаемому насыщенному спирту 6
добавляли 0.1 г 10% Pd/C и перемешивали в среде
(схема 1). Следует отметить, что частичное или
Н2 до израсходования 1 (контроль методом ТСХ,
полное восстановительное дехлорирование этих
30-36 ч). Реакционную массу отфильтровали, ме-
соединений ранее наблюдалось в более жестких
танол упаривали, остаток очищали колоночной
145
146
ЕГОРОВ и др.
Схема 1.
Схема 2.
хроматографией на SiO2 (этилацетат-петролейный
830. Спектр ЯМР 1Н (CDCl3, 300 МГц), δ, м.д.:
эфир, 1 : 10). Получали 40 мг (74%) соединения 4
0.82 т (3Н, СН3, J 7.3 Гц), 0.87 с (3Н, СН3), 0.98 с
в виде бесцветного масла. Спектр ЯМР 1Н (CDCl3,
(3Н, СН3), 1.39 к (2Н, СН2, J 7.2 Гц), 1.98 м (2Н,
500 МГц), δ, м.д.: 0.85 т (3Н, СН3, J 7.1 Гц), 1.39 м
С5Н2), 2.25 м (1Н, Н3). Спектр ЯМР 13С (CDCl3,
(2Н, СН2), 2.06 м (1Н, Н3), 2.46 м (2Н, СН2), 3.33 д
125 МГц), δ, м.д.: 8.25 (СН3), 20.35 (СН2), 24.21
(2Н, С5Н2, J 11.3 Гц). Спектр ЯМР 13С (CDCl3,
(СН3), 25.99 (CH3), 35.21 (СMe2), 40.73 (С5), 55.93
125 МГц), δ, м.д.: 12.84 (СН3), 20.79 (СН2), 22.50
(С3), 187.47 (C4), 214.06 и 221.1 (C1, C2). Найде-
(СН2), 41.20 (С5), 33.0 (С3), 188.46 (C4), 197.61
но, %: C 65.63, H 7.82. C10H14O3. Вычислено, %:
(C1), 207.21 (C2). Масс-спектр, m/z (I, %): 155 (100)
C 65.91, H 7.74. Масс-спектр, m/z (I, %): 183 (100)
[MH]+.
[MH]+, 167 (13) [M-CH3]+, 153 (25) [M-2CH3]+.
3-(1,1-Диметилпропил)циклопентан-1,2,4-
2,3-Дихлор-4,4-диметокси-5-пропилцикло-
трион
(5) получен аналогично
4 из
0.1 г
пент-2-ен-1-ол (6). К перемешиваемому раство-
(0.32 ммоль) соединения 2 с использованием 0.1 г
ру 0.1 г (0.35 ммоль) соединения 1 в 20 мл MeOH
10% Pd/C. Бесцветное масло, выход 45 мг (78%).
при 0°С добавляли 73 мг (1.93 ммоль) NaBH4 и
ИК спектр, ν, см-1: 3429, 2964, 2879, 1739, 1729,
45.5 мг (0.35 ммоль) NiCl2, реакционную массу
1607, 1594, 1456, 1387, 1366, 1280, 1198, 1164,
перемешивали до израсходования дихлоркетона 1
1150, 1110, 1099, 1076, 1031, 1020, 979, 942, 931,
(контроль методом ТСХ, 1-1.5 ч). Метанол упари-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 1 2019
О НЕКОТОРЫХ ОСОБЕННОСТЯХ РЕАКЦИИ ВОССТАНОВЛЕНИЯ
147
вали, остаток растворяли в 20 мл CH2Cl2, промы-
анализа синтезированных соединений получены
вали насыщенным раствором NaCl, органический
на CHNS-анализаторе EURO EA-2000. Ход реак-
слой сушили MgSO4, упарили, остаток очищали
ции контролировали методом ТСХ на пластинках
колоночной хроматографией на SiO2 (этилаце-
“Сорбфил” (Россия) с обнаружением веществ сма-
тат - петролейный эфир, 1 : 5). Выход 80 мг (79%).
чиванием пластинок раствором анисового альде-
Бесцветное масло. ИК спектр, ν, см-1: 3341, 2964,
гида и серной кислоты в этаноле с последующим
2936, 2875, 1731, 1711, 1609, 1457, 1381, 1305, 1261,
нагреванием при 120-150°С. Продукты синтеза
1229, 1204, 1167, 1133, 1110, 1096, 1069, 1020, 980,
выделяли методом колоночной хроматографии на
942, 889, 865, 814, 754. Спектр ЯМР 1Н (CDCl3,
силикагеле (30-60 г адсорбента на 1 г вещества).
500 МГц), δ, м.д.: 0.93 т (3Н, СН3, J 7.3 Гц), 1.48 м
(1Н, H1' ) и 1.63 м (1Н, H2' ), 1.89 д.д.д.д (1Н, H1' ,
ФОНДОВАЯ ПОДДЕРЖКА
J 4.4, 2.3, 12.6 и 10.4 Гц), 2.16 д.д.д.д (1Н, H2' , J 4.4,
2.4, 12.4 и 10.5 Гц), 2.52 с (1Н, ОН), 3.42 с (3Н,
Работа
выполнена
по теме
ААА-
ОСН3), 3.46 с (3Н, ОСН3), 4.38 с (1Н, Н1). Спектр
А-А17-117011910032-4 госзадания. Анализы вы-
ЯМР 13С (CDCl3, 125 МГц), δ, м.д.: 14.48 (СН3),
полнены на оборудовании ЦКП “Химия” УфИХ
18.54 (СН2), 39.15 (СН2), 50.76 (ОСН3),
52.02
РАН.
(ОСН3), 77.80 (C1), 84.43 (C5), 104.55 (C4), 131.49
(C2), 136.22 (C3). Масс-спектр, m/z (I, %): 254 (255,
КОНФЛИКТ ИНТЕРЕСОВ
256) (14) [MH]+, 223 (224, 225) (100) [MH-OCH3]+.
Авторы заявляют об отсутствии конфликта ин-
4-Гидрокси-4-(2-гидроксиэтокси)циклопен-
тересов.
тан-1,3-дион (7). Получали аналогично 4 из 0.2 г
(0.82 ммоль) дихлорциклопентенона 4 с использо-
СПИСОК ЛИТЕРАТУРЫ
ванием 0.2 г 10% Pd/C. Продукт очищали колоноч-
ной хроматографией на SiO2 (этилацетат-петро-
1. Ахметвалеев Р.Р., Акбутина Ф.А., Иванова Н.А.,
лейный эфир, 1:4). Бесцветное масло, выход 98 мг
Мифтахов М.С. Изв. АН. Сер. хим., 2001, 1417.
(69%). Спектр ЯМР 1Н (метанол-d4, 300 МГц),
[Akhmetvaleev R.R., Akbutina F.A., Ivanova N.A.,
δ, м.д.: 2.49 c (1Н, СН2), 2.55 c (1Н, СН2), 2.86 c
Miftakhov M.S. Russ. Chem. Bull., Int. Ed., 2001, 50,
(1Н, С5Н2), 3.31 д (1Н, С5Н2, J 18.4 Гц), 3.68 м
1489.]
2. Исмаилов С.А. Дисс. … докт. хим. наук. Уфа. 1992.
(5Н, OСН2, OH). Спектр ЯМР 13С (метанол-d4,
3. Лагидзе Д.Р., Ананченко С.Н., Торгов И.В. Изв.
125 МГц), δ, м.д.: 24.26 (СН2), 31.86 (СН2), 62.66
АН СССР. Сер. хим., 1965, 1899. [Lagidze D.R.,
(OСH2), 108.04 (C4), 185.60 (C1), 192.28 (C3). Масс-
Ananchenko S.N., Torgov I.V. Russ. Chem. Bull., Int.
спектр, m/z (I, %): 174 (4) [M]+, 150 (100).
Ed., 1965, 14, 1869.]
ИК спектры получены на спектрофотометре “IR
4. Толстиков Г.А., Мифтахов М.С., Вельдер Я.Л.,
Prestige-21 Shimadzu” для образцов в тонком слое.
Исмаилов С.А. Ж. Орг. химии, 1991, 27(1),
83.
Спектры ЯМР 1Н и 13С записаны на спектрометрах
[Tolstikov G.A., Miftakhov M.S., Vel’der Ya.L., and
“Bruker AM-300” с рабочими частотами 300.13 и
Ismailov S.A., Zh. Org. Khim., 1991, 27, 83. [J. Org.
Chem. USSR, 1991, 27.]
75.47 МГц и “Bruker AVANCE-500” с рабочими ча-
5. Чертанова Л.Ф., Исмаилов С.А., Халилов Л.М.,
стотами 500.13 и 125.77 МГц соответственно, вну-
Мифтахов М.С., Прищепова Е.В., Шитикова О.В.,
тренний стандарт - ТМС. Масс-спектры получены
Толстиков Г.А. Изв. АН СССР. Сер. хим., 1991,
на масс-спектрометре LCMS-2010EV (Shimadzu)
1794. [Chertanova L.F., Ismailov S.A., Khalilov L.M.,
(шприцевой ввод, раствор образца в хлороформе/
Miftakhov M.S., Prishchepova E.V., Shitikova O.V., and
ацетонитриле при расходе 0.1 мл/мин, элюент -
Tolstikov G.A., Russ. Chem. Bull., Int. Ed., 1991, 40,
ацетонитрил/вода (95/5) в режиме регистрации
1587.]
положительных ионов при потенциале игольчато-
6. Гималова Ф.А., Егоров В.А., Валеев Р.Ф.,
го ионизирующего электрода 4.5 кВ; температу-
Мифта-хов М.С. Ж. орг. химии,
2007,
43(2),
ра капилляра интерфейса 250°С, напряжение на
312.
[Gimalova F.A., Egorov V.A., Valeev R.V.,
капилляре интерфейса 5В). Данные элементного
Miftakhov M.S. Russ. J. Org. Chem., 2007, 43, 307.]
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 1 2019
148
ЕГОРОВ и др.
About Some Features of the Reduction Reaction
of Di- and Trichlorocyclopentenone
V. A. Egorov, L. S. Khasanova, F. A. Gimalova*, I.A. Zagreeva, and M. S. Miftakhov
Ufa Institute of Chemistry, Ufa Researcher Centre, RAS,
450054, Russia, Republic of Bashkortostan, Ufa, pr. Oktyabrya 71
*e-mail: bioreg@anrb.ru
Received July 25, 2018
Revised August 9, 2018
Accepted August 22, 2018
By hydrogenation of 5-allyl- and 5-(1,1-dimethyl-2-propenyl)-2,3,5-trichlorcyclopentenones in methanol in the
presence of 10% Pd/C, 3-propyl- and 3-(1,1-dimethylpropyl)-cyclopentane-1,2,4-trions, the products of reduction and
complete dechlorination, were obtained.
Keywords: di- and trichlorocyclopentenones, hydrogenation, dechlorination, hydrolysis, cyclopentane-1,2,4-trions
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 1 2019