ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 10, с. 1519-1526
УДК 547.833.3:547.304.3.4
РЕАКЦИЯ АЗОСОЧЕТАНИЯ ЕНАМИНОАМИДОВ РЯДА
3,3-ДИМЕТИЛ-1,2,3,4-ТЕТРАГИДРОИЗОХИНОЛИНА
С СОЛЯМИ АРИЛДИАЗОНИЯ
© 2019 г. А. Г. Михайловскийa, *, Е. С. Погореловаa, Н. Н. Першинаa,
Е. Н. Люстa, М. В. Дмитриевb, **
a ФГБОУ ВО МЗ РФ «Пермская государственная фармацевтическая академия»,
614990, Россия, г. Пермь, ул. Полевая 2
*e-mail: neorghim@pfa.ru
b ФГБОУ ВО РФ «Пермский государственный национальный исследовательский университет»,
614990, Россия, г. Пермь, ул. Букирева 15
**e-mail: koh2@psu.ru
Поступила в редакцию 03 апреля 2019 г.
После доработки 14 мая 2019 г.
Принята к публикации 30 мая 2019 г.
Реакция азосочетания (Z)-2-(3,3-диметил-3,4-дигидроизохинолин-1(2Н)-илиден)-N-(п-толил)-ацетамида с
солями арилдиазония приводит к (Z)-2-(3,3-диметил-3,4-дигидроизохинолин-1-ил)-N-(п-толил)-2-(2-
арилгидразоно)ацетамидам. Структура гидразона доказана данными ЯМР 1Н спектроскопии и РСА. При
отсутствии N-п-толильного заместителя в амидной группе продукты азосочетания существуют в
растворе в виде азо-гидразо таутомеров. Изучены электронные спектры поглощения.
Ключевые слова: (Z)-2-(3,3-диметил-3,4-дигидроизохинолин-1(2Н)-илиден)-N-(п-толил)-ацетамид, азо-
сочетание с солями арилдиазония, (Z)-2-(3,3-диметил-3,4- дигидроизохинолин-1-ил)-N-(п-толил)-2-(2-
арилгидразоно)ацетамиды, отсутствие N-п-толила, азо-гидразо-таутомерия.
DOI: 10.1134/S0514749219100057
Реакция азосочетания енаминов ряда
3,3-
енаминокетоны ряда 1,2,3,4-тетрагидроизохиноли-
диалкил-1,2,3,4-тетрагидроизохинолина с солями
на образуют в этой реакции азосоединения [3].
диазония изучалась ранее с различными по
Соединения, имеющие в своей структуре
строению енаминами. Авторами работы
[1]
изохинолин, широко известны в качестве
показано, что сочетание 1-метил-3,3-диалкил-3,4-
лекарственных и биологически активных веществ
дигидроизохинолинов с двукратным количеством
[4, 5]. В ряде молекул лекарственных веществ
соли диазония приводит к образованию
присутствует также фрагмент гидразона [6, 7].
формазанов. Это объясняется тем, что в названных
Таким образом, гидразоны ряда изохинолина могут
енаминах есть возможность замещения двух
рассматриваться в качестве потенциальных
атомов водорода метильной группы. В случае,
лекарственных веществ.
когда такая возможность имеется лишь для одного
атома водорода, следует ожидать образования
Целями данной работы является исследование
азокрасителя, который может переходить в форму
реакции азосочетания енаминоамидов ряда
3,3-
гидразона. При этом в зависимости от структурных
диметил-1,2,3,4-тетрагидроизохинолина с солями
факторов и создаваемых условий среды для
диазония и изучение строения полученных
продукта азосочетания следует ожидать форму
продуктов в зависимости от структуры азосостав-
только гидразона или азокрасителя или смесь азо-
ляющей.
гидразо таутомеров. Например, при азосочетании с
солями диазония основания дротаверина
[2]
Исследования показали, что (Z)-2-(3,3-диметил-
образуются гидразоны. В то же время третичные
3,4-дигидроизохинолин-1(2Н)-илиден)-N-(п-толил)-
1519
1520
МИХАЙЛОВСКИЙ и др.
Схема 1.
Me
Me
_
Me
Me
RC6H4N2+Cl
N
N
H
H
N
O
N
C6H4CH3-п
N
O
NHC6H4Me-п
RC
6H4
H
1
2a_h
2, R = H (a), п-NO2 (b), п-CO2Et (c), п-Ac (d), п-Me (e), м-Me (f), п-Br (g), п-EtO (h).
ацетамид
1 при азосочетании с солями арил-
изохинолинового цикла в исходном амиде 1 (10.08
диазония образует соединения 2a-h (схема 1).
м.д.) и сходных с ними енаминоамидов [8]. На
основании этих данных можно сделать вывод о
По данным спектров ЯМР 1Н и РСА, продукты
том, что во внутримолекулярном взаимодействии
2a-h существуют в виде гидразона, наличие формы
принимает участие не амидный карбонил, а
азокрасителя для них не выявлено.
амидная NH и азометиновая группа изохиноли-
В то же время амид 3 без заместителей при
нового цикла. При этом отсутствует раздвоение
амидном атоме азота образует при азосочетании
каких-либо сигналов, что свидетельствует в пользу
соединения 4а-d, для которых, согласно данным
одной формы.
спектров ЯМР
1Н, характерна азо-гидразонная
ИК спектры амидов 4a-d содержат полосы погло-
таутомерия (схема 2).
)
щения хелатированных групп NH (3120-3200 cм-1
Полученные соединения 2a-h и 4a-d представ-
и С=О (1605 см-1).
ляют собой кристаллические вещества, их окраска
В спектрах ЯМР соединений
4а-d имеются
варьирует от ярко-желтой до красной. Все они
синглеты протонов групп NH примерно равной
растворимы в хлороформе и ДМСО, трудно
растворимы в спирте и бензоле.
интенсивности, которые соответствуют по
химсдвигу синглету протона группы NH изохино-
В ИК спектрах соединений 2a-h, снятых в
линового цикла (10.05-10.08 м.д.). Вторая группа
CHCl3 в концентрации 0.01 моль/л, наблюдаются
синглетов протонов групп NH cущественно
уширенные полосы поглощения хелатированных
отличается по химсдвигу: 12.40-12.60 и 13.70-
групп С=О и NH соответственно в области 1605-
13.90 м.д. Кроме того, имеет место раздвоение
1615 и 3010-3040 см-1.
синглетов метильных групп в положении
3 и
В спектрах ЯМР 1Н гидразонов 2a-h, в отличие
метиленовой группы в положении 4. Все эти факты
от исходного амида 1, имеются синглеты протонов
свидетельствуют о наличии в растворе двух азо-
в области 13.18-13.45 и 14.01-14.47 м.д., что на 3-
гидразо таутомеров примерно в равных соотно-
4 м.д. превышает величину химсдвига сигнала NH
шениях.
Схема 2.
Me
Me
Me
_
Me
Me
Me
RC6H4N2+Cl
N
N
N
H
H
H
NH
O
O
N
N
N
O
N NH2
NH2
RC6H4
H
RC6H4
3
4a_d
4, R = м-Br (a), п-NO2 (b), п-MeO (c), п-EtO (d).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
РЕАКЦИЯ АЗОСОЧЕТАНИЯ ЕНАМИНОАМИДОВ
1521
Схема 3.
N
N
H
N
H
O
O
N
O
N
N
H
N
Ar
N
N
N
N
H
Tol-п
Ar
N H
Ar
H Tol-п
Ar
A
B
C
Масс-спектры гидразонов 2a-h содержат пики
стандартные для соответствующих атомов значе-
молекулярного иона. Наиболее устойчива к элект-
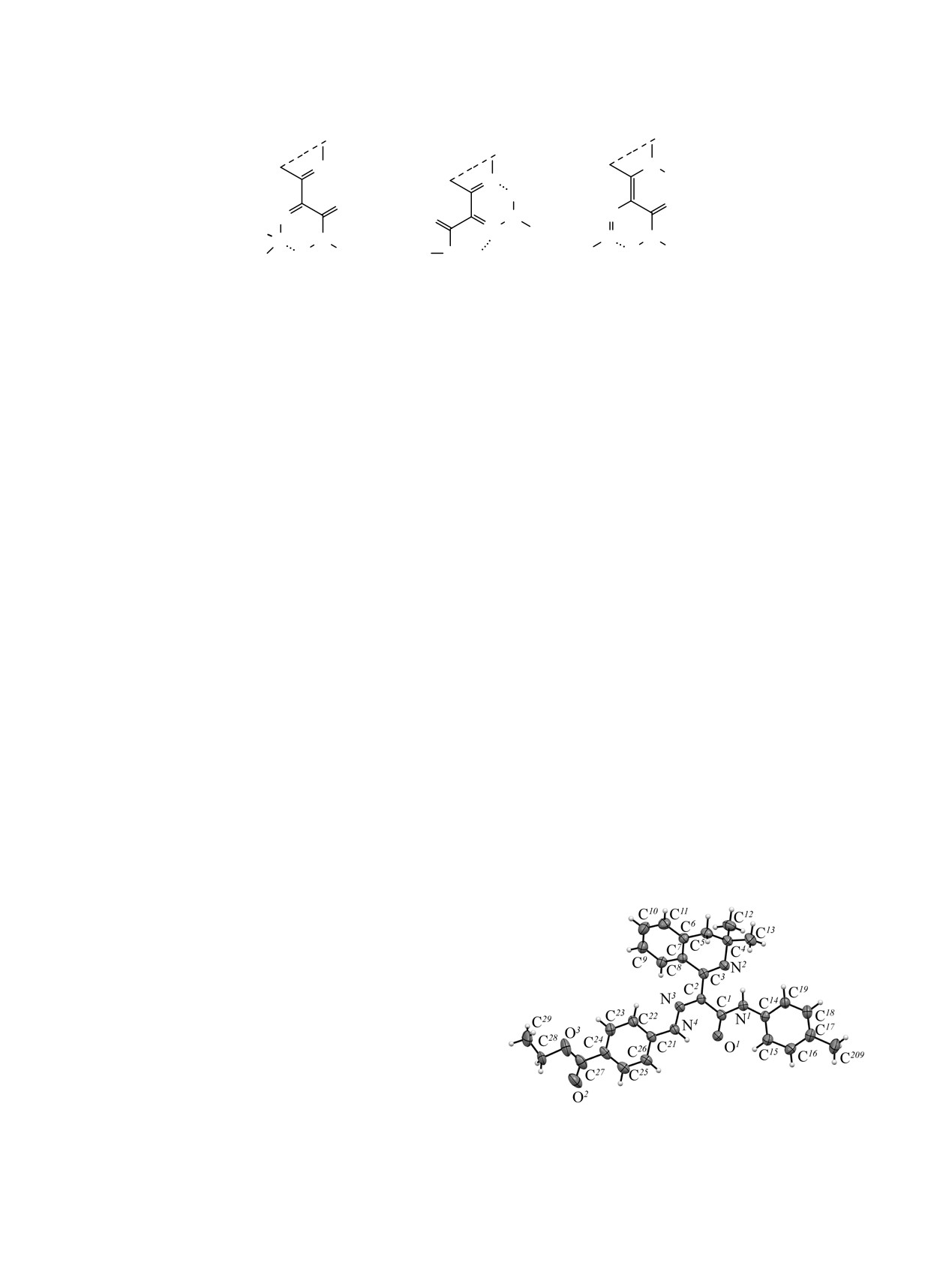
ния. Дигидропиридиновый цикл находится в кон-
ронному удару молекула, содержащая этокси-
формации «искаженная ванна», атомы C4 и N2 откло-
группу ([M]+ 94%), наименее устойчива - нитро-
няются от плоскости C5C6C7C3 на 0.87 и 0.42 Å
группу ([M]+ 32%). Для всех гидразонов этого ряда
соответственно. Большая часть молекулы (за исклю-
характерен пик m/z
185
(32-100%), вероятная
чением изохинолинового цикла) приблизительно
структура для него
- радикал
3,3-диметил-1-
плоская, что обуславливает наличие системы соп-
метилимино-3,4-дигидроизохинолина (С12Н13N2).
ряженных кратных связей. Геометрия молекулы
Масс-спектры
5 из
8 соединений содержат
также стабилизирована двумя внутримолекуляр-
осколочный пик с массой 158 небольшой интен-
ными водородными связями N4-H4···O1и N1-
сивности
(7-16%), подходящей структурой для
H1···N2; параметры ВВС: N1-H1 0.90(2), N4-H4
которого является остаток 3,3-диметил-3,4-дигидро-
0.97(3), H4···O1
1.78(4), H1···N2
1.84(2), N4···O1
изохинолина (С11H12N). Характерными для всего
2.544(4), N1···N2 2.643(4) Å, углы N4H4O1 133(3)° и
ряда являются пики более лёгких осколочных
N1H1N2 147(2)°. Укороченные межмолекулярные
ионов: 106 (5-100) [CH3C6H4NH]+ и 91 (11-100)
контакты в кристалле отсутствуют.
[CH3C6H4]+.
Окраска полученных веществ варьирует в
Масс-спектры незамещённых амидов
4а-d
зависимости от заместителя. В связи с этим
схожи со спектрами соответствующих N-п-толил-
возникает вопрос о связи окраски со спектрами
замещённых амидов 2а-h. Все они содержат пик
поглощения в видимой и УФ области. Спектры
молекулярного иона интенсивностью от 10% (п-NO2)
всех полученных соединений, снятые в метаноле,
до 72% (п-EtO), что отражает возрастание устойчи-
содержат бензольную полосу поглощения ππ*
вости молекулы с ростом донорной способности
перехода в области 202-203 нм (log ε 4.12-4.50)
заместителя. Масс-спектры амидов 4b-d содержат
[9]. Наблюдается также полоса поглощения,
пик, соответствующий массе [M - 1]+ (21-100%).
соответствующая ππ* переходу замещённого
Имеются также названные выше осколочные пики
бензола в области 230-251 нм (log ε 4.07-4.51).
185 и 158. Наиболее интенсивным оказался оско-
Спектры содержат К-полосу, соответствующую
лочный пик группы CONH2 (83-100%).
ππ*-переходу электронов всей сопряжённой
На основании спектральных данных для
соединений
2а-h можно было бы предложить,
помимо представленной формулы гидразона, другое
строение и другие конфигурации, например,
структуры A, B, C (схема 3). С целью более
точного доказательства структуры был осуществ-
лен РСА на примере соединения 2с. Монокристалл
был получен медленной перекристаллизацией из 2-
пропанола.
Согласно данным РСА, соединение 2с кристал-
лизуется в центросимметричной пространственной
группе моноклинной сингонии (см. рисунок). Длины
Общий вид молекулы соединения 2с по данным РСА в
связей и валентные углы в соединении принимают
тепловых эллипсоидах 30 % вероятности.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
1522
МИХАЙЛОВСКИЙ и др.
Схема 4.
N
N
H
H
NaOH
N
N
N
C6H4CH3-п
N
C6H4CH3-п
H+
N
O
N
O
H
_
O
+
O
2
N
Na+ _
N
O
2b
системы (347-392 нм, log ε 4.15-4.59). В ряде
группу. В 10% водно-спиртовом растворе NaOH
случаев можно отметить влияние заместителя в
окраска раствора меняется от оранжевой до
ароматическом ядре фрагмента гидразона на
фиолетовой, что сопровождается появлением новой
положение λmax K-полосы. В ряду гидразонов 2а-h
полосы поглощения в видимой области (λmax 514 нм,
положение максимума этой полосы сдвинуто
log ε 4.18). При подкислении или разбавлении раст-
батохромно как для наиболее электроноакцеп-
вора окраска возвращается к исходной (схема 4).
торного (п-NO2), так и наиболее электронодо-
Таким образом, при азосочетании (Z)-2-(3,3-
норного заместителя (п-EtO), cдвиги относительно
диметил-3,4-дигидроизохинолин-1(2Н)-илиден)-N-
незамещённого бензола составляют соответственно
(п-толил)-ацетамида с солями арилдиазония обра-
24 и 17 нм. Тот факт, что доноры и акцепторы
зуются (Z)-2-(3,3-диметил-3,4-дигидроизохинолин-
действуют здесь в одном направлении,
1-ил)-N-(п-толил)-2-(2-арилгидразоно)ацетамиды,
свидетельствует о сложном электронном взаимо-
форма гидразона доказана данными спектров ЯМР
действии в сопряжённой системе.
1Н и РСА. При отсутствии N-п-толильного замес-
Молекула гидразонов 2а-h содержит в своей
тителя в амидной группе для продуктов азосоче-
структуре как минимум три оснόвных атома азота,
тания в растворе характерна смесь азо-гидразо
соответственно при подкислении среды картина
таутомеров. Это можно объяснить повышенной
спектра должна меняться. Анализ спектров кислых
кислотностью протона группы СONHAr по сравне-
растворов (0.1 м HCl в 80% метаноле) показывает
нию с СONH2, т.к. ароматический радикал является
гипсохромный сдвиг названной выше К-полосы на
электроноакцепторной группой. Следовательно, N-H
30-40 нм и появление новой полосы поглощения в
связывание в случае N-(п-толил)-замещённых более
области
409-454 нм (log ε
4.18-4.56). Ее
предпочтительно, чем взаимодействие групп NH и
возникновение можно объяснить тем, что при
СО.
протонировании атомов азота возрастает поляр-
Полученные гидразоны, имеющие в своей
ность в цепи сопряжения и соответственно вероят-
структуре изохинолиновый цикл, представляют
ность электронных переходов. Анализ величин λmax
интерес в качестве биологически активных веществ
новой полосы поглощения показывает, что по
и красителей.
сравнению с незамещённым фенилом (426 нм)
акцепторные заместители вызывают гипсохромный
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(409-418 нм), донорные - батохромный (431-454 нм)
сдвиги. Попытка корреляции частот поглощения с
Спектры ЯМР 1Н зарегистрированы в растворе
константами Гаммета не даёт удовлетворительных
CDCl3 на приборе Bruker DRX-500 (500 МГц),
результатов. Вероятно, эффект заместителя зату-
внутренний стандарт ТМС. ИК спектры сняты на
хает вследствие длинной цепи сопряжения, также
спектрометре Specord М-80 в растворе CНCl3 в
трудно говорить о степени протонирования всех
концентрации 0.01 моль/л. Масс-спектры сняты на
атомов азота, в результате выполнение принципа
приборе FINIGAN МАТ INCOS 50 (70 эв, ЭУ).
линейности свободных энергий не наблюдается.
Электронные спектры поглощения гидразонов 2a-h
Отдельно следует отметить свойства соедине-
и 4a-d сняты на приборе UV-1800 Shimadzu в
ний 2b и 4b, содержащих в п-положении нитро-
метаноле в концентрации 2.5×10-5 моль/л, спектры
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
РЕАКЦИЯ АЗОСОЧЕТАНИЯ ЕНАМИНОАМИДОВ
1523
обработаны с помощью программы UV Probe 2.42.
добавлением 0.5 мл концентрированной HCl, смесь
Элементный анализ проводили на приборе СHNS-
охлаждали до
8-10°С, после чего добавляли
932 Leco Corporation.
приготовленную соль диазония. Поддерживая
температуру не выше 10°С, прибавляли медленно
Проверка чистоты полученных веществ
по каплям насыщенный раствор ацетата натрия до
осуществлялась методом ТСХ на пластинах Silufol
рН 8, а затем около 100 мл ледяной воды до
UV-254 в системе ацетон-этанол-хлороформ, пятна
полного выпадения осадка, смесь выдерживали
окрашены в оранжевый цвет.
ещё 30 мин при 20°С. Осадок отфильтровывали,
Cинтез исходных веществ 1 и 3 описан в работе
тщательно промывая водой, сушили и перекрис-
[8]. Все вещества перекристаллизованы из пропан-
таллизовывали. Выход 2.78 г (68%), оранжевые
2-ола.
кристаллы, т.пл. 130-132°С. УФ спектр, λmax (log ε):
202 (4.81), 239 (4.42), 368 (4.46); 0.1 м HCl: 426
Рентгеноструктурный анализ соединения
2c
(4.20). ИК спектр, ν, см-1: 3070 (NH хелат ), 1640
выполнен на монокристальном дифрактометре
(C=N), 1615 (C=O хелат). Cпектр ЯМР 1Н, δ, м.д.:
Xcalibur Ruby с ССD-детектором по стандартной
1.59 c (6H, 2CH3), 2.39 c (3H, CH3-Ar), 2.92 с (2Н,
методике (MoKα-излучение, 295(2) K, ω-сканирова-
Н4), 7.03 - 7.83 м (13Наром), 13.43 c (1H, NH), 14.04
ние с шагом 1°). Поглощение учтено эмпирически
с (1H, NH). Масс-спектр, m/z (Iотн, %): 410 (48) [M]+,
с использованием алгоритма SCALE3 ABSPACK
409 (63) [M - 1]+, 276 (8) [M - C8H8NO(CONHTol)]+,
[10]. Сингония кристалла (C29H30N4O3, M 482.57)
185 (43) [C12H13N2 (3,3-диметил-1-метиленимино-3,4-
моноклинная, пространственная группа P21/n, a
дигидроизохинолин)]+, 158 (7) [C11H12N (3,3-диметил-
9.090(3), b 17.872(5), c 16.472(6) Å, β 101.71(3)°, V
3,4-дигидроизохинолин)]+,
105
(37)
[C7H7N]+,
91
2620.4(15) Å3, Z 4, dвыч 1.223 г/см3; μ 0.081 мм-1.
(42) [C7H7]+, 77 (100) [Ph]+. Найдено, %: С 75.97; Н
Структура расшифрована с помощью программы
6.26; N 13.71. C26H26N4О. Вычислено, %: С 76.07; Н
SHELXS [11] и уточнена полноматричным МНК по
6.38; N 13.65. M 410.21.
F2 в анизотропном приближении для всех нево-
дородных атомов с использованием программы
(Z)-2-(3,3-Диметил-3,4-дигидроизохинолин-1-
SHELXL [12] с графическим интерфейсом OLEX2
ил)-2-[2-(4-нитрофенил)гидразоно]-N-п-
[13]. Атомы водорода групп NH уточнены
толилацетамид
(2b) получили аналогично
независимо в изотропном приближении. При уточ-
гидразону 2a из 1.38 г (10 ммоль) п-нитроанилина
нении остальных атомов водорода использована
и 3.01 г (10 ммоль) амида 1. Раствор соли диазония
модель
«наездника». Окончательные параметры
использовали в виде тонкодисперсной суспензии.
уточнения: R1 0.0766, wR2 0.1864 [для 2144 отра-
Выход 2.87 г (63%), оранжевые кристаллы, т.пл.
жений с I > 2σ(I)], R1 0.2242, wR2 0.2662 (для всех
234-236°С. УФ спектр, λmax (log ε): 202 (4.36), 251
6167 независимых отражений), S 0.977. Результаты
(4.08), 392 (4.20); 0.1 м HCl: 409 (4.54). ИК спектр,
РСА зарегистрированы в Кембриджском центре
ν, см-1: 3040 (NH хелат), 1640 (C=N), 1608 (C=O
кристаллографических данных под номером CCDC
хелат). Cпектр ЯМР 1Н, δ, м.д.: 1.38 c (6H, 2CH3),
1906913 и могут быть запрошены по адресу
2.38 c (3H, CH3-Ar), 2.87 с (2Н, Н4), 7.20-8.32 м
(12Наром), 13.29 c (1H, NH), 14.47 с (1H, NH). Масс-
спектр, m/z (Iотн, %): 455 (32) [M]+, 454 (35) [M - 1]+,
(Z)-2-(3,3-Диметил-3,4-дигидроизохинолин-1-
185 (100) [C12H13N2 (3,3-диметил-1-метиленимино-3,4-
ил)-2-(2-фенилгидразоно)-N-п-толил-ацетамид
дигидроизохинолин)]+, 134 (7) [C8H8NО(CONHTol)]+,
(2а). Диазотирование и азосочетание проводили по
91 (7) [C7H7]+, 43 (6) [CONH]+, 30 (5) [NO]+. Найдено,
общим методикам [2, 3]. Свежеперегнанный анилин
%: С 68.56; Н 5.53; N 15.45. C26H25N5О3. Вычис-
в количестве 10 ммолей (1 мл) смешивали с 10 мл
лено, %: С 68.56; Н 5.53; N 15.37. M 455.20.
водно-спиртовой смеси (1:1 по объёму), добавляли
2 мл концентрированной HCl. К полученному
(Z)-этил
4-{2-[1-(3,3-диметил-3,4-дигидроизо-
раствору гидрохлорида анилина при 3-5°С прибав-
хинолин-1-ил)-2-оксо-2-(п-толиламино)этилиден]-
ляли по каплям раствор 0.94 г (11 моль) нитрита
гидразинил}бензоат
(2с) получили аналогично
натрия в 6-8 мл воды (йодкрахмальная проба).
гидразону 2a из 1.81 г (10 ммоль) этилового эфира
Избыток HNO2 удаляли действием мочевины.
п-аминобензойной кислоты (анестезина) и 3.01 г
Используемый в качестве азосоставляющей
(10 ммоль) амида 1. Выход 3.47 г (63%), оранжевые
енаминоамид 1 в количестве 3.01 г (10 ммоль)
кристаллы, т.пл. 174-176°С. УФ спектр, λmax (log ε):
растворяли в 150 мл водно-спиртовой смеси с
202 (4.83), 239 (4.51), 371 (4.20); 0.1 м HCl: 417
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
1524
МИХАЙЛОВСКИЙ и др.
(4.30). ИК спектр, ν, см-1: 3030 (NH хелат), 1640
(Z)-2-(3,3-Диметил-3,4-дигидроизохинолин-1-
(C=N), 1715 (CО2Et), 1608 (C=O хелат). Cпектр
ил)-N-п-толил-2-(2-м-толигидразоно)-ацетамид
ЯМР 1Н, δ, м.д.: 1.39 c (6H, 2CH3), 1.42 т (3H,
(2f) получили аналогично гидразону 2a из 1.05 г
CH3СН2, J 7.2 Гц), 2.32 c (3H, CH3), 2.83 с (2Н, Н4),
(10 ммоль) п-толуидина и 3.01 г (10 ммоль) амида 1.
4.38 к
(2H, CH3СН2О, J
7.2 Гц),
7.27-8.01 м
Выход 2.62 г (62%), оранжевые кристаллы, т.пл.
(12Наром), 13.18 c (1H, NH), 14.08 с (1H, NH). Масс-
147-148°С. УФ спектр, λmax (log ε): 202 (4.28), 240
спектр, m/z (Iотн, %): 482 (74) [M]+, 481 (100) [M - 1]+,
(4.43), 372 (4.42); 0.1 м HCl: 431 (4.18). ИК спектр,
348 (8) [M - CONHTol]+, 185 (69) [C12H13N2 (3,3-ди-
ν, см-1: 3030 (NH хелат), 1635 (C=N), 1605 (C=O
метил-1-метиленимино-3,4-дигидроизохинолин)]+,
хелат). Cпектр ЯМР 1Н, δ, м.д.: 1.37 c (6H, 2CH3),
158 (12) [C11H12N (3,3-диметил-3,4-дигидроизохино-
2.36 c (3H, CH3-Ar), 2.38 с (3H, CH3-Ar), 2.80 с (2Н,
лин)]+, 149 (56) [C6H4CO2C2H5]+, 133 (18) [CONHTol -
Н4), 7.10-8.05 м (12Наром), 13.45 c (1H, NH), 14.01 с
1]+, 91 (85) [C7H7]+, 43 (21) [CONH]+, 29 (26) [C2H5]+.
(1H, NH). Масс-спектр, m/z (Iотн, %): 424 (55) [M]+,
Найдено, %: С 72.03; Н 6.18; N 11.68. C29H30N4О3.
423 (69) [M - 1]+, 185 (53) [C12H13N2 (3,3-диметил-
Вычислено, %: С 72.18; Н 6.27; N 11.61. M 482.23.
1-метиленимино-3,4-дигидроизохинолин)]+, 158 (7)
[C8H8NО(CONHTol)]+,
91
(100)
[C7H7]+,
43
(7)
(Z)-2-[2-(4-ацетилфенил)гидразоно]-2-(3,3-
[CONH]+. Найдено, %: С 76.15; Н 6.53; N 13.33.
диметил-3,4-дигидроизохинолин-1-ил)-N-п-
C27H28N4О. Вычислено, %: С 76.39; Н 6.65; N 13.20.
толилацетамид (2d) получили аналогично гидра-
M 424.54.
зону 2a из 1.65 г (10 ммоль) п-аминоацетофенона и
3.01 г (10 ммоль) амида 1. Выход 2.76 г (61%),
(Z)-2-[2-(4-бромфенил)гидразоно]-2-(3,3-диме-
оранжевые кристаллы, т.пл. 194-195°С. УФ спектр,
тил-3,4-дигидроизохинолин-1-ил)-N-п-толил-
λmax (log ε): 202 (4.88), 240 (4.51), 376 (4.20); 0.1 м
ацетамид (2g) получили аналогично гидразону 2a
HCl: 418 (4.31). ИК спектр, ν, см-1: 3040 (NH хелат),
из 1.72 г (10 ммоль) п-броманилина и 3.01 г (10 ммоль)
1675 (CОСН3),1640 (C=N), 1608 (C=O хелат). Cпектр
амида 1. Выход 3.61 г (74%), оранжевые кристаллы,
ЯМР 1Н, δ, м.д.: 1.37 c (6H, 2CH3), 2.38 c (3H, CH3-
т.пл. 162-163°С. УФ спектр, λmax (log ε): 203 (4.72),
Ar), 2.76 c (3H, CH3CO), 2.87 с (2Н, Н4), 7.23-8.04 м
240 (4.38), 370 (4.40); 0.1 м HCl: 426 (4.15). ИК
(12Наром), 13.28 c (1H, NH), 14.02 с (1H, NH). Масс-
спектр, ν, см-1: 3020 (NH хелат), 1635 (C=N), 1610
спектр, m/z (Iотн, %): 452 (79) [M]+, 451 (100) [M - 1]+,
(C=O хелат). Cпектр ЯМР 1Н, δ, м.д.: 1.37 c (6H,
185 (69) [C12H13N2 (3,3-диметил-1-метиленимино-
2CH3), 2.38 c (3H, CH3-Ar), 2.80 с (2Н, Н4), 7.04-
3,4-дигидроизохинолин)]+, 158 (8) [C11H12N (3,3-диме-
7.98 м (12Наром), 13.38 c (1H, NH), 14.02 с (1H, NH).
тил-3,4-дигидроизохинолин)]+, 106 (85) [C7H7NH]+,
Масс-спектр, m/z (Iотн, %): 490 (55) [M + 2]+, 489
106 (71) [C7H7NH]+, 91 (85) [C7H7]+, 43 (63) [CONH]+.
(100) [M + 1]+, 488 (72) [M]+, 487 (87) [M - 1]+, 185
Найдено, %: С 74.22; Н 6.21; N 12.42. C28H28N4О2.
(35)
[C12H13N2
(3,3-диметил-1-метиленимино-3,4-
Вычислено, %: С 74.31; Н 6.24; N 12.38. M 452.22.
дигидроизохинолин)]+, 106 (11) [C7H7NH]+, 91 (15)
[C7H7]+, 43 (7) [CONH]+. Найдено, %: С 63.72; Н
(Z)-2-(3,3-Диметил-3,4-дигидроизохинолин-1-
5.03; Br 16.24; N 11.55. C26H25BrN4О. Вычислено,
ил)-N-п-толил-2-(2-п-толигидразоно)-ацетамид
%: С 63.81; Н 5.15; Br 16.33; N 11.45. M 488.12.
(2e) получили аналогично гидразону 2a из 1.05 г
(10 ммоль) п-толуидина и 3.01 г (10 ммоль) амида 1.
(Z)-2-(3,3-Диметил-3,4-дигидроизохинолин-1-
Выход 2.71 г (64%), оранжевые кристаллы, т.пл.
ил)-2-[2-(4-этоксифенил)гидразоно]-N-п-толил-
192-193°С. УФ спектр, λmax (log ε): 202 (4.89), 242
ацетамид (2h) получили аналогично гидразону 2a
(4.46), 375 (4.53); 0.1 м HCl: 438 (4.32). ИК спектр,
из 1.37 г (10 ммоль) п-этоксианилина (п-фенетидина)
ν, см-1: 3030 (NH хелат), 1640 (C=N), 1605 (C=O
и 3.01 г (10 ммоль) амида 1. Выход 3.36 г (74%),
хелат). Cпектр ЯМР 1Н, δ, м.д.: 1.36 c (6H, 2CH3),
оранжевые кристаллы, т.пл. 117-118°С. УФ спектр,
2.35 c (3H, CH3-Ar), 2.38 с (3H, CH3-Ar), 2.86 с
λmax (log ε): 202 (4.79), 249 (4.37), 385 (4.46); 0.1 м
(2Н, Н4), 7.15-7.83 м (12Наром), 13.46 c (1H, NH),
HCl:
454
(4.20). ИК спектр, ν, см-1: 3020 (NH
13.99 с (1H, NH). Масс-спектр, m/z (Iотн, %): 424 (85)
хелат), 1640 (C=N), 1610 (C=O хелат). Cпектр ЯМР
[M]+, 423 (100) [M - 1]+, 185 (32) [C12H13N2 (3,3-ди-
1Н, δ, м.д.: 1.36 c (6H, 2CH3), 1.40 т (3H, CH3СН2, J
метил-1-метиленимино-3,4-дигидроизохинолин)]+,
7.3 Гц), 2.32 c (3H, CH3-Ar), 2.82 с (2Н, Н4), 4.24 к
134 (7) [C8H8NО(CONHTol)]+, 106 (5) [C7H7NH]+,
(2H, CH3СН2О, J 7.3 Гц), 7.17-8.05 м (12Наром),
91 (11) [C7H7]+, 43 (2) [CONH]+. Найдено, %: С
13.15 c (1H, NH), 14.03 с (1H, NH). Масс-спектр, m/z
76.12; Н 6.57; N 13.31. C27H28N4О. Вычислено, %: С
(Iотн, %): 455 (24) [M + 1]+, 454 (94) [M]+, 453 (83)
76.39; Н 6.65; N 13.20. M 424.54.
[M - 1]+, 185 (52) [C12H13N2 (3,3-диметил-1-метилен-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
РЕАКЦИЯ АЗОСОЧЕТАНИЯ ЕНАМИНОАМИДОВ
1525
имино-3,4-дигидроизохинолин)]+, 158 (16) [C11H12N
(4с) получили аналогично гидразону 2а из 1.23 г
(3,3-диметил-3,4-дигидроизохинолин)]+,
121
(68)
(10 ммоль) п-метоксианилина (п-анизидина) и 2.16 г
[C6H4OC2H5]+, 106 (100) [C7H7NH]+, 91 (62) [C7H7]+,
(10 ммоль) амида 3. Выход 2.83 г (81%), оранжевые
43 (17) [CONH]+, 29 (56) [C2H5]+. Найдено, %: С
кристаллы, т.пл. 137-139°С. УФ спектр, λmax (log ε):
73.87; Н 6.58; N 12.47. C28H30N4О2. Вычислено, %:
202 (4.28), 235 (4.23), 360 (4.18). ИК спектр, ν, см-1:
С 73.98; Н 6.65; N 12.33. M 454.24.
3470 (NH в составе NH2), 3130 (NH хелат), 1650
(C=O в составе СОNH2), 1605 (C=O хелат). Cпектр
(Е)-2-[2-(3-бромфенил)гидразоно]-2-(3,3-диме-
ЯМР 1Н, δ, м.д.: 1.23 c (3H, CH3), 1.33 с (3H, CH3),
тил-3,4-дигидроизохинолин-1-ил)ацет-амид (4а)
2.67 с и 2.73 с (2Н, Н4), 3.65 с и 3.69 с (3H, СH3O),
получили аналогично гидразону
2a из
1.72 г
6.13 с (2H, СОNH2), 7.05-8.10 м (8Наром), 10.05 c
(10 ммоль) п-броманилина и 2.16 г (10 ммоль)
(1H, NHцикла), 12.60 c (1H, NH), 13.70 с (1H, NH).
амида
3.
Выход
3.22 г
(81%), оранжевые
Масс-спектр, m/z (Iотн, %): 351 (5) [M + 1]+, 350 (27)
кристаллы, т.пл. 190-191°С. УФ спектр, λmax (log ε):
[M]+, 349 (39) [M - 1]+, 185 (15) [C12H13N2 (3,3-диме-
202 (4.38), 230 (4.28), 347 (4.18). ИК спектр, ν, см-1:
тил-1-метиленимино-3,4-дигидроизохинолин)]+,
3470 (NH в составе NH2), 3120 (NH хелат), 1650
107 (44) [C6H4OCH3]+, 106 (23) [C6H4OCH3 - 1]+, 44
(C=O в составе СОNH2), 1610 (C=O хелат). Cпектр
(100) [CONH2]+, 43 (49) [CONH]+, 28 (16) [СО]+, 15
ЯМР 1Н, δ, м.д.: 1.25 c (3H, CH3), 1.32 с (3H, CH3),
(16) [CH3]+. Найдено, %: С 68.47; Н 6.24; N 16.03.
2.71 с (1Н, Н4), 2.80 с (1Н, Н4), 6.62 с (2H, СОNH2),
C20H22N4О2. Вычислено, %: С 68.55; Н 6.33; N
7.05-8.07 м (8Наром), 10.60 c (1H, NHцикла), 12.50 c
15.99. M 350.17.
(1H, NH), 13.75 с (1H, NH). Масс-спектр, m/z (Iотн,
%): 400 (6) [M + 1]+, 399 (14) [M]+, 397 (12) [M - 2]+,
(Е)-2-(3,3-диметил-3,4-дигидроизохинолин-1-
185 (10) [C12H13N2 (3,3-диметил-1-метиленимино-
ил)-2-[2-(4-этоксифенил)гидразоно]ацетамид
3,4-дигидроизохинолин)]+, 183 (9) [C6H4BrN2]+, 170
(4d) получили аналогично гидразону 2а из 1.35 г
(14) [C12H12N (1,3,3-триметил-3,4-дигидроизохино-
(10 ммоль) п-этоксианилина (п-фенетидина) и 2.16 г
лин)-3Н при С1]+, 158 (5) [C11H12N (3,3-диметил-
(10 ммоль) амида 3. Выход 3.39 г (93%), оранжевые
3,4-дигидроизохинолин)]+,
156
(7)
[C6H4Br]+,
44
кристаллы, т.пл. 153-154°С. УФ спектр, λmax (log ε):
(100) [CONH2]+. Найдено, %: С 57.08; Н 4.67; Br
202 (4.26), 235 (4.27), 360 (4.20). ИК спектр, ν, см-1:
19.88; N 14.12. C19H19BrN4О. Вычислено, %: С
3470 (NH в составе NH2), 3140 (NH хелат), 1650
57.15; Н 4.80; Br 20.01, N 14.03. M 399.28.
(C=O в составе СОNH2), 1605 (C=O хелат). Cпектр
ЯМР 1Н, δ, м.д.: 1.22 т (3H, СH3CH2, J 7.3 Гц), 1.23
(Е)-2-(3,3-диметил-3,4-дигидроизохинолин-1-
c (3H, CH3), 1.33 с (3H, CH3), 2.67 с и 2.73 с (2Н,
ил)-2-[2-(4-нитрофенил)гидразоно]ацетамид (4b)
Н4), 4.01 к (2H,СH3CH2, J 7.3 Гц), 6.13 с (2H,
получили аналогично гидразону
2b из
1.38 г
СОNH2), 7.07-8.17 м (8Наром), 10.15 c (1H, NHцикла),
(10 ммоль) п-нитроанилина и 2.16 г (10 ммоль)
12.60 c (1H, NH), 13.70 с (1H, NH). Масс-спектр, m/z
амида 3. Выход 2.87 г (94%), красные кристаллы, т.
(Iотн, %): 365 (15) [M + 1]+, 364 (72) [M]+, 363 (100)
пл. 197-198°С. λmax (log ε): 202 (4.12), 230 (4.07),
[M - 1]+, 185 (39) [C12H13N2 (3,3-диметил-1-метилен-
347 (4.18). ИК спектр, ν, см-1: 3470 (NH в составе
имино-3,4-дигидроизохинолин)]+, 184 (12) [C12H13N2
NH2),
3180 (NH хелат),
1660 (C=O в составе
(3,3-диметил-1-метиленимино-3,4-дигидроизохи-
СОNH2), 1610 (C=O хелат). Cпектр ЯМР 1Н, δ, м.д.:
нолин - 1]+, 158 (21) [C11H12N]+, 135 (41) [C2H5O·
1.27 c (3H, CH3), 1.32 с (3H, CH3), 2.81 с (1Н, Н4),
C6H4N]+, 121 (15) [C6H4OC2H5]+, 92 (15) [C6H4O]+,
2.83 с (1Н, Н4), 6.03 с (2H, СОNH2), 7.07-8.13 м
44 (83) [CONH2]+, 43 (39) [CONH]+, 15 (6) [CH3]+.
(8Наром), 10.60 c (1H, NHцикла), 12.53 c (1H, NH),
Найдено, %: С 69.12; Н 6.52; N 15.41. C21H24N4О2.
13.90 с (1H, NH). Масс-спектр, m/z (Iотн, %): 365
Вычислено, %: С 69.21; Н 6.64; N 15.37. M 364.19.
(10) [M]+, 364 (21) [M - 1]+, 185 (10) [C12H13N2 (3,3-
диметил-1-метиленимино-3,4-дигидроизохино-
КОНФЛИКТ ИНТЕРЕСОВ
лин)]+, 170 (7) [C12H12N (1,3,3-триметил-3,4-дигидро-
изохинолин)-3Н при С1]+, 44 (100) [CONH2]+, 30
Авторы заявляют об отсутствии конфликта
(63) [NO]+. Найдено, %: С 62.38; Н 5.18; N 19.23.
интересов.
C19H19N5О3. Вычислено, %: С 62.46; Н 5.24; N
19.17. M 365.39.
СПИСОК ЛИТЕРАТУРЫ
(Е)-2-(3,3-диметил-3,4-дигидроизохинолин-1-
1. Шкляев В.С., Александров Б.Б., Вахрин М.И., Легот-
ил)-2-[2-(4-метоксифенил)-гидразоно]ацетамид
кина Г.И. А.с. 852865 (1981). СССР. Б.И. 1981, № 29.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
1526
МИХАЙЛОВСКИЙ и др.
2. Сурикова О.В., Михайловский А.Г., Вихарева Е.В.,
8. Шкляев В.С., Александров Б.Б., Михайловский А.Г.,
Вахрин М.И. ХГС. 2008, 44, 246. [Surikova O.V.,
Вахрин М.И. ХГС. 1989, 25, 1239. [Shklyaev V.S.,
Mikhailovskii A.G., Vikhareva E.V., Vakhrin M.I.
Aleksandrov B.B., Mikhailovskii A.G. Vakhrin M.I.
Chem. Heterocycl. Compd. 2008, 44, 184.] doi 10.1007/
Chem. Heterocycl. Compd.
1989,
25,
1038.] doi
s10593-008-0030-8.
10.1007/BF004873052.
3. Полыгалова Н.Н., Михайловский А.Г., Вахрин М.И.
9. Преч Э., Бюльман Ф., Аффольтер К. Определение
ХГС. 2006, 42, 1382. [Polygalova N.N., Mikhailovs-
строения органических соединений. М.: Мир,
kii A.G., Vakhrin M.I. Chem. Heterocycl. Compd. 2006,
БИНОМ. Лаборатория знаний, 2006, 396. [Pretsch E.,
42, 1200.] doi 10.1007/s10593-006-0226-8
Buhlmann P., Affolter C. Structure determination of
4. Избранные методы синтеза и модификации
organic compounds. Berlin, Heideberg, Springer-
гетероциклов. Ред. Карцев В.Г. М.: ICSPF, 2008, 7
Verlag, 2000.]
(Изохинолины: химия и биологическая активность).
10. CrysAlisPro, Agilent Technologies, Version
5. Избранные методы синтеза и модификации
1.171.37.33 (release 27-03-2014 00 CrysAlis171.NET).
гетероциклов. Ред. Карцев В.Г. М.: ICSPF, 2011, 8
11. Sheldrick G.M. Acta Cryst.
2008, A64,
112. doi
(Природные изохинолины: химия и биологическая
10.1107/S0108767307043930
активность).
12. Sheldrick G.M. Acta Cryst. 2015, C71, 3. doi 10.1107/
6. Китаев Ю.П., Бузыкин Б.И. Гидразоны. М.: Наука,
S2053229614024218
1974.
13. Dolomanov O.V., Bourhis L.J., Gildea R.J, Howard J.A.K.,
7. Машковский М.Д. Лекарственные средства. М.:
Puschmann H. J. Appl. Cryst. 2009, 42, 339. doi
Новая волна, 2012.
10.1107/S0021889808042726.
The Reaction of Azocoupling for Enaminoamides
of 3,3-Dimethyl-1,2,3,4-tetrahydroisoquinoline Series
with Aryldiazonium Salts
A. G. Mikhailovskiia, *, E. S. Pogorelovaa, N. N. Pershinaa, E. N.Liusta, and M. V. Dmitrievb, **
a Perm State Pharmaceutical academy, 614990, Russia, Perm, ul. Polevaya 2
*e-mail: neorghim@pfa.ru
b Perm State National Research University, 614990, Russia, ul. Bukireva 15
**e-mail: koh2@psu.ru
Received April 3, 2019; revised May 14, 2019; accepted May 30, 2019
The reaction of azocoupling for (Z)-2-(3,3-dimethyl-3,4-dihydroisoquinoline-1(2H)-ylidene-N-(p-tolyl)-
acetamide with aryldiazonium salts leads to (Z)-2-(3,3-dimethyl-3,4-dihydroisoquinoline-1-yl)-N-(p-tolyl)-2-(2-
arylhydrazono)-acetamides. The structure of hydrazone is proved by data of NMR 1H and X-ray. In default of N-
p-tolyl-substituent in amide's group the products of azocoupling exist in the solution as azo-hydrazo-tautomers.
The electronic spectrums of absorbtion are researched.
Keywords: (Z)-2-(3,3-Dimethyl-3,4-dihydroisoquinoline-1(2H)-ylidene-N-(p-tolyl)-acetamide, azocoupling
with diazonium salts, (Z)-2-(3,3-dimethyl-3,4-dihydroisoquinoline-1-yl)-N-(p-tolyl)-2-(2-arylhydrazono)-
acetamides, default of N-p-tolyl, azo-hydrazo tautomerism
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019