ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 10, с. 1527-1539
УДК 541.135 + 544.17 + 547.1
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ
4-ФОРМИЛ-2-МЕТОКСИФЕНИЛИЗОНИКОТИНАТА
© 2019 г. В. И. Поткинa, *, Н. А. Бумагинb, **, Е. А. Дикусарa, С. К. Петкевичa, П. В. Курманc
a ГНУ «Институт физико-органической химии НАН Беларуси» (ИФОХ НАН Беларуси),
220072, Беларусь, г. Минск, ул. Сурганова 13
*e-mail: potkin@ifoch.bas-net.by
b ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова», химический факультет,
119991, Москва, Россия, Ленинские горы 1, стр. 3
**e-mail: bna51@mail.ru
c ГНУ «Институт биоорганической химии НАН Беларуси»,
220141, Беларусь, г. Минск, ул. Академика В.Ф. Купревича 5/3
Поступила в редакцию 05 апреля 2019 г.
После доработки 27 июня 2019 г.
Принята к публикации 08 августа 2019 г.
Ацилированием ванилина изоникотиноила хлоридом получен ванилиновый эфир изоникотиновой
кислоты
(4-формил-2-метоксифенилизоникотинат), на основе которого синтезирована серия
функционально замещенных производных, в том числе содержащих изоксазольный и изотиазольный
гетероциклы в молекуле. Конденсацией изоникотината ванилина с аминами синтезированы азометины.
Восстановлением изоникотината ванилина и одного из азометинов на его основе триацетил-
оксиборгидридом натрия получены соответствующие спирт и амин. Ацилирование амино- и
гидроксипроизводных изоникотинатов 5-арилизоксазол- и 4,5-дихлоризотиазолкарбонил хлоридами
приводит к соответствующим сложным эфирам и амидам с остатками изоксазола и изотиазола.
Полученные бигетероциклические соединения легко образуют комплексы с палладием LPdCl2, которые
проявляют высокую каталитическую активность в реакции Сузуки в воде в отсутствие органического
сорастворителя.
Ключевые слова: изоникотиновая кислота, хлорангидрид изоникотиновой кислоты, сложные эфиры,
ванилин, ацилирование, изоксазолы, изотиазолы, амиды.
DOI: 10.1134/S0514749219100069
Пиридиновый гетероцикл широко используется
функционально замещенных производных ванили-
в дизайне и синтезе новых биологически активных
нового эфира изоникотиновой кислоты 1, в том
молекул и входит в структуры большого числа
числе содержащих изоксазольный и изотиазольный
фармацевтических субстанций и агрохимических
гетероциклы. Изоксазольный и изотиазольный
препаратов
[1-6]. Кроме того, пиридин и его
фрагменты могут придать новые полезные свойст-
производные являются широко используемыми
ва их конъюгатам с пиридиновым гетероциклом. В
лигандами для получения комплексов с переход-
ходе предшествующих работ мы установили, что
ными металлами [7], в их ряду комплексы с пал-
производные изоксазола и изотиазола проявляют
ладием являются эффективными катализаторами
синергический эффект в композициях с пирет-
реакций кросс-сочетания в водных средах
роидными и неоникотиноидными инсектицидами,
(«зеленая химия») [8].
а также с химиотерапевтическими препаратами
(цисплатин, карбоплатин и темобел). Это позво-
Ранее мы сообщали о синтезе производных
ляет уменьшить их дозы, что особенно важно в
этилового эфира 2,6-диметил-4-(хлорметил)пири-
химиотерапии опухолей для снижения побочных
дин-3-карбоновой кислоты [9]. В данной работе
токсических эффектов и улучшения качества
представлены результаты исследований по синтезу
жизни пациентов
[10-12]. Кроме того, произ-
1527
1528
ПОТКИН и др.
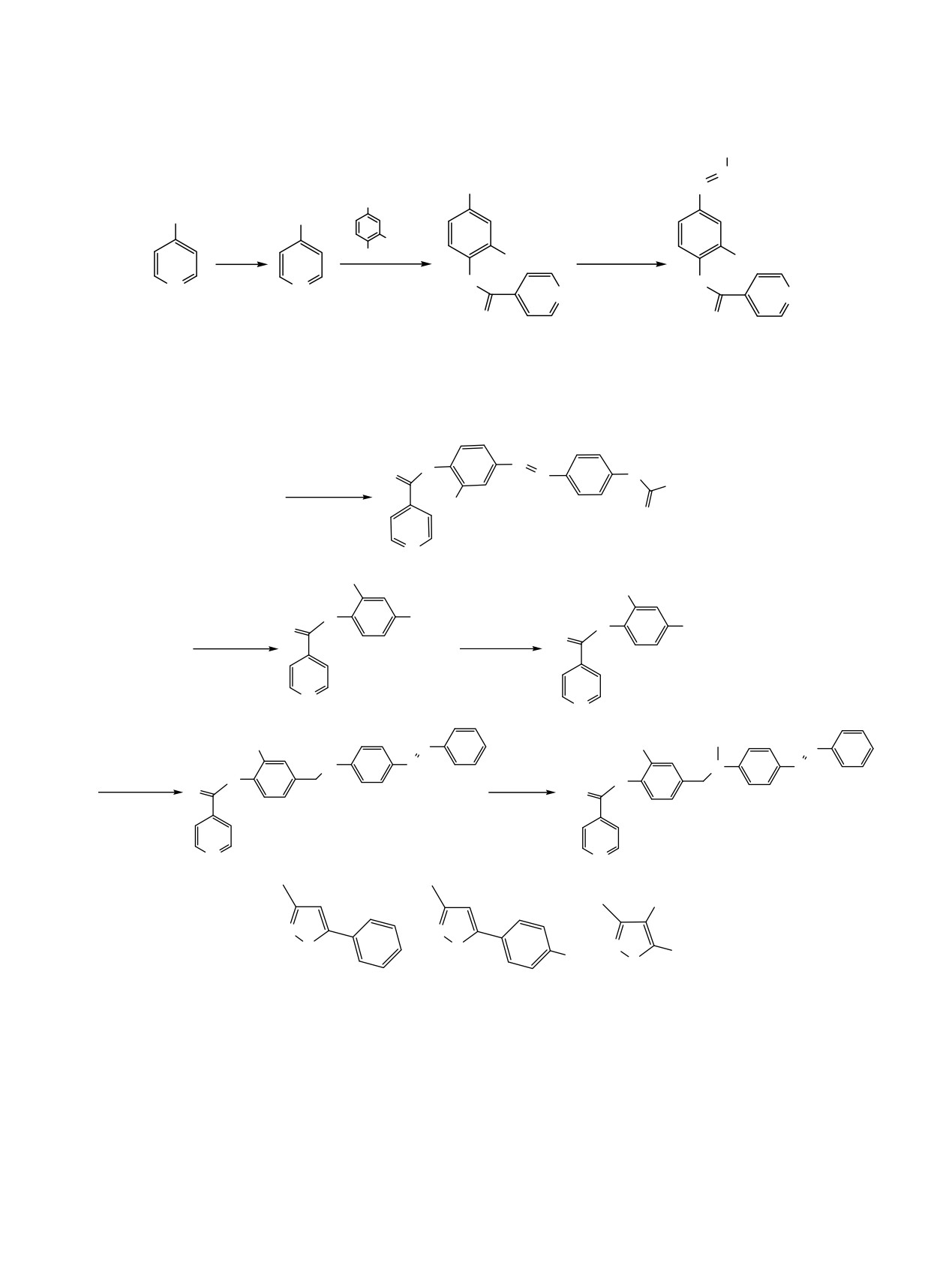
Схема 1.
R1
N
CHO
HC
CHO
CO2H
COCl
OMe
SOCl2
OH
R1NH2
OMe
OMe
CH2Cl2, NEt3
MeOH, AcOH
O
O
N
N
N
N
HCl
O
O
1
2_22
R1 = 4-MeC6H4 (2), 2-HOC6H4 (3), 3-HOC6H4 (4), 4-HOC6H4 (5), 2-MeOC6H4 (6), 3-MeOC6H4 (7), 4-MeOC6H4 (8), 4-
EtOC6H4 (9), 3-HO2CC6H4 (10), 4-HO2CC6H4 (11), 3-EtO2CC6H4 (12), 4-EtO2CC6H4 (13), 4-MeC(O)C6H4 (14), 1-AdCHMe
(15), 4-C6H5C6H4 (16), 2-C10H7 (17), 4-FC6H4 (18), 4-BrC6H4 (19), 4-C6H4N=NC6H4 (20), 4-H2NSO2C6H4 (21), 1-Br-2-C10H6
(22).
H
O
C
O
N
O
R2COCl
R2
5
Et2O, Et3N
MeO
O
N
23_25
MeO
MeO
O
CH2OH
O
O
CH2OC(O)R2
Na[BH(OAc)3]
R2COCl
O
1
C
6H6
Et2O, Et3N
N
N
26
27_29
MeO
MeO
C(O)R2
N
N
HN
N
N
N
Na[BH(OAc)3]
O
R2COCl
O
20
O
O
C6H6
Et2O, Et3N
N
N
30
31_33
Cl
R2 =
N
N
O
O
N
Cl
Me
S
23, 27, 31
24, 28, 32
25, 29, 33
водные изоксазола и изотиазола образуют комп-
Изоникотинат ванилина [4-формил-2-метокси-
лексы с палладием(II), проявляющие высокую
фенилизоникотинат (1)] синтезирован с выходом
каталитическую активность в реакциях кросс-
76% ацилированием ванилина гидрохлоридом
сочетания в водной среде [13, 14].
изоникотиноила хлорида. Полученный эфир 1 при
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ 4-ФОРМИЛ-2-МЕТОКСИФЕНИЛИЗОНИКОТИНАТА
1529
кипячении с аминами в метаноле в присутствии
28, 31, 32 изоксазольный фрагмент характеризует
каталитических количеств уксусной кислоты
синглет с δ 6.51-7.06 м.д. Азометины 2-25 отно-
образует (Е)-азометины 2-22 с выходами 62-79%.
сятся к альдиминам, для которых Е-форма является
предпочтительной, как ранее было установлено в
Восстановлением как самого изоникотината
результате специальных спектроскопических
ванилина 1, так и азометина 20 триацетоксибор-
исследований этой группы веществ [15].
гидридом натрия в среде бензола синтезированы
соответствующие спирт 26 и амин 30. Ацилиро-
Синтезированные соединения содержат в своей
ванием соедиений
5,
26,
30 хлорангидридами
структуре различные фармакофорные фрагменты и
замещенных изоксазол- и изотиазолкарбоновых
представляют интерес для биотестирования и
кислот в диэтиловом эфире в присутствии триэтил-
установления взаимосвязи структура - активность.
амина с выходами
62-90% получены сложные
Их образцы переданы для скрининга пестицидной
эфиры 23-25, 27-29 и амиды 31-33, содержащие
и противоопухолевой активности в профильные
пиридиновый и изоксазольный или изотиазольный
организации, а также использованы в качестве
гетероциклы (схема 1).
лигандов [соединения 25 (L1), 29 (L2), 31 (L3) и 33
(L4)] для получения комплексов палладия и
Состав и строение соединений 1-33 установ-
последующей их оценки в качестве катализаторов
лены на основании данных элементного анализа,
реакции Сузуки.
ИК, ЯМР 1Н, 13С спектроскопии и хроматомасс-
спектрометрии. Следует отметить, что во всех
Cинтез комплексов палладия проводили в среде
превращениях
4-формил-2-метоксифенилизонико-
метанола, в которой смешанные лиганды L1-L4
тината
(1) и его производных
5,
20,
28,
30
обладают достаточной растворимостью. По
сложноэфирный фрагмент сохраняется неизмен-
данным элементного анализа (C, H, N, S)
ным, что подтверждается присутствием в ИК
полученные комплексы, представляющие собой
спектрах полученных веществ характеристической
желто-оранжевые порошки, имеют состав LPdCl2.
полосы валентных колебаний связи С=О в
Для испытания комплексов (L1)PdCl2-(L4)PdCl2 в
интервале 1735-1757 см-1. В ИК спектрах 1,2-
качестве катализаторов реакции Сузуки были
азолсодержащих диэфиров 23-25 с азометиновым
использованы их растворы в ДМФА (0.02 М).
фрагментом полосы С=О колебаний обоих сложно-
Исходя из стоящих перед нами задач по адаптации
эфирных фрагментов проявляются в виде одной
новых катализаторов к водным средам и раз-
обобщенной полосы в области 1738-1755 см-1, а в
работке основ экологически безопасных процессов,
спектрах диэфиров 27-29, а также амидов 31-33
при выборе растворителей для реакции мы
наблюдаются 2 полосы поглощения С=О связей с
ориентировались прежде всего на воду. В качестве
частотами 1743-1753 см-1 и 1645-1740 см-1. В ИК
модельной была выбрана реакция
4-метокси-
спектрах амидов 31-33, как и следовало ожидать,
фенилборной кислоты с 3-бромбензойной кисло-
частота поколебаний полосы поглощения амидной
той. Испытания проводили при 100°С в присутст-
группы существенно ниже, чем сложноэфирной
вии 0.1 мол % комплексов палладия и карбоната
(1645-1660 см-1). В спектрах ЯМР 1Н всех сое-
калия в качестве основания на воздухе в отсутст-
динений 1-33 присутствуют пары дублетов СН
вие инертной атмосферы. Результаты испытания
группировок пиридинового гетероцикла и сигналы
каталитической активности комплексов представ-
заместителей. В спектрах производных 23, 24, 27,
лены на схеме 2.
Схема 2.
CO2H
OMe
CO2H
0.1 мол % Pd
+
K2CO3, H2O
100oC, 15 мин
Br
OMe
B(OH)2
Pd: (L1)PdCl2_(L4)PdCl2
100% (по данным ЯМР 1H)
96_98% (выделено)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
1530
ПОТКИН и др.
Как следует из полученных данных, все
1469, 1423, 1408, 1390, 1325, 1279, 1208, 1188,
испытанные комплексы (L1)PdCl2-(L4)PdCl2 в
1148, 1128, 1099, 1086, 1064, 1028, 1011, 877, 860,
изученных условиях проявляют высокую каталити-
844, 818, 750, 734, 699, 687, 555. Спектр ЯМР 1H
ческую активность. В присутствии всего 0.1 мол %
(500 МГц, CDCl3), δ, м.д.: 3.87 с (3Н, ОМе), 7.34 д
комплексов палладия реакции завершаются пол-
(1Наром, J 7.9 Гц), 7.52 д.д (1Наром, J 7.9, 1.7 Гц), 7.54
ностью за 15 мин при 100°C с количественным
д (1Наром, J 1.7 Гц), 7.99 д.д (2Нпиридин, J 6.0, 1.6 Гц),
выходом продукта кросс-сочетания - 4'-метокси-
8.85 д.д (2Нпиридин, J 6.0, 1.6 Гц), 9.96 с (1Н, CH=О).
[1,1'-бифенил]-3-карбоновой кислоты. Более под-
Спектр ЯМР 13C (125 МГц, CDCl3), δ, м.д.: 56.27
робное изучение палладиевых комплексов синтези-
(ОМе), 111.13 (1СНаром), 123.42 (1СНаром), 123.44
рованных лигандов и их каталитической актив-
(2СНпиридин), 124.78 (1СНаром), 150.99 (2СНпиридин),
ности в реакциях кросс-сочетания является
135.75,
136.21,
144.63,
152.01,
162.86
(5Счетв),
предметом наших дальнейших исследований.
191.05 (СН=О). Найдено, %: С 64.91; H 4.69; N
5.04. [M]+ 257. C14H11NO4. Вычислено, %: С 65.37;
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
H 4.31; N 5.45. М 257.25.
Азометины 2-22 (общая методика). Смесь 0.26 г
ИК спектры соединений записаны на Фурье-
(0.1 ммоль) альдегида 1, 0.11 ммоль соответст-
спектрофотометре Protege-460 фирмы Nikolet
вующего амина и
1 капли ледяной уксусной
(США) в KBr. Спектры ЯМР 1Н и 13С записаны на
кислоты в 30 мл сухого метанола кипятили 2-3 ч.
спектрометре Bruker Avance-500 (Германия).
Горячий раствор охлаждали и оставляли на 10-15 ч
Химические сдвиги измерены относительно
при 0-5°С. Выпавшие осадки азометинов 2-22
остаточных сигналов дейтерированных
отделяли фильтрованием на стеклянном пористом
растворителей: CDCl3 (δН 7.26 м.д., δС 77.2 м.д.);
фильтре, промывали небольшим количеством
ДМСО-d6 (δН 2.50 м.д., δС 40.1 м.д.). Масс-спектры
(2×5-7 мл) холодного метанола и сушили на
получены на приборе Agilent
5975 inert
воздухе.
MSD/6890N Network GC System (США) в режиме
ионизации электронным ударом с энергией
(Е)-2-Метокси-4-(п-толилимино)метилфенил-
электронов 70 эВ; капиллярная колонка HP-5MS
изоникотинат (2). Выход 65%, т.пл. 137-138°С.
(30 м×0.25 мм×0.25 мкм); фаза - 5% PhMe Silicone;
ИК спектр, см-1: 3083, 3033, 2975, 2942, 2920, 2850,
температура испарителя
+250°С. Элементный
1740 (C=O), 1626 (C=N), 1593, 1562, 1508, 1460,
анализ выполняли на CHNS-анализаторе Vario
1411, 1375, 1326, 1276, 1257, 1216, 1196, 1150,
micro cube V1.9.7 (Германия).
1120, 1099, 1063, 1034, 880, 862, 850, 824, 753, 700,
680, 622, 523. Спектр ЯМР 1H (500 МГц, CDCl3), δ,
Все вещества и растворители использовали
м.д.: 2.38 с (3Н, Ме), 3.91 с (3Н, ОМе), 7.15 д
маркой не ниже ч.д.а или х.ч.
(2Наром, J 8.1 Гц), 7.21 д (2Наром, J 8.1 Гц), 7.25 д
Хлорангидриды изоксазол- и изотиазолкарбо-
(1Наром, J 8.1 Гц), 7.39 д.д (1Наром, J 8.1, 1.7 Гц), 7.73
новых кислот получали по методикам [13, 16-18],
д (1Наром, J 1.7 Гц), 8.02 д.д (2Нпиридин, J 6.0, 1.6 Гц),
гидрохлорид хлорангидрида изоникотиновой
8.44 с (1Н, CH=N), 8.86 д.д (2Нпиридин, J 6.0, 1.6 Гц).
кислоты - по методике [19].
Спектр ЯМР 13C (125 МГц, CDCl3), δ, м.д.: 21.16
(Ме),
56.24 (ОМе),
110.77
(1СНаром),
120.96
4-Формил-2-метоксифенилизоникотинат
(1).
(2СНаром), 122.92 (1СНаром), 123.10 (1СНаром), 123.48
К раствору 3.04 г (2.0 ммоль) ванилина и 4.45 г
(2СНпиридин), 129.95 (2СНаром), 150.96 (2СНпиридин),
(4.4 ммоль) триэтиламина в 100 мл CH2Cl2 прибав-
158.49 (СН=N),
135.95,
136.18,
136.56,
142.07,
ляли в один прием 3.74 г (2.1 ммоль) гидрохлорида
149.26, 151.66, 163.21 (7Счетв). Найдено, %: С 72.85;
хлорангидрида изоникотиновой кислоты. Смесь
H 5.22; N 7.75. [M]+ 346. C21H18N2O3. Вычислено,
перемешивали при 20-23°С в течение 10-12 ч,
%: С 72.82; H 5.24; N 8.09. М 346.39.
раствор разбавляли 200 мл воды, органический
слой отделяли, промывали 5%-ным водным раст-
(Е)-4-(2-Гидроксифенил)иминометил-2-ме-
вором NaHCO3
(2×50 мл) и сушили Na2SO4.
токсифенилизоникотинат (3). Выход 67%, т.пл.
Растворитель удаляли, остаток кристаллизовали из
202-203°С. ИК спектр, см-1: 3320, 3084, 3053, 2975,
смеси CH2Cl2 с гексаном. Выход 76%, т.пл. 107-
2943, 2920, 2858, 1744 (C=O), 1626 (C=N), 1601,
108°С. ИК спектр, см-1: 3056, 2970, 2850,
1744
1583, 1512, 1480, 1465, 1416, 1368, 1316, 1289,
(С=O), 1702 (C=O), 1687 (C=O), 1600, 1564, 1505,
1270, 1252, 1223, 1214, 1203, 1160, 1141,
1117,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ 4-ФОРМИЛ-2-МЕТОКСИФЕНИЛИЗОНИКОТИНАТА
1531
1096, 1086, 1064, 1028, 974, 877, 862, 851, 812, 757,
7.73 д (1Наром, J 1.7 Гц), 8.01 д.д (2Нпиридин, J 6.0,
749, 741, 702, 677, 615. Спектр ЯМР 1H (500 МГц,
1.6 Гц), 8.63 с (1Н, CH=N), 8.89 д.д (2Нпиридин, J 6.0,
ДМСО-d6), δ, м.д.: 3.89 с (3Н, ОМе), 6.85 т.д
1.6 Гц), 9.57 с (1Н, ОН). Спектр ЯМР 13C (125 МГц,
(1Наром, J 7.5, 1.3 Гц), 6.92 д.д (1Наром, J 8.0, 1.3 Гц),
ДМСО-d6), δ, м.д.: 56.56 (ОМе), 111.59 (1СНаром),
7.11 т.д (1Наром, J 7.7, 1.5 Гц), 7.26 д.д (1Наром, J 7.8,
116.37 (2СНаром), 122.44 (1СНаром), 123.20 (2СНаром),
1.5 Гц), 7.45 д (1Наром, J 8.1 Гц), 7.63 д.д (1Наром, J
123.61
(2СНпиридин),
123.80
(1СНаром),
151.66
8.1, 1.7 Гц), 7.96 д (1Наром, J 1.7 Гц), 8.03 д.д
(2СНпиридин), 156.89 (СН=N), 136.30, 136.57, 141.59,
(2Нпиридин, J 6.0, 1.6 Гц), 8.75 с (1Н, CH=N), 8.91 д.д
142.99, 151.61, 157.05, 163.47 (7Счетв). Найдено, %:
(2Нпиридин, J 6.0, 1.6 Гц), 9.05 с (1Н, ОН). Спектр
С 69.06; H 4.60; N 7.69. [M]+ 348. C20H16N2O4.
ЯМР 13C (125 МГц, ДМСО-d6), δ, м.д.: 56.74 (ОМе),
Вычислено, %: С 68.96; H 4.63; N 8.04. М 348.36.
112.18 (1СНаром), 116.66 (1СНаром), 119.44 (1СНаром),
(Е)-4-(2-Метоксифенил)иминометил-2-ме-
120.08
(1СНаром),
123.36
(1СНаром),
123.59
токсифенилизоникотинат (6). Выход 69%, т.пл.
(2СНпиридин),
123.65
(1СНаром),
128.27
(1СНаром),
123-124°С. ИК спектр, см-1: 2962,
2931,
1737
151.65 (2СНпиридин), 158.72 (СН=N), 136.29, 136.46,
(C=O), 1630 (C=N), 1588, 1507, 1496, 1461, 1413,
137.97, 141.91, 151.61, 151.98, 163.43 (7Счетв). Найде-
1285, 1253, 1217, 1196, 1154, 1129, 1115, 1028, 860,
но, %: С 68.61; H 4.73; N 7.74. [M]+ 348. C20H16N2O4.
807, 752, 736, 698, 620. Спектр ЯМР 1H (500 МГц,
Вычислено, %: С 68.96; H 4.63; N 8.04. М 348.36.
CDCl3), δ, м.д.: 3.88 с (3Н, ОМе), 3.90 с (3Н, ОМе),
(Е)-4-(3-Гидроксифенил)иминометил-2-ме-
6.93-7.03 м (3Наром), 7.19 т.д (1Наром, J 8.0, 1.6 Гц),
токсифенилизоникотинат (4). Выход 66%, т.пл.
7.24 д (1Наром, J 8.0 Гц), 7.40 д.д (1Наром, J 8.0, 1.4 Гц),
200-201°С. ИК спектр, см-1: 3123, 3105, 3073, 3062,
7.44 д (1Наром, J 1.1 Гц), 8.01 д (2Нпиридин, J 6.0 Гц),
3004, 2975, 2955, 2933, 2871, 2838, 2679,
1749
8.45 с (1Н, CH=N), 8.85 д (2Нпиридин, J 6.0 Гц).
(C=O), 1743 (C=O), 1602, 1580, 1509, 1495, 1479,
Спектр ЯМР 13C (125 МГц, CDCl3), δ, м.д.: 55.94
1462, 1449, 1412, 1348, 1313, 1280, 1270, 1256,
(ОМе),
56.29 (ОМе),
110.92
(1СНаром),
111.66
1228, 1187, 1161, 1151, 1135, 1111, 1087, 1074,
(1СНаром), 120.56 (1СНаром), 121.17 (1СНаром), 122.85
1060, 1032, 1008, 996, 972, 957, 878, 862, 851, 823,
(1СНаром),
123.32
(1СНаром),
123.45
(2СНпиридин),
818, 784, 754, 738, 698, 684. Спектр ЯМР 1H (500 МГц,
126.94
(1СНаром),
150.92
(2СНпиридин),
160.51
ДМСО-d6), δ, м.д.: 3.86 с (3Н, ОМе), 6.65-6.73 м
(СН=N),
135.89,
136.53,
141.64,
142.18,
151.63,
(3Наром), 7.21 т (1Наром, J 8.0 Гц), 7.45 д (1Наром, J
152.23, 163.15 (7Счетв). Найдено, %: С 69.51; H 5.03;
8.1 Гц), 7.58 д.д (1Наром, J 8.2, 1.7 Гц), 7.75 д
N 7.25. [M]+ 362. C21H18N2O4. Вычислено, %: С
(1Наром, J 1.7 Гц), 8.01 д.д (2Нпиридин, J 6.0, 1.6 Гц),
69.60; H 5.01; N 7.73. М 362.38.
8.59 с (1Н, CH=N), 8.90 д.д (2Нпиридин, J 6.0, 1.6 Гц),
(Е)-4-(3-Метоксифенил)иминометил-2-ме-
9.57 с (1Н, ОН). Спектр ЯМР 13C (125 МГц, ДМСО-
токсифенилизоникотинат (7). Выход 66%, т.пл.
d6), δ, м.д.: 56.61 (ОМе), 108.47 (1СНаром), 112.00
93-94°С. ИК спектр, см-1: 3053, 3026, 2931, 2853,
(1СНаром), 112.29 (1СНаром), 113.77 (1СНаром), 122.91
2831, 1743, 1632, 1597, 1582, 1563, 1506, 1482,
(1СНаром),
123.60
(2СНпиридин),
123.85
(1СНаром),
1459, 1413, 1371, 1285, 1257, 1203, 1157, 1141,
130.52 (1СНаром), 151.65 (2СНпиридин), 160.03 (СН=N),
1099, 1052, 1031, 928, 867, 750, 687, 555. Спектр
136.09,
136.27,
142.03,
151.65,
153.25,
158.73,
ЯМР 1H (500 МГц, CDCl3), δ, м.д.: 3.85 с (3Н,
163.42 (7Счетв). Найдено, %: С 69.20; H 5.08; N 7.59.
ОМе), 3.91 с (3Н, ОМе), 6.78-6.83 м (3Наром), 7.27 д
[M]+ 348. C20H16N2O4. Вычислено, %: С 68.96; H
(1Наром, J 8.0 Гц), 7.30 т (1Наром, J 8.0 Гц), 7.41 д.д
4.63; N 8.04. М 348.36.
(1Наром, J 8.1, 1.7 Гц), 7.73 д (1Наром, J 1.6 Гц), 8.03
(Е)-4-(4-Гидроксифенил)иминометил-2-ме-
д.д (2Нпиридин, J 6.0, 1.6 Гц), 8.44 с (1Н, CH=N), 8.87
токсифенилизоникотинат (5). Выход 70%, т.пл.
д.д (2Нпиридин, J 6.0, 1.6 Гц). Спектр ЯМР 13C (125 МГц,
188-189°С. ИК спектр, см-1: 3067, 3042, 3016, 2948,
CDCl3), δ, м.д.: 55.49 (ОМе), 56.26 (ОМе), 106.81
2865, 2802, 2678, 1757 (C=O), 1626 (C=N), 1587,
(1СНаром), 110.86 (1СНаром), 112.11 (1СНаром), 113.01
1567, 1506, 1463, 1450, 1412, 1369, 1279, 1257,
(1СНаром), 122.98 (1СНаром), 123.30 (1СНаром), 123.52
1202, 1148, 1122, 1096, 1083, 1060, 1031, 1004, 971,
(2СНпиридин), 130.11 (1СНаром), 150.95 (2СНпиридин),
858, 831, 820, 809, 748, 693, 626, 528. Спектр ЯМР
159.51 (СН=N),
135.70,
136.57,
142.28,
151.71,
1H (500 МГц, ДМСО-d6), δ, м.д.: 3.85 с (3Н, ОМе),
153.32, 160.51, 163.19 (7Счетв). Найдено, %: С 69.68;
6.83 д (2Наром, J 8.7 Гц), 7.23 д (2Наром, J 8.7 Гц),
H 5.13; N 7.26. [M]+ 362. C21H18N2O4. Вычислено,
7.42 д (1Наром, J 8.2 Гц), 7.53 д.д (1Наром, J 8.2, 1.7 Гц),
%: С 69.60; H 5.01;N 7.73. М 362.38.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
1532
ПОТКИН и др.
(Е)-4-(4-Метоксифенил)иминометил-2-ме-
м (2Наром), 7.64 д.д (1Наром, J 8.2, 1.7 Гц), 7.79-7.83
токсифенилизоникотинат (8). Выход 70%, т.пл.
м (2Наром), 7.83-7.87 м (1Наром), 8.03 д.д (2Нпиридин, J
146-147°С. ИК спектр, см-1: 3033, 3008, 2963, 2929,
6.0, 1.6 Гц), 8.72 с (1Н, CH=N), 8.91 д.д (2Нпиридин, J
2833, 1739 (C=O), 1625 (C=N), 1605, 1587, 1509,
6.0, 1.6 Гц), 13.02 уш.с (1Н, СООН). Спектр ЯМР
1466, 1451, 1412, 1373, 1306, 1274, 1253, 1217,
13C
(125 МГц, ДМСО-d6), δ, м.д.: 56.63 (ОМе),
1198, 1150, 1121, 1098, 1036, 970, 880, 863, 827, 777,
112.27 (1СНаром), 121.96 (1СНаром), 123.08 (1СНаром),
750, 699, 683, 623, 523. Спектр ЯМР 1H (500 МГц,
123.60
(2СНпиридин),
123.92
(1СНаром),
126.38
CDCl3), δ, м.д.: 3.84 с (3Н, ОМе), 3.92 с (3Н, ОМе),
(1СНаром), 127.44 (1СНаром), 130.17 (1СНаром), 151.67
6.94 д (2Наром, J 8.9 Гц), 7.23-7.26 м (3Наром), 7.39
(2СНпиридин), 161.59 (СН=N), 132.55, 135.89, 136.24,
д.д (1Наром, J 8.1, 1.7 Гц), 7.72 д (1Наром, J 8.1 Гц),
142.23,
151.67,
151.97,
163.39,
167.65
(8Счетв).
8.02 д.д (2Нпиридин, J 6.0, 1.6 Гц), 8.46 с (1Н, CH=N),
Найдено, %: С 66.74; H 4.37; N 6.86. [M]+ 376.
8.87 д.д (2Нпиридин, J 6.0, 1.6 Гц). Спектр ЯМР 13C
C21H16N2O5. Вычислено, %: С 67.02; H 4.29; N 7.44.
(125 МГц, CDCl3), δ, м.д.: 55.65 (ОМе),
56.25
М 376.37.
(ОМе), 110.64 (1СНаром), 114.57 (2СНаром), 122.39
(Е)-4-(4-Изоникотиноилокси)-3-метоксибен-
(2СНаром), 122.92 (1СНаром), 122.96 (1СНаром), 123.52
зилиденаминобензойная кислота
(11). Выход
(2СНпиридин),
150.98
(2СНпиридин), 157.32 (СН=N),
79%, т.пл. 272-273°С. ИК спектр, см-1: 3072, 2923,
136.07,
136.59,
141.93,
144.69,
151.66,
158.58,
2854, 2657, 2544, 1736 (C=O), 1693 (C=O), 1588,
163.25 (7Счетв). Найдено, %: С 69.74; H 4.98; N 7.37.
1567, 1508, 1422, 1315, 1282, 1274, 1262, 1214,
[M]+ 362. C21H18N2O4. Вычислено, %: С 69.60; H
1204, 1156, 1123, 1095, 1085, 1032, 871, 747, 698,
5.01; N 7.73. М 362.38.
547. Спектр ЯМР 1H (500 МГц, ДМСО-d6), δ, м.д.:
(Е)-2-Метокси-4-(4-этоксифенил)иминоме-
3.87 с (3Н, ОМе), 7.34 д (2Наром, J 8.4 Гц), 7.48 д
тилфенилизоникотинат
(9). Выход
72%, т.пл.
(1Наром, J 8.1 Гц), 7.62 д.д (1Наром, J 8.1, 1.4 Гц), 7.78
159-160°С. ИК спектр, см-1: 2976, 2944, 2922, 2879,
д (1Наром, J 1.4 Гц), 7.98-8.05 м (2Наром, + 2Нпиридин),
1749 (C=O), 1625 (C=N), 1602, 1587, 1515, 1504,
8.65 с (1Н, CH=N), 8.90 д (2Нпиридин, J 5.8 Гц).
1476, 1466, 1456, 1443, 1408, 1324, 1316, 1299,
Спектр ЯМР 13C (125 МГц, ДМСО-d6), δ, м.д.:
1269, 1253, 1244, 1218, 1196, 1167, 1110, 1093,
56.65 (ОМе),
112.21
(1СНаром),
121.63
(2СНаром),
1081, 1072, 1060, 1043, 1030, 874, 850, 835, 795, 752,
123.35
(1СНаром),
123.60
(2СНпиридин),
123.98
702, 680, 615, 553, 530. Спектр ЯМР 1H (500 МГц,
(1СНаром),
131.24
(2СНаром),
151.66
(2СНпиридин),
ДМСО-d6), δ, м.д.: 1.34 т (3Н, Ме, J 7.1 Гц), 3.86 с
162.10 (СН=N),
128.66,
135.75,
136.23,
142.42,
(3Н, ОМе), 4.04 к (2Н, СН2, J 7.1 Гц), 6.98 д (2Наром,
151.71, 155.82, 163.38, 167.61 (8Счетв). Найдено, %:
J 8.9 Гц), 7.31 д (2Наром, J 8.9 Гц), 7.44 д (1Наром, J
С 67.18; H 4.29; N 7.06. [M]+ 376. C21H16N2O5.
8.1 Гц), 7.56 д.д (1Наром, J 8.2, 1.6 Гц), 7.74 д
Вычислено, %: С 67.02; H 4.29; N 7.44. М 376.37.
(1Наром, J 1.6 Гц), 8.02 д.д (2Нпиридин, J 6.0, 1.6 Гц),
(Е)-2-Метокси-4-(3-этоксикарбонилфенил)-
8.66 с (1Н, CH=N), 8.90 д.д (2Нпиридин, J 6.0, 1.6 Гц).
иминометилфенилизоникотинат
(12).
Выход
Спектр ЯМР 13C (125 МГц, ДМСО-d6), δ, м.д.:
65%, т.пл. 79-80°С. ИК спектр, см-1: 2991, 2931,
15.25 (Ме),
56.56 (ОМе),
63.81 (СН2),
111.70
1739 (C=O), 1725 (C=O), 1633 (C=N), 1595, 1578,
(1СНаром), 115.48 (2СНаром), 122.55 (1СНаром), 123.05
1566, 1509, 1475, 1418, 1372, 1298, 1273, 1205,
(2СНаром),
123.56
(2СНпиридин),
123.79
(1СНаром),
1156, 1128, 1083, 1063, 1025, 768, 754, 742, 699,
151.63 (2СНпиридин), 157.96 (СН=N), 136.26, 136.38,
684, 623. Спектр ЯМР 1H (500 МГц, ДМСО-d6), δ,
141.70,
144.32,
151.59,
157.91,
163.40
(7Счетв).
м.д.: 1.34 т (3Н, Ме, J 7.1 Гц), 3.87 с (3Н, ОМе),
Найдено, %: С 70.32; H 5.35; N 7.01. [M]+ 376.
4.34 к (2Н, СН2, J 7.1 Гц), 7.48 д (1Наром, J 8.1 Гц),
C22H20N2O4. Вычислено, %: С 70.20; H 5.36; N 7.44.
7.56-7.60 м (2Наром), 7.63 д.д (1Наром, J 8.2, 1.7 Гц),
М 376.41.
7.79-7.83 м (2Наром), 7.84-7.87 м (1Наром), 8.02 д.д
(Е)-3-(4-Изоникотиноилокси)-3-метоксибен-
(2Нпиридин, J 6.0, 1.6 Гц), 8.71 с (1Н, CH=N), 8.91 д.д
зилиденаминобензойная кислота
(10). Выход
(2Нпиридин, J 6.0, 1.6 Гц). Спектр ЯМР 13C (125 МГц,
77%, т.пл. 223-224°С. ИК спектр, см-1: 3072, 2923,
ДМСО-d6), δ, м.д.: 14.74 (Ме), 56.64 (ОМе), 61.50
2854, 2657, 2544, 1736 (C=O), 1693 (C=O), 1588,
(СН2),
112.24
(1СНаром),
122.01
(1СНаром),
123.16
1567, 1508, 1422, 1315, 1282, 1274, 1262, 1214,
(1СНаром),
123.59
(2СНпиридин),
123.92
(1СНаром),
1204, 1156, 1123, 1095, 1085, 1032, 871, 747, 698,
126.45 (1СНаром), 127.22 (1СНаром), 130.35 (1СНаром),
547. Спектр ЯМР 1H (500 МГц, ДМСО-d6), δ, м.д.:
151.67 (2СНпиридин), 161.78 (СН=N), 131.63, 135.84,
3.87 с (3Н, ОМе), 7.48 д (1Наром, J 8.1 Гц), 7.54-7.59
136.24,
142.28,
151.67,
152.09,
163.39,
166.07
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ 4-ФОРМИЛ-2-МЕТОКСИФЕНИЛИЗОНИКОТИНАТА
1533
(8Счетв). Найдено, %: С 68.45, H 5.06, N 6.39. [M]+
1360, 1346, 1325, 1313, 1285, 1248, 1210, 1196,
404. C23H20N2O5. Вычислено, %: С 68.31; H 4.98; N
1158, 1121, 1102, 1092, 1079, 1064, 1034, 966, 852,
6.93. М 404.42.
827, 814, 758, 707, 682, 677. Спектр ЯМР 1H (500 МГц,
ДМСО-d6), δ, м.д.: 1.03 д (3Н, Ме, J 6.5 Гц), 1.43-
(Е)-2-Метокси-4-(4-этоксикарбонилфенил)-
1.68 м (12Н, 6СН2), 1.92 уш.с (3Н, 3СН), 2.71 к (1Н,
иминометилфенилизоникотинат
(13).
Выход
СН-Ме, J 6.5 Гц), 3.79 с (3Н, ОМе), 6.81 д (1Наром, J
65%, т.пл. 135-136°С. ИК спектр, см-1: 2974, 2926,
8.0 Гц), 7.12 д.д (1Наром, J 8.0, 1.7 Гц), 7.29 д
1736 (C=O), 1716 (C=O), 1632 (C=N), 1594, 1565,
(1Наром, J 1.7 Гц), 7.83 д.д (2Нпиридин, J 6.0, 1.6 Гц),
1508, 1474, 1413, 1377, 1281, 1220, 1201, 1158,
8.07 с (1Н, CH=N), 8.80 д.д (2Нпиридин, J 6.0, 1.6 Гц).
1125, 1064, 1033, 983, 865, 851, 775, 746, 699, 619.
Спектр ЯМР 13C (125 МГц, ДМСО-d6), δ, м.д.:
Спектр ЯМР 1H (500 МГц, ДМСО-d6), δ, м.д.: 1.34 т
16.56 (Ме), 28.57 (3СН), 37.47 (3СН2), 39.23 (3СН2),
(3Н, Ме, J 7.1 Гц), 3.87 с (3Н, ОМе), 4.32 к (2Н,
56.10 (ОМе),
75.37 (СН-Ме),
111.03
(1СНаром),
СН2, J 7.1 Гц), 7.37 д (2Наром, J 8.5 Гц), 7.49 д
115.83
(1СНаром),
122.61
(1СНаром),
123.09
(1Наром, J 8.1 Гц), 7.63 д.д (1Наром, J 8.1, 1.7 Гц), 7.79
(2СНпиридин),
151.35
(2СНпиридин), 158.71 (СН=N),
д (1Наром, J 1.7 Гц), 7.99-8.06 м (2Наром, + 2Нпиридин),
36.05, 128.70, 137.34, 148.36, 149.61, 151.35 (6Счетв).
8.67 с (1Н, CH=N), 8.91 д.д (2Нпиридин, J 6.0, 1.6 Гц).
Найдено, %: С 74.50; H 7.77; N 6.43. [M]+ 418.
Спектр ЯМР 13C (125 МГц, ДМСО-d6), δ, м.д.:
C26H30N2O3. Вычислено, %: С 74.61; H 7.23; N 6.69.
14.79 (Ме),
56.66 (ОМе),
61.26 (СН2),
112.24
М 418.54.
(1СНаром), 121.79 (2СНаром), 123.39 (1СНаром), 123.60
(2СНпиридин),
124.00
(1СНаром),
131.06
(2СНаром),
4-(Е)-[(1,1'-Бифенил)-4-ил]иминометил-2-ме-
токсифенилизоникотинат (16). Выход 69%, т.пл.
151.68 (2СНпиридин), 162.30 (СН=N), 127.72, 135.69,
191-192°С. ИК спектр, см-1: 3073, 3054, 3006, 2965,
136.22,
142.45,
151.71,
156.08,
163.38,
166.00
(8Счетв). Найдено, %: С 68.75; H 4.93; N 6.55. [M]+
2940, 2916, 2842, 1750 (C=O), 1627 (C=N), 1599,
1581, 1564, 1511, 1487, 1462, 1450, 1410, 1316,
404. C23H20N2O5. Вычислено, %: С 68.31; H 4.98; N
1294, 1264, 1224, 1192, 1156, 1111, 1080, 1059,
6.93. М 404.42.
1030, 973, 877, 841, 767, 747, 697, 676, 663, 612,
(Е)-4-(4-Ацетилфенил)иминометил-2-ме-
516. Спектр ЯМР 1H (500 МГц, ДМСО-d6), δ, м.д.:
токсифенилизоникотинат (14). Выход 62%, т.пл.
3.88 с (3Н, ОМе), 7.37 т (1Наром, J 7.4 Гц), 7.41 д
157-158°С. ИК спектр, см-1: 3058, 3046, 3033, 2925,
(2Наром, J 8.4 Гц), 7.46-7.51 м (3Наром), 7.62 д.д
2858, 2833, 1737 (C=O), 1679 (C=O), 1671 (C=O),
(1Наром, J 8.2, 1.7 Гц), 7.7.70-7.74 м (2Наром), 7.75 д
1631 (C=N), 1589, 1564, 1508, 1477, 1413, 1371,
(2Наром, J 8.4 Гц), 7.80 д (1Наром, J 1.7 Гц), 8.03 д.д
1357, 1325, 1276, 1226, 1206, 1156, 1123, 1095,
(2Нпиридин, J 6.0, 1.6 Гц), 8.73 с (1Н, CH=N), 8.91 д.д
1064, 1030, 978, 871, 835, 788, 750, 697, 679, 617,
(2Нпиридин, J 6.0, 1.6 Гц). Спектр ЯМР 13C (125 МГц,
563. Спектр ЯМР 1H (500 МГц, ДМСО-d6), δ, м.д.:
ДМСО-d6), δ, м.д.: 56.64 (ОМе), 112.02 (1СНаром),
2.60 с (3Н, Ме), 3.87 с (3Н, ОМе), 7.37 д (2Наром, J
122.32
(2СНаром),
123.02
(1СНаром),
123.59
8.5 Гц), 7.49 д (1Наром, J 8.1 Гц), 7.63 д.д (1Наром, J
(2СНпиридин),
123.91
(1СНаром),
127.06
(2СНаром),
8.2, 1.7 Гц), 7.79 д (1Наром, J 1.7 Гц), 8.00-8.06 м
127.97 (1СНаром), 128.08 (2СНаром), 129.55 (2СНаром),
(2Наром, + 2Нпиридин), 8.67 с (1Н, CH=N), 8.91 д.д
151.67 (2СНпиридин), 160.39 (СН=N), 136.10, 136.25,
(2Нпиридин, J 6.0, 1.6 Гц). Спектр ЯМР 13C (125 МГц,
138.55,
140.13,
142.09,
151.00,
151.67,
163.41
ДМСО-d6), δ, м.д.: 27.26 (Ме), 56.65 (ОМе), 112.22
(8Счетв). Найдено, %: С 76.46; H 4.95; N 6.41. [M]+
(1СНаром), 121.69 (2СНаром), 123.39 (1СНаром), 123.59
408. C26H20N2O3. Вычислено, %: С 76.46; H 4.94; N
(2СНпиридин),
123.98
(1СНаром),
130.24
(2СНаром),
6.86. М 408.46.
151.66 (2СНпиридин), 162.21 (СН=N), 134.91, 135.70,
(Е)-2-Метокси-4-(нафталин-2-илимино)ме-
136.21,
142.44,
151.70,
156.02,
163.36,
197.56
тилфенилизоникотинат (17). Выход 71%, т.пл.
(8Счетв). Найдено, %: С 70.51; H 4.85; N 7.01. [M]+
158-159°С. ИК спектр, см-1: 3088, 3050, 2965, 2935,
374. C22H18N2O4. Вычислено, %: С 70.58; H 4.85; N
1736 (C=O), 1617, 1586, 1560, 1505, 1469, 1453,
7.48. М 374.40.
1410, 1275, 1259, 1194, 1165, 1149, 1114, 1092,
(Е)-4-[1-(Адамантан-1-ил)этил]иминометил-
1032, 889, 823, 751, 700, 680, 476. Спектр ЯМР 1H
2-метоксифенилизоникотинат (15). Выход 66%,
(500 МГц, ДМСО-d6), δ, м.д.: 3.89 с (3Н, ОМе),
т.пл. 34-35°С. ИК спектр, см-1: 3068, 3031, 2964,
7.47-7.51 м (2Наром), 7.53 т.д (1Наром, J 8.1, 1.4 Гц),
2903, 2846, 2658, 1735 (C=O), 1642 (C=N), 1602,
7.56 д.д (1Наром, J 8.7, 2.1 Гц), 7.65 д.д (1Наром, J 8.2,
1563, 1515, 1464, 1451, 1434, 1408, 1384, 1375,
1.7 Гц), 7.78 д (1Наром, J 1.9 Гц), 7.84 д (1Наром, J
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
1534
ПОТКИН и др.
1.7 Гц), 7.94 т (2Наром, J 7.1 Гц), 7.98 д (1Наром, J
151.66, 163.37 (7Счетв). Найдено, %: С 58.69; H 3.73;
8.7 Гц), 8.03 д.д (2Нпиридин, J 6.0, 1.6 Гц), 8.81 с (1Н,
N 6.37. [M]+ 411. C20H15BrN2O3. Вычислено, %: С
CH=N), 8.91 д.д (2Нпиридин, J 6.0, 1.6 Гц). Спектр
58.41; H 3.68; N 6.81. М 411.26.
ЯМР 13C (125 МГц, ДМСО-d6), δ, м.д.: 56.61 (ОМе),
2-Метокси-4-[(1Е)-(4-фенилдиазенил)фенил-
112.01 (1СНаром), 118.78 (1СНаром), 121.64 (1СНаром),
иминометил]фенилизоникотинат
(20). Выход
123.02
(1СНаром),
123.58
(2СНпиридин),
123.92
69%, т.пл. 184-185°С. ИК спектр, см-1: 3030, 2925,
(1СНаром), 126.11 (1СНаром), 127.11 (1СНаром), 128.21
2868, 1748 (C=O), 1625 (C=N), 1586, 1505, 1472,
(1СНаром), 128.44 (1СНаром), 129.52 (1СНаром), 151.64
1416, 1409, 1367, 1271, 1252, 1217, 1199, 1150,
(2СНпиридин), 160.66 (СН=N), 132.20, 134.27, 136.14,
1118, 1083, 1059, 1030, 968, 871, 847, 779, 754, 697,
136.24,
142.11,
149.34,
151.64,
163.40
(8Счетв).
680, 617, 552. Спектр ЯМР 1H (500 МГц, CDCl3), δ,
Найдено, %: С 75.47; H 4.74; N 6.95. [M]+ 382.
м.д.: 3.93 с (3Н, ОМе), 7.29 д (1Наром, J 8.0 Гц), 7.35
C24H18N2O3. Вычислено, %: С 75.38; H 4.74; N 7.33.
д (2Наром, J 8.6 Гц), 7.44 д.д (1Наром, J 8.1, 1.6 Гц),
М 382.42.
7.45 т (1Наром, J 7.3 Гц), 7.52 т (2Наром, J 7.4 Гц),
(Е)-4-(4-Фторфенил)иминометил-2-метокси-
7.76 д (1Наром, J 1.6 Гц), 7.93 д (2Наром, J 7.3 Гц),
фенилизоникотинат (18). Выход 69%, т.пл. 151-
8.00 д (2Наром, J 8.6 Гц), 8.03 д.д (2Нпиридин, J 5.9,
152°С. ИК спектр, см-1: 3033, 2970, 2933, 2874,
1.5 Гц), 8.48 с (1Н, CH=N), 8.87 д (2Нпиридин, J
2851, 1736 (C=O), 1630 (C=N), 1602, 1593, 1565,
5.9 Гц). Спектр ЯМР 13C (125 МГц, CDCl3), δ, м.д.:
1510, 1501, 1460, 1414, 1369, 1329, 1282, 1261,
56.26 (ОМе),
110.96
(1СНаром),
121.76
(2СНаром),
1232, 1216, 1200, 1150, 1128, 1099, 1063, 1035, 978,
122.96
(2СНаром),
123.07
(1СНаром),
123.49
866, 858, 833, 805, 783, 751, 699, 684, 619, 523.
(2СНпиридин),
123.52
(1СНаром),
124.27
(2СНаром),
Спектр ЯМР 1H (500 МГц, ДМСО-d6), δ, м.д.: 3.86 с
129.24
(2СНаром),
131.04
(1СНаром),
151.98
(3Н, ОМе), 7.27 т (2Наром, J 8.8 Гц), 7.33-7.39 м
(2СНпиридин), 159.92 (СН=N), 135.53, 136.49, 142.53,
(2Наром, J 8.1 Гц), 7.47 д (1Наром, J 8.1 Гц), 7.59 д.д
151.02,
151.76,
152.85,
154.19,
163.17
(8Счетв).
(1Наром, J 8.1, 1.7 Гц), 7.76 д (1Наром, J 1.7 Гц), 8.02
Найдено, %: С 71.85; H 4.63; N 12.75. [M]+ 436.
д.д (2Нпиридин, J 6.0, 1.6 Гц), 8.66 с (1Н, CH=N), 8.91
C26H20N4O3. Вычислено, %: С 71.55; H 4.62; N
д.д (2Нпиридин, J 6.0,
1.6 Гц). Спектр ЯМР 13C
12.84. М 436.47.
(125 МГц, ДМСО-d6), δ, м.д.: 56.61 (ОМе), 111.95
(1СНаром), 116.49 д (2СНаром, J 22.4 Гц),
122.95
(Е)-2-Метокси-4-(4-сульфоноилфенилимино-
(1СНаром), 123.44 д (2СНаром, J 8.4 Гц),
123.58
метил)фенилизоникотинат (21). Выход 68%, т.пл.
(2СНпиридин), 123.88 (1СНаром), 151.64 (2СНпиридин),
216-217°С. ИК спектр, см-1: 3317, 3073, 3055, 3019,
160.50 (СН=N), 135.98, 136.24, 142.06, 148.12 д (J
2969, 2938, 1741 (C=O), 1625 (C=N), 1597, 1581,
2.6 Гц), 151.66, 161.19 д (J 242.6 Гц),
163.38
1567, 1515, 1409, 1331, 1301, 1270, 1226, 1156,
(7Счетв). [M]+ 350. C20H15FN2O3. М 350.35.
1115, 1093, 1064, 1025, 876, 839, 751, 700, 677, 613,
546, 507. Спектр ЯМР 1H (500 МГц, ДМСО-d6), δ,
(Е)-4-(4-Бромфенил)иминометил-2-метокси-
м.д.: 3.87 с (3Н, ОМе), 7.39 уш.с (2Н, NH2), 7.42 д
фенилизоникотинат (19). Выход 70%, т.пл. 162-
(2Наром, J 8.5 Гц), 7.50 д (1Наром, J 8.1 Гц), 7.62 д.д
163С. ИК спектр, см-1: 3079, 3016, 2922, 2878,
(1Наром, J 8.2, 1.6 Гц), 7.79 д (1Наром, J 1.4 Гц), 7.88 д
2852, 1735 (C=O), 1626 (C=N), 1596, 1578, 1563.
(2Наром, J 8.5 Гц), 8.02 д.д (2Нпиридин, J 6.0, 1.6 Гц),
1507, 1486, 1474, 1454, 1417, 1411, 1371, 1326,
8.67 с (1Н, CH=N), 8.91 д.д (2Нпиридин, J 6.0, 1.6 Гц).
1281, 1260, 1214, 1200, 1185, 1155, 1124, 1097,
Спектр ЯМР 13C (125 МГц, ДМСО-d6), δ, м.д.:
1088, 1073, 1063, 1028, 1007, 973, 875, 851, 829,
56.67 (ОМе),
113.06
(1СНаром),
121.88
(2СНаром),
753, 699, 686, 619, 517. Спектр ЯМР 1H (500 МГц,
123.42
(1СНаром),
123.61
(2СНпиридин),
124.01
ДМСО-d6), δ, м.д.: 3.86 с (3Н, ОМе), 7.26 д (2Наром,
(1СНаром),
127.58
(2СНаром),
151.66
(2СНпиридин),
J 8.6 Гц), 7.47 д (1Наром, J 8.1 Гц), 7.59 д.д (1Наром, J
162.51 (СН=N),
135.67,
136.24,
141.91,
142.46,
8.1, 1.6 Гц), 7.61 д (2Наром, J 8.6 Гц), 7.77 д (1Наром, J
151.72, 154.77, 163.38 (7Счетв). Найдено, %: С 57.94;
1.6 Гц), 8.02 д.д (2Нпиридин, J 6.0, 1.6 Гц), 8.66 с (1Н,
H 4.19; N 9.96; S 7.41. [M]+ 411. C20H17N3O5S.
CH=N), 8.91 д.д (2Нпиридин, J 6.0, 1.6 Гц). Спектр
Вычислено, %: С 58.39; H 4.16; N 10.21; S 7.79. М
ЯМР 13C (125 МГц, ДМСО-d6), δ, м.д.: 56.63 (ОМе),
411.43.
112.06
(1СНаром),
123.15
(1СНаром),
123.58
(2СНпиридин),
123.84
(2СНаром),
123.93
(1СНаром),
(Е)-4-[(1-Бромнафталин-2-ил)иминометил]-2-
132.68
(2СНаром),
151.66
(2СНпиридин),
161.27
метоксифенилизоникотинат
(22). Выход
70%,
(СН=N),
119.24,
135.85,
136.22,
142.22,
151.01,
т.пл. 179-180°С. ИК спектр, см-1: 3067, 3050, 3031,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ 4-ФОРМИЛ-2-МЕТОКСИФЕНИЛИЗОНИКОТИНАТА
1535
2970, 2936, 1738 (C=O), 1629, 1588, 1561, 1506,
(11Счетв). Найдено, %: С 64.47; H 5.17; N 4.56. [M]+
1496, 1464, 1452, 1416, 1407, 1384, 1329, 1326,
259. C14H13NO4. Вычислено, %: С 64.86; H 5.05; N
1274, 1259, 1217, 1213, 1199, 1166, 1154, 1117,
5.40. М 259.26.
1095, 1063, 1032, 981, 878, 825, 813, 751, 743, 699,
2-Метокси-4-(4-фенилдиазенилфениламино-
680, 527. Спектр ЯМР 1H (500 МГц, ДМСО-d6), δ,
метил)фенилизоникотинат (30). Выход 89%, т.пл.
м.д.: 3.89 с (3Н, ОМе), 7.49 д (1Наром, J 8.6 Гц), 7.52
127-128°С. ИК спектр, см-1: 3397(NH), 3033, 2855,
д (1Наром, J 8.1 Гц), 7.58 т.д (1Наром, J 7.5, 0.8 Гц),
1736 (C=O), 1604, 1509, 1460, 1410, 1334, 1310,
7.67-7.73 м (2Наром), 7.56 д (1Наром, J 1.6 Гц), 7.98-
1286, 1271, 1193, 1152, 1138, 1119, 1096, 1085,
8.08 м (2Наром, + 2Нпиридин), 8.26 д (1Наром, J 8.5 Гц),
1062, 1032, 992, 833, 801, 764, 752, 704, 687, 677,
8.70 с (1Н, CH=N), 8.91 д.д (2Нпиридин, J 6.0, 1.6 Гц).
546. Спектр ЯМР 1H (500 МГц, CDCl3), δ, м.д.: 3.79
Спектр ЯМР 13C (125 МГц, ДМСО-d6), δ, м.д.:
с (3Н, ОМе), 4.42 д (2H, CH2, J 4.7 Гц), 4.68 т (1Н,
56.65 (ОМе),
112.58
(1СНаром),
120.51
(1СНаром),
NH, J 4.7 Гц), 6.71 д (2Наром, J 8.9 Гц), 6.97-7.05 м
122.99
(1СНаром),
123.59
(2СНпиридин),
124.05
(2Наром), 7.14 д (1Наром, J 8.0 Гц), 7.39 д.т (1Наром, J
(1СНаром), 126.60 (1СНаром), 126.75 (1СНаром), 128.81
7.3, 1.2 Гц), 7.48 т (2Наром, J 7.6 Гц), 7.82-7.89 м
(1СНаром), 129.02 (1СНаром), 129.64 (1СНаром), 151.66
(4Наром), 8.01 д.д (2Нпиридин, J 6.0, 1.6 Гц), 8.85 д.д
(2СНпиридин), 162.87 (СН=N), 116.47, 132.57, 132.77,
(2Нпиридин, J 6.0, 1.6 Гц). Спектр ЯМР 13C (125 МГц,
135.85,
136.20,
142.45,
148.00,
151.72,
163.39
CDCl3), δ, м.д.: 47.83 (CH2), 56.05 (ОМе), 111.65
(9Счетв). Найдено, %: С 62.74; H 3.72; N 5.67. [M]+
(1СНаром), 112.60 (2СНаром), 119.67 (1СНаром), 122.40
461. C24H17BrN2O3. Вычислено, %: С 62.49; H 3.71;
(2СНаром),
123.90
(1СНаром),
123.47
(2СНпиридин),
N 6.07. М 461.32.
125.35 (2СНаром), 129.09 (2СНаром), 129.78 (1СНаром),
Восстановление соединений 1, 20 в соедине-
150.88 (2СНпиридин), 136.67, 138.24, 138.80, 145.13,
ния 26, 30 (общая методика). К суспензии 0.46 г
150.70, 151.35, 153.15, 163.53 (8Счетв). Найдено, %:
(12 ммоль) боргидрида натрия в 50 мл безводного
С 71.39; H 5.00; N 12.25. [M]+ 438. C26H22N4O3.
бензола при перемешивании добавляли порциями
Вычислено, %: С 71.22; H 5.06; N 12.78. М 438.49.
2.2 г (36 ммоль) ледяной уксусной кислоты, затем
10 ммоль соединения 1 или 20. Смесь переме-
Диэфиры и амиды 23-25, 27-29, 31-33 (общая
методика). К раствору 1 ммоль соединения 5, 26,
шивали 4 ч, приливали 100 мл воды и 100 мл
30 в 100 мл сухого эфира прибавляли 0.13 г
CH2Cl2, органический слой отделяли и сушили
сульфатом натрия. Растворитель отгоняли при
(1.2 ммоль) триэтиламина и в один прием 1.2 ммоль
хлорангидрида изоксазол- или изотиазолкарбо-
пониженном давлении, остаток соединения
26
новой кислоты, и перемешивали при 20-23°С в
очищали перекристаллизацией из смеси эфир-
течение 10-12 ч. Выпавший осадок отфильтро-
CH2Cl2, 2:3; соединение 30 - из эфира.
вывали, промывали эфиром (3×10 мл) и большим
4-Гидроксиметил-2-метоксифенилизонико-
количеством горячей воды (5×50 мл, 50-60°С).
тинат (26). Выход 75%, т.пл. 58-59°С. ИК спектр,
Продукты реакций сушили на воздухе при 40-50°С
см-1: 3265 (OH), 3112, 3068, 3010, 2966, 2934, 2872,
в течение 1-2 сут. Полученные соединения не
1744 (C=O), 1603, 1565, 1510, 1495, 1464, 1413,
требовали дальнейшей очистки.
1326, 1282, 1272, 1223, 1193, 1149, 1119, 1095,
1085, 1061, 1030, 1000, 940, 919, 877, 855, 820, 807,
(Е)-4-(4-Изоникотиноилокси-3-метокси-
797, 755, 736, 701, 677, 586, 544, 468. Спектр ЯМР
бензилиденамино)фенил-5-фенилизоксазол-3-
1H (500 МГц, CDCl3), δ, м.д.: 3.72 уш.с (1Н, ОН),
карбоксилат (23). Выход 85%, т.пл. 179-180°С.
3.76 с (3Н, ОМе), 4.66 с (2Н, СН2), 6.93 д.д (1Наром,
ИК спектр, см-1: 3150, 3137, 3047, 3037, 3022, 2864,
J 8.1, 1.5 Гц), 7.05 д (1Наром, J 1.5 Гц), 7.08 д (1Наром,
1754 (C=O), 1625 (C=N), 1591, 1506, 1463, 1445,
J 8.1 Гц), 7.98 д.д (2Нпиридин, J 6.0, 1.6 Гц), 8.73 д.д
1421, 1406, 1375, 1282, 1255, 1225, 1198, 1192,
(2Нпиридин, J 6.0, 1.6 Гц). Спектр ЯМР 13C (125 МГц,
1183, 1158, 1149, 1142, 1117, 1095, 1086, 1063,
CDCl3), δ, м.д.: 56.26 (ОМе),
100.40
(1СНизокс),
1031, 990, 878, 864, 810, 771, 765, 755, 699, 688,
110.89 (1СНаром), 122.11 (2СНаром), 122.29 (2СНаром),
676, 616, 537. Спектр ЯМР 1H (500 МГц, CDCl3), δ,
123.03
(1СНаром),
123.36
(1СНаром),
123.49
м.д.: 3.92 с (3Н, ОМе), 7.06 с (1Н, СНизокс), 7.26-
(2СНпиридин),
126.13
(2СНаром),
129.36
(2СНаром),
7.33 м (5Наром), 7.42 д.д (1Наром, J 8.1, 1.7 Гц), 7.49-
131.15
(1СНаром),
150.97
(2СНпиридин),
159.81
7.53 м (3Наром), 7.73 д (1Наром, J 1.7 Гц), 7.83-7.87 м
(СН=N),
126.59,
135.57,
136.52,
142.39,
148.37,
(2Наром), 8.02 д.д (2Нпиридин, J 6.0, 1.6 Гц), 8.45 с (1Н,
150.11,
151.73,
156.58,
158.67,
163.18,
172.33
CH=N), 8.86 д.д (2Нпиридин, J 6.0, 1.6 Гц). Спектр
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
1536
ПОТКИН и др.
ЯМР 13C (125 МГц, CDCl3), δ, м.д.: 56.26 (ОМе),
151.29,
151.78,
153.67,
157.65,
163.22
(11Счетв).
100.40 (1СНизокс), 110.89 (1СНаром), 122.11 (2СНаром),
Найдено, %: С 54.72; H 2.96; N 7.66; S 5.68. [M]+
122.29 (2СНаром), 123.03 (1СНаром), 123.36 (1СНаром),
528. C24H15Cl2N3O5S. Вычислено, %: С 54.56; H
123.49
(2СНпиридин),
126.13
(2СНаром),
129.36
2.86; N 7.95; S 6.07. М 528.36.
(2СНаром),
131.15
(1СНаром),
150.97
(2СНпиридин),
4-Изоникотиноилокси-3-метоксибензил-5-
159.81 (СН=N),
126.59,
135.57,
136.52,
142.39,
фенилизоксазол-3-карбоксилат (27). Выход 84%,
148.37,
150.11,
151.73,
156.58,
158.67,
163.18,
т.пл. 137-138°С. ИК спектр, см-1: 3150, 3071, 3054,
172.33 (11Счетв). Найдено, %: С 69.57; H 3.87; N
3134, 3033, 2975, 2955, 2942, 1743 (C=O), 1727
7.79. [M]+ 519. C30H21N3O6. Вычислено, %: С 69.36;
(C=O), 1608, 1572, 1512, 1446, 1406, 1363, 1289,
H 4.07; N 8.09. М 519.51.
1277, 1237, 1205, 1157, 1124, 1097, 1065, 1024, 998,
(Е)-4-(4-(Изоникотиноилокси-3-метокси-
948, 96, 846, 802, 767, 751, 685, 676. Спектр ЯМР
бензилиденамино)фенил-5-(п-толил)изоксазол-
1H (500 МГц, CDCl3), δ, м.д.: 3.84 с (3Н, ОМе), 5.43
3-карбоксилат (24). Выход 87%, т.пл. 190-192°С.
с (2Н, СН2), 6.94 с (1Н, СНизокс), 7.12 д.д (1Наром, J
ИК спектр, см-1: 3141, 3038, 3024, 2953, 2922, 2865,
8.1, 1.8 Гц), 7.14 д (1Наром, J 1.8 Гц), 7.16 д (1Наром, J
1755 (C=O), 1625 (C=N), 1591, 1563, 1507, 1464,
8.1 Гц), 7.45-7.51 м (3Наром), 7.77-7.82 м (2Наром),
1450, 1430, 1421, 1406, 1375, 1322, 1283, 1256,
8.00 д.д (2Нпиридин, J 6.0, 1.3 Гц), 8.85 д (2Нпиридин, J
1226, 1212, 1199, 1192, 1183, 1157, 1150, 1142,
6.0 Гц). Спектр ЯМР 13C (125 МГц, CDCl3), δ, м.д.:
1118, 1095, 1086, 1063, 1031, 991, 879, 865, 814,
56.13 (ОМе), 67.40 (СН2), 100.12 (1СНизокс), 113.10
754, 699, 677, 617. Спектр ЯМР 1H (500 МГц,
(1СНаром), 121.35 (1СНаром), 122.95 (1СНаром), 123.49
CDCl3), δ, м.д.: 2.43 с (3Н, Ме), 3.92 с (3Н, ОМе),
(2СНпиридин),
126.07
(2СНаром),
129.29
(2СНаром),
7.01 с (1Н, СНизокс), 7.26-7.33 м (7Наром), 7.42 д.д
131.01 (1СНаром), 150.90 (2СНпиридин), 126.65, 134.44,
(1Наром, J 8.1, 1.6 Гц), 7.72-7.76 м (3Наром), 8.03 д.д
136.63,
139.84,
151.30,
156.77,
159.94,
163.33,
(2Нпиридин, J 6.0, 1.4 Гц), 8.46 с (1Н, CH=N), 8.87 д
172.02 (9Счетв). Найдено, %: С 66.50; H 4.25; N 5.93.
(2Нпиридин, J 6.0 Гц). Спектр ЯМР 13C (125 МГц,
[M]+ 430. C24H18N2O6. Вычислено, %: С 66.97; H
CDCl3), δ, м.д.: 21.72 (Ме), 56.28 (ОМе),
99.83
4.22; N 6.51. М 430.42.
(1СНизокс), 110.91 (1СНаром), 122.12 (2СНаром), 122.32
4-Изоникотиноилокси-3-метоксибензил-5-(п-
(2СНаром), 123.04 (1СНаром), 123.39 (1СНаром), 123.54
толил)изоксазол-3-карбоксилат (28). Выход 88%,
(2СНпиридин),
126.10
(2СНаром),
130.05
(2СНаром),
т.пл. 174-175°С. ИК спектр, см-1: 3126, 3058, 3033,
150.97 (2СНпиридин), 159.83 (СН=N), 135.60, 136.57,
141.65,
142.41,
148.42,
150.11,
151.02,
151.75,
2968, 2942, 2921, 2850, 1753 (C=O), 1740 (C=O),
1612, 1512, 1450, 1408, 1367, 1324, 1265, 1231,
156.54, 158.80, 163.20, 172.57 (12Счетв). Найдено, %:
1202, 1155, 1122, 1061, 1039, 994, 952, 821, 781,
С 69.48; H 4.54; N 7.62. [M]+ 533. C31H23N3O6.
Вычислено, %: С 69.79; H 4.35; N 7.88. М 533.54.
701, 681, 560, 502. Спектр ЯМР 1H (500 МГц,
), δ, м.д.: 2.39 с (3Н, Ме), 3.83 с (3Н, ОМе),
CDCl3
(Е)-4-(4-Изоникотиноилокси-3-метоксибен-
5.42 с (2Н, СН2), 6.88 с (1Н, СНизокс), 7.11 д.д
зилиденамино)фенил-4,5-дихлоризотиазол-3-
(1Наром, J 8.1, 1.7 Гц), 7.14 д (1Наром, J 1.7 Гц), 7.16 д
карбоксилат (25). Выход 90%, т.пл. 180-181°С.
(1Наром, J 8.1 Гц), 7.27 д (2Наром, J 8.2 Гц), 7.68 д
ИК спектр, см-1: 3063, 3033, 2967, 2933, 2918, 2876,
(2Наром, J 8.2 Гц), 8.01 д (2Нпиридин, J 5.8 Гц), 8.85 д
1738 (C=O), 1630 (C=N), 1592, 1508, 1501, 1479,
(2Нпиридин, J 5.8 Гц). Спектр ЯМР 13C (125 МГц,
1462, 1451, 1415, 1408, 1394, 1367, 1354, 1324,
CDCl3), δ, м.д.: 21.64 (Ме), 56.11 (ОМе),
67.32
1278, 1238, 1209, 1196, 1149, 1124, 1097, 1085,
(СН2),
99.51
(1СНизокс),
113.07
(1СНаром),
121.31
1075, 1063, 1032, 1012, 964, 874, 859, 844, 818, 796,
(1СНаром),
122.92
(1СНаром),
123.54
(2СНпиридин),
750, 735, 698, 681, 616, 518. Спектр ЯМР 1H (500 МГц,
125.99
(2СНаром),
129.94
(2СНаром),
150.76
CDCl3), δ, м.д.: 3.93 с (3Н, ОМе), 7.27-7.33 м
(2СНпиридин), 123.95, 134.48, 136.73, 139.79, 141.43,
(5Наром), 7.42 д.д (1Наром, J 8.1, 1.7 Гц), 7.74 д
151.27,
156.69,
160.00,
163.27,
172.20
(10Счетв).
(1Наром, J 1.7 Гц), 8.03 д.д (2Нпиридин, J 6.0, 1.5 Гц),
Найдено, %: С 67.49; H 4.68; N 5.89. [M]+ 444.
8.46 с (1Н, CH=N), 8.88 д.д (2Нпиридин, J 6.0, 1.5 Гц).
C25H20N2O6. Вычислено, %: С 67.56; H 4.54; N 6.30.
Спектр ЯМР 13C (125 МГц, CDCl3), δ, м.д.: 56.31
М 444.44.
(ОМе), 110.92 (1СНаром), 122.13 (2СНаром), 122.29
(2СНаром), 123.06 (1СНаром), 123.42 (1СНаром), 123.55
4-Изоникотиноилокси-3-метоксибензил-4,5-
(2СНпиридин),
151.01
(2СНпиридин), 159.86 (СН=N),
дихлоризоксазол-3-карбоксилат
(29).
Выход
123.29,
135.61,
136.58,
142.44,
148.46,
150.18,
89%, т.пл. 142-143°С. ИК спектр, см-1: 3108, 3067,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ 4-ФОРМИЛ-2-МЕТОКСИФЕНИЛИЗОНИКОТИНАТА
1537
3050, 3033, 3017, 2922, 2852, 1749 (C=O), 1727
(1Наром, J 7.7, 1.8 Гц), 7.07 д (1Наром, J 1.5 Гц), 7.09 д
(C=O), 1607, 1514, 1466, 1408, 1354, 1323, 1291,
(1Наром, J 8.3 Гц), 7.20 д (2Наром, J 7.9 Гц), 7.24 д
1270, 1218, 1206, 1158, 1120, 1083, 1036, 977, 826,
(2Наром, J 8.0 Гц), 7.46-7.52 м (3Наром), 7.55 д
754, 700, 680, 520. Спектр ЯМР 1H (500 МГц,
(2Наром, J 7.0 Гц), 7.81-7.92 м (4Наром), 8.02 д.д
CDCl3), δ, м.д.: 3.82 с (3Н, ОМе), 5.42 с (2Н, СН2),
(2Нпиридин, J 6.0, 1.5 Гц), 8.85 д.д (2Нпиридин, J 6.0,
7.11 д.д (1Наром, J 8.1, 1.8 Гц), 7.14 д (1Наром, J
1.5 Гц). Спектр ЯМР 13C (125 МГц, CDCl3), δ, м.д.:
1.8 Гц), 7.16 д (1Наром, J 8.1 Гц), 7.99 д.д (2Нпиридин, J
21.57 (Ме),
53.92 (CH2),
56.09 (ОМе),
99.59
6.0, 1.3 Гц), 8.84 д.д (2Нпиридин, J 6.0, 1.3 Гц). Спектр
(1СНизокс), 113.33 (1СНаром), 121.38 (1СНаром), 122.71
ЯМР 13C (125 МГц, CDCl3), δ, м.д.: 56.12 (ОМе),
(2СНаром),
123.04
(2СНаром),
123.59
(2СНпиридин),
67.59 (СН2),
113.06
(1СНаром),
121.32
(1СНаром),
123.89 (2СНаром), 125.89 (2СНаром), 128.86 (1СНаром),
122.96
(1СНаром),
123.47
(2СНпиридин),
150.90
129.23 (2СНаром), 129.80 (2СНаром), 131.48 (1СНаром),
(2СНпиридин), 125.90, 134.35, 136.62, 139.83, 150.90,
150.57 (2СНпиридин), 129.86, 135.85, 136.95, 139.20,
151.29, 154.09, 158.96, 163.30 (9Счетв). Найдено, %:
141.07,
143.83,
151.21,
151.60,
152.56,
159.25,
С 49.53; H
2.84; N
5.99; S
6.62.
[M]+
439.
160.99, 163.20,
170.48
(13Счетв). Найдено, %: С
C18H12Cl2N2O5S. Вычислено, %: С 49.22; H 2.75; N
71.44; H
4.61; N
11.00.
[M]+ 624. C37H29N5O5.
6.38; S 7.30. М 439.26.
Вычислено, %: С 71.26; H 4.69; N 11.23. М 623.67.
2-Метокси-4-[5-фенил-N-(4-фенилдиазенил-
4-[4,5-Дихлор-N-(4-фенилдиазенилфенилизо-
фенил)изоксазол-3-карбоксиамидометил]фенил-
тиазол-3-карбоксиамидо)метил]-2-метоксифе-
изоникотинат (31). Выход 68%, т.пл. 171-172°С.
нилизоникотинат (33). Выход 68%, т.пл. 63-64°С.
ИК спектр, см-1: 3150, 3135, 3085, 3056, 3040, 2928,
ИК спектр, см-1: 3058, 3033, 2934, 2850,
1748
2855, 1743 (C=O), 1645 (C=O), 1610, 1598, 1573,
(C=O), 1660 (C=O), 1596, 1509, 1499, 1407, 1351,
1508, 1463, 1445, 1415, 1410, 1365, 1348, 1285,
1266, 1200, 1151, 1122, 1083, 1061, 1033, 1007, 930,
1270, 1254, 1197, 1154, 1125, 1095, 1064, 1027, 855,
847, 769, 752, 685, 580. Спектр ЯМР 1H (500 МГц,
764, 755, 601, 685, 580. Спектр ЯМР 1H (500 МГц,
CDCl3), δ, м.д.: 3.79 с (3Н, ОМе), 5.17 с (2H, CH2),
CDCl3), δ, м.д.: 3.78 с (3Н, ОМе), 5.22 с (2H, CH2),
6.91 д (1Наром, J 7.9 Гц), 7.09 д (1Наром, J 8.0 Гц),
6.51 с (1Н, СНизокс), 6.91 д (1Наром, J 7.7 Гц), 7.07 с
7.12 с (1Наром), 7.16 д (2Наром, J 7.6 Гц), 7.45-7.54 м
(1Наром), 7.09 д (1Наром, J 8.0 Гц), 7.23 д (2Наром, J
(3Наром), 7.77 д (2Наром, J 8.0 Гц), 7.86-7.91 м
8.2 Гц), 7.39-7.45 м (3Наром), 7.47-7.53 м (3Наром),
(2Наром), 8.00 д (2Нпиридин, J 5.9 Гц), 8.84 д (2Нпиридин,
7.67 уш.с (2Наром), 7.84-7.91 м (4Наром), 8.01 д
J 5.9 Гц). Спектр ЯМР 13C (125 МГц, CDCl3), δ,
(2Нпиридин, J 5.9 Гц), 8.85 д (2Нпиридин, J 5.9 Гц).
м.д.: 53.14 (CH2), 56.10 (ОМе), 112.89 (1СНаром),
Спектр ЯМР 13C (125 МГц, CDCl3), δ, м.д.: 54.03
121.08 (1СНаром), 122.80 (1СНаром), 123.07 (2СНаром),
(CH2),
56.18 (ОМе),
100.23
(1СНизокс),
113.44
123.47
(2СНпиридин),
123.76
(2СНаром),
128.43
(1СНаром), 121.50 (1СНаром), 122.80 (2СНаром), 123.12
(2СНаром), 129.27 (2СНаром), 131.64 (1СНаром), 150.82
(2СНаром),
123.54
(2СНпиридин),
123.97
(2СНаром),
(2СНпиридин), 122.31, 135.78, 136.72, 139.24, 142.71,
126.03 (2СНаром), 128.96 (1СНаром), 129.20 (2СНаром),
149.20,
151.35,
151.44,
152.48,
160.34,
162.43,
129.31 (2СНаром), 130.76 (1СНаром), 131.57 (1СНаром),
163.28 (12Счетв). Найдено, %: С 58.40; H 3.43; N
150.90 (2СНпиридин), 126.76, 135.84, 136.79, 139.31,
11.03; S 5.01. [M]+ 617. C30H21Cl2N5O4S. Вычислено,
143.86,
148.59,
151.29,
151.71,
152.64,
159.35,
%: С 58.26; H 3.42; N 11.32; S 5.18. М 618.49.
163.37, 170.06 (12Счетв). Найдено, %: С 71.24; H
4.40; N 11.18. [M]+ 610. C36H27N5O5. Вычислено, %:
ФОНДОВАЯ ПОДДЕРЖКА
С 70.93; H 4.46; N 11.49. М 609.64.
Работа выполнена при частичной финансовой
2-Метокси-4-({N-[4-(фенилдиазенил)фенил]-
поддержке Российского фонда фундаментальных
5-(п-толил)изоксазол-3-карбоксамидо}метил)-
исследований, грант 18-58-00013-Бел_a, и Бело-
фенилизоникотинат (32). Выход 62%, т.пл. 65-67°С.
русского республиканского фонда фундаменталь-
ИК спектр, см-1: 3056, 3033, 2970, 2934, 2854, 1747
ных исследований, грант Х18Р-010.
(C=O), 1657 (C=O), 1597, 1564, 1509, 1462, 1444,
1408, 1366, 1324, 1267, 1200, 1151, 1122, 1084,
1062, 1032, 960, 948, 929, 847, 801, 766, 752, 700,
КОНФЛИКТ ИНТЕРЕСОВ
687, 637, 579, 545, 504. Спектр ЯМР 1H (500 МГц,
CDCl3), δ, м.д.: 2.34 с (3Н, Ме), 3.77 с (3Н, ОМе),
Авторы заявляют об отсутствии конфликта
5.17 с (2H, CH2), 6.60 с (1Н, СНизокс), 6.91 д.д
интересов.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
1538
ПОТКИН и др.
СПИСОК ЛИТЕРАТУРЫ
Petkevich S.K., Kazbanov V.V., Gurinovich T.A.,
Roeva M.O., Grigoriev D.G., Kletskov A.V.,
1. Yet L. Privileged Structures in Drug Discovery:
Kalunov V.N. Med. Chem. 2012, 8, 22. doi 10.2174/
Medicinal Chemistry and Synthesis. London: John
157340612799278298
Wiley & Sons, Inc., 2018.
12. Kulchitsky V.A., Alexandrova R., Suziedelis K.,
2. Altaf A.A., Shahzad A., Gul Z., Rasool N., Badshah A.,
Paschkevich S.G., Potkin V.I. Recent Patents Nanomed.
Lal B., Khan E. J. Drug Design Med. Chem. 2015, 1, 1.
2014, 4, 82. doi 10.2174/1877912305999150212114954
doi 10.11648/j.jddmc.20150101.11
13. Potkin V.I., Bumagin N., Petkevich S., Lyakhov A.S.,
3. Sanchez T. W., Debnath B., Christ F., Otake H.,
Rudakov D.A., Livantsov M.V., Golantsov N.
Debyser Z., Neamati N. Bioorg. Med. Chem. 2013, 21,
Synthesis. 2012, 44, 151. doi 10.1055/s-0031-1289618
957. doi 10.1016/j.bmc.2012.12.012
14. Бумагин Н.А., Поткин В.И. Изв. АН. Сер. хим. 2016,
4. Casida J.E. Annu. Rev. Entomol. 2018, 63, 125. doi
2, 321. [Bumagin N.A., Potkin V.I. Russ. Chem. Bull.
10.1146/annurev-ento-020117-043042
2016, 65, 321.] doi 10.1007/s11172-016-1306-2
5. Hladik M.L., Main A.R., Goulson D. Environ. Sci.
15. Saleem L.M.N. Org. Magnet. Res. 1982, 19, 176. doi
Technol. 2018, 52, 3329. doi 10.1021/acs.est.7b06388
10.1002/mrc.1270190403
6. Wood T.J., Goulson D. Environ. Sci. Pollut. Res. Int.
16. Поткин В.И., Петкевич С.К., Клецков А.В.,
2017, 24, 17285. doi 10.1007/s11356-017-9240-x
Дикусар Е.А., Зубенко Ю.С., Жуковская Н.А.,
7. Pal S. Pyridine: A Useful Ligand in Transition Metal
Казбанов В.В., Пашкевич С.Г. ЖОрХ. 2013, 49, 1543.
Complexes. Ed. Pratima Parashar Pandey. London:
[Potkin V.I., Petkevich S.K., Kletskov A.V., Dikusar E.A.,
IntechOpen. 2018, 57. doi 10.5772/intechopen.76986
Zubenko Yu.S., Zhukovskaya N.A., Kazbanov V.V.,
8. Bumagin N.A. Catal. Commun. 2016, 79, 17. doi
Pashkevich S.G. Russ. J. Org. Chem. 2013, 49, 1523].
10.1016/j.catcom.2016.02.016
doi 10.1134/S1070428013100205
9. Дикусар Е.А., Петкевич С.К., Клецков А.В.,
17. Поткин В.И., Гаджилы Р.А., Дикусар Е.А.,
Зверева Т.Д., Жуковская Н.А., Гаджилы Р.А.,
Петкевич С.К., Жуковская Н.А., Алиев А.Г.,
Алиев А.Г., Мамедова Г.М., Нагиева Ш.Ф.,
Нагиева Ш.Ф. ЖОрХ. 2012, 48, 132. [Potkin V.I.,
Поткин В.И. ЖОрХ. 2018, 54, 90. [Dikusar E.A.,
Gadzhily R.A., Dikusar E.A., Petkevich S.K.,
Petkevich S.K., Kletskov A.V., Zvereva T.D.,
Zhukovskaya N.A., Aliev A.G., Nagieva Sh.F Russ.
Zhukovskaya N.A., Gadzhili R.A., Aliev A.G.,
J. Org. Chem.
2012,
48,
127.] doi
10.1134/
Mamedova G.M., Nagieva Sh. F., Potkin V.I. Rus.
S1070428012010216
J. Org. Chem.
2018,
54,
87.] doi
10.1134/
18. Поткин В.И., Петкевич С.К., Залесская Е.Г. ЖОрХ.
S1070428018010074
2009, 45, 892. [Potkin V.I., Petkevich S.K., Zalesskaya E.G.
10. Kletskov A.V., Potkin V.I., Dikusar E.A., Zolotar R.M.
Russ. J. Org. Chem. 2009, 45, 879.] doi 10.1134/
Natur. Prod. Commun. 2017, 12, 105. doi 10.1177/
S107042800906013X
1934578x1701200130
19. Wang Zh., Yang L., Cui Sh., Liang Y., Zhang X.
11. Kulchitsky V.A., Potkin V.I., Zubenko Yu.S.,
Molecules.
2014,
19,
4791.
doi
10.3390/
Chernov A.N., Talabaev M.V., Demidchik Yu.E.,
molecules19044791
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ 4-ФОРМИЛ-2-МЕТОКСИФЕНИЛИЗОНИКОТИНАТА
1539
Functional Derivatives
of 4-Formyl-2-methoxyphenylisonicotinate
V. I. Potkina, *, N. A. Bumaginb, **, E. A. Dikusara, S. K. Petkevicha, and P. V. Kurmanc
a Institute of Physical-Organic Chemistry, NAS of Belarus, 220072, Belarus, Minsk, ul. Surganova 13
*e-mail: potkin@ifoch.bas-net.by
b Lomonosov Moscow State University, Faculty of Chemistry, 119991, Russia, Moscow, Leninskie Gory 1, str. 3
**e-mail: bna51@mail.ru
c Institute of Bioorganic Chemistry, NAS of Belarus, 220141, Belarus, Minsk, ul. Academika V.F. Kuprevich 5/3
Received April 5, 2019; revised June 27, 2019; accepted August 8, 2019
By acylation of vanillin with isonicotinoyl chloride, isonicotinic acid vanillinate was obtained (4-formyl-2-
methoxyphenylisonicotinate), on the basis of which a series of functionally substituted derivatives, including
those containing isoxazole and isothiazole heterocycles in the molecule, was synthesized. Azomethines have
been synthesized by condensation of vanillin isonicotinate with amines. By reducing of vanillin isonicotinate
and one of the azomethins based on it with sodium triacetyloxyborohydride the corresponding alcohol and
amine were obtained. Acylation of amino and hydroxy derivatives of isonicotinates by 5-arylisoxazole- and
4,5-dichloroisothiazolecarbonyl chlorides leads to the corresponding esters and amides with isoxazole and
isothiazole residues. The synthesized bi-heterocyclic compounds readily form complexes with palladium
LPdCl2, which exhibit high catalytic activity in the Suzuki reaction in water in the absence of an organic co-
solvent.
Keywords: isonicotinic acid, isonicotinic acyl chloride, esters, vanillin, acylation, isoxazoles, isothiazoles,
amides
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019