ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 10, с. 1567-1576
УДК 547.587.51
РАСТИТЕЛЬНЫЕ КУМАРИНЫ: XVII1. СИНТЕЗ И
ПРЕВРАЩЕНИЯ КАРБОКСАМИДОКУМАРИНОВ.
Д. О. Захаровa, А. В. Липееваa, Ю. В. Гатиловa, b, А. Г. Макаровa, Э. Э. Шульцa, b, *
a ФГБУН «Новосибирский институт органической химии им Н.Н. Ворожцова СО РАН»,
630090, Россия, г. Новосибирск, пр. Академика Лаврентьева 9
*e-mail: schultz@nioch.nsc.ru
b ФГАОУ ВО «Новосибирский национальный государственный университет»,
630090, Россия, г. Новосибирск, ул. Пирогова 1
Поступила в редакцию 13 апреля 2019 г.
После доработки 15 августа 2019 г.
Принята к публикации 16 августа 2019 г.
Взаимодействие хлорангидрида умбеллиферон-6-карбоновой кислоты с аминами и метиловыми эфирами
α-, β- или ω-аминокислот приводит к соответствующим N-замещенным 6-карбоксамидокумаринам.
Реакцией 2-(7-гидрокси-2-оксо-2H-хромен-6-карбоксамидо)уксусной кислоты (получают при взаимо-
действии указанного хлорангидрида с глицином) с хлористым тионилом получен соответствующий
хлорангидрид, который легко вступает во взаимодействие с бензиламинами и метиловыми эфирами α-
аминокислот с образованием производных, содержащих дипептидные фрагменты.
Ключевые слова: кумарины, умбеллиферон, аминокислоты, амиды, пептиды.
DOI: 10.1134/S0514749219100094
Природные и синтетические кумарины состав-
природного кумарина пеурутеницина (1). Следует
ляют важную группу биологически активных
отметить, что ранее с помощью палладий-катали-
соединений, спектр биологического действия кото-
зируемых реакций кросс-сочетания, аминирования,
рых во многом определяется наличием и располо-
аминометилирования и азид-алкинового циклопри-
жением заместителей. В ряду 6-замещенных кума-
соединения нами был синтезирован широкий круг
ринов обнаружены вещества, обладающие cелек-
производных кумарина пеурутеницина
1 по
тивной противоопухолевой [2-4], противовирусной
положениям С7 и С8 [1, 11-14]. Среди синтезиро-
(анти-ВИЧ
1) активностью
[5-7], некоторые
ванных производных были найдены перспектив-
соединения этого ряда являются селективными
ные антикоагулянты
[13] и антиаритмические
антагонистами прогестероновых рецепторов
[8],
соединения [14].
ингибиторами циклинзависимых киназ
[9] или
Нами установлено, что обработка пеуруте-
ингибиторами моноаминоксидаз
[10]. Следует
ницина 20% раствором щелочи в диоксане по
отметить, что наличие некоторых заместителей в
модифицированной нами методике [15] приводит к
положении С6 (изопренильных групп, фтора,
образованию умбелиферон-6-карбоновой кислоты
хлора, гидрокситриазолильного, гидроксиизо-
(2), которая при кипячении в чистом хлористом
ксазолильного фрагментов, нитрогруппы) увели-
тиониле легко дает соответствующий хлоран-
чивает селективность противоопухолевого дейст-
гидрид 3 (схема 1). Следует отметить, что более
вия замещенных кумаринов [2, 3, 9], а также
мягкие условия проведения реакции не привели к
усиливает анти-ВИЧ эффект [5].
удовлетворительному результату - при использо-
В настоящем исследовании нами предложен
вании хлориcтого оксалила в ТГФ или меньшего
метод синтеза кумаринов, содержащих карбокса-
количества хлористого тионила конверсия исход-
мидный заместитель в положении С6, на основе
ной кислоты не превышала 50%.
Реакция хлорангидрида умбеллиферон-6-кар-
1 Сообщение XVI см. [1].
боксикислоты 3 с бензиламинами 4, 5 в ТГФ в
1567
1568
ЗАХАРОВ и др.
Схема 1.
O
O
O
1) NaOH (20%)
H2O/диоксан
MeO
Cl
HO
, 20 мин
SOCl2,
2) H+
HO
O
O
HO
O
O
HO
O
O
1
2, 55%
3, 94%
присутствии Et3N в условиях работы
[16] не
Производные природных соединений, содер-
привела к успеху. Также безуспешным оказалось
жащие дипептидные фрагменты, являются важ-
использование галогенсодержащих растворителей.
ными с точки зрения разнообразной биологической
Проведение реакции при нагревании в бензоле
активности. Так, ди- и полипептиды, полученные
позволило получить соответствующие N-бензил-6-
конъюгацией хитозана с остатками глицина или
карбоксамидоумбеллифероны 7, 8 (схема 2). Высо-
аланина, проявляют цитотоксичность in vitro и in
кие выходы целевых карбоксамидокумаринов 7-9
vivo и перспективны для создания противодиабе-
были достигнуты при проведении реакции в
тических соединений [17]. Дипептиды, имеющие в
бензоле и использовании 1.2 эквивалентов амина и
своем составе конъюгированные фрагменты лей-
2.3 эквивалентов Et3N.
цина и глицина, активно изучаются как вещества,
способные бороться с синдромом хронической
Перспективным направлением модификации
усталости [18]. Найдены перспективные противо-
кумарина пеурутеницина 1 является введение в его
вирусные соединения, содержащие несколько
структуру фрагментов различных аминокислот.
фрагментов глицина [19]. В связи с этим получение
Данная модификация представляет интерес в связи
замещенных кумаринов, содержащих дипептидные
с противовирусными, антибактериальными, про-
фрагменты, является целесообразным.
тивоопухолевыми свойствами соединений, содер-
жащих подобные фрагменты. Нами синтезированы
Нами показано, что взаимодействие хлорангид-
новые производные пеурутеницина, содержащие
рида 3 с глицином в присутствии триэтиламина в
фрагменты различных аминокислот. Реакция хлор-
ТГФ гладко приводит к карбоксамидокислоте 24
ангидрида 3 с метиловыми эфирами α-аминокислот -
(выход 86%) (схема 4). При обработке соединения
L-аланина (10), L-валина (11), L-метионина (12) и
24 хлориcтым тионилом получали хлорангидрид 25
α-фенилаланина (13) - протекала с образованием
(выход 81%). Реакцией соединения 25 с бензил-
индивидуальных соединений 17-20 с выходом 40-
аминами 4, 5 или метиловым эфиром α-аминомас-
60% (схема 3). Взаимодействие соединения 3 с
ляной кислоты (26) в условиях (в, схема 3) получи-
метиловым эфиром β-фенилаланина (14) приво-
ли кумариновые дипептиды 27-29 (выход 62-75%).
дило к образованию карбоксамидокумарина 21 с
выходом 53%. Наиболее высокие выходы кумарин-
Строение синтезированных соединений уста-
6-карбоксамидов 22, 23 были получены в реакциях
новлено на основании спектральных данных и
кумарина 3 с метиловыми эфирами длинноцепо-
данных элементного анализа. Полосы поглощения
чечных ω-аминокислот - 8-аминокаприловой (15) и
карбонила амидных групп в ИК спектрах соеди-
9-аминопеларгоновой (16) кислот (выход 71-75%).
нений 7-9, 17-23, 24, 26, 27-29 регистрируются в
Схема 2.
MeO
R1
O
R1
O
NH2
MeO
R2
MeO
NH2
N
N
6
4, 5
H
H
3
MeO
б
a, б
HO
O
O
R2
O
O
HO
9, 56%
7_8, 67_77%
R1 = R2 = H (4, 7); R1 = R2 = OMe (5, 8).
a: ТГФ, ТЭА (1.3 экв), 65°C; б: бензол, ТЭА (2.3 экв), 80°C.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
РАСТИТЕЛЬНЫЕ КУМАРИНЫ: XVII.
1569
Схема 3.
R
Ph
O
O
R
NH2
CH
NH2
CO2CH3
H
3CO2C
H3CO2C
Ph
N
N
10_13
14
H
H
3
H
в
в
3CO2C
HO
O
O
HO
O
O
17_20
NH2
(СH2)nCO2CH3
21
в
15, 16
O
(CH2)n
H3CO2C
N
n = 7 (15, 22);
H
8 (16, 23).
HO
O
O
22, 23
R = CH3 (10, 17); (CH3)2CH (11, 18); CH3SCH2CH2 (12, 19); PhCH2CH(CO2Me) (13, 20).
в: бензол, ТЭА, 80°C.
Схема 4.
O
O
HO
NH2
HO
Cl
O
N
SOCl2
N
3
H
H
Et3N, ТГФ, 60oC
O
75°C, 90 мин
O
HO
O O
HO
O O
24
25
O
HN
R
NH2
R
N
4, 5, 26
H
25
O
Et3N, бензол, 80oC
HO
O O
27_29
R= PhCH2 (27); 2-OCH3-4-OCH3C6H3CH2 (28); CH3CH2CH(CO2CH3) (26, 29).
области
1626-1650 см-1, NH- и гидроксильной
Молекулы кумарина также образуют стопки за
групп - в области 3285-3503 см-1. Спектры ЯМР
счет пи-стекинг взаимодействий между бензоль-
1Н и 13С полученных соединений полностью согла-
ными циклами [межцентроидные расстояния 3.619(3),
суются с их структурой и содержат один набор
3.679(3), 3.880(3) Å].
характеристичных сигналов кумаринового остова и
соответствующего заместителя.
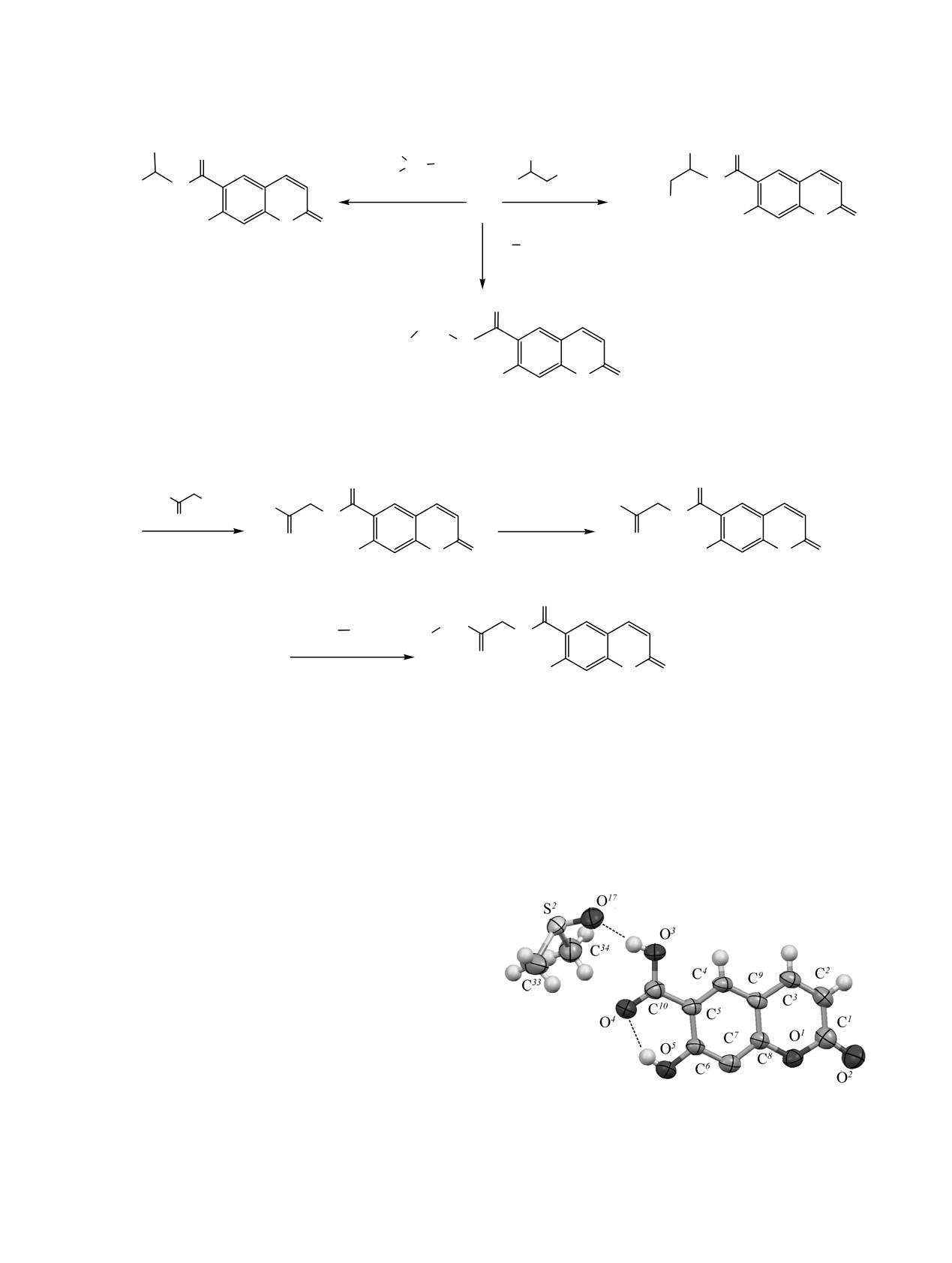
Строение умбеллиферон-6-карбоновой кислоты
2 подтверждено данными РСА для кристалло-
сольвата с ДМСО (см. рисунок, показана одна из
3-х независимых пар молекул). Длины связей в моле-
кулах кумарина 2 близки к аналогичным длинам в
молекуле
7-гидрокси-6-метокси-2H-хромен-2-она
[20]. Гидроксильные группы кумарина 2 образуют
внутримолекулярные водородные связи с карбок-
силами (расстояния H···O 1.85, 1.86, 1.86 Å). В
кристалле молекулы кумарина 2 и ДМСО связаны
в пары с помощью водородных связей
Молекулярная структура умбеллиферон-6-карбоновой
COOH···O=SMe2 (расстояния H···O 1.74, 1.75, 1.76 Å).
кислоты (2) и ДМСО.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
1570
ЗАХАРОВ и др.
Таким образом, взаимодействие хлорангидрида
Метиловые эфиры аминокислот 10-14, 26 полу-
умбелиферон-6-карбоновой кислоты с аминами
чали по методике [22] из соответствующих амино-
или метиловыми эфирами α-, β- или ω-амино-
кислот: (Sigma-Aldrich, 98%) (Acros Organics, 98%).
кислот в присутствии избытка триэтиламина
Гидрохлориды 8-аминокаприловой 15 и 9-амино-
приводит к соответствующим N-замещенным 6-
пеларгоновой 16 кислот синтезировали из азелаи-
карбоксамидокумаринам. Получены 6-замещенные
новой и себациновой кислот по методикам [23].
кумарины, содержащие амидные и дипептидные
Растворители (ТГФ, бензол), а также Et3N очищали
фрагменты, которые представляют интерес в
по стандартным методикам и перегоняли в токе
качестве потенциальных лекарственных средств.
аргона непосредственно перед проведением реакций.
Амины 4-6 (фирмы Alfa Aesar) использовали без
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
дополнительной очистки.
Рентгеноструктурный эксперимент кристалло-
Спектры ЯМР растворов соединений в CDCl3
сольвата соединения
2 проводили на дифрак-
или в смеси CDCl3 + CD3ОD (5:1) (соединение 24)
тометре Bruker KAPPA APEX-II (CCD детектор,
записывали на cпектрометрах Bruker AV-300
графитовый монохроматор, λ(MoKα) 0.71073 Å,
[300.13 (1Н) и 75.47 (13С) МГц], AV-400 [400.13
температура 297 К, φ,ω-сканирование). Поглоще-
(1Н) и 100.78 (13С) МГц] и AV-600 [600.30 (1Н) и
ние учитывали эмпирическим методом по прог-
150.96 (13С) МГц] (Германия). Химические сдвиги
рамме SADABS. Структуру расшифровали прямым
в спектрах ЯМР 1H и 13С измеряли относительно
методом и уточняли по комплексу программ
внутреннего стандарта ТМС. Мультиплетность
SHELXTL. Уточнение проводили в анизотропном
сигналов в спектрах ЯМР 13С определяли при
приближении для неводородных атомов. Поло-
записи спектров в режиме J модуляции.
жения атомов водорода определены геометрически
ИК спектры регистрировали на ИК-Фурье
и уточнены изотропно в модели наездника.
спектрометре Vector-22 в таблетках KВr. УФ-
Структурные данные депонированы в Кембриджс-
спектры поглощения записывали на спектрометре
кую базу структурных данных CCDC 1896497 и
HР 8453 UV Vis (Германия).
могут быть свободно получены [24].
Величины удельного вращения [α]D измеряли на
7-Гидрокси-2-оксо-2Н-хромен-6-карбоновая
поляриметре PolAAr 3005 (Германия) при комнат-
кислота (2). К раствору 1.0 г (4.5 ммоль) пеуруте-
ной температуре (23-25°С) в хлороформе.
ницина 1 в 200 мл диоксана добавляли 400 мл 20%-
го водного раствора NaOH. Реакционную смесь
Элементный анализ выполняли на СНN-
кипятили в течение 20 мин. По окончании реакции
анализаторе, модель
1106 фирмы Carlo Erba
раствор охлаждали до 10°C и обрабатывали 10%-
(Италия). Для записи масс-спектров, определения
ным раствором H2SO4 (70 мл) до pH = 3-4, продукт
молекулярных масс и элементного состава исполь-
экстрагировали из водной фазы CHCl3 (3×15 мл),
зовали масс-спектрометр высокого разрешения
объединенные органические слои сушили над
DFS Thermo Scientific (США) (энергия ионизи-
MgSO4, осушитель отфильтровывали, раствор упа-
рующих электронов 70 эВ, температура испарителя
ривали. Остаток перекристаллизовывали из эта-
270-300°С).
нола и сушили в вакууме. Выход 0.514 г (55%).
Контроль протекания реакций и чистоты
т.пл. 248-250°C (разл.) {258°С (разл.) [15]}. ИК
полученных соединений осуществляли методом
спектр, ν, см-1: 3504, 3394, 3066, 2849, 2702, 2472,
ТСХ на пластинах Silufol UV-254 с использо-
1705, 1678, 1628, 1597, 1579, 1392, 1294, 1242,
ванием систем: хлороформ, хлороформ-этанол
1147, 1119, 916, 862, 810, 760, 727, 633. УФ-спектр
(50:1). Проявление пятен производили в УФ-свете.
(EtOH), λмакс, нм (log ε): 208 (3.69), 224 (3.58), 238
(3.56), 305 (3.32), 330 (3.50). Спектр ЯМР 1H, δ,
Продукты реакции выделяли с помощью
м.д.: 6.14 д (1Н, Н4, J 9.4 Гц), 6.70 с (1Н, Н8), 7.59 д
колоночной хроматографии на силикагеле (фирмы
(1Н, Н3, J 9.4 Гц), 7.96 с (1Н, Н5), 11.25 с (OH).
Acros,
0.035-0.070 мм), элюент
- хлороформ,
Спектр ЯМР 13С, δ, м.д.: 95.83 (C4a), 103.27 (C8),
хлороформ-этанол (50:3) или перекристаллизацией
110.97 (C6), 111.74 (C3), 131.30 (C4), 144.52 (C5),
из соответствующего растворителя.
157.37 (C8а), 161.79 (C7), 164.51 (C2), 173.13 (С=О).
Пеурутеницин
1 получали из фурокумарина
Методом медленного испарения раствора образца в
пеуцеданина по методике, описанной в работе [21].
ДMСO получен кристаллический сольват. Крис-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
РАСТИТЕЛЬНЫЕ КУМАРИНЫ: XVII.
1571
таллографические данные соединения
2: трик-
в. К раствору 0.1 г (0.45 ммоль) соединения 3 в
линная сингония, a
9.8317(16), b
14.153(3), c
7.5 мл безводного бензола добавляли
0.31 мл
14.642(2) Å, α 94.164(6), β 103.756(5), γ 97.066(6)°,
(2.23 ммоль) безводного Et3N и 0.049 г (0.054 ммоль)
V
1952.9(6) Å3, пространственная группа P-1,
амина. Реакционную смесь кипятили
20 ч, по
C10H6O5 + C2H6SO, Z 6, dвыч 1.450 г/см3, μ 0.268 мм-1.
охлаждении растворитель упаривали, получивший-
Измеряли интенсивность 12184 отражений с 2θ <
ся осадок обрабатывали смесью вода-хлористый
50°, из них 6847 независимых (Rint 0.0554). Резуль-
метилен. Слои разделяли, органический слой
таты уточнения: wR2 0.1992, R 0.1144, S 0.901 для
сушили MgSO4 и упаривали, остаток растирали с
всех отражений, R 0.0620 для 3446 наблюдаемых
эфиром.
отражений [F > 4σ(F)].
г. К раствору 0.1 г (0.45 ммоль) соединения 3 в
7-Гидрокси-2-оксо-2Н-хромен-6-карбонил-
7.5 мл безводного ТГФ добавляли
0.310 мл
хлорид (3). а. К раствору 100 мг (0.49 ммоль)
(2.23 ммоль) безводного Et3N и 0.049 г (0.054 ммоль)
умбеллиферон-6-карбоновой кислоты 2 в 20 мл
амина. Реакционную смесь кипятили в течение
безводного бензола добавляли 0.282 мл (3.92 ммоль)
2 сут. По окончании реакции растворитель упа-
SOCl2. Реакционную смесь кипятили 24 ч. По окон-
ривали, получившийся осадок обрабатывали смесью
чании реакции растворитель упаривали в вакууме.
вода-хлористый метилен. Органический слой
Получали 85 мг (84%) хлорангидрида 3, который
сушили MgSO4 и упаривали.
использовали в дальнейших реакциях без допол-
N-Бензил-7-гидрокси-2-оксо-2Н-хромен-6-
нительной очистки.
карбоксамид (7). Получен по методике в из 0.1 г
б. Раствор 100 мг (0.49 ммоль) умбеллиферон-6-
(0.45 ммоль) хлорангидрида 3 и 0.057 г (0.54 ммоль)
карбоновой кислоты 2 в 2 мл SOCl2 кипятили 1.5 ч.
бензиламина 4. Выход 0.101 г (77%), т.пл. 115°С
Затем тионил хлорид упаривали в вакууме, полу-
(разл., из эфира). ИК спектр, ν, см-1: 3398, 3066,
чали 96 мг (88%) хлорангидрида 3 в виде твердого
3032, 2920, 2850, 1741, 1649, 1569, 1392, 1300,
осадка, который использовали в дальнейших прев-
1238, 1144, 823, 752, 698. УФ-спектр (EtOH), λмакс,
ращениях без дополнительной очистки. Спектр
нм (log ε): 201 (3.79), 204 (3.79), 206 (3.65), 223
ЯМР 1H, δ, м.д.: 6.34 д (1Н, Н4, J 9.4 Гц), 6.88 с (1Н,
(3.43), 244 (3.24), 329 (3.07), 372 (3.45). Спектр
Н8), 7.70 д (1Н, Н3, J 9.4 Гц), 8.26 с (1Н, Н5), 9.98 с
ЯМР 1H, δ, м.д.: 4.56 с (2Н, СН2), 6.10 д (1Н, Н4, J
(1Н, ОН). Спектр ЯМР 13С, δ, м.д.: 105.10 (С8), 112.92
9.4 Гц), 6.67 с (1Н, Н8), 7.23 м (2Наром, Н2',6'), 7.25 м
(С6), 114.62 (С4а), 114.96 (С3), 135.00 (С4), 142.55
(1Hаром, H4'), 7.28 м (2Hаром, H3',5'), 7.55 д (1Н, Н3, J
(С5), 158.90 (С8а), 160.23 (С2), 163.42 (С7), 172.39
9.4 Гц), 7.91 с (1Н, Н5). Спектр ЯМР 13С, δ, м.д.:
(С=О). Hайдено, %: С 53.52; Н 2.26; Cl 15.75.
43.31 (СН2), 104.73 (С8), 110.70 (С6), 112.21 (С3),
C10H5ClO4. Вычислено, %: C 53.48; H 2.24; Cl 15.78.
114.05 (С4а), 120.49 (С5), 127.33 (Саром4'),
127.56
'
,
6
'
,
5
Взаимодействие хлорангидрида 3 с аминами
(С
аром
'),
128.49 (C
аром
'),
137.71 (Cаром1'), 143.65 (C4),
4-6 или эфирами аминокислот 10-16 (общая
157.40 (С8а), 159.33 (C2), 161.00 (С-OH), 164.73
методика). а. К раствору
0.1 г
(0.45 ммоль)
(C=O), 167.76 (C7). Найдено, %: С 69.24; Н 4.52; N
хлорангидрида
3 в
7.5 мл безводного CH2Cl2
4.68. C17H13NO4. Вычислено, %: C 69.15; H 4.44; N
добавляли 0.074 мл (0.54 ммоль) безводного Et3N и
4.74.
0.049 г (1.03 ммоль) амина. Реакционную смесь
N-(2,4-Диметоксибензил)-7-гидрокси-2-оксо-
кипятили 20 ч, по охлаждении растворитель упари-
2Н-хромен-6-карбоксамид (8). Получен по мето-
вали, получившийся осадок обрабатывали смесью
дике в из 0.1 г (0.45 ммоль) хлорангидрида 3 и
вода-хлористый метилен. Слои разделяли,
0.089 г (0.54 ммоль) 2,4-диметоксибензиламина (5).
органический слой сушили MgSO4 и упаривали.
Выход 0.106 г (67%), т.пл. 197-200°С (из эфира).
б. К раствору 0.1 г (0.45 ммоль) соединения 3 в
ИК спектр, ν, см-1: 3384, 3082, 3064, 2944, 2921,
7.5 мл безводного бензола добавляли 0.074 мл
2846, 2515, 1747, 1656, 1626, 1589, 1567, 1510,
(0.54 ммоль) безводного Et3N и 0.049 г (1.03 ммоль)
1392, 1292, 1243, 1211, 1155, 1134, 1114, 1037, 831.
амина. Реакционную смесь кипятили
20 ч, по
УФ-спектр (EtOH), λмакс, нм (log ε): 225 (3.55), 278
охлаждении упаривали, получившийся осадок
(3.79), 283 (3.53), 327 (3.22), 373 (2.91). Спектр
обрабатывали смесью вода-хлористый метилен.
ЯМР 1H, δ, м.д.: 3.69 c (3Н, OСH3), 3.75 с (3Н,
Слои разделяли, органический слой сушили MgSO4
OCH3), 4.44 с (2Н, CH2), 6.12 д (1Н, Н4, J 9.7 Гц),
и упаривали.
6.34 д.д (1Наром, Н5', J 8.2, 2.0 Гц), 6.37 д (1Наром, Н3',
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
1572
ЗАХАРОВ и др.
J 2.0 Гц), 6.69 с (1Н, Н8), 7.13 д (1Наром, Н6', J 8.2 Гц),
Метил-2-(7-гидрокси-2-оксо-2Н-хромен-6-
7.58 д (1Н, Н3, J 9.7 Гц), 7.83 с (1Н, Н5). Спектр
карбоксамидо)-3-метилбутаноат (18). Получен по
ЯМР 13С, δ, м.д.: 38.72 (CH2), 55.19 (OMe), 55.21
методике в из 0.1 г (0.45 ммоль) хлорангидрида 3 и
(OMe), 98.45 (C8), 103.94 (C8'), 104.34 (C6'), 111.28
0.115 г (0.54 ммоль) метилового эфира L-валина
(C4a), 112.70 (C6), 114.21 (C3), 117.98 (C5), 128.54
(11). Выход 0.06 г (40 %), т.пл. 168 °С. [α]
28.5 +3.18
'
'
(C
ар
ом),
130.08 (C
ар
ом),
143.87 (C4), 157.15 (C8а),
(c 1.05, CHCl3). ИК спектр, ν, см-1: 3344, 3066,
'
'
158.37 (C2),
160.44 (C
ар
ом),
161.20 (C
ар
ом),
163.06
2952, 2919, 1743, 1620, 1600, 1565, 1538, 1496,
(C=O), 166.85 (C7), 167.16 (C=O). Найдено, %: С
1388, 1307, 1282, 1147, 1103, 987, 825. УФ-спектр
64.27; Н 4.62; N 3.96. Вычислено, %: C 64.22; H
(CHCl3), λмакс, нм (log ε): 247 (4.78), 307 (4.24), 330
4.82; N 3.94;. Масс-спектр, m/z: 355.1044 [M]+ .
(4.52), 343 (4.44). Спектр ЯМР 1H, δ, м.д.: 0.85 д
Вычислено для C19H17NO6 M 355.1050.
(6Н, 2СН3, J 7.0 Гц), 3.50 м (1Н, СН2'), 3.68 с (3Н,
ОСН3), 5.09 д.д (1Н, СН1', J 7.0, 6.4 Гц), 6.26 д (1Н, Н3,
N-(3,4-Диметоксифенэтил)-7-гидрокси-2-
J 9.4 Гц), 6.86 с (1Н, Н8), 7.59 д (1Н, Н4, J 9.4 Гц),
оксо-2Н-хромен-6-карбоксамид (9). Получен по
8.00 с (1Н, Н5), 8.67 д (1H, NH, J 6.4 Гц), 11.17 с
методике в из 0.1 г (0.45 ммоль) хлорангидрида 3 и
(1Н, ОН). Спектр ЯМР 13С, δ, м.д.: 22.60 (СН3),
0.097 г (0.54 ммоль) 3,4-(диметоксифенил)этил-
23.42 (СН3),
29.68 (С2'),
52.76 (ОСН3),
60.02
амина (6). Выход 0.092 г (56%). Желтое вязкое
(С1'),104.81 (С8), 109.96 (С4а), 111.13 (С6), 111.91
маслообразное вещество. ИК спектр, ν, см-1: 3377,
(С3), 126.99 (С4), 142.97 (С5), 158.87 (С8а), 160.43
2953, 2922, 2850, 1739, 1650, 1602, 1572, 1516,
(С2), 161.83 (С=О), 164.23 (С7), 169.43 (СООМе).
1463, 1390, 1305, 1261, 1234, 1143, 1025, 906, 823,
Найдено, %: C 60.80; H 5.94; N 4.40. C16H17NO6.
259. УФ-спектр (EtOH), λмакс, нм (log ε): 225 (3.61),
Вычислено, %: C 60.18; H 5.37; N 4.39.
286 (3.78), 328 (3.36), 372 (3.07). Спектр ЯМР 1H, δ,
м.д.: 2.88 т (2Н, СН27', J 8.8 Гц), 3.70 м (2Н, СН28', J
Метил-2-(7-гидрокси-2-оксо-2Н-хромен-6-
8.8 Гц), 3.82 с (3Н, ОСH3), 3.84 с (3Н, ОCH3), 6.17 д
карбоксамидо)-4-(метилтио)бутаноат
(19).
(1Н, Н3, J 9.4 Гц), 6.73 с (1Н, Н8), 6.74-6.89 м (3Н,
Получен по методике в из 0.1 г (0.45 ммоль) хлор-
Н2'-4') 7.34 с (1H, H5), 7.51 д (1Н, Н4, J 9.4 Гц).
ангидрида 3 и 0.107 г (0.54 ммоль) метилового
Спектр ЯМР 13С, δ, м.д.: 34.97 (C7'), 41.02 (C8'),
эфира L-метионина
12. Выход
0.104 г
(60%),
28.5
55.87 (2OMe), 105.41 (C8), 111.03 (C4a), 111.47 (C7'),
желтое масло, [α]
+13.34 (с 1.00, CHCl3). ИК
111.94 (C10'), 112.96 (C3), 113.41 (C6), 120.69 (C6'),
спектр, ν, см-1: 3344, 3062, 2952, 2920, 2850, 1739,
126.23 (C5), 130.87 (C5'), 142.97 (C4), 147.89 (C8'),
1648, 1600, 1568, 1548, 1439, 1388, 1307, 1230,
149.14 (C9'), 157.81 (C8a), 161.64 (C2), 165.05 (C=O),
1147, 1103, 912, 825, 752. УФ-спектр (EtOH), λмакс,
168.63 (C7). Найдено, %: С 65.22; Н 5.32; N 3.65.
нм (log ε): 247 (4.84), 306 (4.27), 330 (4.14). Спектр
C20H19NO6. Вычислено, %: C 65.03; H 5.18; N 3.79.
ЯМР 1H, δ, м.д.: 2.08 с (3Н, SСН3), 2.14 м (2Н, Н1'),
2.58 т (2Н, Н2', J 8.4 Гц), 3.79 с (3Н, ОСН3), 4.90 т
Метил-2-(7-гидрокси-2-оксо-2Н-хромен-6-
(1Н, СН), 6.19 д (1Н, Н3, J 9.5 Гц), 6.71 с (1Н, Н8),
карбоксамидо)пропаноат (17). Получен по мето-
7.56 д (1Н, Н4, J 9.5 Гц), 7.77 с (1Н, Н5). Спектр
дике в из 0.1 г (0.45 ммоль) хлорангидрида 3 и
ЯМР 13С, δ, м.д.: 15.47 (SCH3), 30.21 (С2'), 30.73
0.075 г (0.54 ммоль) метилового эфира L-аланина
(С1'), 51.86 (ОСН3), 52.90 (СН), 105.23 (С8), 111.37
(10). Выход 0.067 г (46%), т.пл. 168°С (разл., из
28.5
(С4а), 111.71 (С6), 113.69 (С3), 126.90 (С4), 143.03
эфира), [α]
6.15 (с 1.00, CHCl3). ИК спектр, ν,
(С5), 157.92 (С8а), 160.25 (С2), 164.49 (С=О), 168.61
см-1: 3386, 3351, 3060, 2952, 2921, 1741, 1650, 1571,
(С7), 172.49 (СООМе). Найдено, %: С 54.86; Н 4.94;
1390, 1309, 1215, 1147, 1111, 825. УФ-спектр (EtOH),
N 3.87; S 9.02. Вычислено, %: C 54.69; H 4.88; N
λмакс, нм (log ε): 225 (3.77), 242 (3.53), 327 (3.42),
3.99; S 9.12. Масс-спектр m/z: 351.0772 [M]+. Вычис-
371 (3.12). Спектр ЯМР 1H, δ, м.д.: 1.54 д (3Н, СН3,
лено для C16H17NO6S M 351.0771.
J 7.2 Гц), 3.71 с (3Н, ОСН3), 4.75 д.д (1Н, СН, J 6.5,
7.2 Гц), 6.25 д (1Н, Н4, J 9.4 Гц), 6.79 с (1Н, Н8),
Метил-2-(7-гидрокси-2-оксо-2Н-хромен-6-
7.58 д (1Н, Н3, J 9.4 Гц), 7.64 с (1Н, Н5), 8.35 д (1H,
карбоксамидо)-3-фенилпропаноат (20). Получен
NH, J 6.5 Гц). Спектр ЯМР 13С, δ, м.д.: 18.21 (СН3),
по методике в из 0.1 г (0.45 ммоль) хлорангидрида
48.41 (ОСН3), 52.90 (СН), 105.42 (С8), 111.40 (С4а),
3 и 0.115 г (0.54 ммоль) метилового эфира L-
111.67 (С6), 113.89 (С3), 126.38 (C5), 142.82 (С4),
фенилаланина (13). Выход 0.057 г (55%), желтое
28.5
158.02 (С8а), 160.18 (С2), 164.70 (С=О), 168.35 (С7),
масло, [α]
+7.12 (с 1.00, CHCl3). ИК спектр, ν,
173.43 (СООМе). Найдено, %: С 57.89; Н 4.60; N 4.73.
см-1: 3369, 3062, 3029, 2919, 2850, 1743, 1648, 1619,
C14H13NO6. Вычислено, %: C 57.73; H 4.50; N 4.81.
1600, 1571, 1540, 1388, 1217, 1147, 1101, 823, 700.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
РАСТИТЕЛЬНЫЕ КУМАРИНЫ: XVII.
1573
УФ-спектр (EtOH), λмакс, нм (log ε): 201 (4.57), 205
13С, δ, м.д.: 24.63 (C6'), 26.57 (C3'), 28.73 (C5'), 28.87
(4.32), 225 (4.67), 243 (4.21), 327 (4.18), 375 (3.84).
(C4'), 29.22 (C2'), 33.93 (C7'), 39.82 (C1'),
51.53
Спектр ЯМР 1H, δ, м.д.: 3.01-3.24 м (2Н, СН2), 3.71
(ОСН3), 105.36 (С8), 111.15 (С4а), 112.45 (С6), 113.55
с (3Н, ОСН3), 4.95 м (1Н, СН), 6.13 д (1Н, Н3, J
(С3), 126.19 (С4), 143.03 (С5), 157.74 (С8а), 160.38
9.4 Гц), 6.72 с (1Н, Н8), 7.15-7.24 м (3Наром, Н2',4',6'),
(С2), 164.82 (С=О), 168.72 (С7), 174.34 (СООМе).
7.32-7.40 м (3Наром, Н3',5'), 7.42 с (1Н, Н5), 7.43 д
Найдено, %: С 63.29; Н 6.52; N 3.77. C19H23NO6.
(1Н, Н4, J 9.4 Гц). Спектр ЯМР 13С, δ, м.д.: 37.57
Вычислено, %: C 63.15; H 6.42; N 3.88.
(CH2), 52.64 (OCH3), 53.37 (CH), 105.32 (C8), 111.32
Метил-8-(7-гидрокси-2-оксо-2Н-хромен-6-
(C4a), 111.72 (C6), 113.72 (C3), 126.35 (C4), 127.32
'
'
,
6
'
,
5
'
карбоксамидо)нонаноат (23). Получен по методи-
(C
ар
ом), 128.65 (C
аром
'),
129.13 (C
аром
'),
135.29 (Cа
ом),
ке в из 0.1 г (0.45 ммоль) хлорангидрида 3 и 0.120 г
142.77 (C5), 157.96 (C8a), 160.05 (C2), 164.51 (C=O),
(0.54 ммоль) гидрохлорида метилового эфира 9-
168.11 (COOMe), 171.77 (C7). Найдено, %: С 65.68;
аминопеларгоновой кислоты 16. Выход 0.130 г
Н 4.73; N 3.75. Вычислено, %: C 65.39; H 4.66; N
(71%), т.пл. 78°С (из эфира). ИК спектр, ν, см-1:
3.81. Масс-спектр m/z: 367.1053 [M]+. Вычислено
3409, 3380, 3055, 2925, 2854, 1736, 1708, 1653,
для C20H17NO6 M 367.1050.
1622, 1570, 1437, 1390, 1311, 1246, 1145, 916, 854,
Метил-3-(7-гидрокси-2-оксо-2Н-хромен-6-
837, 825. УФ-спектр (EtOH), λмакс, нм (log ε): 245
карбоксамидо)-3-фенилпропаноат (21). Получен
(3.72), 307 (3.34), 331 (3.20). Спектр ЯМР 1H, δ,
по методике в из 0.1 г (0.45 ммоль) хлорангидрида
м.д.: 1.27 м (8H, Н2'-5'), 1.59 м (4H, H6',7'), 2.28 т (2H,
3 и 0.115 г (0.54 ммоль) метилового эфира 3-амино-
H8'), 3.43 т (2H, H1'), 3.64 с (3Н, ОСН3), 6.20 д (1Н,
3-фенилпропановой кислоты (14). Выход 0.095 г
Н3, J 9.4 Гц), 6.81 с (1Н, Н8), 7.59 c (1Н, Н5), 7.65 д
(53%), т.пл. 94°С (разл., из эфира). ИК спектр, ν,
(1Н, Н4, J 9.4 Гц). Спектр ЯМР 13С, δ, м.д.: 24.72
см-1: 3435, 3336, 3060, 3033, 2951, 2850, 1737, 1621,
(C6'), 26.72 (C3'), 28.64 (C5'), 28.84 (C4'), 29.20 (C2'),
1600, 1533, 1436, 1390, 1296, 1238, 1213, 1168,
33.92 (C7'), 39.84 (C1'), 51.37 (ОСН3), 105.17 (С8),
1116, 910, 700. УФ-спектр (EtOH), λмакс, нм (log ε):
111.09 (С4а), 112.51 (С6), 113.37 (С3), 126.26 (С4),
206 (4.75), 223 (4.45), 328 (4.29), 372 (4.03). Спектр
143.06 (С5), 157.63 (С8а), 160.37 (С2), 164.72 (С=О),
ЯМР 1H, δ, м.д.: 2.65, 2.97 м (оба м, 2Н, CH2), 3.61 с
168.64 (С7), 174.29 (СООМе). Найдено, %: С 63.29;
(3Н, ОСН3), 5.58 м (1Н, СН), 6.18 д (1Н, Н4, J 9.4
Н 6.52; N 3.77. C19H23NO6. Вычислено, %: C 63.15;
Гц), 6.75 с (1Н, Н8), 7.22-7.30 м (3Наром, Н2',4',6'),
H 6.42; N 3.88.
7.41-7.48 м (3Наром, Н3',5'), 7.61 д (1Н, Н3, J 9.4 Гц),
7.89 с (1Н, Н5). Спектр ЯМР 13С, δ, м.д.: 39.76
2-(7-Гидрокси-2-оксо-2Н-хромен-6-карбокса-
(СН2), 49.79 (СН), 51.99 (ОСН3), 104.76 (С8), 111.23
мидо)уксусная кислота (24). Получена по мето-
'
,
6
(С4а), 112.93 (С6), 113.38 (C3), 126.13 (С
'), 128.12
дике г из 0.1 г (0.45 ммоль) хлорангидрида 3 и
аром
'
'
,
5
(C4),
128.17 (C
ар
ом),
128.72 (C
а
р
ом
'),
143.61 (C5),
0.04 г (0.54 ммоль) глицина. Выход 0.101 г (86%),
'
147.22 (C
ар
ом),
157.50 (C8a), 160.89 (C2),
163.92
т.пл. 208°С (из эфира). ИК спектр, ν, см-1: 3386,
(C=O), 167.21 (C7), 171.93 (COOMe). Найдено, %: С
3163, 3058, 3008, 2965, 2919, 2699, 1742, 1626,
65.48; Н 4.73; N 3.77. C20H17NO6. Вычислено, %: C
1601, 1577, 1492, 1391, 1298, 1222, 1190, 1147,
65.39; H 4.66; N 3.81.
1103, 1076, 1042, 904, 828. УФ-спектр (EtOH), λмакс,
нм (log ε): 205 (4.38), 224 (4.29), 243 (4.33), 326
Метил-8-(7-гидрокси-2-оксо-2Н-хромен-6-
(4.15). Спектр ЯМР 1H, δ, м.д.: 3.97 с (2Н, СН2),
карбоксамидо)октаноат (22). Получен по мето-
6.05 д (1Н, Н3, J 9.6 Гц), 6.65 с (1Н, Н8), 7.59 д (1Н,
дике в из 0.1 г (0.45 ммоль) хлорангидрида 3 и
Н4, J 9.6 Гц), 7.93 с (1Н, Н5). Спектр ЯМР 13С, δ,
0.112 г (0.54 ммоль) гидрохлорида метилового
м.д.: 40.96 (С1'), 103.88 (С8), 111.49 (С4а), 112.63
эфира 8-аминокаприловой кислоты (15). Выход
(С6), 113.98 (С3), 129.49 (С4), 144.05 (С5), 161.22
0.132 г (75%), вязкое маслообразное вещество. ИК-
(С8а), 162.10 (С2), 167.28 (С=О), 167.30 (С7), 171.46
спектр, ν, см-1: 3409, 3380, 3055, 2925, 2854, 1736,
(СООН). Найдено, %: C 55.01; H 3.64; N 5.13.
1708, 1653, 1622, 1570, 1437, 1390, 1311, 1246,
C12H9NO6. Вычислено, %: C 54.76; H 3.45; N 5.32.
1145, 916, 854, 837, 825. УФ-спектр (EtOH), λмакс,
нм (log ε): 245 (3.72), 307 (3.34), 331 (3.20). Спектр
2-(7-Гидрокси-2-оксо-2Н-хромен-6-карбокса-
ЯМР 1H, δ, м.д.: 1.33 м (6H, С5',4',3'), 1.59 м (4H,
мидо)уксусной кислоты хлорангидрид (25). Раст-
H6',2'), 2.28 т (2H, H7'), 3.43 т (2H, H1'), 3.64 с (3Н,
вор 0.15 г (0.49 ммоль) соединения 24 в 2 мл SOCl2
ОСН3), 6.22 д (1Н, Н3, J 9.4 Гц), 6.83 с (1Н, Н8), 7.59
кипятили в течение 1.5 ч. Затем хлориcтый тионил
д (1Н, Н4, J 9.4 Гц), 7.65 с (1Н, Н5). Спектр ЯМР
упаривали в вакууме и получали 0.13 г (81%) хлор-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
1574
ЗАХАРОВ и др.
ангидрида 25. Аморфный порошок. Спектр ЯМР
Метил-2-[2-(7-гидрокси-2-оксо-2Н-хромен-6-
1H, δ, м.д.: 4.23 с (2Н, СН2), 6.31 д (1Н, Н3, J 9.4 Гц),
карбоксамидо)ацетамидо]бутаноат (29). Получен
6.91 с (1Н, Н8), 7.85 д (1Н, Н4, J 9.4 Гц), 8.19 с (1Н,
по методике в из 0.1 г (0.35 ммоль) хлорангидрида
Н5), 9.97 (2Н, NH, OH). Спектр ЯМР 13С, δ, м.д.:
25 и 0.048 г (0.42 ммоль) метилового эфира α-
50.10 (С1'), 95.65 (С8), 111.49 (С4а), 112.63 (С6),
аминомасляной кислоты (26). Выход 0.095 г (75%),
113.89 (С3), 129.49 (С4), 144.05 (С5), 157.07 (С8а),
т.пл. 114°С (из эфира). ИК спектр, ν, см-1: 3503,
161.22 (С2), 162.04 (C7), 162.10 (С=О),
169.66
3399, 3247, 3065, 2956, 2919, 2850, 1741, 1678,
(COOCl). Найдено, %: C 48.22; H 2.18; Cl 12.12; N
1627, 1599, 1579, 1491, 1460, 1391, 1294, 1211,
4.56. C12H8ClNO6. Вычислено, %: C 48.42; H 2.71;
1145,
1118,
1105,
1076,
912,
827. УФ-спектр
Cl 11.91; N 4.71.
(CHCl3), λмакс, нм (log ε): 205 (4.32), 242 (4.21), 324
(4.06), 349 (3.7). Спектр ЯМР 1H, δ, м.д.: 1.85 м (3H,
N-[2-(Бензиламино)-2-оксоэтил]-7-гидрокси-
CH9'), 2.25-2.48 м (2Н, СН7'), 3.74 (3H, OСH3), 4.34
2-оксо-2H-хромен-6-карбоксамид
(27). Получен
м (3H, CH3' + CH6'), 6.25 д (1Н, Н3, J 9.6 Гц), 6.85 с
по методике в из 0.1 г (0.35 ммоль) хлорангидрида
(1Н, Н8), 7.61 д (1Н, Н4, J 9.6 Гц), 8.05 с (1Н, Н5).
25 и 0.046 мл (0.42 ммоль) бензиламина 4. Выход
Спектр ЯМР 13С, δ, м.д.: 21.83 (С8'), 25.24 (C7'),
0.081 г (66%), желтое вязкое масло. ИК спектр, ν,
44.53 (C3'), 54.79 (OMe), 56.15 (C6'), 104.33 (С8),
см-1: 3445, 3348, 2917, 2849, 2599, 2489, 1753, 1737,
109.69 (С4а), 111.61 (С6), 113.53 (С3), 131.06 (С4),
1645, 1612, 1601, 1496, 1480, 1418, 1388, 1320,
142.86 (С5), 158.64 (С8а), 159.91 (С2), 163.38 (C7),
1299, 1287, 1146, 1134, 1096, 1028, 908, 826, 748,
164.42 (С1'=O), 170.78 (C4'=O), 177.49 (COOMe).
741. УФ-спектр (CHCl3), λмакс, нм (log ε): 202 (4.48),
Найдено, %: C 55.94; H 5.45; N 7.87. C17H18N2O7.
237 (4.25), 300 (3.85), 327 (3.97). Спектр ЯМР 1H, δ,
Вычислено, %: C 56.35; H 5.01; N 7.73.
м.д.: 3.73 с, 4.01 с (2Н, СН2), 6.09 д (1Н, Н3, J
9.8 Гц), 6.59, 7.00 м (5Наром), 6.69 c (1H, H8), 7.57 д
БЛАГОДАРНОСТИ
(1Н, Н4, J 9.8 Гц), 7.93 с (1Н, Н5). Спектр ЯМР 13С,
δ, м.д.: 42.92, 51.85 (CH2), 95.77 (С8), 111.43 (С4а),
Авторы благодарят Химический Сервисный
112.76 (С6), 113.73 (С3), 115.85 (C8',12'), 119.36 (С4),
Центр коллективного пользования СО РАН за
121.10 (C10'), 128.93 (C9',11'), 131.14 (C7'), 143.93 (С5),
спектральные и аналитические исследования.
157.08 (С8а), 158.20 (С2), 161.05 (C7), 161.99 (С1'=O),
169.91 (C4'=O). Найдено, %: C 65.16; H 4.21; N 8.08.
ФОНДОВАЯ ПОДДЕРЖКА
C19H16N2O5. Вычислено, %: C 64.77; H 4.58; N 7.95.
N-[2-(2,4-Диметоксибензиламино)-2-оксо-
Работа выполнена при финансовой поддержке
этил]-7-гидрокси-2-оксо-2H-хромен-6-карбокса-
Российского фонда фундаментальных исследова-
мид (28). Получен по методике в из 0.1 г (0.35 ммоль)
ний и Правительства Новосибирской области
хлорангидрида 25 и 0.063 мл (0.42 ммоль) 2,4-
(проект № 18-43-543014).
диметоксибензиламина (5). Выход 0.089 г (62%),
желтое вязкое масло. ИК спектр, ν, см-1: 3372, 3285,
КОНФЛИКТ ИНТЕРЕСОВ
2993, 2953, 2918, 2849, 1736, 1628, 1591, 1510,
Авторы заявляют об отсутствии конфликта
1464, 1456, 1391, 1287, 1209, 1159, 1141, 1030, 831.
интересов.
УФ-спектр (CHCl3), λмакс, нм (log ε): 204 (4.56), 227
(4.19), 283 (3.64), 329 (3.81), 372 (3.35). Спектр
СПИСОК ЛИТЕРАТУРЫ
ЯМР 1H, δ, м.д.: 3.71 с, 3.73 с (3Н, OСН3), 3.99 м,
4.14 м (2Н, CH2), 6.09 д (1Н, Н3, J 9.4 Гц), 6.29 уш.c
1. Lipeeva A.V., Shults E.E. Сhem. Heterocycl. Compd.
(2H, H8',9'), 6.37 д (1Н, Н11', J 9.1 Гц), 6.65 c (1H, H8),
2017, 53, 1302. doi 10.1007/s10593-018-2210-5
7.57 д (1Н, Н4, J 9.4 Гц), 7.92 с (1Н, Н5). Спектр
2. Aoki T., Hyohdoh I., Furuichi N., Ozawa S., Watanabe F.,
ЯМР 13С, δ, м.д.: 44.84, 51.86 (CH2), 67.92, 68.50
Matsushita M., Sakaitani M., Ori K., Takanashi K.,
(OMe), 96.05 (С8), 98.38 (C11'), 104.65 (C9'), 110.00
Harada N., Tomii Y., Tabo M., Yoshinari K., Aoki Y.,
(С4а), 111.81 (С6), 113.84 (С3), 114.91 (C7'), 120.04
Shimma N., Iikura H. Bioorg. Med. Chem. Lett. 2013,
(С4), 131.30 (C8'), 143.16 (С5), 159.03 (С8а), 159.52
23, 6223. doi 10.1016/j.bmcl.2013.10.001
(C12'), 160.16 (C10'), 164.74 (С2), 167.78 (C7), 168.93
3. Shakeel-u-Rehman, Masood-ur-Rahman, Tripathi V.K.,
(С1'=O), 171.09 (C4'=O). Найдено, %: C 60.89; H
Singh J., Ara T., Koul S., Farooq S., Kaul A. Bioorg
4.25; N 6.62. C21H20N2O7. Вычислено, %: C 61.16; H
Med. Chem. Lett.
2014,
24,
4243. doi
10.1016/
4.89; N 6.79.
j.bmcl.2014.07.031
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
РАСТИТЕЛЬНЫЕ КУМАРИНЫ: XVII.
1575
4. Emami S., Dadashpour S. Eur. J. Med. Chem. 2015,
15. Soine T.O., Zheveleva A., Mahandrus M.M., Erhardt P.,
102, 611. doi 10.1016/j.ejmech.2015.08.033
Bubeva-Ivanova L. J. Pharm. Sci. 1973, 62, 1879.
5. Márquez N., Sancho R., Bedoya L.M., Alcami J.,
16. Buchstaller H.-P., Eggenweiler H.-M., Sirrenberg C.,
López-Pérez J.L., Feliciano A.S., Fiebich B.L.,
Grädler U., Musil D, Hoppe E., Zimmermann A.,
Muñoz E. Antivir. Res. 2005, 66, 137. doi 10.1016/
Schwartz H., März J., Bomke J., Wegener A., Wolf M.
j.antiviral.2005.02.006
Bioorg. Med. Chem. Lett. 2012, 22, 4396. doi 10.1016/
6. Hassan Mohd. Z., Osman H., Ali M.A., Ahsan M.J. Eur.
j.bmcl.2012.04.121
J. Med. Chem.
2016,
123,
236. doi
10.1016/
17. Omid N.J., Javan N.B., Dehpour A.-R, Partoazar A.,
j.ejmech.2016.07.056
Tehrani M.R., Dorkoosh F. Int. J. Pharm. 2018, 535,
7. Hamdy A.M., Khaddour Z., Al-Masoudi N.A., Rahman Q.,
293. doi 10.1016/j.ijpharm.2017.11.020
Hering-Junghans C., Villinger A., Langer P. Bioorg. Med.
18. Han N.-R., Kim H.-Y., Kim N.-R., Lee W.-K.,
Chem. 2016, 24, 5115. doi 10.1016/j.bmc.2016.08.029
Jeong H., Kim H.-M., Jeong H.-J. Mol. Med. Rep. 2018,
8. Kinoshita M., Negishi M., Sakai H., Hirano T., Mori S.,
17, 4120. doi 10.3892/mmr.2017.8335
Fujii S., Kagechika H., Tanatani A. Bioorg. Med. Chem.
19. Swatek K.N., Aumayr M., Pruneda J.N., Visser L.J.,
2016, 24, 5602. doi 10.1016/j.bmc.2016.09.020
Berryman S., Kueck A.F., Geurink P.P., Ovaa H.,
9. Finn G., Creaven B., Egan D. Eur. J. Pharmacol. 2003,
van Kuppeveld F.J.M., Tuthill T.J., Skern T.,
481, 159. doi 10.1016/j.ejphar.2003.09.035
Komander D. PNAS. 2018, 115, 2371. doi 10.1073/
pnas.1710617115
10. He X., Chen Y.-Y., Shi J.-B., Tang W.-J., Pan Z.-X.,
Dong Z.-Q., Song B.-A., Li J., Liu X.-H. Bioorg. Med.
20. Beh H.-K., Ismail Z., Asmawi M.Z., Loh W.-S., Fun H.-K.
Chem. 2014, 22, 3732. doi 10.1016/j.bmc.2014.05.002
Acta Crystallogr.
2010, E66, o2138. doi
10.1107/
S1600536810029296
11. Махнева Е.А., Липеева А.В., Шульц Э.Э.,
Шакиров М.М., Толстиков Г.А. ЖOpХ. 2012, 48,
21. Осадчий С.А., Шульц Э.Э., Шакиров М.М.,
1097.
[Makhneva E.A., Lipeeva A.V., Shults E.E.,
Толстиков Г.А. Изв. РАН. Сер. хим. 2006, 55, 363.
Shakirov M.M., Tolstikov G.A. Russ. J. Org. Chem.
[Osadchii S.A., Shul’ts E.E., Shakirov M.M.,
2012, 48, 1094.] doi 10.1134/S1070428012080106
Tolstikov G.A. Russ. Chem. Bull. 2006, 55, 375.] doi
10.1007/s11172-006-0263-6
12. Махнева Е.А., Липеева А.В., Шульц Э.Э. ЖОрХ.
2014,
50,
676.
[Makhniova E.A., Lipeeva A.V.,
22. Физер Л., Физер М. Реагенты для органического
Shul’ts E.E. Russ. J. Org. Chem. 2014, 50, 662.] doi
синтеза. M.: Мир, 1970, III, 331.
10.1134/S107042801405008X
23. Петренко Н.И., Петухова В.З., Шакиров М.М.,
13. Lipeeva A.V., Khvostov M.V., Baev D.S., Shakirov M.M.,
Шульц Э.Э., Толстиков Г.А. ЖОрХ. 2000, 36, 1013.
Tolstikova T.G., Shults E.E. Med. Chem. 2016, 12, 674.
[Petrenko N.I., Petukhova V.Z., Shakirov M.M.,
doi 10.2174/1573406412666160129105115
Shul’ts E.E., Tolstikov G.A. Russ. J. Org. Chem. 2000,
14. Lipeeva A.V., Brysgalov A.O., Tolstikova T.G., Shults E.E.
36, 982.]
Curr. Bioactive Compd. 2019, 15, 71. doi 10.2174/
24. Данные РСА для соединения 2 доступны по адресу
1573407213666171030152601
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
1576
ЗАХАРОВ и др.
Study of Plant Coumarins: XVII.
Synthesis and Transformations of 6-Carboxamidocoumarins
D. O. Zakharova, A. V. Lipeevaa, Yu. V. Gatilova,b, A. G. Makarova, and E. E. Shultsa,b, *
a N.N. Vorozhtsov Novosibirsk Institute of Organic Chemistry SB RAS,
630090, Russia, Novosibirsk, pr. Akademika Lavrent’eva 9
*e-mail: schultz@nioch.nsc.ru
b Novosibirsk State University,630090, Russia, Novosibirsk, ul. Pirogova 1
Received April 13, 2019; revised August 15, 2019; accepted August 16, 2019
The preparation of the umbelliferone-6-carboxylic acid chloride from plant coumarin peuruthenicin is described.
The interaction of the umbelliferone-6-carboxylic acid chloride with amines and methyl esters of α-, β - or ω-
amino acids leads to the corresponding N-substituted 6-carboxamides. Reaction of 2-(7-hydroxy-2-oxo-2H-
chrome-6-carboxamido)acetic acid (obtained in the interaction of the mentioned acid chloride with glycine), with
thionyl chloride affords the corresponding acid chloride, which easily interacts with benzylamine and methyl
esters of α-amino acids, giving coumarin derivatives containing dipeptide fragments.
Keywords: coumarin, umbelliferone, benzyl amine, amino acid, peptide, amide
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019