ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 10, с. 1630-1632
КРАТКИЕ СООБЩЕНИЯ
УДК 547.745 + 547.759.5 + 547.867.8
ВЗАИМОДЕЙСТВИЕ ПИРРОЛО[2,1-a][1,4]ОКСАЗИН-1,6,7-
ТРИОНОВ С КАРБОЦИКЛИЧЕСКИМИ
ЕНАМИНОКЕТОНАМИ. СИНТЕЗ СПИРО-
[ИНДОЛ-3,2'-ПИРРОЛОВ]
© 2019 г. Н. А. Третьяков, А. Н. Масливец*
ФГБОУ ВО «Пермский государственный национальный исследовательский университет»,
614990, Россия, г. Пермь, ул. Букирева 15
*e-mail: koh2@psu.ru
Поступила в редакцию 11 марта 2019 г.
После доработки 13 мая 2019 г.
Принята к публикации 30 мая 2019 г.
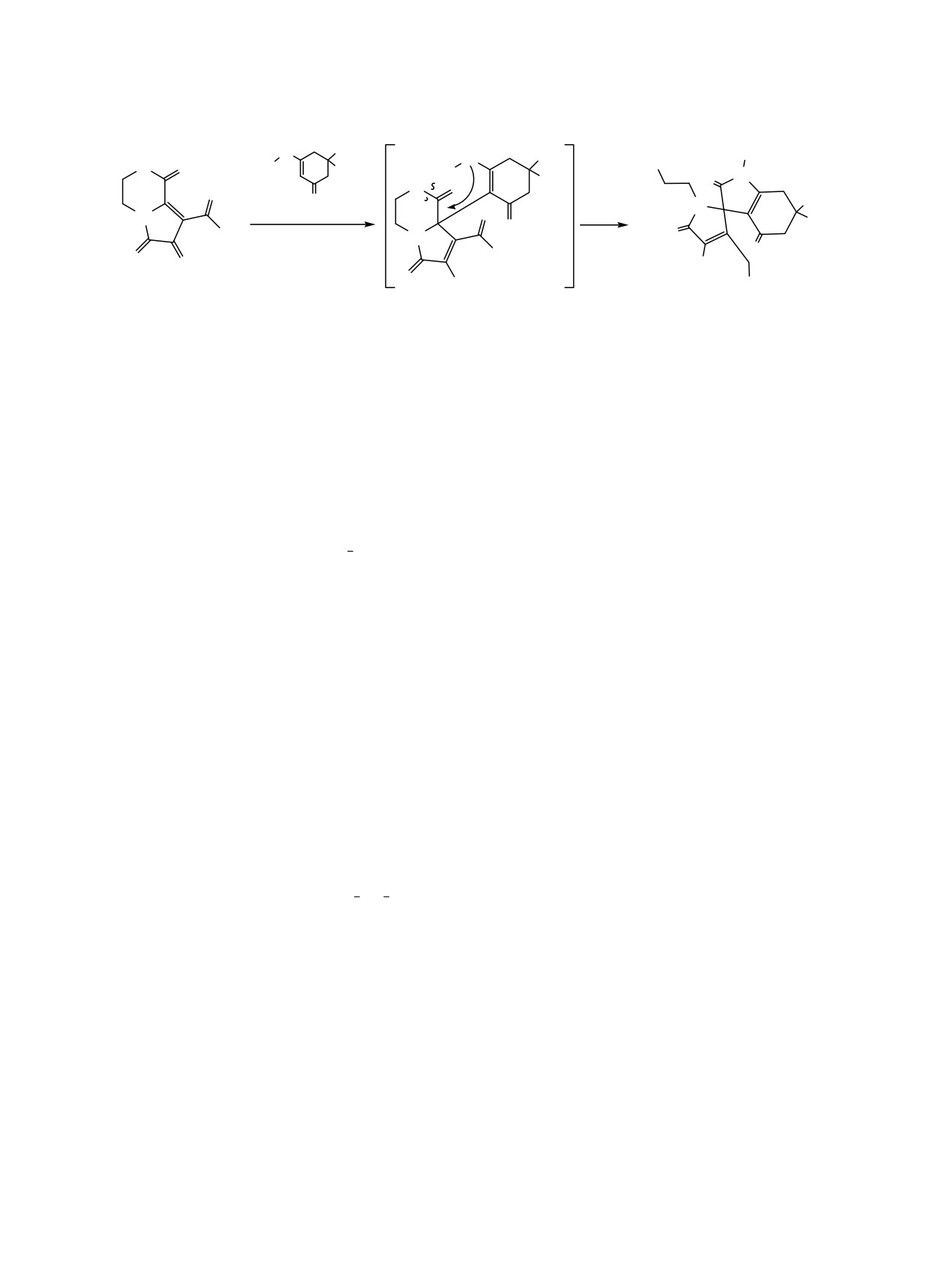
8-Ароил-3,4-дигидро-1Н-пирроло[2,1-а][1,4]оксазин-1,6,7-трионы реагируют с 3-бензиламино-5,5-диме-
тилциклогекс-2-ен-1-оном с образованием 3'-ароил-1-бензил-4'-гидрокси-1'-(2-гидроксиэтил)-6,6-диме-
тил-6,7-дигидроспиро[индоло-3,2'-пиррол]-2,4,5'(1Н,1'Н,5Н)-трионов.
Ключевые слова: 1Н-пиррол-2,3-дионы, пирролооксазин-1,6,7-трионы, циклогекс-2-ен-1-он, спиро[ин-
доло-3,2'-пиррол]-2,4,5'-трион, рециклизация.
DOI: 10.1134/S0514749219100173
Описаны три направления взаимодействия гете-
2,7b-метанобензо[5,6][1,4]диазепино[1,7-a]хино-
рено[е]пиррол-2,3-дионов с енаминами. 3-Ароил-
ксалинов [12].Реакции пирроло[2,1-а][1,4]оксазин-
пирроло[1,2-с][4,1]бензоксазепин-1,2,4-трионы
1,6,7-трионов с енаминами ранее не изучались.
(1Н-пиррол-2,3-дионы, аннелированные по стороне
При взаимодействии
8-ароил-3,4-дигидро-1Н-
[е] бензоксазепиноновым фрагментом) реагируют с
пирроло[2,1-а][1,4]оксазин-1,6,7-трионов 1a, b [13]
3-аминоциклогекс-2-енонами с первоначальным
с 3-бензиламино-5,5-диметилциклогекс-2-ен-1-оном
переамидированием γ-лактамного фрагмента пир-
2 образуются 3'-ароил-1-бензил-4'-гидрокси-1'-(2-гид-
ролобензоксазепинтрионов аминогруппой реа-
роксиэтил)-6,6-диметил-6,7-дигидроспиро[индол-
гента, замыканием пиррольного цикла и переэте-
3,2'-пиррол]-2,4,5'(1Н,1'Н,5Н)-трионы 3a, b (схема 1).
рефикацией ε-лактона в γ-лактон с образованием
спиро[фуран-2,3'-индолов]
[1]. Спиро-гетероцик-
По-видимому, соединения
3 образуются
лизации
3-ацилпирроло[1,2-а][1,4]бензоксазин-
вследствие последовательной нуклеофильной
1,2,4-трионов под действием карбоциклических [2-
атаки группами β-CH и NH енаминофрагмента
6], гетероциклических [7-9] и ациклических енами-
енамина
2 атомов С8а и С1 соединений 1 и
нов [10, 11] протекают по схеме последовательной
последующего раскрытия оксазинового цикла по
атаки группами β-CH и NH енаминофрагмента
связи С1-O2 по схеме, близкой к описанной ранее
енаминов атомов С3а и С4=О пирролобензокса-
для пирролобензоксазинтрионов [2-11].
зинтрионов с расщеплением оксазинонового цикла
1-Бензил-4'-гидрокси-1'-(2-гидроксиэтил)-6,6-
по связи С4-О5. 3-Ароил-5-фенилпирроло[1,2-а]хи-
диметил-3'-(4-метоксибензоил)-6,7-дигидро-
ноксалин-1,2,4-трионы взаимодействуют с 3-амино-
спиро[индоло-3,2'-пиррол]-2,4,5'(1Н,1'Н,5Н)-
циклогекс-2-енонами последовательной атакой
трион (3а). К раствору 3.5 ммоль соединения 1а в
группами β-CH и NH енаминофрагмента енаминов
15 мл сухого хлороформа добавляли раствор
атомов С3а и С2=О с образованием мостиковых
3.5 ммоль соединения 2 в 5 мл сухого хлороформа,
1630
ВЗАИМОДЕЙСТВИЕ ПИРРОЛО[2,1-a][1,4]ОКСАЗИН-1,6,7-ТРИОНОВ
1631
Схема 1.
H
Me
H
N
Me
Bn
Bn
N
HO
O O
Me
Bn
N
Me
O
O O
O
O
Me
N
2
O
N
Me
O
Ar
N
O
Ar
O
O
O
O
HO
O
OH
Ar
1a, b
3a, b
1, 3 Ar = 4-МеOC6H4 (а), 4-ClC6H4 (b).
кипятили 5 мин, охлаждали, образовавшийся осадок
ТМС. Элементный анализ выполняли на анали-
отфильтровывали. Выход
63%, т.пл.
224-225°С
заторе Vario MICRO cube. Индивидуальность синте-
(CHCl3). ИК спектр, ν, см-1: 3420 (CH2CH2OH),
зированных соединений подтверждена методом ТСХ
3130 (C4'OН), 1722 (C5'=O), 1704 (C2=O),
1660
на пластинках Merck Silica gel 60 F254, элюент -
(ArC=O), 1632 (C4=O). Спектр ЯМР 1Н, δ, м.д.: 0.82
этилацетат, проявляли парами иода.
с (3Н, Ме), 1.03 с (3Н, Ме), 1.96-2.66 м (4H,
NCH2CH2OH), 3.13 т (2Н, C7H2, J 7.0 Hz), 3.36 т
ФОНДОВАЯ ПОДДЕРЖКА
(2Н, C5H2, J 7.0 Гц), 3.83 с (3Н, МеO), 4.67 уш.с
(1Н, NCH2CH2OH), 4.90 к (2H, NCH2Ph, J 16.3 Гц),
Исследование выполнено при финансовой
7.00 д (2Н, Наром, J 8.9 Гц), 7.33 т (1Н, Наром, J 7.3 Гц),
поддержке РФФИ в рамках научного проекта
7.41 т (2Н, Наром, J 7.5 Гц), 7.50 д (2Н, Наром, J 7.2 Гц),
№ 19-33-90222, Минобрнауки России (проект
7.68 д (2Н, Наром, J 8.9 Гц), 11.96 уш.с (1Н, C4'OН).
№ 4.6774.2017/8.9) и Правительства Пермского края.
Найдено, %: C 67.87; H 5.74; N 5.29. C30H30N2O7.
Вычислено, %: C 67.91; H 5.70; N 5.28.
КОНФЛИКТ ИНТЕРЕСОВ
1-Бензил-4'-гидрокси-1'-(2-гидроксиэтил)-6,6-
Авторы заявляют об отсутствии конфликта
диметил-3'-(4-хлорбензоил)-6,7-дигидроспиро-
интересов.
[индоло-3,2'-пиррол]-2,4,5'(1Н,1'Н,5Н)-трион
(3b). К раствору 1.0 ммоль соединения 1b в 15 мл
СПИСОК ЛИТЕРАТУРЫ
сухого хлороформа добавляли раствор 1.0 ммоль
соединения 2 в 5 мл сухого хлороформа, кипятили
1. Масливец А.А., Масливец А.Н. ЖОрХ.
2015,
5 мин, охлаждали, образовавшийся осадок отфильт-
51,
1213.
[Maslivets A.A., Maslivets A.N. Russ.
ровывали. Выход 61%, т.пл. 215-217°С (C6H6). ИК
J. Org. Chem.
2015,
51,
1194.] doi
10.1134/
спектр, ν, см-1: 3420 (NCH2CH2OH), 3130 (C4'OН),
S1070428015080254
1729 (C5'=O), 1706 (C2=O), 1661 (ArC=O),
1631
2. Машевская И.В., Толмачева И.А., Тиунова О.Ю.,
(C4=O). Спектр ЯМР 1Н, δ, м.д.: 0.85 с (3Н, Ме),
Алиев З.Г., Масливец А.Н. ХГС. 2002, 38,
565.
1.04 с (3Н, Ме), 1.98-2.67 м (4H, NCH2CH2OH), 3.12
[Mashevskaya I.V., Tolmacheva I.A., Tiunova, O.Yu.,
т (2Н, C7H2, J 7.0 Гц), 3.36 т (2Н, C5H2, J 7.0 Гц),
Aliev Z.G., Maslivets A.N. Chem. Heterocycl. Compd.
4.67 уш.с (1Н, OН), 4.90 к (2H, CH2Ph, J 16.3 Гц),
2002, 38, 500.] doi 10.1023/A:1016008128005
7.33 т (1Н, Наром, J 7.3 Гц), 7.41 т (2Н, Наром, J 7.5 Гц),
3. Машевская И.В., Дувалов А.В., Толмачева И.А.,
7.50 д (2Н, Наром, J 7.4 Гц), 7.53 д (2Н, Наром, J 8.5 Гц),
Алиев З.Г., Масливец А.Н. ЖОрХ. 2004, 40, 1405.
7.64 д (2Н, Наром, J 8.5 Гц), 11.93 уш.с (1Н, OН).
[Mashevskaya I.V., Duvalov A.V., Tolmacheva I.A.,
Aliev Z.G., Maslivets A.N. Russ. J. Org. Chem. 2004,
Найдено, %: C 65.14; H 5.07; N 5.22. C29H27ClN2O6.
40, 1359.] doi 10.1007/s11178-005-0020-6
Вычислено, %: C 65.11; H 5.09; N 5.24.
4. Рачева Н.Л., Шуров С.Н., Алиев З.Г., Масливец А.Н.
ИК спектры синтезированных соединений запи-
ЖОрХ. 2007, 43, 103. [Racheva N.L., Shurov S.N.,
саны на спектрофотометре Spectrum Two в виде
Aliev Z.G., Maslivets A.N. Russ. J. Org. Chem. 2007,
пасты в вазелиновом масле. Спектры ЯМР 1Н запи-
43, 108.] doi 10.1134/S1070428007010149
саны на спектрометре Bruker AM-400 (рабочая час-
5. Рачёва Н.Л., Алиев З.Г., Масливец А.Н. ЖОрХ.
тота 400 МГц) в ДМСО-d6, внутренний стандарт -
2008, 44, 848. [Racheva, N.L., Aliev, Z.G., Maslivets A.N.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019
1632
ТРЕТЬЯКОВ, МАСЛИВЕЦ
Russ. J. Org. Chem. 2008, 44, 836.] doi 10.1134/
Maslivets A.N. Russ. J. Org. Chem. 2012, 48, 1257.]
S1070428008060092
doi 10.1134/S1070428012090205
10. Рачева Н.Л., Белова М.А., Масливец А.Н. ЖОрХ.
6. Рачёва Н.Л., Алиев З.Г., Масливец А.Н. ЖОрХ.
2008, 44, 587. [Racheva N.L., Belova M.A., Maslivets A.N.
2008, 44, 943. [Racheva, N.L., Aliev, Z.G., Maslivets A.N.
Russ. J. Org. Chem. 2008, 44, 582.] doi 10.1134/
Russ. J. Org. Chem. 2008, 44, 937.] doi 10.1134/
S1070428008040192
S1070428008060298
11. Рачева Н.Л., Алиев З.Г., Белова М.А., Машевская И.В.,
7. Mashevskaya I.V., Duvalov A.V., Rozhkova Yu.S.,
Масливец А.Н. ЖОрХ. 2008, 44, 710. [Racheva N.L.,
Shklyaev Yu.V., Racheva N.L., Bozdyreva K.S.,
Aliev Z.G., Belova M.A., Mashevskaya I.V., Maslivets A.N.
Maslivets A.N. Mendeleev Commun. 2004, 75.
Russ. J. Org. Chem. 2008, 44, 701.] doi 10.1134/
8. Рачева Н.Л., Шкляев Ю.В., Рожкова Ю.С.,
S1070428008050114
Масливец А.Н. ЖОрХ. 2007, 43, 1335. [Racheva N.L.,
12. Bozdyreva K.S., Maslivets A.N., Aliev Z.G. Mendeleev
Shklyaev Yu.V., Rozhkova Yu.S., Maslivets A.N.
Commun. 2005, 15, 163.
Russ. J. Org. Chem. 2007, 43, 1330.] doi 10.1134/
13. Третьяков Н.А., Шаврина Т.В., Масливец А.Н.
S1070428007090114
ЖОрХ. 2019, 55, 790. [Tretyakov N.A., Shavrina T.V.,
9. Коновалова В.В., Шкляев Ю.В., Масливец А.Н.
Maslivets A.N. Russ. J. Org. Chem. 2019, 55, 685.] doi
ЖОрХ. 2012, 48, 1257. [Konovalova V.V., Shklyaev Yu.V.,
10.1134/S1070428019050221
Interaction of Pyrrolo[2,1-a][1,4]oxazin-1,6,7-triones
with Carbocyclic Enaminoketones.
Synthesis of Spiro[indol-3,2'-pyrroles]
N. A. Tretyakov and A. N. Maslivets*
Perm State National Research University, 614990, Russia, Perm, ul. Bukireva 15
*e-mail: koh2@psu.ru
Received March 11, 2019; revised May 13, 2019; accepted May 30, 2019
8-Aroyl-3,4-dihydro-1H-pyrrolo[2,1-a][1,4]oxazin-1,6,7-triones react with 3-benzylamino-5,5-dimethylcyclo-
hex-2-en-1-one with the formation of
3'-aroyl-1-benzyl-4'-hydroxy-1'-(2-hydroxyethyl)-6,6-dimethyl-6,7-
dihydrospiro[indolo-3,2'-pyrrole]-2,4,5'(1H,1'H,5H)-triones.
Keywords: 1H-pyrrole-2,3-diones, pyrrolooxazin-1,6,7-triones, cyclohex-2-en-1-one, spiro[indolo-3,2'-pyrro-
le]-2,4,5'-trione, ring opening
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 10 2019