ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 11, с. 1737-1745
УДК 547.727
ХИМИЯ ИМИНОФУРАНОВ:
XVI1. СИНТЕЗ, СТРОЕНИЕ, БИОЛОГИЧЕСКАЯ
АКТИВНОСТЬ И ЦИКЛИЗАЦИЯ
2-(2-ФЕНИЛАМИНОБЕНЗОИЛГИДРАЗОНО)-4-
ОКСОБУТАНОВЫХ КИСЛОТ
© 2019 г. И. А. Кизимоваa, Н. М. Игидовa, С. В. Чащинаa, И. Н. Черновb, А. Е. Рубцовc, *
a ФГБОУ ВО «Пермская государственная фармацевтическая академия» Минздрава РФ,
614990, Россия, г. Пермь, ул. Полевая 2
b НИИ химии ФГАОУ ВО «Нижегородский государственный университет им. Н.И. Лобачевского»,
603022, Россия, г. Нижний Новгород, пр. Гагарина 23
c ФГБОУ ВО «Пермский государственный национальный исследовательский университет»,
614990, Россия, г. Пермь, ул. Букирева 15
*е-mail: rubtsov@psu.ru
Поступила в редакцию 29 апреля 2019 г.
После доработки 10 сентября 2019 г.
Принята к публикации 10 сентября 2019 г.
Изучено взаимодействие 2-фениламинобензоилгидразина с 4-арил-2-гидрокси-4-оксобут-2-еновыми и 2-
гидрокси-5,5-диметил-4-оксогекс-2-еновой кислотами, в результате которого образуются 4-арил-2-(2-
фениламинобензоилгидразоно)-4-оксобутановые и
5,5-диметил-2-(2-фениламинобензоилгидразоно)-4-
оксогексановая кислоты. Производные кислот в растворах находятся в виде смеси Z,E-гидразоноформ и
в циклической пиразолиновой форме, а под действием уксусного ангидрида циклизуются в 5-арил- и 5-
трет-бутил-3-(2-фениламинобензоилгидразоно)-2,3-фурандионы. Изучена антиноцицептивная и проти-
вовоспалительная активность 4-арил-2-(2-фениламинобензоилгидразоно)-4-оксобутановых и 5,5-диме-
тил-2-(2-фениламинобензоилгидразоно)-4-оксогексановой кислот.
Ключевые слова: гидразид фенилантраниловой кислоты, 2,4-диоксобутановые кислоты, 3-гидразонофу-
ран-2-оны, биологическая активность.
DOI: 10.1134/S0514749219110119
В ряду производных 2-имино(гидразоно)произ-
практически любые фармакофорные группы.
С
водных 4-оксобут-2-еновых кислот были найдены
целью поиска новых биологически активных
вещества, обладающие анальгетической [2-4], про-
соединений нами был осуществлен синтез, в
тивовоспалительной
[3,
4], антимикробной
[3],
котором в качестве фармакофорной группы был
гемостатической [5] и другими видами биологи-
использован фрагмент гидразида фенилантранило-
ческой активности. В настоящее время наиболее
вой кислоты. Производные гидразида фенилантра-
удобным методом синтеза
2-имино(гидразоно)-
ниловой кислоты были выбраны в качестве фарма-
производных 4-оксобут-2-еновых кислот является
кофорной группы, так как среди соединений, син-
взаимодействие соединения, содержащего первич-
тезированных на их основе, были найдены вещест-
ную аминогруппу, с 2,4-диоксобутановыми кисло-
ва, обладающие высокой противовоспалительной
тами [6-9], как правило, реакция идет региосе-
активностью [10-12], кроме того, N-арилантрани-
лективно по второму атому углерода диоксо-
ловые кислоты, такие как, например, мефенамовая,
кислот и позволяет вводить в структуру молекулы
меклофенамовая, флуфенамовая, являются несте-
роидными противовоспалительными лекарствен-
1 Сообщение XV см. [1].
ными средствами [13].
1737
1738
КИЗИМОВА и др.
Схема 1.
O
O
O
R
R
O
OH
H
OH
OH
N
R
O N
R
O N
NH2 +
OH
N
_H2O
HN
NH
N
NH
O
O O
HO
Ph
H
O
O
O
NH
HN
HN
Ph
Ph
Ph
A
B
C
1
2a_i
3a_i
2,3, R = t-Bu (a), Ph (b), 4-Tol (c), 4-MeOC6H4 (d), 4-EtOC6H4 (e), 4-ClC6H4 (f), 4-BrC6H4 (g), 4-FC6H4 (h),
3,4-(MeO)2C6H3 (i).
Первоначально из 4-замещенных 2-гидрокси-4-
NH при 9.01-9.08 м.д., характерным для дифенил-
оксобут-2-еновых кислот 2a-i и гидразида N-фе-
аминогруппы заместителя, и сигналом группы NH
нилантраниловой кислоты (1) получены 2-(ароил-
при 13.49-13.78 м.д., вовлеченной в ВВС с кар-
гидразоно)-4-оксобутановые кислоты 3a-i. Реакция
боксильной группой. В спектрах ЯМР 13С соеди-
протекает региоселективно по атому углерода кар-
нений 3b-g форма A характеризуется сигналом
бонильной группы С2=О (схема 1).
углерода метиленовой группы при 35.8-37.2 м.д.;
углерода карбоксильной группы при 160.3-163.7 м.д.;
Кислоты
3а-i представляют собой желтые
углерода группы С4=O при 192.6-194.2 м.д. Форма
кристаллические соединения. По данным спектров
B характеризуется сигналом углерода метиленовой
ЯМР 1H, соединения 3а-g в растворе ДМСО-d6
группы при 50.8-51.0 м.д.; углерода группы С5-OH
существуют в 3-х формах А-С. Состав равно-
при 93.6-94.2 м.д.; углерода С3 при 146.3-146.5;
весной смеси стабилен и не меняется во времени.
углерода амидной группы при 162.0-162.5 м.д.;
Наличия енгидразиноформ, в отличие от родст-
углерода карбоксильной группы при
167.2-
венных структур [14-16], не наблюдается. Форма
167.9 м.д. Форма С характеризуется сигналом угле-
A характеризуется наличием синглета метиле-
рода метиленовой группы при 43.4-45.8 м.д.; угле-
новых протонов при 4.5-4.57 м.д. для кислот 3b-g
рода карбоксильной группы при 163.7-164.0 м.д.;
c ароматическим заместителем в положении 4 и
углерода группы С4=O при 194.9-196.3 м.д. Равно-
при 4.05 м.д. для кислоты 3a c трет-бутильным
весное соотношение циклической и открытых форм
заместителем в положении 4; наличием сигнала
для кислот 3b-g хорошо коррелирует с констан-
группы NH при 11.24-11.38 м.д., вовлеченного в
тами Гаммета σ для заместителей в ароматическом
внутримолекулярную водородную связь (ВВС) с
кольце, где константа ρ в уравнении равна 0.387.
группой С4=O, и сигналом группы NH при 8.50-
По данным спектров ЯМР, записанных для соеди-
8.57 м.д., характерным для дифениламиногруппы
нений 3h, i в растворе дейтерированного хлоро-
заместителя. Форма B характеризуется наличием в
форма, равновесие сильно смещено в сторону
спектре 2-х несимметричных дублетных сигналов,
ациклических форм с преобладанием формы A,
которые образуют типичную АВ-систему (J 19.1-
что, по-видимому, связано с меньшей способ-
19.5 Гц) при 3.22-3.27 и 3.31-3.33 м.д. для кислот
ностью к сольватации и разрушению ВВС менее
3b-g c ароматическим заместителем в положении 4
полярного хлороформа в отличие от ДМСО.
и при 2.91, 3.41 м.д. для кислоты 3a, , указы-
вающих на циклическую 5-гидрокси-3-пиразолино-
Была изучена противовоспалительная и антино-
вую систему, в которой имеется хиральный атом
цицептивная активность синтезированных соеди-
углерода в положении 5 цикла, а также наличием
нений. Aнтиноцицептивную (анальгетическую) актив-
синглета гидроксильной группы при 7.72-7.78 м.д.
ность определяли по методике
«уксусных
Форма С характеризуется наличием синглета мети-
корчей» [17]. Противовоспалительное действие изу-
леновых протонов при 4.22-4.29 м.д. для кислот
чали на модели острого воспалительного оттека,
3b-g и при 3.78 для кислоты 3a; сигналом группы
вызванного субплантарным введением 0.1 мл 1%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019
ХИМИЯ ИМИНОФУРАНОВ: XVI. СИНТЕЗ, СТРОЕНИЕ
1739
Противовоспалительная и антиноцицептивная активность соединений 3 в дозе 50 мг/кг у крыс.
Антиноцицептивная активность
Противовоспалительная активность
Процент
Объем лапы
Соединение
уменьшен ия
Р по
Объем лапы
Прирост объема
Торможение
Количество
до введения
корчей по
сравнению с
через 3 ч,
лапы через
отека через
корчей
флогогена,
сравнению с
контролем
мл
3 ч, %
3 ч, %
мл
контролем
3a
20.5±7.4
33.0
<0.05
0.94±0.06
1.06±0.08
13.72±3.96б,в
79.35
3b
35.5±7.0
-16.0
>0.05
1.49±0.01
1.77±0.04
19.12±3.05б,в
71.24
3c
7.8±4.8а
74.5
<0.001
0.96±0.04
1.11±0.10
7.87±2.86б,в
88.11
3d
30.8±4.8
-0.01
>0.05
1.04±0.07
1.27±0.05
24.72±8.67б,в
62.81
3e
24.5±6.6
19.9
<0.05
0.81±0.03
1.18±0.08
47.26±7.40
28.90
3f
16.5±5.3
46.0
<0.05
0.85±0.04
1.09±0.06
29.33±6.30б,в
55.87
3g
14.2±5.8
53.6
<0.01
0.92±0.03
1.31±0.17
41.10±13.10б,в
38.16
3h
0.7±0.6а,б
97.7
<0.001
0.89±0.03
1.23±0.03
37.52±4.30б,в
43.55
3i
23.7±7.8
22.5
<0.05
0.94±0.03
1.02±0.03
9.18±4.72б,в
86.19
Нимесулид
7.5±2.2а
75.4
<0.05
1.34±0.06
1.53±0.07
12.10±2.38б,в
81.70
Метамизол
14.0±0.5
54.2
<0.05
0.94±0.07
1.60±0.08
71.60±9.84
7.72
натрия
Контроль
30.6±5.5
-
-
0.77±0.05
1.26±0.08
66.47±10.19
-
а Различие достоверно по сравнению с метамизолом натрия;
б различие достоверно по сравнению с нимесулидом;
в различие достоверно по сравнению с контролем.
водного раствора каррагенина в заднюю лапу крыс
раскрытие 3-имино-3H-фуранового цикла, которое
(см. таблицу) [17].
позволяет синтезировать разнообразные классы сое-
динений [1, 18-26], в том числе обладающих биоло-
Полученные данные свидетельствуют о перс-
гической активностью [3-6, 20]. С этой целью нами
пективности поиска веществ с антиноцицептивной
был осуществлен синтез 3-(2-фениламинобензоил)-
и противовоспалительной и активностью в ряду кис-
гидразонов фуран-2,3-дионов 4a-i при нагревании
лот 3 и их производных. Для получения производ-
кислот 3a-i в пропионовом ангидриде при темпе-
ных кислот наиболее удобным способом является
ратуре 70°С в течение 20 мин (схема 2).
Схема 2.
O
Ph
R
OH
HN
O
O N
NH
(EtCO)2O
N
NH
O
_2EtCOOH
NH
R
O O
Ph
3a_i
4a_i
3,4, R = t-Bu (a), Ph (b), 4-Tol (c), 4-MeOC6H4 (d), 4-EtOC6H4 (e), 4-ClC6H4 (f), 4-BrC6H4 (g),
4-FC6H4 (h), 3,4-(MeO)2C6H3 (i).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019
1740
КИЗИМОВА и др.
ABSPACK [27]. Сингония кристалла моноклинная,
пространственная группа P21/n, a
12.965(3) Å,
b 6.8792(19) Å, c 22.655(6) Å, β 100.57(3)°, V
1986.3(10) Å3. C24H19N3O3. Z 4. Всего измерено
13914 отражений, из них независимых 9999, 4704
отражения с I > 2σ(I). Полнота сбора данных для
θ < 26.00° 99.9%. Структура расшифрована пря-
мым методом и уточнена полноматричным МНК
по F2 в анизотропном приближении для всех нево-
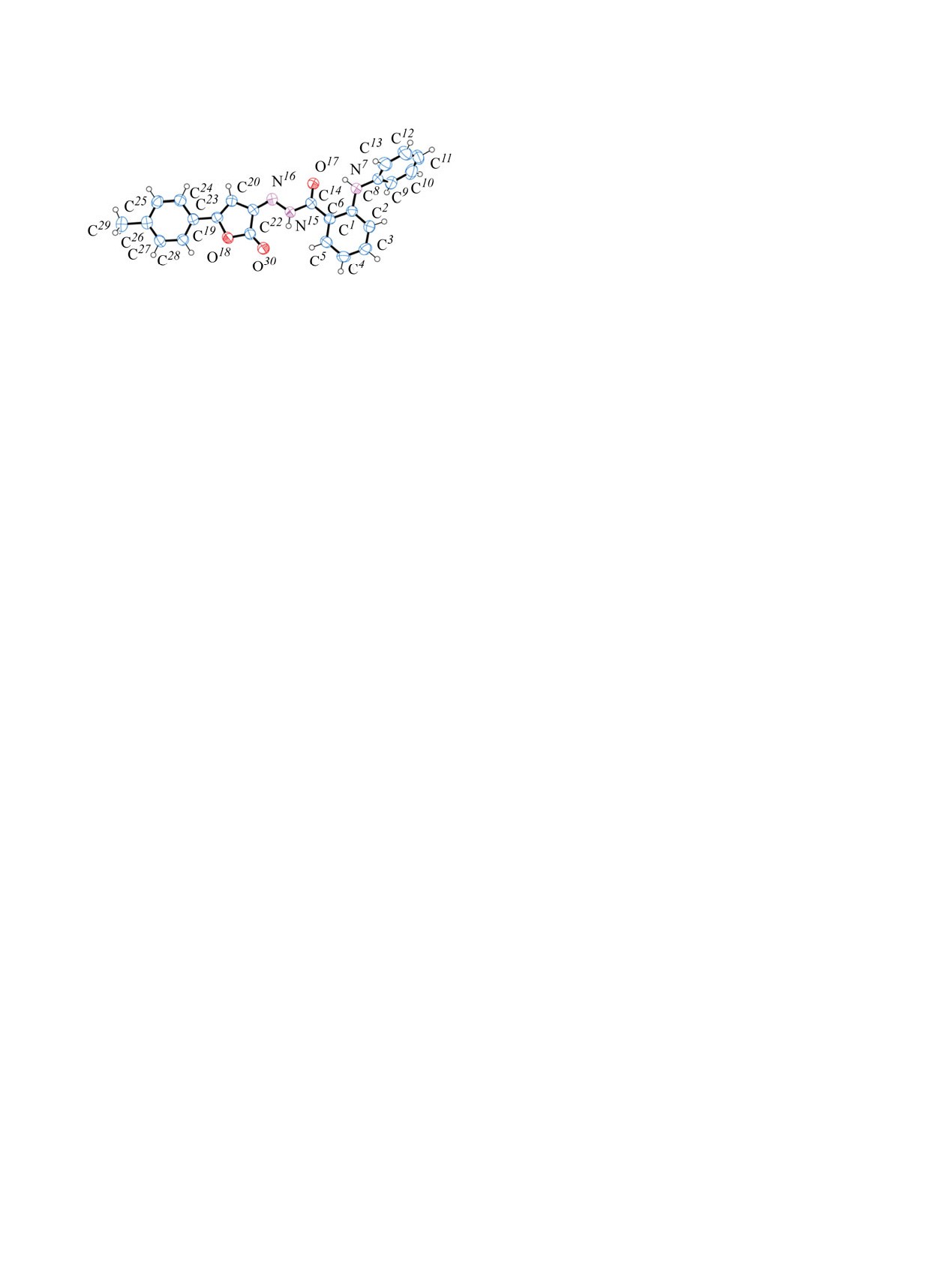
Общий вид молекулы (Z)-N'-[5-(4-метилфенил)-2-оксо-
дородных атомов. Атомы водорода включены в
фуран-3(2H)-илиден]-2-(фениламино)бензогидразида
(4с) в тепловых эллипсоидах 50% вероятности.
уточнение в модели «наездника» в изотропном
приближении с зависимыми тепловыми парамет-
рами. Все расчеты проведены с использованием
Фураноны 4a-i - кристаллические вещества от
программного пакета SHELX97 [28]. Окончатель-
оранжевого до красного цвета. В спектрах ЯМР 1Н
ные параметры уточнения: R1 0.0597, wR2 0.1434
соединений 4a-i присутствуют характеристические
[для отражений с I > 2σ(I)], R1 0.0597, wR2 0.1666
синглеты протонов группы NH при 12.72-12.91 и
(для всех отражений), GooF
1.037. Результаты
8.83-9.68 м.д., синглет винильного протона фура-
рентгеноструктурного исследования соединения 4с
нового цикла при 6.56-7.24 м.д. В спектрах ЯМР
зарегистрированы в Кембриджском центре крис-
13С соединений 4a-i присутствуют характеристи-
таллографических данных (CCDC 1911561). Эти
ческие сигналы углерода С4H при 98.3-102.6 м.д.,
материалы находятся в свободном доступе и могут
сигналы углерода С3, С5 и С2 фуранового цикла
при 136.3-137.4, 157.2-159.1 и 159.1-161.9 м.д.
data_request/cif.
соответственно, а также сигнал амидного карбони-
В работе использовались коммерчески доступ-
ла при 161.9-165.2 м.д. Структура соединения 4с
ные ацетофенон, 4-метилацетофенон, 4-метокси-
подтверждена методом рентгеноструктурного
ацетофенон, 4-этоксиацетофенон, 4-хлорацетофе-
анализа (см. рисунок).
нон, 4-бромацетофенон, 4-фторацетофенон, 3,4-ди-
метоксиацетофенон, диэтилоксалат, N-фенилантра-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ниловая кислота фирмы Sigma-Aldrich®; гидразин
фирмы Вектон®, растворители толуол, изопропи-
ИК спектры записаны на приборе ФСМ-1201
ловый спирт, диэтиловый эфир и ацетонитрил ква-
(Россия) в вазелиновом масле, спектры ЯМР 1Н -
лификации «химически чистый» после дополни-
на приборах Bruker Avance III (Германия) в ДМСО-
тельной отчистки [29]. Гидразид N-фенилантра-
d6, рабочие частоты 400 (1H) и 100 (13С) МГц, внут-
ниловой кислоты 1 синтезировали по методике
ренний стандарт - остаточный сигнал от дейтеро-
[30]. Соединение 2а-i синтезировали по методике
растворителя. Элементный анализ проводили на
[31]. Физико-химические константы и спектраль-
приборе Leco CHNS-932 (США). Химическую
ные характеристики соответствуют литературным.
чистоту соединений и протекание реакций конт-
ролировали методом ТСХ на пластинах Sorbfil
2-(2-Фениламинобензоилгидразоно)-4-оксо-
ПТСХ П-А-УФ-254 (Россия) в системе эфир-бен-
бутановые кислоты (3a-i) (общая методика). К
зол-ацетон, 10:9:1, детектирование проводили в
раствору 0.01 моль гидразида N-фенилантранило-
УФ-свете и парами йода. Температуры плавления
вой кислоты (1) в 20 мл изопропилового спирта до-
определяли на приборе SMP40(Великобритания).
бавляли 0.01 моль соответствующей кислоты 2a-i,
смесь нагревали в течение 2-3 мин. Раствор охлаж-
Рентгеноструктурный анализ соединения 4с вы-
дали до 0°С, выпавший осадок отфильтровывали и
полнен на монокристальном автоматическом
перекристаллизовывали из ацетонитрила.
дифрактометре Xcalibur R с ССD-детектором по
стандартной методике [MoKα-излучение, 293(2) K,
5,5-Диметил-4-оксо-2-{2-[2-(фениламино)бен-
ω-сканирование, шаг сканирования 1°] [27]. Для
зоил]гидразоно}гексановая кислота (3a). Выход
анализа использовали желтый призматический
3.2 г (84%), светло-желтые кристаллы, т.пл. 130-
кристалл (0.5×0.4×0.4 мм). Поглощение учтено эм-
132°С (MeCN). ИК спектр, ν, см-1: 3375, 3205, 1697,
пирически с использованием алгоритма SCALE3
1638, 1582, 1534. Спектр ЯМР 1Н (ДМСО-d6), δ,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019
ХИМИЯ ИМИНОФУРАНОВ: XVI. СИНТЕЗ, СТРОЕНИЕ
1741
м.д.: форма A (54%): 1.14 с (9H, 3Me), 4.05 с (2Н,
4-(4-Mетоксифенил)-4-оксо-2-{2-[2-(фенил-
СН2), 6.9-7.6 м (9Наром), 8.50 уш.с (1Н, NH), 11.24 с
амино)бензоил]гидразоно}бутановая кислота
(1Н, NH); форма B (14%): 1.02 с (9H, 3Me), 2.91 д
(3d). Выход 3.96 г (92%), светло-желтые крис-
(1Н, С4Н2, J 19.3 Гц), 3.41 д (1Н, С4Н2, J 19.3 Гц),
таллы, т.пл. 103-105°С (MeCN). Спектр ЯМР 1Н
6.42 (1H, OH), 6.8-7.6 м (10Н, Hаром + NH); форма C
(ДМСО-d6), δ, м.д.: форма A (50%): 3.87 с (3Н, Me),
(32%): 1.11 с (9H, 3Me), 3.78 с (2Н, СН2), 6.9-7.6 м
4.51 с (2Н, СН2), 6.9-8.0 м (13Наром), 8.57 уш.с (1Н, NH),
(9Наром), 9.0 уш.с (1Н, NH), 13.49 с (1Н, NH).
11.38 с (1Н, NH); форма B (28%): 3.25 д (1Н, С4Н2,
Спектр ЯМР 13С (ДМСО-d6), δ, м.д. (форма A):
J 19.2 Гц), 3.31 д (1Н, С4Н2, J 19.2 Гц), 3.75 с (3Н,
25.9, 35.7, 43.9, 116.8, 117.9, 118.9, 119.1, 119.5,
Me), 6.8-8.0 м (14Н, Hаром + NH), 7.79 (1H, OH); форма
119.6, 121.5, 129.2, 132.2, 141.8, 142.0, 142.7, 163.5,
C (22%): 3.87 с (3Н, Me), 4.22 с (2Н, СН2), 6.9-8.0 м
165.4, 209.9. Найдено, %: C 66.18; H 6.10; N 11.06.
(13Наром), 9.05 уш.с (1Н, NH), 13.65 с (1Н, NH). Спектр
C21H23N3О4. Вычислено, %: C 66.13; H 6.08; N
ЯМР 13С (ДМСО-d6), δ, м.д. (форма A): 36.9, 55.5,
11.02. M 381.17.
113.8, 116.5, 118.3, 118.9, 121.5, 125.9, 129.0, 129.1,
129.2, 130.4, 130.5, 141.9, 143.7, 146.4, 163.5, 165.6, 192.7.
4-Oксо-4-фенил-2-{2-[2-(фениламино)бен-
Найдено, %: C 66.86; H 4.87; N 9.78. C24H21N3О5.
зоил]гидразоно}бутановая кислота (3b). Выход
Вычислено, %: C 66.81; H 4.91; N 9.74. M 431.15.
3.45 г (86%), светло-желтые кристаллы, т.пл. 88-
90°С (MeCN). ИК спектр, ν, см-1: 3357, 3158, 1686,
4-Оксо-2-{2-[2-(фениламино)бензоил]гидра-
1641, 1592, 1577. Спектр ЯМР 1Н (ДМСО-d6), δ,
зоно}-4-(4-этоксифенил)бутановая кислота (3е).
м.д.: форма A (20%): 4.56 с (2Н, СН2), 6.9-8.0 м
Выход 3.74 г (84%), светло-желтые кристаллы,
(14Наром), 8.55 уш.с (1Н, NH), 11.38 с (1Н, NH);
т.пл. 130-132°С (MeCN). Спектр ЯМР 1Н (ДМСО-
форма B (70%): 3.24 д (1Н, С4Н2, J 19.1 Гц), 3.32 д
d6), δ, м.д.: форма A (48%): 1.37 м (3Н, Me), 4.15 м
(1Н, С4Н2, J 19.1 Гц), 6.8-7.6 м (15Н, Hаром + NH),
(2Н, СН2), 4.50 с (2Н, СН2), 6.9-8.0 м (13Наром), 8.55
7.78 (1H, OH); форма C (10%): 4.29 с (2Н, СН2),
уш.с (1Н, NH), 11.39 с (1Н, NH); форма B (35%):
6.9-8.0 м (14Наром), 9.02 уш.с (1Н, NH), 13.58 с (1Н,
1.32 м (3Н, Me), 3.23 д (1Н, С4Н2, J 19.1 Гц), 3.33 д
NH). Спектр ЯМР 13С (ДМСО-d6), δ, м.д. (форма
(1Н, С4Н2, J 19.1 Гц), 4.02 к (2Н, СН2), 6.8-8.0 м
B): 51.0, 94.2, 117.6, 118.3, 119.3, 120.9, 123.5,
(14Н, Hаром + NH), 7.79 (1H, OH); форма C (17%):
124.6, 127.3, 127.9, 128.6, 129.1, 130.6, 131.3, 142.4,
1.31 м (3Н, Me), 4.15 м (2Н, СН2), 4.22 с (2Н, СН2),
142.5, 142.6, 146.4, 162.4, 167.3. Найдено, %: C
6.9-8.0 м (13Наром), 9.01 уш.с (1Н, NH), 13.51 с (1Н,
68.79; H 4.80; N 10.51. C23H19N3О4. Вычислено, %:
NH). Спектр ЯМР 13С (ДМСО-d6), δ, м.д. (форма
C 68.82; H 4.77; N 10.47. M 401.14.
A): 14.3, 36.9, 63.5, 114.2, 114.3, 118.3, 118.9, 121.5,
125.9, 128.9, 129.1, 129.2, 130.2, 130.5, 141.9, 143.7,
4-(4-Mетилфенил)-4-оксо-2-{2-[2-(фенилами-
146.3, 162.6, 165.6, 192.6. Найдено, %: C 67.37; H
но)бензоил]гидразоно}бутановая кислота
(3c).
5.24; N 9.46. C25H23N3О5. Вычислено, %: C 67.41; H
Выход 3.28 г (79%), светло-желтые кристаллы,
5.20; N 9.43. M 445.48.
т.пл. 108-110°С (MeCN). ИК спектр, ν, см-1: 3366,
3144, 1676, 1640, 1594. Спектр ЯМР 1Н (ДМСО-d6),
4-Оксо-2-{2-[2-(фениламино)бензоил]гидра-
δ, м.д.: форма A (36%): 2.41 с (3Н, Me), 4.53 с (2Н,
зоно}-4-(4-хлорфенил)бутановая кислота
(3f).
СН2), 6.9-8.0 м (13Наром), 8.55 уш.с (1Н, NH), 11.37
Выход 3.49 г (80%), желтые кристаллы, т.пл. 103-
с (1Н, NH); форма B (45%): 2.29 с (3Н, Me), 3.22 д
105°С (MeCN). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
(1Н, С4Н2, J 19.1 Гц), 3.31 д (1Н, С4Н2, J 19.1 Гц),
форма A
(10%):
4.54 с
(2Н, СН2),
6.9-8.0 м
6.8-7.6 м (15Н, Hаром + NH), 7.78 (1H, OH); форма C
(13Наром), 8.52 уш.с. (1Н, NH), 11.35 с (1Н, NH);
(19%): 2.40 с (3Н, Me), 4.25 с (2Н, СН2), 6.9-8.0 м
форма B (85%): 3.27 д (1Н, С4Н2, J 19.4 Гц), 3.32 д
(14Наром), 9.01 уш.с (1Н, NH), 13.54 с (1Н, NH).
(1Н, С4Н2, J 19.4 Гц), 6.8-8.0 м (14Н, Hаром + NH),
Спектр ЯМР 13С (ДМСО-d6), δ, м.д. (форма B):
7.73 (1H, OH); форма C (5%): 4.24 с (2Н, СН2), 6.9-
20.5, 51.0, 94.2, 117.6, 118.3, 119.3, 120.9, 123.5,
8.0 м (13Наром), 9.01 уш.с (1Н, NH), 13.64 с (1Н,
124.6, 127.3, 127.9, 128.6, 129.1, 130.6, 131.3, 113.6,
NH). Спектр ЯМР 13С (ДМСО-d6), δ, м.д. (форма
117.5, 118.3, 123.5, 124.6, 128.3, 128.4, 129.1, 129.2,
B): 50.8, 93.6, 117.9, 118.2, 119.5, 120.8, 123.8,
136.4, 139.8, 142.5, 143.8, 146.4, 162.5, 167.3. Масс-
126.8, 127.8, 129.1, 130.5, 131.3, 131.9, 141.6, 142.3,
спектр, m/z: 415 [M]+. Найдено, %: C 69.34; H 5.15;
142.7, 146.5, 162.4, 167.2. Найдено, %: C 63.42; H
N 10.14. C24H21N3О4. Вычислено, %: C 69.39; H
4.11; N 9.69. C23H18ClN3О4. Вычислено, %: C 63.38;
5.10; N 10.11. M 415.45.
H 4.16; N 9.64. M 435.88.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019
1742
КИЗИМОВА и др.
4-(4-Бромфенил)-4-оксо-2-{2-[2-(фениламино)-
ка). Соответствующую кислоту 3a-i (0.01 моль)
бензоил]гидразоно}бутановая кислота (3g). Выход
нагревали при 70°С в течение 3-4 мин в уксусном
4.22 г (88%), желтые кристаллы, т.пл. 100-102°С
ангидриде (3-4 мл). Выпавший после охлаждения
(MeCN). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: форма
осадок отфильтровывали, промывали безводным
A (7%): 4.53 с (2Н, СН2), 6.9-8.0 м (13Наром), 8.53
эфиром и перекристаллизовывали из безводного
уш.с (1Н, NH), 11.36 с (1Н, NH); форма B (90%):
толуола.
3.25 д (1Н, С4Н2, J 19.4 Гц), 3.32 д (1Н, С4Н2, J
(Z)-N'-[5-(трет-Бутил)-2-оксофуран-3(2H)-
19.4 Гц), 6.8-8.0 м (14Н, Hаром + NH), 7.72 (1H, OH);
илиден]-2-(фениламино)бензогидразид
(4a).
форма C (3%): 4.26 с (2Н, СН2), 6.9-8.0 м (13Наром),
Выход 2.87 г (79%), светло-оранжевые кристаллы,
9.08 уш. с (1Н, NH), 13.75 с (1Н, NH). Спектр ЯМР
т.пл. 237-238°С (толуол). Спектр ЯМР 1Н (CDCl3),
13С (ДМСО-d6), δ, м.д. (форма B): 50.8, 93.6, 118.0,
δ, м.д.: 1.30 с (9H, t-Bu), 6.05 с (1Н, СН), 6.85 м
118.2, 119.5, 120.5, 120.8, 123.8, 127.1, 129.1, 130.5,
(1Наром), 7.10 м (1Наром), 7.27 м (2Наром), 7.31-7.39 м
130.7, 131.3, 142.0, 142.3, 142.7, 146.5, 162.4, 167.2.
(4Наром), 7.62 м (1Наром), 9.62 с (1Н, NH), 12.82 с
Найдено, %: C 57.44; H 3.84; N 8.66. C23H18ClN3О4.
(1Н, NH). Спектр ЯМР 13С (CDCl3), δ, м.д.: 26.4,
Вычислено, %: C 57.5; H 3.78; N 8.75. M 480.32.
32.9, 99.5, 113.4, 114.9, 117.3, 121.5, 122.9, 127.2,
4-Оксо-2-{2-[2-(фениламино)бензоил]гидра-
128.8, 133.4, 136.7, 140.2, 147.3, 160.4, 165.2, 172.1.
зоно}-4-(4-фторфенил)бутановая кислота
(3h).
Найдено, %: C 69.37; H 5.88; N 11.48. C21H21N3О3.
Выход 3.18 г (76%), светло-желтые кристаллы,
Вычислено, %: C 69.41; H 5.82; N 11.56. M 363.42.
т.пл. 103-105°С (MeCN). Спектр ЯМР 1Н (CDCl3),
(Z)-N'-[2-Оксо-5-фенилфуран-3(2H)-илиден]-
δ, м.д.: форма A (60%): 4.45 с (2Н, СН2), 6.9-8.0 м
2-(фениламино)бензогидразид (4b). Выход 2.99 г
(13Наром), 8.31 уш.с. (1Н, NH), 11.98 с (1Н, NH);
(78%), оранжевые кристаллы, т.пл.
155-157°С
форма B (5%): 3.25 д (1Н, С4Н2, J 19.4 Гц), 3.32 д
(толуол). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 6.71 с
(1Н, С4Н2, J 19.4 Гц), 6.8-8.0 м (15Н, Hаром + NH,
(1Н, СН), 6.86 м (1Наром), 7.11 м (1Наром), 7.27 м
OH); форма C (35%): 4.37 с (2Н, СН2), 6.9-8.0 м
(2Наром), 7.32-740 м (4Наром), 7.46-7.54 м (3Наром),
(13Наром), 9.01 уш.с (1Н, NH), 13.51 с (1Н, NH).
7.66 м (1Наром), 7.76 м (2Наром), 9.68 с (1Н, NH),
Спектр ЯМР 13С (CDCl3), δ, м.д. (форма A): 35.9,
12.92 с (1Н, NH). Спектр ЯМР 13С (CDCl3), δ, м.д.:
115.2, 115.9, 117.6, 121.7, 123.3, 127.8, 128.8, 128.9,
100.5, 113.2, 114.9, 117.4, 121.5, 123.0, 125.0, 126.6,
132.2, 132.3, 133.9, 136.3, 139.9, 147.5, 163.2, 166.3,
127.2, 128.6, 128.9, 131.0 133.6, 136.2, 140.1, 147.4,
194.3. Спектр ЯМР 19F (CDCl3), δ, м.д: форма A: -
158.9, 160.1, 165.1. Найдено, %: C 72.12; H 4.52; N
100.8; форма B: -113.5; форма C: -104.0. Найдено,
10.90. C23H17N3О3. Вычислено, %: C 72.05; H 4.47;
%: C
65.80; H
4.39; N
10.09. C23H18FN3О4.
N 10.96. M 383.41.
Вычислено, %: C 65.87; H 4.33; N 10.02. M 419.41.
(Z)-N'-[5-(4-метилфенил)-2-оксофуран-3(2H)-
4-(3,4-Диметоксифенил)-4-оксо-2-{2-[2-(фе-
илиден]-2-(фениламино)бензогидразид
(4с).
ниламино)бензоил]гидразоно}бутановая кисло-
Выход 2.74 г (69%), светло-оранжевые кристаллы,
та (3i). Выход 4.24 г (92%), желтые кристаллы,
т.пл. 210-212°С (толуол). Спектр ЯМР 1Н (ДМСО-
т.пл. 110-112°С (MeCN). ИК спектр, ν, см-1: 3357,
d6), δ, м.д.: 2.37 с (3H, CH3), 6.96 м (1Наром), 7.05 м
3208, 1703, 1668, 1639, 1594. Спектр ЯМР 1Н (CDCl3),
(1Наром), 7.09 м (1Наром), 7.12 с (1Н, СН), 7.29 м
δ, м.д.: форма A (75%): 3.97 с (3Н, Me), 3.98 с (3Н,
(2Наром), 7.34 м (2Наром), 7.44-7.55 м (2Наром), 7.66 м
Me), 4.42 с (2Н, СН2), 6.9-8.0 м (13Наром), 8.5 уш.с
(1Наром), 7.72 м (2Наром), 7.79 м (1Наром), 8.92 с (1Н,
(1Н, NH), 12.4 с (1Н, NH); форма C (25%): 3.97 с
NH), 12.80 с (1Н, NH). Найдено, %: C 72.46; H 4.88;
(3Н, Me), 3.98 с (3Н, Me), 4.37 с (2Н, СН2), 6.9-8.0
N 10.64. C24H19N3О3. Вычислено, %: C 72.53; H
м (13Наром), 9.45 уш.с (1Н, NH), 13.51 с (1Н, NH).
4.82; N 10.57. M 397.43.
Спектр ЯМР 13С (CDCl3), δ, м.д. (форма A): 35.8,
(Z)-N'-[5-(4-Метоксифенил)-2-оксофуран-3-
55.6, 55.7, 110.1, 110.9, 112.9, 114.9, 117.4, 121.7,
(2H)-илиден]-2-(фениламино)бензогидразид (4d).
123.1, 125.1, 127.6, 127.8, 128.7, 128.8, 133.7, 140.0,
Выход 2.52 г (61%), красные кристаллы, т.пл. 200-
147.5, 148.8, 154.7, 163.1, 166.1, 194.0. Найдено, %:
202°С (толуол). Спектр ЯМР 1Н (CDCl3), δ, м.д.:
C 65.14; H 5.09; N 9.02. C25H23N3О6. Вычислено, %:
3.90 с (3H, CH3), 6.56 с (1Н, СН), 6.80-7.80 м
C 65.07; H 5.02; N 9.11. M 461.47.
(13Наром), 9.65 с (1Н, NH), 12.85 с (1Н, NH). Спектр
3-(2-Фениламинобензоил)гидразоны
5-заме-
ЯМР 13С (CDCl3), δ, м.д.: 55.9, 98.5, 114.1, 114.9,
щенных 2,3-фурандионов (4a-i) (общая методи-
117.4, 119.2, 121.5, 122.9, 126.9, 127.2, 128.8, 133.4,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019
ХИМИЯ ИМИНОФУРАНОВ: XVI. СИНТЕЗ, СТРОЕНИЕ
1743
136.7,
140.2,
147.3,
159.1,
160.3,
161.9,
165.1.
Найдено, %: C 68.90; H 4.10; N 10.41. C23H16FN3О3.
Найдено, %: C 69.66; H 4.69; N 10.08. C24H19N3О4.
Вычислено, %: C 68.82; H 4.02; N 10.47. M 401.40.
Вычислено, %: C 69.72; H 4.63; N 10.16. M 413.43.
(Z)-N'-[5-(3,4-Диметоксифенил)-2-оксофуран-
(Z)-N'-[2-Оксо-5-(4-этоксифенил)фуран-3(2H)-
3(2H)-илиден]-2-(фениламино)бензогидразид
илиден]-2-(фениламино)бензогидразид
(4e).
(4i). Выход 2.66 г (60%), красные кристаллы, т.пл.
Выход 2.78 г (65%), оранжевые кристаллы, т.пл.
170-172°С (толуол). Спектр ЯМР 1Н (CDCl3), δ,
197-199°С (толуол). Спектр ЯМР 1Н (CDCl3), δ,
м.д.: 3.96 c (3H, CH3), 3.97 c (3H, CH3), 6.56 с (1Н, СН),
м.д.: 1.46 т (3H, CH3, J 7.0 Гц), 4.11 к (2H, CH2, J
6.86 м (1Наром), 6.96 м (1Наром), 7.11 м (1Наром), 7.20
7.0 Гц), 6.55 с (1Н, СН), 6.87 м (1Наром), 6.98 м
м (1Наром), 7.27 м (2Наром), 7.32-7.40 м (5Наром), 7.65 м
(2Наром), 7.10 м (1Наром), 7.27 м (2Наром), 7.32-740 м.
(1Наром), 9.64 с (1Н, NH), 12.84 с (1Н, NH). Спектр
(4Наром), 7.64 м (1Наром), 7.69 м (2Наром), 9.68 с (1Н,
ЯМР 13С (CDCl3), δ, м.д.: 55.5, 55.6, 98.7, 107.6,
NH), 12.85 с (1Н, NH). Спектр ЯМР 13С (CDCl3), δ,
110.9, 113.5, 114.9, 117.4, 119.2, 119.4, 121.5, 122.9,
м.д.: 14.1, 63.3, 98.3, 113.5, 114.6, 114.9, 117.4,
127.2, 128.8, 133.4, 136.6, 140.2, 147.3, 149.0, 151.8,
118.9, 121.5, 122.9, 126.9, 127.2, 128.8, 133.4, 136.7,
158.9, 160.3, 165.1. Масс-спектр, m/z:
443
[M]+.
140.2, 147.2, 159.1, 160.4, 161.3, 165.1. Найдено, %:
Найдено, %: C 67.65; H 4.88; N 9.41. C25H21N3О5.
C 70.18; H 4.88; N 9.91. C25H23N3О4. Вычислено, %:
Вычислено, %: C 67.71; H 4.77; N 9.48. M 443.46.
C 70.25; H 4.95; N 9.83. M 427.46.
ФОНДОВАЯ ПОДДЕРЖКА
(Z)-N'-[2-Оксо-5-(4-хлорфенил)фуран-3(2H)-
илиден]-2-(фениламино)бензогидразид
(4f).
Работа выполнена при финансовой поддержке
Выход 3.3 г (79%), светло-оранжевые кристаллы,
Российского фонда фундаментальных исследова-
т.пл. 240-141°С (толуол). Спектр ЯМР 1Н (ДМСО-
ний (проект № 19-43-590023).
d6), δ, м.д.: 6.68 м (1Наром), 7.05 м (1Наром), 7.10 м
(2Наром), 7.24 с (1Н, СН), 7.30 м (3Наром), 7.49 м
КОНФЛИКТ ИНТЕРЕСОВ
(1Наром), 7.61 м (2Наром), 7.75 м (1Наром), 7.82 м
(2Наром), 8.91 с (1Н, NH), 12.82 с (1Н, NH). Спектр
Авторы заявляют об отсутствии конфликта
ЯМР 13С (ДМСО-d6), δ, м.д.: 102.6, 118.2, 119.4,
интересов.
120.3, 121.9, 126.0, 127.0, 129.20, 129.24, 129.28,
129.31, 133.6, 135.9, 137.2, 142.2, 144.5, 157.2,
СПИСОК ЛИТЕРАТУРЫ
159.1, 164.6. Найдено, %: C 66.03; H 3.74; N 10.14.
C23H16ClN3О3. Вычислено, %: C 66.11; H 3.86; N
1. Васильева А.Ю., Ваганов В.Ю., Шипиловских С.А.,
10.06. M 417.85.
Рубцов А.Е. ЖОрХ. 2018, 54, 581. [Vasileva A.Yu.,
(Z)-N'-[5-(4-Бромфенил)-2-оксофуран-3(2H)-
Vaganov V.Yu., Shipilovskikh S.A., Rubtsov A.E.
Russ. J. Org. Chem. 2018, 54, 582.] doi 10.1134/
илиден]-2-(фениламино)бензогидразид
(4g).
S1070428018040115
Выход 3.79 г (82%), красные кристаллы, т.пл. 235-
2. Пулина Н.А., Собин Ф.В., Кожухарь В.Ю.,
237°С (толуол). Спектр ЯМР 1Н (CDCl3), δ, м.д.:
Махмудов Р.Р., Рубцов А.Е., Наугольных Е.А. Хим.-
6.7-7.9 м (14Н, СH + Наром), 9.64 с (1Н, NH), 12.91 с
фарм. ж. 2014, 48, 14. [Pulina N.A. Sobin F.V.,
(1Н, NH). Спектр ЯМР 13С (CDCl3), δ, м.д.: 101.0,
Kozhukhar V.Y., Makhmudov, R.R., Rubtsov A.E.,
115.0, 121.5, 121.7, 123.1, 125.5, 126.3, 127.2, 128.9,
Naugol’nykh E.A. Pharm. Chem. J. 2014, 48, 11.] doi
131.9, 133.6, 135.9, 137.4, 140.1, 143.6, 147.5, 157.7,
10.1007/s11094-014-1034-6
159.8, 161.9. Найдено, %: C 59.81; H 3.42; N 9.16.
3. Пулина Н.А., Залесов В.В., Быстрицкая О.А.,
C23H16BrN3О3. Вычислено, %: C 59.76; H 3.49; N
Рубцов А.Е., Кутковая Н.В. Хим.-фарм. ж. 2009, 43,
9.09. M 462.30.
17.
[Pulina N.A., Zalesov V.V., Bystritskaya O.A.,
Rubtsov A.E., Kutkovaya N.V. Pharm. Chem. J. 2009,
(Z)-N'-[2-Оксо-5-(4-фторфенил)фуран-3(2H)-
43, 444.] doi 10.1007/s11094-009-0334-8
илиден]-2-(фениламино)бензогидразид
(4h).
4. Быков Р.А., Трапезникова Н.Н., Баландина С.Ю.,
Выход 3.17 г (79%), темно-оранжевые кристаллы,
Комарова О.А., Махмудов Р.Р., Пулина Н.А.,
т.пл. 200-202°С (толуол). Спектр ЯМР 1Н (ДМСО-
Собин Ф.В., Рубцов А.Е. Хим.-фарм. ж. 2018, 52,
d6), δ, м.д.: 6.97 м (1Наром), 7.03 м (1Наром), 7.08 м
33. [Bykov R.A. , Trapeznikova N.N., Balandina S.Yu.,
(2Наром), 7.12 с (1Н, СН), 7.28 м (3Наром), 7.36 м
Komarova O.A., Makhmudov R.R., Pulina N.A.
(2Наром), 7.45 м (1Наром), 7.73 м (1Наром), 7.88 м
Sobin F.V., Rubtsov A.E. Pharm. Chem. J. 2018, 52,
(2Наром),
8.83 с
(1Н, NH),
12.72 с
(1Н, NH).
415.] doi 10.1007/s11094-018-1833-2
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019
1744
КИЗИМОВА и др.
5. Пулина Н.А., Кожухарь В.Ю., Кузнецов А.С.,
Yakimovich S.I., Russ. J. Gen. Chem. 2007, 77, 1732.]
Рубцов А.Е., Старкова А.В. Изв. АН. Сер. хим. 2017,
doi 10.1134/S107036320710012X
66, 1497. [Pulina N.A., Kozhukhar V.Y., Kuznetsov A.S.,
17. Руководство по проведению доклинических иссле-
Rubtsov A.E. Russ. Chem. Bull. 2017, 66, 1497.] doi
дований лекарственных средств. Часть первая. М.:
10.1007/s11172-017-1914-5
Гриф и Ко, 2012.
6. Рубцов А.Е., Залесов В.В. ЖОрХ. 2003, 39,
918.
18. Elkholy Y.M., Ali K.A., Farag A.M. Phosphorus, Sulfur
[Rubtsov A.E., Zalesov V.V. Russ. J. Org. Chem. 2003,
Silicon Relat. Elem. 2006, 181, 2037. doi 10.1080/
39, 869.] doi 10.1023/B:RUJO.0000003167.28537.71
10426500600605731
7. Комарова О.А., Игидов Н.М., Рубцов А.Е., Залесов В.В.,
19. Elkholy Y.M., Ali K.A., Farag A.M. J. Heterocycl.
Макаров А.С., Токсарова Ю.С. ЖОрХ. 2010, 46, 242.
Chem. 2006, 43, 1183. doi 10.1002/jhet.5570430508
[Komarova O.A., Igidov N.M., Rubtsov A.E., Zalesov V.V.,
20. Рубцов А.Е., Залесов В.В. ЖОрХ. 2007, 43, 739.
Makarov A.S., Toksarova Yu.S. Russ. J. Org. Chem.
[Rubtsov A.E., Zalesov V.V., Russ. J. Org. Chem. 2007,
2010, 46, 236.] doi 10.1134/S1070428010020156
43, 735.] doi 10.1134/S1070428007050156
8. Шипиловских С.А., Рубцов А.Е., Залесов В.В. ХГС.
21. Sayed H.H., Hashem A.I., Yousif N.M., El-Sayed W.A.
2009, 45,
832.
[Shipilovskikh S.A., Rubtsov A.E.,
Arch. Pharm.
2007,
340,
315. doi
10.1002/
Zalesov V.V. Chem. Heterocycl. Comp. 2009, 45, 658.]
ardp.200700043
doi 10.1007/s10593-009-0334-3
22. Харитонова С.С., Игидов Н.М., Захматов А.В.,
9. Тюнева А.В., Игидов Н.М., Корягина Н.Н.,
Рубцов А.Е. ЖОрХ. 2013, 49, 252. [Kharitonova S.S.,
Бородин А.Ю., Захматов А.В., Макаров А.С.,
Igidov N.M., Zakhmatov A.V., Rubtsov A.E. Russ. J. Org.
Токсарова Ю.С., Рубцов А.Е. ЖОрХ. 2011, 47, 266.
Chem. 2013, 49, 243.] doi 10.1134/S1070428013020115
[Tyuneva A.V., Igidov N.M., Koryagina N.N.,
23. Майорова О.А., Егорова А.Ю. ЖОрХ. 2013, 49, 1363.
Borodin A.Y., Zakhmatov A.V., Makarov A.S.,
[Maiorova O.A., Egorova A.Y. Russ. J. Org. Chem.
Toksarova Y.C., Rubtsov A.E. Russ. J. Org. Chem.
2013, 49, 1348.] doi 10.1134/S1070428013090170
2011, 47, 258.] doi 10.1134/S1070428011020163
24. Шипиловских С.А., Рубцов А.Е. ЖОрХ. 2014, 50,
10. Kankanala K., Reddy V.R., Devi Y.P., Mangamoori L.N.,
305. [Shipilovskikh S.A., Rubtsov A.E. Russ. J. Org.
Rambabu D., Mukkanti K., Pal S. J. Het. Chem. 2015,
Chem. 2014, 50, 298.] doi 10.1134/S1070428014020286
52, 105. doi 10.1002/jhet.1993
25. Майорова О.А., Бабкина Н.В., Егорова А.Ю. ХГС.
11. Parveen R., Sravanthi B., Dastidar P. Chem.-Asian J.
2015,
51,
514.
[Maiorova O.A., Babkina N.V.,
2017, 12, 792. doi 10.1002/asia.201700049
Egorova A.Y. Chem. Heterocycl. Comp. 2015, 51, 514.]
12. Kumar N., Chauhan L.S., Sharma C.S., Dashora N.,
doi 10.1007/s10593-015-1730-5
Bera R. Med. Chem. Res. 2015, 24, 2580. doi 10.1007/
26. Максимов Е.А., Майорова О.А., Егорова А.Ю.
s00044-015-1318-8
ЖОрХ. 2015, 51, 1330. [Maksimov E.A., Mayorova O.A.,
13. Машковский М.Д. Лекарственные средства. M.:
Yegorova A.Y. Russ. J. Org. Chem. 2015, 51, 1305.]
Новая волна, 2012, 180.
doi 10.1134/S107042801509016X
27. CrysAlisPro, Agilent Technologies, Version 1.171.36.28
14. Пулина Н.А., Кузнецов А.С., Рубцов А.Е. ЖОрХ.
2015, 51, 986. [Pulina N.A. Kuznetsov A.S., Rubtsov A.E.,
(release 01-02-2013 CrysAlis171.NET).
Russ. J. Org. Chem. 2015, 51, 967.] doi 10.1134/
28. Sheldrick G.M. Acta Cryst.
2008, A64,
112. doi
S1070428015070131
10.1107/S0108767307043930
15. Пакальнис В.В., Зерова И.В., Якимович С.И.,
29. Органикум. М.: Мир, 2008, 2, 488.
Алексеев В.В. ХГС. 2013, 49, 440. [Pakal’nis V.V.,
30. Meira C.S., dos Santos Filho J.M., Sousa C.C., Anjos P.S.,
Zerova I.V., Yakimovich S.I., Alekseyev V.V., Chem.
Cerqueira J.V., Dias Neto H.A., da Silveira R.G., Russo H.M.,
Heterocycl. Comp. 2013, 49, 408.] doi 10.1007/s10593-
Wolfender J.-L., Queiroz E.F., Moreira D.R.M.,
013-1261-x
Soares M.B.P. Bioorg. Med. Chem. 2018, 26, 1971.
16. Пакальнис В.В., Зерова И.В., Якимович С.И., ЖОХ.
31. Verbic T., Drakulic B., Zloh M., Pecelj J., Popovic G.,
2007,
77,
1732.
[Pakal’nis V.V., Zerova I.V.,
Juranic I. J. Serbian Chem. Soc. 2007, 12, 1201.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019
ХИМИЯ ИМИНОФУРАНОВ: XVI. СИНТЕЗ, СТРОЕНИЕ
1745
Chemistry of Iminofurane: XVI.
Synthesis, Structure, Biological Activity, and Cyclization
of 2-(2-Phenylaminobenzoylhydrazono)-4-oxobutanoic Acids
I. A. Kizimovaa, N. M. Igidova, S. V. Chaschinaa, I. N. Chernovb, and A. E. Rubtsovс, *
a Perm State Pharmaceutical Academy, 614990, Russia, Perm, ul. Polevaya 2
b Scientific Research Institute of Chemistry FSAEI of HE N.I. Lobachevsky State University of Nizhny Novgorod,
603022, Russia, Nizhny Novgorod, pr. Gagarina 23
с Perm State National Research University, 614990, Russia, Perm, ul. Bukireva 15
*e-mail: rubtsov@psu.ru
Received April 29, 2019; revised September 10, 2019; accepted September 10, 2019
The interaction of 2-phenylaminobenzoylhydrazine with 4-aryl-2-hydroxy-4-oxobut-2-enoic and 2-hydroxy-5,5-
dimethyl-4-oxohex-2-enoic acids, resulting in the formation of 4-aryl-2-(2-phenylaminobenzoylhydrazono)-4-
oxobutanoic and 5,5-dimethyl-2-(2-phenylaminobenzoylhydrazono)-4-oxohexanoic acids. Derivatives of acids
in solutions are in the form of a mixture of Z,E-hydrazono form and in cyclic pyrazolinic form, and under the
action of acetic anhydride they are cyclized in 5-aryl- and 5-tert-butyl-3-(2-phenylaminobenzoylhydrazono)-2,3-
furandion. The antinociceptive and anti-inflammatory activity of 4-aryl-2-(2-phenylaminobenzoylhydrazono)-4-
oxobutanoic and 5,5-dimethyl-2-(2-phenylaminobenzoylhydrazono)-4-oxohexanoic acids was studied.
Keywords: phenanthranilic acid hydrazide, 2,4-dioxobutanoic acids, 3-hydrazonofuran-2-ones, biological
activity
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019