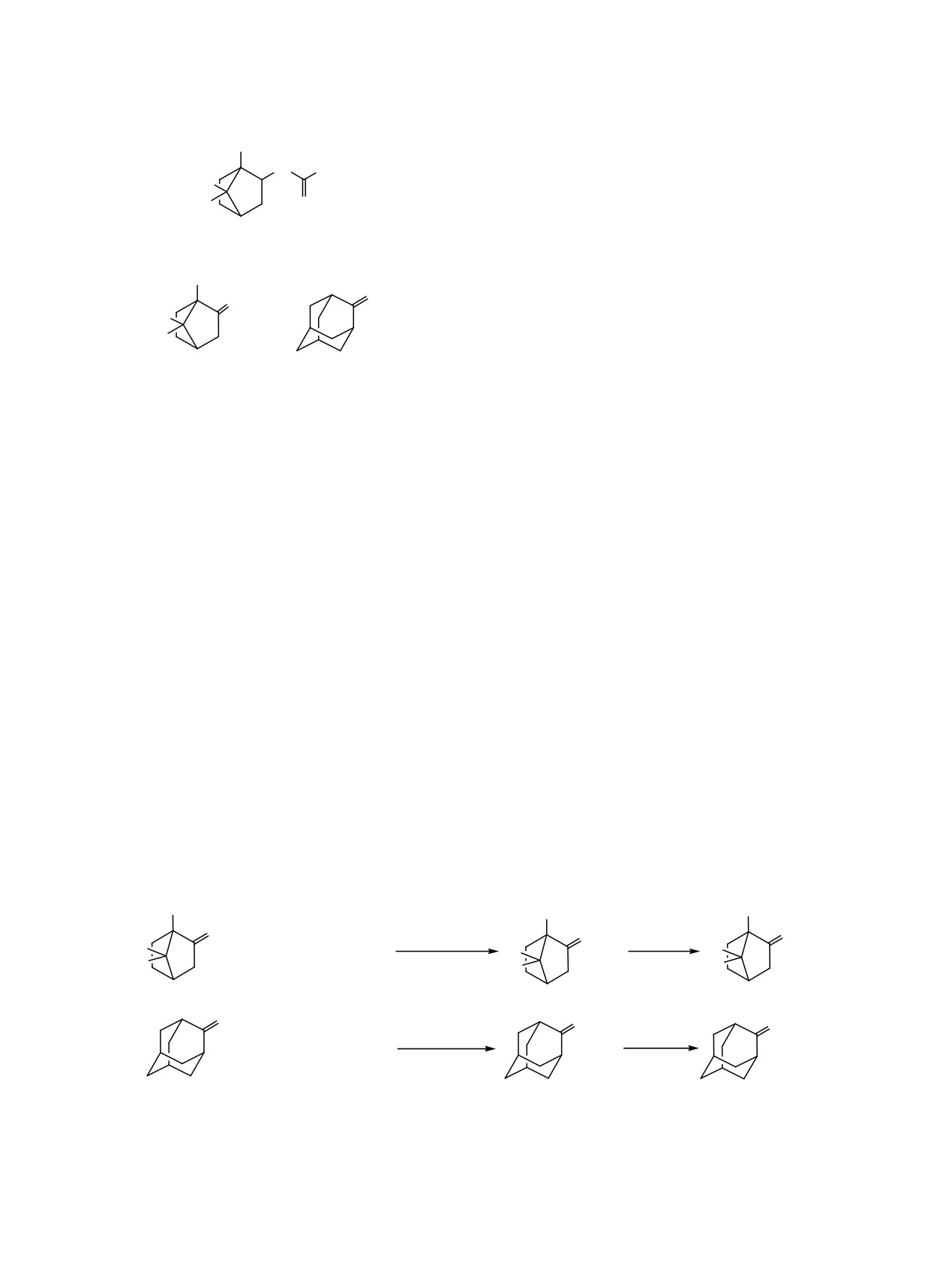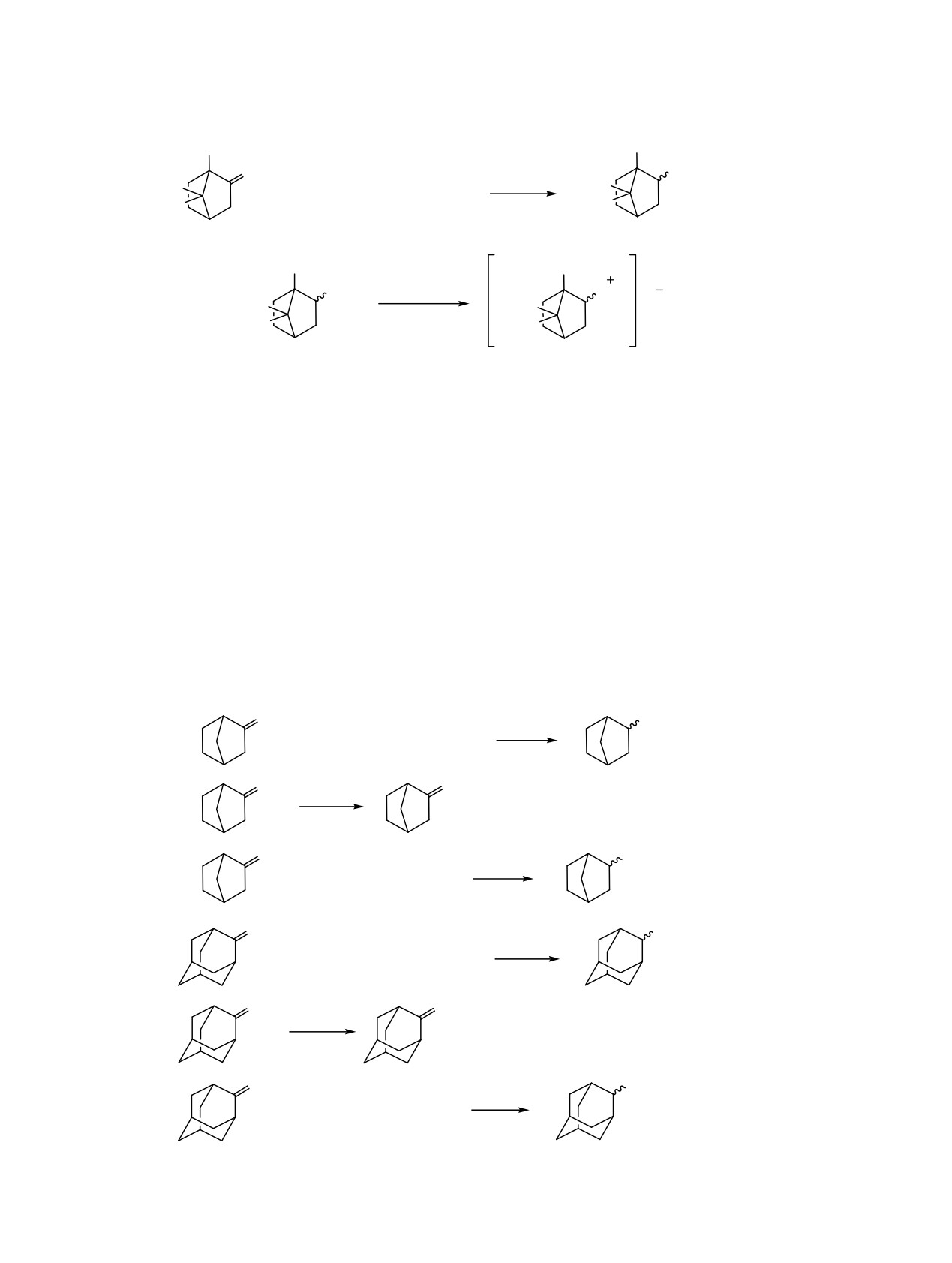ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 11, с. 1781-1788
УДК 547.599:542.942.5 + 615
ПОТЕНЦИАЛЬНЫЕ СИНТЕТИЧЕСКИЕ АДАПТОГЕНЫ:
V.1 РЕАКЦИЯ ШВЕНКА-ПАПА В СИНТЕЗЕ
МОНОАМИНОВ КАРКАСНОГО СТРОЕНИЯ
© 2019 г. И. А. Новаковa, М. Б. Навроцкийa, А. С. Мкртчянa, С. Н. Волобоевb,
О. В. Востриковаa, А. А. Вернигораa, *, Р. В. Брунилинa
a ФГБОУ ВО «Волгоградский государственный технический университет»,
400005, Россия, г. Волгоград, пр. им. Ленина 28
b ООО «ЛУКОЙЛ-Волгограднефтепереработка», 400029, Россия, г. Волгоград, ул. 40 лет ВЛКСМ 55
*e-mail: vernigoraa@vstu.ru
Поступила в редакцию 21 мая 2018 г.
После доработки 09 сентября 2019 г.
Принята к публикации 12 сентября 2019 г.
Изучение восстановления кетоксимов каркасного строения в условиях реакции Швенка-Папа позволило
установить, что оксимы D,L-, D- и L-камфоры гладко восстанавливаются в соответствующие амины с
высоким выходом. В то же время, оксим - D,L-норкамфоры и адамантан-2-оноксим претерпевает
частичное каталитическое деоксимирование с образованием смеси соответствующих аминов и спиртов.
Ключевые слова: моноамины каркасного строения, оксимы, восстановление, реакция Швенка-Папа.
DOI: 10.1134/S051474921911017X
В продолжение начатых нами ранее работ [1, 2]
этого, следует отметить, что похожие соединения
по направленному конструированию структурных
были недавно получены и изучены китайскими уче-
аналогов синтетических адаптогенов - Хлодантана
ными на предмет фунгицидной активности [7, 8].
[3] и Бромантана [4] (схема 1) были предложены к
Таким образом, задачей настоящей работы было
синтезу их биоизостеры (схема 2), содержащие
получение ключевых интермедиатов синтеза
фрагмент камфана и норкамфана, взамен адаман-
целевых структур: первичных аминов каркасного
танового каркаса (схема 3).
строения, на основе D,L-, D, L-камфоры и D,L-нор-
Целесообразность такой модификации струк-
камфоры, а также - выполнение сравнительной
туры веществ-прототипов была продиктована сле-
оценки условий их получения, с получением
дующими обстоятельствами. Во-первых, согласно
адамантан-2-амина (исходя из адамантан-2-она).
данным академика О.И. Киселёва и соавторов [5],
Восстановительное аминирование некоторых из
негативным побочным эффектом препаратов ряда
этих веществ было описано в литературе ранее с
адамантана может быть возникновение синдрома
использованием реакции Лейкарта-Валлаха [9, 10,
Рея, как проявление гепатотоксического действия.
11, 12]. Этот метод, однако, реализуется в очень
В то же время, соответствующие производные кам-
жестких условиях. Более мягким вариантом яв-
фанового ряда лишены этой особенности [5]. С
другой стороны, описан ряд примеров фармако-
логически-активных соединений [6], в том числе -
Схема 1.
обладающих противовирусными свойствами, в
H
Cl
N
которых замена адамантильного радикала на кам-
H
фанильный ведет к увеличению целевого вида
N
активности, без повышения токсичности. Кроме
Br
O
1 Сообщение IV см. [1].
Бромантан
Хлодантан
1781
1782
НОВАКОВ и др.
Схема 2.
Швенка-Папа ни разу не использовалась для
R
восстановления оксимов в амины. В то же время,
H
данные более ранней обзорной работы
[24],
N Ar
R
говорят о том, что эта реакция находила некоторое
R
O
использование при восстановлении оксимов. При
этом, один из первоисточников [25] говорит о том,
R = H, CH3.
что в этом случае реакция может проходить не-
Схема 3.
однозначно. С одной стороны, реализуется восстанов-
R
ление оксима в амин, а с другой стороны - деокси-
O
O
мирование. В свою очередь, данные T. Kametani и
R
Y. Nomura свидетельствуют о том, что получить
R
первичные амины из кетоксимов этим авторам
удалось лишь с невысоким выходом [26]. Так,
1_4
5
циклогексиламин был получен из соответст-
(1-3); R = H (4).
R = CH3
вующего оксима с выходом лишь ~ 49%.
Конфигурация хиральных центров:
1, 4 - (1RS), 2 - (1R), 3 - (1S).
Принимая во внимание удобства этого метода, а
также - структуры целевых соединений, нами была
впервые осуществлена попытка превращения
ляется первоначальное оксимирование указанных
оксимов кетонов каркасного строения в соот-
кетонов, с последующим восстановлением полу-
ветствующие амины, с использованием реакции
ченных оксимов по методу Вышнеградского-Ла-
Швенка-Папа, причем, в качестве основания был
денбурга [13, 14, 15] (натрием в кипящем спирте)
использован KOH, а не NaOH [25, 26]. Исходные
или путем каталитического гидрирования [16, 17].
оксимы были получены по уточненному методу K.
Auwers [27], путем обработки спиртового раствора
В свою очередь, следует отметить, что нашей
соответствующего каркасного кетона концент-
группой в ходе синтеза производных каркасных
рированным водным раствором H2NOH·HCl в
соединений ряда норкамфана [18, 19, 20] и ада-
присутствии спиртовой щелочи, с последующим
мантана
[21], широко использовалась реакция
выделением продуктов реакции. Описанные
Швенка-Папа [22], сочетающая в себе достоинства
превращения представлены на схеме 4.
каталитического гидрирования и восстановления
водородом in statu nascendi. Метод препаративно
Все оксимы были получены с хорошим
прост и заключается в обработке субстрата никель-
выходом и в дополнительной очистке не
алюминиевым сплавом в слабом водном растворе
нуждались.
щелочи (с добавкой, при необходимости, органи-
Восстановление полученных оксимов
6-8 в
ческого сорастворителя).
условиях реакции Швенка-Папа привело к
Данные последней обзорной работы
[23], к
желаемым аминам с чистотой свыше 99%, которые
удивлению, свидетельствуют о том, что реакция
были выделены и охарактеризованы в виде
Схема 4.
R
R
R
O
NONa
NOH
EtOH
AcOH
R
R
+ H2NOH·HCl + NaOH
R
R
_2NaCl, _3H2O
_AcONa
R
R
1_4
6_9
O
NONa
NOH
EtOH
AcOH
+ H2NOH·HCl + NaOH
_2NaCl, _3H2O
_AcONa
5
10
R = CH3 (1-3, 6-8); R = H (4, 9).
Конфигурация хиральных центров: 1, 4, 6, 9 - (1RS), 2, 7 - (1R), 3, 8 - (1S).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019
ПОТЕНЦИАЛЬНЫЕ СИНТЕТИЧЕСКИЕ АДАПТОГЕНЫ: V. РЕАКЦИЯ ШВЕНКА-ПАПА
1783
Схема 5.
CH3
CH3
NOH
NH2
H
H3C
3
3C
+ 4KOH + 2Ni_Al2 +
9H2O
3
+ 4K[Al(OH)4]
THF
H3C
H3C
6_8
11_13
CH3
CH3
NH2
HCl
NH3
Cl
H3C
H3C
t-BuOMe
H
3C
H3C
11_13
16_18
Конфигурация хиральных центров: 6, 11, 16 - (1RS, 2RS), 7, 12, 17 - (1R, 2RS), 8, 13, 18 - (1S, 2RS).
солянокислых солей. Описанные превращения
N,N-ди[(1RS,2RS)-норкамфан-2-ил]амина, образую-
представлены на схеме 5.
щегося, по-видимому, в ходе реакции восстано-
вительного аминирования, как показано на схеме 7.
В случае восстановления адамантан-2-оноксима
Выделение (1RS,2RS)-норкамфан-2-амина и ада-
и оксима норкамфоры была получена смесь аминов
мантан-2-амина было достигнуто путем осаждения
и соответствующих спиртов, что может быть
их хлористоводородных солей из смеси t-BuOMe-
объяснено протеканием процессов каталитичес-
THF током сухого HCl. Различия в поведении
кого деоксимирования и восстановления обра-
оксимов 6-8 и оксимов 9, 10 в условиях реакции
зующихся кетонов, как показано на схеме 6.
Швенка-Папа, очевидно, связаны с лучшей сорб-
Помимо этого, в случае оксима норкамфоры
цией последних на поверхности активных центров
фиксируется образование небольших количеств
катализатора, за счет меньшего экранирования
Схема 6.
NOH
NH2
3
+ 4KOH
+
2Ni_Al2
+ 9H2O
3
+ 4K[Al(OH)4]
THF
NOH
O
NiCK
H2O
O
OH
3
+ 2KOH + Ni_Al2 + 6H2O
3
+ 2K[Al(OH)4]
THF
NOH
NH2
3
+ 4KOH
+
2Ni_Al2
+ 9H2O
3
+ 4K[Al(OH)4]
THF
NOH
O
NiCK
H2O
O
OH
3
+ 2KOH + Ni_Al2 + 6H2O
3
+ 2K[Al(OH)4]
THF
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019
1784
НОВАКОВ и др.
Схема 7.
O
NH2
N
+
_
H2O
3
+ 2KOH + Ni_Al2 + 6H2O
3
+ 2K[Al(OH)4]
THF
N
N
H
фрагмента гидроксиламина. Это, в свою очередь,
Saturn-2100 в условиях ионизации электронным
предрасполагает к снижению селективности про-
ударом интенсивностью 70 эВ. Элементный анализ
цесса гидрирования и его осложнению побочной
выполнен на приборе Vario EL Cube.
реакцией деоксимирования. Следует отметить, что
Концентрирование растворов после реакций и
эти результаты хорошо согласуются с результа-
экстракций выполнялось с использованием рота-
тами работ [25, 26], а также - с данными об ослож-
ционного испарителя Heidolph Hei-VAP Precision.
нениях при получении Дейтифорина, путем ката-
В синтезах были использованы реагенты произ-
литического гидрирования оксима
1-[(1RS,2RS)-
водства компаний Alfa Aesar, Sigma Aldrich и
норкамфан-2-ил]-1-этанона [5].
растворители производства компании «Компонент-
Некоторые из полученных аминов и их
Реактив».
солянокислых солей обладают антивирусной
Дополнительная осушка и очистка растворите-
активностью в отношении вирусов гриппа [28],
лей проводилась в соответствии со стандартными
сопоставимой и превосходящей активность
методами [29].
амантадина. Кроме этого, все полученные
вещества представляют собой ключевые интер-
D,L-Камфоры оксим
(6). К раствору
10 г
медиаты синтеза новых биоизостерических ана-
(~ 66 ммоль) D,L-камфоры в 95%-ном EtOH (100
логов Хлодантана, а также - экспериментального
мл) прибавлялся раствор 9.12 г (~ 131 ммоль)
препарата АДК-918 [3].
H2NOH·HCl в воде (10 мл). Полученный раствор
Таким образом, было показано, что реакция
обрабатывался раствором 16 г (0.4 ммоль) NaOH в
Швенка-Папа может быть с успехом использована
95%-ном EtOH (180 мл) при перемешивании. При
для получения библиотек первичных аминов на
этом происходило разогревание смеси и выделение
основе оксимов кетонов, содержащих пространст-
осадка NaCl. Реакционная смесь перемешивали
венно экранированную группу C=NOH в мягких
еще 1 ч, после чего оставили при комнатной
условиях, и представляет собой практическую
температуре с защитой от CO2 воздуха. Окончание
альтернативу другим способам восстановления.
реакции определяли путем смешивания небольшой
аликвоты реакционной массы с 10-ти кратным
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
объемом воды (отсутствие помутнения указывает
на окончание реакции), либо - путем хроматог-
Температуры плавления полученных соедине-
рафического анализа подкисленной пробы реак-
ний были определены на приборе Buchi M-565 при
ционной массы. По окончании реакции, реак-
скорости нагрева
1°С/мин (приведены коррек-
ционная смесь разбавлялась 2-х кратным объемом
тированные значения). В случае гидрохлоридов
воды и нейтрализовалась расчетным количеством
аминов 15-19 эти значения не являются харак-
ледяной AcOH. Этиловый спирт отгонялся в
теристическими, так как представляют собой тем-
вакууме водоструйного насоса на ротационном
пературы разложения, зависящие от скорости
испарителе, при температуре бани
<
40°C.
нагревания. Спектры ЯМР 1Н регистрировали на
Кристаллизовавшийся при этом из реакционной
приборе Varian Mercury
300 BB при рабочей
массы оксим, отделялся от охлажденного раствора
частоте 300 МГц [внутренний стандарт - гексаме-
фильтрованием, промывлся водой на фильтре и
тилдисилоксан (ГМДС)]. ИК спектры были запи-
сушился на воздухе до постоянной массы. Выход
саны на приборе Nicolet-6700 (Termo Electron Co).
8 г (73%), т.пл. 116.7-117.5°C. Содержание основ-
ГЖХ-МС анализ выполняли на приборе Varian
ного вещества по ГЖХ 97.1%, τR 11.394 мин. ИК
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019
ПОТЕНЦИАЛЬНЫЕ СИНТЕТИЧЕСКИЕ АДАПТОГЕНЫ: V. РЕАКЦИЯ ШВЕНКА-ПАПА
1785
спектр, ν, см-1: 3260, 2956, 1687, 1441, 1372, 1248,
Адамантан-2-она оксим (10). Получался ан-
921, 863, 852. Спектр ЯМР 1Н, δ, м.д.: 0.74 с (3H,
алогично оксиму D,L-камфоры 6, за исключением
CH3), 0.85 с (3H, CH3), 0.94 с (3H, CH3), 1.13-1.22 м
использования адамантан-2-она взамен D,L-кам-
(1H, CH), 1.35-1.44 м (1H, CH2), 1.59-1.68 м (1H,
форы. Выход 95%, т.пл. 167.8-168.3°C. Содер-
CH2), 1.72-1.82 м (1H, CH2), 1.85 т (1H, CH2, J
жание основного вещества по ГЖХ
99.3%, τR
4.3 Гц), 1.98 д (1H, CH2, J 17.7 Гц), 2.45-2.53 м (1Н,
14.048 мин. Масс-спектр, m/z (Iотн, %): 166 (25.2)
СН), 8.47 д (1H, NOH, J 7.9 Гц). Масс-спектр, m/z
[M]+, 147 (85), 132 (71.6), 105 (33.4), 91 (66), 79
(Iотн, %): 168 (71.3) [M]+, 150 (64.7), 124 (100), 110
(100), 69 (50), 65 (29). Спектр ЯМР 1Н соответст-
(74), 94 (51), 79 (51.5), 67 (58.7), 41 (60). Найдено,
вует литературным данным [32].
%: С 72.01; Н 10.24; N 8.39. С10H17NO. Вычислено,
(1RS,2RS)-Норкамфан-2-амина гидрохлорид
%: C 71.86; H 10.18; N 8.38.
(19). К раствору 5.7 г (~ 46 ммоль) оксима 9 в 50 мл
ТГФ прибавлялся 250 мл 1 М раствора KOH в воде.
D-Камфоры оксим (7). Получался аналогично
К полученной смеси, при интенсивном переме-
6, за исключением использования D-камфоры,
шивании, порциями по 2.5 г с интервалами по
взамен D,L-камфоры. Выход
87%, т.пл.
118.9-
20 мин, прибавлялся никель-алюминиевый сплав.
119.5°C. Содержание основного вещества по ГЖХ
В общей сложности прибавлялось 10 г сплава,
98.7%, τR 11.407 мин. ИК спектр, ν, см-1: 3262,
причем за счет тепловыделения в ходе реакции
2956, 1688, 1442, 1372, 1249, 921, 864, 853. Спектр
смесь начинала слабо кипеть. По окончании
ЯМР 1Н соответствует данным литературы [30].
прибавления всего сплава, реакционную смесь
Масс-спектр, m/z (Iотн, %): 168 (100) [M]+, 150 (20),
перемешивали еще 30 мин, повторно доводили до
109 (17). Найдено, %: С 72.01; Н 10.25; N 8.40.
кипения и кипятили при интенсивном переме-
С10H17NO. Вычислено, %: C 71.86; H 10.18; N 8.38.
шивании еще 2 ч. После этого нагревание отклю-
L-Камфоры оксим (8). Получался аналогично
чали, реакционную массу охлаждали при переме-
7, за исключением использования L-камфоры, вза-
шивании до комнатной температуры, разбавляли
мен D-камфоры. Выход 82%, т.пл. 118.8-119.5°C.
50 мл ТГФ и фильтровали. Осадок катализатора на
Содержание основного вещества по ГЖХ 98.8%, τR
фильтре (обладает пирофорными свойствами!)
11.439 мин. ИК спектр, ν, см-1: 3284, 2957, 1685,
промывали ТГФ (3×50 мл) и немедленно высыпали
1437, 1369, 1247, 921, 863, 852. Спектр ЯМР 1Н, δ,
в воду. Фильтрат извлекался 3×100 мл t-BuOMe,
м.д.: 0.74 с (3H, CH3), 0.85 с (3H, CH3), 0.94 с (3H,
водная фаза отбрасывалась, а органические
CH3), 1.15-1.22 м (1H, CH2), 1.35-1.41 м (1Н, СН2),
вытяжки объединялись и сушились KOH при
1.59-1.69 м (1H, CH2), 1.73-1.81 м (1H, CH2), 1.85 т
кипячении. Охлажденный раствор отделялся от
(1Н, СН2, J 4.4 Гц), 1.98 д (1H, CH2, J 18.0 Гц), 2.49
осушителя декантацией и упаривался при нор-
д (1H, CH, J 17.7 Гц), 8.45 с (1H, NOH). Масс-
мальном, а затем
- пониженном давлении на
спектр, m/z (Iотн, %): 168 (46.4) [M]+, 150 (57.4), 134
водяной бане с защитой от CO2 воздуха. В кубе
(38.3), 124 (100), 110 (67), 94 (55), 79 (65.7), 67 (66),
осталась смесь аминов и норборнеолов, которую
41 (62). Найдено, %: С 72.10; Н 10.00; N 8.39.
растворили в смеси безводного t-BuOMe и ТГФ и
обработали полученный раствор током сухого HCl
С10H17NO. Вычислено, %: C 71.86; H 10.18; N 8.38.
при перемешивании, до достижения слабо кислой
D,L-Норкамфоры оксим (9). Получался анало-
среды в смеси. Выделявшийся объемистый белый
гично оксиму D,L-камфоры 6, за исключением того,
осадок гидрохлорида амина
19 отделили
что продукт реакции не кристаллизовался из раст-
фильтрованием, промыли на фильтре безводным t-
вора в ходе отгонки спирта. Охлажденный кубовой
BuOMe и сушили на воздухе до постоянной массы.
раствор извлекался t-BuOMe. Объединенные орга-
Выход 2.8 г (42%). Содержание основного продукта
нические вытяжки сушились Na2SO4, фильтро-
14, полученного из осажденной соли обработкой
вались и упаривались. Оставшийся в кубе оксим
щелочью, по ГЖХ ~ 100% [соотношение между
имел достаточную чистоту для дальнейших прев-
парами диастереомеров: ~ 56.3% (τR 5.176 мин) и
ращений и образовывался с выходом, близким к
~ 43.7% (τR 5.297 мин)]. ИК спектр, ν, см-1: 2950,
количественному. Спектр ЯМР 1Н, масс-спектр и
2869, 2596, 1968, 1598, 1498, 1451, 1099, 1052,
ИК спектр соответствуют литературным данным
1032. Спектр ЯМР
1Н соответствует данным
[31]. Найдено,
%: С
66.98; Н
9.01; N
11.24.
литературы [33]. Масс-спектр свободного осно-
С7H11NO. Вычислено, %: C 67.20; H 8.80; N 11.20.
вания, m/z (Iотн, %): Пара диастереомеров 1: 112
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019
1786
НОВАКОВ и др.
(32.5)
[M]+,
111
(41),
82
(100),
79
(34); Пара
уш.с (3H, NH3+). Масс-спектр свободного осно-
диастереомеров 2: 112 (33) [M]+, 111 (39), 82 (100),
вания, m/z (Iотн, %): 153 (43) [M]+, 121 (35.5), 95
79 (44), 56 (33). Найдено, %: С 58.18; Н 8.87; N
(76), 93 (35), 82 (100), 67 (44), 43 (38). Найдено, %:
9.56. С7H14ClN. Вычислено, %: C 56.90; H 9.49; N
С 64.52; Н 10.34; N 7.35. С10H20ClN. Вычислено, %:
9.49.
C 63.26; H 10.54; N 7.38.
(1RS,2RS)-Камфан-2-амина гидрохлорид (16).
Адамантан-2-амина гидрохлорид (20). Полу-
Получался аналогично 19, за исключением исполь-
чался аналогично
19, за исключением исполь-
зования оксима 6, взамен оксима 9. Осаждение
зования оксима 10, взамен оксима 9. Осаждение
солянокислой соли амина вели из чистого t-
солянокислой соли амина ведут из чистого t-
BuOMe. Выход 84%. Содержание основного ве-
BuOMe. Выход 71%. Содержание основного ве-
щества по ГЖХ (свободного основания 11) 98.9%,
щества по ГЖХ (свободного основания 15, выде-
τR 8.652 мин. ИК спектр, ν, см-1: 2984, 2882, 2607,
ленного из осажденной соли) 99.9%, τR 6.744 мин.
2030.
1600, 1519, 1458, 1381, 1085, 1061,
1046.
Масс-спектр свободного основания, m/z (Iотн, %): 151
Спектр ЯМР 1Н, δ, м.д.: 0.82-0.84 м (3H, CH3), 0.94
(35.4) [M], 150 (100), 134 (27), 92 (30.5), 91 (34.4).
д (3H, CH3, J 4.9 Гц), 0.97 с (3H, CH3), 1.11 д (1H,
CH, J 4.3 Гц), 1.20-1.26 м (1H, CH2), 1.37-1.42 м
БЛАГОДАРНОСТИ
(1H, CH2), 1.57 д (1H, CH2, J 11.0 Гц), 1.65-1.77 м
(1H, CH2), 1.95-2.01 м (1H, CH2), 2.15-2.23 м (1H,
Работа выполнена с использованием оборудо-
CH2), 3.05 д (1H, CH, J 4.9 Гц), 8.23 уш.с (3H,
вания ЦКП ФХМИ ФГБОУ ВО «ВолгГТУ» и
NH3+). Масс-спектр свободного основания, m/z
инжинирингового центра на базе ФГБОУ ВО
(Iотн, %): 153 (54) [M], 121 (37), 110 (32), 95 (72), 82
«ВолгГТУ».
(100), 67 (45), 43 (40). Найдено, %: С 64.77; Н
ФОНДОВАЯ ПОДДЕРЖКА
10.27; N 7.47. С10H20ClN. Вычислено, %: C 63.26; H
10.54; N 7.38.
Настоящая работа выполнена при финансовой
(1R,2RS)-Камфан-2-амина гидрохлорид
(17).
поддержке гранта РНФ № 16-13-00100.
Получался аналогично 19, за исключением испо-
льзования оксима 7, взамен оксима 9. Осаждение
КОНФЛИКТ ИНТЕРЕСОВ
солянокислой соли амина вели из чистого t-
BuOMe. Выход 81%. Содержание основного ве-
Авторы заявляют об отсутствии конфликта
щества по ГЖХ (свободного основания 12) 99.6%,
интересов.
τR 8.645 мин. ИК спектр, ν, см-1: 2985, 2884, 2609,
2031, 1601, 1523, 1458, 1381, 1084, 1062,
1046.
СПИСОК ЛИТЕРАТУРЫ
Спектр ЯМР 1Н свободного основания соответст-
1. Бабушкин А.С., Навроцкий М.Б., Новаков И.А.,
вует данным литературы [8]. Масс-спектр свобод-
Орлинсон Б.С., Робинович М.Д., Шейкин Д. С.,
ного основания, m/z (Iотн, %): 154 (42) [M]+, 153
Волобоев С.Н. Хим.-фарм. ж.
2016,
50,
9.
(69), 121 (45), 110 (37), 108 (35), 95 (76), 93 (36), 82
[Babushkin A.S., Navrotskii M.B., Novakov I.A.,
(100), 43 (39). Найдено, %: С 65.21; Н 10.17; N 7.42.
Orlinson B.S., Robinovich M.D., Sheikin D.S.,
С10H20ClN. Вычислено, %: C 63.26; H 10.54; N 7.38.
Voloboev S.N. Pharm. Chem. J. 2016, 50, 781.] doi
10.1007/s11094-017-1531-5
(1S,2RS)-Камфан-2-амина гидрохлорид
(18).
2. Новаков И.А., Яблоков А.С., Вернигора А.А.,
Получался аналогично 19, за исключением испо-
Орлинсон Б.С., Навроцкий М.Б., Волобоев С.Н. Изв.
льзования оксима 8, взамен оксима 9. Осаждение
АН. Сер. хим.
2017,
66,
1597.
[Novakov I.A.,
солянокислой соли амина ведут из чистого t-
Yablokov A.S.,
Vernigora
A.A.,
Orlinson B.S.,
BuOMe. Выход 78%. Содержание основного ве-
Navrotskii M.B., Voloboev S.N. Russ. Chem. Bull.
щества по ГЖХ (свободного основания 13) 99.5%,
2017, 66, 1597.] doi 10.1007/s11172-017-1929-y
τR 8.645 мин. ИК спектр, ν, см-1: 2985, 2883, 2608,
3. Морозов И.С., Арцимович Н.Г., Климова Н.И. Пат.
2032, 1600, 1523, 1458, 1381, 1083, 1062,
1046.
1646256 (1991). РФ. Б.И. 1996, № 16.
Спектр ЯМР 1Н, δ, м.д.: 0.82 кв (9H, 3CH3, J1
4. Морозов И.С., Иванова И.А., Лукичева Т.А. Хим.-
17.1 Гц, J2 10.4 Гц), 1.05 д (1Н, СН, J 12.8 Гц), 1.27
фарм. ж. 2001, 35, 3. [Morozov I.S., Ivanova I.A.,
д (1Н, СН2, J 9.8 Гц), 1.51-1.69 м (4Н, 4СН2), 2.09 т
Lukicheva T.A. Pharm. Chem. J. 2001, 35, 235.] doi
(1Н, СН2, J 12.5 Гц), 3.17 д (1Н, СН, J 10.4 Гц), 8.04
10.1023/A:1011905302667
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019
ПОТЕНЦИАЛЬНЫЕ СИНТЕТИЧЕСКИЕ АДАПТОГЕНЫ: V. РЕАКЦИЯ ШВЕНКА-ПАПА
1787
5. Тандура С.Н., Зарубаев В.В., Анфимов П.М.,
20. Новаков И.А., Орлинсон Б.С., Брунилин Р.В.,
Киселев О.И. Антибиот. химиотер. 2013, 58, 36.
Навроцкий М.Б., Еремийчук А.С. Пат.
2307826
[Tandura S.N., Zarubaev V.V., Anfimov P.M., Kiselev O.I.
(2007). РФ.
Antibiotics Chemother. 2013, 58, 36.]
21. Новаков И.А., Орлинсон Б.С., Мамутова Н.Н.,
6. Шокова Э.А., Ким Дж. К., Ковалев В.В. ЖОрХ.
Савельев Е.Н., Потаенкова Е.А. ЖОХ. 2015, 85,
2016, 52, 471. [Shokova E.A., Kim J.K., Kovalev V.V.
1076. [Novakov I.A., Orlinson B.S., Mamutova N.N.,
Russ. J. Org. Chem. 2016, 52, 459.] doi 10.1134/
Saveliev E.N., Potaenkova E.A. Russ. J. Gen. Chem.
S1070428016040011
2015, 85, 1602.] doi 10.1134/S107036321507004X
7. Lin G., Huang Y., Duan W., Cen B., Lei F. Huaxue
22. Вацуро К.В., Мищенко Г.Л. Именные реакции в
Tongbao. 2015, 78, 722.
органической химии. М: Химия, 1976. 266 с.
8. Huang Y., Duan W., Lin G., Cen B., Wang F., Lei F.
23. Cho H., Schäfer C., Török B. Curr. Org. Synth. 2016,
Huaxue Tongbao.
2014,
77,
878. doi
10.14159/
13, 255. doi 10.2174/1570179413999151110122145
j.cnki.0441-3776.2014.09.003
24. Keefer L.K., Lunn G. Chem. Rev. 1989, 89, 459. doi
9. Ingersoll A.W., Brown J.H., Kim C.K., Beauchamp W.D.,
10.1021/cr00093a002
Jennings G. J. Am. Chem. Soc. 1936, 58, 1808. doi
25. Staskun B., van Es T. J. Chem. Soc. 1966, 531. doi
10.1021/ja01300a089
10.1039/j39660000531
10. Leuckart R., Bach E. Ber. Dtsch. Chem. Ges. 1887, 20,
26. Kametani T., Nomura Y. J. Pharm. Soc. Japan. 1954.
104. doi 10.1002/cber.18870200125
74, 413. doi 10.1248/yakushi1947.74.4_413
11. Griepenkerl J. Liebigs Ann.
1892,
269,
347. doi
27. Auwers K., Ber. Dtsch. Chem. Ges. 1889, 22, 604. doi
10.1002/jlac.18922690211
10.1002/cber.18890220259
12. Бардышев И.И., Козлов Н.Г. Доклады Академии
28. Zhao X., Zhang Z.-W., Cui W., Chen S., Zhou Y.,
Наук БССР. 1979, 23, 630.
Dong J., Jie Y., Wan J., Xu Y., Hu W. Med. Chem.
13. Hückel W., Nerdel F. Liebigs Ann. 1937, 528, 57. doi
Comm. 2015, 6, 727. doi 10.1039/c4md00515e
10.1002/jlac.19375280105
29. Титце Л., Айхер Т. Препаративная органическая
14. Ling Y., Yang X., Liu S. Huaxue Tongbao. 1996, 1, 39.
химия. Реакции и синтезы в практикуме органи-
15. Крестинский В.Н., Бардышев И.И. ЖОХ. 1940, 10, 1894.
ческой химии и научно-исследовательской лабора-
тории. М.: Мир, 1999, 704. [Tietze L., Eicher T.
16. Kaye I., Linsk J. J. Chem. Soc. 1963, 6078.
Reactionen und Synthesen im organischchemischen
17. Бардышев И.И., Козлов Н.Г., Геллер А.А. Вести
Praktikum und Forschungslaboratorium. Stutgart-New
Академии Наук БССР. 1979, 3, 116.
York: Georg Thieme Verlag, 1991.
18. Новаков И.А., Орлинсон Б.С., Брунилин Р.В.,
30. Zhou Y., Dong J., Zhang F., Gong Y. J. Org. Chem.
Бакшаева А.А., Сорокина Е.В. ЖОХ. 2015, 85, 511.
2011, 76, 588. doi 10.1021/jo102124d
[Novakov I.A., Orlinson B.S., Brunilin R.V., Bakshae-
va A.A., Sorokina E.V. Russ. J. Gen. Chem., 2015, 85,
31. Hunt P.A., Moody C.J., Slawin A.M.Z., Williams D.J.,
761.] doi 10.1134/S1070363215030378
Myers P.L., Smith C. J. Chem. Soc. Perkin Trans. 1.
1992, 831. doi 10.1039/P19920000831
19. Новаков И.А., Орлинсон Б.С., Брунилин Р.В., Нав-
роцкий М.Б., Еремийчук А.С., Думлер С.А., Гордее-
32. Suzuki K., Watanabe T., Murahashi S.-I. J. Org. Chem.
ва Е.А. Хим.-фарм. ж. 2011, 45 (7), 41.[Novakov I.A.,
2013, 78, 2301. doi 10.1021/jo302262a
Orlinson B.S., Brunilin R.V., Navrotskii M.B., Ere-
33. Brown H. C., Kim K.-W., Srebnik M., Singaram B.,
miichuk A.S., Dumler S.A., Gordeeva E.A. Pharm.
Tetrahedron. 1987, 43, 4071. doi 10.1016/S0040-4020
Chem. J. 2011, 45, 419.] doi 10.1007/s11094-011-0646-3
(01)83445-1
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019
1788
НОВАКОВ и др.
Potential Synthetic Adaptogenes: V. Cage Monoamines
Synthesis via Schwenk-Papa Reaction
I. A. Novakova, M. B. Nawrozkija, A. S. Mkrtchyana, S. N. Voloboevb, O. V. Vostrikovaa,
A. A. Vernigoraa, *, and R.V. Brunilina
a Volgograd State Technical University, 400005, Russia, Volgograd, pr. Lenina 28
b LLC LUKOIL-Volgogradneftepererabotka, 400029, Russia, Volgograd, ul. 40 let VLKSM 55
*e-mail: vernigoraa@vstu.ru
Received May 21, 2019; revised September 9, 2019; accepted September 12, 2019
The study of the reduction of ketoximes of the framework structure under the conditions of the Schwenk-Papa
reaction allowed us to establish that the D,L, D- and L-camphor oximes are smoothly reduced to the
corresponding amines in high yield. At the same time, oxime D,L-norcamphor and adamantan-2-onoxime
undergoes partial catalytic deoximation with the formation of a mixture of the corresponding amines and
alcohols.
Keywords: cage amine, oxime, reduction, Schwenk-Papa reaction
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 11 2019