ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 12, с. 1834-1842
УДК 547.917
СИНТЕЗ НОНАНО-9-ЛАКТОНА,
АННЕЛИРОВАННОГО С δ-ЛАКТОННЫМ ЦИКЛОМ
© 2019 г. Л. Х. Файзуллина*, А. Р. Тагиров, Ш. М. Салихов, Ф. А. Валеев
ФГБУН «Уфимский институт химии Уфимского федерального исследовательского центра РАН»,
450054, Россия, Республика Башкортостан, г. Уфа, пр. Октября 69
*e-mail: sinvmet@anrb.ru
Поступила в редакцию 30 апреля 2019 г.
После доработки 16 октября 2019 г.
Принята к публикации 24 октября 2019 г.
С целью получения аннелированных дилактонов в аддуктах Михаэля левоглюкозенона циклогексанона
осуществлена модификация углеводного остатка в δ-лактон и его производные, конденсированные с
октагидрохромановым бициклом. Последующее окислительное расщепление мостика в октагидро-
хромановом фрагменте действием PCC (пиридиний хлорхромат) привело к получению нонано-9-лактона,
аннелированного в С6-С7-положениях с δ-лактоном и δ-метиллактолом. Установлено, что наличие
карбонильной функции в углеводном остатке препятствует разрыву С-С-связи.
Ключевые слова: левоглюкозенон, аддукты Михаэля, ацетали, кетали, лактоны, дилактоны,
окислительный разрыв С-С-связи.
DOI: 10.1134/S0514749219120048
Хиральные лактоны среднего и большого
В дикетонах 1a, b кетогруппы защитили в виде
размеров, получаемые в 2 стадии из аддуктов
диоксоланов 2a, b [13] и после раскрытия 1,6-
Михаэля левоглюкозенона и циклоалканонов [1-3],
ангидромостика действием ZnCl2 в Ac2O получили
содержат аннелированный с лактонным кольцом
ацетаты 3a, b (схема 1).
углеводный остаток, привлекательный для его
Гидролиз диацетатов 3a, b осуществляли дейст-
превращения в лактоны обычного размера цикла.
вием КОН-EtOH-H2O. Полученные диолы переве-
Как известно, γ- и δ-лактоны, конденсированные с
ли в кетали 4a, b действием p-TsOH в метаноле.
центральным карбо- или гетероциклическим
Альтернативный способ гидролиза-кетализации
кором, вносят существенный вклад в биологичес-
диацетатов 4a, b действием MeONa в MeOH ока-
кую активность соответствующего природного
зался эффективнее и привёл также к продуктам
соединения [4-12]. С целью получения конденси-
селективного метилирования только полукеталь-
рованного дилактона подобного строения мы
ных центров (схема 2).
изучили возможности превращения углеводного
остатка в аддуктах Михаэля левоглюкозенона и
Об образовании соединений 4a, b в спектре 1H-
циклогексанона в аннелированный в положениях
13C HMBC свидетельствуют корреляционные пики
С6-С7 с δ-лактоном нонано-9-лактон.
Н5'/С6'а и OCH3/C6'a. Наличие эффекта Оверхаузера
Схема 1.
O
O
OAc
O
O
O
OAc
[13]
ZnCl
2, Ac2O
O
O
H
O
H
O
H
77%
O
O
O
O
O
O
1a, b
2a, b
3a, b
1834
СИНТЕЗ НОНАНО-9-ЛАКТОНА, АННЕЛИРОВАННОГО С δ-ЛАКТОННЫМ ЦИКЛОМ
1835
Схема 2.
O
H
O
H
O
PCC, CH2Cl2
[O]
O
кипячение, 26%
O
O
O
6
5'
O H
O H
MeO
MeO
1. KOH, EtOH, H2O
6'a
окисление
H
O
H
O
2. MeOH, п-TsOH
4'a
по Коллинзу, 87%
3а, b
10'a
10'b
OH
O
73% на 2 стадии
3'
или
или
H
PDC, CH2Cl2, 87%
H
1'
O
O
MeONa_MeOH, 80%
или
O
PCC, CH2Cl2, 70%
O
4а, b
5
R:S, 1:1
PDC - пиридинийдихромат
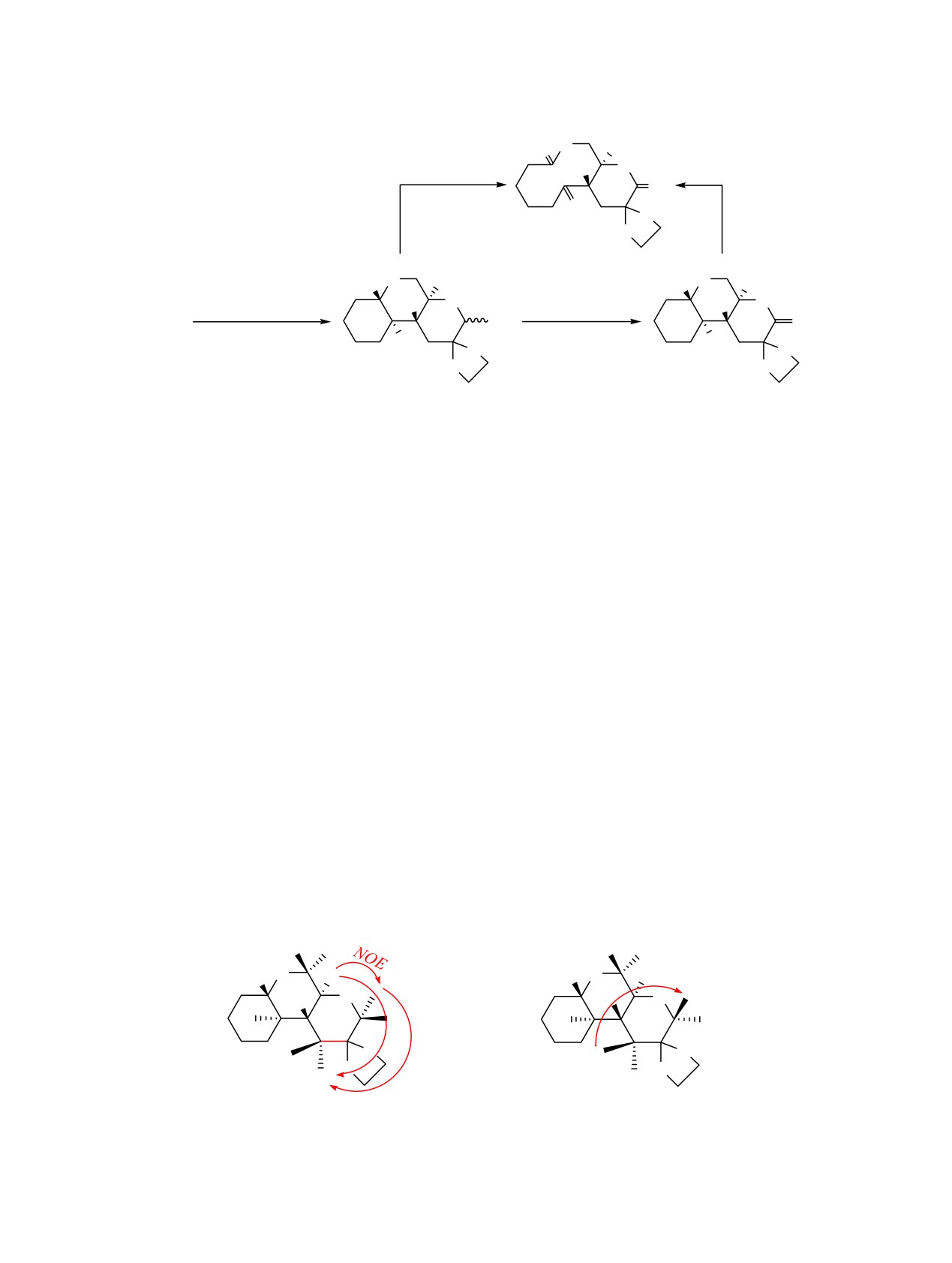
между протонами метоксигруппы и Н10'b подтверж-
от [1-3], оказалась безуспешной, только при кипя-
дает S-конфигурацию центра С6'а, а взаимодействие
чении раствора полуацеталей 4а, b в CH2Cl2 в при-
между Н10'a/H4'a свидетельствует о R-конфигурации
сутствии РСС с небольшим выходом удалось полу-
центра С10'a в обоих изомерах. NOE-Эффекты
чить дилактон 6 (схема 2). Низкая эффективность
между протонами Н3'/H4'a, Н3'/Н1'В, Н4'а/Н10'а у эпи-
превращения, по всей вероятности, обусловлена
мера 4a и Н3'/H1'А у аномера 4b позволяют пред-
конкурирующей реакцией окисления полуацеталь-
полагать R- и S-конфигурацию центра С3', соот-
ной функции, приводящей к образованию нереак-
ветственно.
ционноспособного лактона 5.
Попытка окисления аномерных ацеталей 4а, b
Строение дилактона 6 подтверждается сигна-
действием Br2 в растворе диоксан - вода завер-
лами четвертичных углеродов С2 при 166.29 м.д.,
шилась образованием сложной смеси продуктов
С5 при 205.81 м.д. и С10 при 171.95 м.д., а также
реакции, тогда как окисление по Коллинзу или
корреляционными взаимодействиями Н4/С2, Н12/С10
действием PDCпривело к лактону 5 (схема 2).
и Н4а/С5 в спектре 1H-13C HMBC.
Строение лактона 5 подтверждается сигналом
Полученный результат позволил направить
лактонного карбонила при 168.03 м.д. в спектре
наши исследования по альтернативному пути полу-
ЯМР 13С, а также корреляционными взаимодейст-
чения, включающего последовательные стадии
виями Н1/С3', Н4а/С3' в спектре 1H-13C HMBC.
защиты ацетальной гидроксильной группы в лак-
Попытка получения целевого конденсирован-
толах 4a, b действием TBSCl (третбутилдиметил-
ного дилактона 6 действием окислителей на основе
силилхлорид), расщепления мостиковой С-С-связи
CrO3 на кеталь 5 при комнатной температуре с
в силанах, снятия TBS-защиты и окисления аце-
целью расщепления смежной С-С-связи, в отличие
тального центра.
HAHB
HA
HB
H
MeO
O
5
H
MeO O (S)
(S)
NOE
H
H
(S)
O
H
(S)
O
(S)
H
4a
(S)
4a
10a
10a
H
10b
3
OH
H
10b
3
OH
(R)(S)
(R)
(R)
(S)
(S)
(S)
(S)
NOE
O
1
O
HA
HA
O
O
HB
HB
4a
4b
NOE-взаимодействия в диастереомерах соединения 4.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
1836
ФАЙЗУЛЛИНА и др.
Схема 3.
MeO
O H
O
O H
H
O
H
O
TBSCl
PCC, CH2Cl2,
4a, b
OTBS
OTBS
99%
65%
H
O
O
O
O
O
7a, b
8a, b
R:S, 2:1
O
O H
H
O
MeOH_CSA
PCC, CH2Cl2, кипячение, 72%
OH
6
92%
или
O
PDC, CH2Cl2, кипячение, 20%
O
O
9a, b
Так, обработка лактолов 4a, b TBSCl в CH2Cl2 в
С=О в спектре HMBC. Карбонильный атом угле-
присутствии имидазола привела к TBS-эфирам 7a, b.
рода С5 регистрируется при 208.01 [208.00] м.д.,
Окислительным расщеплением С-С-связи в
который в спектре HMBC коррелирует с прото-
силанах 7a, b в CH2Cl2 действием РСС получили
нами Н4А и Н12А. Так как конфигурация центра С12а
аномерные нонано-9-лактоны 8a, b. Гидролиз защит-
в ходе реакции не затрагивается, наличие эффекта
ной группы в метаноле в присутствии камфор-
Оверхаузера между протонами Н12А с протоном Н4а
сульфокислоты (CSA) с хорошим выходом привел
позволяют утверждать о S-конфигурации центра С4а.
к лактолам 9a, b, стадия окисления полуацеталей
Таким образом, наличие карбонильной функции
9a, b завершила синтез дилактона 6 с общим
в углеводном остатке полукеталей препятствует
выходом 43% на 4 стадии (схема 3).
расщеплению С-С-связи. Введение метильной
Для выяснения степени влияния δ-лактонного
группы, несмотря на её удалённость от реак-
карбонила на реакцию расщепления С-С-связи в
ционного центра, как и в [14], способствует этому
октагидрохромановом фрагменте его метилирова-
превращению (см. таблицу). Учитывая тот факт,
ли действием MeMgI. После обработки полученной
что эти заместители не оказывают существенного
смеси аномерных полукеталей 10a, b РСС произо-
влияния на конформацию молекулы, их действие
шло гладкое расщепление С-С-связи с образова-
на реакционную способность рассматриваемых
нием диастереомерных лактонов 11a, b с наиболее
полукеталей можно отнести к эффекту поля.
высоким выходом в этом ряду полукеталей - 78%.
В результате исследования осуществлены син-
(схема 4).
тезы нонано-9-лидов, в том числе аннелированного
Об образовании лактонов 11a, b свидетельст-
δ-лактонным циклом, перспективные для изучения
вуют сигналы карбоксильной группы при 172.62
взаимосвязи структура - активность в ряду полу-
[172.47] м.д., а также корреляционный пик Н12А/
ченных лактонов из левоглюкозенона.
Схема 4.
12'
MeO O
H
O
O H
O
Me
O
Me
H
9
H
MeMgI
PCC, CH2Cl
2
12a
5
5
2'
69%
OH
78%
4a
OH
4'
3'
O
H
O
O
O
O
10a, b
11a, b
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
СИНТЕЗ НОНАНО-9-ЛАКТОНА, АННЕЛИРОВАННОГО С δ-ЛАКТОННЫМ ЦИКЛОМ
1837
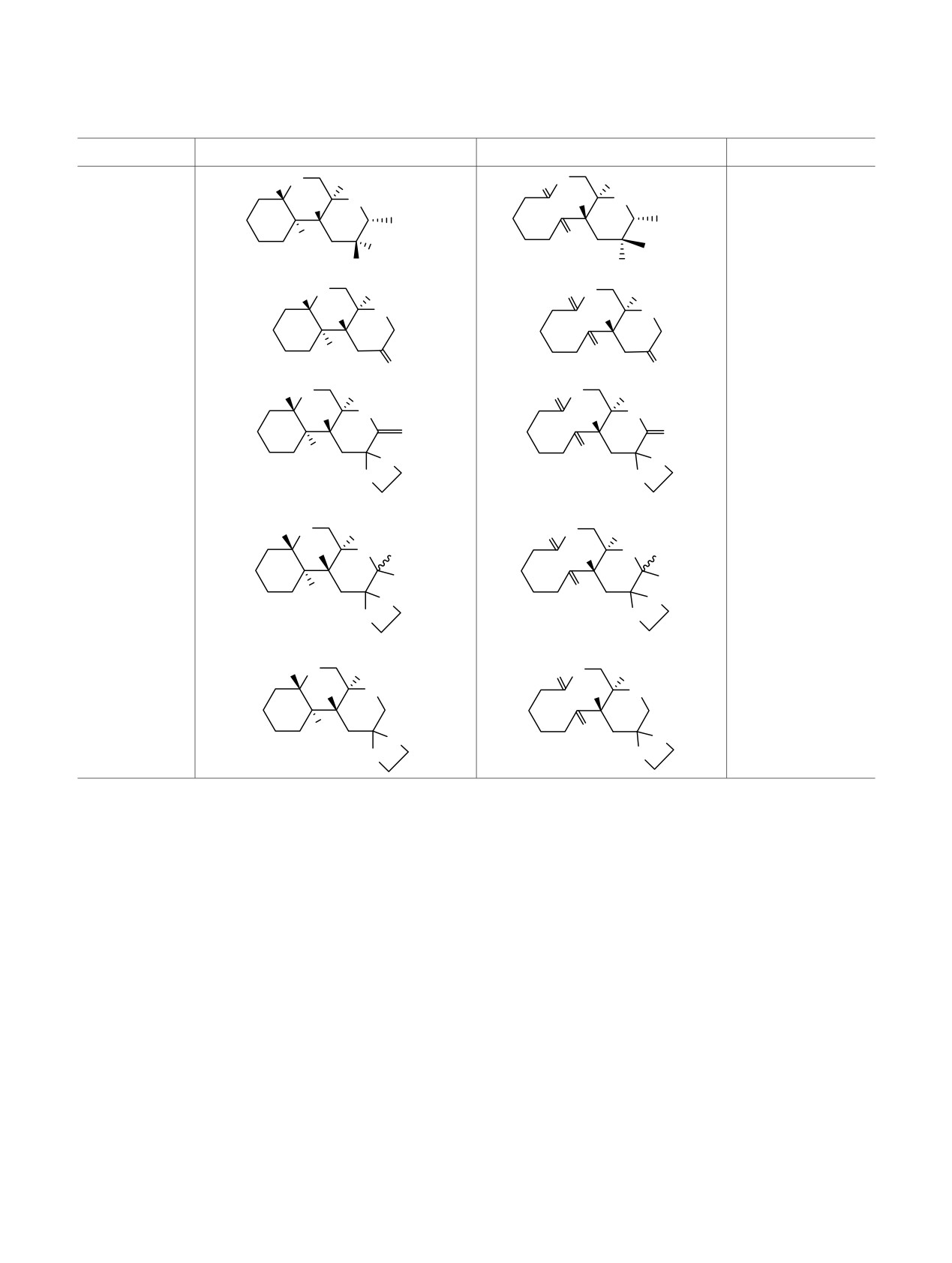
Окисление кеталей в лактоны действием PCC.
№
Кеталь
Лактон
Выход, %
O
H
O
H
MeO
O
H
O
O
H
1a
OMe
OMe
42
H
O
OMe
OMe
OMe
OMe
O
H
O
O
H
HO
H
O
H
O
2b
-
H
O
O
O
MeO O
H
O
O
H
H O
H
O
O
O
3
-
H
O
O
O
O
O
5
6
MeO O
H
O
O
H
H O
Me
H
O
Me
OH
OH
4
78
H
O
O
O
O
O
10а, b
11а, b
MeO O
H
O
O
H
H O
H
O
5b
65
H
O
O
O
O
O
а
[1].
b
[15].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
MeCN-Н2О ИК спектры сняты на приборах
Shimadzu IR Prestige-21 (Япония) или Bruker Tensor
27 (Германия) (в пленке или в вазелиновом масле).
Спектры ЯМР 1Н и 13С записывали на спект-
Для аналитической ТСХ применяли пластины
рометре Bruker AM-300 (Германия) с рабочими
Sorbfil марки ПТСХ-АФ-А, изготовитель ЗАО
частотами 300 (1Н) и 75.47 МГц (13С) соответст-
«Сорбполимер» (г. Краснодар). Температуры плав-
венно и спектрометре Bruker Avance III (Германия),
ления измеряли на приборе Boëtius РНМК
05
500 МГц, растворитель CDCl3, использование других
(Германия). Элементный анализ проводили на
растворителей указано в каждом конкретном
СНNS(O)-анализаторе Евро-3000 (Италия). Углы
случае. Масс-спектры зарегистрированы на ВЭЖХ
оптического вращения измеряли на поляриметре
масс-спектрометре LCMS-2010 EV Shimadzu
Perkin Elmer-341 (США).
(Япония) с одним квадруполем в режиме регист-
рации положительных и отрицательных ионов при
Реактивы PCC (98%), PDC (99%), CSA (99%), п-
потенциале капилляра 4.5 и -3.5 кВ соответст-
TsOH (99%) были приобретены в Sigma Aldrich,
венно, ионизация электрораспылением, элюент -
TBSCl
(98%)
- ABCR. Очистку растворителей
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
1838
ФАЙЗУЛЛИНА и др.
проводили по известным методикам [16-18], и они
96.46 [92.85] (C3), 97.93 [98.10] (C6a),105.39 [105.80]
имели константы, соответствующие литературным
(C2). Масс-спектр, m/z: 301 [M + H]+. Найдено, %: С
данным [16-18].
59.95, H 7.97. С15Н24О6. Вычислено, %: С 59.98, Н
8.05. Мвыч 300.35.
6а'-Метоксидекагидро-1'H-спиро([1,3]диоксо-
лан-2,2'-пирано[2,3-c]хромен)-3'-ол (4а, b). К раст-
(4a'S,6a'S,10a'R,10b'R)-6a'-Метоксиоктагид-
вору 880 мг (2.27 ммоль) бидиоксаланов 2а, b в
ро-1'H-спиро([1,3]диоксолан-2,2'-пиран[2,3-c]-
10.0 мл Ас2О при перемешивании и охлаждении
хромен)-3'(10b'H)-он (5). а. К раствору 38.94 мл
добавили 380 мг (2.27 ммоль) ZnCl2 и перемеши-
СН2Cl2 и 2.02 мл пиридина в атмосфере Ar добав-
вали до исчезновения исходного (контроль мето-
ляли 1.515 г (14.9 ммоль) CrO3 и перемешивали
дом ТСХ). Затем реакционную массу выливали в
20 мин. Затем к полученной реакционной массе
ледяной раствор 15.0 мл насыщенного водного
добавляли 0.330 г (1.15 ммоль) спирта 4а, b и пере-
раствора NaHCO3, продукты реакции экстрагиро-
мешивали 7 мин (контроль методом ТСХ). Реак-
вали этилацетатом (3×15 мл). Экстракт сушили
ционную смесь обрабатывали насыщенным водным
MgSO4, растворитель отогоняли, остаток хроматог-
раствором NaHCO3, продукты реакции экстрагиро-
рафировали на SiO2. Выход 830 мг (71%), кара-
вали эфиром (3×10 мл). Экстракт сушили MgSO4,
мель, Rf 0.8 (петролейный эфир-этилацетат, 1:1).
растворитель упаривали, остаток хроматографиро-
ИК спектр, νmax, см-1: 3378, 2940, 2867, 1735, 1706,
вали на колонке с силикагелем. Выход 0.232 г (71%).
1374, 1234, 1123, 1097, 1038, 951, 908.
б. К раствору 76 мг (0.25 ммоль) лактола 4а, b в
Раствор 830 мг (21.10 ммоль) диацетатов 3a, b и
5.0 мл CH2Cl2 при тщательном перемешивании не-
1 г КОН в 2.2 мл H2O и 6.7 мл C2H5OH пере-
большими порциями добавляли 190 мг (0.5 ммоль)
мешивали 30 мин (контроль методом ТСХ). Смесь
РDС. Через 48 ч (контроль по ТСХ) в реакционную
нейтрализовали 10%-ным раствором HCl до pH 7,
массу добавляли 5.0 мл Et2O, отфильтровывали
экстрагировали EtOAc (3×10.0 мл), объединенные
осадок, фильтрат упаривали, остаток хроматогра-
органические слои промывали насыщенным
фировали на SiO2. Выход 65 мг (87%).
раствором NaCl, сушили MgSO4, концентрировали,
в. К раствору 130 мг (0.43 ммоль) лактола 4a, b
сырую смесь 0.60 г растворяли в 5 мл абсолютного
в 7.0 мл CH2Cl2 при тщательном перемешивании не-
метанола и добавляли каталитическое количество
большими порциями добавляли 186 мг (0.86 ммоль)
TsOH. По окончании реакции (контроль ТСХ)
РCС. Через 48 ч (контроль по ТСХ) в реакционную
растворитель отгоняли, остаток хроматографиро-
массу добавляли 8.0 мл Et2O, отфильтровывали
вали. Выход 420 мг (73%) в виде смеси 2 диастерео-
осадок, фильтрат упаривали, остаток хроматогра-
меров в соотношении
1:1. Кристаллическое
фировали на SiO2. Выход 90 г (70%), белые крис-
вещество, т.пл. 252°С. Rf 0.17 (петролейный эфир-
20
таллы, т.пл. 81°С, [α]
+123.8° (c 1.0, CHCl3), Rf
этилацетат, 1:1). ИК спектр, νmax, см-1: 3357, 2932,
0.5 (петролейный эфир-EtOAc, 1:1). ИК спектр,
2887, 1086, 1050, 990, 869, 649. Спектр ЯМР 1Н
νmax, см-1: 3405, 2964, 1753, 1464, 1245, 1120, 1063,
(CDCl3), δ, м.д.: 1.06-1.29 м (6Н, Н1В, Н10b, Н7В, Н8В,
665. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.15-1.34 м
Н9В, Н10В) [5Н, Н10b, Н7В, Н8В, Н9В, Н10В], 1.51-1.72 м
(5Н, Н10b, Н7В, Н8В, Н9В, Н10В), 1.55-1.62 м (2Н, Н8А,
(4Н, Н7А, Н8А, Н9А, Н10А) [5Н, Н1В, Н7А, Н8А, Н9А,
Н9А), 1.71-1.76 м (2Н, Н1А, Н10A), 2.02 м (1Н, Н7А),
Н10А], 1.87-2.02 м (2Н, Н1А, Н10а) [2Н, Н1А, Н10а],
2.18-2.24 м (2Н, Н1В, Н10а), 3.13 с (3Н, СН3), 3.54 т
3.01 с (3Н, СН3) [3.18 с (3Н, СН3)], 3.27 д.т (1Н, H4a,
(1Н, H5А, 2J5А,5В 10.6, 3J5А,4а 10.6 Гц), 3.75 д.д (1Н,
3J4a,5А 5.2, 3J4a,5В 10.3, 3J4a,10b 10.3 Гц) [3.68 д.т (1Н,
H5В, 2J5В,5А
10.6, 3J5В,4а 5.3 Гц), 4.05-4.08 м (2Н,
H4a, 3J4a,5А 5.1, 3J4a,5В 10.2, 3J4a,10b 10.3 Гц)], 3.52 т
СН2О), 4.05-4.08 м (2Н, СН2О), 4.18-4.23 м (3Н,
(1Н, H5А, 2J5А,5В 10.3, 3J5А,4а 10.3 Гц) [3.53 т (1Н, H5A,
СН2О, Н4а). Спектр ЯМР 13С (CDCl3), δ, м.д.: 22.23
2J5А,5В 10.3, 3J5А,4а 10.3 Гц], 3.65 д.д (1Н, H5В, 2J5В,5А
(C9), 24.87 (C8), 25.24 (C10), 31.04 (C7), 34.49 (C10a),
10.3, 3J5В,4а 5.2 Гц) [3.60 д.д (1Н, H5В, 3J5В,5А 10.3,
35.81 (C1), 46.77 (OCH3), 47.65 (C10b), 61.30 (C5),
3J5В,4а 5.2 Гц)], 3.94-4.12 м (8Н, СН2О), 4.78 с (1Н,
65.48 (ОСН2), 66.09 (ОСН2), 76.82 (C4a), 97.88(C6a),
Н3) [4.62 с (1Н, Н3)]. Спектр ЯМР 13С (CDCl3), δ,
102.73 (C2), 168.06 (C3). Масс-спектр, m/z: 299 [M +
м.д.: 22.26 [22.43] (C9), 24.75 [24.37] (C8),
25.34
H]+. Найдено, %: С 60.11, H 7.37. С15Н22О6. Вычис-
[25.31] (C10), 31.23 [31.29] (C7), 35.83 [35.85] (C10a),
лено, %: С 60.39, Н 7.43. Мвыч 298.33.
35.73
[30.86] (C1),
46.55
[46.63] (OCH3),
47.03
[47.19] (C10b),
62.13
[62.58] (C5),
65.11
[65.26]
трет-Бутил{(4a'S,6a'S,10a'R,10b'R)-6a'-метокси-
(ОСН2), 66.05 [65.60] (ОСН2), 74.96 [67.94] (C4a),
декагидро-1'H-спиро([1,3]диоксолан-2,2'-пирано-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
СИНТЕЗ НОНАНО-9-ЛАКТОНА, АННЕЛИРОВАННОГО С δ-ЛАКТОННЫМ ЦИКЛОМ
1839
[2,3-c]хромен)-3'-илокси}диметилсилан
(7а, b).
(8а, b). К раствору 168 мг (0.4 ммоль) TBS-эфиров
Раствор 150 мг (0.5 ммоль) спирта 4а, b, 150 мг
7a, b в 5.0 мл CH2Cl2 при тщательном перемеши-
(1.0 ммоль) TBSCl и 68 мг (1.0 ммоль) имидазола в
вании небольшими порциями добавляли 261 мг
15.0 мл CH2Cl2 перемешивали при комнатной тем-
(1.2 ммоль) РСС. Через 48 ч (контроль по ТСХ) в
пературе. После исчезновения исходного соеди-
реакционную массу добавляли 5.0 мл Et2O, отфиль-
нения (контроль по ТСХ) реакционную массу раз-
тровывали осадок, фильтрат упаривали, остаток
бавляли водой (20.0 мл), затем экстрагировали
хроматографировали на SiO2. Выход 129 мг (65%)
CH2Cl2 (3×30.0 мл), экстракт сушили MgSO4. Раст-
лактонов 8а, b. Бесцветное маслообразное вещест-
воритель отгоняли, остаток хроматографировали
во, Rf 0.42 (петролейный эфир-EtOAc, 1:1).
на SiO2. Выход
206 мг
(99%). Маслообразное
Эпимер 8a. Спектр ЯМР 1Н (CDCl3), δ, м.д.:
вещество, Rf 0.45 (петролейный эфир-EtOAc, 1:1).
0.09 с (3Н, CH3Si), 0.10 с (3Н, CH3Si), 0.92 с (9Н,
Эпимер 7a. Спектр ЯМР 1Н (CDCl3), δ, м.д.:
(CH3)3C), 1.42-1.48 м (1Н, Н7В), 1.52-1.58 м (1Н,
0.10 с (3Н, CH3Si), 0.12 с (3Н, CH3Si) 0.92 с [9Н,
Н8В), 1.72 д.д (1Н, Н4B, 2J4B,4A 13.7, 3J4B,4a 3.9 Гц),
(CH3)3C], 1.13-1.24 м (3Н, Н10b, Н7В, Н8В) 1.27 т (1Н,
1.82-1.90 м (1Н, Н8A), 2.01-2.08 м (1Н, Н4А, H7А),
H1В, 2J1В,1А 13.0, 3J1В,10b 12.8 Гц), 1.48-1.52 м (1Н,
2.23-2.34 м (2Н, Н6B, Н9В), 2.42-2.53 м (2Н, Н6А,
Н10В), 1.54-1.59 м (2Н, Н9В, Н8А), 1.62-1.67 м (2Н,
Н9А), 2.82 д.д.д.д
(1Н, H4а, 3J4а,12а
5.9, 3J4а,4В
3.9,
Н9А, Н10А), 1.71-1.75 м (1Н, Н7А), 1.89 д.д (1Н, H1А,
3J4а,4А
9.8 Гц), 3.92-4.06 м (5Н, Н12В, Н12а, СН2О),
2J1А,1В 13.0 Гц, 3J1А,10b 3.8 Гц), 2.04 д.д.д.д (1Н, H10a,
4.18-4.20 м (1Н, СН2О), 4.42 т (1Н, H12А, 2J12А,12В
3J10a,10В 12.9, 3J10a,10А 2.8 Гц), 3.25 д.т (1Н, H4a, 3J4a,5А
10.7, 3J12А,12а 10.7 Гц), 4.68 с (1Н, H2). Спектр ЯМР
5.1, 3J4a,5В 10.3, 3J4a,10b 10.3 Гц), 3.67 д.д (1Н, H5В,
13С (CDCl3), δ, м.д.: -5.28 (CH3Si), -4.32 (CH3Si),
2J5В,5А
10.5, 3J5В,4а 5.2 Гц), 3.94-4.09 м (4Н, Н5А,
17.99 [(CH3)3C], 20.38 (C8), 22.47 (C7), 25.58, 25.65,
СН2О), 4.20-4.23 м (1Н, СН2О), 4.63 с (1Н, Н3).
25.70 [(CH3)3C], 34.07 (C9), 35.83 (C4), 41.09 (C6),
Спектр ЯМР 13С (CDCl3), δ, м.д.: -4.16 (CH3Si), -
52.75 (C4a), 64.39 (C12), 65.74 (ОСН2), 67.06 (ОСН2),
4.20 (CH3Si), 18.04 [(CH3)3C], 22.87 (C9), 24.98 (C8),
75.12 (C12a), 97.94 (C2), 104.37 (C3), 172.23 (C10),
25.46 (C7), 25.72 [(CH3)3C], 36.40 (C10a), 36.67 (C1),
207.96 (C5).
38.58 (C10), 46.45 (C10b), 62.30 (C5), 65.71 (ОСН2),
Эпимер 8b. ИК спектр, νmax, см-1: 2956, 2857,
67.06 (ОСН2), 75.35 (C4a), 95.81 (C6а), 98.61 (C3),
1740, 1706, 1472, 1252, 1249, 1193, 1068, 841, 782,
105.73 (C2).
756. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.11 с (3Н,
Эпимер 7b. ИК спектр, νmax, см-1: 3457, 2954,
CH3Si), 0.13 с (3Н, CH3Si), 0.90 с [9Н, (CH3)3C],
1715, 1472, 1252, 1075, 838,780, 665. Спектр ЯМР
1.52 д.д (1Н, Н4B, 2J4B,4A 13.6, 3J4B,4a 3.9 Гц), 1.56-
1Н (CDCl3), δ, м.д.: 0.05 с (3Н, CH3Si), 0.07 с (3Н,
1.62 м (2Н, Н7В, Н8В), 1.68 т (1Н, Н4А, 2J4А,4В 13.6,
CH3Si), 0.84 с [9Н, (CH3)3C], 1.46-1.50 м (2Н, Н1В,
3J4А,4a
13.6 Гц), 1.92-1.95 м (1Н, Н7А), 2.08-2.11 м
Н7В), 1.60-1.63 м (2Н, Н8В, Н9В), 1.82-1.93 м (2Н,
(1Н, Н8A), 2.26-2.36 м (2Н, Н9В, H6В), 2.44-2.55 м
Н1A, Н9A), 2.01-2.05 м (2Н, Н7A, Н8A), 2.18-2.23 м
(2Н, Н9А, Н6А), 2.85-2.89 м (1Н, Н4а), 3.51 т.д (1Н,
(1Н, Н10В), 2.39-2.41 м (1Н, Н10A), 2.52-2.58 м (1Н,
H12а, 3J12а,4а 10.6, 3J12а,12А 10.6, 3J12а, 12А 5.6 Гц), 3.65
Н10а), 2.72-2.77 м (1Н, Н10b), 3.38 д.т (1Н, H4a, 3J4a,5А
д.д (1Н, Н12В, 2J12В,12А 10.6, 3J12В,12а 5.6 Гц), 3.93-4.22
5.4, 3J4a,5В
10.2, 3J4a,10b
10.2 Гц), 3.69 м (1Н, H5В),
м (5Н, Н12А, СН2О), 4.54 с (1Н, H2). Спектр ЯМР 13С
3.92-4.10 м (4Н, Н5А, СН2О), 4.20-4.23 м (1Н,
(CDCl3), δ, м.д.: -5.33 (CH3Si), -4.22 (CH3Si), 18.08
СН2О), 4.52 с (1Н, Н3). Спектр ЯМР 13С (CDCl3), δ,
[(CH3)3C], 20.31 (C8), 23.29 (C7), 25.70 [(CH3)3C],
м.д.: -3.59 (CH3Si), -2.96 (CH3Si), 18.29 [(CH3)3C],
34.05 (C9), 35.84 (C4), 42.47 (C6), 52.81 (C4a), 62.57
22.96 (C9), 25.74 [(CH3)3C], 27.09 (C8), 27.91 (C7),
(C12), 65.64 (ОСН2), 66.97 (ОСН2), 69.87 (C12a),
34.52 (C1), 36.59 (C10a), 42.29 (C10), 49.09 (C10b),
98.59 (C2), 106.12 (C3), 172.42 (C10), 207.85 (C5).
65.53 (C5), 66.20 (ОСН2), 66.93 (ОСН2), 78.25 (C4a),
Масс-спектр, m/z: 415 [M + H]+. Найдено, %: С
98.36 (C3), 98.59 (C6а), 105.44 (C2). Масс-спектр, m/
57.85, H 8.21. С20Н34О7Si. Вычислено, %: С 57.94, Н
z: 415 [M + H]+. Найдено, %: С 60.71, H 9.19.
8.27. Мвыч 414.57.
С21Н38О6Si. Вычислено, %: С 60.83, Н 9.24. Мвыч
(4a'S,12a'S)-2'-Гидроксигексагидро-2'H-спиро-
414.24.
([1,3]диоксолан-2,3'-пирано[2,3-c]оксецин)-
(4a'S,12a'S)-2'-(трет-Бутилдиметилсилил-
5',10'(12'H,12a'H)-дион (9a, b). К раствору 105 мг
окси)гексагидро-2'H-спиро([1,3]диоксолан-2,3'-
(0.25 ммоль) TBS-эфиров 8а, b в 5.0 мл MeOH
пирано[2,3-c]оксецин)-5',10'(12'H,12a'H)-дион
добавляли каталитические количества CSA. Через
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
1840
ФАЙЗУЛЛИНА и др.
24 ч (контроль по ТСХ) в реакционную массу
фильтрат упаривали, остаток хроматографировали
добавляли воду и экстрагировали EtOAc (3×20 мл),
на SiO2. Выход 38 мг (26%), белые кристаллы, т.пл.
20
экстракт сушили MgSO4. Растворитель упаривали,
156°С, [α]
-30.1° (c 0.86, CHCl3), Rf 0.3 (петро-
остаток хроматографировали на SiO2. Выход 70 мг
лейный эфир-EtOAc, 1:1). ИК спектр, νmax, см-1:
(92%) лактолов 9а, b, белые кристаллы, т.пл. 268°С,
2964, 1737, 1420, 1284, 1229, 1114, 1036, 958, 742.
Rf 0.1 (петролейный эфир-EtOAc, 1:1). ИК спектр,
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.48-1.52 м (1Н,
νmax, см-1: 3430, 2931, 1734, 1707, 1441, 1248, 1163,
Н8В), 1.60-1.64 м (1Н, Н7В), 1.89-1.91 м (1Н, Н8А),
1047, 952, 632. Спектр ЯМР 1Н (CDCl3), δ, м.д.:
2.04 д.д.
(1Н, H9В, 2J9В,9А
14.2, 3J9В,8А
4.4, 3J9В,8В
1.45-1.54 м (2Н, Н7В [Н7В]), 1.57-1.62 м (3Н, Н8В,
9.8 Гц), 2.09-2.17 м (1Н, Н7А), 2.29 д.д.д.д (1Н, H4В,
[Н8В, Н4В]), 1.79-1.89 м (3Н, Н4B, [Н7A, Н7A]), 2.02-
2J4В,4А 11.6, 3J4В,4а 2.4 Гц), 2.45 м (2Н, Н9А, Н6В), 2.51
2.09 м (1Н, Н4A, [Н8A, Н8A]), 2.23-2.37 м (5Н, Н9B,
д.д.д.д. (1Н, H4А, 2J4А,4В 11.6, 3J4А,4а 7.5 Гц), 2.62 м
H6B, [Н9B, Н6В, Н4A]), 2.44-2.54 м (4Н, Н9A, Н6A, [Н9A,
(1Н, Н6А), 3.14 д.д.д.д (1Н, H4а, 3J4а,12а 4.6, 3J4а,4В
Н6A]), 2.78 д.д.д.д (1Н, H4а, 3J4а,12а
6.4, 3J4а,4В
3.9,
7.5 Гц), 4.05-4.14 м (4Н, СН2О, Н12В), 4.37 м (1Н,
3J4а,4А
10.3 Гц) [2.85 д.д.д.д
(1Н, H4а, 3J4а,12а
5.8,
СН2О), 4.52 т (1Н, H12A, 2J12А,12В 10.9, 3J12А,4а 10.8 Гц),
3J4а,4В
4.1, 3J4а,4А 9.9 Гц)], 3.34 c (1H, OH) [3.34 д
4.78 д.д.д (1Н, H12а, 3J12а,4а 4.6, 3J12а,12А 10.8, 3J12а,12В
(1Н, ОН, 3J2,ОН 6.7 Гц)], 3.93-4.09 м
(7Н, Н12а,
4.6 Гц). Спектр ЯМР 13С (CDCl3), δ, м.д.: 20.25 (C8),
СН2О) [4.47 д.д.д (1Н, H12а, 2J12а,12А 10.6, 3J12а,12В
22.52 (C7), 33.92 (C4), 34.55 (C9), 41.09 (C6), 50.14
4.4 Гц)], 4.14-4.18 м (3Н, H12В, [H12А], СН2О), 4.39
(C4a), 63.55 (C12), 65.49 (ОСН2), 66.82 (ОСН2), 78.46
т.т (1Н, H12А, 2J12А,12В 10.7, 3J12А,12а 10.7 Гц), 4.80 с
(C12a), 100.96 (C2), 166.29 (C10), 171.95 (C2), 205.81
(1Н, H2) [4.73 д (1Н, Н2, 3JОН,2 6.7 Гц)]. Спектр ЯМР
(C5). Масс-спектр, m/z: 299 [M + H]+. Найдено, %: С
13С (CDCl3), δ, м.д.: 20.26 [20.26] (C8), 22.51 [22.45]
56.29, H 6.00. С14Н18О7. Вычислено, %: С 56.37, Н
(C7), 34.06 [34.09] (C9), 35.02 [30.21] (C4),
41.86
6.08. Мвыч 298.29.
[40.10] (C6), 52.86 [52.54] (C4a), 64.35 [64.88] (C12),
(4a'S,6a'S,10a'R,10b'R)-6a'-Метокси-3'-метил-
65.30 [65.41] (ОСН2), 65.71 [66.23] (ОСН2), 74.95
декагидро-1'H-спиро([1,3]диоксолан-2,2'-пирано-
[67.55] (C12a),
95.96
[92.23] (C2),
104.04
[104.61]
[2,3-c]хромен)-3'-ол (10а, b). К раствору 200 мг
(C3),
172.57
[172.42] (C10),
207.81
[207.69] (C5).
(0.7 ммоль) лактона 5 в 3.0 мл Et2O при переме-
Масс-спектр, m/z: 301 [M + H]+. Найдено, %: С
шивании добавляли 0.3 мл (0.7 ммоль) MeMgI.
55.94, H 6.68. С14Н20О7. Вычислено, %: С 55.99, Н
Через 15 мин (контроль по ТСХ) в реакционную
6.71. Мвыч 300.30.
массу добавляли 1.0 мл насыщенного водного раст-
(4a'S,12a'S)-Гексагидро-2'H-спиро([1,3]ди-
вора NH4Cl, продукты реакции экстрагировали этил-
оксолан-2,3'-пирано[2,3-c]оксицеин)-2',5',10'-
ацетатом (2×5.0 мл). Экстракт сушили MgSO4,
(12'H,12a'H)-трион (6). а. Раствор 83 мг (0.27 ммоль)
растворитель отогоняли, остаток хроматографиро-
спирта 9а, b и 118 мг (1.1 ммоль) РСС в CH2Cl2
вали на колонке с силикагелем. Выход 145 мг
кипятили в течение 3 ч. После исчезновения исход-
(69%) эпимерных спиртов 10а, b в соотношении
ного спирта (контроль по ТСХ) реакционную
1:1. Масло, Rf 0.33 (петролейный эфир-EtOAc, 1:1).
массу охлаждали, добавляли 5.0 мл Et2O, отфильт-
ИК спектр, νmax, см-1: 3338, 3082, 2984, 2468, 1309,
ровывали осадок, фильтрат упаривали, остаток
1043, 991, 1170, 936, 700. Спектр ЯМР 1Н (CDCl3),
хроматографировали на SiO2. Выход 60 мг (72%).
δ, м.д.: 1.10-1.32 м (6H, Н1B, Н7B, Н8B, Н9B, Н10B,
Н10b) [1.10-1.32 м (5H, Н7B, Н8B, Н9B, Н10B, Н10b)],
б. К раствору 40 мг (0.13 ммоль) лактола 9а, b в
1.49-1.59 м (2Н, Н8А, Н9A) [1.49-1.59 м (3Н, Н1B,
5.0 мл CH2Cl2 при тщательном перемешивании не-
Н8А, Н9A)], 1.68-1.71 м (2Н, Н7А, Н10A) [1.68-1.71 м
большими порциями добавляли 20 мг (0.53 ммоль)
(2Н, Н7А, Н10A)], 1.89-2.07 м (2Н, Н1А, Н10a) [1.89-
РDС. Через 48 ч (контроль по ТСХ) в реакционную
2.07 м (2Н, Н1А, Н10a)], 3.11 с (3Н, ОСН3) [3.12 с
массу добавляли 5.0 мл Et2O, отфильтровывали
(3Н, ОСН3)], 3.29 д.т (1H, H4а, 3J4а,10b 10.3, 3J4а,5B
осадок, фильтрат упаривали, остаток хроматогра-
10.3, 3J4а,5A 5.2 Гц) [3.81 д.т (1H, H4а, 3J4а,10b 10.3,
фировали на SiO2. Выход 10 мг (20%).
3J4а,5B
10.3, 3J4а,5A
5.2 Гц)], 3.52 т (1Н, Н5B, 2J5B,5A
в. Раствор 148 мг (0.49 ммоль) спирта 4а, b и
10.3, 3J5B,4а
10.3 Гц) [3.53 т (1Н, Н5B, 2J5B,5A 10.3,
424 мг (1.9 ммоль) РСС в 3.0 мл CH2Cl2 кипятили в
3J5B,4а 10.3 Гц)], 3.68 д.д (1Н, Н5A, 2J5A,5B 10.3, 3J5A,4а
течение 12 ч. После исчезновения исходного спирта
5.2 Гц) [3.62 д.д (1Н, Н5A, 2J5A,5B 10.3, 3J5A,4а 5.2 Гц)],
(контроль по ТСХ) реакционную массу охлаждали,
3.94-4.03 м (4Н, СН2О) [3.97-4.17 м (4Н, СН2О)],
добавляли 5.0 мл Et2O, отфильтровывали осадок,
4.62 c (1Н, Н3) [4.79 c (1Н, Н3)]. Спектр ЯМР 13С, δ,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
СИНТЕЗ НОНАНО-9-ЛАКТОНА, АННЕЛИРОВАННОГО С δ-ЛАКТОННЫМ ЦИКЛОМ
1841
м.д.: 22.25 [25.26] (C9), 24.74 [24.37] (C8),
25.34
ФОНДОВАЯ ПОДДЕРЖКА
[25.31] (C10), 31.29 [31.23] (C7), 35.73 [30.86] (C1),
35.83
[35.85] (C10a),
46.55
[46.63] (ОCH3),
47.03
Работа выполнена по теме
№ АААА-А17-
[47.19] (C10b),
62.13
[62.58] (C5),
65.11
[65.26]
117011910022-5 госзадания и финансовой под-
(CH2O), 65.60 [66.06] (CH2O), 74.96 [67.94] (C4a),
держке гранта Российского фонда фундаменталь-
96.46
[92.85] (C3),
97.93
[98.10] (C6a),
105.39
ных исследований (проект № 17-43-020166-р_а).
[105.80] (C2). Масс-спектр, m/z:
315
[M + H]+.
Найдено, %: С 61.09, H 8.27. С16Н26О6. Вычислено,
КОНФЛИКТ ИНТЕРЕСОВ
%: С 61.13, Н 8.34. Мвыч 314.37.
Авторы заявляют об отсутствии конфликта
(4a'S,12a'S)-2'-Гидрокси-2'-метилгексагидро-
интересов.
2'H-спиро([1,3]диоксолан-2,3'-пирано[2,3-c]оксе-
цин)-5',10'(12'H,12a'H)-дион (11а, b). К раствору
СПИСОК ЛИТЕРАТУРЫ
100 мг (0.30 ммоль) лактолов 10а, b в 5.0 мл CH2Cl2
при тщательном перемешивании небольшими пор-
1. Халилова Ю.А., Спирихин Л.В., Салихов Ш.М.,
циями добавляли 140 мг (0.60 ммоль) РСС. Через
Валеев Ф.А. ЖОрХ. 2014, 50, 117. [Khalilova Yu.A.,
48 ч (контроль по ТСХ) в реакционную массу
Spirikhin L.V., Salikhov Sh.M., Valeev F.A. Russ.
добавляли 5.0 мл Et2O, отфильтровывали осадок,
J. Org. Chem.
2014,
50,
125.] doi
10.1134/
фильтрат упаривали, остаток хроматографировали
S1070428014010229
на SiO2. Выход 81 мг (78%) лактонов 11а, b. Белые
2. Тагиров А.Р., Файзуллина Л.Х., Салихов Ш.М.,
кристаллы, т.пл. 106°С, Rf 0.22 (петролейный эфир-
Валеев Ф.А. Бутлеровские сообщ. 2014, 39, 48.
EtOAc, 1:1). ИК спектр, νmax, см-1: 3487, 2954, 2854,
3. Файзуллина Л.Х., Халилова Я.А., Салихов Ш.М.,
1735, 1706, 1457, 1378, 1249, 1170, 1049, 912, 768,
Валеев Ф.А. ЖОрХ. 2018, 54, 598. [Faizullina L.Kh.,
Khalilova Y.A., Salikhov Sh.M., Valeev F.A. Chem.
721. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.35 с (СН3)
Heterocycl. Compd.
2018,
54,
598.] doi
10.1007/
[1.53 с (СН3)], 1.54-1.62 м {(4Н, Н7В, Н8В), [Н7В,
s10593-018-2314-y
Н8В]}, 1.59 д.д (1Н, H4В, 2J4В,4А 13.1, 3J4В,4а 3.8 Гц)
4. Fraga B.M. Natural Product Rep. 1994, 11, 533. doi
[1.73 д.д (1Н, H4В, 2J4В,4А 13.0, 3J4В,4а 3.7 Гц)], 1.82-
10.1039/np9941100533
1.88 м {(2Н, Н8А) [Н8А]}, 1.93-2.01 м {(2Н, Н7А)
5. Collins I. J. Chem. Soc., Perkin Trans. 1. 1999, 1377.
[Н7А]}, 2.23-2.30 м {(2Н, Н9В), [Н9В]}, [2.15 д.д (1Н,
doi 10.1039/A808137I
H4А, 2J4А,4В 13.0, 3J4А,4а 13.8 Гц)], 2.23-2.52 м {7Н,
6. Blay G., Cardona M.L., Garcia B., Pedro J.R. J. Org.
Н6А, Н6В, Н4А, Н9А) [Н6А, Н6В, Н9А]}, 2.82 д.д.д (1Н,
Chem. 1991, 56, 6172. doi 10.1021/jo00021a040
H4a, 3J4a,12а 10.5, 3J4a,4А 13.8, 3J4a,4В 3.8 Гц) [2.78 д.д.д
7. Blay G., Cardona M.L., Garcia B., Pedro J.R.
(1Н, H4a, 3J4a,12а
10.3, 3J4a,4А
13.7, 3J4a,4В 3.7 Гц)],
Tetrahedron. 1989, 45, 5925. doi 10.1016/S0040-4020
3.96-4.04 м (10Н, СН2О, Н12В)[СН2О, Н12В], 4.07-
(01)89119-5
4.13 м (3Н, Н12А )[Н12А, Н12а], 4.30 т
(1Н, H12А,
8. Patel R.M, Puranik V.G., Argade N.P. Org. Biomol.
2J12А,12В
10.6, 3J12А,12а 10.6 Гц) [4.39 т
(1Н, H12А,
Chem. 2011, 9, 6312. doi 10.1039/C1OB05709J
2J12А,12В
10.5, 3J12А,12а
10.5 Гц], 4.48 д.т (1Н, H12a,
9. Girard A., Greck Ch., Geneˆt J.P. Tetrahedron Lett.
3J12a,12А
10.6, 3J12a,12В
4.4, 3J12a,4а 10.5 Гц). Спектр
1998, 39, 4259. doi 10.1016/S0040-4039(98)00697-2
ЯМР 13С (CDCl3), δ, м.д.: 20.26 [20.31] (C8), 22.00
10. Mehl F., Bombarda I., Vanthuyne N., Faure R.,
[18.19] (CH3), 22.49 [22.53] (C7), 31.25 [33.33] (C4),
Gaydou E.M. Food Chem. 2010, 121, 98. doi 10.1016/
34.08 [34.13] (C9), 39.95 [40.97] (C6), 53.34 [52.91]
j.foodchem.2009.12.010
(C4a), 65.02 [65.06] (C12), 65.59 [65.80] (ОСН2), 66.01
11. Negishi E., Kotora M. Tetrahedron. 1997, 53, 6707. doi
[66.02] (ОСН2), 68.86 [73.00] (C12a), 97.50 [98.50]
10.1016/S0040-4020(97)00199-3
(C2),
106.14
[106.18] (C3),
172.61
[172.60] (C10),
12. Grieco P.A., Nishizawa M., Burke S.D., Marinovic N.
208.00 [208.01] (C5). Масс-спектр, m/z: 315 [M + H]+.
J. Am. Chem. Soc. 1976, 98, 1612. doi 10.1021/ja00422a072
Найдено, %: С 57.29, H 7.10. С15Н22О7. Вычислено,
13. Галимова Ю.С., Тагиров А.Р., Файзуллина Л.Х.,
%: С 57.32, Н 7.05. Мвыч 314.33.
Салихов Ш.М., Валеев Ф.А. ЖОрХ. 2017, 53, 377.
[Galimova Yu.S., Tagirov A.R., Faizullina L.Kh.,
БЛАГОДАРНОСТИ
Salikhov Sh.M., Valeev F.A. Rus. J. Org. Chem. 2017,
53, 374.] doi 10.1134/S1070428017030113
Анализы выполнены на оборудовании ЦКП
14. Borowitz I.J., Williams G.J., Gross L., Rapp R.D.
«Химия» УфИХ УФИЦ РАН г. Уфа.
J. Org. Chem. 1968, 33, 2013. doi 10.1021/jo01269a067
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
1842
ФАЙЗУЛЛИНА и др.
15. Тагиров А.Р., Файзуллина Л.Х., Еникеева Д.Р., Гали-
17. Гордон А., Форд Р. Спутник химика. М.: Мир. 1976,
мова Ю.С., Салихов Ш.М., Валеев Ф.А. ЖОрХ.
541.
2018, 54, 723. [Tagirov A.R., Faizullina L.Kh., Enikee-
18. Riddick J.A., Bunger W.B., Sakano T.K. The
va D.R., Galimova Yu.S., Salikhov Sh.M., Valeev F.A.
Techniques of Chemistry. Organic Solvents. Physi-
Russ. J. Org. Chem. 2018, 54, 723.] doi 10.1134/
cal Properties and Methods of Purification.
S1070428018050093
New York, Chichester, Brisbane, Toronto, Singapore:
16. Вайсберг А., Прооскауэр Э., Риддик Д., Тупс Э.
A Wiley
- Interscience publication.
1986,
Органические растворители. М.: Наука. 1958, 518.
1325.
Synthesis of Nonano-9-lacton Annelated with a δ-Lacton Cycle
L. Kh. Faizullina*, A. R. Tagirov, Sh. M. Salikhov, and F. A. Valeev
Ufa Institute of Chemistry, Ufa Researcher Centre, RAS,
450054, Russia, Republic of Bashkortostan, Ufa, pr. Oktyabrya 69
*e-mail: sinvmet@anrb.ru
Received April 30, 2019; revised October 16, 2019; accepted October 24, 2019
In order to of obtain annelated dilactones in Michael adducts of levoglucosenone and cyclohexanone the
carbohydrate residue was modified into a δ-lactone and its derivatives condensed with an octahydrochroman
bicycle. Subsequent oxidative cleavage of the bridge in the octahydrochromanic fragment by PCC resulted in
nonano-9-lactone, annelated at C6-C7 positions with δ-lactone and δ-methyl lactol. It has been established that
the presence of a carbonyl function in the carbohydrate residue prevents the rupture of the C-C bond.
Keywords: levoglucosenone, Michael adducts, acetals, ketals, lactones, dialactones, C-C bond oxidative
breakdown
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019