ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 12, с. 1857-1869
УДК 547.741 + 543.51 + 543.54
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ:
XX.1 ИССЛЕДОВАНИЕ 5-(ПРОП-2-ИН-1-ИЛСУЛЬФАНИЛ)-
1Н-ПИРРОЛ-2-АМИНОВ МЕТОДАМИ ЭЛЕКТРОННОЙ
И ХИМИЧЕСКОЙ ИОНИЗАЦИИ
© 2019 г. Л. В. Клыба*, Н. А. Недоля, Е. Р. Санжеева, О. А. Тарасова, В. А. Шагун
ФГБУН «Иркутский институт химии им. А.Е. Фаворского СО РАН», 664033, Россия, г. Иркутск, ул. Фаворского 1
*e-mail: klyba@irioch.irk.ru
Поступила в редакцию 23 мая 2019 г.
После доработки 23 октября 2019 г.
Принята к публикации 24 октября 2019 г.
Впервые изучены масс-спектры электронной (70 эВ) и химической (газ-реагент - метан) ионизации 1-
[алкил, 2-(винилокси)этил]-5-(проп-2-ин-1-илсульфанил)-1Н-пиррол-2-аминов. При ионизации электро-
нами исследуемые соединения образуют устойчивые молекулярные ионы, распад которых протекает
преимущественно по направлениям, характерным для распада М+• 7-[алкил, 2-(винилокси)этил]-2,7-
дигидротиопирано[2,3-b]пиррол-6-аминов - продуктов их внутримолекулярной циклизации. В масс-
спектрах присутствуют также пики ионов, образование которых возможно только при распаде
неперегруппированного молекулярного иона. Основное направление фрагментации М+• обеих структур
связано с разрывом связи Nпирр-Сзам и образованием устойчивых ионов [M - R3]+ (Iотн 85-100%) {за
исключением N,N-диэтил- и N,N-дипропил-1-[2-(винилокси)этил]-5-(проп-2-ин-1-илсульфанил)-1Н-пир-
рол-2-аминов}. Квантово-химические расчёты, выполненные с использованием метода B3LYP/6-311+G(d,p),
согласуются с экспериментальными данными. При химической ионизации 5-(проп-2-ин-1-илсульфанил)-
1H-пиррол-2-аминов в масс-спектрах доминируют пики М+• (Iотн 65-100%) и протонированной молекулы
[M + H]+ (Iотн 75-100%). Зарегистрированы масс-спектры химической ионизации 5-(проп-1-ин-1-илсуль-
фанил)-1H-пиррол-2-аминов, образующихся в результате частичной (5-10%) термоиндуцируемой изо-
меризации 5-(проп-2-ин-1-илсульфанил)-1Н-пиррол-2-аминов.
Ключевые слова: 1-[алкил, 2-(винилокси)этил]-5-(проп-2-ин-1-илсульфанил)-1Н-пиррол-2-амины, элек-
тронная и химическая ионизация, масс-спектры, молекулярные ионы, внутримолекулярная циклизация,
изомеризация, фрагментация, квантово-химические расчёты.
DOI: 10.1134/S0514749219120073
Пирролы и их производные - один из наиболее
гетероатомных заместителей (например, сульфа-
востребованных классов гетероциклических соеди-
нил- и аминогрупп) может кардинально изменять
нений, интерес к которым неуклонно растёт [2-6].
физические, химические и биологические свойства
Широкий спектр биологической активности и
как самих пирролов, так и материалов на их основе
разнообразное применение в различных областях
[7-10]. Производные пирроламинов, как известно,
(прежде всего в медицине, фармакологии, мате-
обладают антибактериальной, антивирусной, про-
риаловедении, нелинейной оптике и супрамолеку-
тивосудорожной, противовоспалительной, болеуто-
лярной химии) продолжают стимулировать поиск и
ляющей, жаропонижающей и другими видами био-
разработку новых подходов и удобных общих
логической активности [11, 12] и играют роль клю-
методов синтеза пиррольных структур, и в первую
чевых компонентов для конструирования разно-
очередь, новых полизамещённых пирролов с реак-
образных ДНК-связывающих лигандов, проявляю-
ционноспособными и фармакофорными заместите-
щих антибиотические, противовирусные и онколи-
лями. Доказано, что введение в пиррольное ядро
тические свойства [13-16]. Однако отсутствие эффек-
тивных общих методов их синтеза значительно
1 Сообщение XIX см. [1].
снижает их доступность и ассортимент [17, 18].
1857
1858
КЛЫБА и др.
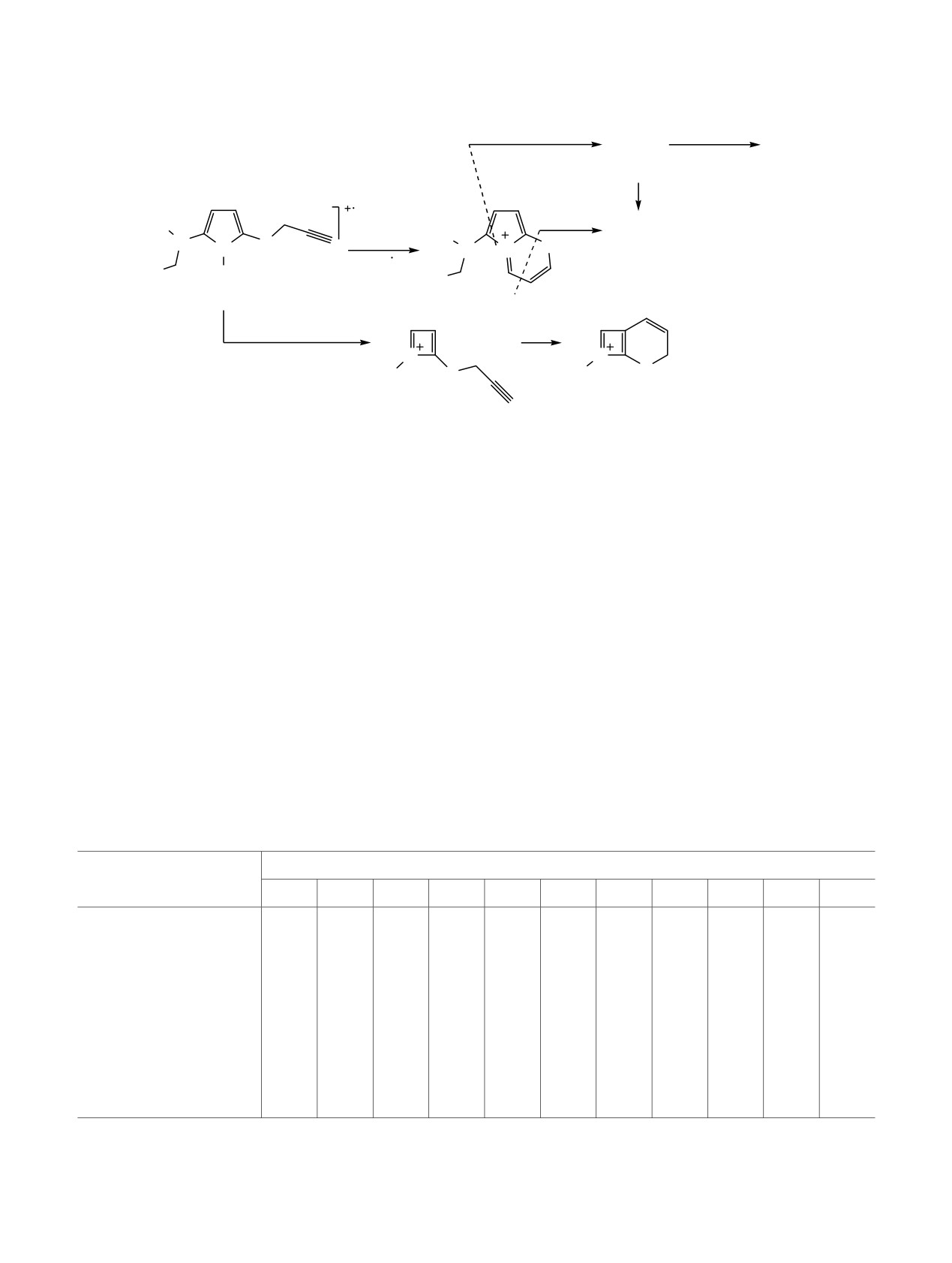
Схема 1.
R1
1. BuLi, ТГФ-гексан
N
R1
N=C=S
2. R3
S
N N
3. t-BuOK-ДМСО
R2
4. HC CCH2Br
R3
R2
1_4
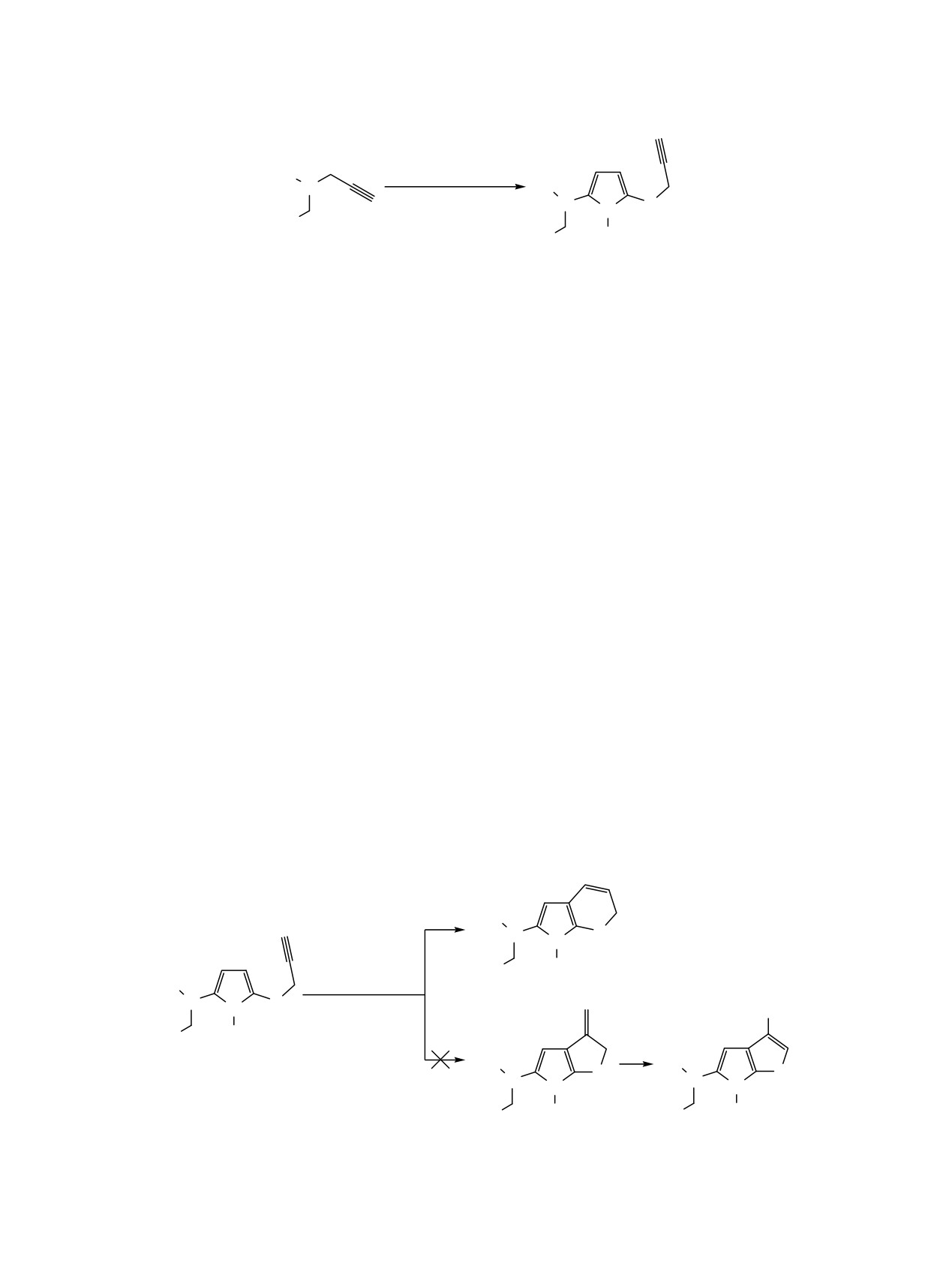
R1 = Me, R2 = H: R3 = Me (1a), Et (1b), i-Pr (1c), n-Bu (1d), s-Bu (1e), CH2=CHOCH2CH2 (1f); R1 = Et, R2 = Me: R3 =
Et (2b), i-Pr (2c), CH2=CHOCH2CH2 (2f); R1 = n-Pr, R2 = Et: R3 = CH2=CHOCH2CH2 (3f); R1-R2 = (CH2)4: R3 =
CH2=CHOCH2CH2 (4f).
Насколько нам известно (кроме наших
В работе в продолжение систематических иссле-
собственных работ [19, 20]), в литературе нет
дований масс-спектров новых классов функциона-
публикаций о пирролах, содержащих как амино-,
лизированных гетероциклов, включая пирролы [31-
так и алкилсульфанильные заместители, и, сле-
35], мы впервые изучили распад молекулярных ионов
довательно, об общих методах их синтеза.
1-[алкил, 2-(винилокси)этил]-5-(проп-2-ин-1-илсуль-
Открытый и систематически развиваемый нами
фанил)-1Н-пиррол-2-аминов 1-4 в условиях элект-
концептуально новый общий подход к синтезу
ронной (70 эВ) и химической (газ-реагент - метан)
фундаментальных гетероциклов из доступных
ионизации. Как оказалось, масс-спектры электрон-
алленов или алкинов, изотиоцианатов и алки-
ной ионизации соединений 1-3 в основном иден-
лирующих агентов [21-25] позволяет осуществлять
тичны спектрам соответствующих 2,7-дигидротио-
быструю однореакторную сборку пиррольных
пирано[2,3-b]пиррол-6-аминов 5 [1] - продуктов их
структур с разнообразными, в том числе гетеро-
термоиндуцируемой перегруппировки (схема
2)
атомными, заместителями в различных положе-
[20]. Следует отметить, что 3,6-дигидро-2H-тиено-
ниях пиррольного цикла
[26-30]. Так, ранее
[2,3-b]пиррол-5-амины 6 и/или изомерные им 6H-
неизвестные 1-[алкил, 2-(винилокси)этил]-5-(проп-
тиено[2,3-b]пиррол-5-амины 6', образования кото-
2-ин-1-илсульфанил)-1Н-пиррол-2-амины 1-4 - по-
рых также можно было ожидать, среди продуктов
тенциальные субстанции лекарственных пре-
гетероциклизации не идентифицированы [20].
паратов и/или их прекурсоры, мономеры и
строительные блоки для многоцелевого органи-
Общие пути фрагментации молекулярных ионов
ческого синтеза - получены в одну препаративную
5-(проп-2-ин-1-илсульфанил)-1Н-пиррол-2-аминов
стадию разработанной нами трёхкомпонент-
(М+•) и 2,7-дигидротиопирано[2,3-b]пиррол-6-аминов
ной реакцией литиированных пропаргиламинов,
(М+•) [1] и вероятные механизмы образования из
изотиоцианатов и пропаргилбромида (схема
1)
них основных осколочных ионов представлены на
[20].
схемах 3-5 и в табл. 1.
Схема 2.
R1
N
S
N
R3
R2
1
ДМСО
R
5
N
S
~120°C, 5_8 мин
N
Me
R3
R2
1_3
R1
R1
S
S
N
N N
N
R3
R3
R2
R2
6
6'
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XX.
1859
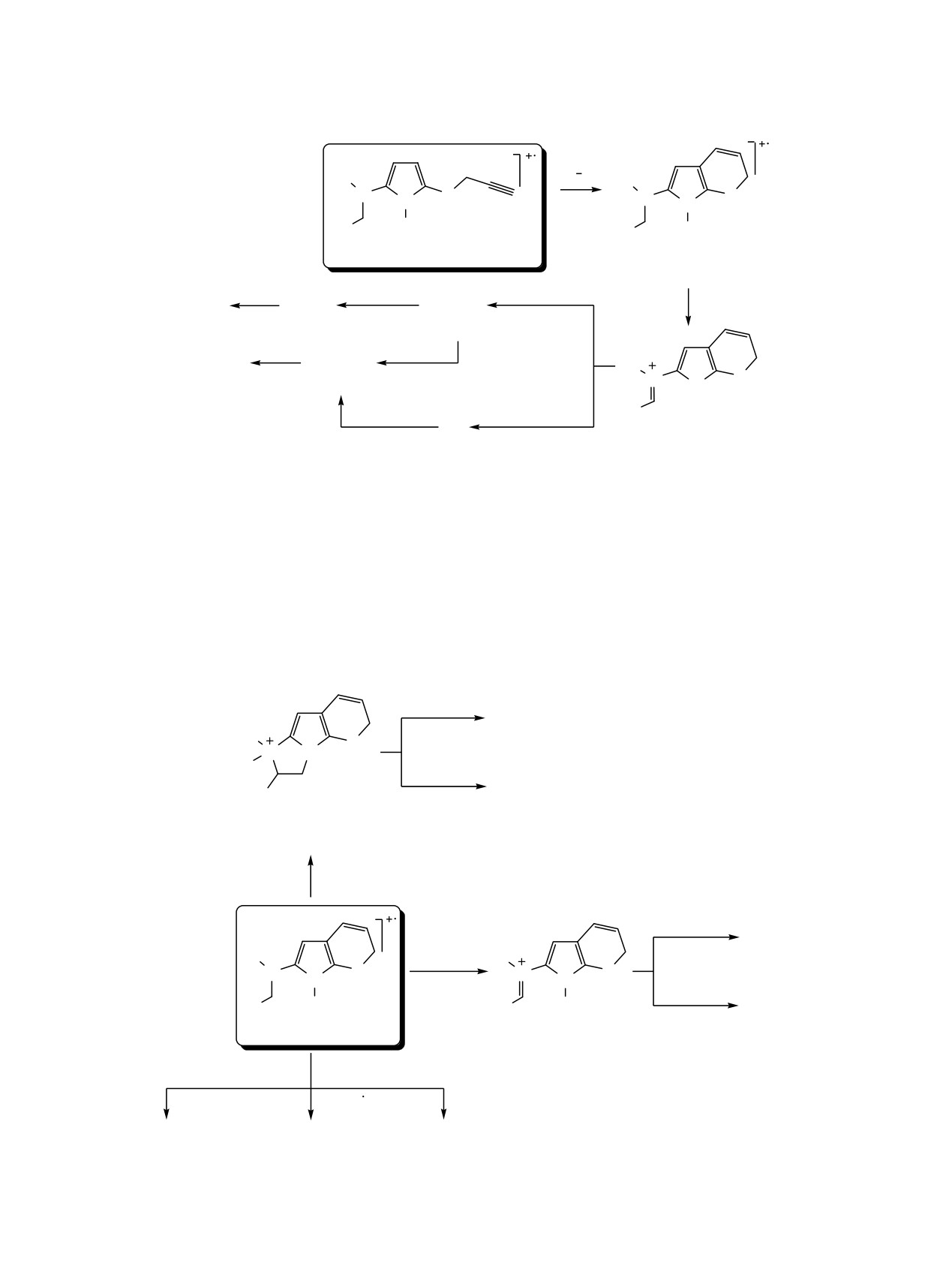
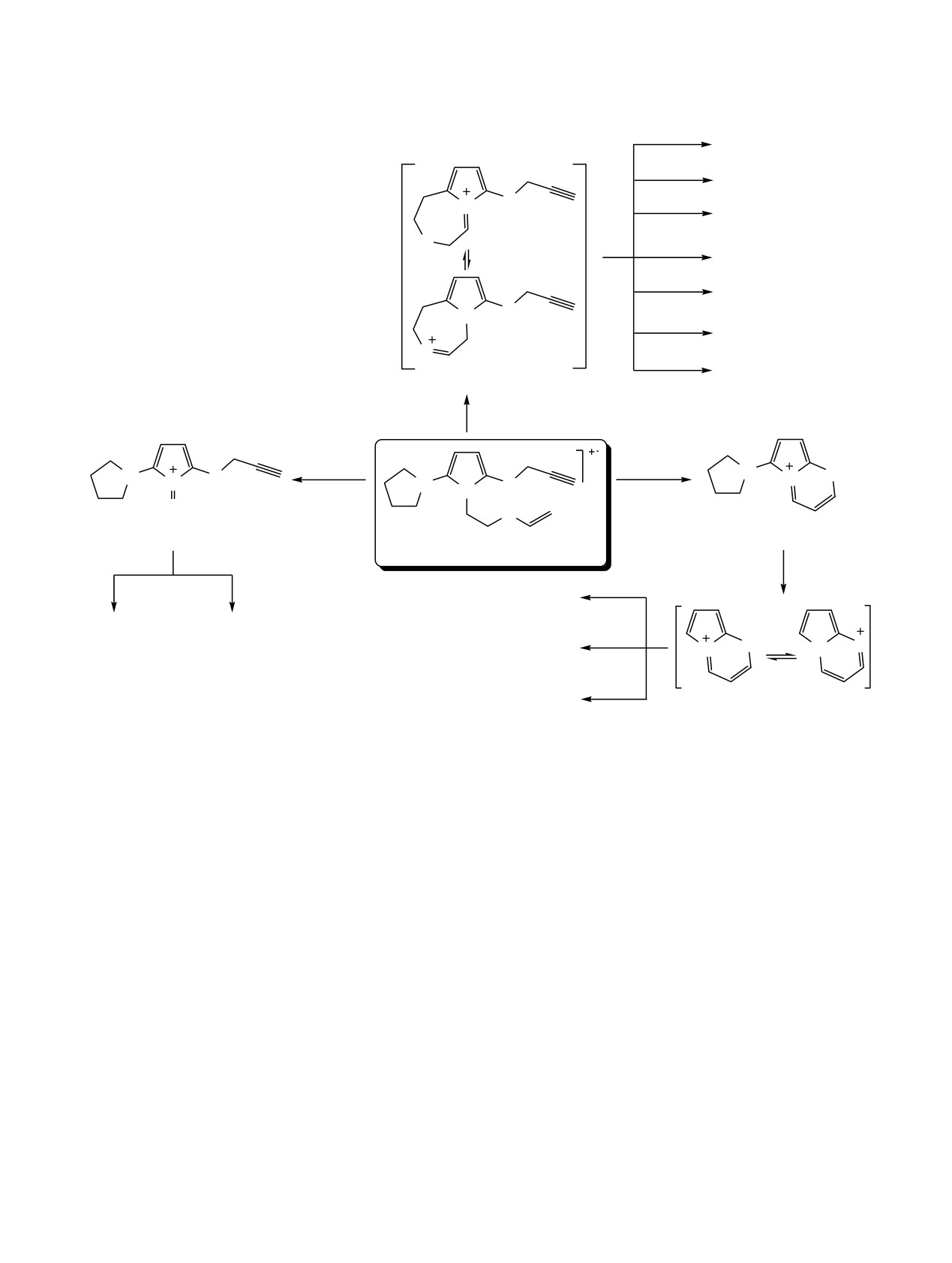
Схема 3.
R1
e
R1
N
S
N S
N
N
2
R3
R
R3
R2
+.
+.
1_3: M
M1
5
_(R3)
m/z 65
m/z 97
m/z 136
_S
_(C3H3)
_R1R2CHN
D
B
m/z 109
m/z 77
R1
_S
_HCN
S
E
N
N
H
R2
o
o
C
A
_R2CH2N
_R1CN
Как и ранее описанные бициклические пиррол-
Iотн 85-100%) {за исключением N,N-диэтил- и N,N-
6-амины 5 (М+•, Iотн 27-100%) [1], исследуемые 1Н-
дипропил-1-[2-(винилокси)этил]-5-(проп-2-ин-1-
пиррол-2-амины 1-4 при ионизации электронами
илсульфанил)-1Н-пиррол-2-аминов 2f и 3f}.
образуют устойчивые молекулярные ионы (М+•, Iотн
41-100%), доминирующее направление фрагмен-
На примере соединения 1а проведён квантово-
тации которых связано с разрывом связи Nпирр-Сзам,
химический анализ потенциальной возможности
элиминированием заместителя R3 в виде радикала
перегруппировки молекулярных ионов иссле-
и образованием устойчивых ионов [M - R3]+ (ион А,
дуемых
5-(проп-2-ин-1-илсульфанил)-1Н-пиррол-
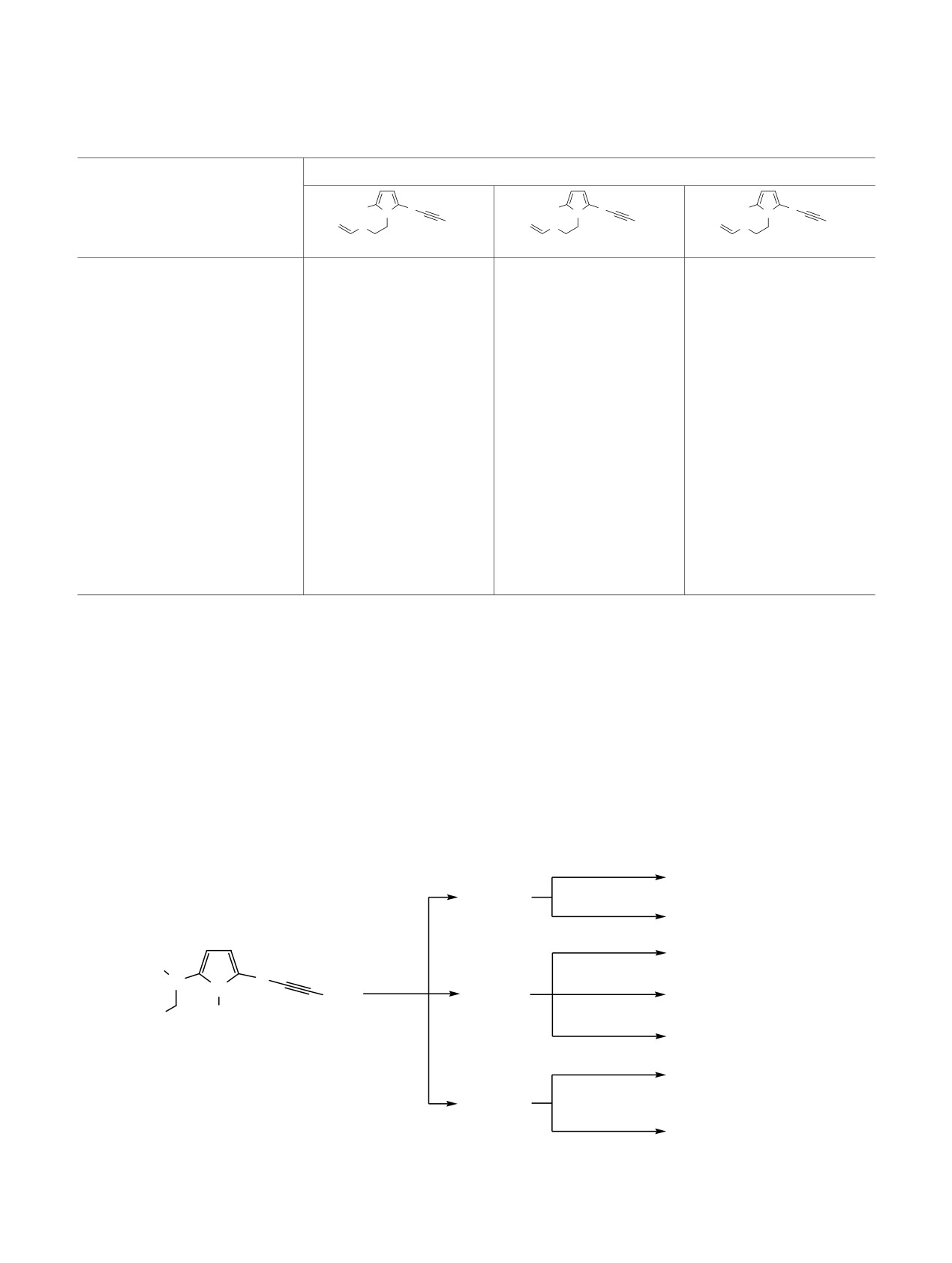
Схема 4.
m/z 165 (7, 14)
_C2H3R
H
S
N
N
Me
m/z 164 (22, 15)
R
_(C2H4R)
F1
R = H, m/z 193 (46)
R = Et, m/z 221 (19)
_
1b, d
Me
m/z 151 (26)
_CH2N
R1
H
m/z 179 (8)
1a, 2b
N
S
N
S
N
_(R1)
N
2
R3
R3
m/z 150 (16)
R
R2
_
MeN
+.
m/z 178 (10)
1a_e, 2b:
M1
F, m/z 179 (90)
m/z 207 (100)
1c, e
_(R3N)
_(R3NH)
_R3
NH2
m/z 165 (15, 18)
m/z 164 (17, 14)
m/z 163 (12, 7)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
1860
КЛЫБА и др.
Схема 5.
m/z 178 (10, 20, 32)
2b, c, f, 3f
_Et
m/z 192 (15)
_(R3)
R1
S
N
N
m/z 179 (8, 24, 17)
_C2H4
m/z 193 (8)
A1
R
m/z 207 (100, 100, 28)
m/z 235 (16)
R2
R2
R1
S
1f, 2f, 3f
N
N
H
N
S
N
S
N
N
_(R1)
R3
F2
R2
+.
1f, 2b, c, f, 3f:
M1
O
m/z 235 (3)
O
m/z 249 (9)
m/z 263 (14)
_C2H4O
_C3H6O
_C4H6O
_(C4H7O)
_C4H8O
m/z 191 (9)
m/z 177 (19)
m/z 165 (25)
m/z 164 (29)
m/z 163 (15)
m/z 205 (17)
m/z 191 (8)
m/z 179 (17)
m/z 178 (32)
m/z 177 (25)
m/z 219 (10)
m/z 205 (6)
m/z 193 (7)
m/z 192 (15)
m/z 191 (9)
2-аминов с образованием катион-радикалов 2,7-
спектрометрического эксперимента. Исследование
дигидротиопирано[2,3-b]пиррол-6-аминов 5 (М+• →
проводили с использованием метода B3LYP/6-
М1+•) или
3,6-дигидро-2H-тиено[2,3-b]пиррол-5-
311+G(d,p) [36]. Все расчёты выполнены в рамках
аминов 6 (М+• → М2+•) (рис. 1) в условиях масс-
программного комплекса GAUSSIAN-09 [37]. Ста-
Таблица 1. Общие характеристические ионы, генерируемые при фрагментации перегруппированного молекулярного
иона М+•, в масс-спектрах 5-(проп-2-ин-1-илсульфанил)-1Н-пиррол-2-аминов 1-3 (ионизация электронами, 70 эВ).
m/z (Iотн, %)
Ионы
1a
1b
1c
1d
1e
1f
2b
2c
2f
3f
194
208
222
236
236
250
236
250
278
306
М1+•
(100)
(100)
(51)
(76)
(41)
(100)
(75)
(76)
(100)
(100)
179
179
179
179
179
179
207
207
207
235
[M - R3]+, А, А1
(90)
(92)
(100)
(100)
(100)
(85)
(100)
(100)
(28)
(16)
[A - R1R2CHN]+, B, m/z 136
(20)
(51)
(45)
(38)
(36)
(59)
(5)
(9)
(35)
(23)
138
138
138
138
138
138
152
152
152
166
[A - R1CN]+, C
(49)
(44)
(42)
(37)
(34)
(37)
(29)
(11)
(24)
(7)
[B - C3H3]+•, D, m/z 97
(21)
(9)
(5)
(5)
(7)
(5)
(3)
(3)
(9)
(5)
[B - HCN]+, E, m/z 109
(7)
(12)
(10)
(7)
(12)
(8)
(2)
(2)
(9)
(7)
[E - S]+, m/z 77
(9)
(8)
(11)
(4)
(5)
(10)
(-)
(-)
(8)
(6)
[D - S]+•, m/z 65
(13)
(16)
(11)
(6)
(10)
(11)
(2)
(3)
(11)
(6)
179
193
207
221
221
235
207
221
249
263
[M - R1]+, F, F1, F2
(90)a
(46)
(2)
(19)
(-)
(3)
(100)a
(20)
(9)
(14)b
a По массе совпадает с ионом А.
b По массе совпадает с ионом [M - C2H3O]+.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XX.
1861
ционарные точки идентифицировали анализом
матрицы Гессе. Поиск и локализацию переходных
состояний проводили методом синхронного тран-
зита QST [38]. Анализ частот колебаний в точке
седла и соответствие критических точек гра-
диентной линии, их соединяющей, проводили
методом внутренней координаты реакции (IRC).
Все полученные результаты относятся к газовой
фазе.
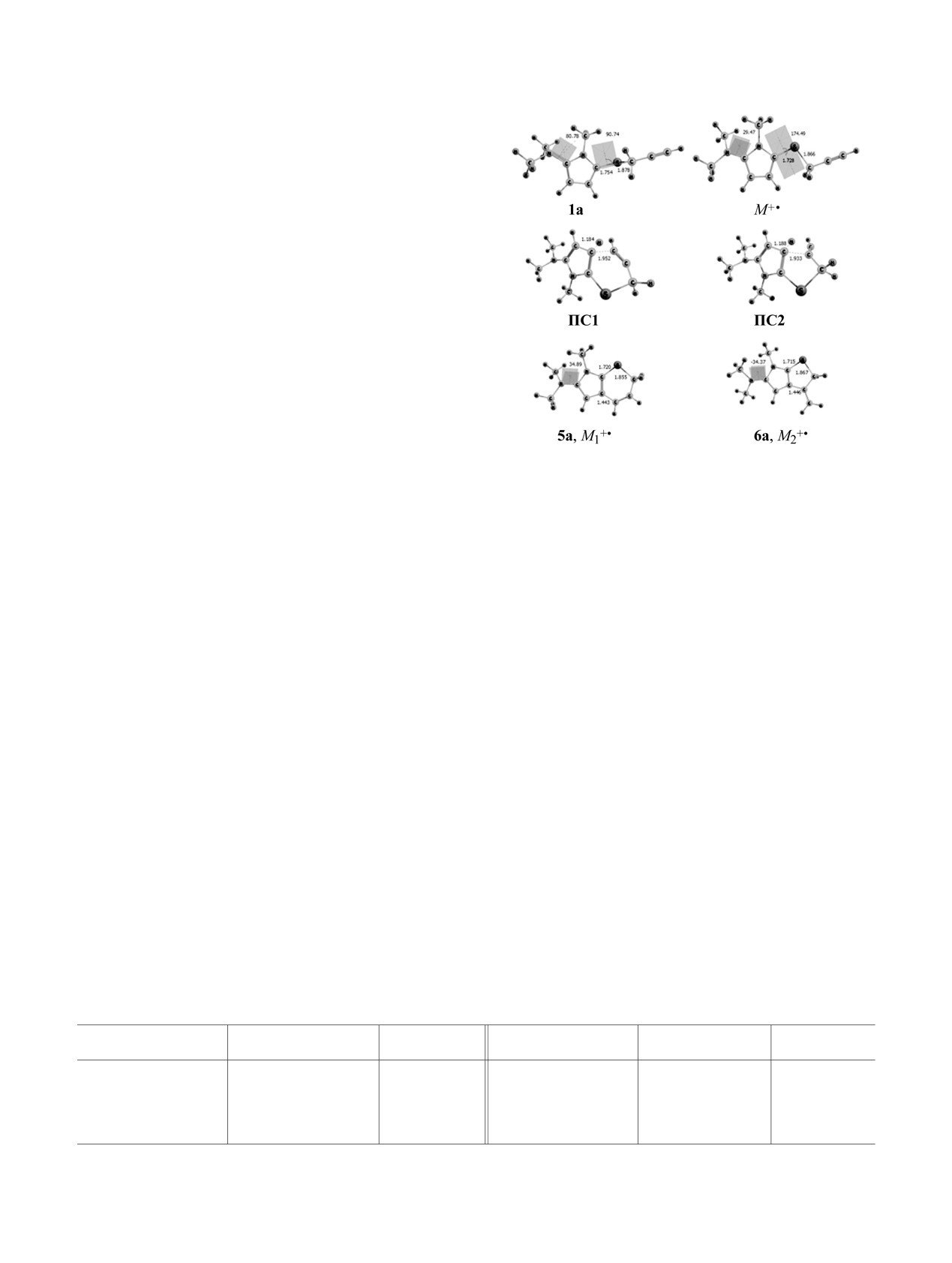
Как показали расчёты, электронная ионизация
соединения 1а приводит к его структурной реор-
ганизации, основным итогом которой является зна-
чительное уплощение скелета М+• (рис. 1). Обра-
зующийся интермедиат молекулярного иона потен-
циально способен к термодинамически контроли-
руемой внутримолекулярной циклизации, которую
инициирует взаимодействие терминального или
Рис. 1. Молекулярные структуры ключевых состояний
интернального атома углерода проп-2-ин-1-илсуль-
процессов внутримолекулярной циклизации катион-
фанильного фрагмента с пиррольным циклом.
радикала М+• соединения
1а, по данным метода
Экзотермичность процессов образования конден-
B3LYP/6-311+G(d,p).
сированных молекулярных систем 5а (М+• → М+•) и
6а (М+• → М+•) (рис. 1) составляет соответственно
38.0 ккал/моль и 33.8 ккал/моль (табл. 2). Форми-
ионов, которые не наблюдались в спектрах 2,7-
рование шестичленного гетероцикла протекает
дигидротиопирано[2,3-b]пиррол-6-аминов 5 [1]. Их
образование, вероятно, происходит из неперегруп-
через переходное состояние ПС1 (рис. 1) с прео-
долением барьера в 30.3 ккал/моль (табл. 2). Барьер
пированного молекулярного иона (М+•) соединений
альтернативного канала замыкания пятичленного
1-4 (схема 6, табл. 3). В этом случае стабилизация
иона [M - R3]+, возможно, происходит через обра-
цикла (ПС2, рис. 1) превышает значение ПС1 на
9.6 ккал/моль (табл. 2).
зование 6-(амино)пирроло[2,1-b][1,3]тиазин-5-иевого
иона А2 (схема 6), дальнейшая фрагментация кото-
Таким образом, исходя из полученных термо-
рого приводит к последовательному выбросу ради-
динамических и кинетических характеристик,
калов R1(R2CН2)NСН и С2Н3S и появлению ионов с
основным результатом инициируемой электронной
m/z 122 (ион Н) и 63, пики которых отсутствуют в
ионизацией внутримолекулярной гетероциклиза-
спектрах
2,7-дигидротиопирано[2,3-b]пиррол-6-
ции 5-(проп-2-ин-1-илсульфанил)-1Н-пиррол-2-амина
аминов 5 [1]. Кроме того, для соединений 1-3
(1а) должно быть образование интермедиата М+•,
характерен выброс фрагмента R1(R2CH2)NC и обра-
соответствующего катион-радикалу 2,7-дигидротио-
зование иона [M - R1(R2CH2)NC]+, возможно, имею-
пирано[2,3-b]пиррол-6-амина (5а). Это согласуется
щего структуру азетиевого иона G (схема 6), пик
с полученными экспериментальными данными.
которого также отсутствует в масс-спектрах соеди-
В масс-спектрах 5-(проп-2-ин-1-илсульфанил)-
нений 5 [1]. Ион G, в свою очередь, может стаби-
1Н-пиррол-2-аминов 1-4 также присутствуют пики
лизироваться в виде 2-тиа-8-азонийбицикло[4.2.0]-
Таблица 2. Относительная устойчивость (ΔG) и мнимые или наименьшие гармонические частоты (iw/w1) ключевых
состояний соединения 1а, полученные в процессе формирования бициклических структур 5а и 6а, по данным расчёта
методом B3LYP/6-311+G(d,p).
Структура
ΔG, ккал/моль
iw/w1, см-1
Структура
ΔG, ккал/моль
iw/w1, см-1
1а, M+•
0.0
28
ПС2
39.9
-i696
ПС1
30.3
-i619
6а, M2+•
-33.8
59
5а, M1+•
-38.0
65
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
1862
КЛЫБА и др.
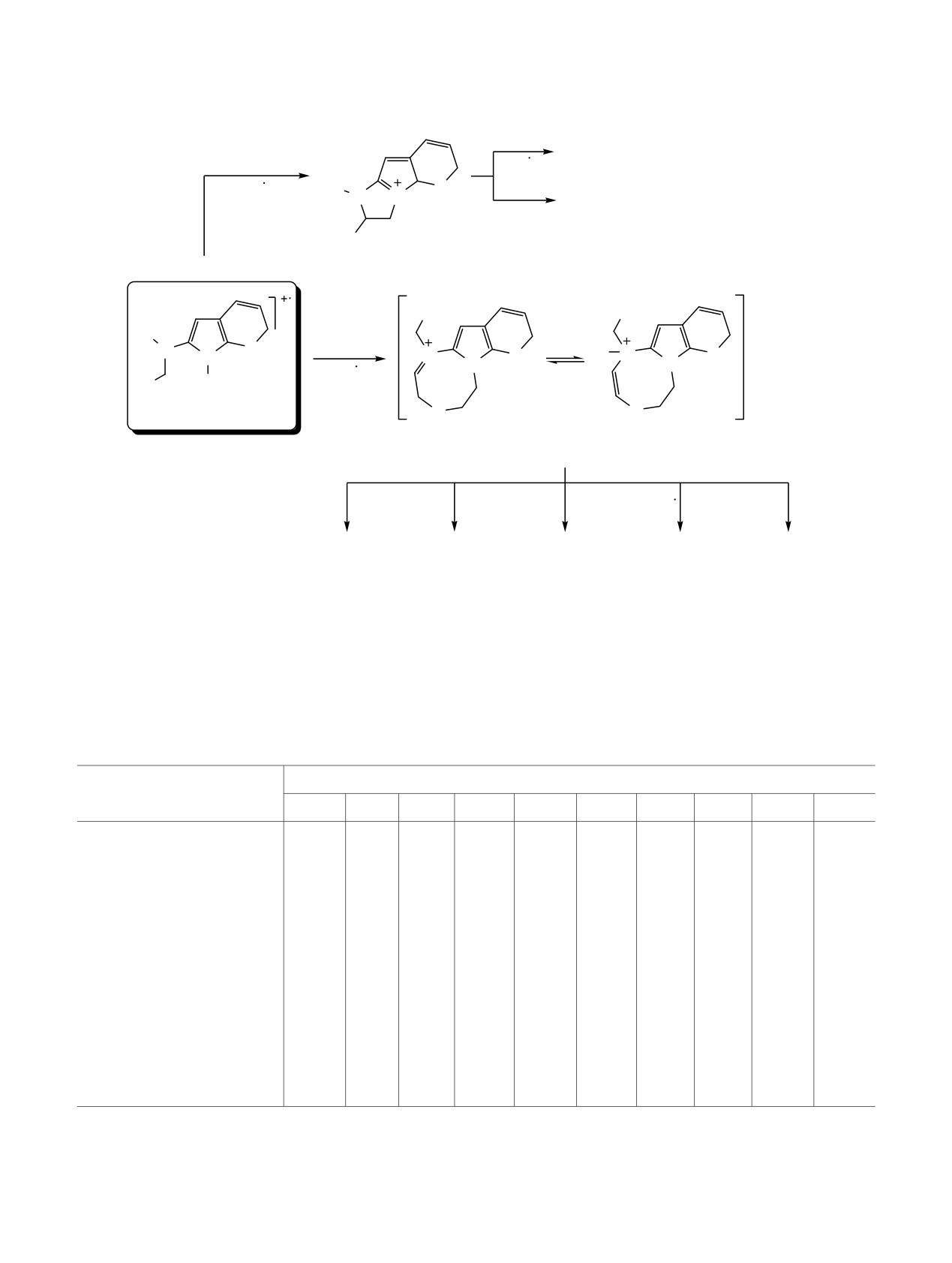
Схема 6.
m/z 122
m/z 63
_
_R1R2C2H3N
(C2H3S)
H
~ H
~ H
R1
[C2H3S]+
R1
S
S
N N
N
N
m/z 59
_(R3)
R2
R3
R2
1_4:
M+.
A2
Кроме 2c, 4f
_[R1(R2CH2
)NC]
N
N
S
S
R3
R3
G
G'
окта-1(8),4,6-триенового иона G' или иных гете-
оказалась неудачной - был получен смолообраз-
роциклических структур. Для соединений 2f и 3f
ный продукт [20], то с большой долей вероятности
этот канал фрагментации молекулярного иона
можно предположить, что образование наблю-
является основным (Iотн 74 и 78% соответственно)
даемых в масс-спектре соединения
4f ионов
(табл. 3).
происходит из неперегруппированного моле-
кулярного иона. При фрагментации М+• соединения
Возможно, именно этим, т.е. доминированием
4f основной вклад в полный ионный ток вносят
конкурентного канала фрагментации неперегруп-
ионы, образующиеся при отрыве 2-(винилокси)-
пированного молекулярного иона, обусловлена
этильного (ион А2) и пирролидинового (ион с m/z
низкая интенсивность пиков иона
[M
- R3]+,
206) радикалов, а также осколочные ионы,
наблюдаемая в спектрах соединений 2f (Iотн 28%) и
образующиеся при их дальнейшей деградации
3f (Iотн 16%) (табл. 3).
(схема 7).
Поскольку предпринятая нами ранее попытка
При электронной ионизации молекулярные ионы
зациклизовать 2-(проп-2-ин-1-илсульфанил)-5-пир-
(М+•) исследуемых 5-(проп-2-ин-1-илсульфанил)-
ролидин-1-ил-1H-пиррол
4f в соответствующий
1Н-пиррол-2-аминов (кроме соединения 4f) перег-
2,7-дигидротиопирано[2,3-b]пиррол-6-амин
5
[20]
руппировываются преимущественно в соответст-
Таблица 3. Основные характеристические ионы, генерируемые при фрагментации молекулярного иона М+•, в масс-
спектрах 5-(проп-2-ин-1-илсульфанил)-1Н-пиррол-2-аминов 1-4 (ионизация электронами, 70 эВ).
m/z (Iотн, %)
Ионы
1a
1b
1c
1d
1e
1f
2b
2c
2f
3fa
4f
194
208
222
236
236
250
236
250
278
306
276
М+•
(100)
(100)
(51)
(76)
(41)
(100)
(75)
(76)
(100)
(100)
(75)
179
179
179
179
179
179
207
207
207
235
205
[M - R3]+, А2
(90)
(92)
(100)
(100)
(100)
(85)
(100)
(100)
(28)
(16)
(100)
138
152
166
180
180
194
152
166
194
194
194
[M - R1(R2CH2)NC]+, G
(49)
(30)
(7)
(18)
(21)
(34)
(29)
(-)
(74)
(78)
(-)
[A2 - R1(R2CН2)NСН]+,
(15)
(29)
(18)
(14)
(14)
(26)
(7)
(7)
(17)
(8)
(12)
H, m/z 122
[C2H3S]+, m/z 59
(26)
(22)
(8)
(9)
(9)
(21)
(5)
(4)
(17)
(14)
(13)
m/z 63
(22)
(18)
(8)
(7)
(6)
(13)
(4)
(4)
(7)
(5)
(7)
a В спектре также присутствуют пики иона [M - C2H5]+, m/z 277 (Iотн 15%), и иона с m/z 247 (Iотн 9%).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XX.
1863
Схема 7.
m/z 178 (16)
_C2H4
m/z 177 (18)
_C2H5
S
N
m/z 164 (12)
_C2H2O
O
m/z 163 (9)
_C2H3O
m/z 162 (6)
_C2H4O
S
N
m/z 150 (24)
_C3H4O
O
m/z 149 (10)
m/z 206 (33)
_C3H5O
_C4H8N
N
S
N
N
S
N
N
S
_C3H5O
N
_C4H7O
CH2
O
m/z 219 (13)
A2, m/z 205 (100)
4f: M+., 276 (65)
_C4H7N
_C2H4
_C4H7N
m/z 109 (11)
_HCN
m/z 191 (8)
m/z 150 (24)
[C3H2S]+.
N S
N S
m/z 70 (11)
[HCS]+
m/z 136 (56)
m/z 45 (36)
вующие катион-радикалы (М1+•) 2,7-дигидротио-
3-9%) (для соединений 1а, с, f, 2b, c, f), [(M + H) -
пирано[2,3-b]пиррол-6-аминов 5. Основное направ-
CH3]+• (Iотн 4-7%) (для соединений 1а-f), [M -
ление распада обеих структур связано с разрывом
CH3]+ (Iотн 4-10%) (кроме 4f), [(M + H) - C3H3S]+ •
связи Nпирр-Сзам и образованием иона [M - R3]+
(Iотн
5-10%) (для соединений
1f и
2), вклад
(ионы А, А1 и А2).
которых, как видно из значений интенсивности их
пиков, невелик. Кроме этого, в масс-спектрах 1-[(2-
При химической ионизации
5-(проп-2-ин-1-
винилокси)-этил]замещённых соединений 1f и 2f
илсульфанил)-1Н-пиррол-2-аминов
1-4 метаном,
наблюдаются ионы [M - С2Н3О]+ [m/z 207 (Iотн 7%)
как и в случае 2,7-дигидротиопирано[2,3-b]пиррол-
и m/z 235 (Iотн 6%)].
6-аминов 5 [1], в масс-спектрах доминируют пики
М+• (Iотн 65-100%) и протонированного молекуляр-
Спектры химической ионизации исследуемых 5-
ного иона [M + H]+ (Iотн 75-100%) (табл. 4). Наряду
(проп-2-ин-1-илсульфанил)-1Н-пиррол-2-аминов
с ними в спектрах регистрируются ионы [M +
во многом совпадают со спектрами соответст-
C2H5]+ (Iотн 5-11%), образующиеся по механизму
вующих
2,7-дигидротиопирано[2,3-b]пиррол-6-
электрофильного присоединения, и ионы [M - H]+
аминов 5 [1], за исключением отдельных моментов.
(Iотн 8-25%), [M - S]+• (Iотн 5-15%) (для соединений
Так, для некоторых соединений наблюдается отрыв
1b, c, f), [M - R3]+ (Iотн 3-13%) (для соединений
радикала C3H3S. Для соединения 1а - это ион [(M +
1а-d, 2b, c), [(M + H) - (R3 - H)]+ (Iотн 4-13%)
С2Н5) - C3H3S]+, для соединений 1f, 2 - ион [(M +
(для соединений 1с, f, 2c), [(M + H) - R3]+• (Iотн
H) - C3H3S]+•.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
1864
КЛЫБА и др.
Таблица 4. Основные характеристические ионы в масс-спектрах 5-(проп-2-ин-1-илсульфанил)-1Н-пиррол-2-аминов
1-4 (химическая ионизация, газ-реагент - метан).
m/z (Iотн, %)
Ионы
1aa
1b
1c
1db
1fc
2b
2cd
2f
3fe
4ff
194
208
222
236
250
236
250
278
306
276
М+•
(98)
(100)
(100)
(87)
(65)
(98)
(98)
(77)
(82)
(81)
195
209
223
237
251
237
251
279
307
277
[M + H]+
(100)
(98)
(75)
(100)
(100)
(100)
(100)
(100)
(100)
(100)
223
237
251
265
279
265
279
307
335
305
[M + С2Н5]+
(11)
(7)
(5)
(8)
(8)
(8)
(8)
(6)
(10)
(8)
193
207
221
235
249
235
249
277
305
275
[M - H]+
(16)
(18)
(11)
(24)
(8)
(24)
(25)
(21)
(16)
(16)
179
193
207
221
235
221
235
263
291
261
[M - СН3]+
(5)
(5)
(4)
(4)
(5)
(6)
(10)
(5)
(5)
(-)
162
176
190
204
218
204
218
246
274
244
[M - S]+•
(-)
(5)
(14)
(-)
(15)
(-)
(-)
(-)
(-)
(-)
179
179
179
179
179
207
207
207
235
205
[M - R3]+
(5)g
(4)
(13)
(3)
(-)
(7)
(8)
(-)
(-)
(-)
180
194
208
222
236
222
236
264
292
262
[(M + H) - СН3]+•
(6)
(7)
(7)
(5)
(4)
(-)
(-)
(-)
(-)
(-)
180
180
180
180
180
208
208
208
236
206
[(M + H) - R3]+•
(6)h
(-)
(3)
(-)
(6)
(9)
(5)
(5)
(-)
(-)
181
181
181
181
181
209
209
209
237
207
[(M + H) - (R3 - H)]+
(-)
(-)
(13)
(-)
(6)
(-)
(4)
(-)
(-)
(-)
124
138
152
166
180
166
180
208
236
206
[(M + H) - C3H3S]+•
(-)
(-)
(-)
(-)
(6)i
(10)
(10)
(5)i
(-)
(-)
a В спектре также присутствует пик иона [(M + С2Н5) - C3H3S]+•, m/z 152 (Iотн 14%).
b В спектре также присутствует пик иона [(M + H) - C3H7]+•, m/z 194 (Iотн 3%).
c В спектре также присутствуют пики ионов [M - C2H3O]+, m/z 207 (Iотн 16%), и [M - C3H6O]+, m/z 192 (Iотн 6%).
d В спектре также присутствует пик иона [(M + H) - С2Н5]+•, m/z 222 (Iотн 10%).
e По массе ион [M - C2H3O]+, m/z 263 (Iотн 10%), совпадает с ионом [M - C3H7]+, а ион [(M + H) - C2H3O]+•, m/z 264 (Iотн 5%), -
с ионом [(M + H) - C3H7]+•.
f В спектре также присутствуют пики ионов [M - C2H3O]+, m/z 233 (Iотн 11%), и [M - C4H7N]+, m/z 208 (Iотн 9%).
g По массе совпадает с ионом [M - СН3]+.
h По массе совпадает с ионом [(M + H) - СН3]+•.
i
По массе совпадает с ионом [(M + H) - R3]+•.
Следует отметить, что при регистрации спект-
Основные характеристические ионы в масс-спект-
ров химической ионизации 5-(проп-2-ин-1-илсуль-
рах и общая картина образования осколочных
фанил)-1Н-пиррол-2-аминов наблюдается их час-
ионов представлены в таблицах 5 и 6 и на схеме 9.
тичная (5-10%) термоиндуцируемая изомеризация
в соответствующие 5-(проп-1-ин-1-илсульфанил)-
При химической ионизации
5-(проп-1-ин-1-
1H-пиррол-2-амины 7a-d, f, 8b, f, 9f (схема 8), для
илсульфанил)-1H-пиррол-2-аминов 7a-d, f, 8b, f, 9f
которых записаны индивидуальные масс-спектры.
в масс-спектрах также доминируют пики M+• (Iотн
Схема 8.
R1
R1
N
S
N
S
N
N
Me
R3
R3
R2
R2
1a_d, f, 2b, f, 3f
7a_d, f, 8b, f, 9f
1, 7: R1 = Me, R2 = H: R3 = Me (a), Et (b), i-Pr (c), n-Bu (d), CH2=CHOCH2CH2 (f); 2, 8: R1 = Et, R2 = Me: R3 = Et (b),
CH2=CHOCH2CH2 (f); 3, 9: R1 = n-Pr, R2 = Et: R3 = CH2=CHOCH2CH2 (f).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XX.
1865
Таблица 5. Основные характеристические ионы в масс-спектрах 5-(проп-1-ин-1-илсульфанил)-1H-пиррол-2-аминов
7a-d, 8b (химическая ионизация, газ-реагент - метан).
m/z (Iотн, %)
Ионы
Me2N
S
Me2N
S
Me2N
S
Me2N
S
Et2N
S
N
N
N
N
N
Me
Me
Et
Me
Pr-i
Me
Bu-n
Me
Et
Me
7a
7b
7c
7da
8bb
М+•
194 (100)
208 (100)
222 (100)
236 (100)
236 (100)
[M + H]+
195 (69)
209 (82)
223 (72)
237 (73)
237 (75)
[M + C2H5]+
223 (3)
237 (3)
251 (4)
265 (-)
265 (6)
[M - H]+
193 (12)
207 (14)
221 (14)
235 (14)
235 (16)
[M - C3H3]+
155 (62)
169 (73)
183 (56)
197 (9)
197 (19)
[M - S]+•
162 (12)
176 (11)
190 (13)
204 (-)
204 (-)
[(M + H) - C3H3]+•
156 (50)
170 (63)
184 (68)
198 (-)
198 (14)
[(M + H) - C3H3S]+•
124 (33)
138 (40)
152 (30)
166 (67)
166 (5)
[(M + H) - S] +
163 (-)
177 (9)
191 (15)
205 (-)
205 (-)
[(M + C2H5) - C3H3]+•
184 (12)
198 (14)
212 (13)
226 (-)
226 (-)
[(M + C2H5) - C3H3S]+•
152 (13)
166 (17)
180 (14)
194 (12)
194 (-)
[M - R1(R2CH2)N]+
150 (10)
164 (7)
178 (-)
192 (-)
164 (11)
a В спектре также присутствуют пики ионов [M - C3H7]+, m/z 193 (Iотн 8%), [(M + Н) - C4H8]+, m/z 181 (Iотн 16%), и [M - R3]+, m/z 179
(Iотн 6%).
b В спектре также присутствуют пики ионов [M - Me]+, m/z 221 (Iотн 9%), и [M - C2H4]+•, m/z 208 (Iотн 15%).
78-100%) и протонированной молекулы [M + H]+
осколочных ионов [M - C2H3O]+ (Iотн 14-29%) и
(Iотн 63-97%) (табл. 5 и 6). Наряду с ними в спект-
[(M + Н) - C2H3O]+• (Iотн 11-28%), связанных с дест-
рах регистрируются пики ионов [M + C2H5]+ (Iотн 2-
рукцией 1-[2-(винилокси)этильного] заместителя, и
10%), образующихся по механизму электрофиль-
ионов [(M + C2H5) - R3]+• (Iотн 10-28%), а также
ного присоединения. Отличительной особенностью
ионов [(M + Н) - R3]+• (Iотн 100 и 100%) и [M - R3N]+
масс-спектров химической ионизации 5-(проп-1-
(Iотн 18 и 13%) - для соединений 7f, 8f.
ин-1-илсульфанил)-1H-пиррол-2-аминов является
присутствие в них пиков ионов, обусловленных
Впервые записаны и проанализированы масс-
элиминированием радикала CH3С≡С как из моле-
спектры электронной и химической ионизации 5-
кулярного иона (Iотн 9-73%), так и из ионов [M + H]+
(проп-2-ин-1-илсульфанил)-1Н-пиррол-2-аминов 1-
(Iотн 14-68%) (кроме соединений 7e, f, 8f) и [M +
4. В спектрах электронной ионизации присутст-
C2H5]+ (Iотн 12-14%) (для соединений 7a-c). Проте-
вуют пики двух серий ионов, образование которых
кает также процесс отрыва аминного заместителя
возможно при распаде молекулярных ионов иссле-
из молекулярного иона с образованием иона [M -
дуемых соединений 1-4 (М+•) и 2,7-дигидротио-
R1(R2CH2)N]+ (Iотн 5-28%) (кроме соединений 7c, e).
пирано[2,3-b]пиррол-6-аминов 5 (М+•) - продуктов
Пики этих ионов отсутствуют в спектрах хими-
их внутримолекулярной циклизации, инициируе-
ческой ионизации
5-(проп-2-ин-1-илсульфанил)-
мой электронами, что согласуется с данными
1Н-пиррол-2-аминов и 2,7-дигидротиопирано[2,3-
квантово-химических расчётов. Основное направ-
b]пиррол-6-аминов 5 [1]. В свою очередь, в спект-
ление деградации обоих молекулярных ионов (М+•
рах 5-(проп-1-ин-1-илсульфанил)-1H-пиррол-2-аминов
и М+•) связано с разрывом связи Nпирр-Сзам и обра-
отсутствуют пики ионов [M - CH3]+ и [M - R3]+,
зованием иона [M - R3]+. Выброс радикала R3
характерные для спектров 5-(проп-2-ин-1-илсуль-
катион-радикалом М1+• приводит к N-алкил-N-
фанил)-1Н-пиррол-2-аминов. Кроме того, для 1H-
метилен-2,7-дигидротиопирано[2,3-b]пиррол-6-
пиррол-2-аминов 7f, 8f, 9f характерно образование
аминиевым ионам А (схема 3) и/или 2,3,4a,6-тетра-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
1866
КЛЫБА и др.
Таблица 6. Основные характеристические ионы в масс-спектрах 5-(проп-1-ин-1-илсульфанил)-1-(2-(винилокси)этил)-
1H-пиррол-2-аминов 7f, 8f, 9f (химическая ионизация, газ-реагент - метан).
m/z (Iотн, %)
Ионы
Me2N
N
S
Et2N
N
S
Pr2N
N
S
O
Me
O
Me
O
Me
7fa
8f
9fb
М+•
250 (100)
278 (78)
306 (100)
[M + H]+
251 (63)
279 (68)
307 (97)
[M + C2H5]+
279 (2)
307 (8)
335 (10)
[M - H]+
249 (11)
277 (6)
305 (18)
[M - C3H3]+
211 (11)
239 (11)
267 (14)
[M - C2H3O]+
207 (29)
235 (22)
263 (14)
[M - R1(R2CH2)N]+
206 (28)
206 (5)
206 (11)
[M - R3N]+
165 (18)
193 (13)
221 (-)
[MH - C3H3]+•
212 (-)
240 (-)
268 (33)
[(M + H) - R3]+•
180 (100)
208 (100)
236 (-)
[(M + H) - C2H3O]+•
208 (28)
236 (12)
264 (11)
[(M + C2H5) - R3]+•
208 (28)c
236 (12)c
264 (11)c
a В спектре также присутствует пик иона [(M + H) - С3Н7О]+•, m/z 192 (Iотн 18%).
b В спектре также присутствуют пики ионов [(M + C2H5) - С3Н6]+, m/z 293 (Iотн 30%), и [(M + C2H5) - С3Н7]+•, m/z 292 (Iотн 18%).
c По массе совпадает с ионом [(M + H) - C2H3O]+•.
гидро-1H-тиопирано[3',2':4,5]пирроло[1,2-a]имида-
соединений 1-3 характерен также выброс радикала
зол-4-иевым ионам А1 (схема 5). Стабилизация
R1(R2CH2)NC.
иона [M - R3]+, генерируемого из неперегруппиро-
ванного молекулярного иона (М+•), вероятно, про-
Масс-спектры химической ионизации 5-(проп-
исходит с образованием 6-(амино)пирроло[2,1-b]-
2-ин-1-илсульфанил)-1Н-пиррол-2-аминов
1-3 в
[1,3]тиазин-5-иевого иона А2 (схема 6). Для М+•
основном также качественно схожи с масс-спект-
Схема 9.
Для 7a_c
[M _ S]+.
M +.
[M _ C3H3]+
Для 7b, c
[(M + H) _ S]+
R1
N
S
[CH5]+
Кроме 7d, f, 8f
N
[M + H]+
[(M + H) _ C3H3]+.
Me
R3
R2
Кроме 9f
[(M + H) _ C3H3S]+.
7a_d, f, 8b, f, 9f
Для 7a_c
[(M + Et) _ C3H3]+.
[M + Et]+
Для 7a_d
[(M + Et) _ C3H3S]+.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XX.
1867
рами соответствующих 2,7-дигидротиопирано[2,3-
3. Gribble G.W. Compr. Heterocycl. Chem. II. 1996, 2, 207.
b]пиррол-6-аминов 5 [1]. В то же время химическая
4. d’Ischia M., Napolitano A., Pezzella A. Compr.
ионизация соединений 1-3 сопровождается частич-
Heterocycl. Chem. III. 2008, 3, 353.
ной (5-10%) изомеризацией в соответствующие 5-
5. Joshi S.D., More U.A., Kulkarni V.H., Aminabhav T.M.
(проп-1-ин-1-илсульфанил)-1H-пиррол-2-амины 7-9.
Curr. Org. Chem.
2013,
17,
2279. doi
10.2174/
13852728113179990040
Присутствие в спектрах электронной ионизации
6. Baumann M., Baxendale I.R., Ley S.V., Nikbin N.
пиков ионов [M - R1(R2CH2)NC]+, ионов с m/z 63 и
Beilstein J. Org. Chem. 2011, 7, 442. doi 10.3762/
59, а при химической ионизации метаном - обра-
bjoc.7.57
зование
5-(проп-1-ин-1-илсульфанил)-1H-пиррол-
7. Domingo V.M., Brillas E., Torrelles X., Rius J., Julia L.
2-аминов 7-9, являются аналитическими призна-
J. Org. Chem. 2001, 66, 8236. doi 10.1021/jo010514w
ками
5-(проп-2-ин-1-илсульфанил)-1Н-пиррол-2-
8. Rosa A., Ricciardi G., Baerends E.J., Zimin M.,
аминов 1-3.
Rodgers M.A.J., Matsumoto S., Ono N. Inorg. Chem.
2005, 44, 6609. doi 10.1021/ic050838t
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
9. Cirrincione G., Almerico A.M., Aiello E., Dattolo G.
The Chemistry of Heterocyclic Compounds. Ed.
Масс-спектры положительных ионов электрон-
Taylor E.C. J. Wiley: New York, 1992, 48, part 2, 299.
ной ионизации (70 эВ) исследуемых соединений
doi 10.1002/9780470187340.ch3
зарегистрированы на приборе Shimadzu GCMS-
10. Marcotte F.-A., Lubell W.D. Org. Lett. 2002, 4, 2601.
QP5050A с системой прямого ввода образца DI-50
doi 10.1021/ol0262690
(масс-анализатор квадрупольный, диапазон детек-
11. Unverferth K., Engel J., Höfgen N., Rostock A.,
Günther R., Lankau H.-J., Menzer M., Rolfs A.,
тируемых масс 34-650 Дa). Температуру ионного
Liebscher J., Müller B., Hofmann H. J. Med. Chem.
источника и ввода образца подбирали так, чтобы
1998, 41, 63. doi 10.1021/jm970327j
обеспечить получение качественного масс-спектра,
12. Iaroshenko V.O., Wang Y., Sevenard D.N.,
исключив при этом термическую деструкцию
Volochnyuk D.M. Synthesis. 2009, 1851. doi 10.1055/s-
вещества.
0029-1216640
Масс-спектры химической ионизации положи-
13. Ong C.W., Yang Y.-T., Liu M.-C., Fox K.R., Liu P.H.,
тельных ионов зарегистрированы на приборе
Tung H.-W. Org. Biomol. Chem. 2012, 10, 1040. doi
Agilent 5975С, газ-реагент - метан. Ввод образцов
10.1039/C1OB06803B
осуществляли через хроматограф Agilent 6890N.
14. Pućkowska A., Midura-Nowaczek K., Bruzgo I. Acta
Разделение осуществляли на хроматографической
Polon. Pharmaceutica. 2008, 65, 213.
колонке HP-5MS (30 м×0.25 мм×0.25 мкм) при
15. Baraldi P.G., Zaid A.N., Preti D., Fruttarolo F.,
постоянной скорости потока, газ-носитель - гелий,
Tabrizi M.A., Iaconinoto A., Pavani M.G., Carrion M.D.,
Cara C.L.L., Romagnoli R. Arkivoc. 2006, vii, 20. doi
режим программирования: от
60 до
180°С со
10.3998/ark.5550190.0007.704
скоростью 5 град/мин.
16. Broyles S.S., Kremer M., Knutson B.A. J. Virol. 2004,
78, 2137. doi 10.1128/JVI.78.4.2137-2141.2004
БЛАГОДАРНОСТИ
17. Chien T.-C., Meade E.A., Hinkley J.M., Townsend L.B.
Org. Lett. 2004, 6, 2857. doi 10.1021/ol049207d
Работа выполнена с использованием оборудо-
18. Nair V., Vinod A.U., Rajesh C.A. J. Org. Chem. 2001,
вания Байкальского аналитического центра коллек-
66, 4427. doi 10.1021/jo001714v
тивного пользования СО РАН.
19. Tarasova O.A., Nedolya N.A., Vvedensky V.Yu.,
Brandsma L., Trofimov B.A. Tetrahedron Lett. 1997,
КОНФЛИКТ ИНТЕРЕСОВ
38, 7241. doi 10.1016/S0040-4039(97)01680-8
20. Nedolya N.A., Tarasova O.A., Albanov A.I.,
Авторы заявляют об отсутствии конфликта
Trofimov B.A. Synthesis. 2016, 48, 4278. doi 10.1055/
интересов.
s-0035-1561492
21. Brandsma L., Nedolya N.A., Tarasova O.A.,
СПИСОК ЛИТЕРАТУРЫ
Trofimov B.A. ХГС.
2000,
1443.
[Brandsma L.,
Nedolya N.A., Tarasova O.A., Trofimov B.A. Chem.
1. Клыба Л.В., Недоля Н.А., Санжеева Е.Р., Тарасо-
Heterocycl. Compd. 2000, 36, 1241.]
ва О.А. ЖОрХ. 2019, 55, 930.
22. Brandsma L., Nedolya N.A. Synthesis. 2004, 735. doi
2. Sundberg R.J. Compr. Heterocycl. Chem. 1984, 4, 313.
10.1055/s-2004-816005
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
1868
КЛЫБА и др.
23. Недоля Н.А., Трофимов Б.А. ХГС.
2013,
166.
33. Клыба Л.В., Недоля Н.А., Тарасова О.А.,
[Nedolya N.A., Trofimov B.A. Chem. Heterocycl.
Жанчипова Е.Р., Волостных О.Г. ЖОрХ. 2010, 46,
Compd. 2013, 49, 152.] doi 10.1007/s10593-013-1236-y
1039.
[Klyba L.V., Nedolya N.A., Tarasova O.A.,
24. Nedolya N.A., Tarasova O.A., Albanov A.I.,
Zhanchipova E.R., Volostnykh O.G. Russ. J. Org.
Trofimov B.A. J. Org. Chem. 2017, 82, 7519. doi
Chem. 2010, 46, 1038.] doi 10.1134/S1070428010070134
10.1021/acs.joc.7b01217
34. Клыба Л.В., Тарасова О.А., Недоля Н.А.,
Санжеева Е.Р. ЖОрХ. 2016, 52, 1594. [Klyba L.V.,
25. Nedolya N.A., Tarasova O.A., Albanov A.I.,
Tarasova O.A., Nedolya N.A., Sanzheeva E.R. Russ.
Trofimov B.A. Synthesis. 2018, 50, 4313. doi 10.1055/
J. Org. Chem.
2016,
52,
1587.] doi
10.1134/
s-0037-1609561
S1070428016110063
26. Nedolya N.A., Brandsma L., Tarasova O.A.,
35. Клыба Л.В., Тарасова О.А., Недоля Н.А. ЖОрХ. 2016,
Verkruijsse H.D., Trofimov B.A. Tetrahedron Lett.
52, 1782. [Klyba L.V., Tarasova O.A., Nedolya N.A.
1998, 39, 2409. doi 10.1016/S0040-4039(98)00211-1
Russ. J. Org. Chem. 2016, 52, 1773.] doi 10.1134/
27. Brandsma L., Nedolya N.A., Trofimov B.A. Eur.
S1070428016120101
J. Org. Chem. 1999, 2663. doi 10.1002/(SICI)1099-
36. Becke A.D. J. Chem. Phys.
1993,
98,
5648. doi
0690(199910)1999:10
10.1063/1.464913
28. Nedolya N.A., Tarasova O.A., Albanov A.I.,
37. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Trofimov B.A. Tetrahedron Lett. 2010, 51, 5316. doi
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
10.1016/j.tetlet.2010.07.179
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
29. Недоля Н.А., Брандсма Л., Тарасова О.А.,
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
Албанов А.И., Трофимов Б.А. ЖОрХ. 2011, 47,
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
658.
[Nedolya N.A., Brandsma L., Tarasova O.A.,
Fukuda R., Hasegawa J., Ishida M., Nakajima T.,
Albanov A.I., Trofimov B.A. Russ. J. Org. Chem. 2011,
Honda Y., Kitao O., Nakai H., Vreven T., Montgome-
47, 659.] doi 10.1134/S1070428011050034
ry J.A. Jr., Peralta J.E., Ogliaro F., Bearpark M.,
30. Tarasova O.A., Nedolya N.A., Albanov A.I.,
Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N.,
Trofimov B.A. Eur. J. Org. Chem. 2018, 5961. doi
Kobayashi R., Normand J., Raghavachari K., Rendell A.,
10.1002/ejoc.201800987
Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Rega N.,
31. Клыба Л.В., Недоля Н.А., Тарасова О.А.,
Millam J.M., Klene M., Knox J.E., Cross J.B., Bakken V.,
Санжеева Е.Р. ЖОрХ. 2013, 49, 398. [Klyba L.V.,
Adamo C., Jaramillo J., Gomperts R., Stratmann R.E.,
Nedolya N.A., Tarasova O.A., Sanzheeva E.R. Russ.
Yazyev O., Austin A.J., Cammi R., Pomelli C.,
J. Org. Chem.
2013,
49,
384.] doi
10.1134/
Ochterski J.W., Martin R.L., Morokuma K., Zakrzews-
S1070428013030123
ki V.G., Voth G.A., Salvador P., Dannenberg J.J.,
32. Клыба Л.В., Недоля Н.А., Тарасова О.А.,
Dapprich S., Daniels A.D., Farkas O., Foresman J.B.,
Санжеева Е.Р. ЖОрХ. 2014, 50, 43. [Klyba L.V.,
Ortiz J.V., Coslowski J., Fox D.J. Gaussian 09, revision
Nedolya N.A., Tarasova O.A., Sanzheeva E.R. Russ.
A.01, Gaussian, Inc., Wallingford, 2009.
J. Org. Chem.
2014,
50,
35.] doi
10.1134/
38. Peng C., Schlegel H.B. Israel J. Chem. 1993, 33, 449.
S1070428014010072
doi 10.1002/ijch.199300051
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
МАСС-СПЕКТРЫ НОВЫХ ГЕТЕРОЦИКЛОВ: XX.
1869
Mass Spectra of New Heterocycles:
XX. Study of 5-(Prop-2-yn-1-ylsulfanyl)-1Н-pyrrol-2-amines
by Election and Chemical Ionization
L. V. Klyba*, N. A. Nedolya, E. R. Sanzheeva, O. A. Tarasova, and V. A. Shagun
A.E. Favorskii Irkutsk Institute of Chemistry, SB, RAS, 664033, Russia, Irkutsk, ul. Favorskogo 1
*e-mail: klyba@irioch.irk.ru
Received May 23, 2019; revised October 23, 2019; accepted October 24, 2019
The mass spectra of electron (70 eV) and chemical (reagent gas - methane) ionization of 1-[alkyl- and 2-
(vinyloxy)ethyl]-5-(prop-2-yn-1-ylsulfanyl)-1H-pyrrol-2-amines were studied for the first time. Under the
electron ionization, compounds under study form stable molecular ions, the decay of which proceeds mainly by
directions, typical for the decay of M+• of 2,7-dihydrothiophene[2,3-b]pyrrol-6-amines, products of their
intramolecular cyclization. In the mass spectra there are also ion peaks, the formation of which is possible only
with the decay of a not rearrangement molecular ion. The main direction of the fragmentation of M+• of both
structures related to the break of the Npyrr-Csubst bond and the formation of stable ions [M - R3]+ (Irel. 85-100%)
{with the exception of N,N-diethyl- and N,N-dipropyl-1-[2-(vinyloxy)ethyl]-5-(prop-2-yn-1-ylsulfanyl)-1H-
pyrrol-2-amine}. Quantum chemical calculations performed using the B3LYP/6-311+G(d,p) method are
consistent with experimental data. Under chemical ionization of 5-(prop-2-yn-1-ylsulfanyl)-1H-pyrrol-2-amines,
the mass spectra are dominated by peaks of M+• (Irel. 65-100%) and protonated molecule [M + H]+ (Irel. 75-
100%). The mass spectra of chemical ionization of 5-(prop-1-yn-1-ylsulfanyl)-1H-pyrrol-2-amines formed as a
result of partial (5-10%) thermo-induced isomerization of 5-(prop-2-yn-1-ylsulfanyl)-1H-pyrrol-2-amines have
been recorded.
Keywords: 1-[alkyl and 2-(vinyloxy)ethyl]-5-(prop-2-yn-1-ylsulfanyl)-1H-pyrrol-2-amines, electron ionization,
chemical ionization, mass spectra, molecular ions, intramolecular cyclization, isomerization, fragmentation,
quantum chemical calculations
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019