ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 12, с. 1883-1887
УДК 542.9:547
ОКИСЛЕНИЕ ТИОАМИДОВ В АМИДЫ
С ИСПОЛЬЗОВАНИЕМ ТЕТРАХЛОРГЛИКОЛУРИЛА
И ТЕТРАБРОМГЛИКОЛУРИЛА
© 2019 г. I. Boudebouz*, S. Arrous, И. В. Парунов
ФГАОУ ВО «Национальный исследовательский Томский государственный университет»,
634050, Россия, г. Томск, пр. Ленина 36
*e-mail: imene_boudebouz@yahoo.ca
Поступила в редакцию 31 мая 2019 г.
После доработки 10 июля 2019 г.
Принята к публикации 24 октября 2019 г.
Обнаружено, что тетрабром- и тетрахлоргликолурил являются хорошими окислителями, способными
окислять тиоамиды до кислородных аналогов. Этот подход предлагает много преимуществ, таких как
хороший выход продукта, малое время реакции, простота выделения продуктов и экологичность синеза.
Соединения были получены с выходом 81-99% за время реакции, не превышающее 10-25 мин.
Ключевые слова: амид, гликолурил, окисление, тетрабромгликолурил, тетрахлоргликолурил, тиоамид,
тиогидантоин.
DOI: 10.1134/S0514749219120103
Превращение тиоамидов в их оксопроизводные
соединений в их кислородные аналоги исполь-
является важной задачей в органической химии.
зуются такие соединения, как бензолселениновый
Несомненно, амиды являются одной из наиболее
ангидрид [3], диметилсульфоксид/йод [4], соеди-
важных групп соединений в органической химии,
нения, содержащие NO+ [5], глинафен [6], п-нитро-
поскольку они могут быть дегидратированы до
бензальдегид/триметилсилил трифторметансуль-
нитрилов, гидролизованы до карбоновых кислот и
фонат [7], 2-нитробензолсульфонилхлорид/супер-
разложены до аминов, содержащих на один атом
оксид калия [8], диоксид марганца [9], периодат
углерода меньше, по реакции Хофмана. Амиды
тетрабутиламмония
[10], перманганат калия в
активно используются в агрохимикатах, инсек-
мокрым кремнеземе [11]. Однако, некоторые из
тицидах, синтезе полимеров и фармацевтических
этих методов имеют определенные ограничения,
средств, а также в огромном количестве приме-
такие как длительное время реакции и низкие
няются в качестве биологически активных веществ
выходы продуктов [8], токсичные или дорогие
[1], составляя около 25% коммерчески доступных
реагенты [3, 5] и трудоемкие методики получения
лекарств [2]. Для превращения тиокарбонильных
[3, 5, 7].
O
O
Br
Br
Cl
Cl
N N
N N
N N
N N
Br
Br
Cl
Cl
O
O
ТБГУ
ТХГУ
Тетрабромгликолурил (ТБГУ/TBG) и тетрахлоргликолурил (ТХГУ/TCG).
1883
1884
BOUDEBOUZ и др.
Схема 1.
S
O
TBG/TCG
HN NH
ROH, 40°C
HN NH
Большая группа N-галоген реагентов широко
Изучено влияние ТБГУ и ТХГУ на ход реакции.
используется в органическом синтезе и в химии
В реакции тиоамида
1а с ТБГУ выход соот-
природных соединений [12]. N-галогенированные
ветствующего амида 1b составил 95%, при време-
гликолурилы, такие как тетрабромгликолурил и
ни реакции в 15 мин, в то время как реакция окис-
тетрахлоргликолурил (см. рисунок), относятся к
ления тиоамида 5b, имеющего 2 группы C=S,
классу соединений, в которых атомы галогена
протекала в течение 25 мин с выходом амида 5b в
связаны с атомами азота гликолурила.
92%.
До сих пор нет сведений о применении ТБГУ и
Однако в случае ТБГУ, кроме выхода в 90-99%,
ТХГУ при окислении тиоамидов. В настоящем
все реакции были завершены в течение 10-20 мин
исследовании приведен простой метод окисления
для всех тиоамидов. При этом для окисления всех
тиоамидов с помощью ТБГУ и ТХГУ при тем-
тиоамидов использовали 0.4 моль ТБГУ или ТХГУ
пературе 40°C (схема 1).
на один моль тиоамида.
В литературе отсутсвуют работы, связанные
Чтобы продемонстрировать преимущество и
сокислением тиоамидов
1-6а до их соответст-
эффективность ТБГУ и ТХГУ по сравнению с
вующих оксопроизводных, за исключением соеди-
указанными реагентами для окисления тиоамидов
нения 4а, которое было получено в предыдущих
в амиды, проведено сравнение результатов окис-
исследованиях с использованием периодата тетра-
ления с испоьзованием ТБГУ и ТХГУ с другими
бутиламмония [14] и транс-3,5-дигидроперокси-
известными окислителями [14] и [15]. В качестве
3,5-диметил-1,2-диоксолана [15]. Кислородсодер-
соединения сравнения использовали барбитуровую
жащие аналоги 1-6b выбранных тиоамидов обла-
кислоту для окислния тиоамидов в амиды (табл. 1).
дают рядом практичных свойств [16-19]. В данном
Таким образом, ТБГУ и ТХГУ являются высоко-
исследовании изучена мягкая и эффективная
эффективными и мягкими агентами в реакциях
конверсия циклических тиоамидов в соответст-
окисления тиоамидов и тиомочевин. Таблица
2
вующие оксосоединения с использованием ТБГУ и
показывает, что ТБГУ по сравнению с ТХГУ
ТХГУ, синтезированных в соответствии с
обладает большей реакционной способностью
описанными методами [20, 21]. Как показано в
(меньшее время реакции и высокие выходы).
табл. 1, различные тиоамиды реагировали с ТБГУ и
ТХГУ при 40°C с получением соответствующих
Продемонстрирована полезность ТБГУ и ТХГУ
амидов. Как видно из табл. 2, реакции проводили в
в качестве эффективных, коммерчески доступных,
течение 10-25 мин, и желаемые продукты полу-
экологически и экономически активных окис-
чали с выходом (81-99%). Окисление ТБГУ и ТХГУ
лителей для окисления циклических тиоамидов до
протекает гетерогенно в нейтральных условиях. Вы-
их соответствующих амидов. Таким образом,
деление продуктов окисления является простым и
описан новый, мягкий, простой и очень удобный
состоит в фильтрации непрореагировавших ве-
метод с высокими выходами, малым временем
ществ с последующим упариванием растворителя.
реакции.
Таблица 1. Окислительная способность ТБГУ, ТХГУ, тетра-п-бутиламмониум иодата, транс-3,5-дигидроперокси-3,5-
диметил-1,2-диоксолана в реакциях окисления тиоаминов в амины.
№
Реагенты
Условия реакции
Время, мин
Выход, %
1
ТБГУ
EtOH, 40°C
10
92
2
ТХГУ
EtOH, 40°C
20
88
3
n-Bu4N+ IO4-
CH2Cl2:CH3CN (1:1), rt
120
86
4
DHPDMDO
CH3CN, rt
10
85
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
ОКИСЛЕНИЕ ТИОАМИДОВ В АМИДЫ С ИСПОЛЬЗОВАНИЕМ ТЕТРАХЛОРГЛИКОЛУРИЛА
1885
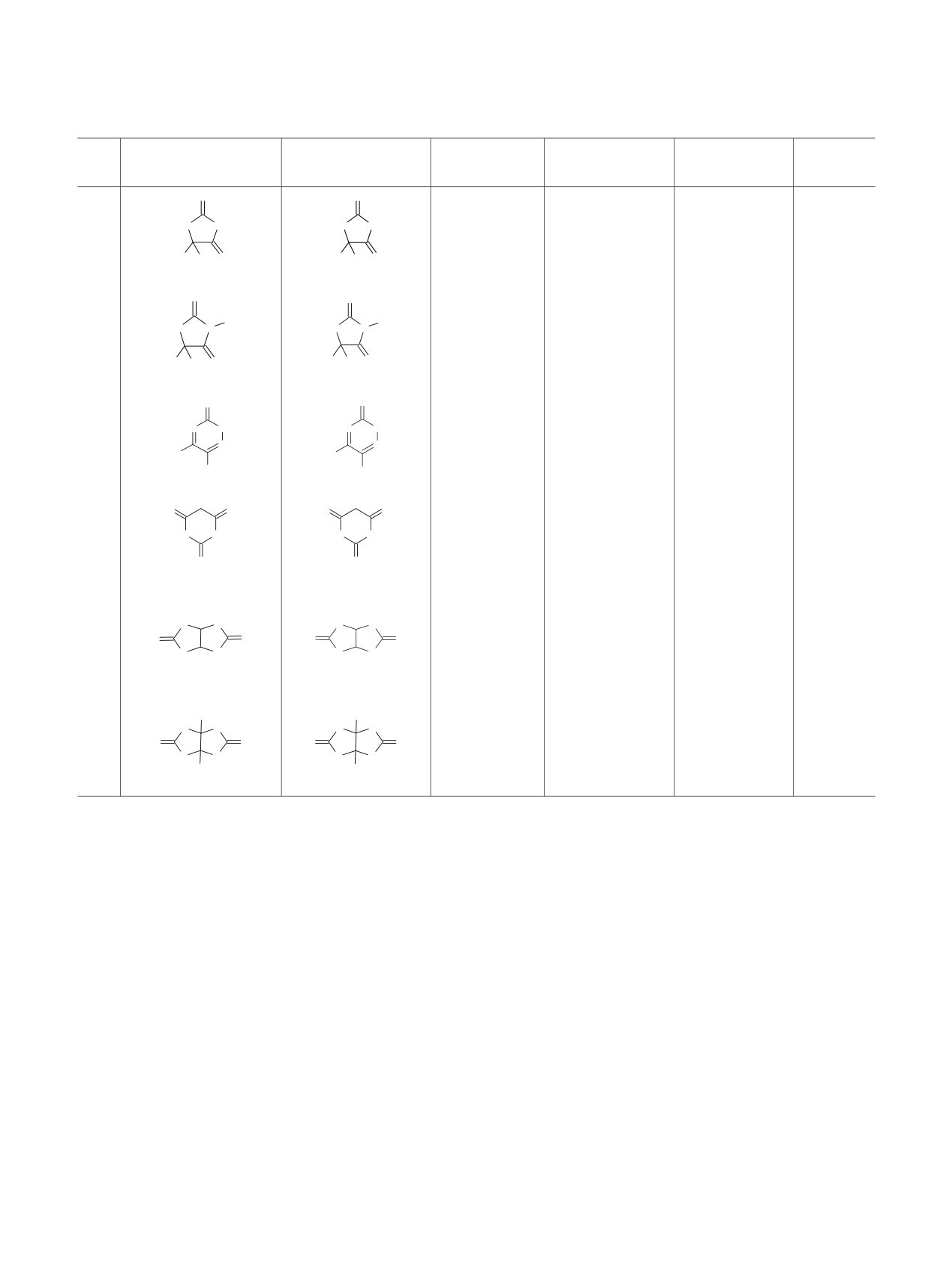
Таблица 2. Окисление тиоамидов с ТБГУ и ТХГУ.
Время, мин
Выход, %
№
Субстрат
Продукт
Растворитель
Ссылка
ТБГУ/ТХГУ
ТБГУ/ТХГУ
S
O
HN
NH
HN
NH
1
EtOH
10/15
99/95
[16, 22]
Ph Ph
O
Ph Ph
O
1a
1b
S
O
Ph
Ph
HN
N
HN
N
2
EtOH
10/20
90/86
[23]
Ph Ph
O
PhPh
O
2a
2b
S
O
N
NH
N
NH
3
N
N
EtOH
10/15
91/82
[24, 18]
Ph
Ph
Ph
Ph
3a
3b
O
O
O
O
HN
NH
HN
NH
4
EtOH
10/20
92/88
[25]
S
O
4a
4b
H
H
H
H
N
N
N
N
S
S
O
O
5
N
N
N
N
EtOH
15/25
96/92
[26]
H
H
H
H
5a
5b
H
Ph
H
H
Ph
H
N
N
N
N
S
S
O
O
6
N
N
N
N
MeOH
20/25
90/81
[26]
H
Ph
H
H
Ph
H
6a
6b
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
продуктов с использованием метода высокого ослаб-
ленного полного отражения в спектрометре Bruker
ЯМР-анализ проводили с использованием ЯМР-
Tensor 27 FTIR. Спектры записывали в диапазоне от
спектрометра Bruker AVANCE 400 III HD (Bruker,
400 до 4000 см-1 с разрешением 4 см-1 за 16 сканов.
Billerica, MA, USA). Одномерные спектры были
Температура плавления определялась в открытых
записаны на ядрах атомов 1H (частота 400.17 МГц)
капиллярах с использованием аппарата Бучи.
и 13C (частота 100.63 МГц) для подтверждения
ТБГУ и ТХГУ были получены согласно
структуры. Химические сдвиги (δ) представлены
методике [27], бромированием и хлорированием
относительно пика тетраметилсилана, установ-
гликолурила с использованием молекулярного
ленного на уровне 0.00 м.д. В случае мультиплетов
брома и хлора соответственно.
сигналы сообщаются как интервалы. Принятые сок-
ращения: с - синглет; д - дублет; т - триплет; м -
Общая методика конверсии тиоамидов в
мультиплет. Константы связи были выражены в
амиды. К раствору тиоамида (1 моль) в 10 мл
Гц. Инфракрасные спектры с Фурье-преобразо-
растворителя (табл.
2) добавляли ТБГУ/ТХГУ
ванием (FTIR) были получены непосредственно из
(0.4 моль). Во время добавления ТБГУ/ТХГУ цвет
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
1886
BOUDEBOUZ и др.
реакционной смеси становился светло-желтым.
Тетрагидроимидазо[4,5-d]имидазол-2,5(1H,3H)-
Смесь перемешивали при комнатной температуре в
дион (5b). Выход ТБГУ/ТХГУ 96/92%. Белое твер-
течение 10-25 мин. О завершении реакции свиде-
дое вещество, т.пл. >300°C [26]. ИК спектр (KBr),
тельствовало исчезновение желтого цвета раст-
νmax, см-1: 3203 (NH), 2866 (CH), 1679 (C=O).
вора. Полученную смесь фильтровали для удале-
Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 7.18 с (4H,
ния осадка гликолурила, после чего раствор упари-
NH), 5.16 с (2H, CH). Спектр ЯМР 13C (ДМСО-d6),
вали. Полученное твердое вещество отфильтро-
δ, м.д.: 161.21, 65.05.
вывали, промывали водой. В результате реакций
3a,6a-Дифенилпергидроимидазо[4,5-d]имида-
получали соответствующие карбонильные соеди-
зол-2,5-дион (6b). Выход ТБГУ/ТХГУ 90/81%. Белое
нения.
твердое вещество, т.пл. 373-378°C [26]. ИК спектр
Структуры полученных продуктов были уста-
(KBr), νmax, см-1: 3221 (NH), 2829 (CH), 1676 (C=O),
новлены на основе их физических и спектроско-
1491 (C=C). Спектр ЯМР 1H (ДМСО-d6), δ, м.д.:
пических (ИК, ЯМР 1Н и 13С) исследований. Резуль-
7.75 с (4H, NH), 7.05 м (10Hаром). Спектр ЯМР 13C
таты анализов совпали с литературными данными.
(ДМСО-d6), δ, м.д.: 161.18, 138.73, 128.23, 127.80,
[16, 18, 22-26].
127.48, 82.24.
5,5-Дифениламидазолидин-2,4-дион
(1b).
КОНФЛИКТ ИНТЕРЕСОВ
Выход ТБГУ/ТХГУ 99/95%. Белое твердое ве-
щество, т.пл. 293-298°C [16, 22]. ИК спектр (KBr),
Авторы заявляют об отсутствии конфликта
νmax, см-1: 3198 (NH), 3070 (CH), 1714, 1694 (C=O),
интересов.
1493 (C=C) 1241 (C-N). Спектр ЯМР 1H (ДМСО-
d6), δ, м.д.: 11.12 с (1H, NH), 9.33 с (1H, NH), 7.32-
СПИСОК ЛИТЕРАТУРЫ
7.42 м (10Hаром). Спектр ЯМР 13C (ДМСО-d6), δ,
м.д.:
175.29,
156.46,
140.36,
128.98,
127.04,
1. (a) Greenberg A., Breneman C.M., Liebman J.F. The
70.67.
Amide Linkage: Structural Significance in Chemistry,
3,5,5-Трифенилимидазолидин-2,4-дион
(2b).
Biochemistry, and Materials Science. New York:
Выход ТБГУ/ТХГУ 90/86%. Белое твердое ве-
Wiley-Interscience.
2000; (b) Humphrey J.M.,
Chamberlin A.R. Chem. Rev. 1997, 97, 2243. doi
щество, т.пл. 200-203°C [23]. ИК спектр (KBr),
10.1021/cr950005s
νmax, см-1: 3178 (NH), 3103 (CH), 1714, 1772 (C=O),
2. (a) Lundberg H., Tinnis F., Selander N., Adolfsson H.
1394 (C-N), 1489 (C=C). Спектр ЯМР 1H (ДМСО-
Chem. Soc. Rev.
2014,
43,
2714. doi
10.1039/
d6), δ, м.д.: 9.98 с (1H, NH), 7.39-7.51 м (10Hаром).
C3CS60345H; (b) Chaudhari P.S., Salim S.D., Sawant R.V.,
Спектр ЯМР 13C (ДМСО-d6), δ, м.д.: 172.80, 154.68,
Akamanchi K.G. Green Chem. 2010, 12, 1707. doi
140.01,
132.14,
129.42,
129.17,
128.41,
127.37,
10.1039/c0gc00053a
127.25, 69.62.
3. Cussans N.J., Ley S.V., Barton D.H.R. J. Chem. Soc.
5,6-Дифенил-1,2,4-триазин-3(2H)-он (3b). Вы-
Perkin Trans.
1.
1980,
1,
1650. doi
10.1039/
ход ТБГУ/ТХГУ 91/82%. Белое твердое вещество,
P19800001650
т.пл. 170-174°C [24, 18]. ИК спектр (KBr), νmax, см-1:
4. Mikolajczyk M., Luczak, J. Synthesis. 1975, 114. doi
3197 (NH), 1659 (C=O), 1561 (C=C), 1445(C=N),
10.1055/s-1975-23679
1369 (C-N). Спектр ЯМР 1H (ДМСО-d6), δ, м.д.:
5. Jorgensen K.A., Ghattas A.B.A.G., Lawesson, S.O.
Tetrahedron. 1982, 38, 1163. doi 10.1016/0040-4020
8.75 с (1H, NH), 7.25-7.45 м (10Hаром). Спектр ЯМР
(82)85099-0
13C (ДМСО-d6), δ, м.д.: 167.78, 153.87, 142.82,
6. Chalais S., Cornelis A., Laszlo P., Mathy A.
136.22,
134.98,
131.30,
129.78,
129.34,
129.28,
Tetrahedron Lett. 1985, 26, 2327. doi 10.1016/S0040-
128.66, 128.50.
4039(00)95088-3
Пиримидин-2,4,6(1H,3H,5H)-трион
(4b). Вы-
7. Ravindranathan T., Chavan S.P., Awachat M.M.,
ход ТБГУ/ТХГУ 92/88%. Белое твердое вещество,
Kelkar S.V.A. Tetrahedron Lett. 1995, 36, 2277. doi
т.пл. 245-247°C [25]. ИК спектр (KBr), νmax, см-1:
10.1016/0040-4039(95)00189-J
3189 (NH), 1751, 1684 (C=O). Спектр ЯМР 1H
8. Kim Y.H., Chung B.C., Chang H.S. Tetrahedron Lett.
(ДМСО-d6), δ, м.д.: 11.12 с (1H, NH), 3.45 с (2H,
1985, 26, 1079. doi 10.1016/S0040-4039(00)98517-4
CH2). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.: 168.24,
9. Radha R.R., Rahman M.F., Bhalerao U.T. Tetrahedron.
152.13, 40.47.
1992, 48, 1953. doi 10.1016/S0040-4020(01)88517-3
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019
ОКИСЛЕНИЕ ТИОАМИДОВ В АМИДЫ С ИСПОЛЬЗОВАНИЕМ ТЕТРАХЛОРГЛИКОЛУРИЛА
1887
10. Pourali A.R. Monatsh. Chem. 2005, 136, 733. doi
19. Addiscott T.M. Thomas V.H. Chem. Ind. 1979, 29.
10.1007/s00706-005-0289-8
20. Frank S., Alfred H., Irving R. J. Org. Chem. 1960, 25,
11. Masoud N.E., Majid M., Iraj M.B., Mohammad H.B.
660. doi 10.1021/jo01074a619
Phosphorus, Sulfur, Silicon.
2009,
184,
141. doi
21. Yagovkin A.Y., Bakibaev A.A., Filimonov V.D. Пат.
10.1080/10426500802080865
1675300 (1991), СССР.
12. Kolvari E., Choghamarani A.G., Salehi P., Shirini, F.
22. Fernand A.G., Salomé S.D.K., Coco N.K., Giulio G.M.,
Zolfigol, M.A. J. Iran. Chem. Soc. 2007, 4, 126. doi
Didier M.L., Géorges C.A., Moudachirou M.,
10.1007/BF03245963
Jacques H.P. Afr. J Pure Appl. Chem. 2011, 5, 168.
13. Paterson O. Пат. 3071591 (1963), США.
23. Giulio G.M., Johan W., Gerhard K.E.S., Wolfgang P., J
14. Pourali A.R. Monatsh. Chem. 2005, 136, 733. doi
acques H.P., Didier M.L. J. Med. Chem. 2005, 48, 7486.
10.1007/s00706-005-0289-8
doi 10.1021/jm0503906
15. Azarifar D., Golbaghi M. J. Sulfur Chem. 2016, 37, 1.
24. Mara E.F.B., Hugo T.S.B., Marciana P.U., Carla C.C.,
doi 10.1080/17415993.2015.1082181
Marcelo S. J. Braz. Chem. Soc. 2008, 19, 909. doi
16. Abhijit K., Sampada J., Rajesh O. E-J. Chem. 2011, 8,
10.1590/S0103-50532008000500015
S47. doi 10.1155/2011/159430
25. Mohammadpoor B., Memarian H.R., Hajipour A.R.,
17. Muccioli G.G., Wouters J., Charlier C., Scriba G.K.E.,
Bahrami K. Bull. Korean Chem. Soc. 2003, 24, 1002.
Pizza T., Pace P.D., Martino P.D., Poppitz W.,
doi 10.5012/bkcs.2003.24.7.1002
Poupaert J.H., Lambert D.M. J. Med. Chem. 2006, 49,
26. Esmail V., Mehdi D.E., Zahra A., Morteza R. Green
872. doi 10.1021/jm050484f
Chem. Lett. Rev.
2014,
7,
119. doi
10.1080/
18. Pooja M., Suroor A.K., Tauseef B., Surajpal V.,
17518253.2014.895865
Darpan K., Ozair A. Acta Pol. Pharm. Drug Res. 2009,
27. Slezaka F., Irsch L., Sen I. J. Org. Chem. 1960, 25, 660.
66, 379.
doi 10.1021/jo01074a619
Oxidation of Thioamides to Amides Using Tetrachloroglycoluril
and Tetrabromoglycoluril
I. Boudebouz*, S. Arrous, and I. V. Parunov
National Research Tomsk State University, 634050, Russia, Tomsk, pr. Lenina 36
*e-mail: imene_boudebouz@yahoo.ca
Received May 31, 2019; revised July 10, 2019; accepted October 24, 2019
Tetrabromo and tetrachloroglycoluril were found to be good oxidizing agents, which transfer thioamides into
their oxygen analogues. This approach offers many advantages such as good product yields, short reaction time,
easy isolation of products and environmentally benign reaction conditions. The products were obtained with
good to excellent yield 81-99% within short reaction times 10-25 min.
Keywords: amide, glycoluril, oxidation, thioamide, tetrabromoglycoluril, tetrchloroglycoluril
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 12 2019