ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, Том 55, № 2, с. 192-197
УДК 547.655.6
КИСЛОТНО-КАТАЛИЗИРУЕМАЯ
ГЕТЕРОЦИКЛИЗАЦИЯ ТИОГЛЮКОЗИДОВ
ТРИАЛКИЛНАФТАЗАРИНОВ В АНГУЛЯРНЫЕ
ХИНОН-УГЛЕВОДНЫЕ ТЕТРАЦИКЛЫ
© 2019 г. Ю. Е. Сабуцкий, В. А. Денисенко, Р. С. Попов, С. Г. Полоник*
«Тихоокеанский институт биоорганической химии им. Г.Б. Елякова ДО РАН»,
690022, Россия, г. Владивосток, Проспект 100 лет Владивостоку 159
*e-mail: sergpol@piboc.dvo.ru
Поступила в редакцию 31 августа 2018 г.
После доработки 4 сентября 2018 г.
Принята к публикации 6 сентября 2018 г.
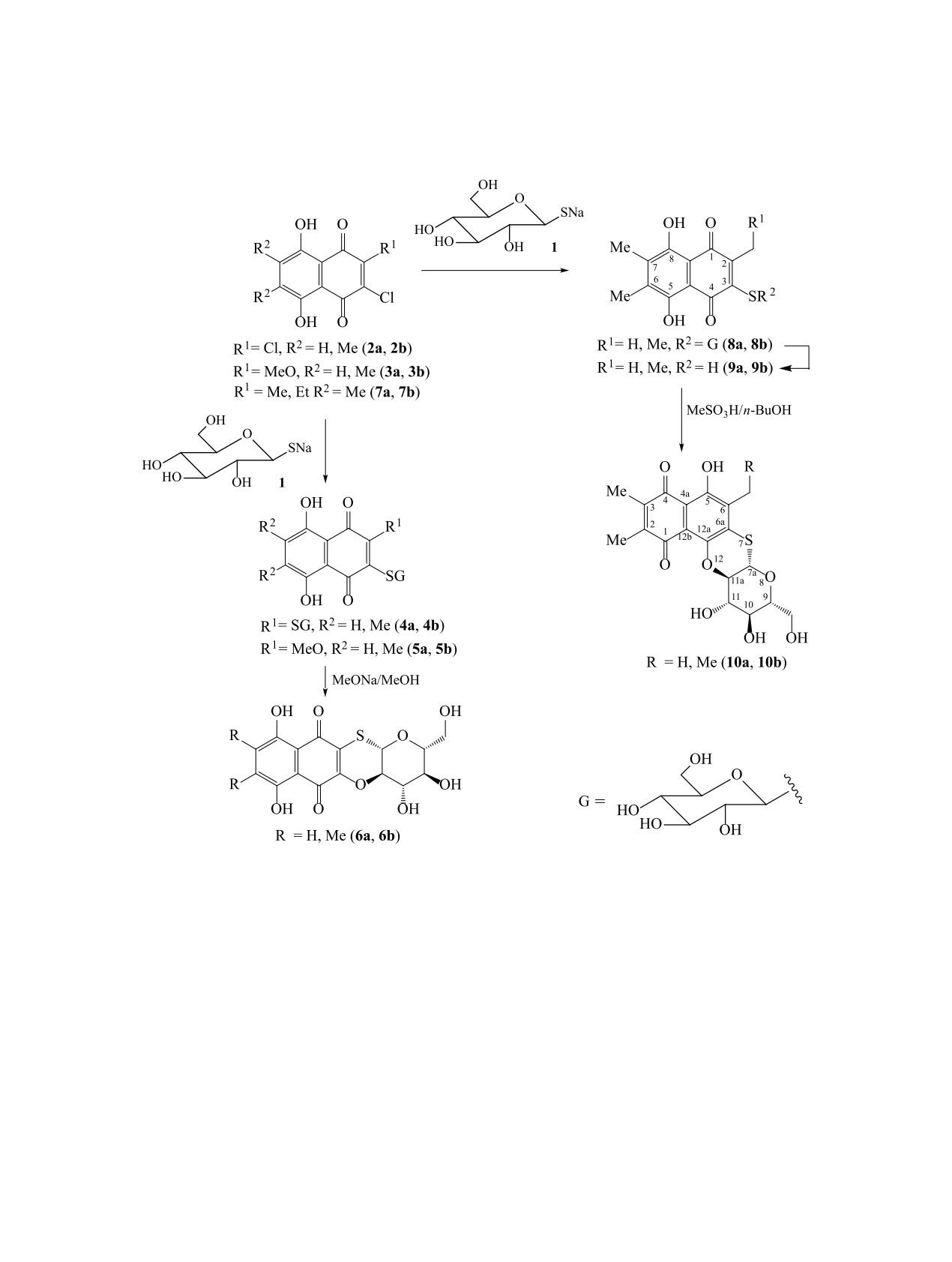
Внутримолекулярной конденсацией тиоглюкозидов триалкилнафтазаринов в растворе кипящего н-бута-
нола и метансульфокислоты впервые получены тетрациклические нафтохинон-углеводные конъюгаты
с ангулярным сочленением гетероцикла. Конкурирующей реакцией является гидролиз тиоглюкозидной
связи и образование триалкилмеркаптонафтазаринов.
Ключевые слова: 1,4-нафтохиноны, нафтазарины, S-тиоглюкозиды, гетероциклизация, тетрацикли-
ческие конъюгаты 1,4-нафтохинонов, меркапто-1,4-нафтохиноны.
DOI: 10.1134/S0514749219020046
1,4-Нафтохиноны широко распространены в
вращаются в углеводные конъюгаты 6a, 6b с вы-
природе [1]. Вещества этой группы проявляют ан-
ходом 75-81% [13] (cхема 1). Ранее, аналогич-
тибактериальную [2], кардиопротективную [3] и
ные конъюгаты
1,4-нафтохинона, полученные
противоопухолевую активность [4, 5]. Широкий
на основе 1-меркапто производных D-галактозы,
спектр биологического действия делает эту груп-
D-маннозы, D-ксилозы и L-арабинозы [14], изуча-
пу соединений перспективной для поиска новых
лись на модели промиелоцитарной лейкемии че-
веществ-лидеров для целей медицинской химии
ловека HL-60 [15]. Было показано, что линейные
[6, 7]. Нафтохиноны часто обладают плохой рас-
тетрациклические конъюгаты и их ацетилпроизво-
творимостью, что затрудняет их практическое
дные проявляют цитотоксическую активность in
использование. Конъюгация хинонов с нетоксич-
vitro в концентрациях 1.0-5.0 мкM, при этом ис-
ными углеводами позволяет улучшить их раство-
ходные ациклические ацетилтиогликозиды были в
римость и приводит к новым структурам с новыми
10-100 раз менее активны. Известно, что замещен-
видами биологической активности [8-12]. В ходе
ные нафтазарины существуют в различных тауто-
нашего исследовательского проекта по конъюга-
мерных формах, которые реагируют с образовани-
ции нафтохинонов с углеводами мы конденсиро-
ем отличающихся продуктов реакции [16]. Поэто-
вали натриевую соль β-D-глюкопиранозы (1) с
му, можно ожидать, что в определенных условиях
замещенными хлорпроизводными нафтазарина
тиогликозиды нафтазарина могут циклизоваться в
(5,8-дигидрокси-1,4-нафтохинона) 2a, 2b-3a, 3b и
ангулярные тетрациклы.
получили моно- и дитиоглюкозиды 4a, 4b-5a, 5b,
Здесь мы сообщаем о первом синтезе тетра-
которые под действием MeONa/MeOH легко пре-
циклических нафтазарин-углеводных конъюгатов
192
КИСЛОТНО-КАТАЛИЗИРУЕМАЯ ГЕТЕРОЦИКЛИЗАЦИЯ ТИОГЛЮКОЗИДОВ
193
Схема 1.
с ангулярным сочленением гетероцикла. Для того,
высокого разрешения. Появление в спектрах этих
чтобы исключить образование тетрацикла линей-
веществ четырех сигналов гидроксильных групп
ного строения, для синтеза были взяты хлоралкил-
D-глюкозы при сохранении сигналов двух α-ги-
нафтазарины 7a, 7b, в которых эта возможность
дроксильных групп нафтазаринового ядра и ал-
блокирована алкильным заместителем. Хлорал-
кильных заместителей указывает на образование
килнафтазарины 7a, 7b (1 ммоль) конденсирова-
тиоглюкозидной связи. 1',2'-транс-(β)-Конфигура-
ли с солью тиоглюкозы 1 (1.1 ммоль) в растворе
ция тиоглюкозидной связи в в соединения 8a, 8b
ацетона-МеОН в течении 5 ч и получили тиоглю-
подтверждается величиной КССВ аномерных про-
козиды нафтазарина 8a, 8b с выходом 95-96%
тонов (J1',2' 9.5-9.6 Гц), наблюдаемых в спектрах в
(схема 1). Строение вновь полученных тиоглюко-
спектрах ПМР при 5.13-5.19 м.д.
зидов 8a, 8b подверждается данными ИКС, ЯМР
Гетероциклизацию полученных тиоглюкозидов
1Н и 13С спектроскопии и масс-спектрометрии
8a, 8b проводили в смеси кипящего н-бутанола и
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
194
САБУЦКИЙ и др.
Схема 2.
метансульфокислоты (5 : 1 v/v). В течении 0.5 ч
веществ кроме дублета аномерного протона при
исходные глюкозиды превращались в окрашенные
5.16-5.17 м.д. с КССВ (J 9.1-9.2 Гц) наблюдали
продукты реакции с Rf 0.95(B) и Rf ~ 0.4(B), кото-
только три сигнала протонов гидроксильных групп
рые выделили препаративной ТСХ. По данным
глюкозы, проявляющихся в виде уширенных од-
масс-спектрометрии высокого разрешения мало-
нопротонных синглетов. В области слабого поля,
полярные вещества отвечали брутто формулам
где резонируют протоны α-гидроксильных групп
С13Н12О4S и С14Н14О4S. В спектрах ЯМР 1Н этих
нафтазаринового кольца, в спектрах ПМР вновь
соединений наблюдали сигналы трех алкильных
выделенных полярных веществ наблюдали един-
групп, два сигнала протонов в области 10-13 м.д.,
ственный синглет α-гидроксильной группы, про-
которые характерны для α-гидроксильных групп
являющийся при 13.16-13.18 м.д., что указывает
нафтазаринового кольца, и новый однопротонный
на включение другого α-гидроксила нафтазарина
синглет при ~5.3 м.д., который легко обменивал-
в оксатииновый цикл и позволяет приписать этим
ся на дейтерий. Совокупность данных ИКС, ЯМР
соединениям структуру ангулярного тетрацикла
спектроскопии и масс-спектрометрии позволила
10a, 10b.
приписать эти веществам строение меркаптонаф-
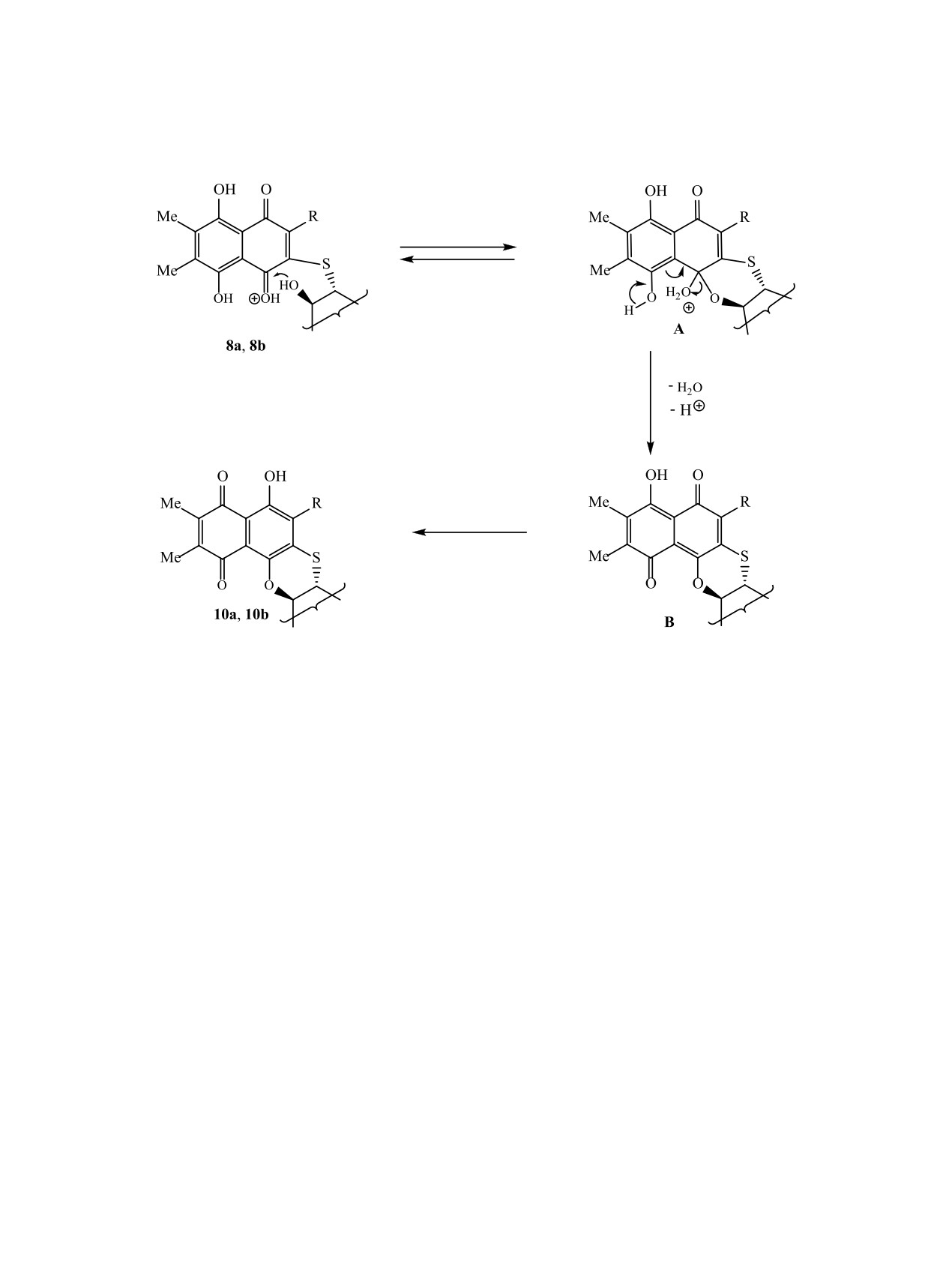
Гетероциклизация тиогликозида 8a, 8b проте-
тазаринов 9a, 9b - продуктов кислотного гидроли-
кает как 1,2-присоединение С2'-OH гидроксильной
за тиоглюкозидов.
группы к протонированному хиноидному карбо-
ЯМР спектры полярных соединений содержали
нилу с образованием гемиацеталя А. Последую-
сигналы нафтазаринового агликона и D-глюкозы.
щая дегидратация гемиацеталя А приводит к не-
Однако, в области 4.2-5.5 м.д., в которой проявля-
устойчивому интермедиату В, который, после пе-
лись сигналы аномерного протона и 4-х протонов
ремещения протона и двойных связей, превраща-
углеводных гидроксильных групп исходных тио-
ется в стабильный ангулярный тетрацикл 10a, 10b
глюкозидов 8a, 8b, в спектрах вновь полученных
(схема 2).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
КИСЛОТНО-КАТАЛИЗИРУЕМАЯ ГЕТЕРОЦИКЛИЗАЦИЯ ТИОГЛЮКОЗИДОВ
195
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
245°С. 1Н ЯМР (500 МГц, ДМСО-d6): 2.19 с (6H,
С6-Ме и С7-Me), 2.34 с (3Н, С2-Ме), 3.04 м (1Н,
Температуры плавления измерены на столи-
Н5'), 3.07 м (1Н, Н4'), 3.12 м (1Н, Н2'), 3.19 м (1Н,
ке Боэтиуса и не исправлены. ИК-спектры запи-
Н3'), 3.32 м (1Н, Н6'), 3.49 м (1Н, Н6'), 4.25 т (1Н,
саны на Фурье-спектрофотометре «Vector-22» в
J 5.7 Гц, С6'-ОН), 4.90 д (1Н, J 5.2 Гц, С4'-ОН),
KBr и CHCl3. Спектры ЯМР записывали в раство-
5.08 д (1Н, J 5.0 Гц, С3'-ОН), 5.13 д (1Н, J 9.6 Гц,
рах СDCl3 и ДМСО-d6 на спектрометрах «Bruker
Н1'), 5.39 д (1Н, J 6.1 Гц, С2'-ОН), 13.23 с (1Н, С8-
DRX-500» и «Avance III-700 Bruker» с рабочей ча-
ОН), 13.24 с (1Н, С5-ОН). 13C ЯМР (ДМСО-d6,
стотой 500 и 700 МГц для 1Н и 125 и 176 МГц для
125 МГц): 12.2 (2Ar-Ме), 15.0 (С2-Ме), 60.9 (С6'),
13С. Химические сдвиги приведены в м.д. в шка-
69.9 (С4'), 74.9 (С2'), 78.1 (С3'), 81.4 (С5'), 85.0 (С1'),
ле δ относительно ТМС. КССВ (J) даны в герцах.
108.8 (С10), 109.1 (С9), 139.8 (С6), 139.9 (С7), 140.5
Двумерные зксперименты ЯМР (COSY, NOESY,
(С3), 146.3 (С2), 167.8 (С8), 167.9 (С5), 173.5 (С1),
174.0 (С4). ИК спектр (KBr): 3520 (OH), 3470
HSQC, HSQC-TOSCY, HMBC) выполняли по стан-
(OH), 3413 (OH), 2920, 1635 (C=O), 1619 (C=O),
дартным методикам при комнатной температуре.
1432, 1402, 1377, 1356, 1273, 1242, 1975, 1044, 870,
Масс спектры высокого разрешения определены
820 cм-1. Масс-спектр высокого разрешения (ESI):
на приборе «Agilent 6510 Q-TOF LC/MS» в режи-
m/z [M - H]-. Вычислено для C19H21O9S 425.0912,
ме регистрации отрицательно заряженных ионов
найдено 425.0911.
[M - H]-. Аналитическую ТСХ проводили на пла-
стинках марки Silufol. Для уменьшения остаточ-
5,8-Дигидрокси-3-(β-D-глюкопиранозил-
ной адсорбции хинонов хроматографические пла-
1-тио)-6,7-диметил-2-этилнафталин-1,4-дион
стинки Silufol предварительно насыщали парами
(8a). Выход 439 мг (96%), Rf 0.63(A), т.пл. 214-
НСl. Индивидуальные вещества выделяли препа-
216°С. 1H ЯМР (700 МГц, ДМСО-d6): 1.08 т (3Н,
ративной ТСХ (ПТСХ) на стеклянных пластинах
J 7.0 Гц, СН3СН2), 2.18 с (6H, С6-Ме и С7-Me),
20 × 25 см на силикагеле Merck 40-60 μ. Для ТСХ
2.85 м (1Н, СН3СН2), 2.92 м (1Н, СН3СН2), 3.03 м
использовали системы растворителей: система (А)
(1Н, Н5'), 3.08 м (1Н, Н4'), 3.12 м (1Н, Н2'), 3.19 м
бензол-этилацетат-метанол (2 : 1 : 1 v/v), система
(1Н, Н3'), 3.32 м (1Н, Н6'), 3.47 м (1Н, Н6'), 4.21 т
(В) бензол-этилацетат-МеОН (7 : 4 : 2 v/v) и си-
(1Н, J 5.6 Гц, С6'-ОН), 4.93 д (1Н, J 5.7 Гц, С4'-ОН),
стема (С) гексан-бензол-хлороформ (9 : 3 : 3 v/v).
5.11 д (1Н, J 4.9 Гц, С3'-ОН), 5.19 д (1Н, J 9.5 Гц,
Исходные хлортриалкилнафтазарины были полу-
Н1'), 5.42 д (1Н, J 6.4 Гц, С2'-ОН), 13.25 с (1Н, С8-
чены хлорированием соответствующих триалкил-
ОН), 13.29 с (1Н, С5-ОН). 13C ЯМР (ДМСО-d6,
нафтазаринов [17].
176 МГц): 12.3 (2 × Ме), 13.1 (Ме), 60.9 (С6'), 70.0
(С4'), 75.0 (С2'), 78.1 (С3'), 81.5 (С5'), 84.8 (С1'), 108.9
Конденсация триалкилхлорнафтазаринов
(С10), 109.4 (С9), 139.6 (С6), 140.1 (С7), 140.3 (С3),
(7a, 7b) с натриевой солью D-тиоглюкозы (1).
151.3 (С2), 169.3 (С8), 169.4 (С5), 171.9 (С1), 172.9
Хлорнафтохинон 7a, 7b (1.00 мМ) растворили в
(С4). ИК спектр (KBr): 3550 (OH), 3461 (OH), 3411
ацетоне (60 мл), добавили МеОН (60 мл), тиоглю-
(OH), 2938, 1637 (C=O), 1615 (C=O), 1597 (C=C),
козу 1 240 мг (1.10 мМ) и перемешивали 5 ч при
1454, 1395, 13377, 1342, 1303, 1231, 1092, 1074,
комнатной температуре до превращения исход-
1050, 822 см-1. Масс-спектр высокого разреше-
ного хинона 7a, 7b с Rf 0.95 (А) в новый красный
ния (ESI): m/z [M - H]-. Вычислено для C20H23O9S
продукт реакции с Rf 0.63 (А). Отфильтровали
439.1068, найдено 439.1069.
неорганические соли, осадок промыли ацетоном.
Фильтрат упарили в вакууме, из остатка препа-
Гетероциклизация тиоглюкозидов нафта-
ративной ТСХ на силикагеле в системе В, выде-
зарина (общая методика). Тиоглюкозид 8a, 8b
лили гликозид, который смыли с SiO2 метанолом,
(0.25 мМ) растворили при перемешивании в смеси
растворитель удалили и получили тиоглюкозиды
10 мл н-бутанола и 2 мл MeSO3H, кипятили 30 мин с
8a, 8b.
обратным холодильником, контролируя ход реакции
ТСХ в системе (В) до превращения тиогликозида
5,8-Дигидрокси-3-(β-D-глюкопирано-
8a, 8b в продукты реакции с Rf ~ 0.92-0.95 (В) и Rf
зил-1-тио)-2,6,7-триметилнафталин-1,4-дион
~ 0.41-0.43 (В). Реакционную смесь перенесли в де-
(8a). Выход 425 мг (96%), Rf 0.63 (A), т.пл. 243-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
196
САБУЦКИЙ и др.
лительную воронку, добавили 10 мл бутанола, про-
(125 МГц): 11.9 (ArCН3), 12.3 (ArCН3), 13.1 (С3),
мыли 50 мл воды, бутанольный экстракт упарили
60.8 (СН2ОН), 70.5 (С10), 73.7 (С7а), 74.2 (С9),
в вакууме без осушки, из остатка ПТСХ в системе
79.0 (С11а), 82.1 (С11), 110.2 (С12b), 116.1 (C4a),
(С) выделили неполярный продукт реакции 9a, 9b.
128.5 (C6a), 133.51 (C6), 140.4 (C3), 145.1 (C2),
Полярную полосу на старте собрали, нанесли на
145.4 (C12a), 153.8 (C5), 181.8 (C1), 189.3 (C4). ИК
свежую пластину, проявили пластину в системе (B)
спектр (KBr): 3550 (OH), 3450 (OH), 3412 (OH),
и выделили полярный продукт 10a, 10b.
2921, 1637 (C=O), 1597 (C=C), 1559, 1448, 1398,
1373, 1299, 1267,1101, 1072, 1045, 814 см-1. Масс-
5,8-Дигидрокси-3-меркапто-2,6,7-триме-
спектр высокого разрешения (ESI): m/z [M - H]-.
тил-нафталин-1,4-дион (9a). Выход 10 мг (15%),
Вычислено для C19H19O8S
407.0806, найдено
267-269°С.
1Н ЯМР спектр
Rf 0.92 (B), т.пл.
407.0806.
(500 МГц, CDCl3): 2.25 с (3Н, ArМе), 2.26 с (3Н,
ArМе), 2.27 с (3Н, ArМе), 5.38 c (1H, ArSH),
(7aS,9R,10S,11S,11aR)-5,10,11-Тригидрокси-9- (ги-
13.05 c (1H, α-OH), 13.52 c (1H, α-OH). 13С ЯМР
дроксиметил)-2,3-диметил-6-этил-7a,10,11,11a-те-
спектр (125 МГц): 12.4 (ArCН3), 12.5 (ArCН3),
трагидро-9H-нафто[1,2-b]пирано-
14.7 (ArCН3), 108.3, 108.7, 129.5, 137.9, 138.8,
[2,3-e][1,4]оксатиин-1,4-дион
(10b).
Выход
140.2, 145.1, 161.9, 162.3, 176.4, 179.9. ИК спектр
35 мг (33%), Rf 0.43(В), т.пл. 269-271°С. 1Н ЯМР
(CHCl3): 2929, 2542 (SH), 1594 (C=O), 1569 (C=C),
спектр (700 МГц, ДМСО-d6): 1.11 т (1Н, СН2CH3,
1448, 1397, 1382, 1340, 1306, 1271, 1122, 1093
J 7.4 Гц), 2.04 с (3Н, С3-Ме), 2.05 с (3Н, С2-Ме),
см-1. Масс-спектр высокого разрешения (ESI): m/z
2.68 м (2Н, СН2СН3), 3.30 м (1Н, Н10), 3.37 м
[M - H]-. Вычислено для C13H11O4S 263.0384, най-
(1Н, Н11а), 3.50 м (2Н, Н9 и CH2OH), 3.65 м (1Н,
дено 263.0384.
Н11), 3.74 м (1H, CH2OH), 4.67 уш.с (1Н, СН2ОН),
5.02 уш.с (1Н, С10-ОН), 5.18 д (1Н, J 9.2 Гц, Н7а),
5,8-Дигидрокси-3-меркапто-6,7-диме-
5.36 уш.с (1Н, С11-ОН), 13.16 с
(1Н, С5-ОН).
тил2-этилнафталин-1,4-дион
(9b). Выход
26
13С ЯМР спектр (176 МГц): 11.4 (СН2СН3), 11.9
мг (37%), Rf 0.95 (B), т.пл. 162-163°С. 1Н ЯМР
(С2), 13.2 (С3), 20.3 (СН2СН3), 60.8 (СН2ОН), 70.5
спектр (700 МГц, CDCl3): 1.19 т (3Н, СН2CH3,
(С10), 73.6 (С7а), 74.2 (С11), 79.0 (С11а), 82.1 (С9),
J 7.5 Гц), 2.73 кв (2Н, СН2CH3, J 7.5 Гц), 2.26 с
110.5 (С12b), 116.4 (C4a), 132.6 (C6a), 134.2 (C6), 140.5
(3Н, С6-Ме), 2.27 с (3Н, С7-Ме), 5.37 c (1H, ArSH),
(C3), 145.3 (C2), 145.4 (C12a), 153.7 (C5), 181.9 (C1),
13.07 c (1H, α-OH), 13.56 c (1H, α-OH). 13С ЯМР
189.4 (C4). ИК спектр (KBr): 3550 (OH), 3486 (OH),
спектр (176 МГц): 11.3 (СН2СН3), 12.4 (ArCН3),
3412 (OH), 2921, 1635 (C=O), 1621 (C=O), 1603,
12.5 (ArCН3), 20.1 (СН2СН3), 108.4 (C10), 108.8
1556, 1433, 1402, 1356, 1276, 1237, 1131, 1105, 1065,
(C9), 137.9 (C7), 140.3 (C6), 144.2 (C3), 144.4 (C2),
1041, 918, 810 cм-1. Масс-спектр высокого разреше-
162.0 (C5), 162.3 (C8), 176.7 (C1), 179.6 (C4). ИК
ния (ESI): m/z [M - H]-. Вычислено для C20H21O8S
спектр (CHCl3): 2976, 2935, 2876, 2540 (SH), 1595
421.0963, найдено 421.0965.
(C=O), 1565 (C=C), 1451, 1395, 1340, 1303, 1382,
1098, 1273, 1046, 1016 см-1. Масс-спектр высоко-
БЛАГОДАРНОСТИ
го разрешения (ESI): m/z [M - H]-. Вычислено для
C14H13O4S 277.0540, найдено 277.0538.
Авторы приносят благодарность к.х.н.
Н.С. Полонику за предоставленные образцы
(7aS,9R,10S,11S,11aR)-5,10,11-Тригидрокси-
исходных триалкилхлорнафтазаринов.
9-(гидроксиметил)-2,3,6-триметил-7a,10,11,11a-
тетрагидро-9H-нафто[1,2-b]пирано[2,3-e]-
ФОНДОВАЯ ПОДДЕРЖКА
[1,4]-оксатиин-1,4-дион (10a). Выход 26 мг (25%),
Rf 0.41 (В), т. пл.
248-251°С. 1Н ЯМР спектр
Работа выполнена при финансовой поддержке
(500 МГц, ДМСО-d6): 2.04 с (6Н, 2 × Ме), 2.16 с
РФФИ. Проект 18-33-00492 мол_а.
(3Н, Ме), 3.31 м (1Н, Н10), 3.36 м (1Н, Н11а), 3.50 м
(2Н, СН2OН и H9), 3.64 м (1Н, Н11), 3.73 м (1Н,
КОНФЛИКТ ИНТЕРЕСОВ
СН2OH), 4.70 уш.с (1Н, СН2OH ), 5.04 уш.с, 1Н,
С10-OH), 5.17 д (1Н, Н7a, J 9.1 Гц), 5.37 уш.с, (1Н,
Авторы заявляют об отсутствии конфликта ин-
С11-OH), 13.18 с (1Н, С5-ОН). 13С ЯМР спектр
тересов.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
КИСЛОТНО-КАТАЛИЗИРУЕМАЯ ГЕТЕРОЦИКЛИЗАЦИЯ ТИОГЛЮКОЗИДОВ
197
СПИСОК ЛИТЕРАТУРЫ
10. Pelageev D.N., Dyshlovoy S.A., Pokhilo N.D., Deni-
senko V.A., Borisova K.L., von Amsberg G.K., Boke-
meyer C., Fedorov S.N., Honecker F., Anufriev V.Ph.
1. Thomson, R.H. Naturally occurring quinones IV,
Eur. J. Med. Chem. 2014, 77, 139.
Chapman & Hall; London, UK, 1997.
11. Lin H.-Y., Han H.-W., Bai L.-F., Qiu H,-Y., De-
2. Sanchez-Calvo J.M., Barbero G.R., Guerrera-Vas-
Zheng Y., Qi J.-L., Wang X.-M., Gu H.-W., Yang Y.-H.
quez G., Duran A.G., Macias M., Rodrıguez-Igle-
RSC. Adv. 2014, 4, 49796.
sias M.A., Molinillo J.M.G., Macias, F.A. Med. Chem.
Res. 2016, 25, 1274.
12. Полоник С.Г., Толкач А.М., Уварова Н.И. Изв. АН.
Сер хим. 1996, 477. [Polonik S.G., Tolkach A.M.,
3. Мищенко Н.П., Федореев С.А., Багирова В.Л. Хим.-
Uvarova N.I. Russ. Chem. Bull. Int. Ed. 1996, 45, 459.]
фарм. ж. 2003, 37, 49. [Mishchenko N.P., Fedore-
ev S.A., Bagirova V.L. Pharm. Chem. J. 2003, 37, 48.]
13. Sabutskii Y.E., Denisenko V.A., Popov R.S.,
Polonik S.G. Arkivoc 2017, iii, 302.
4. Asche C. Mini Rev. Med. Chem. 2005, 5, 449.
14. Полоник С.Г., Денисенко В.А. Изв. АН. Сер хим.
5. Wellington K.W. RSC Advances. 2015, 5, 20309.
2009,
1034.
[Polonik S.G., Denisenko V.A. Russ.
6. Klotz L., Hou X. Jacob C. Molecules. 2014, 19, 14902.
Chem. Bull. Int. Ed. 2009, 58, 1062.]
7. Constantino L., Barlocco D. Curr. Med. Chem. 2006,
15. Fedorov S.N., Shubina L.K., Kuzmich A.S.,
13, 65.
Polonik S.G. Open Glycoscience, 2011, 4, 1.
8. Полоник С.Г., Прокофьева Н.Г., Агафонова И.Г., Ува-
16. Huot R., Brassard P. Can. J. Chem. 1974, 54, 838.
рова Н.И. Хим.-фарм. ж. 2003, 37, 3. [Polonik S.G.,
17. Полоник Н.С., Полоник С.Г., Денисенко В.А., Мои-
Prokof’eva N.G., Agafonova I.G., Uvarova N.I.
сеенко О.П., Ануфриев В.Ф. ЖОрХ, 2011, 47, 1029.
Pharm. Chem. J. 2003, 37, 397.]
[Polonik N.S., Polonik S.G., Denisenko V.A., Moiseen-
9. Su Y., Xie J., Wang Y., Hub X., Lin X. Eur. J. Med.
ko O.P., Anufriev V.Ph. Russ. J. Org. Chem. 2011, 47,
Chem. 2010, 45, 2713.
1045.]
Acid-Catalyzed Beterocyclization of Trialkylnaphthazarin
Thioglucosides in Angular Quinone-Carbohydrate Tetracycles
Y. E. Sabutskii*, V. A. Denisenko, R. S. Popov, and S. G. Polonik*
Elyakov Pacific Institute of Bioorganic Chemistry, FEB RAS,
690022, Russia, Vladivostok, Prospekt 100 let Vladivostoku 159
*e-mail: chemist.518@mail.ru
Received August 31, 2018
Revised September 4, 2018
Accepted September 6, 2018
Tetracyclic naphthoquinone-carbohydrate conjugates with an angular junction of the heterocycle were obtained for
the first time by intramolecular condensation of trialkylnazarin thioglucosides in a solution of boiling n-butanol
and methanesulfonic acid. The competing reaction is the hydrolysis of the thioglucosidic bond and the formation of
trialkylmercaptonaphthazarines.
Keywords: 1,4-naphthoquinones, naphthazarines, S-thioglucosides, heterocyclization, tetracyclic conjugates of
1,4-naphthoquinones, mercapto-1,4-naphthoquinones
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019