ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, Том 55, № 2, с. 208-214
УДК 547.78:543.54:543.42
ИССЛЕДОВАНИЕ ДИАСТЕОМЕРИИ СОЕДИНЕНИЙ, В
КОТОРЫХ СТЕРЕОГЕННЫЕ ЦЕНТРЫ РАЗДЕЛЕНЫ
ДЛИННОЙ ЦЕПЬЮ
© 2019 г. В. П. Талзиa, *, С. Н. Евдокимовa, А. Л. Шацаускасb
a ФГБУН «Институт проблем переработки углеводородов», СО РАН (ИППУ СО РАН),
644040, Россия, г. Омск, ул. Нефтезаводская 54
*e-mail: vtalsi@ihcp.ru
b ФГБОУ ВО «Омский государственный технический университет» (ОмГТУ),
644050, Россия, г. Омск, пр. Мира 11
Поступила в редакцию 31 августа 2018 г.
После доработки 31 августа 2018 г.
Принята к публикации 10 сентября 2018 г.
При записи спектров ЯМР нескольких синтезированных в Омских университетах гетероциклических
соединений наблюдали проявление диастеомерии при большом (до пятнадцати связей) расстоянии
между стереогенными центрами, которое было объяснено регулярной вторичной спиральной структурой
цепи, связывающей центры.
Ключевые слова: ЯМР, диастереомерия подандов, оксазолопиридины, пирамидальная инверсия азота,
вторичная спиральная структура оксиэтильной цепи.
DOI: 10.1134/S051474921902006X
ЯМР спектроскопия
- уникальный метод
тиокарбаминовой кислоты. Стереогенным центром
исследования диастереомерии органических
в них является пирамидальный атом азота,
соединений, в молекулах которых имеются
испытывающий заторможенную инверсию,
стереогенные центры, хиральные оси и плоскости.
которая приводит к взаимному превращению
Наличие перечисленных элементов асимметрии
диастереомеров. [1].
усложняет интерпретацию спектров. Простейшим
В своей практике, применяя спектроскопию
примером является удвоение части сигналов,
ЯМР для идентификации органических соедине-
обусловленное существованием диастереомеров,
ний, мы до сих пор имели дело с влиянием стерео-
когда исследуемое соединение содержит два
генных центров на расстоянии только одной - трех
хиральных центра. При наличии только одного
связей от центров [1, 2]. Нам не встречались
стереогенного центра становятся анизохронными
примеры проявления диастереомерии в спектрах
(приобретают различные химические сдвиги)
ЯМР при большом расстоянии между хиральными
диастереотопные или прохиральные атомы,
центрами. Это не удивительно, так как хиральность
которыми являются ближайшие к хиральному
проявляется только в хиральной среде, и
центру геминальные протоны СН2-групп или
протоны и атомы углерода соседних геминальных
метильных групп
[1]. В случае соединений, в
Схема 1.
которых асимметричный центр входит в состав
OH
цикла, расщепление сигналов в спектрах ЯМР 13С
наблюдается не только для атомов углерода
O
O
геминальных метильных групп, но и для других,
C
ближайших к хиральному центру атомов углерода.
C
N
S-
Расщепление обусловлено существованием
N
S-
H
диастереомеров, которые подобны изображенным
H
на схеме 1 циклическим анионам 2-гидроксиэтил-
HO
208
ИССЛЕДОВАНИЕ ДИАСТЕОМЕРИИ СОЕДИНЕНИЙ, В КОТОРЫХ СТЕРЕОГЕННЫЕ
209
расщепление сигналов ЯМР на сигналы отдельных
от температуры их регистрации (рис.
1-4),
диастереомеров обусловлено взаимным влиянием
количество сигналов атомов углерода СН2 групп в
хиральных центров. При большом расстоянии
спектрах ЯМР 13С при 30°С или 50°С (рис. 3) и
между стереогенными центрами логично
относительная суммарная интегральная интенсив-
предположить, что разница химических сдвигов
ность протонов этих групп, определенная по
аналогичных атомов в спектрах ЯМР диа-
спектрам ЯМР
1Н, однозначно доказывают
стереомеров будет стремиться к нулю. Однако, при
предложенные симметричные структурные
исследовании подандов, представляющих собой
формулы 2-4. Отнесение сигналов в спектрах ЯМР
одинаковые ароматические молекулы, соеди-
соединений
2-4 было выполнено с учетом
ненные оксиэтильной цепью, были зафиксированы
двумерных корреляционных спектров, полученных
методом ЯМР, выделены и исследованы методом
с помощью импульсных программ HSQC, HMBC.
РСА диастереомеры, расстояние между
При -30°С наблюдается расщепление сигналов
хиральными центрами в которых превышает десять
почти всех углеродов в спектрах ЯМР
13С
связей [3-5]. У авторов указанный факт удивления
соединений 3 и 4 (рис. 3) за исключением атомов
не вызвал, хотя разделение диастереомеров, в
метильных групп на два сигнала различной
которых хиральные центры находятся на
интенсивности в соотношении
~
1/5. Причем
расстоянии более чем трех связей друг от друга,
наибольшее расщепление, которое приводит к
считается трудновыполнимой задачей [6]. Ниже
уширению и уменьшению относительной
будет предложена другая точка зрения на природу
интенсивности соответствующих сигналов при
изомерии соединений, синтезированных в работах
повышении температуры, испытывают сигналы
[3-5].
симметричных пар α - (С8, С13, С9), β - (С14, С15) и
Спектры ЯМР соединений с асимметричными
γ - (С16) атомов по отношению к атомам азота
центрами могут быть дополнительно усложнены,
оксазольных циклов. Логично объяснить рас-
если на расщепление сигналов накладывается
сматриваемое расщепление сигналов сущест-
химический обмен, причиной которого служит
вованием двух диастереомеров соединений 3 и 4 со
инверсия центров с необходимой для проявления
значительно большей вероятностью образования
химического обмена в спектрах ЯМР частотой (10-
одного из них в соответствие с наличием двух
100 Гц). Заторможенная пирамидальная инверсия
хиральных центров - пирамидальных атомов азота
атомов азота, подобная химическому обмену,
оксазольных циклов. При
50°С перечисленные
изображенному на схеме
1
- давно известный
сигналы диастереомеров, как обычно в случае
пример явления, которое может приводить к рас-
быстрого химического обмена, сливаются в
щеплению, уширению, слиянию или исчезновению
сигналы с взвешенной средней величиной
сигналов ЯМР в зависимости от температуры
химического сдвига (рис. 1-3).
регистрации спектров
[1,
7]. Причем наличие
Сигналы атомов С8, С13, С15, С16 основного
объемных заместителей у атома азота - одна из
диастереомера соединений 3 и 4 в отличие от
известных причин замедления быстрой (1011 Гц) в
аналогичных сигналов минорного диастереомера
случае аммиака пирамидальной инверсии атомов
при
-30°С дополнительно едва заметно
азота [7]. Именно такие заместители появляются у
расщеплены на сигналы приблизительно
атомов азота оксазольных циклов в результате
одинаковой интенсивности (рис.
3). Логично
рассмотренных ниже реакций.
объяснить это расщепление зеркально противо-
положной конфигурацией двух стереогенных
При анализе спектров ЯМР соединений,
центров в молекулах основного диастереомера.
полученных при взаимодействии оксазолопири-
дина 1 с этилен-, диэтилен- и триэтиленгликолем
Диастереомерия подандов
3 и
4 явно
было установлено, что в результате реакции
проявляется в спектрах ЯМР, несмотря на большое
образуются соединения 2-4 (Схема 2).
расстояние между хиральными центрами. В случае
соединения 4 стереогенные атомы азота разделены
Хотя анализ спектров ЯМР выделенных и
пятнадцатью связями.
очищенных на кафедре Органической химии
Омского политехнического университета соеди-
Соображения, которые могут быть использова-
нений 2-4 усложняют расщепление, уширение и
ны для объяснения этого экспериментального факта,
исчезновение отдельных сигналов в зависимости
были обнаружены в работе [8], авторы которой
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
210
ТАЛЗИ и др.
Схема 2.
OH
HO
Br
2
HO
OH
O
N
+
O
HO
O
O
OH
N O
12
1
2
аналог соединения 4, полученный по реакции
оксазолопиридина 1 с этиленгликолем
3 аналог соединения 4, полученный по реакции
оксазолопиридина 1 с диэтиленгликолем
1
6
2
17
O
N
5
O
4
3
14
16
O
O
15
8
18
N
7
N
2HBr
11
13
O
9
O
10
12
O
N O
4
определяли методом ЯМР, насколько далеко может
групп по крайней мере основного диастереомера
быть передано влияние стереогенного центра по
соединений 3 и 4 в спектрах ЯМР 1Н (рис. 1) при
цепи олигомера фенилмочевины. В качестве зонда
-30°С анизохронны.
были использованы диастеретопные СН2-протоны
Спектры ЯМР 13С вещества 2, полученные при
концевой бензильной группы, специально
двух различных температурах, приведены на рис. 4.
введенной в состав олигомера. Максимальное
При 50°С спектр соединения
2 отличается от
расстояние, на котором еще фиксировалась
спектра своих аналогов 3 и 4 с более длинной
обусловленная наличием стереогенного центра
оксиэтильной цепью только отсутствием сигналов
анизохронность протонов СН2-группы зонда,
дополнительных групп СН2. При -30°С спектры
составило 24-связи. Такое дальнодействие было
соединения 2 и соединений 3 и 4 существенно
объяснено регулярной вторичной спиральной
различаются. Хотя в спектре соединения 2 можно
структурой цепи олигомера. Авторы даже
обнаружить рассмотренное выше в случае
предложили использовать расстояние от
соединений
3 и
4 расщепление сигналов, но
стереогенного центра, на котором еще проявляется
гораздо более
заметным является другое
анизохронность протонов диастереотопных CH2-
расщепление всех сигналов соединения 2, даже
групп зонда, как маркер, характеризующий длину,
сигнала атомов углерода метильных групп на два
на которую распространяется регулярная
сигнала с отношением интенсивностей
~2/3 в
спиральная топология цепи в растворах
результате проявления еще одного типа диастерео-
органических соединений.
мерии.
Следуя работе [8], можно предположить, что
Возможно, данный тип диастеомерии
причина дальнодействующей корреляции между
обусловлен осевой спиральной хиральностью.
хиральными центрами, которая приводит к
Один из рассматриваемых изомеров соединения 2
анизохронности аналогичных атомов диастерео-
соответствует правому, другой - левому винту
меров соединений 3 и 4, объясняется регулярной
спирали оксиэтильной цепи в молекуле поданда 2.
спиральной вторичной структурой оксиэтильной
Этот тип диастеомерии, который мы не беремся
цепи, соединяющей хиральные центры. В
наглядно изобразить, проявляется только при
соответствие с предпологаемой топологией цепи
пониженной температуре и определенной длине
сигналы геминальных протонов всех, даже
цепи, обеспечивающей ее конформационную
наиболее удаленных от хиральных центров СH2-
жесткость. Возможно, соединения 2-4 образуют в
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
ИССЛЕДОВАНИЕ ДИАСТЕОМЕРИИ СОЕДИНЕНИЙ, В КОТОРЫХ СТЕРЕОГЕННЫЕ
211
18а*
243 K
18a
14a*
14а
16a*
17а*
17а
16а
15а
16а*
15а*
14b
8.5
8.0
7.5
7.0
6.5
6.0
5.5
5.0
4.5
4.0
3.5
3.0
2.5
2.0
1.5
1.0 м.д.
12
323 К
1, 2, 3, 5, 6
18
11
14
15
16, 17
8.5
8.0
7.5
7.0
6.5
6.0
5.5
5.0
4.5
4.0
3.5
3.0
2.5
2.0
1.5
1.0 м.д.
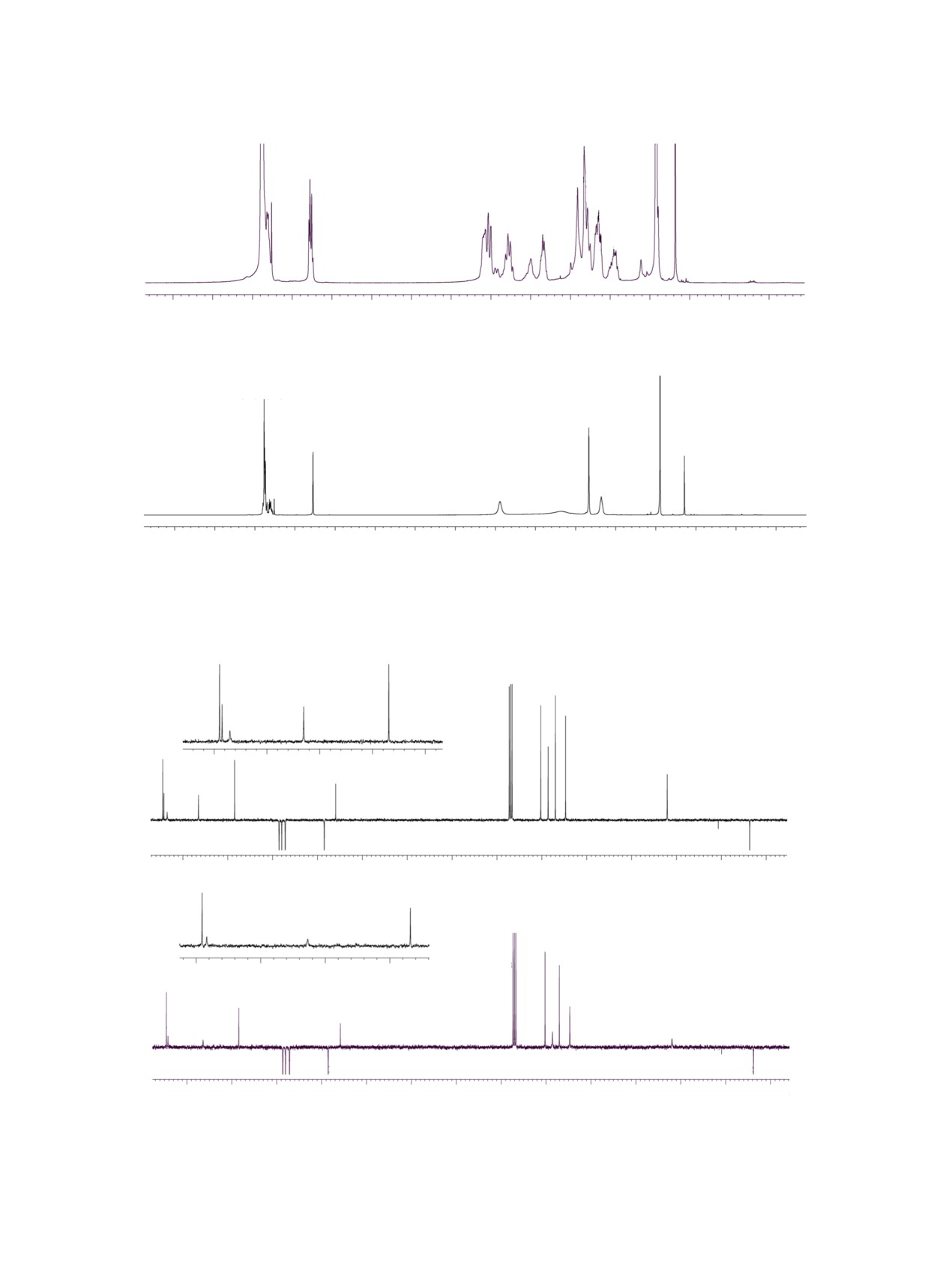
Рис. 1. Спектры ЯМР 1Н соединения 4 при различных температурах. Обозначения на спектре, полученном при -30°С: 17а-17а*,
14а-14а* и т.д., соответствуют геминальным диастереотопным парам сигналов протонов СН2-групп основного диастерео-
мера. Наблюдаемые отдельные сигналы минорного диастереомера обозначены индексом b. Отнесение рассматриваемых
сигналов выполнено с помощью корреляционного двумерного спектра, полученного с помощью импульсной программы HSQC.
4
10
9
8
13
323К
155
150
145
140
м.д.
150
140
130
120
110
100
90
80
70
60
50
40
30
м.д.
10
4
9
8
18
303К
17
CDCl3
155
150
145
140 м.д.
10
4
16
7
15
9
14
8
1, 2, 3, 5, 6
11
12
150
140
130
120
110
100
90
80
70
60
50
40
30
м.д.
Рис. 2. Спектр ЯМР 13С соединения 4 при 30°С и 50°С.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
212
ТАЛЗИ и др.
9a
14a
15a
10a, b
18
17
13a
16a
8a
9b
13b
8b
14b
15b
16b
154
152
150
148
146 м.д.
70
65
60
55
50
45 м.д.
4
7
CDCl3
11
1
243 К
3, 5
12
2, 6
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
м.д.
Рис. 3. Спектр ЯМР 13С соединения 4 при -30°С. 8а, 8b и т. д. обозначены сигналы аналогичных атомов углерода основного
и минорного диастереомеров соединения 2.
10 9 13
8
4
323 К
м.д.
CDCl3 16
155
150
145
140
14
15
1 - 6
7
12
11
150
130
110
90
70
50
30
м.д.
152
148
144
140 м.д.
65 6 0
55 50
45
м.д.
160
150
140
130
120
110
100
90
80
70
60
50
40
30
м.д.
Рис. 4. Спектр ЯМР 13С соединения 2 при -30°С и 50°С.
растворе сэндвич металлоценового типа, толщина
длины оксиэтильной цепи при переходе от
которого зависит от длины, локализованной внутри
соединения
2 к соединениям
3 и
4 растет
сэндвича оксиэтильной спирали. При увеличении
расстояние между концевыми
ароматическими
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
ИССЛЕДОВАНИЕ ДИАСТЕОМЕРИИ СОЕДИНЕНИЙ, В КОТОРЫХ СТЕРЕОГЕННЫЕ
213
NHC*H3
DMSO
H2O
1, 2
1, 2
5, 6
5, 6
3, 4
3, 4
7
7
3.5
3.0
2.5
2.0
1.5
1.0
0.5
0.0
-0.5
-1.0
м.д.
13-16
11, 12
OCH3
NHC=O
N*HCH3
13
12
11
10
9
8
7
6
5
4
3
2
1
0
-1 м.д.
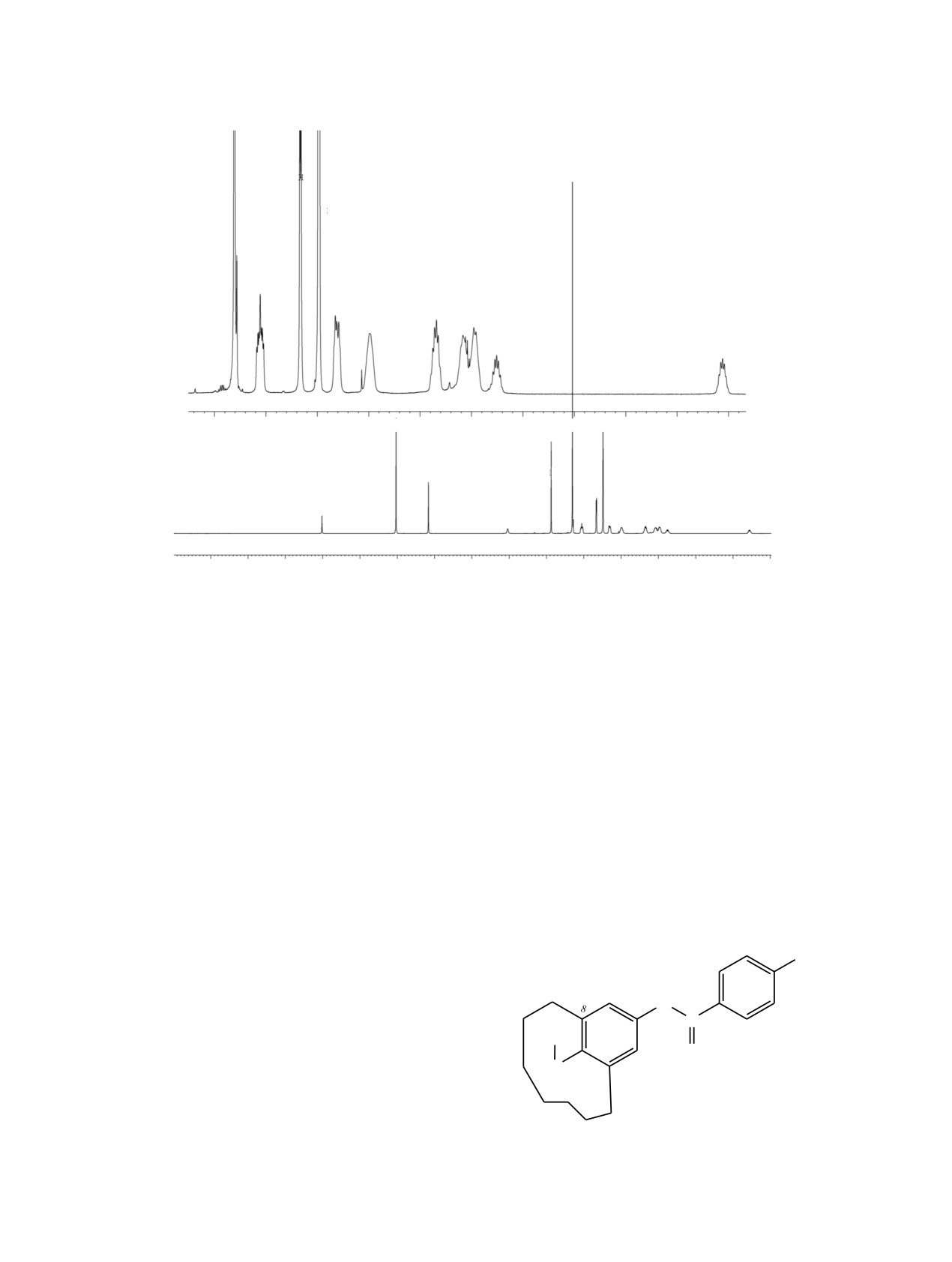
Рис. 5. Спектр ЯМР 1H соединения 5 при 60°С.
системами. В результате их π-взаимодействие
сивности сигналов углеродов 5, 6, 8, 9, NHCH3 в
становится более слабым, и существование
спектре ЯМР 13С соединения 5, которое можно
диастереомеров, отличающихся правой и левой
отнести к ускорению пирамидальной инверсии
винтовой конфигурацией оксиэтильной спирали, в
фрагмента NHCH3. Однако, указанное изменение
спектрах ЯМР уже не проявляется. Может быть,
ширины сигналов атомов углерода не отражается в
именно такие же диастереомеры подандов с левой
отличие от случая соединений 2-4 на сигналах
и правой оксиэтильной спиралью были
протонов СН2-групп цепи.
обнаружены и разделены в работах
[3-5]. По
крайней мере, длина оксиэтильной цепи в них
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
такая же, как в соединении 2.
Спектры ЯМР 13С, 1Н оксазолопиридинов 1-4 и
Нужно отметить, что анизохронность геми-
метациклофана 5 записаны на ЯМР спектрометре
нальных протонов СН2 групп может не быть
связанной c наличием стереогенных центров и их
инверсией, как в соединениях
2-4. Ярко
выраженная анизохронность сигналов протонов
Схема 3.
16
цепи (СН2)n характерна для спектров ЯМР
1Н
COOCH3
14
метациклофанов, например, соединения 5 (рис. 5),
принадлежащего к специфическим неплоским
1
12
H
N
15
ароматическим соединениям [9, 10]. Все геми-
4
C
13
нальные протоны 1-7 соединения 5 существенно
CH3
анизохронны, причем даже при 60°С. Соединение
11
O
10
5
HN
5 содержит стереогенный центр - пирамидальный
9
5
атом азота группы NHCH3 (схема 3). При 60°С
6
7
наблюдается существенное уменьшение ширины и
2
соответственно увеличение относительной интен-
3
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
214
ТАЛЗИ и др.
Avance 400 (Bruker) с использованием CDCl3 и
2017, 53, 1598.] doi 10.1134/S1070428017110021
DMSO-d6 в качестве растворителя, внешнего
2. Барышева Н.А., Икрина М.А., Симонов В.Д.,
стандарта и для дейтериевой стабилизации. Для
Талзи В.П. ЖОрХ. 1985, 21, 515.
записи спектров ЯМР 13С применялась импульсная
3. Овчинникова И.Г. Автореф. дис
к.х.н.
программа APT при релаксационной задержке 15 с.
Екатеринбург. 2007.
Длительности 90°C импульсов составляли 3 (1Н) и
4. Гейн В.Л., Замараева Т.М., Дмитриев М.В.,
7
(13С) μc. Входящие в программный пакет
Овчинникова И.Г., Федорова О.В. ЖОрХ. 2017, 53,
спектрометра импульсные программы HSQC,
1077. doi 10.1134/S1070428017070223
HMBC (версии с градиентными импульсами)
5. Овчинникова И.Г., Федорова О.В., Степухин П.А.,
использовались для записи двумерных корреля-
Литвинов И.А., Русинов Г.Л., Кристаллография,
ционных спектров.
2009, 54, 37.
БЛАГОДАРНОСТЬ
6. Ohrui H., Matsui M. Proc Jpn Acad Ser B Phys Biol
В заключении авторы выражают благодарность
Sci. 2007, 83, 127. doi 10.2183/pjab.83.127
д.х.н. А.С. Фисюку и к.х.н Г.П. Сагитуллиной за
7. Lehn J.M., Nitrogen Inversion: Experimental & Theory,
предоставление спектрально чистых образцов
Berlin: Springer-Verlag, 1970.
гетероциклических соединений 1-5.
8. Clayden J., Lemiegre L., Morris G.A., Pickworth M.,
КОНФЛИКТ ИНТЕРЕСОВ
Snape T.J, Jones L.H. J. Am. Chem. Soc. 2008, 130,
15193. doi 10.1021/ja805758v
Авторы заявляют об отсутствии конфликта
9. Cram D.J., Knox G.R. J. Am. Chem. Soc. 1961, 83,
интересов.
2204.
СПИСОК ЛИТЕРАТУРЫ
10. Jenneskens L.W., Klamer J.C., de Boer H.J.R.,
1. Талзи В.П., Евдокимов С.Н. ЖОрХ. 2017, 53, 1598.
de Wolf W.H., Bichlhaupt F., Stam C.H. Angew.Chem.
[Talsi V.P. Evdokimov S.N. Russ. J. Org. Chem.
1984, 96, 236. doi 10.1002/anie.198402381
Investigation of Diastomerism of Compound in which Stereogenic
Centers are Divided by a Long Chain
V. P. Talsia, *, S. N. Evdokimova, and A. L. Shatsauskasb
a Institute of Hydrocarbon Processing Problems, SB RAS, 644040, Russia, Omsk, ul. Neftezavodskaya 54
*e-mail: vtalsi@ihcp.ru
b Omsk State Technical University, 644050, Russia, Omsk, pr. Mira 11
Received August 31, 2018
Revised August 31, 2018
Accepted September 10, 2018
When recording the NMR spectra of several heterocyclic compounds synthesized at Omsk universities,
diasteomerism was observed at a large (up to fifteen bonds) distance between the stereogenic centers, which was
explained by the regular secondary spiral structure of the chain connecting the centers.
Keywords: NMR, podand diastereomerism, oxazolopyridines, pyramidal nitrogen inversion, secondary helical
structure of the hydroxyethyl chain
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019