ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, Том 55, № 2, с. 252-265
УДК 547.92
ХЕМОСЕЛЕКТИВНЫЙ СИНТЕЗ 14β-(ИЗОКСАЗОЛ-3-ИЛ)-
МЕТИЛСТЕРОИДОВ ЭСТРАНОВОГО РЯДА И ИХ
ТРАНСФОРМАЦИИ С РАСКРЫТИЕМ
ГЕТЕРОЦИКЛИЧЕСКОГО ЯДРА
© 2019 г. А. В. Барановскийa, *, А. С. Ладыкоa, В. А. Шатскаяb, А. М. Щербаковb, **
a ГНУ «Институт биоорганической химии НАН Беларуси», 220141, Беларусь, г. Минск, ул. Купревича 5/2
*e-mail: baranovsky@iboch.by
b НИИ канцерогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
115522, Россия, г. Москва, Каширское ш. 24, стр. 15
**e-mail: alex.scherbakov@gmail.com
Поступила в редакцию 16 мая 2018 г.
После доработки 23 мая 2018 г.
Принята к публикации 1 декабря 2018 г.
Выполнен синтез стероидов с изоксазольным, изоксазолиновым, енаминокарбонильным заместителем
при С-14 и конденсированным по С-14—С-15 пирролидиновым циклом. Оценено влияние растворителей
на результат диполярного циклоприсоединения и сольволиз мостиковых нитростероидов.
Цитостатические свойства аналогов эстрона проанализированы на опухолевых клетках различного
генеза. Выявлена активность соединений в отношении клеток рака молочной железы, рака кишечника,
рака предстательной железы и рака легкого.
Ключевые слова: эстрадиол, диполярное циклоприсоединение, гидрогенолиз, нитрилоксиды,
енаминокетоны, лактамы, ЯМР, культуры клеток опухолей человека.
DOI: 10.1134/S0514749219020125
Ранее
[1] было показано, что сольволиз
растворителя использовали диметилацетамид [3]
нитростероидов типа
1 протекает через
вместо ДМФА, что существенно сократило время
образование алкоксинитронов 2 (схема 1) и замена
реакции и улучшило суммарный выход продуктов.
этанола на изопропанол приводит к лактаму 3 без
Для оценки выхода лактама проведена реакция
примеси N-гидроксилактама 4. Такое заключение
нитроаддукта 6 с NaHCO3 в смеси изопропанол-
было сделано на основе аналитического экспери-
вода (95:5). В результате, после кипячения смеси в
мента под контролем ВЭЖХ-МС. Для подтверж-
течение 24 ч и последующей хроматографической
дения полученных данных осуществлен препара-
очистки, был выделен единственный продукт
тивный синтез лактама в модифицированных
реакции - лактам 7. По сравнению с аналогичной
условиях и исследовано влияние растворителей на
реакцией в 96% этаноле, выход продукта оказался
выход продуктов диполярного циклоприсоеди-
значительно выше
(90% против
42%). Таким
нения к нитростероиду
6 (изоксазолов и
образом, полученный результат полностью
изоксазолинов). Во второй части исследования
подтвердил выводы о механизме реакции сольво-
выполнено раскрытие гетероциклического ядра
лиза и результаты аналитического эксперимента.
изоксазолов с целью получения 14β-функциона-
лизированной цепи и изучены цитостатические
Успех реакции получения лактама стимули-
свойства новых аналогов эстрона.
ровал исследовать влияние растворителя и на
Синтез нитроаддукта 6 (схема 2) выполнен из
формирование изоксазолов и изоксазолинов. Как
эстрона
5 по ранее описанному методу
[2] с
было показано [4], в абсолютном этаноле выход
некоторыми модификациями, в частности, при
изоксазолов не превышал 50-60%, а изоксазолинов
получении смеси Δ14- и Δ15-кетонов в качестве
70% в наиболее удачных экспериментах.
252
ХЕМОСЕЛЕКТИВНЫЙ СИНТЕЗ 14β-(ИЗОКСАЗОЛ-3-ИЛ)МЕТИЛСТЕРОИДОВ
253
Схема 1.
-O
OAc
OAc
O
O
O-
ROH, H2O, NaHCO3
NO2
N+
N+
O-
O-
MeO
1
O
O
O
O
ROH
+
H
H
H
N+
NH
N
O-
+N
OH
RO
O-
O
O
3
4
2
R = Et, i-Pr
Замена этанола на смесь изопропанол-вода
изопропанол-вода
95:5. Этот вариант дает
(95:5) при присоединении винилэтилового эфира
наиболее высокие выходы изоксазолов, а
дало увеличение выхода изоксазолинов 12 на 15-
непрореагировавший исходный стероид 6 может
20%, при некотором сокращении времени реакции.
быть использован повторно в присоединении.
Однако более полезным данный подход оказался в
Полученные в результате циклоприсоединения
синтезе изоксазолов
10 и
11, где в этаноле
и сольволиза стероиды были изучены в ряде
наблюдалось образование лактама при достаточно
реакций, включающих раскрытие гетеро-
умеренном выходе целевого продукта (50%). При
циклического ядра и модификацию цикла D
применении системы изопропанол-вода после 6
для получения новых аналогов эстрона и
часов кипячения суммарный выход изоксазолов 10,
эстрадиола.
11 составил 71%. В реакционной смеси не были
обнаружены лактам 7 или его 3-гидроксипроиз-
Синтез производных с пирролидиновым циклом
водное, а выделен только исходный нитроаддукт 6
осуществлен из лактама 7. Защитная группа при С-
(26%). Таким образом, конверсия нитроаддукта 6 в
3 в лактаме 7 была заменена на этоксиэтильную [5]
данной реакции составила 98%, причем, следует
для повышения растворимости в органических
отметить, что гидролиза защитной группы при С-3
растворителях, и ЕЕ-эфир 8 был превращен в смесь
в нитросоединении 6 не наблюдалось. Снижение
диола
9 и его
17β-эпимера при кипячении с
концентрации воды в системе до 1% не привело к
диизобутилалюминий гидридом (DIBAH) [6, 7] в
положительным результатам: время реакции
толуоле. Реакция выполнялась последовательно:
увеличилось до
18 ч, суммарный выход
предполагалось, что на первом этапе будет
изоксазолов составил 59% при 95% конверсии.
селективно восстановлена карбонильная группа
Чтобы еще более снизить вероятность нуклео-
при низкой температуре, а затем при кипячении
фильного присоединения спирта-растворителя к
произойдет деоксигенирование и восстановление
нитрилоксиду, вместо изопропилового спирта был
ЕЕ-эфира. К сожалению, селективность вос-
использован более стерически затрудненный трет-
становления кетонной функции была неприемлема
бутиловый спирт в присутствии 5% воды. Однако,
даже при -78°С: соотношение спиртов составило
реакция соединения 6 с пропаргиловым спиртом в
2:1 в пользу 17α-эпимера, что, очевидно связано с
этом случае протекала медленно и выход продукта
координацией электрофильного реагента с
оказался ниже, чем при реакции в изопропаноле,
лактамным циклом. С целью улучшения
был выделен исходный стероид, а образования
соотношения в пользу
17β-эпимера, схема
лактама не было зафиксировано. Следовательно,
синтеза была изменена. Карбонильная группа в
опираясь на полученные резу-льтаты, наиболее
ЕЕ-эфире
8 была восстановлена трис-(трет-
оптимальной для диполярного присоединения
бутокси)алюминий гидридом [5] и образовавшийся
пропаргилового спирта является система
17β-спирт 16 был превращен в бис-ЕЕ-эфир 17. Его
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
254
БАРАНОВСКИЙ и др.
Схема 2.
O
OH
O
OAc
ii
iii
i
NO2
H
H
NH
NH
RO
HO
HO
BzO
O
6
5
7, R=Bz
9
i
iv
v
8, R=EE
i
O
O
OR
OEt
iii
N
O
H
H
N
RO
NH
NH
RO
O
HO
EEO
OEt
O
10, R=Bz
12, R=Bz, 15
16, R=H
18
vii
ix
11, R=H
15
13, R=H,
17, R=EE
HO
viii
vi
14, R=Bz, C15- одинарная связь
vi
15, R=H, C15- одинарная связь
OAc
x
OAc
OAc
O
xi
N
NH2
N
N
AcO
O
O
AcO
O
HO
RO
19a, 17a
19b, 17b
xi
22a, 17a
O
20, R=Bz
23
AcO
22b, 17b
21, R=H
OAc
OAc
xii
NH2
NH2
AcO
O
HO
O
24, R=H
R
26
25, R=OAc
i: ссылка [5]; ii: NaHCO3, i-PrOH, H2O, Δ; iii: DIBAH, PhMe, Δ; iv: пропаргиловый спирт, NaHCO3, i-PrOH, H2O, Δ;
v: CH2=CHOEt, NaHCO3, i-PrOH, H2O, Δ; vi: 1) NaBH4, THF, MeOH; 2) Ac2O, HClO4 EtOAc; vii: KOH, MeOH, H2O;
viii: HCO2NH4, Pd/C, EtOH; ix: CH2=CHOEt, Et2O, PPTS; x: TsOH, MeCN; xi: H2, Ni/Ra, MeOH; xii: NaHCO3, MeOH, H2O.
деоксигенирование сопровождалось восстанов-
гидрирования. При попытках гидрирования (Pd/C,
лением защитных групп, которое, однако,
H2; Ni/Ra, H2; Pd/C, HCO2NH4) реакция протекала
протекало разными путями. Результатом
не селективно: наряду с насыщением двойной
восстановления заместителя при С-3 оказалась
связи наблюдалось раскрытие цикла и внут-
свободная 3-гидроксигруппа, а восстановление 17-
римолекулярная циклизация по Михаэлю
эфирной группы остановилось на стадии этилового
продуктов раскрытия с образованием разно-
эфира
[8].
Таким образом, продуктом
образных конденсированных производных по С-14-
восстановления лактама
17 оказалось
17β-
С-15. Неэффективным оказалось и раскрытие
этоксипроизводное 18.
изоксазольного цикла стероида 10 под действием
гексакарбонила молибдена: реакция протекала
Изучение химических свойств изоксазо-
сложно, давая после гидролиза смесь продуктов.
лилстероидов 10 и 11 было сконцентрировано на
Таким образом, возникла необходимость
восстановительных трансформациях их гетеро-
выведения двойной связи стероидов 10 и 11 из
циклического цикла. Наличие Δ15-связи в
сопряжения для осуществления намеченной цели.
стероидах внесло определенные сложности при
Известно, что боргидрид натрия способен
раскрытии гетероцикла или селективного ее
восстановить сопряженные системы с образо-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
ХЕМОСЕЛЕКТИВНЫЙ СИНТЕЗ 14β-(ИЗОКСАЗОЛ-3-ИЛ)МЕТИЛСТЕРОИДОВ
255
ванием насыщенных спиртов [9, 10]. Этот процесс
изоксазолинового цикла стероида 14 происходит
наблюдался и в случае восстановления стероида
элиминирование этанола [13-16] с образованием
10, приводя преимущественно к
17α-эпимеру
изоксазолов
20 и
21 с высоким суммарным
(соотношение
17α-эпимеров-17β-эпимеров
выходом. Изоксазолы 20 и 21 исследовались в
составило
1.5:1 по данным интегрирования в
реакциях гидрирования (Ni/Ra, Pd/C), однако и здесь,
спектре ЯМР). В условиях восстановления
в отсутствие Δ15-связи, однозначные результаты не
происходил и гидролиз защитной группы при С3,
были получены. Судя по имеющимся данным,
поэтому образовавшаяся смесь продуктов была
после раскрытия изоксазольного цикла, енамино-
проацетилирована в триацетаты 19а, b, которые
карбонильная система вступает в реакции с
удалось частично разделить и доказать
участием 17-карбонила по альдольному типу с
конфигурацию центра С-17 эпимеров (установлена
образованием мостиковых структур. Во избежание
методом NOESY: у 17α-производного наблюдался
этих осложнений, карбонильная группа при С-17 в
кросс-пик между протонами при С-17 и С-14',
стероиде 20 была восстановлена под действием
сигнал 17β-H в спектре ЯМР 1Н 17α-эпимера 19а
трис-трет-бутоксиалюминий гидрида. Восстанов-
представляет форму дублета дублетов с КССВ 7.5
ление протекало неселективно, соотношение
и 9.0 Гц, сигнал 17α-H в спектре ЯМР 1Н 17β-
эпимеров по С-17 было близко к 1:1, поэтому, в
эпимера
19b обнаруживается в виде дублета
дальнейшем, для синтеза спиртов использовали Δ15-
дублетов с КССВ 2.5 и 8.0 Гц). Гидрирование
изоксазолины 12, которые восстанавливали натрий
триацетата
19а над никелем Ренея привело к
боргидридом.
несколько неожиданному результату: наряду с
Сопряженное восстановление эпимеров
12
раскрытием изоксазольного цикла наблюдался
натрий боргидридом, как и в случае стероида 10,
гидрогенолиз ацетоксиметильной группы,
приводит преимущественно к 17α-спиртам (1.5:1) и
находящейся при С-5 изоксазолинового цикла -
сопровождается гидролизом защитной группы при
продуктом реакции оказался енаминокетон
24,
С-3. Смесь четырех диастереомеров (по С-17 и
структура которого была доказана методами
С-5') без разделения была ацетилирована в кислых
корреляционной спектроскопии ЯМР. Примеры
условиях, где, наряду с ацетилированием,
такого превращения для
5-ацетоксиметил-
протекала и ароматизация гетероцикла. Из
изоксазолов не описаны, однако наблюдались в
образовавшейся смеси двух эпимеров
22 был
ряду
5-ациламинометилизоксазолов
[11]. Когда
выделен
17α-эпимер
22а. При анализе COSY
изоксазол 19а был подвергнут гидрированию в
спектров изоксазолов 20-22 была обнаружена одна
присутствии 5% палладия на угле была получена
характерная закономерность: протон при С5'
смесь енаминокетонов
24 и
25.
Попытка
изоксазольного цикла имел интенсивный кросс-пик
повторного гидрирования смеси не привела к
с протонами при С-141, а взаимодействие с
удалению ацетильной группы в енаминокетоне 25.
протоном при С-4' не наблюдалось. Отнесение
Вероятно, гидрогенолиз является конкурентной
сигналов ядер изоксазольного цикла основывалось
реакцией, которая возможна при наличии гете-
на величине химических сдвигов и анализе
роцикла, аналогично гидрогенолизу бензиловых
спектров HMBC и NOESY стероидов
20-22.
эфиров
[12]. Селективный гидролиз защитной
Енаминоальдегид 23 был получен в результате
группы при С-3 соединения
24 привел к
гидрирования изоксазола
22a над никелем
формированию гидроксиацетата 26.
Ренея.
Изоксазолины 12 и их 3-гидроксипроизводные
Стероиды 11, 13, 15 и 21 были протестированы
13, в отличие от изоксазолов, устойчивы в
на их цитостатическую активность в отношении
условиях каталитического гидрирования над
ряда линий злокачественных клеток человека. В
палладиевыми катализаторами и их восста-
исследование включены рак молочной железы
новление приводило к стероидам
14 и
15
MCF-7, MDA-MB-231 и T-47D, рак кишечника
соответственно. Для соединения 14, в результате
HCT 116, рак предстательной железы 22Rv1 и рак
повторного хроматографирования удалось
легкого A549. Цитостатическая активность соеди-
выделить индивидуальные изомеры
[4], но
нений анализировалась в концентрациях от 6 до
установить конфигурацию хирального центра С-5'
50 мкМ. При низких концентрациях от 6 до 25 мкМ
методами двумерной спектроскопии ЯМР не
цитостатическое действие стероидов 11, 13, 15 и 21
удалось (табл
5,
6). Под действием TsOH из
было маловыраженным. В таблице 1 представлен
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
256
БАРАНОВСКИЙ и др.
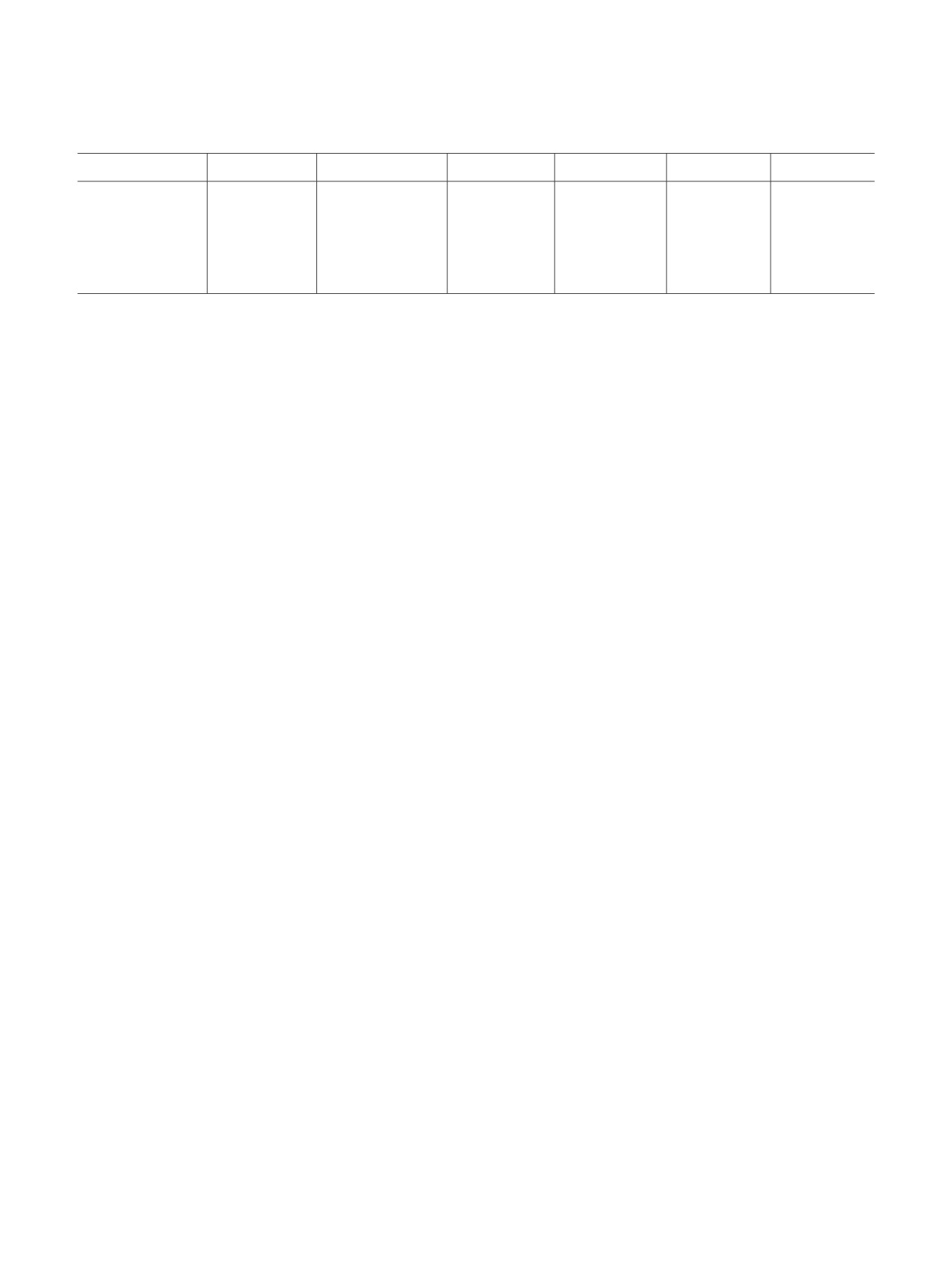
Таблица 1. Выживаемость опухолевых клеток, обработанных синтезированными соединениями (50 мкМ, 72 ч роста с
соединением). Указана выживаемость в процентах относительно контрольных клеток ± стандартное отклонение.
Соединение
MCF-7
MDA-MB-231
T-47D
HCT 116
22Rv1
A549
11
105 ± 10
90 ± 9
75 ± 8
87 ± 7
88 ± 9
97 ± 10
13
82 ± 7
101 ± 11
64 ± 7
76 ± 8
95 ± 10
102 ± 10
15
97 ± 8
89 ± 9
57 ± 6
76 ± 8
76 ± 8
97 ± 10
21
95 ± 9
82 ± 9
49 ± 5
74 ± 8
89 ± 9
83 ± 9
процент выживаемости клеток, обработанных
Корреляционные спектры (HSQC, COSY, TOCSY,
соединениями в концентрации
50 мкМ. Среди
HMBC, NOESY) зарегистрированы и обработаны с
исследованных стероидов соединение
13 было
использованием стандартного программного
более активно в отношении клеток гормоно-
обеспечения фирмы Bruker-Biospin, ИК спектры
зависимого рака молочной железы MCF-7. Рост
получены на ИК-Фурье спектрометре Perkin Elmer
клеток трижды негативного рака молочной железы
Spectrum 100 в пленке или таблетках KBr. Масс-
MDA-MB-231 ингибировало на 18% соединение
спектры регистрировались на комплексе ВЭЖХ
21, другие стероиды были менее активны.
Accela с масс-детектором LCQ-Fleet в режиме
Стероиды 13, 15, 21 демонстрировали схожую
химической ионизации при атмосферном давлении
активность на клетках HCT
116, вызывая
(APCI) или электроспрея (ESI), детектирование
приблизительно 25%-ное торможение роста этой
положительных ионов. Отношения m/z и
линии. Как видно из представленных данных,
относительные интенсивности (%) приведены для
стероиды 11, 13, 15 не показали активности на
наиболее интенсивных пиков. Масс-спектры
клетках рака легкого, а 21 вызывало торможение
высокого разрешения регистрировались на масс-
роста этой опухоли. Стероид 15 был активен в
спектрометре
6550 iFunnel Q-TOF (Agilent
клетках рака предстательной железы. Наиболее
Technologies) в режиме ESI. Подготовка раст-
интересной и специфической активностью
ворителей осуществлялась по общепринятой
исследованные соединения обладают в клетках
практике [17], все реакции проводили в атмосфере
гормонозависимого рака молочной железы T-47D.
аргона. Протекание реакций контролировали
Выживаемость этой клеточной линии составила от
методом ТСХ на пластинках Merck (Kieselgel 60
49 до 75%. Наиболее активным оказался стероид
F254). Хроматографическое разделение реакцион-
21, ингибирующий рост клеток T-47D на
51%.
ных смесей осуществляли на силикагеле 40/60
Соединения 13 и 15 также проявили достаточно
(Kieselgel 60, Merck).
высокую активность (табл. 1), стероид 11 был
3-Бензоилокси-2'-оксопирролидино-
менее активен.
[4',5':14β,15β]-эстра-1,3,5(10)-триен-17-он
7. К
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
раствору 0.272 г (0.56 ммоль) нитросоединения 6 в
45 мл изопропанола добавили 0.470 г (5.6 ммоль)
Температуры плавления определены на авто-
NaHCO3 и 2.5 мл воды. Смесь дегазировали и
матическом аппарате для определения темпера-
кипятили
24 ч, после чего охладили и
туры плавления WRS-2 Bestscope и не коррек-
нейтрализовали насыщенным раствором NH4Cl.
тировались. Спектры ЯМР 1Н и 13С получены на
Органическую фазу экстрагировали хлороформом,
спектрометре AVANCE
500 (Bruker-Biospin) с
экстракт высушили над Na2SO4. Остаток после
рабочей частотой 500.03 и 125.73 MГц для ядер 1Н
упаривания очищали на колонке с силикагелем
и
13С, соответственно, с использованием 5-мм
(EtOAc). Получили 0.216 г (90%) соединения 7.
широкополосного датчика (BBO) с Z-градиентом.
Спектр ЯМР 1H, δ, м.д. (CDCl3): 1.13 с (1H, С18-Н3),
Спектры регистрировались при температуре образца
2.13 д (1Н, J 17.5 Гц, H14i), 2.18 д.д
(1Н, J
293 К для растворов в CDCl3 или CD3OD, в качестве
19.5, 3.5 Гц, H16), 2.26 д (1Н, J 17.5 Гц, H14i),
внутреннего стандарта использовался остаточный
2.43 м (1H, Н11α), 2.75 тд (1Н, J 11.0, 2.0 Гц, H9α),
сигнал растворителя δ 7.26 (1Н, CDCl3), 3.31 (1Н,
2.91 м (2H, Н6), 3.18 д.д (1Н, J 19.5, 9 Гц, H16),
CD3OD), 77.16 (13С, CDCl3), 49.00 (13С, CD3OD) м.д.
4.24 д.д (J 9.0, 3.5 Гц, H15α), 6.89 уш.с (1H, NH),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
ХЕМОСЕЛЕКТИВНЫЙ СИНТЕЗ 14β-(ИЗОКСАЗОЛ-3-ИЛ)МЕТИЛСТЕРОИДОВ
257
Таблица 2. Параметры спектров ЯМР 13С и 1Н соединений 9, 17, 18.
9 (CD3OD)
17a (CDCl3)
18b (CD3OD)
№ атома
13С
1Н
13С
1Н
13С
1Н
1
128.15
7.14
127.26
7.19
128.06
7.11
2
114.27
6.59
115.33
6.80
114.24
6.59
3
156.12
-
155.13
-
156.18
-
4
115.75
6.50
117.24
6.71
115.79
6.51
5
138.20
-
137.86
-
138.30
-
6
31.74
2.83
31.11
2.84
31.84
2.84
7
25.97
1.42(α), 1.85(β)
24.06
1.41(α), 1.92(β)
26.31
1.37(α), 1.90(β)
8
45.03
1.45(β)
44.84/44.95
1.45(β)
45.08
1.40(β)
9
41.40
2.43(α)
38.50
2.48(α)
41.22
2.34(α)
10
131.56
-
132.72
-
131.54
-
11
27.45
2.34(α), 1.27(β)
26.88/26.97
2.25(α), 1.40(β)
27.49
2.24(α), 1.32(β)
12
31.43
1.43(α), 1.66(β)
36.05/36.09
1.32(α), 1.54(β)
37.88
1.30(α), 1.55(β)
13
48.08
-
47.42
-
50.13
-
14
60.70
-
56.00
-
61.65
-
15
59.93
4.20(α)
58.08
3.95(α)
63.45
4.20(α)
16
35.75
2.28, 2.08
40.21
1.82, 2.54
35.67
2.76, 1.85
17
78.23
4.14(β)
84.90/87.66
3.64/3.80 (α)
89.29
3.35(α)
18
19.66
1.12
16.96
1.07/1.14
17.47
1.17
141
32.66
1.93, 2.20
40.44/40.62
1.86, 3.41
32.60
1.80, 2.78
142
45.30
3.35, 3.49
170.99/171.16
-
44.97
3.45, 3.59
a Сигналы ЕЕ-групп: 13С -
15.36 (CH2CH3-3),
15.48/15.57 (CH2CH3-17),
19.98/20.38
(CH3-17),
20.52 (CH3-3),
58.98/59.49
(CH2CH3-17), 61.61 (CH2CH3-3), 97.29/100.91 (CH-17), 99.73 (CH-3); 1Н - 1.17-1.19 (CH2CH3-3 и CH2CH3-17), 1.28/1.30 (CH3-17),
1.47 (CH3-3), 3.45/3.59/3.50/3.57 (CH2CH3-17), 3.53/3.77 (CH2CH3-3), 4.66/4.70 (CH-17), 5.33 (CH-3).
b Сигналы этоксигруппы: 13С - 15.69 (CH2CH3), 66.31 (CH2CH3); 1Н - 1.20 (CH2CH3), 3.35 и 3.60 (CH2CH3).
6.95 д (1H, J 2.5 Гц, Н4), 7.01 д.д (1Н, J 8.5,
3,17α-Дигидроксипирролидино-[2',3':14β,15β]-
2.5 Гц, H2), 7.35 д (1Н, J 8.5 Гц, H1), 7.5 т (2Н, J
эстра-1,3,5(10)-триена гидрохлорид 9. К 0.12 г
7.5 Гц, Hм), 7.63 т (1H, J 7.5 Гц, Hп), 8.18 д (2H,
(0.3 ммоль) эфира 8 (был получен из лактама 7 по
J
7.5 Гц, Hо). Спектр ЯМР 13C, δ, м.д.:
15.6
описанному методу [5]) при -70°С добавили 3.75 мл
(C18), 23.8 (C7), 26.6 (C11), 30.8 (C6), 33.2 (C12),
(4.5 ммоль) 1.2 М раствора DIBAH в толуоле,
38.7 (C9), 40.6 (C14i), 43.3 (C16), 43.4 (C8),
51.4
образовавшийся раствор перемешивали 10 мин,
(C15), 53.5 и 53.7 (С13 и С14), 119.5 (C2),
121.9
затем охлаждающую баню убрали и оставили
(C4), 127.4 (C1), 128.7 (См), 129.6 (Си), 130.3 (Со),
реакционную смесь нагреваться при перемеши-
133.8 (Сп), 136.1 и 137.7 (C5 и C10), 149.2 (C3),
вании до комнатной температуры в течение 1 ч.
165.6 (CO-Ph),
177.4 (C14ii), 216.8 (C17). Масс-
После восстановления
17-карбонильной группы
спектр (ESI), m/z (Iотн,
%):
430.1
(100)
(ВЭЖХ-MС), раствор кипятили 6 часов, охладили
[M+H]+. Найдено, %: С 76.02; Н 6.41; N 3.11;
до комнатной температуры и медленно вылили в
М 429.5. C27H27NO4. Вычислено, %: С 75.50; Н 6.34;
20 мл охлажденной воды. Образовавшуюся
N 3.26.
суспензию интенсивно перемешивали
30 мин,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
258
БАРАНОВСКИЙ и др.
Таблица 3. Параметры спектров ЯМР 13С соединений 10, 11, 13, 14, 15, 20 в CDCl3.
14c
14c
№ атома
10a
11
13b
15d
20e
верхний
нижний
1
128.60
128.46
128.57
126.61
126.66
127.38/127.41
126.58
2
119.60
113.56
113.70/113.74
119.10
119.07
113.91
119.11
3
148.58
153.18
153.44
149.16
149.13
156.18
149.15
4
121.18
114.40
114.52
121.61
121.65
115.79
121.61
5
137.27
137.08
137.13/137.23
138.33
138.43
138.81/138.83
138.34
6
30.50
30.37
30.54/30.66
30.32
30.27
31.31/31.38
30.22
7
24.81
24.81
25.11
24.36
24.28
25.50/25.61
24.16
8
41.84
42.06
42.13/42.29
42.21
41.75
43.76/44.06
42.32
9
33.53
33.14
33.04/33.10
38.82
38.69
39.44/39.54
38.81
10
138.72
133.01
133.03
137.85
137.85
132.43
137.91
11
27.65
27.61
27.78
25.24
25.40
26.42/26.55
25.15
12
28.24
28.25
28.04/28.13
33.01
32.88
34.33
33.25
13/14
52.51
52.38
52.39
49.35
49.25
50.27/50.36
48.83
13/14
54.65
54.54
54.96, 54.92
53.11
53.25
54.22/54.29
53.02
15
164.64
164.52
164.88
24.23
24.94
25.06/25.48
24.20
16
132.32
132.05
132.03/132.07
33.42
33.44
34.15/34.22
33.53
17
213.61
213.56
213.84
221.46
221.44
224.42/224.55
221.36
18
23.27
23.00
23.06/23.18
15.85
16.30
16.31/16.58
15.90
141
29.76
29.74
31.37/31.43
34.53
34.80
35.14/34.83
33.07
142
160.66
160.58
156.80/156.87
156.99
156.92
159.22/159.32
160.01
143
103.35
103.24
46.30
46.60
46.29
46.85/47.25
106.28
144
171.63
171.29
101.77
101.74
101.89
103.01/103.35
158.38
145
56.75
56.61
-
-
-
-
-
a Cигналы бензоилоксигруппы: 128.67 (Ph-3), 129.72 (Ph-1), 130.27 (Ph-2), 133.68 (Ph-4), 165.58 (PhCO).
b Cигналы этоксигруппы: 15.14 (СН3), 63.75 (СН2).
c Верхний изомер - сигналы этоксигруппы: 15.14 (СН3), 63.55 (СН2); сигналы бензоилоксигруппы: 128.70 (Ph-3), 130.31 (Ph-2),
129.84 (Ph-1), 133.67 (Ph-4), 165.55 (PhCO). Нижний изомер - сигналы этоксигруппы: 15.18 (СН3), 63.67 (СН2); сигналы
бензоилоксигруппы: 128.69 (Ph-3), 129.85 (Ph-1), 130.31 (Ph-2), 133.66 (Ph-4), 165.55 (PhCO).
d Растворитель CD3OD; сигналы этоксигруппы: 15.41/15.44 (СН3), 64.29/64.39 (СН2).
e Сигналы бензоилоксигруппы: 128.69 (Ph-3), 129.79 (Ph-1), 130.29 (Ph-2), 133.69 (Ph-4), 165.56 (PhCO).
после чего воду отделили центрифугированием
которую растворили в смеси 5 мл метанола и 1 мл
(15 мин, 5000 об/мин). Осадок трижды сонифициро-
2М соляной кислоты и раствор перемешивали 5 ч,
вали с
10 мл этанола, отделяя этанол центри-
после чего растворитель упарили. Остаток
фугированием. Водную и этанольную фракции
растворили в 3 мл ДМФА и стероид осадили 6 мл
объединили, упарили, осадок растворили в
эфира. Получили 0.04 г (38%) стероида 9 в виде
метаноле, профильтровали, фильтрат упарили,
аморфного порошка. ИК спектр (KBr), ν, см-1:
осадок промыли хлористым метиленом и
3335, 2945, 2860, 1620, 1585. Спектры ЯМР 1Н и
высушили. Получили
0.079 г смеси эпимеров,
13С см. табл. 2. Масс-спектр (ESI), m/z (Iотн, %):
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
ХЕМОСЕЛЕКТИВНЫЙ СИНТЕЗ 14β-(ИЗОКСАЗОЛ-3-ИЛ)МЕТИЛСТЕРОИДОВ
259
Таблица 4. Параметры спектров ЯМР 13С соединений 19, 21-24, 26 в CDCl3.
№ атома
21
19аa
19bb
22ac
23d
24e
26f
1
126.60
126.66
126.72
126.62
126.53
126.42
126.58
2
113.08
118.79
118.79
118.76
113.08
118.86
113.06
3
153.97
148.65
148.65
148.62
154.10
148.77
154.01
4
115.17
121.39
121.46
121.35
115.12
121.42
115.10
5
138.17
138.30
138.30
138.39
137.93
138.24
137.99
6
30.25
30.20
30.25
30.21
30.43
30.40
30.53
7
24.26
24.59
25.10
24.60
26.25
26.00
26.26
8
42.66
42.00
41.35
42.10
43.59
43.25
43.70
9
38.46
38.62
38.25
38.63
39.21
39.53
39.33
10
132.24
138.40
138.40
138.45
132.80
138.59
132.98
11
25.19
25.45
26.01
25.43
24.91
24.75
24.91
12
33.27
30.96
36.44
30.96
30.64
30.64
30.66
13/14
48.79
46.11
48.65
46.11
46.74
46.67
46.72
13/14
53.04
50.26
50.88
50.28
51.75
51.46
51.49
15
24.09
27.98
30.82
27.84
26.13
26.13
26.14
16
33.59
26.57
29.56
26.57
26.74
26.80
26.82
17
222.08
82.76
83.38
82.80
82.89
82.88
82.96
18
15.85
19.45
16.52
19.38
19.49
19.39
19.50
141
32.92
33.24
32.85
33.01
43.62
43.69
43.79
142
160.06
162.67
163.08
161.40
166.67
164.22
164.55
143
106.30
105.70
105.84
106.01
99.09
98.24
98.28
144
158.43
166.31
165.98
158.07
187.20
196.54
196.64
145
-
56.48
56.51
-
-
29.64
29.56
a Сигналы ацетоксигрупп: 20.79 (145-СН3), 21.25 (3-СН3 и 17-СН3), 170.39 (145-СО), 169.99 (3-СО), 171.16 (17-СО).
b Сигналы ацетоксигрупп: 20.79 (145-СН3), 21.55 (17-СН3), 21.25 (3-СН3), 170.39 (145-СО), 169.99 (3-СО), 170.66 (17-СО).
c Сигналы ацетоксигрупп: 21.24 (3-СН3 и 17-СН3), 169.97 (3-СО), 171.20 (17-СО).
d Сигналы ацетоксигруппы: 21.27 (17-СН3), 171.38 (17-СО).
e Сигналы ацетоксигрупп: 21.27 (3-СН3 и 17-СН3), 170.01 (3-СО), 171.30 (17-СО).
f Сигналы ацетоксигруппы: 21.29 (17-СН3), 171.33 (17-СО).
314.0
(100)
[M+H]+. ВРМС: Мнайд.
314.2114.
смесь разбавили хлористым метиленом, промыли
C20H28NO2+. Мвыч. 314.2115.
раствором NaHCO3, высушили над Na2SO4 и
упарили. Остаток
(0.147 г) очистили методом
3,17β-бис(1-этоксиэтокси)-2'-оксопирроли-
препаративной ТСХ (этилацетат-гексан,
5:1).
дино-[4',5':14β,15β]-эстра-1,3,5(10)-триен
17. К
Получили 0.070 г (59%) соединения 17 (масло).
смеси 0.1 г (0.25 ммоль) стероида 16 (получен из
Спектры ЯМР 1Н и 13С см. табл. 2. Масс-спектр
лактама
8
[5]), 0.02 г (0.08 ммоль) пиридиний
(ESI), m/z (Iотн, %): 494.8 (40) [M+Na]+, 472.7 (20)
тозилата и молекулярных сит 4А в 2 мл ТГФ
[M+H]+, 400.7 (100) [M+H-винилэтиловый эфир]+,
добавили 2 мл винилэтилового эфира и затем
382.8 (45) [M+H-винилэтиловый эфир-H2O]+, 310.5
перемешивали
48 ч. После окончания реакции
(65) [M+H-2(винилэтиловый эфир)-H2O]+.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
260
БАРАНОВСКИЙ и др.
Таблица 5. Параметры спектров ЯМР 1Н соединений 10, 11, 13, 14, 15, 20 в CDCl3.
№ атома
10a
13b
14c верхний
14c нижний
15d
20e
1
7.15
6.91
7.34
7.33
7.14
7.34
2
6.93
6.59
7.00
7.00
6.60
7.01
4
6.85
6.48
6.96
6.95
6.54
6.96
6
2.79
2.69
2.93
2.92
2.83
2.92
7α
1.34
1.26
1.58
1.57
1.52
1.57
7β
2.24
2.12
2.10
2.09
2.10
2.14
8
1.97
2.09
1.75
1.83
1.60/1.68
1.70
9
2.35
2.24
2.74
2.75
2.67
2.74
11α
2.32
2.25
2.38
2.37
2.36
2.38
11β
1.36
1.33
1.47
1.46
1.35
1.45
12αf
1.92
1.92
1.69
1.68
1.74
1.67
12βf
1.61
1.78
1.45
1.44
1.33
1.44
15α
7.42
7.38
2.26
2.27
2.34/2.34
2.26
15β
-
-
1.98
1.92
1.85/1.89
1.99
16α
6.31
6.28
2.51
2.53
2.50
2.44
16β
-
-
2.31
2.31
2.33
1.89
17α/β
-
-
-
-
-
-
18
1.21
1.09/1.10
1.14
1.12
1.15/1.18
1.20
2.71/2.73,
2.44/2.47,
141
3.08, 3.19
2.38, 2.59
2.40, 2.55
2.68, 2.98
2.88/2.90
2.61/2.66
143
6.16
2.81
3.09
2.71, 3.05
2.77, 3.01
2.82, 3.16/3.19
6.21
144
-
5.49
5.44
5.45
5.51
8.33
145
4.77
-
-
-
-
-
a Cигналы бензоилоксигруппы: 7.49 (м-Ph), 7.62 (п-Ph), 8.17 (о-Ph).
b Cигналы этоксигруппы: 1.18 (CH3), 3.55 и 3.85 (CH2).
c Верхний изомер - сигналы этоксигруппы: 1.19 (CH3), 3.52 и 3.84 (CH2); сигналы бензоилоксигруппы: 7.51 (м-Ph), 7.63 (п-Ph), 8.20
(о-Ph). Нижний изомер - сигналы этоксигруппы: 1.20 (CH3), 3.54 и 3.84 (CH2); сигналы бензоилоксигруппы: 7.51 (м-Ph), 7.63
п-Ph), 8.20 (о-Ph).
d Растворитель CD3OD; сигналы этоксигруппы: 1.20 (CH3), 3.57 и 3.81(CH2).
e Сигналы бензоилоксигруппы: 7.51 (м-Ph), 7.64 (п-Ph), 8.20 (о-Ph).
f В ссылке [4] для Δ15-производных конфигурация протонов при С-12 указана неверно.
3-Гидрокси-17β-этоксипирролидино-
Осадок трижды сонифицировали с 10 мл метанола, от-
[2',3':14β,15β]-эстра-1,3,5(10)-триена гидрохлорид
деляя метанол центрифугированием. Водную и мета-
18. К 0.07 г (0.15 ммоль) эфира 17 добавили 1.5 мл
нольную фракции объединили, упарили, осадок раст-
(1.8 ммоль) 1.2 М раствора DIBAH в толуоле,
ворили в метаноле, профильтровали, фильтрат упа-
образовавшийся раствор кипятили 4 ч, охладили до
рили, осадок промыли хлористым метиленом и высу-
комнатной температуры и медленно вылили в 10 мл
шили. Остаток после высушивания (0.055 г) раст-
охлажденной воды. Образовавшуюся суспензию
ворили в смеси 1 мл метанола и 0.2 мл 5М соляной
интенсивно перемешивали 30 мин, после чего воду
кислоты, раствор перемешивали 1 ч, после чего
отделили центрифугированием (15 мин, 5000 об/мин).
добавили 10 мл эфира. Выпавшее масло отделили,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
ХЕМОСЕЛЕКТИВНЫЙ СИНТЕЗ 14β-(ИЗОКСАЗОЛ-3-ИЛ)МЕТИЛСТЕРОИДОВ
261
Таблица 6. Параметры спектров ЯМР 1Н 19, 21-24, 26 соединений в CDCl3.
№ атома
21
19aa
19bb
22ac
23d
24e
26f
1
7.15
7.31
7.30
7.30
7.15
7.28
7.16
2
6.67
6.86
6.84
6.85
6.66
6.86
6.66
4
6.60
6.80
6.79
6.80
6.57
6.80
6.57
6
2.83
2.85
2.85
2.87
2.77
2.83
2.78
7α
1.51
1.38
1.37
1.39
1.38
1.40
1.36
7β
2.09
2.09
2.10
2.09
2.03
2.09
2.04
8
1.61
1.68
1.77
1.68
1.51
1.54
1.51
9
2.66
2.62
2.60
2.62
2.55
2.60
2.54
11α
2.31
2.30
2.27
2.28
2.27
2.29
2.26
11β
1.40
1.34
1.41
1.34
1.32
1.37
1.32
12α
1.62
1.64
1.51
1.61
1.62
1.64
1.63
12β
1.40
1.64
1.51
1.61
1.62
1.64
1.63
15α
2.22
2.16
2.04
2.14
2.09
2.09
2.08
15β
1.95
1.55
1.68
1.57
1.73
1.76
1.75
16α
2.42
1.61
2.48
1.59
1.66
1.65
1.66
16β
1.83
2.25
1.79
2.23
2.34
2.34
2.35
17α/β
-
4.99
4.90
4.98
5.11
5.14
5.12
18
1.20
1.03
0.95
1.03
1.06
1.05
1.06
141
2.65, 2.98
2.75, 2.92
2.95, 3.16
2.78, 2.96
2.09, 2.30
2.06, 2.26
2.04, 2.25
143
6.21
6.21
6.16
6.26
5.09
5.12
5.11
144
8.32
-
-
8.33
9.05
-
-
145
-
5.15
5.15
-
-
2.06
2.06
a Сигналы ацетоксигрупп: 2.05 (17-СН3), 2.13 (145-СН3), 2.29 (3-СН3).
b Сигналы ацетоксигрупп: 2.12 (17-СН3 и 145-СН3), 2.29 (3-СН3).
c Сигналы ацетоксигрупп: 2.04 (17-СН3), 2.28 (3-СН3).
d Сигналы ацетокси- и аминогрупп: 2.06 (17-СН3), 5.38 и 10.11 (NH2).
e Сигналы ацетокси- и аминогрупп: 2.07 (17-СН3), 2.28 (3-СН3), 5.06 и 10.00 (NH2).
f Сигналы ацетокси- и аминогрупп: 2.06 (17-СН3), 5.01 и 10.02 (NH2).
промыли эфиром до pH 7 и высушили. Получили
смесь охладили, разбавили
10
мл CHCl3
и
0.036 г (64%) стероида 18. Т. пл. 284-287°С (эфир).
отфильтровали гидрокарбонат натрия. Фильтрат
Спектры ЯМР 1Н и 13С см. табл. 2. Масс-спектр
упарили и остаток хроматографировали на
(ESI), m/z (Iотн, %): 342.5
(100)
[M+H]+. ВРМС:
колонке с силикагелем (толуол-этилацетат, 5:1).
Мнайд. 342.2424. C22H32NO+. Мвыч. 342.2428.
Получили в порядке элюирования 0.026 г (26%)
исходного нитросоединения
6,
0.044 г
(43%)
Присоединение пропаргилового спирта к
соединения 10 и 0.022 г (28%) соединения 11.
нитроаддукту 6. а. К раствору 0.100 г (0.21 ммоль)
Конверсия - 98%.
нитросоединения
6 в
15.2 мл изопропанола
добавили 0.172 г (2.05 ммоль) NaHCO3, 0.35 мл
б. К раствору 0.180 г (0.37 ммоль) нитросое-
пропаргилового спирта и 0.8 мл (5%) воды. Смесь
динения 6 в 50 мл изопропанола добавили 0.31 г
дегазировали и кипятили 6 ч. Затем реакционную
(3.69 ммоль) NaHCO3,
0.48 мл пропаргилового
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
262
БАРАНОВСКИЙ и др.
спирта и 0.67 мл воды (39.12 ммоль, 1%). Смесь
13C, δ, м.д.: 15.2 (CH3CH2O), 23.1 и 23.2 (C18), 25.0
дегазировали, заполнили аргоном и кипятили 18 ч.
(C7), 27.7 (C11), 28.0 и 28.1 (C12), 30.6 и 30.7 (C6),
Затем реакционную смесь охладили, упарили,
31.3 и 31.4 (C14i), 33.4 и 33.5 (C9), 41.8 и 42.0 (C8),
добавили насыщенный раствор NH4Cl и
46.3 (C-143), 52.3 (С13), 54.87 и 54.93 (С14), 63.69 и
органическую фазу экстрагировали СHCl3.
63.71 (CH3CH2O), 101.8 (C14iv), 119.57 и
119.59
Экстракт высушили над Na2SO4, растворитель
(C2), 121.1 (C4), 128.6 (C1), 128.7 (Cм), 129.8 (Cи),
упарили и остаток хроматографировали на колонке
130.3 (Cо), 132.2 и 132.3 (C16), 133.6 (Cп), 137.2 и
с силикагелем (толуол-этилацетат, 5:1). Получили
137.3 (C10), 138.8 и 138.8 (C5), 148.5 (C3), 156.6 и
в порядке элюирования 0.067 г (37%) нитросое-
156.7 (C14ii), 164.6 (C15), 165.5 (СOPh), 213.4 (C17).
динения 6, 0.09 г (50%) 3-бензоилокси-14β-[(5'-
Масс-спектр (APCI), m/z (Iотн,
%):
500.1
(100)
гидроксиметил)-изоксазол-3'-илметил]-эстра-
[M+H]+. ВРМС: Мнайд. 500.2435. C31H34NO5+. Мвыч.
1,3,5(10),15-тетраен-17-она
10.
ИК спектр
500.2431.
(пленка), ν, см-1: 3350, 2935, 2870, 1730, 1700, 1610,
3-Гидрокси-14β-(5'-этоксиизоксазолин-3'-
755. Спектры ЯМР 1Н и 13С см. табл. 3, 5. Масс-
илметил)эстра-1,3,5(10),15-тетраен-17-он
13. К
спектр (ESI), m/z (Iотн, %): 484.1 (100) [M+H]+, 466.2
раствору 0.083 г (0.17 ммоль) стероида 12 в 2 мл
(59) [M+H-H2O]+. Найдено, %: С 74.71; Н 5.96; N
этанола и 0.2 мл воды добавили 0.011 г (0.2 ммоль)
2.77; М 483.6. C30H29NO5. Вычислено, %: С 74.52;
KOН. Полученную смесь перемешивали 1 ч и
Н 6.05; N 2.90; и 0.013 г (9%) 3-гидрокси-14β-[(5'-
нейтрализовали
10% уксусной кислотой, затем
гидроксиметил)-изоксазол-3'-илметил]-эстра-
растворители упарили до минимального объема
1,3,5(10),15-тетраен-17-она 11. Спектр ЯМР 1H, δ,
без нагревания. К остатку добавили раствор NaCl,
м.д. (CDCl3): 1.24 с (3H, С18-Н3), 3.12 д (1H, J 15.5 Гц,
органическую фазу экстрагировали хлороформом и
H14i), 3.21 д (1H, J 15.5 Гц, H14i), 4.81 с (2H, H14v),
высушили над Na2SO4. После удаления
6.20 с (1H, H14iii), 6.33 д (1H, J 6 Гц, H16), 6.53 д (1H,
растворителя остаток очищали на колонке с
J 2.5, Н4), 6.64 д.д (1H, J 8.5, 2.5 Гц, H2), 7.01 д (1H,
силикагелем (толуол-этилацетат, 5:1). Получили
J 8.5 Гц, H1), 7.45 д (1H, J 6 Гц, H15). Спектр ЯМР
0.054 г (80%) стероида 13. ИК спектр (KBr), ν, см-1:
13С см. табл. 3. Масс-спектр (APCI), m/z (Iотн, %):
3365, 2930, 1705, 1695, 1610, 1090, 760. Спектры
380.2
(95)
[M+H]+,
362.3
(100)
[M+H-H2O]+.
ЯМР 1Н и 13С см. табл. 3, 5. Масс-спектр (APCI),
Конверсия 95%.
m/z (Iотн, %): 396.0 (100) [M+H]+, 350.2 (11) [M+H-
3-Бензоилокси-14β-(5'-этоксиизоксазолин-3'-
EtOH]. ВРМС: Мнайд. 396.2174. C24H30NO+. Мвыч.
илметил)эстра-1,3,5(10),15-тетраен-17-он
12. К
396.2169.
раствору 1.00 г (2.05 ммоль) нитросоединения 6 в
3-Бензоилокси-14β-(5'-этоксиизоксазолин-3'-
152 мл изопропанола добавили 1.725 г (20.53 ммоль)
илметил)эстра-1,3,5(10)-триен-17-он
14.
К
NaHCO3, 3.94 мл винилэтилового эфира и 8 мл
раствору 1.30 г (2.61 ммоль) соединения 12 в 80 мл
воды. Смесь дегазировали, заполнили аргоном и
этанола добавили 0.60 г (9.37 ммоль) HCO2NH4 и
кипятили 12 ч, затем реакционную смесь охладили,
0.2 г 5% палладия на угле. Смесь дегазировали,
разбавили 60 мл CHCl3 и отфильтровали гидрокар-
заполнили аргоном и перемешивали 3 ч при 40-50°С,
бонат натрия. Фильтрат упарили и остаток хрома-
затем охладили, отфильтровали катализатор и
тографировали на колонке с силикагелем (толуол-
фильтрат упарили. Остаток очищали на колонке с
этилацетат, 3:1). Получили 0.935 г (91%) смеси
силикагелем (толуол-этилацетат, 3:1). Получили
изоксазолинов 12. Т. пл. 121-122°С (EtOH). ИК
1.161 г (89%) смеси изоксазолинов 14. Изомеры
спектр (пленка), ν, см-1 2840, 1720, 1695, 1425,
были разделены для аналитических целей методом
1295, 935. Спектр ЯМР 1H, δ, м.д. (CDCl3): 1.11 и
препаративной ТСХ. IR (пленка) ν, см-1: 2930,
1.12 два с (3H, С18-Н3), 1.17 два т (3H, J 7,
2865, 1734, 1265, 1065, 710. Спектры ЯМР 1Н и 13С
CH3CH2O), 2.30 м (1H, H9α), 2.73 д (1H, J 16 Гц,
см. табл. 3, 5. Масс-спектр (ESI), m/z (Iотн, %): 524.2
H14i), 2.80 м (3H, Н6 и H14iii), 2.91 два д (1H, J 16 Гц,
(31) [M+Na]+, 502.2 (100) [M+H]+.
H14i), 3.08 два д (1H, J 6.5, 1.5 Гц, H14iii), 3.55 м (1H,
CH3CH2O), 3.85 м (1H, CH3CH2O), 5.48 два м (1H,
3-Гидрокси-14β-(5'-этоксиизоксазолин-3'-
H14iv), 6.30 д (1H, J 6 Гц, H16), 6.86 д (1H, J 2 Гц, Н4),
илметил)эстра-1,3,5(10)-триен-17-он
15.
По
6.94 д.д (1H, J 2.5, 8.5 Гц, H2), 7.15 д (1H, J 8.5 Гц,
вышеприведенной методике для соединения 14 из
H1), 7.39 два д (1H, J 6 Гц, H15), 7.49 уш.т (2H, J 8 Гц,
0.112 г
(0.28 ммоль) смеси изоксазолинов
13
Hм), 7.62 м (1H, Hп), 8.17 м (2H, Hо). Спектр ЯМР
получили 0.070 г (63%) смеси изоксазолинов 15 в
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
ХЕМОСЕЛЕКТИВНЫЙ СИНТЕЗ 14β-(ИЗОКСАЗОЛ-3-ИЛ)МЕТИЛСТЕРОИДОВ
263
виде масла. ИК спектр (пленка), ν, см-1: 3385, 2930,
очищали на колонке с силикагелем и получили
2865, 1730, 1090, 755. Спектры ЯМР 1Н и 13С см.
смесь триолов (0.095 г, 89%), изомерных по С17 в
табл. 3, 5. Масс-спектр (APCI), m/z (Iотн, %): 398.1
соотношении 17α-17β 1,5:1 (Масс-спектр (ESI), m/z
(100) [M+H]+. Найдено, %: С 72.76; Н 7.83; N 3.41;
(Iотн, %): 384.2 (75) [M+Н]+, 366.1 (100) [M+H-H2О]+),
М 397. C24H31NO4. Вычислено, %: С 72.52; Н 7.86;
Триолы (0.095 г, 0.25 ммоль) растворили в 12 мл
N 3.52.
этилацетата и добавили 0.153 мл (1.62 ммоль)
уксусного ангидрида и
5 мкл
60% хлорной
3-Бензоилокси-14β-(изоксазол-3'-илметил)-
кислоты. Образовавшийся раствор перемешивали
эстра-1,3,5(10)-триен-17-он 20. К раствору 0.60 г
при комнатной температуре
0.5
ч, затем
(1.20 ммоль) стероида 14 в 10 мл MeCN добавили
нейтрализовали
10 мл насыщенным раствором
0.057 г (0.33 ммоль) п-TsOH. Смесь дегазировали,
NaHCO3 и органическую фазу проэкстрагировали
заполнили аргоном и перемешивали 2,5 ч при 80°С.
этилацетатом. Экстракт высушили над Na2SO4,
После кипячения смесь охладили, нейтрализовали
растворитель упарили и остаток очищали на
насыщенным раствором NaHCO3, органическую
колонке с силикагелем (толуол-этилацетат, 1:1).
фазу экстрагировали этилацетатом и высушили над
Получили 0.124 г (97%) смеси триацетатов 19. ИК
Na2SO4. После удаления растворителя остаток
спектр (пленка), ν, см-1: 2940, 2865, 1750, 1245,
упарили и разделяли на колонке с силикагелем
1215, 1020, 755. Масс-спектр (ESI), m/z (Iотн, %):
(толуол-этилацетат,
3:1). Получили в порядке
532.2
(23)
[M+Na]+,
450.1
(100)
[M+H-AcOH]+.
элюирования 0.388 г (71%) изоксазола 20. ИК
Эпимеры 19a (17α-ацетат) и 19b (17β-ацетат) были
спектр (пленка), ν, см-1: 2930, 2865, 1735, 1495,
частично разделены методом препаративной ТСХ.
1265, 1065, 755. Спектры ЯМР 1Н и 13С см. табл. 3,
Спектры ЯМР 1Н и 13С см. табл. 4, 6.
5. Масс-спектр (ESI), m/z (Iотн, %):
456.0
(100)
[M+H]+,
438
(18)
[M+H-H2O]+. ВРМС: Мнайд.
3,17-Диацетокси-14β-(изоксазол-3'-илметил)-
456.2169. C29H30NO4+. Мвыч. 456.2169; и 0.085 г
эстра-1,3,5(10)-триен
22. По вышеприведенной
(20%) изоксазола 21.
методике для стероида 19, из 0.20 г (0.40 ммоль)
смеси стероидов 12 получили 0.147 г (84% из
3-Гидрокси-14β-(изоксазол-3'-илметил)эстра-
стероидов 12) смеси изоксазолов 22 в соотношении
1,3,5(10)-триен-17-он
21. К раствору
0.30 г
17α-17β
1.3:1 (по данным интегрирования в
(0.66 ммоль) соединения 20 в 10 мл 96% этанола
спектре ЯМР). Масс-спектр (ESI), m/z (Iотн, %):
добавили
0.277 г
(3.3 ммоль) NaHCO3. Смесь
460.2 (17) [M+Na]+,438.0 (9) [M+H]+, 378.2 (100)
дегазировали, заполнили аргоном и перемешивали
[M+H-AcOH]+.
17α-Изомер
22а был частично
3 ч при 60°С, затем охладили и растворитель
отделен методом препаративной ТСХ. Спектры
упарили. Остаток разбавили водой и органическую
ЯМР 1Н и 13С см. табл. 4, 6. ВРМС: Мнайд. 378.2059.
фазу экстрагировали этилацетатом. Экстракт
C24H28NO+. Мвыч. 378.2064 [M+H-AcOH]+.
высушили над Na2SO4, упарили растворитель и
остаток хроматографировали на колонке с
14β-(2'-амино-4'-оксобут-2'-енил)-17α-ацетокси-
силикагелем (толуол-этилацетат, 3:1). Получили
3-гидроксиэстра-1,3,5(10)-триен
23. К раствору
0.209 г (90%) изоксазола 21 в виде масла. ИК
0.020 г (46 мкмоль) соединения 22а в 5 мл MeOH
спектр (пленка), ν, см-1: 3360, 2930, 2865, 1725, 760.
добавили 0.03 г суспезии никеля Ренея в метаноле.
Спектры ЯМР 1Н и 13С см. табл. 4, 6. Масс-спектр
Смесь дегазировали, заполнили водородом и
(APCI), m/z (Iотн, %): 352.2 (100) [M+H]+, 334.5 (22)
перемешивали 16 ч при комнатной температуре в
[M+H-H2O]. ВРМС: Мнайд. 352.1903. C22H26NO3+.
атмосфере водорода. Катализатор отфильтровали, а
Мвыч. 352.1907.
фильтрат упарили. Остаток делили методом препа-
ративной ТСХ (петролейный эфир-этилацетат,
14β-(5'-Ацетоксиметилизоксазол-3'-илметил)-
5:3). Получили
0.009 г
(50%) соединения
23.
3,17-диацетоксиэстра-1,3,5(10)-триен
19.
К
Спектры ЯМР 1Н и 13С см. табл. 4, 6. Масс-спектр
раствору 0.134 г (0.28 ммоль) соединения 10 в 10 мл
(ESI), m/z (Iотн, %): 420.2 (9) [M+Na]+, 398.2 (100)
ТГФ добавили 0.10 г (2.64 ммоль) NaВН4 и 2 мл
[M+H]+. ВРМС: Мнайд. 398.2328. C24H32NO+. Мвыч.
метанола. Раствор перемешивали при комнатной
398.2326.
температуре 1 ч, затем к нему добавили 10 мл
насыщенного раствора NH4Cl после чего орга-
14β-(2'-амино-4'-оксопент-2'-енил)-3,17α-ди-
ническую фазу экстрагировали CHCl3 и высушили
ацетоксиэстра-1,3,5(10)-триен 24. По вышеприве-
над Na2SO4. После удаления растворителя остаток
денной методике для соединения 23, из 0.015 г
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
264
БАРАНОВСКИЙ и др.
(29 мкмоль) стероида
19а получили
0.009 г
встряхивали плато для растворения образовавшихся
(69%) соединения 24. ИК спектр (пленка), ν, см-1:
кристаллов формазана и оптическую плотность
3405, 3185, 2925, 2855, 1730, 1605, 1520, 1250,
(ОП) полученных растворов анализировали на
755. Спектры ЯМР
1Н и 13С см. табл. 4,
6.
спектрофотометре MultiScan FC (ThermoFisher)
Масс-спектр (ESI), m/z (Iотн,
%):
454.4
(100)
при 571 нм. Далее из значений ОП вычитали ОП в
[M+H]+. ВРМС: Мнайд. 454.2581. C27H36NO+. Мвыч.
лунках, не содержащих клеток; за 100% принимали
454.2588.
ОП растворов, полученных в контрольных
образцах. Эксперимент повторяли трижды.
14β-(2'-амино-4'-оксопент-2'-енил)-17α-ацето-
кси-3-гидроксиэстра-1,3,5(10)-триен
26.
К
ФОНДОВАЯ ПОДДЕРЖКА
раствору 0.006 г (13 мкмоль) соединения 24 в 5 мл
MeOH добавили
1 мл насыщенного раствора
Работа выполнялась при финансовой поддержке
NaHCO3. Смесь перемешивали 8 ч при 40°С, затем
БРФФИ (грант № Х17-013), РНФ (грант № 14-15-
реакционную смесь охладили и упарили. Остаток
00362, эксперименты с клеточными культурами) и
разделяли методом препаративной ТСХ (петролей-
гранта Президента РБ (2016).
ный эфир-этилацетат, 1:1). Получили 0.002 г (37%)
соединения 26. ИК спектр (пленка), ν, см-1: 3380,
КОНФЛИКТ ИНТЕРЕСОВ
3190, 2930, 2865, 1715, 1610, 1520, 1250,
755.
Спектры ЯМР 1Н и 13С см. табл. 4, 6. Масс-спектр
Авторы заявляют об отсутствии конфликта
(ESI), m/z (Iотн, %): 412.1
(100)
[M+H]+. ВРМС:
интересов.
Мнайд. 412.2477. C25H34NO+. Мвыч. 412.2482.
Исследование цитотоксической активности.
СПИСОК ЛИТЕРАТУРЫ
Клетки рака молочной железы MCF-7, MDA-MB-
231 и T-47D, рака кишечника HCT
116, рака
1.
Baranovsky A.V., Bolibrukh D.A., Schneider B.
предстательной железы 22Rv1 и рака легкого A549
Steroids. 2015, 104, 37. doi 10.1016/j.steroids.2015.08.009
получены из коллекции ATCC.
2.
Барановский А.В., Бильдюкевич В.Н., Голубева М.Б.,
Кузьмицкий Б.Б., Мамчиц Ю.Ю. Биоорг. Химия.
Культивирование клеток проводили в стандарт-
2016, 42, 94. [Baranovsky A.V., Bil’dyukevich V.N.,
ной среде DMEM (Hyclone) с добавлением 10%
Golubeva M.B., Kuzmitsky B.B., Mamchits Yu. Yu.
эмбриональной сыворотки телят (Hyclone), 0.1 мг/мл
Russ. J. Bioorg. Chem. 2016, 42, 83.] doi 10.1134/
пирувата натрия (Santa Cruz), 50 ед/мл пеницил-
S1068162015060023
лина и 50 мкг/мл стрептомицина. Для проведения
3.
Pataki J., Siade G. J. Org. Chem. 1972, 37, 2127.
экспериментов использовали клеточный инкубатор
4.
Baranovsky A.V., Bolibrukh D.A., Khripach V.A.,
NU-5840E (NuAir) с поддержанием необходимых
Schneider B. Arkivoc.
2008,
9,
29. doi
10.3998/
условий (37°С, атмосфера, содержащая 5% СО2,
ark.5550190.0009.904
при относительной влажности 85-90%).
5.
Барановский А.В., Голубева М.Б. ХПС. 2016, 730.
[Baranovskii A.V, Golubeva M.B. Chem. Nat. Comp.
Для проведения биологических испытаний
2016, 52, 856.] doi 10.1007/s10600-016-1796-z
стероиды 11, 13, 15 и 21 растворяли в ДМСО в
6.
Nicolaou K. C., Hao J, Reddy M.V., Rao P.B., Rassias G.,
концентрации 10 мМ и хранили при -20 С до
Snyder S.A., Huang X., Chen D.Y.-K., Brenzovich W.E.,
проведения исследований. Опухолевые клетки
Giuseppone N., Giannakakou P, O'Brate A. J. Am.
рассевали на
24-луночное плато (Corning) по
Chem. Soc. 2004, 126, 12897. doi 10.1021/ja040093a
40000 клеток в лунку и через
24 ч. вносили
7.
Kopka I.E., Lin L.S., Jewell J.P., Lanza T.J., Fong T.M.,
соединения в интервале концентраций от 6 до 50 мкМ.
Shen C.-P., Lao Z.J., Ha S., Castonguay L.G., Van der
К контрольным клеткам добавляли соответствующий
Ploeg L., Goulet M.T., Hagmann W.K. Bioorg. Med.
объем растворителя (ДМСО), при этом его конеч-
Chem. Lett. 2010, 20, 4757. doi 10.1016/j.bmcl.2010.06.127
ная концентрация в среде не превышала 0.5%.
8.
Brewster J.H. Comprehensive organic synthesis. Ed.
Через
72 часа роста с соединениями среду
B.M. Trost. Oxford-New York-Seoul-Tokyo:
Pergamon Press. 2007, 8, 211.
удаляли и вносили к клеткам МТТ реагент
(AppliChem) на 2 ч. Тест выполнен в модификации,
9.
Singh V., Vedantham P., Sahu P.K. Tetrahedron. 2004,
60, 8161. doi 10.1016/j.tet.2004.06.096
описанной ранее [18]. После окончания инкубации
клетки лизировали в 100% ДМСО (AppliChem);
10.
Fajkos J. Chem. Listy. 1957, 51, 1894.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
ХЕМОСЕЛЕКТИВНЫЙ СИНТЕЗ 14β-(ИЗОКСАЗОЛ-3-ИЛ)МЕТИЛСТЕРОИДОВ
265
11. Yermolina M.V., Wang J.-Z., Caffrey M., Rong L.-J.L.,
16. Васильев Н.В., Савостин В.С., Коломиец A.Ф.,
Wardrop D.J. J. Med. Chem.
2011, 54,
765. doi
Сокольский Г.А. ХГС. 1989, 25, 663. [Vasil’ev N.V.,
10.1021/jm1008715
Savostin V.S., Kolomiets A.F., Sokol’skii G.A. Chem.
12. Entwistle I.D., Wood W.W. Comprehensive organic
Heterocycl. Compd.
1989,
25,
555.] doi
10.1007/
synthesis. Ed. B.M. Trost. Oxford-New York-Seoul-
BF00482506
Tokyo: Pergamon Press. 2007, 8, 955.
17. Armarego W.L.F., Chai C.L.L. Purification of
13. Grundmann C., Grunanger P. The nitrile oxides. New
Laboratory Chemicals, 5th Ed. Oxford: Butterworth-
York: Springer-Verlag. 1971.
Heinemann. 2003.
14. Херузе Ю.И., Галишев В.А., Петров А.А. ЖОрХ.
18. Scherbakov A.M., Komkov A.V., Komendantova A.S.,
1988, 24, 944.
Yastrebova M.A., Andreeva O.E., Shirinian V.Z.,
15. Schmitt D.C., Lam L., Johnson J.S. Org. Lett. 2011, 13,
Hajra A., Zavarzin I.V., Volkova Y.A. Front
5136. doi 10.1021/ol202002r
Pharmacol. 2018, 8, 979. doi 10.3389/fphar.2017.00979
Chemoselective Synthesis of the 14β-(Isoxazol-3-yl)methyl Estrane
Steroidsand Their Transformation with the Cleavage
of Heterocyclic Nucleus
A. V. Baranovskya, *, A. S. Ladykoa, V. A. Shatskayab, and A. M. Scherbakovb
a Institute of bioorganic chemistry of the NAS, 220147, Belarus, Minsk, ul. Kuprevicha 5/2
*e-mail: baranovsky@iboch.by
b N.N. Blokhin National Medical Research Center of Oncology, 115522, Russia, Moscow, Kashirskoe shosse 24
**e-mail: alex.scherbakov@gmail.com
Received May 16, 2018
Revised May 23, 2018
Accepted December 1, 2018
Synthesis of steroids bearing an isoxazole, isoxazoline, enaminocarbonyl substituent at C-14 and a fused C-14 -
C-15 pyrrolidine ring was fulfilled. The influence of solvents on the result of dipolar cycloaddition and the
solvolysis of bridged nitrosteroids was evaluated. The cytostatic properties of estrone analogues were analyzed
on tumor cells of various origins. The activity of the compounds to breast cancer, intestinal cancer, prostate
cancer and lung cancer cells was revealed.
Keywords: estradiol, dipolar cycloaddition, hydrogenolysis, nitrile oxides, enamino ketones, lactams, NMR,
human tumor cell cultures
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019