ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, Том 55, № 2, с. 266-278
УДК 547.1'123 + 547.789.1 + 547.812 + 548.737 + 547.814.1 + 547.825
МНОГОКОМПОНЕНТНЫЕ СИНТЕЗЫ ПРОИЗВОДНЫХ
ТИАЗОЛА, СЕЛЕНАЗОЛА, ПИРАНА И ПИРИДИНА,
ИНИЦИИРУЕМЫЕ РЕАКЦИЕЙ КНЁВЕНАГЕЛЯ
© 2019 г. И. В. Дяченкоa, В. Д. Дяченкоa, П. В. Дороватовскийb,
В. Н. Хрусталевb, c, В. Г. Ненайденкоd, *
a Луганский национальный университет им. Тараса Шевченко, 91011, Украина, г. Луганск, ул. Оборонная 2
b Национальный исследовательский центр «Курчатовский институт», 123182, Россия, г. Москва, ул. Академика Курчатова 1
c ФГАОУ ВО «Российский университет дружбы народов», 117198, Россия, г. Москва, ул. Миклухо-Маклая 6
d ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова», 119991, Россия, г. Москва, Ленинские горы 1
*e-mail: nenajdenko@gmail.com
Поступила в редакцию 1 июня 2018 г.
После доработки 16 июня 2018 г.
Принята к публикации 14 августа 2018 г.
На основе многокомпонентной конденсации, инициируемой реакцией Кнёвенагеля, синтезированы (2Е,
2'Е)-3,3'-[пропан-1,3-диилбис(окси)бис(4,1-фенилен)]бис[2-(4-(4-арилтиазол-2-ил))акрилонитрилы],
функционально замещенные пиридины и конденсированные пираны, содержащие в положении 3 тио-
(селен)азольный заместитель. Строение
2-амино-5-оксо-4-(1-фенилэтил)-4,5-дигидропирано[3,2-c]-
хромен-3-карбонитрила и
2-амино-7-гексилокси-4-циклогексил-4Н-хромен-3-карбонитрила изучено
методом РСА.
Ключевые слова: тиазол, селеназол, пиран, пиридин, реакция Кнёвенагеля, рентгеноструктурный
анализ.
DOI: 10.1134/S0514749219020137
Производные тиазола, пирана и пиридина
Показано, что конденсация
4-гидрокси-3-
широко представлены в природе, что обуслав-
этоксибензальдегида 1a с цианотиоацетамидом 2a,
ливает постоянный интерес исследователей к
4-бутилфенацилбромидом 3а и аллилбромидом 4
указанным гетероциклам. Среди синтетических
приводит к образованию (Е)-3-(4-аллилокси-3-
замещенных тиазола обнаружены вещества с
этоксифенил)-2-[4-(4-бутилфенил)тиазол-2-ил]-
противоопухолевыми [1, 2], противовирусными [3]
акрилонитрила
5.
Конденсация эффективно
и бактерицидными
[4] свойствами. Некоторые
протекает в ДМФА при 20°С в присутствии 10%-
производные пирана эффективны при лечении рака
ного водного раствора NaOH и включает
(активаторы каспазы и индуктов апоптоза) [5] и
образование в качестве интермедиатов реакции
нейрогенеративных заболеваний
[6]. Функцио-
алкена Кнёвенагеля А, который затем прев-
нализированные пиридины пригодны для лечения
ращается в тиазол Ганча В. Последний легко
себорейного дерматита [7], болезни Альцгеймера
алкилируется аллилбромидом 4 по Вильямсону,
[8] и заболеваний ЦНС [9]. Продолжая иссле-
что приводит к простому эфиру 5 (схема 1).
дования многокомпонентных конденсаций,
приводящих к получению потенциально
Применение в данной многокомпонентной
биологически активных производных тиазола,
конденсации ароматических альдегидов
1a, b,
пирана и пиридина
[10-12] нами изучены
фенацилбромидов 3b, c и 1,3-дибромпропана 6 при
инициируемые реакцией Кнёвенагеля много-
прочих равных условиях позволяет получать
компонентные синтезы ранее неизвестных
(2Е,2'Е)-3,3'-[пропан-1,3-диилбис(окси)бис(4,1-
соединений указанных выше классов гетеро-
фенилен)]бис[2-(4-(4-арилтиазол-2-ил))акрило-
циклов.
нитрилы] 7а-с. Таким образом, все стадии реакции
266
МНОГОКОМПОНЕНТНЫЕ СИНТЕЗЫ ПРОИЗВОДНЫХ ТИАЗОЛА, СЕЛЕНАЗОЛА
267
Схема 1.
S
NH2
Bu
NH2
NC
CN
Br
CHO
S
O
2a
3a
_H2O
_HBr, _H
2O
HO
OEt
OEt
OH
1a
A
Bu
Bu
S
N
S
N
CN
Br
CN
4
OEt
O
OEt
HO
5
B
удается провести в одной колбе, достигая сущест-
Взаимодействие 2-фенилпропионового альдегида
венного возрастания молекулярной сложности
1с с цианотиоацетамидом 2a и 4-гидроксикумари-
(схема 2).
ном 8 в ДМФА в присутствии N-метилморфолина
Схема 2.
R1
R
R
R
OH
OH
Br
OH
2a
O
3b, c
OHC
_H2O
H2N
_HBr, _H2O
R1
CN
N
1a, b
CN
S
S
A
B
R1
R1
Br
Br
6
N
N
R
S
R
S
CN
O
CN
O
7a_c
1, R = 4-OH-3-OEtC6H3 (a), = 4-OHC6H4 (b); 3, R1 = 4-MeC6H4 (b), 4-MeOC6H4 (с); 7, R = OEt, R1 = 4-MeC6H4 (a); R = H,
R1 = 4-MeC6H4 (b); R = H, R1 = 4-MeC6H4 (c).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
268
Схема 3.
OH
O
R
S
O O
O
NH2
2a
8
RCHO
A
C
OH
1c, d
N
C
Ph
Me
O
O
Ph S
O
Ph S
CN
O
O
NH2
O
NH
2
O NH2
O NH2
_H
2
S
N O
_2[H]
9
10
D
1, R = MeCHPh (c), Ph (d)
при 20°С неожиданно приводит к образованию
присоединяется цианотиоацетамид 2a. Возникший
производного хромена 9. Возникновение данного
таким путем аддукт E хемоселективно циклизуется
продукта можно объяснить каскадом протекающих
в замещенный пиридин-2-тиолат F. Алкилирование
реакций, который, по-видимому, включает:
1)
последнего α-бромкетоном 11 приводит к получе-
присоединение СН-кислоты
8 по Михаэлю к
нию тиоэфира G, вступающего затем во взаимо-
алкену Кнёвенагеля А; 2) внутримолекулярную
действие в щелочной среде с аллилбромидом 4 и
циклизацию образовавшегося интермедиата С в
возникновением конечного простого эфира
конденсированный пиран 9 с элиминированием
Вильямсона 12 (схема 4).
молекулы H2S.
Строение всех полученных соединений
Использование в этой конденсации бензальде-
подтверждено комплексом спектральных методов
гида 1d в аналогичных указанным выше условиях
(см. экспериментальную часть). Отметим наличие
привело к образованию
2,5-диоксо-4-фенил-3,5-
в спектре ЯМР 1Н замещенного акрилонитрила 5
дигидро-2Н-хромено[4,3-b]пиридин-3-карботио-
характерных сигналов протонов аллильного
амида
10.
Вероятно, в условиях реакции
заместителя [17, 18], а в простых эфирах 7а-с
сооветствующий пиран D претерпел рециклизацию
сигналов протонов пропильного фрагмента в
Димрота [13] (схема 3).
соответствующих областях δ. Определение
геометрической изомерии осуществлялось с
Взаимодействие
4-этоксибензальдегида
1е с
учетом данных работы [19]. Для однозначного
двукратным избытком цианотиоацетамида
2a,
установления строения продуктов данной
эквимолярным количеством
3-(2-бромацетил)-7-
многокомпонентной конден-сации замещенный
гидрокси-2Н-хромен-2-она 11 и аллилбромида 4 в
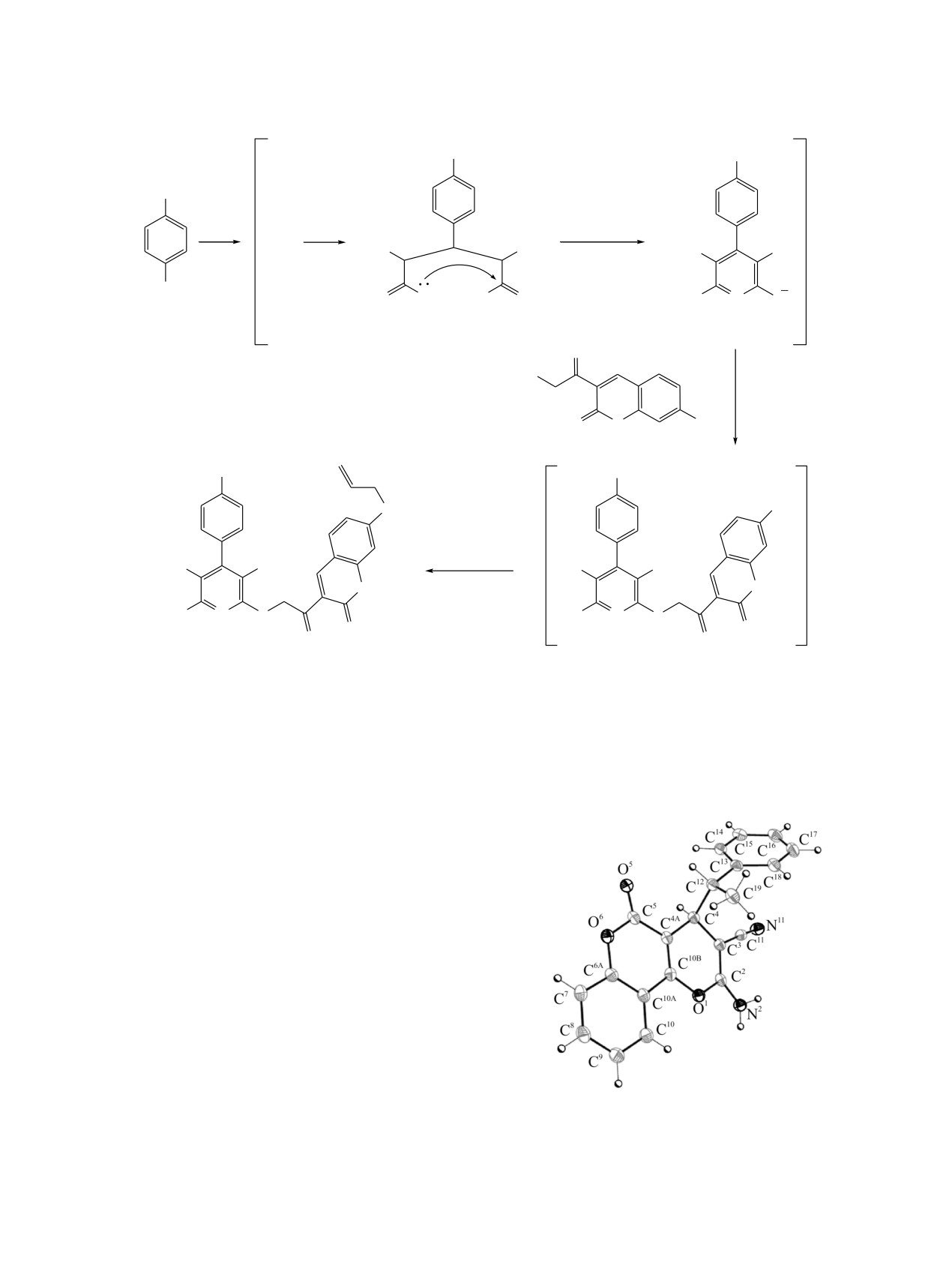
пирано[3,2-c]хромен 9 изучен методом РСА.
ДМФА в присутствии 10%-ного водного раствора
NaOH приводит к образованию 2-[2-(7-аллилокси-2-
Соединение
9 включает трициклическую
оксо-2Н-хромен-3-ил)-2-оксоэтилтио]-6-амино-4-(4
систему из сочлененных пиранового, пиранонового
-этоксифенил)пиридин-3,5-дикарбонитрила
12
-
и бензольного циклов (рис. 1). Бензопираноновый
потенциального синтона для синтеза ансамблей
фрагмент практически плоский (отклонение его
циклов [14-16]. Схема реакции включает возник-
атомов от среднеквадратичной плоскости не
новение соответствующего продукта конденсации
превышает ±0.011°), в то время как пирановый
Кнёвенагеля А, к которому по Михаэлю
цикл принимает конформацию уплощенной ванны
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
МНОГОКОМПОНЕНТНЫЕ СИНТЕЗЫ ПРОИЗВОДНЫХ ТИАЗОЛА, СЕЛЕНАЗОЛА
269
Схема 4.
OEt
OEt
OEt
2a
2a
A
NC
CN
NC
CN
_H2S,
_2[H]
CHO
S
NH2
H2N
S
H2N
N S
1e
E
F
O
Br
O
O
OH
11
OEt
OEt
O
OH
4 / NaOH
NC
CN
NC
CN
O
O
H2N
N S
H2N
N S
O
O
O
O
12
G
с углом перегиба по линии O1…C4 9.15(11)°. Атом
образования алкенов Кнёвенагеля A в качестве
азота N2 имеет тригонально-пирамидальную конфигу-
интермедиатов. Затем протекает реакция Ганча,
рацию (сумма валентных углов равна 354(3)°).
приводящая к соответствующим замещенным
винилтио(селен)азолам В. В дальнейшем
Молекула
9 содержит два асимметрических
происходит присоединение димедона
13 к
центра при атомах углерода C4 и C12. Кристалл
соединения 9 является рацематом и состоит из
энантиомерных пар с относительной конфигура-
цией центров
- rac-(4RS,12RS). В кристалле
молекулы
9 образуют H-связанные слои,
параллельные плоскости
(102), за счет
межмолекулярных водородных связей N-H∙∙∙N и
N-H∙∙∙O (табл. 1, рис. 2).
Также нами изучена многокомпонентная
конденсация, включающая взаимодействие
ароматических альдегидов 1e-h, цианотио(селено)-
ацетамидов 2a, b, α-бромкетонов 3d-f и димедона
13. Данное превращение проводили в ДМФА при
20°С в присутствии морфолина. Каскадное
превращение заканчивается образованием 2-амино-
4-арил(гетарил)-7,7-диметил-3-[4-арил(кумарин-3-
Рис. 1. Молекулярная структура соединения 9. Атомы
ил)тио(селен)азол-2-ил]-7,8-дигидро-4Н-хромен-5
представлены
50%-эллипсоидами анизотропных
(6Н)-онов 14a-d. Реакция включает в себя стадию
смещений.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
270
МНОГОКОМПОНЕНТНЫЕ СИНТЕЗЫ ПРОИЗВОДНЫХ ТИАЗОЛА, СЕЛЕНАЗОЛА
Таблица 1. Водородные связи в структурах 9 и 17.
D-H∙∙∙A
d(D-H), Å
d(H∙∙∙A), Å
d(D∙∙∙A), Å
Угол (DHA), град
Соединение 9
N2-H2A∙∙∙N11a
0.899(15)
2.155(15)
3.0346(17)
165.7(13)
N2-H2B∙∙∙O5b
0.891(16)
2.046(16)
2.9219(15)
167.5(13)
Соединение 17
N2-H2A∙∙∙N9c
0.915(18)
2.247(18)
3.1275(19)
161.3(15)
N2-H2B∙∙∙N9d
0.92(2)
2.38(2)
3.195(2)
148.1(17)
C6-H6∙∙∙O7a
0.95
2.47
3.413(2)
170.0
Кристаллографические операции для генерации симметрически эквивалентных атомов:
a
-x, -y+1, -z+1.
b
-x+1, y-1/2, -z+3/2.
c
-x, -y, -z.
d x+1, y, z.
активированным алкенам B с образованием
денсируются с образованием
2-амино-7-гексил-
соответствующих аддуктов Н, внутримолекулярно
окси-4-циклогексил-4Н-хромен-3-карбонитрила 17 -
циклизующихся в конечные гетероциклические
перспективного полупродукта при создании
системы 14a-d (схема 5). Их спектры ЯМР 1Н
антибактериальных препаратов, эффективных
содержат характеристичные сигналы протонов
против Staphylococcus aureas [23]. Вероятная схема
димедонового фрагмента с типичным расщеп-
конденсации состоит в следующем. На первой
лением и сигнала С4Н-протона пиранового ядра в
стадии образуется продукт реакции Кнёвенагеля -
виде синглета при δ 4.46-4.83 м.д. [20-23].
циклогексилиденцианотиоацетамид A. Далее
следует присоединение резорцина 15 по Михаэлю
Циклогексанкарбоксальдегид 1i, цианотиоацет-
к алкену A. Возникший таким путем аддукт I
амид
2a, резорцин
15 и гексилйодид
16 в
хемоселективно внутримолекулярно гетероцикли-
аналогичных указанным выше условиях кон-
зуется в замещенный пиран K, который вступает в
Рис. 2. Кристаллическая структура соединения 9.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
МНОГОКОМПОНЕНТНЫЕ СИНТЕЗЫ ПРОИЗВОДНЫХ ТИАЗОЛА, СЕЛЕНАЗОЛА
271
Схема 5.
HO
OH
CN
2a, b
15
RCHO
A
1e_i
HO
OH
S
NH2
I
3d_f
O
_H2S
B
Me
O
Me
13
CN
R1
O
R
N
HO
O NH2
K
X
Me
C
OH
Me
N
Me
I
H
16
R1
O
R N
CN
X
Me
O
NH2
Me
O
O NH2
Me
14a
_d
17
1, R = тиофен-2-ил (f), 4-BrC6H4 (g), 2-фурил (h), циклогексил (i); 2, X = Se (b); 3, R1 = кумарин-3-ил (d), Ph (e);
4-PhC6H4 (f); 14, R = 4-EtOC6H4, R1 = кумарин-3-ил, X = S (a); R = 4-BrC6H4, R1 = Ph, X = Se (b); R = 2-фурил, R1 =
4-PhC6H4, X = Se (c); R = тиофен-2-ил, R1 = 4-PhC6H4, X = Se (d).
реакцию Вильямсона с гексилйодидом
16 с
образованием простого эфира 17 (схема 5).
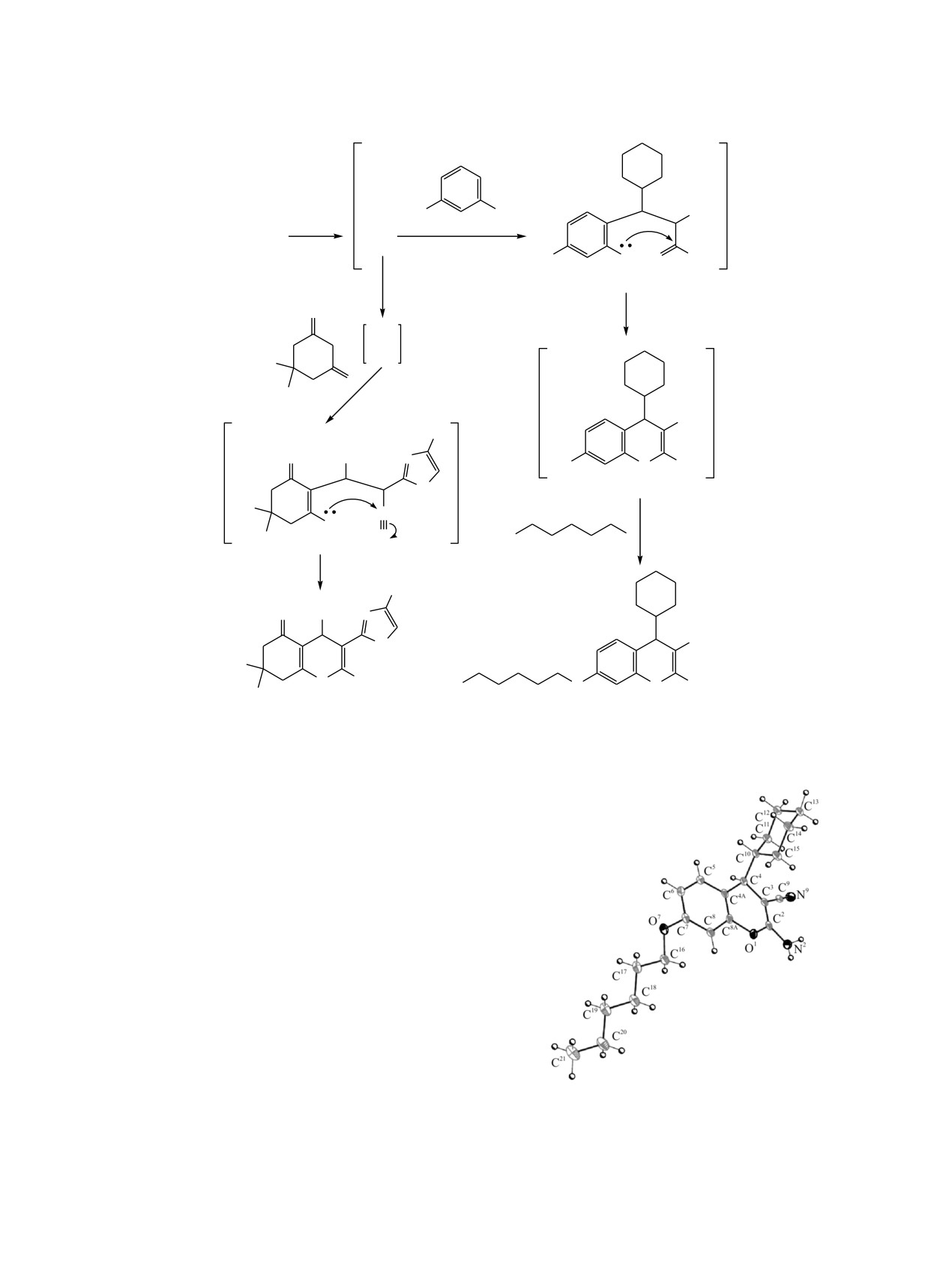
С целью однозначного установления строения
продукта рассмотренной выше многокомпо-
нентной конденсации методом РСА исследована
молекулярная и кристаллическая структура
17
(рис.
3,
4). Пирановый цикл бензопиранового
фрагмента в соединении
17 принимает кон-
формацию уплощенной ванны с углом перегиба по
линии O1∙∙∙C411.98(12)°. Атом азота N2 имеет
тригонально-пирамидальную конфигурацию
(сумма валентных углов равна
352(4)°). Оксо-
гексильный заместитель находится в полностью
трансоидной («линейной») конформации.
Рис. 3. Молекулярная структура соединения 17. Атомы
Молекула 17 содержит один асимметрический
представлены
50%-эллипсоидами анизотропных
центр при атоме углерода C4. Кристалл соединения
смещений.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
272
МНОГОКОМПОНЕНТНЫЕ СИНТЕЗЫ ПРОИЗВОДНЫХ ТИАЗОЛА, СЕЛЕНАЗОЛА
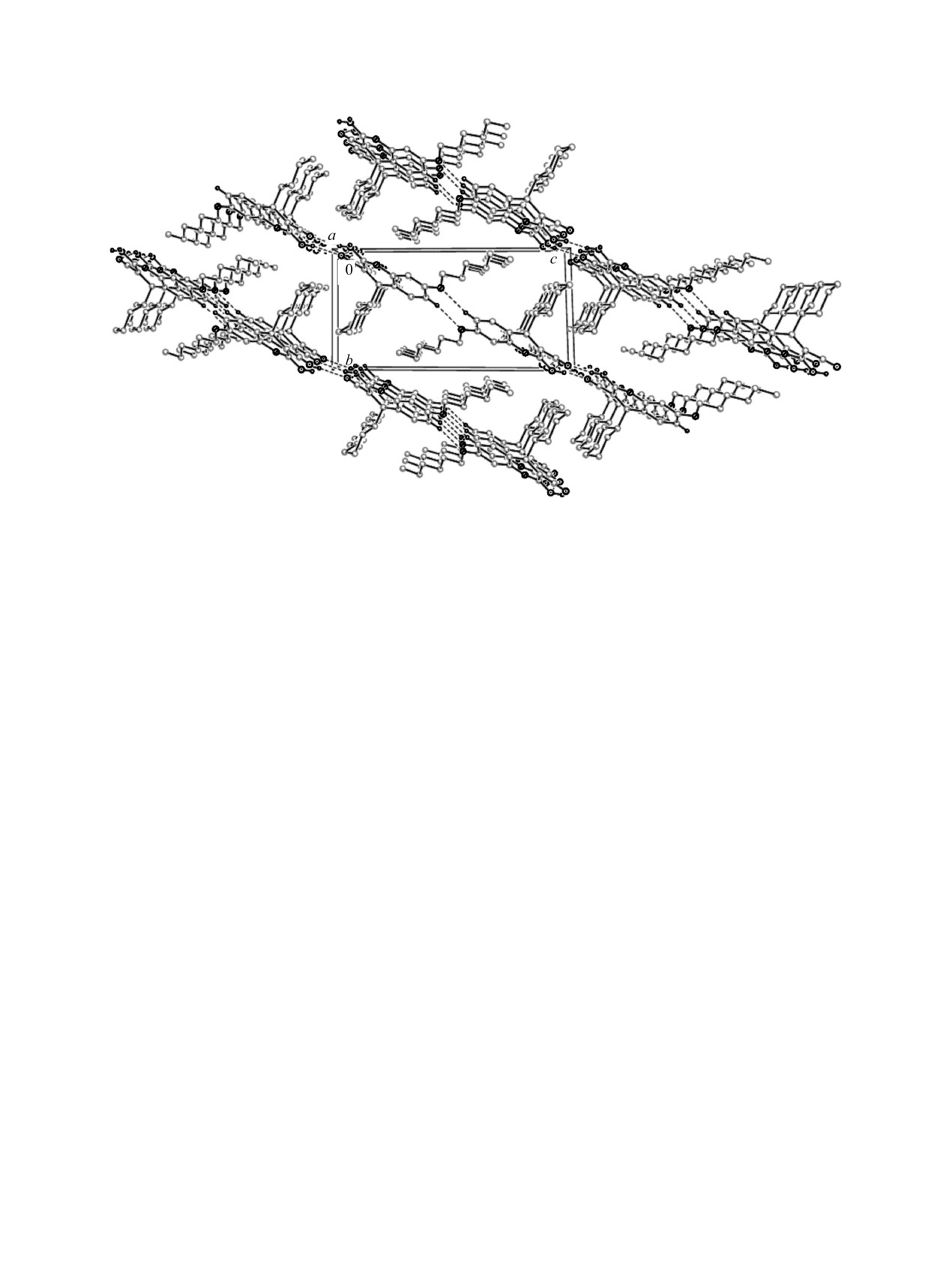
Рис. 4. Кристаллическая структура соединения 17.
17 является рацематом. В кристалле молекулы 17
квадратов по F2 в анизотропном приближении для
образуют H-связанные слои, параллельные
неводородных атомов. Атомы водорода амино-
плоскости
(01), за счет межмолекулярных
групп выявлены объективно в разностных
водородных связей N-H∙∙∙N и C-H∙∙∙O (табл. 1,
Фурье-синтезах и уточнены изотропно с фик-
рис. 4).
сированными параметрами смещения [Uизо(H) =
1.2Uэкв(N)]. Положения остальных атомов водорода
Таким образом, нами продемонстрирована
рассчитаны геометрически и включены в
возможность эффективного многокомпонентного
уточнение с фиксированными позиционными
синтеза различных гетероциклов на основе реакций,
параметрами (модель «наездника») и изотропными
инициируемых конденсацией Кнёвенагеля.
параметрами смещения [Uизо(H) = 1.5Uэкв(C) для
CH3-групп и Uизо(H) = 1.2Uэкв(C) для остальных
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
групп]. Все расчеты проведены с использованием
Параметры элементарных ячеек и интенсив-
комплекса программ SHELXTL
[26]. Таблицы
ности отражений для соединений 9 и 17 измерены на
координат атомов, длин связей, валентных и
синхротронной станции «БЕЛОК» Национального
торсионных углов и анизотропных параметров
исследовательского центра
«Курчатовский
смещения для соединений 9 и 17 депонированы в
институт», используя двухкоординатный детектор
Кембриджском Банке Структурных Данных,
Rayonix SX165 CCD (T 100 K, l 0.96990 Å, φ-
номера депонирования - CCDC 1862036 (9) и
сканирование с шагом 1.0°). Обработка экспери-
CCDC 1862037 (17).
ментальных данных проведена с помощью
ИK спектры получали на приборе ИКС-40 в
программы iMOSFLM, входящей в комплекс
вазелиновом масле. Спектры ЯМР
1H и
13C
программ CCP4
[24]. Основные кристаллост-
регистрировали на спектрофотометре Varian VXR-
руктурные данные и параметры уточнения
400 (399.97 и 100 МГц соответственно) в растворах
представлены в табл. 2.
, внутренний стандарт
- TMC. Масс-
DMSO-d6
Для полученных данных проведен учет
спектры получали на масс-спектрометре высокого
поглощения рентгеновского излучения по
разрешения Orbitrap Elite (для соединений 6, 7с, 9,
программе Scala [25].
и 17). Образцы для HRMS растворяли в 1 мл
Структуры определены прямыми методами и
DMSO, разбавляли в 100 раз 1%-ной HCOOH в
уточнены полноматричным методом наименьших
CH3CN, вводили шприцевым насосом со скорос-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
МНОГОКОМПОНЕНТНЫЕ СИНТЕЗЫ ПРОИЗВОДНЫХ ТИАЗОЛА, СЕЛЕНАЗОЛА
273
Таблица 2. Кристаллоструктурные данные для соединений 9 и 17.
Соединение
9
17
Элементный состав
C21H16N2O3
C22H30N2O2
Молекулярная масса
344.36
354.48
Размеры монокристалла, мм
0.10×0.10×0.30
0.02×0.10×0.10
Сингония
Моноклинная
Триклинная
Пространственная группа
P21/c
P-1
a, Å
8.3001(17)
6.4301(13)
b, Å
15.000(3)
9.1002(18)
c, Å
13.930(3)
17.580(4)
α, град
90
87.26(3)
β, град
99.76(3)
82.39(3)
γ, град
90
76.04(3)
V, Å3
1709.2(6)
989.4(4)
Z
4
2
dc, г·см-3
1.338
1.190
F(000)
720
384
μ, мм-1
0.190
0.156
2θмакс, град
76.86
71.66
Количество измеренных отражений
15269
14541
Количество независимых отражений (Rint)
3390 (0.053)
3205 (0.061)
Количество наблюденных отражений с I > 2σ(I)
2820
2834
Количество уточняемых параметров
243
244
R1; wR2 [для отражений с I > 2σ(I)]
0.042; 0.112
0.047; 0.130
R1; wR2 (все измеренные отражения)
0.052; 0.120
0.052; 0.134
GOF по F2
1.096
1.096
Коэффициент экстинкции
0.014(2)
0.021(2)
Tмин; Tмакс
0.940; 0.970
0.975; 0.990
тью
40 мкл/мин в источник ионизации
нений масс-спектры снимали на спектрометре
электрораспылением. Потоки газов источника
Agilent
1100 Series с селективным детектором
были отключены, напряжение на игле
Agilent LS/MSDLS (образец вводили в матрице
составляло
3.5
кВ, температура капилляра
CH3COOH, ионизация ЭУ, 70 эВ). Элементный
275°С. Масс-спектры регистрировали в режимах
анализ осуществляли на приборе Perkin Elmer CHN
положительных и отрицательных ионов в
-analyser. Температуры плавления определяли на
орбитальной ловушке с разрешением
480000.
блоке Кофлера. Ход реакции и чистоту
Внутренние калибранты
- ион
2DMSO+Н+
полученных соединений контролировали методом
(m/z
157.03515) в положительных ионах и
ТСХ на пластинках Silufol UV-254 в системе
додецилсульфат-анион (m/z
265.14789)
в
ацетон-гексан (3:5), проявление парами йода и УФ-
отрицательных ионах. Для остальных соеди-
облучением.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
274
МНОГОКОМПОНЕНТНЫЕ СИНТЕЗЫ ПРОИЗВОДНЫХ ТИАЗОЛА, СЕЛЕНАЗОЛА
(E)-3-(4-аллилокси-3-этоксифенил)-2-[4-(4-
(2Е,2'Е)-3,3'-[(Пропан-1,3-диилбис(окси)бис-
бутилфенил)тиазол-2-ил]акрилонитрил
(5). К
(4,1-фенилен)]бис[2-(4-(п-толил)тиазол-2-ил)-
перемешиваемому раствору 1.7 г (10 ммоль) 4-гид-
акрилонитрил] (7b). Выход 2.3 г (68%), желтый
рокси-3-этоксибензальдегида 1a и 1.0 г (10 ммоль)
порошок, т. пл. 188-190°С (АсOH). ИК спектр, ν,
цианотиоацетамида 2a в 25 мл ДМФА при 20°С
см-1: 2200 (С≡N). Спектр ЯМР 1Н, δ, м.д.: 2.25 т
прибавляли 3 капли морфолина и перемешивали 1 ч,
(2H, СН2, J 6.0 Гц), 2.35 с (6H, 2Ме), 4.28 т (4H,
после чего прибавляли 2.6 г (10 ммоль) 4-бутил-
2СН2О, J 6.0 Гц), 7.16 д (4Н, Наром., J 8.6 Гц), 7.27 д
фенацилбромида 3a и перемешивали 3 ч. Затем при
(4Н, Наром., J 8.0 Гц), 7.90 д (4Н, Наром., J 8.0 Гц),
перемешивании последовательно прибавляли 4.0 мл
8.04 д (4Н, Наром., J 8.6 Гц), 8.11 с (2Н, 2Нтиазола),
(10 ммоль) 10%-ного водного раствора NaOH и
8.24 с (2Н, 2СН=ССN). Масс-спектр, m/z (Iотн, %):
0.85 мл (10 ммоль) аллилбромида 4, перемешивали
677.2 (100) [M+1]+. Найдено, %: C 72.61; H 4.65; N
1 ч и оставляли. Через сутки реакционную смесь
8.15. C41H32N4O2S2. Вычислено, %: C 72.76; H 4.77;
разбавляли равным объемом воды и отфильтро-
N 8.28. М 676.9.
вывали образовавшийся осадок. Промывали водой,
(2Е,2'Е)-3,3'-[(Пропан-1,3-диилбис(окси)бис-
этанолом и гексаном. Выход 3.2 г (72%), желтый
(4,1-фенилен)]бис[2-(4-(4-метоксифенил)тиазол-
порошок, т. пл. 63-64°С (МеOH). ИК спектр, ν,
2-ил)акрилонитрил]
(7c). Выход
2.5 г
(70%),
см-1: 2202 (С≡N). Спектр ЯМР 1Н, δ, м.д.: 0.89 т
желтый порошок, т. пл. 173-175°С (BuOH), при
(3H, Ме, J 7.3 Гц), 1.21-1.26 м (2Н, СН2), 1.32 т
УФ-облучении флуоресцирует. ИК спектр, ν, см-1:
(3H, Ме, J 6.8 Гц), 1.50-1.64 м (2Н, СН2), 2.59 т
2200 (С≡N). Спектр ЯМР 1Н, δ, м.д.: 2.23 т (2H,
(2H, СН2, J 7.7 Гц), 4.08 кв (2H, ОСН2Ме, J 6.8 Гц),
СН2, J 6.0 Гц), 3.79 с (6Н, 2МеО), 4.25 т (4H,
4.67 д (2H, ОСН2СН=, J 5.0 Гц), 5.27 д (1Н, =СН2,
2СН2О, J 6.0 Гц), 7.01 д (4Н, Наром., J 8.8 Гц), 7.15 д
Jцис 10.52 Гц), 5.41 д (1Н, =СН2, Jтранс 17.3 Гц), 5.91-
(4Н, Наром., J 8.7 Гц), 7.93 д (4Н, Наром., J 8.7 Гц),
6.17 м (1Н, СН=), 7.14 д (1Н, Наром., J 8.6 Гц), 7.26 д
8.02 д (4Н, Наром., J 8.8 Гц), 8.04 с (2Н, 2Нтиазола),
(2Н, Наром., J 7.9 Гц), 7.64 д (1Н, Наром., J 8.6 Гц),
8.22 с (2Н, 2СН=ССN). Спектр ЯМР 13С, δ, м.д.:
7.73 с (1Н, Наром.), 7.90 д (2Н, Наром., J 7.9 Гц), 8.12 с
28.8, 55.7 (2С), 65.1 (2С), 102.1 (2С), 113.8 (2С),
(1Н, Нтиазола), 8.21 с (1Н, СН=ССN). Спектр ЯМР
114.7 (4С), 115.7 (4С), 117.5 (2С), 125.6 (2С), 126.7
13С, δ, м.д.: 14.2, 15.1, 33.5, 35.1, 64.3, 69.3, 96.8,
(2С), 128.1 (4С), 132.6 (4С), 145.0 (2С), 155.6 (2С),
102.0, 113.8, 114.2, 115.0, 117.6, 118.5, 125.1, 125.7,
160.0 (2С), 161.9 (2С), 163.2 (2С). HRMS (ESI), m/z:
126.6 (2С), 129.2 (2С), 131.5, 133.7, 143.3, 145.5,
найдено
709.1940
[M+Н]+. C41H32N4O4S2.
148.2,
151.6,
156.3,
163.9. HRMS (ESI), m/z:
Вычислено 709.1865.
найдено 445.1944 [M+Н]+. C27H28N2O2S. Вычислено
445.1871.
2-Амино-5-оксо-4-(1-фенилэтил)-4,5-дигидро-
пирано[3,2-c]хромен-3-карбонитрил
(9). Смесь
Замещенные акрилонитрилы (7a-c) получали
1.33 мл (10 ммоль) 2-фенилпропионового альдегида
аналогично соединению 5 при соответствующем
1c, 1.6 г (10 ммоль) 4-гидроксикумарина 8, 1 г
использовании ароматических альдегидов 1a, b и
(10 ммоль) цианотиоацетамида 2a и 1.1 мл (10 ммоль)
0.5 мл (5 ммоль) 1,3-дибромпропана 6.
N-метилморфолина в
30 мл ДМФА при
20°С
(2Е,2'Е)-3,3'-[(Пропан-1,3-диилбис(окси)бис-
перемешивали
2 ч и оставляли. Через сутки
(3-этокси-4,1-фенилен)]бис[2-(4-(п-толилтиазол-
реакционную смесь разбавляли равным объемом
2-ил))акрилонитрил]
(7a). Выход 2.9 г (75%),
воды и оставляли. Через 48 ч образовавшийся
ярко-желтый порошок, т.пл. 192-194°С (АсOH).
осадок отфильтровывали и последовательно про-
ИК спектр, ν, см-1: 2215 (С≡N). Спектр ЯМР 1Н, δ,
мывали водой, этанолом и гексаном. Выход 2.6 г
м.д.: 1.38 т (6H, 2Ме, J 6.8 Гц), 2.26 т (2Н, СН2, J
(75%), бесцветные кристаллы, т. пл. 219-221°С (i-
6.0 Гц), 2.36 с (6H, 2Ме), 4.12 кв (4Н, 2ОСН2Ме, J
PrOH). ИК спектр, ν, см-1: 3488, 3252, 3196 (NH2),
6.8 Гц), 4.31 т (4H, 2СН2О, J 6.0 Гц), 7.22 д (2Н,
2210 (С≡N), 1719 (С=О), 1643 (δNH2). Спектр ЯМР
Наром., J 8.8 Гц), 7.29 д (4Н, Наром., J 7.7 Гц), 7.68 д
1Н, δ, м.д.: 1.12 д (3Н, Ме, J 7.2 Гц), 3.11-3.19 м
(2Н, Наром., J 8.8 Гц), 7.75 с (2Н, 2Нтиазола), 7.91 д
(1Н, СНМе), 3.61 д (1Н, Н4, J 3.2 Гц), 7.13-7.25 м
(4Н, Наром., J 7.7 Гц), 8.12 с (2Н, Наром.), 8.24 с (2Н,
(5Н, Наром.), 7.26 уш.с (2H, NH2), 7.44 т (1Н, Наром., J
2СН=ССN). Масс-спектр, m/z (Iотн, %): 765.7 (100)
7.6 Гц), 7.48 д (1Н, Наром., J 7.9 Гц), 7.67 т (1Н,
[M+1]+. Найдено, %: C 70.50; H 5.11; N 7.23.
Наром., J 8.2 Гц), 7.74 д (1Н, Наром., J 7.9 Гц). Спектр
C45H40N4O4S2. Вычислено, %: C 70.66; H 5.27; N
ЯМР 13С, δ, м.д.: 14.1, 43.2, 52.7, 104.85, 104.9,
7.32. М 764.9.
113.4, 117.0, 119.6, 122.5, 126.9, 128.3 (2С), 128.4
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
МНОГОКОМПОНЕНТНЫЕ СИНТЕЗЫ ПРОИЗВОДНЫХ ТИАЗОЛА, СЕЛЕНАЗОЛА
275
(2С), 133.2, 142.8, 152.6, 155.3, 160.6, 161.3, 170.0.
2-Амино-4-арил(гетарил)-7,7-диметил-3-[4-
HRMS (ESI), m/z: найдено
343.1088
[M-Н]+.
арил(кумарин-3-ил)тио(селен)азол-2-ил]-7,8-
C21H16N2O3. Вычислено 343.1161.
дигидро-4Н-хромен-5(6Н)-оны
(14a-d). Общая
методика. К перемешиваемой смеси по 10 ммоль
2,5-Диоксо-4-фенил-3,5-дигидро-2Н-хромено-
альдегида 1e-h и цианотио(селено)ацетамида 2a, b в
[4,3-b]пиридин-3-карботиоамид
(10) получали
30 мл ДМФА (при использовании соединения 2b под
аналогично соединению 9 при соответствующем
аргоном) при 20°С прибавляли 3 капли морфолина,
использовании 1.0 мл (10 ммоль) бензальдегида 1d.
перемешивали 30 мин и прибавляли 10 ммоль α-
Выход 2.3 г (77%), светло-желтый порошок, т. пл.
бромкетона 3d-f, продолжая перемешивание еще
245-247°С (Диоксан). ИК спектр, ν, см-1: 3459,
2 ч. Затем к реакционной смеси прибавляли 1.4 г
3316 (NH2), 1719 (С=О), 1634 (δNH2), 1181 (C=S).
(10 ммоль) димедона 13 и 0.87 мл (10 ммоль)
Спектр ЯМР 1Н, δ, м.д.: 5.12 с (1Н, Нпиридина), 6.83
морфолина, перемешивали 1 ч и оставляли на
уш.с (2H, NH2), 7.16 т (1Н, Наром., J 7.1 Гц), 7.23 т
сутки, разбавляли равным объемом воды и
(2Н, Наром., J 7.4 Гц), 7.34 д (2Н, Наром., J 7.4 Гц),
оставляли на
48 ч. Образовавшийся осадок
7.46 т (2Н, Наром., J 8.4 Гц), 7.70 т (1Н, Наром., J
отфильтровывали, промывали водой, этанолом и
7.6 Гц), 7.99 д (1Н, Наром., J 7.6 Гц). Спектр ЯМР
гексаном.
13С, δ, м.д.: 36.7, 97.2, 105.2, 114.2, 116.9, 123.1,
125.2, 127.2, 128.4 (2С), 128.7 (2С), 133.2, 142.8,
3-[2-(2-Амино-7,7-диметил-5-оксо-4-(4-этокси-
152.5, 155.9, 157.3, 160.7, 169.7. Масс-спектр, m/z
фенил)-5,6,7,8-тетрагидро-4Н-хромен-3-ил)ти-
(Iотн, %): 349.0 [M+1]+. Найдено, %: C 65.39; H 3.33;
азол-4-ил]-2Н-хромен-2-он
(14a). Выход
4.4 г
N 7.96. C19H12N2O3S. Вычислено, %: C 65.51; H
(82%), ярко-желтый порошок, т. пл. 186-188°С
3.47; N 8.04. М 348.4.
(BuOH). ИК спектр, ν, см-1: 3366, 3140, 2977 (NH2),
1708, 1661 (С=О), 1607 (δNH2). Спектр ЯМР 1Н, δ,
2-[2-(7-Аллилокси-2-оксо-2Н-хромен-3-ил)-2-
м.д.: 0.86 с (3Н, Ме), 1.05 с (3Н, Ме), 1.25 т (3Н,
оксоэтилтио]-6-амино-4-(4-этоксифенил)пиридин-
Ме, J 6.8 Гц), 2.08 д (1Н, С8Н2, 2J 16.2 Гц), 2.29 д
3,5-дикарбонитрил (12). Смесь 1.4 мл (10 ммоль)
(1Н, С8Н2, 2J 16.2 Гц), 2.45 д (1Н, С6Н2, 2J 17.6 Гц),
4-этоксибензальдегида 1e, 2 г (20 ммоль) цианотио-
2.59 д (1Н, С6Н2, 2J 17.6 Гц), 3.90 кв (2Н, ОСН2, J
ацетамида 2a и 3 капли N-метилморфолина в 30 мл
6.8 Гц), 4.46 с (1Н, Нпирана), 6.76 д (2Н, Наром., J
ДМФА при 20°С перемешивали 30 мин, после чего
8.3 Гц), 7.18 д (2Н, Наром., J 8.3 Гц), 7.26-7.49 м (2Н,
последовательно прибавляли 4.0 мл (10 ммоль)
Наром.), 7.58 т (1Н, Наром., J 7.4 Гц), 7.77-7.95 м (3H,
10%-ного водного раствора NaOH и 2.8 г (10 ммоль)
NH2 и Наром.), 8.03 с
(1Н, Нтиазола), 8.76 с (1Н,
7-гидрокси-3-(2-бромацетил)кумарина
11. Реак-
Нкумарина). Спектр ЯМР 13С, δ, м.д.: 15.2, 26.7, 29.3,
ционную смесь перемешивали 3 ч и оставляли на
32.3, 36.9, 50.5, 63.3, 82.1, 114.2 (2С), 115.0, 115.5,
сутки. Затем разбавляли равным количеством воды
115.6, 116.3, 119.7, 120.4, 125.1, 129.4, 129.6 (2С),
и отфильтровывали образовавшийся осадок. Про-
132.1, 132.7, 136.6, 139.4, 146.7, 152.7, 157.5, 159.3,
мывали водой, этанолом и гексаном. Выход 4.3 г
161.8, 168.3, 196.1. Масс-спектр, m/z (Iотн, %): 541.2
(80%), желтый порошок, т. пл. 243-245°С (BuOH).
(100) [M+1]+. Найдено, %: C 68.75; H 5.14; N 5.80.
ИК спектр, ν, см-1: 3445, 3318, 3197 (NH2), 2223 пл.
C31H28N2O5S. Вычислено, %: C 68.87; H 5.22; N
(С≡N), 1717, 1695 (С=О), 1644 (δNH2). Спектр ЯМР
5.93. М 540.6.
1Н, δ, м.д.: 1.38 т (3Н, Ме, J 6.8 Гц), 4.12 кв (2Н,
ОСН2Ме, J
6.8 Гц),
4.68-4.74 м
(4H, SCH2+
2-Амино-4-(4-бромфенил)-7,7-диметил-3-(4-
OCH2CH=), 5.32 д (1Н, =СН2, Jцис 10.6 Гц), 5.45 д
фенил-1,3-селеназол-2-ил)-7,8-дигидро-4Н-
(1Н,
=СН2, Jтранс
17.3 Гц),
6.01-6.15 м
(1Н,
хромен-5(6Н)-он (14b). Выход 4.4 г (79%), желтый
СН=СН2), 7.03-7.16 м (4Н, Наром.), 7.50 д (2Н, Наром.,
порошок, т. пл. 115-117°С (EtOH). ИК спектр, ν,
J 8.4 Гц), 7.83 уш.с (2H, NH2), 7.93 д (1Н, Наром., J
см-1: 3200-3455 (NH2), 1657 (С=О), 1619 (δNH2).
8.4 Гц), 8.67 с (1Н, Нкумарина). Спектр ЯМР 13С, δ,
Спектр ЯМР 1Н (CHCl3), δ, м.д.: 0.96 с (3Н, Ме),
м.д.: 15.1, 41.0, 63.8, 69.7, 86.3, 93.7, 101.6, 112.7,
1.12 с (3Н, Ме), 2.20 д (1Н, С8Н2, 2J 16.4 Гц), 2.27 д
114.4, 115.0 (2С), 115.9, 116.1, 118.9, 120.2, 126.1,
(1Н, С8Н2, 2J 16.4 Гц), 2.47 с (2Н, С6Н2), 4.66 с (1Н,
130.7 (2С), 132.9, 133.1, 149.0, 157.7, 158.4, 159.6,
Нпирана), 6.75 уш.с (2H, NH2), 7.25-7.48 м (7Н,
160.0, 160.7, 164.4, 166.5, 190.0. Масс-спектр, m/z
Наром.),
7.75 с (1Н, Нселеназола), 7.80 д (2Н, Наром., J
(Iотн, %): 539.0 [M+1]+. Найдено, %: C 64.52; H 3.97;
7.3 Гц). Спектр ЯМР 13С, δ, м.д.: 26.8, 29.1, 32.3,
N 10.32. C29H22N4O5S. Вычислено, %: C 64.67; H
50.4, 84.8, 91.3, 114.2, 115.0, 120.0,
126.6
(2С),
4.12; N 10.40. М 538.6.
128.1,
129.2
(2С),
131.0
(2С),
131.3
(2С),
135.5,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
276
МНОГОКОМПОНЕНТНЫЕ СИНТЕЗЫ ПРОИЗВОДНЫХ ТИАЗОЛА, СЕЛЕНАЗОЛА
144.0, 152.4, 154.1, 162.2, 162.8, 173.6, 196.2. Масс-
альдегида 1i, 1.0 г (10 ммоль) цианотиоацетамида 2a,
спектр, m/z (Iотн, %): 555.0 (100) [M+1]+. Найдено,
1.1 г (10 ммоль) резорцина 15 и 1.48 мл (10 ммоль)
%: C 56.22; H 4.05; N 4.93. C26H23BrN2O2Se. Вы-
гексилиодида 16. Выход 2.5 г (71%), бесцветные
числено, %: C 56.34; H 4.18; N 5.05. М 554.4.
кристаллы, т. пл. 135-137°С (АсОН). ИК спектр, ν,
см-1: 3215-3446 (NH2), 2212 (С≡N), 1633 (δNH2).
2-Амино-3-[4-(1,1'-бифенил)-1,3-селеназол-2-
Спектр ЯМР 1Н, δ, м.д.: 0.83 т (3Н, Ме, J 7.1 Гц),
ил]-4-(фуран-2-ил)-7,7-диметил-7,8-дигидро-4Н-
0.87-1.18 м (4Н, Налиф.), 1.22-1.32 м (8Н, Налиф.),
хромен-5(6Н)-он (14c). Выход 4.2 г (78%), темно-
1.49-1.68 м (5Н, Налиф.), 2.44-2.48 м (2Н, Налиф.),
красный порошок, т. пл. 183-185°С (Диоксан). ИК
3.22 д (1Н, Н4пирана, J 3.4 Гц), 3.89 т (2Н, OCН2, J
спектр, ν, см-1: 3222-3450 (NH2), 1655 (С=О), 1623
6.5 Гц), 6.44 с (1Н, С8Н), 6.66 д (1Н, С6Н, J 8.5 Гц),
(δNH2). Спектр ЯМР 1Н, δ, м.д.: 0.96 с (3Н, Ме),
6.79 уш.с (2H, NH2), 7.02 д (1Н, С5Н, J 8.5 Гц).
1.07 с (3Н, Ме), 2.18 д (1Н, С8Н2, 2J 16.1 Гц), 2.34 д
Спектр ЯМР 13С, δ, м.д.: 14.4, 22.5 (2С), 25.6 (2С),
(1Н, С8Н2, 2J 16.1 Гц), 2.52 д (1Н, С6Н2, 2J 17.6 Гц),
26.2, 26.4 (2С), 29.0, 29.4, 31.4, 47.2, 53.0, 68.1,
2.60 д (1Н, С6Н2, 2J 17.6 Гц), 4.63 с (1Н, Нпирана),
101.5, 111.4, 115.8, 122.1, 129.6, 151.1, 158.5, 162.7.
6.21 с (1Н, Нфурана), 6.28 с (1Н, Нфурана), 7.37 т (1Н,
HRMS (ESI), m/z: найдено
355.2380
[M+Н]+.
Наром., J 6.8 Гц), 7.42 с (1Н, Нселеназола), 7.47 т (2Н,
C22H30N2O2. Вычислено 355.2307.
Наром., J 7.44 Гц), 7.72 т (4Н, Наром., J 8.6 Гц), 7.95 д
(2Н, Наром., J 8.0 Гц), 8.14 уш.с (2H, NH2), 8.26 с
ФОНДОВАЯ ПОДДЕРЖКА
(1Н, Нфурана). Спектр ЯМР 13С, δ, м.д.: 26.8, 29.2,
32.4 (2С), 32.9, 50.4, 82.9, 107.6, 110.8, 112.5, 114.3,
Работа выполнена при финансовой поддержке
127.0
(4С),
127.1
(2С), 128.0,
129.4
(2С), 134.6,
Программы повышения конкурентоспособности
139.7, 140.1, 142.0, 152.6, 153.7, 155.3, 163.3, 173.7,
РУДН «5-100». Рентгеновские измерения были
195.9. Масс-спектр, m/z (Iотн, %): 543.2 (100) [M+1]+.
проведены на оборудовании уникальной научной
Найдено, %: C 66.33; H 4.70; N 4.97. C30H26N2O3Se.
установки Курчатовский источник синхротронного
Вычислено, %: C 66.42; H 4.83; N 5.16. М 542.5.
излучения, финансируемой Министерством
образования и науки РФ (идентификатор проекта
2-Амино-3-[4-(1,1'-бифенил)-1,3-селеназол-2-ил]-
RFMEFI61917X0007), а также грантов Российского
7,7-диметил-4-(тиофен-2-ил)-7,8-дигидро-4Н-
Фонда Фундаментальных Исследований № 18-53-
хромен-5(6Н)-он (14d). Выход 4.3 г (77%), светло-
желтые поленообразные кристаллы, т. пл. 189-191°С
06006 Аз_а и № 16-29-10669 офи_м.
(диоксан). ИК спектр, ν, см-1: 3280-3444 (NH2),
КОНФЛИКТ ИНТЕРЕСОВ
1652 (С=О), 1621 (δNH2). Спектр ЯМР 1Н, δ, м.д.:
0.91 с (3Н, Ме), 1.06 с (3Н, Ме), 2.17 д (1Н, С8Н2, 2J
Авторы заявляют об отсутствии конфликта
16.2 Гц), 2.34 д (1Н, С8Н2, 2J 16.2 Гц), 2.46 д (1Н,
интересов.
С6Н2, 2J 17.6 Гц), 2.59 д (1Н, С6Н2, 2J 17.6 Гц), 4.83
с (1Н, Нпирана), 6.84 т (1Н, Нтиофена, J 4.0 Гц), 6.97 д
СПИСОК ЛИТЕРАТУРЫ
(1Н, Нтиофена, J 3.0 Гц), 7.24 д (1Н, Нтиофена, J 5.0 Гц),
7.39 т (1Н, Наром., J 7.3 Гц), 7.48 т (2Н, Наром., J 7.3 Гц),
1. Pevarello P., Amici R., Villa M., Salom B., Vulpetti A.,
7.71 д (2Н, Наром., J 8.6 Гц), 7.74 д (2Н, Наром., J
Varasi M. Пат. 6784198 (2004). США. РЖХим. 2005.
8.6 Гц), 7.96 д (2Н, Наром., J 8.2 Гц), 8.18 уш.с (2H,
05.07-19О.135П.
NH2), 8.26 с (1Н, Нселеназола). Спектр ЯМР 13С, δ,
2. Sanner M.A., Helal С.J., Cooper C.B. Пат. 6720427
м.д.: 26.7, 29.2, 32.4, 34.2, 50.4, 85.4, 114.5, 115.3,
(2004). США. РЖХим. 2005. 05.04-19О.172П.
125.0, 126.1, 126.9 (3С), 127.0, 127.1, 127.5 (2С),
3. Bender W., Betz U., Kleymann G., Baumeister J.,
128.0, 129.4 (3С), 134.2, 139.9, 140.0, 149.2, 152.4,
Eckenberg P., Fischer R., Handke-Ergueden G.,
153.7, 162.4, 173.9, 196.1. Масс-спектр, m/z (Iотн, %):
Hendrix M., Henninger K., Jensen A., Keldenich J.,
Reefschlöger J., Schmidf T., Schneider U., Weber O.
559.0 (100) [M+2]+. Найдено, %: C 64.49; H 4.62; N
Заявка 10210319 (2003). Германия. РЖХим. 2004.
4.93. C30H26N2O2SSe. Вычислено, %: C 64.62; H
04.22-19О.114П.
4.70; N 5.02. М 557.6.
4. Haap W., Hölzl W., Ochs D., Puchtler K., Schnyder M.
2-Амино-7-гексилокси-4-циклогексил-4Н-
Заявка 1103180 (2001). ЕПВ. РЖХим. 2001. 01.17-
хромен-3-карбонитрил (17) получали аналогично
19О.327П.
соединениям
14 при соответствующем исполь-
5. Drewe J.A., Xiong C.S., Wang Y. Пат. 6906203 (2005).
зовании 1.21 мл (10 ммоль) циклогексанкарбокс-
США. РЖХим. 2006. 06.14-19О.57П.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
МНОГОКОМПОНЕНТНЫЕ СИНТЕЗЫ ПРОИЗВОДНЫХ ТИАЗОЛА, СЕЛЕНАЗОЛА
277
6. Konkay C.S., Fick D.B., Cai S.X., Lan N.C.,
Kustova T.P., Klyuev M.V., Khelevina O.G.,
Keana J.F.W. Пат. 6800657 (2004). США. РЖХим.
Stuzhin P.A., Fedorov A.Yu., Gushchin A.V.,
2005. 05.18-19О.110П.
Dodonov V.A., Kolobov A.V., Plakhtinskii V.V.,
Orlov V.Yu., Kriven’ko A.P., Fedotova O.V.,
7. Хехст A., Бон М., Кромер К.Т., Маркус С.А. Заявка
Pchelintseva N.V., Charushin V.N., Chupakhin O.N.,
99108756
(2001). Россия. РЖХим.
2001.
01.14-
Klimochkin Yu.N., Klimochkina A.Yu., Kuryatni-
19О.100П.
kov V.N., Malinovskaya Yu.A., Levina A.S., Zhurav-
8. Darvesh S., Magee D., Valenta Z., Martin E. Пат.
lev O.E., Voronchikhina L.I., Fisyuk A.S., Akse-
6436972 (2002). США. РЖХим. 2003. 03.07-19О.87П.
nov A.V., Aksenov N.A., Aksenova I.V., Russ. J. Org.
9. Crooks P.A., Dull G.M., Caldwell W.S., Bhatti B.S.,
Chem. 2017, 53, 1275.] doi 10.1134/S1070428017090019
Deo N.M., Ravard A. Пат. 6624173 (2003). США.
16.
Коновалов А.И., Антипин И.С., Бурилов В.А.,
РЖХим. 2004. 04.11-19О.86П.
Маджидов Т.И., Курбангалиева А.Р., Немтарев А.В.,
10. Дяченко И.В., Дяченко В.Д. ЖорХ. 2016, 52, 40.
Соловьева С.Е., Стойков И.И., Мамедов В.А.,
[Dyachenko I.V., Dyachenko V.D. Russ. J. Org. Chem.
Захарова Л.Я., Гаврилова Е.Л., Синяшин О.Г.,
2016, 52, 32.] doi 10.1134/S1070428016010061
Балова И.А., Васильев А.В., Зенкевич И.Г.,
11. Дяченко И.В., Дяченко В.Д. ЖорХ. 2015, 51, 1319.
Красавин М.Ю., Кузнецов М.А., Молчанов А.П.,
[Dyachenko I.V., Dyachenko V.D. Russ. J. Org. Chem.
Новиков М.С., Николаев В.А., Родина Л.Л.,
2015, 51, 1293.] doi 10.1134/S1070428015090146
Хлебников А.Ф., Белецкая И.П., Вацадзе С.З.,
Громов С.П., Зык Н.В., Лебедев А.Т., Леменовс-
12. Дяченко В.Д., Пугач Ю.Ю. ЖОХ. 2013, 83, 845.
кий Д.А., Петросян В.С., Ненайденко В.Г.,
[Dyachenko V.D., Pugach Yu.Yu. Russ. J. Gen. Chem.
Негребецкий В.В., Бауков Ю.И., Шмиголь Т.А.,
2013, 83, 979.] doi 10.1134/S1070363213050162
Корлюков А.А., Тихомиров А.С., Щекотихин А.Е.,
13. Dimrot K., Wolf K., Kroke H. J. Lie. Ann. Chem. 1964,
Травень В.Ф., Воскресенский Л.Г., Зубков Ф.И.,
678, 181. doi 10.1002/jlac.19646780119
Голубчиков О.А., Семейкин А.С., Березин Д.Б.,
14. Дяченко В.Д., Дяченко И.В., Ненайденко В.Г. Усп.
Стужин П.А., Филимонов В.Д., Краснокутская Е.А.,
хим. 2018, 87, 1. [Dyachenko V.D., Dyachenko I.V.,
Федоров А.Ю., Нючев А.В., Орлов В.Ю., Бегу-
Nenaidenko V.G., Russ. Chem. Rev. 2018, 87, 1.] doi
нов Р.С., Русаков А.И., Колобов А.В., Кофанов Е.Р.,
10.1070/RCR4760
Федотова О.В., Егорова А.Ю., Чарушин В.Н.,
15. Антипин И.С., Казымова М.А., Кузнецов М.А.,
Чупахин О.Н., Климочкин Ю.Н., Осянин В.А.,
Васильев А.В., Ищенко М.А., Кирюшкин А.А.,
Резников А.Н., Фисюк А.С., Сагитуллина Г.П.,
Кузнецова Л.М., Макаренко С.В., Островский В.А.,
Аксенов А.В., Аксенов Н.А., Грачев М.К.,
Петров М.Л., Солод О.В., Тришин Ю.Г., Яковлев И.П.,
Масленникова В.И., Коротеев М.П., Брель А.К.,
Ненайденко В.Г., Белоглазкина Е.К., Белецкая И.П.,
Лисина С.В., Медведева С.М., Шихалиев Х.С.,
Устынюк Ю.А., Соловьев П.А., Иванов И.В.,
Субоч Г.А., Товбис М.С., Миронович Л.М., Ива-
Малина Е.В., Сивова Н.В., Негребецкий В.В.,
нов С.М., Курбатов С.В., Клецкий М.Е., Буров О.Н.,
Бауков Ю.И., Пожарская Н.А., Травень В.Ф.,
Кобраков К.И., Кузнецов Д.Н. ЖорХ. 2018, 54, 161.
Щекотихин А.Е., Варламов А.В., Борисова Т.Н.,
[Konovalov A.I., Antipin I.S., Burilov V.A., Madzhi-
Лесина Ю.А., Краснокутская Е.А., Рогожников С.И.,
dov T.I., Kurbangalieva A.R., Nemtarev A.V.,
Шуров С.Н., Кустова Т.П., Клюев М.В., Хелевина О.Г.,
Solovieva S.E., Stoikov I.I., Mamedov V.A., Zakharo-
Стужин П.А., Федоров А.Ю., Гущин А.В., Додо-
va L.Ya., Gavrilova E.L., Sinyashin O.G., Balova I.A.,
нов В.А., Колобов А.В., Плахтинский В.В., Орлов В.Ю.,
Vasilyev A.V., Zenkevich I.G., Krasavin M.Yu.,
Кривенько А.П., Федотова О.В., Пчелинцева Н.В.,
Kuznetsov M.A., Molchanov A.P., Novikov M.S.,
Чарушин В.Н., Чупахин О.Н., Климочкин Ю.Н.,
Nikolaev V.A., Rodina L.L., Khlebnikov A.F.,
Климочкина А.Ю., Курятников В.Н., Малиновс-
Beletskaya I.P., Vatsadze S.Z., Gromov S.P., Zyk N.V.,
кая Ю.А., Левина А.С., Журавлев О.Е.,
Lebedev A.T., Lemenovskii D.A., Petrosyan V.S.,
Ворончихина Л.И., Фисюк А.С., Аксенов А.В.,
Nenaidenko V.G., Negrebetskii V.V., Baukov Yu.I.,
Аксенов Н.А., Аксенова И.В. ЖорХ. 2017, 53, 1257.
Shmigol’ T.A., Korlyukov A.A., Tikhomirov A.S.,
[Antipin I.S., Kazymova M.A., Kuznetsov M.A.,
Shchekotikhin A.E., Traven’ V.F., Voskresenskii L.G.,
Vasilyev A.V., Ishchenko M.A., Kiryushkin A.A.,
Zubkov F.I., Golubchikov O.A., Semeikin A.S., Bere-
Kuznetsova L.M., Makarenko S.V., Ostrovskii V.A.,
zin D.B., Stuzhin P.A., Filimonov V.D., Krasno-
Petrov M.L., Solod O.V., Trishin Yu.G., Yakovlev I.P.,
kutskaya E.A., Fedorov A.Yu., Nyuchev A.V.,
Nenaidenko V.G., Beloglazkina E.K., Beletskaya I.P.,
Orlov V.Yu., Begunov R.S., Rusakov A.I., Kolo-
Ustynyuk Yu.A., Solov’ev P.A., Ivanov I.V., Malina E.V.,
bov A.V., Kofanov E.R., Fedotova O.V., Egorova A.Yu.,
Sivova N.V., Negrebetskii V.V., Baukov Yu.I.,
Charushin V.N., Chupakhin O.N., Klimochkin Yu.N.,
Pozharskaya N.A., Traven’ V.F., Shchekotikhin A.E.,
Osyanin V.A., Reznikov A.N., Fisyuk A.S., Sagitulli-
Varlamov A.V., Borisova T.N., Lesina Yu.A.,
na G.P., Aksenov A.V., Aksenov N.A., Grachev M.K.,
Krasnokutskaya E.A., Rogozhnikov S.I., Shurov S.N.,
Maslennikova V.I., Koroteev M.P., Brel’ A.K., Lisina S.V.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019
278
МНОГОКОМПОНЕНТНЫЕ СИНТЕЗЫ ПРОИЗВОДНЫХ ТИАЗОЛА, СЕЛЕНАЗОЛА
Medvedeva S.M., Shikhaliev Kh.S., Suboch G.A.,
21. Дяченко В.Д. ЖОХ. 2006, 76, 299. [Dyachenko V.D.
Tovbis M.S., Mironovich L.M., Ivanov S.M., Kurba-
Russ. J. Gen. Chem. 2006, 76, 282.] doi: 10.1134/
tov S.V., Kletskii M.E., Burov O.N., Kobrakov K.I.,
S1070363206020216
Kuznetsov D.N., Russ. J. Org. Chem. 2018, 54, 157.]
22. Кривоколыско С.Г., Дяченко В.Д., Чернега А.Н.,
doi 10.1134/S107042801802001X
Литвинов В.П. Изв. АН. Сер. хим.
2000,
49,
17. Дяченко В.Д., Битюкова О.С., Дяченко А.Д. ЖорХ.
733.
[Krivokolysko S.G., Dyachenko V.D.,
2011, 47,
1317.
[Dyachenko V.D., Bityukova O.S.,
Chernega A.N., Litvinov V.P. Russ. Chem. Bull. 2000,
Dyachenko A.D. Russ. J. Org. Chem. 2011, 47, 1335.]
49, 736.] doi 10.1007/BF02495493
doi 10.1134/S1070428011090132
23. Abd-El-Aziz A.S., Egrody M., Bedair A.H.,
18. Дяченко В.Д. ЖорХ. 2011, 47, 1508. [Dyachenko V.D.
Corkery T., Ata A. Heterocycles.
2004,
63,
Russ. J. Org. Chem. 2011, 47, 1535.] doi 10.1134/
1793. doi 10.3987/COM-04-10089
S1070428011100150
24. Battye T.G., Kontogiannis L., Johnson O., Powell H.R.,
19. Кривоколыско С.Г., Дяченко В.Д., Нестеров В.Н.,
Leslie A.G.W. Acta Cryst. 2011, D67, 271. doi 10.1107/
Литвинов В.П. ХГС. 2001, 929. [Krivokolysko S.G.,
S0907444910048675
Dyachenko V.D., Litvinov V.P. Chem. Heterocycl.
Comp. 2001, 37, 1114.] doi 10.1023/A:1013231800661
25. Evans P. Acta Cryst. 2006, D62, 72. doi 10.1107/
20. Дяченко В.Д., Чернега А.Н. ЖорХ. 2006, 42, 585.
S0907444905036693
[Dyachenko V.D., Chernega A.N. Russ. J. Org. Chem.
26. Sheldrick G.M. Acta Cryst. 2015, C71, 3. doi 10.1107/
2006, 42, 567.] doi 10.1134/S1070428006040142
S2053229614024218
Multicomponent Synthesis of Derivatives of Thiazole, Selenazole,
Pyrane and Pyridine, Initiated by the Reaction of Knoevenagel
I. V. Dyachenkoa, V. D. Dyachenkoa, P. V. Dorovatovskiib,
V. N. Khrustalevb, c, and V.G. Nenaidenkod, *
a Taras Shevchenko Lugansk National University, 91011, Ukraine, Lugansk, Oboronnaya ul. 2
b National Research Center "Kurchatov Institute", 123182, Russia,Moscow, ul. Acad. Kurchatova 1
c Russian Peoples Friendship University, 117198, Russia, Moscow, ul. Miklouho-Maclaya 6
d Lomonosov Moscow State University, 119991, Russia, Moscow, Leninskie Gory 1, stroenie 3
*e-mail: nenajdenko@gmail.com
Received June 1, 2018
Revised June 16, 2018
Accepted August 14, 2018
Based on multicomponent condensation initiated by the Knoevenagel reaction, (2E,2'E)-3,3'-[propane-1,3-
diylbis(oxy)bis(4,1-phenylene)]bis[2-(4-(4-arylthiazol-2-yl))acrylonitriles], functionally substituted pyridines
and fused pyrans, containing in position 3-thio(seleno)azole substituent. The structure of 2-amino-5-oxo-4-(1-
phenylethyl)-4,5-dihydropyrano[3,2-c]chromene-3-carbonitrile and
2-amino-7-hexyloxy-4-cyclohexyl-4H-
chromen-3-carbonitrile was studied by X-ray diffraction.
Keywords: thiazole, selenazole, pyran, pyridine, Knoevenagel reaction, X-ray structural analysis
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 2 2019