ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 3, с. 367-372
УДК 547.745 + 547.836.3
ТРЕХКОМПОНЕНТНАЯ СПИРО-ГЕТЕРОЦИКЛИЗАЦИЯ
ПИРРОЛДИОНОВ, ИНДАН-1,3-ДИОНА И
АЦИКЛИЧЕСКИХ ЕНАМИНОВ
© 2019 г. Т. В. Сальникова, М. В. Дмитриев, А. Н. Масливец*
ФГБОУ ВО «Пермский государственный национальный исследовательский университет»,
614990, Россия, г. Пермь, ул. Букирева 15
*e-mail: koh2@psu.ru
Поступила в редакцию 19 сентября 2018 г.
После доработки 9 октября 2018 г.
Принята к публикации 17 ноября 2018 г.
5-Фенил-4-этоксикарбонил-1Н-пиррол-2,3-дионы реагируют с индан-1,3-дионом и 3-амино-1-фенилбут-2-
ен-1-оном или 3-аминобут-2-енонитрилом с образованием3-бензоил-2-метил-2',5-диоксо-5'-фенил-1,1',2',5-
тетрагидроспиро[индено[1,2-b]пиридин-4,3'-пирролов] и 2-метил-2',5-диоксо-5'-фенил-3-циано-1,1',2',5-
тетрагидроспиро[индено[1,2-b]пиридин-4,3'-пирролов] соответственно.
Ключевые слова:
1H-пиррол-2,3-дионы, трехкомпонентные реакции, спиро-гетероциклизация,
дигидропиридины, инденопиридины, енамины.
DOI: 10.1134/S0514749219030066
Интерес, проявляемый учеными к соединениям,
боксилаты
3a-е (cхема
1).
Взаимодействие
содержащим пиррол-2-оновый фрагмент, не
пирролдионов 1a-e с индан-1,3-дионом и 3-амино-
случаен. Природные пирролоны, такие как клаузен-
бут-2-енонитрилом 2b в аналогичных условиях в
амид и тетрамовые кислоты, проявляют широкий
течение
1-3 ч (контроль ТСХ и ВЭЖХ-МС)
спектр биологической активности [1-3]. Спиро-
приводит к образованию этил 2-метил-2',5-диоксо-
аннелирование пирролонами дает возможность
5'-фенил-3-циано-1,1',2',5-тетрагидроспиро[индено-
вводить ценный фармакофорный фрагмент в струк-
[1,2-b]пиридин-4,3'-пиррол]-4'-карбоксилатов
3f-j
туру гетероциклических систем с потенциальной
(cхема 1), структура которых подтверждена на
биологической активностью. Ранее нами описана
примере РСА соединения 3f.
трехкомпонентная спиро-гетероциклизация
1H-
Соединения 3a-j - оранжевые кристаллические
пиррол-2,3-дионов под действием индан-1,3-диона
вещества с высокими температурами плавления,
и циклических енаминов - 3-амино-5,5-диметил-
легкорастворимые в ДМСО, галогеналканах,
циклогекс-2-енонов, приводящая к образованию
труднорастворимые в ацетоне и этаноле и
спиро[индено[1,2-b]хинолин-10,3'-пирролов]
[4].
нерастворимые в алканах и воде.
Трехкомпонентная спиро-гетероциклизация
1H-
пиррол-2,3-дионов под действием индан-1,3-диона
В ИК спектрах соединений 3a-j присутствуют
и ациклических енаминов ранее не изучалась.
полосы валентных колебаний групп NН (3165-
3273 см-1), лактамной, кетонных и сложноэфирной
При взаимодействии 5-фенил-4-этоксикарбонил-
карбонильных групп (1622-1715 см-1). В ИК спектрах
1Н-пиррол-2,3-дионов 1a-е с индан-1,3-дионом и 3-
соединений 3f-j присутствует характерная полоса
амино-1-фенилбут-2-ен-1-оном 2a в соотношении
валентных колебаний группы CN (2200-2208 см-1).
1:1:1, проводимом путем кипячения раствора
реагентов в среде безводного о-ксилола в течение
В спектрах ЯМР 1Н соединений 3a-j, кроме
1-2 ч в присутствии уксусной кислоты (контроль
сигналов протонов заместителей в положении 1'
ТСХ и ВЭЖХ-МС), образуются этил 3-бензоил-2-
пиррольного цикла, ароматических колец и
метил-2',5-диоксо-5'-фенил-1,1',2',5-тетрагидро-
связанных с ними групп, присутствуют триплет и
спиро[индено[1,2-b]пиридин-4,3'-пиррол]-4'-кар-
мультиплет (или квадруплет) протонов этоксикарбо-
367
368
САЛЬНИКОВА и др.
O
EtOOC
O
Me
R2
O
O
, AcOH
NH2
NH2
EtOOC
Ph
2a, b
O
N O
O
O
EtOOC
Me
_H2O
R1
Ph
Ph
N O
R2
N
1a_e
O
R1
R1
NH
O
_H2O
EtOOC
Me
2
R
Ph
N
O
R1
3a_j
1: R1 = Bn (а); Cy (b); Ph (c); C6H4Me-4 (d); C6H4OMe-4 (e); 2: R2 = COPh (a); CN (b); 3:R1 = Bn, R2 = COPh (a); R1 = Cy,
R2 = COPh (b); R1 = Ph, R2 = COPh (c); R1 = C6H4Me-4, R2 = COPh (d); R1 = C6H4OMe-4, R2 = COPh (e); R1 = Bn, R2 = CN
(f); R1 = Cy, R2 = CN (g); R1 = Ph, R2 = CN (h); R1 = C6H4Me-4, R2 = CN (i); R1 = C6H4OMe-4, R2 = CN (j).
нильного заместителя (0.68-0.82 м.д. и 3.65-3.91 м.д.
В спектрах ЯМР 13С соединений 3а-d и 3g-j
соответственно), синглет протонов группы С2-СН3
присутствуют характерные сигналы атомов
(1.44-2.34 м.д.), а также синглет протона группы
углерода кетонных, сложноэфирной и лактамной
NH (10.11-11.01 м.д.).
карбонильных групп (161.4-189.2 м.д.), а также
спироуглеродного атома (50.2-52.9 м.д.).
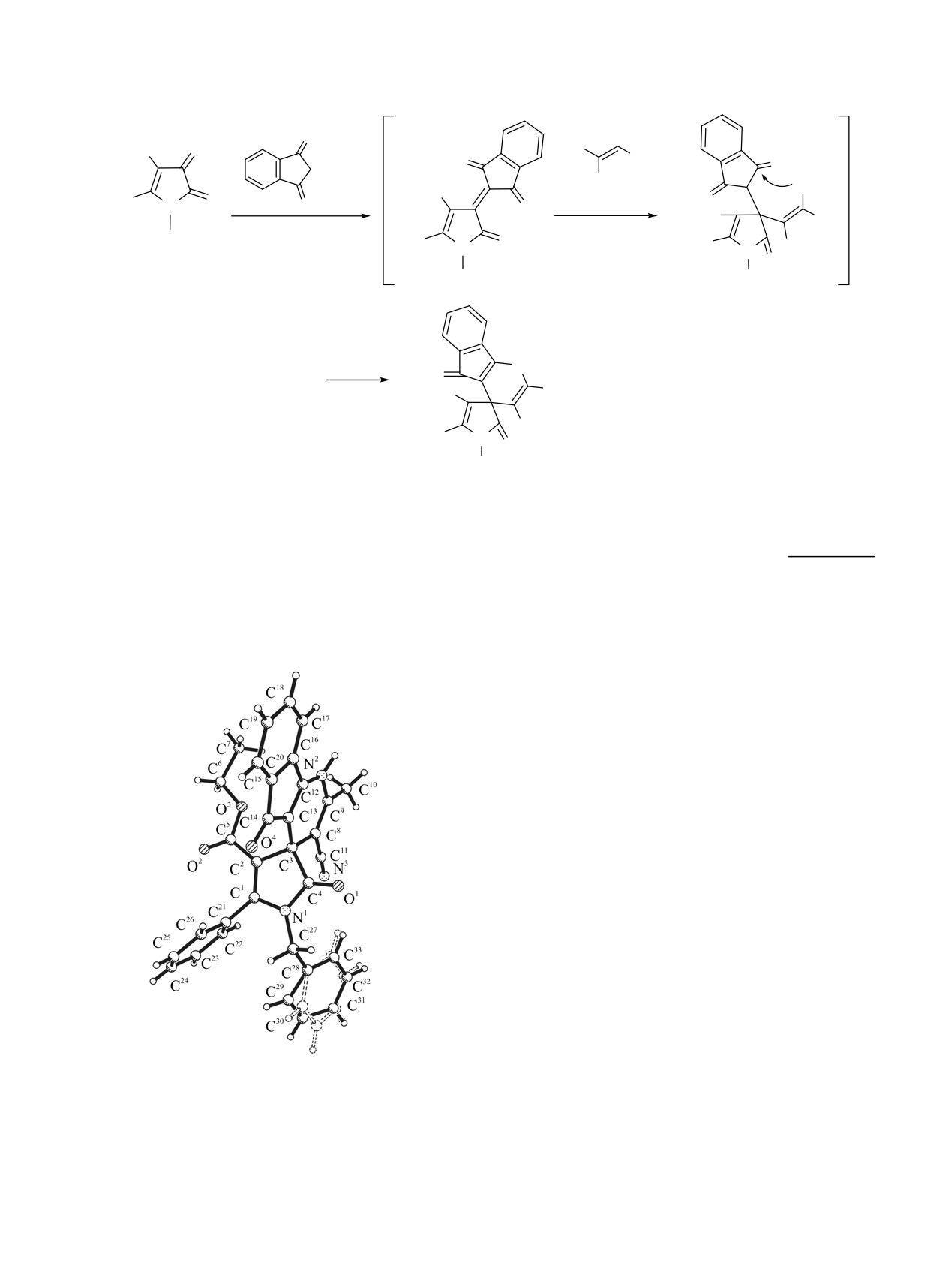
Согласно данным РСА (см. рисунок), соеди-
нение 3f кристаллизуется в центросимметричной
пространственной группе триклинной сингонии в
виде сольвата с о-ксилолом в соотношении 2:1.
Инденопиридиновый и пиррольный циклы плоские
в пределах
0.04 и
0.01Å соответственно.
Фенильный и бензильный заместители развернуты
под большими углами к плоскости пиррольного
цикла, этоксикарбонильный фрагмент лежит в
плоскости цикла. Ароматическое кольцо бен-
зильного заместителя разупорядочено по двум
равнозаселенным позициям. В кристалле молекулы
связаны в центросимметричные димеры за счет
МВС N2-H2···O1 [1-x, 1-y, -z].
Соединения 3 образуются, по-видимому, вследс-
твие первоначальной конденсации кетонной карбо-
нильной группы пирролдионов 1 с метиленовой
группой индан-1,3-диона и последующего после-
довательного нуклеофильного присоединения
Молекулярная структура этил 1'-бензил-2-метил-2',5-
группы β-CH и группы NH2 енамино-фрагмента
диоксо-5'-фенил-3-циано-1,1',2',5-тетрагидроспиро-
[индено[1,2-b]пи-ридин-4,3'-пиррол]-4'-карбоксилата
енаминов 2 к атому углерода в положении 3 и
3f.
кетонной группе соответственно (cхема 1).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 3 2019
ТРЕХКОМПОНЕНТНАЯ СПИРО-ГЕТЕРОЦИКЛИЗАЦИЯ ПИРРОЛДИОНОВ
369
Описанная реакция представляет собой первый
d6), δ, м.д.: 13.4 (CH3CH2), 19.7 (С2-СН3),
44.2
пример трехкомпонентной спиро-гетероциклизации
(CH2Ph), 51.5 (C4), 58.5 (CH3CH2), 104.2, 111.2,
1Н-пиррол-2,3-дионов под действием индан-1,3-
113.5, 119.4, 120.6, 126.5 (2С), 126.7, 127.7 (2С),
диона и ациклических енаминов, а также синтеза
128.0 (2С), 128.2 (2С), 128.5 (2С), 128.7 (2С), 129.1,
малодоступной гетероциклической системы спиро-
130.1, 130.5, 131.8, 132.6, 133.5, 135.7, 137.0, 139.9,
[индено[1,2-b]пиридин-4,3'-пиррола]. Стоит отметить,
141.3, 154.7, 155.5, 162.3 (СОО), 179.5(C2'=O), 189.4
что соединения с инденопиридиновым фрагментом,
(C5=O), 195.2 (PhCO). Найдено, %: C 77.04; H 4.95;
являются основой многих алкалоидов, проявляют
N 4.53. C39H30N2O5. Вычислено, %: C 77.21; H 4.98;
противовоспалительную [5] и цитотоксическую [6]
N 4.62.
активность.
Соединения 3b-e получены аналогично.
Этил 3-бензоил-2-метил-2',5-диоксо-5'-фенил-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1'-циклогексил-1,1',2',5-тетрагидроспиро[инде-
но[1,2-b]пиридин-4,3'-пиррол]-4'-карбоксилат
ИК спектры полученных соединений записаны на
(3b). Выход 60%, т.пл. 312-313°С (1,2-дихлорэтан).
спектрофотометре Perkin Elmer Spectrum Two в виде
ИК спектр, ν, см-1: 3165 (NH), 1690, 1677, 1650,
пасты в вазелиновом масле. Спектры ЯМР 1Н и 13С
1633 (С=O). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д:
записаны на спектрометре Bruker Avance III HD 400
0.68 т (3H, CH3CH2, J 7.1 Гц), 0.78-1.01 м (3Н, Су),
[рабочая частота 400 МГц (1Н) и 100 (13С) МГц],
1.39-1.51 м (1Н, Су), 1.59-1.77 м (7Н, Су+С2-СН3),
внутренний стандарт - ТМС. Элементный анализ
1.89-2.07 м (2Н, Су), 3.05 т.т (1Н, N1'-СН, J 15.4,
выполняли на анализаторе vario MICRO cube.
4.7 Гц), 3.66 к (2Н, CH3CH2, J 7.1 Гц), 7.01 д
Полноту протекания реакций определяли методом
(1Наром, J 6.7 Гц), 7.28-7.54 м (9Наром), 7.55-7.65 м
ВЭЖХ-МС на приборе Waters ACQUITY UPLC I-
(2Наром), 7.69-7.74 м (2Наром), 10.25 с (1Н, NH).
Class (колонка Acquity UPLC BEH C18 1.7 мкм,
Спектр ЯМР 13C (ДМСО-d6), δ, м.д.: 13.4 (CH3CH2),
подвижная фаза
- ацетонитрил-вода, скорость
19.7 (С2-СН3), 24.8 (Су), 25.4 (2С, Су), 28.8 (2С,
потока 0.6 мл/мин, УФ детектор ACQUITY UPLC
Су), 51.7(C4), 54.3 (N1'-СН), 58.3 (CH3CH2), 104.8,
PDA eλ Detector, масс-детектор Xevo TQD).
110.7, 113.8, 119.2, 120.4, 127.9 (2С), 128.1 (2С),
Индивидуальность синтезированных соединений
128.1, 128.3 (2С), 128.7 (2С), 129.1, 130.3, 131.3,
подтверждена методом ТСХ на пластинках Silufol,
131.7, 132.3, 133.5, 140.2, 141.4, 155.2, 155.6, 162.2
элюенты
- бензол-этилацетат,
5:1; этилацетат,
(СОО), 179.3 (C2'=O), 189.2, 195.1 (PhCO, C5=O).
проявляли парами иода. Исходные пирролдионы 1
Найдено, %: C 76.01; H 5.90; N 4.62. C38H34N2O5.
синтезировали взаимодействием соответствующих
Вычислено, %: C 76.23; H 5.72; N 4.68.
енаминов с оксалилхлоридом по ранее описанной
методике [7].
Этил
3-бензоил-2-метил-2',5-диоксо-1',5'-ди-
фенил-1,1',2',5-тетрагидроспиро[индено[1,2-b]-
Этил
1'-бензил-3-бензоил-2-метил-2',5-ди-
пиридин-4,3'-пиррол]-4'-карбоксилат
(3c).
оксо-5'-фенил-1,1',2',5-тетрагидроспиро[индено-
Выход 47%, т.пл. 314-317°С (ацетон). ИК спектр,
[1,2-b]пиридин-4,3'-пиррол]-4'-карбоксилат (3a).
ν, см-1: 3184 (NH), 1706, 1688, 1649, 1645, 1633
Раствор 335 мг (1.0 ммоль) пирролдиона 1а, 146 мг
(С=O). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.78 т
(1.0 ммоль) индандиона и 161 мг (1.0 ммоль)
(3H, CH3CH2, J 7.1 Гц), 1.79 с (3Н, С2-СН3), 3.78 к
3-амино-1-фенилбут-2-ен-1-она 2a в 10 мл безвод-
(2Н, CH3CH2, J 7.1 Гц), 6.99-7.79 м (19Наром), 10.43
ного о-ксилола в присутствии 57 мкл (1.0 ммоль)
с (1Н, NH). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.:
уксусной кислоты кипятили в течение
2 ч
13.5 (CH3CH2),
20.0 (С2-СН3),
51.7 (C4),
58.7
(контроль ТСХ и ВЭЖХ-МС), охлаждали,
(CH3CH2), 104.8, 110.9, 113.8, 119.5, 120.6, 127.4
полученный осадок 3а отфильтровывали. Выход
(2С), 127.7, 128.3 (4С), 128.6 (2С), 128.8 (2С), 128.9
398 мг (62%), т.пл. 303-305°С (ацетон). ИК спектр,
(3С), 130.2, 130.5, 131.9, 132.4, 133.5, 134.9, 135.7,
ν, см-1: 3183 (NH), 1692, 1645, 1632, 1622 (С=O).
140.4, 142.9, 154.0, 155.3, 162.5 (СОО), 178.6, 189.5,
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.70 т (3H,
195.5. Найдено,
%: C
77.11; H
4.68; N
4.71.
CH3CH2, J 7.1 Гц), 1.77 с (3Н, С2-СН3), 3.65-3.75 м
C38H28N2O5. Вычислено, %: C 77.01; H 4.76; N 4.73.
(2Н, CH3CH2), 4.41 д (1H, CH2Ph, J 16.4 Гц), 4.51 д
(1H, CH2Ph, J 16.4 Гц), 6.97-7.44 м (12Наром), 7.46-
Этил
3-бензоил-2-метил-2',5-диоксо-1'-(4-
7.55 м (3Наром), 7.58-7.68 м (2Наром), 7.75-7.81 м
толил)-5'-фенил-1,1',2',5-тетрагидроспиро[инде-
(2Наром), 10.38 с (1Н, NH). Спектр ЯМР 13C (ДМСО-
но[1,2-b]пиридин-4,3'-пиррол]-4'-карбоксилат
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 3 2019
370
САЛЬНИКОВА и др.
(3d). Выход 52%, т.пл. 305-308°С (ацетон). ИК
пространственная группа P-1, a 11.444(2), b 12.461(2),
спектр, ν, см-1: 3194 (NH), 1712, 1689, 1649, 1636,
c 12.9795(17) Å, α 91.911(13), β 101.699(14), γ
1624 (С=O). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.77 т
116.597(19)°, V 1604.3(5) Å3, 2(C33H25N3O4)·C8H10,
(3H, CH3CH2, J 7.1 Гц), 1.44 уш.с (3Н, С2-СН3),
Z 1. Набор экспериментальных отражений получен
2.30 с (3Н, С6Н4-СН3), 3.71-3.91 м (2Н, CH3CH2),
на дифрактометре Xcalibur Ruby с ССD-детектором
6.93-7.06 м (1Наром), 7.10-7.24 м (9Наром), 7.27-7.37
по стандартной методике (MoKα-излучение, 295(2) K,
м (5Наром), 7.38-7.49 м (1Наром), 7.54-7.67 м (2Наром),
ω-сканирование, шаг сканирования 1°). Поглощение
10.11 с (1Н, NH). Спектр ЯМР 13C (CDCl3), δ, м.д.:
учтено эмпирически с использованием алгоритма
13.8 (CH3CH2), 20.6, 21.4, 52.9 (C4), 59.4 (CH3CH2),
SCALE3 ABSPACK [8]. Всего измерено 12733 отра-
105.0, 112.1, 114.5, 120.1, 120.7, 127.5 (2С), 128.6
жений, из них независимых 7433, 4890 отражений
(2С), 128.7 (2С), 128.7 (2С), 128.9, 129.5 (2С), 129.8
с I > 2σ(I). Структура определена прямым методом
(2С), 130.1, 130.5, 131.7, 132.3, 132.5, 133.5, 135.6,
по программе SHELXS-97
[9] и уточнена
138.3, 140.6, 143.3, 155.5, 156.3, 163.1, 182.2, 190.8,
полноматричным МНК по F2 в анизотропном
195.7.Найдено,
%: C
77.33; H
4.97; N
4.76.
приближении для всех неводородных атомовс
C39H30N2O5. Вычислено, %: C 77.21; H 4.98; N 4.62.
использованием программы SHELXL-97 [9]. Атом
водорода группы NH локализован из разностных
Этил 3-бензоил-2-метил-1'-(4-метоксифенил)-
синтезов электронной плотности и уточнен
2',5-диоксо-5'-фенил-1,1',2',5-тетрагидроспиро-
независимо в изотропном приближении, остальные
[индено[1,2-b]пиридин-4,3'-пиррол]-4'-карбокси-
включены в уточнение в модели наездника. На
лат (3e). Выход 56%, т.пл. 280-283°С (дихлорметан).
тепловые и геометрические параметры части
ИК спектр, ν, см-1: 3185 (NH), 1712, 1689, 1649,
атомов компонент разупорядочения наложены
1636, 1623 (С=O). Спектр ЯМР 1Н (CDCl3), δ, м.д.:
мягкие ограничения вида DELU, SADI, DFIX,
0.77 т (3H, CH3CH2, J 7.1 Гц), 1.44 уш.с (3Н, С2-
SAME. Ароматический цикл о-ксилола идеали-
СН3), 3.72-3.87 м (5Н, ОСН3+CH3CH2), 6.79-6.87 м
зирован с помощью жесткого ограничения AFIX
(2Наром), 6.96-7.06 м (1Наром), 7.10-7.26 м (7Наром),
66. Окончательные параметры уточнения: R1
7.27-7.50 м (6Наром), 7.56-7.63 м (2Наром), 10.11 с
0.0629, wR2 0.1619 [для отражений с I > 2σ(I)], R1
(1Н, NH). Найдено, %: C 75.28; H 4.72; N 4.38.
0.0963, wR2 0.1898 (для всех отражений), S 1.032.
C39H30N2O6. Вычислено, %: C 75.23; H 4.86; N 4.50.
Результаты РСА зарегистрированы в Кембридж-
Этил 1'-бензил-2-метил-2',5-диоксо-5'-фенил-
ском центре кристаллографических данных под
3-циано-1,1',2',5-тетрагидроспиро[индено[1,2-b]-
номером CCDC 1864909 и могут быть запрошены
пиридин-4,3'-пиррол]-4'-карбоксилат
(3f).
Раствор 335 мг (1.0 ммоль) пирролдиона 1а, 146 мг
(1.0 ммоль) индандиона и
82 мг
(1.0 ммоль)
Соединения 3g-j получены аналогично.
3-аминобут-2-енонитрила 2b в 10 мл безводного
Этил
2-метил-2',5-диоксо-5'-фенил-3-циано-
о-ксилола в присутствии
57 мкл
(1.0 ммоль)
1'-циклогексил-1,1',2',5-тетрагидроспиро[инде-
уксусной кислоты кипятили в течение
1 ч
но[1,2-b]пиридин-4,3'-пиррол]-4'-карбоксилат
(контроль ТСХ и ВЭЖХ-МС), охлаждали,
(3g). Выход 66%, т.пл. 310-312°С (дихлорметан).
полученный осадок 3f отфильтровывали. Выход
ИК спектр, ν, см-1: 3267 (NH), 2202 (CN), 1702,
358 мг (68%), т.пл. 274-275°С (ацетон). ИК спектр,
1693, 1656 (С=O). Спектр ЯМР 1Н (ДМСО-d6), δ,
ν, см-1: 3195 (NH), 2208 (CN), 1693, 1682, 1652
м.д.: 0.73 т (3H, CH3CH2, J 7.1 Гц), 0.82-1.06 м (3Н,
(С=O). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.74 т
Су), 1.40-1.75 м (5Н, Су), 1.92-2.14 м (2Н, Су), 2.28
(3H, CH3CH2, J 7.1 Гц), 2.32 с (3Н, С2-СН3), 3.76 к
с (3Н, С2-СН3), 3.09 т.т (1Н, N1'-СН, J 12.8, 3.7 Гц),
(2H, CH3CH2, J 7.0 Гц), 4.48-4.61 м (2Н, CH2Ph),
3.66-3.78 м (2H, CH3CH2), 7.23-7.64 м (9Наром),
7.06-7.15 м (4Наром), 7.16-7.27 м (3Наром), 7.32-7.47
10.85 с (1Н, NH). Спектр ЯМР 13C (ДМСО-d6), δ,
м (5Наром), 7.53 т.д (1Наром, J 7.4, 1.2 Гц), 7.60-7.66
м.д.: 13.4 (CH3CH2), 18.3 (С2-СН3), 24.6, 25.3 (2С),
м (1Наром), 11.01 с (1Н, NH). Найдено, %: C 74.94; H
28.7, 28.8 (5C, Cy), 50.2 (С4), 54.6 (N1'-СН), 58.7
4.85; N 7.87. C33H25N3O4. Вычислено, %: C 75.13; H
(CH3CH2), 85.9, 95.4 (2С), 103.6, 111.2, 116.9, 119.6,
4.78; N 7.96.
120.9, 128.4 (2С), 129.6, 130.2, 130.6, 132.2, 132.8,
Для рентгеноструктурного анализа соединения
135.7,
149.3,
155.0,
155.9,
161.4,
178.2,
189.7.
3f использован обломок оранжевого кристалла
Найдено, %: C 74.02; H 5.73; N 8.20. C32H29N3O4.
размером 0.35×0.30×0.20 мм. Кристалл триклинный,
Вычислено, %: C 73.97; H 5.63; N 8.09.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 3 2019
ТРЕХКОМПОНЕНТНАЯ СПИРО-ГЕТЕРОЦИКЛИЗАЦИЯ ПИРРОЛДИОНОВ
371
Этил 2-метил-2',5-диоксо-1',5'-дифенил-3-циано-
м (1Наром), 7.60-7.67 м (1Наром), 11.00 с (1Н, NH).
1,1',2',5-тетрагидроспиро[индено[1,2-b]пиридин-
Спектр ЯМР 13C (ДМСО-d6), δ, м.д.: 13.5 (CH3CH2),
4,3'-пиррол]-4'-карбоксилат
(3h). Выход
55%,
18.2 (С2-СН3),
50.3 (С4),
55.3 (ОСН3),
59.0
т.пл. 322-325°С (дихлорметан). ИК спектр, ν, см-1:
(CH3CH2), 85.5, 103.5, 111.2,
114.3
(2С), 117.1,
3273 (NH), 2202 (CN), 1715, 1693, 1653,
1629
119.8, 121.1, 126.6, 127.7 (2С), 129.0 (2С), 129.3
(С=O). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.82 т
(4С), 130.8, 132.4, 132.8, 135.7, 149.8, 154.7, 155.2,
(3H, CH3CH2, J 7.1 Гц), 2.34 с (3Н, С2-СН3), 3.78-
158.8, 161.7, 177.7, 190.0.Найдено, %: C 72.80; H
3.88 м (2Н, CH3CH2), 7.03-7.12 м (2Наром), 7.17-7.48
4.61; N 7.78. C33H25N3O5. Вычислено, %: C 72.92; H
м (10Наром), 7.53 т.д (1Наром, J 7.4, 1.3 Гц), 7.61-7.66
4.64; N 7.73.
м (1Наром), 10.97 с (1Н, NH). Спектр ЯМР 13C
(ДМСО-d6), δ, м.д.: 13.4 (CH3CH2), 18.1 (С2-СН3),
ФОНДОВАЯ ПОДДЕРЖКА
50.4 (С4), 59.0 (CH3CH2), 85.4, 103.3, 111.4, 117.0,
119.7, 121.0, 127.6 (2С), 128.0 (2С), 128.2, 128.9
Работа выполнена при финансовой поддержке
(4С), 129.2, 129.3, 130.7, 132.3, 132.7, 134.0, 135.6,
РФФИ (проект № 16-43-590357), Правительства
149.7, 154.1, 155.1, 161.6, 177.3, 189.9. Найдено, %:
Пермского края и Совета по грантам Президента
C 74.66; H 4.68; N 8.16. C32H23N3O4. Вычислено, %:
РФ (грант № МК-1657.2017.3).
C 74.84; H 4.51; N 8.18.
КОНФЛИКТ ИНТЕРЕСОВ
Этил 2-метил-2',5-диоксо-1'-(4-толил)-5'-фенил-
3-циано-1,1',2',5-тетрагидроспиро[индено[1,2-b]-
Авторы заявляют об отсутствии конфликта
пиридин-4,3'-пиррол]-4'-карбоксилат (3i). Выход
интересов.
52%, т.пл.
333-336°С (ДМСО-вода,
2:1). ИК
спектр, ν, см-1: 3270 (NH), 2200 (CN), 1714, 1692,
СПИСОК ЛИТЕРАТУРЫ
1653, 1627 (С=O). Спектр ЯМР 1Н (ДМСО-d6), δ,
м.д.: 0.80 т (3H, CH3CH2, J 7.1 Гц), 2.23 с, 2.33 с
1. Liu G.T., Li W.X., Chen Y.Y., Wei H.L. Drug. Dev.
(6Н, С2-СН3+С6Н4-СН3), 3.75-3.88 м (2Н, CH3CH2),
Res. 1996, 39, 174. . doi 10.1002/(SICI)1098-2299
6.89-7.01 м (2Наром), 7.11-7.23 м (4Наром), 7.27-7.46
(199610)39:2<174::AID-DDR10>3.0.CO;2-C
м (5Наром), 7.50-7.56 м (1Наром), 7.61-7.66 м (1Наром),
2. Jiang X.Y., Zhang J.T. J. Asian Nat. Prod. Res. 1998, 1,
11.00 с (1Н, NH). Спектр ЯМР 13C (ДМСО-d6), δ,
53. doi 10.1080/10286029808039843
м.д.: 13.5 (CH3CH2), 18.2 (С2-СН3), 20.6 (С6Н4-
3. Schobert R., Schlenk A. Bioorg. Med. Chem. 2008, 16,
СН3), 50.4 (С4), 59.0 (CH3CH2), 85.4, 103.4, 111.3,
4203. doi 10.1016/j.bmc.2008.02.069
117.1, 119.8, 121.1, 127.7 (2С), 127.9 (2С), 129.0
4. Dmitriev M.V., Salnikova T.V., Silaichev P.S.,
(2С), 129.3, 129.4, 129.5 (2С), 130.8, 131.4, 132.4,
Maslivets A.N. Tetrahedron Lett. 2017, 58, 67. doi
10.1016/j.tetlet.2016.11.100
132.8, 135.7, 137.8, 149.8, 154.4, 155.2, 161.6, 177.5,
189.9.Найдено,
%: C
75.36; H
4.73; N
7.84.
5. Cooper K., Fray M.J., Cross P.E., Richardson K. Пат.
C33H25N3O4. Вычислено, %: C 75.13; H 4.78; N 7.96.
EP 299727 A1, 1989.
6. Miri R., Javidnia K., Hemmateenejad B., Azarpira A.,
Этил 2-метил-1'-(4-метоксифенил)-2',5-диоксо-
Mirghofran Z. Bioorg. Med. Chem. 2004, 12, 2529. doi
5'-фенил-3-циано-1,1',2',5-тетрагидроспиро[ин-
10.1016/j.bmc.2004.03.032
дено[1,2-b]пиридин-4,3'-пиррол]-4'-карбоксилат
7. Sano T., Horiguchi Y., Toda J., Imafuku K., Tsuda Y.
(3j). Выход 60%, т.пл. 327-330°С (ацетон). ИК
Chem. Pharm. Bull.
1984,
32,
497. doi
10.1248/
спектр, ν, см-1: 3261, 3225 (NH), 2202 (CN), 1712,
cpb.32.497
1693, 1654 (С=O). Спектр ЯМР 1Н (ДМСО-d6), δ,
8. CrysAlisPro, Agilent Technologies, Version 1.171.37.33
м.д.: 0.80 т (3H, CH3CH2, J 7.1 Гц), 2.33 с (3Н, С2-
(release 27-03-2014 CrysAlis171 .NET).
СН3), 3.69 с (3Н, ОСН3), 3.76-3.89 м (2H, CH3CH2),
9. Sheldrick G.M. Acta Cryst.
2008, A64,
112. doi
6.83-7.05 м (4Наром), 7.13-7.48 м (7Наром), 7.48-7.57
10.1107/S0108767307043930
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 3 2019
372
САЛЬНИКОВА и др.
Three-Component Spiro Heterocyclization
of Pyrrolediones, Indan-1,3-dione and Acyclic Enamines
T. V. Salnikova, M. V. Dmitriev, and A. N. Maslivets*
Perm State University, 614990, Russia, Perm, ul. Bukireva 15
*e-mail: koh2@psu.ru
Received September 19, 2018
Revised October 9, 2018
Accepted November 17, 2018
Three-component synthesis of 3-benzoyl-2-methyl-2',5-dioxo-5'-phenyl-1,1',2',5-tetrahydrospiro[indeno[1,2-b]-
pyridine-4,3'-pyrroles] and
2-methyl-2',5-dioxo-5'-phenyl-3-cyano-1,1',2',5-tetrahydrospiro[indeno[1,2-b]-
pyridine-4,3'-pyrroles] derivatives via the spiroheterocyclization of 5-phenyl-4-ethoxycarbonyl-1H-pyrrole-2,3-
diones, indan-1,3-dione and 3-amino-1-phenylbut-2-en-1-one or 3-aminobut-2-enonitrile is described.
Keywords:
1H-pyrrole-2,3-diones, three-component reactions, spiro heterocyclization, dihydropyridines,
indenopyridines, enamines
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 3 2019