ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 4, с. 566-572
УДК 547.333.4 + 547.754 + 547.722.3
КАТАЛИЗИРУЕМОЕ ОСНОВАНИЕМ
ВНУТРИМОЛЕКУЛЯРНОЕ ЦИКЛОПРИСОЕДИНЕНИЕ
ХЛОРИДОВ ДИАЛКИЛ-4-ГИДРОКСИБУТ-2-ИНИЛ-
[3-(4-БРОМФЕНИЛ)ПРОП-2-ИНИЛ]АММОНИЯ И
РЕЦИКЛИЗАЦИЯ ПОЛУЧЕННЫХ ПРОДУКТОВ
© 2019 г. Э. O. Чухаджянa, А. Р. Геворкянa, c, *, К. Г. Шахатуниa,
Эл. О. Чухаджянa, Г. А. Паносянb
a Научно-технологический центр органической и фармацевтической химии НАН Республики Армения,
Институт органической химии, 0014, Армения, г. Ереван, пр. Азатутян 26
*e-mail: hasmikgevorgyan973@gmail.com
b Научно-технологический центр органической и фармацевтической химии НАН Республики Армения,
Центр исследования строения молекул, 0014, Армения, г. Ереван, пр. Азатутян 26
c Национальный политехнический университет Армении, 0009, Армения, г. Ереван, ул. Теряна 105
Поступила в редакцию 17 октября 2018 г.
После доработки 28 октября 2018 г.
Принята к публикации 14 декабря 2018 г.
Хлориды диалкил-4-гидроксибут-2-инил[3-(4-бромфенил)проп-2-инил]аммония в присутствии
двукратного мольного количества едкого кали при комнатной температуре с саморазогреванием
подвергаются внутримолекулярному циклоприсоединению с последующей внутримолекулярной
рециклизацией циклических продуктов. Пиперидиниевые и морфолиниевые соли, подобно другим
4-гидроксибут-2-инильным аналогам, при предварительном нагревании до 45-50°C в течение 10-15 мин
в присутствии
0.2 моль щелочи на моль исходной соли с саморазогреванием подвергаются
внутримолекулярному циклоприсоединению. В этих условиях также имеет место рециклизация
циклических продуктов на
10-13%. Хлориды
2,2-пентаметилен-4-гидроксиметил-6-бромбензо[f]-
изоиндолиния, спиро[4-гидроксиметил-6-бромбензо[f]изоиндолин]-2,4'-морфолиния под действием
двукратного мольного количества KOH при комнатной температуре в течение 10-15 мин подвергаются
внутримолекулярной рециклизации с образованием - 8-бром-1,3-дигидронафто[1,2-с]фуранов.
Ключевые слова: внутримолекулярное циклоприсоединение, внутримолекулярная рециклизация,
хлориды диалкил-4-гидроксибут-2-инил[3-(4-бромфенил)проп-2-инил]аммония, хлориды 2,2-диалкил-4-
гидроксиметил-6-бромбензо[f]изоиндолиния, хлорид 2,2-пентаметилен-4-гидроксиметил-6-бромбензо[f]-
изоиндолиния, хлорид спиро[4-гидроксиметил-6-бромбензо[f]изоиндолин]-2,4'-морфолиния, диалкил-
аминометил-8-бром-1,3-дигидронафто[1,2-с]фураны.
DOI: 10.1134/S0514749219040104
В литературе имеются многочисленные работы,
В 2003 году при изучении водно-щелочного
посвященные межмолекулярной рециклизации карбо-
расщепления бромидов и хлоридов - 4-гидрокси-
и, особенно, гетероциклических соединений [1-6]. Во
метилбензо[f]изоиндолиния нами обнаружена
всех случаях под действием различных нуклеофи-
внутримолекулярная рециклизация [10], приводящая
льных, электрофильных или биполярных реагентов
к формированию производных 1,3-дигидробензо-
происходит раскрытие цикла и последующее его
[1,2-c]фуранов с высокими выходами. Образование
замыкание. Процесс часто сопровождается рас-
последних включает стадии внутримолекулярной
ширением или сужением цикла, введением в его
атаки алкокси-аниона на частично положительно
состав гетероатома или его замена на другой.
заряженный углеродный атом изоиндолиниевого
Работы же, посвященные внутримолекулярной
цикла, разрыв N-C связи и образование новой C-O
рециклизации, малочисленны [7-9].
связи. В продолжение исследований было выяв-
566
КАТАЛИЗИРУЕМОЕ ОСНОВАНИЕМ ВНУТРИМОЛЕКУЛЯРНОЕ ЦИКЛОПРИСОЕДИНЕНИЕ
567
Схема 1.
OH
HO
HO
0.2 mol 3N KOH per mol of
R
initial salt, 10_15 min 45_50oC,
H
Br
N
Br
R
R'
R
with self heating 80_85oC
Br
N
N
R'
Cl
R'
Cl
Cl
OH
2a_e
3d, e
2 mol KOH,
10_15 min, rt
2 mol KOH per
HO
O
O
mol of initial salt,
with self heating
Br
R
Br
R
Br
R
70_75oC
N
N
N
R'
_
_Cl
R'
Cl
R'
Cl
Cl
3a_c
4a_e
R = R' = Me (a), Et (b), Pr (c); R,R' = (CH2)5 (d), (CH2)2O(CH2)2 (e).
лено влияние объемных заместителей, находящих-
вследствие этого электронный сдвиг, обуслов-
ся у атома азота, и заместителей в ароматическом
ленный наличием атома брома, имеет противо-
кольце, а также числа ароматических колец на внутри-
положное направление направлению циклизации,
молекулярное циклоприсоединение и на рецикли-
тем самым затрудняет циклизацию. Однако, при
зацию полученных циклических продуктов [11-15].
ступенчатом добавлении к водному раствору солей
2а-c двукратного мольного количества едкого
С целью расширения и развития области
калия на моль исходной соли имеет место
внутримолекулярной рециклизации внутримоле-
саморазогревание реакционной смеси (температура
кулярным циклоприсоединением хлоридов
4-
реакционной смеси от
30°С ступенчато подни-
гидроксибут-2-инил[3-(4-бромфенилпроп-2-инил)]-
мается до
70-75°С) и сразу наблюдается
аммония мы синтезировали хлориды 4-гидрокси-
образование слоя аминного продукта, т. е. имеет
метил-6-бромбензо[f]изоиндолиния и изучили их
место циклоприсоединение с последующей
рециклизацию. Алкилированием диалкил
[3-(4-
рециклизацией циклических продуктов 3а-c. Для
бромфенил)проп-2-инил]аминов (1а-е) [16] 1-хлор-
обеспечения полноты рециклизации смесь в
4-гидроксибут-2-ином [17] были получены хлориды
течение 15-20 мин нагревают при 60-65°С. Затем
диалкил-4-гидроксибут-2-инил[3-(4-бромфенил)-
из реакционной смеси экстрагированием выделяют
проп-2-инил]аммония
(2а-е) почти с количест-
4-диметил- (4а), 4-диэтил- (4b), 4-дипропиламино-
венными выходами и изучены их внутримо-
метил-8-бром-1,3-дигидронафто[1,2-с]фураны
(4с)
лекулярное циклоприсоединение и рециклизация
с 50, 82 и 62% выходами соответственно (схема 1).
полученных циклических солей - хлоридов 2,2-
В случае солей 2а-c невозможно выделить соли
диалкил-4-гидроксиметил-6-бромбензо[f]изоиндо-
3а-с, т.к. они в вышеуказанных условиях быстро
линия
(3а-е). Циклоприсоединение солей
2а-е
подвергаются внутримолекулярной рециклизации.
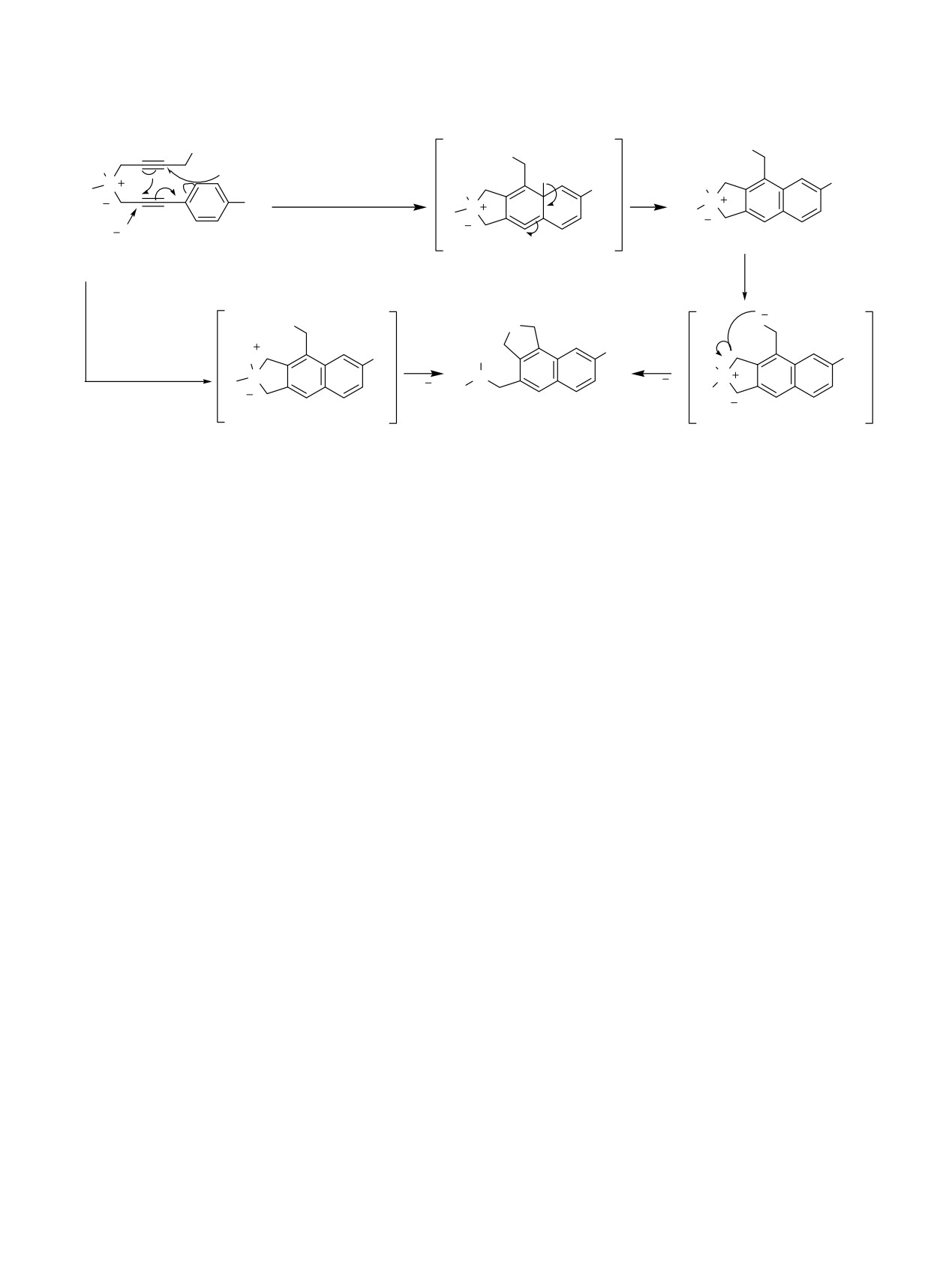
реализуется по механизму, описанному нами в
работах [18, 19].
Следует отметить, что циклоприсоединение
хлоридов 2d, е, аналогично другим солям с 4-
Выявлено, что соли 2а-c в присутствии 0.2 моль
гидроксибут-2-инильной группой
[11-14], в
щелочи на моль исходной соли, даже при
присутствии 0.2 моль щелочи на моль исходной
предварительном нагревании реакционной смеси
соли протекает после предварительного нагревания
до 45-50°С в течение 10-15 мин, в отличие от
реакционной смеси до 45-50°С в течение 10-
других
4-гидроксибут-2-инильных аналогов
15 мин. Затем с саморазогреванием имеет место
[11-14], не подвергаются циклоприсоединению.
циклоприсоединение (схема 1).
Эти данные говорят в пользу механизма
циклизации [18, 19], т.к. атом брома по сравнению
Наряду с циклическими продуктами 3d, е с 60 и
с атомом хлора менее электроотрицателен,
62%-ными выходами соответственно были
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
568
ЧУХАДЖЯН и др.
выделены также продукты рециклизации - 4-пента-
Установлено неблагоприятное влияние атома
метиленаминометил-8-бром-1,3-дигидро-нафто[1,2-
брома, находящегося в
4-ном положении
с]- (4d) и 4-морфолинометил-8-бром-1,3-дигидро-
бензольного кольца в диеновом фрагменте, на
нафто[1,2-c]фураны (4е) с 10-13%-ными выходами.
циклоприсоединение и его благоприятное действие
на внутримолекулярную рециклизацию получен-
Способность солей
2d, е подвергаться
ных циклических продуктов.
циклоприсоединению в вышеуказанных условиях,
по сравнению с солями 2а-с, можно объяснить
Разработан доступный способ получения
наличием пиперидинового или морфолинового
потенциально биоактивных новых производных
цикла в молекуле. Последние по сравнению с
1,3-дигидронафто[1,2-c]фуранов
(4а-е), а также
диалкильными заместителями в большей степени
хлоридов
2,2-пентаметилен-4-гидроксиметил-6-
нейтрализуют положительный заряд атома азота, в
бромбензо[f]изоиндолиния
(3d), и спиро[4-
результате чего облегчается процесс цикло-
гидроксиметил-6-бромбензо[f]изоиндолин]-2,4'-
присоединения по механизму
[19]. В пользу
морфолиния (3е) - соединений, синтез которых
изложенного свидетельствуют также результаты
другими химическими методами трудно осущест-
кинетических исследований: скорости цикло-
вить.
присоединения пиперидиниевой и морфолиниевой
Структуры исходных солей 2а-е, циклических
солей превышают скорость циклоприсоединения
продуктов
3d, е и аминов рециклизации
4а-е
диалкильных аналогов [20].
подтверждены ИК, ЯМР 1Н и 13С спектральными
Установлено, что соли 3d, e в водном растворе
методами.
при наличии двукратного мольного количества
едкого калия в течение 10-15 мин при комнатной
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
температуре легко подвергаются внутримолеку-
лярной рециклизации с образованием аминов 4d, е
ИК спектры солей
2a-e,
3d, e (плёнки из
с 55 и 58%-ными выходами соответственно.
хлороформа), аминов
4а-е (тонкий слой)
зарегистрированы на спектрометре Specord IR-75.
То обстоятельство, что в случае солей 2а-с в
Спектры ЯМР 1Н и 13C записаны на спектрометре
щелочной среде были выделены лишь продукты
Mercury-300 VX фирмы Varian
(300.077 и
рециклизации, и в случае солей 3d, e в отличие от
75.463 МГц, соответсвенно) в ДМСО-d6-CCl4.
циклических продуктов, полученных циклизацией
Химические сдвиги приведены относительно
-3-фенил- или
-3-(4-хлорфенил)проп-2-инильных
сигнала ТМС как внутреннего стандарта.
аналогов [10, 12], рециклизация в щелочной среде
Элементный анализ проведён на компактном
протекает при комнатной температуре, говорит о
элементном анализаторе Vario MICRO cube.
благоприятном действии атома брома, нахо-
Температуры плавления солей определены на
дящегося в цикле на рециклизацию. Последний
приборе фирмы VEB Wägetechnik Rapido Radebeul
является менее электроотрицательным, по
Betrieb des VEB Kombinat NAGEMA DDR.
сравнению с атомом хлора, в результате чего
увеличивается электронная плотность молекулы,
Амины 1a-e получали по методике [16].
тем самым облегчается способность нуклеофиль-
Получение солей 2a-e (общая методика). Соли
ной атаки алкокси-аниона на частично
2a-е практически с количественными выходами
положительно заряженный углеродный атом
получали алкилированием
3 ммоль соответст-
изоиндолиниевого цикла.
вующих аминов
1a-е двукратным мольным
Протекание рециклизации при комнатной
количеством 1-хлор-4-гидроксибут-2-ином [17] в
температуре является уникальным случаем в
среде ацетонитрилa (5-7 мл). Реакционную смесь
области внутримолекулярной рециклизации.
нагревали в течение 3-4 ч. Затем под низким
давлением отгоняли растворитель. Оставшиеся
Таким образом, впервые в катализируемое
медообразные соли после промывания абсолют-
основанием внутримолекулярное [4+2] циклопри-
ным эфиром (3×20 мл) кристаллизовались и были
соединение типа диенового синтеза вовлечены
выделены фильтрованием.
хлориды аммония, содержащие 4-гидроксибут-2-
инильную группу наряду с 3-(4-бромфенил)проп-2-
Хлорид диметил-4-гидроксибут-2-инил[3-(4-
инильной.
бромфенил)проп-2-инил]аммония
(2a). Выход
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
КАТАЛИЗИРУЕМОЕ ОСНОВАНИЕМ ВНУТРИМОЛЕКУЛЯРНОЕ ЦИКЛОПРИСОЕДИНЕНИЕ
569
0.9 г (88%), белые кристаллы, т.пл. 153-155°C (абс.
2220 (двузамещенная ацетиленовая связь), 880-830
EtOH). ИК спектр, ν, см-1: 3350-3100, 1040 (группа
(п-замещенное бензольное кольцо). Спектр ЯМР
ОН),
3040,
1570 (ароматическое кольцо),
2220
1Н, δ, м.д.: 1.66-1.78 м (2Н, γ-CH2), 1.90-2.02 м (4Н,
(двузамещенная ацетиленовая связь), 850-810 (п-
β,β'-2CH2), 3.73-3.88 м (4Н, α,α'-CH2), 4.17 уш.т
замещенное бензольное кольцо). Спектр ЯМР 1Н,
(2Н, J 5.6, 2.0 Гц, OCH2), 4.73 уш.т (2H, J 2.0 Гц,
δ, м.д.: 3.42 с (6Н, CH3), 4.19 т (2Н, J 1.8 Гц, OCH2),
CH2C≡C), 4.99 с (2H, CH2C≡CAr), 5.62 уш.т (1H, J
4.79 т (2H, J 1.8 Гц, CH2C≡CH), 5.00 с (2H,
5.6 Гц, OH), 7.51-7.59 м (4H, C6H4). Спектр ЯМР
CH2C≡CAr), 5.52, уш.с (1H, OH), 7.50-7.58 м (4H,
13C, δ, м.д.: 19.2 (2β,β'-CH2), 20.2 (γ-CH2), 48.9 (α,α'-
C6H4). Спектр ЯМР 13C, δ, м.д.: 48.8 (CH3), 48.9
CH2), 49.8 (NCH2), 49.9 (NCH2), 57.1 (ОCH2), 71.2
(CH3), 49.0 (CH2), 53.4 (CH2), 71.8 (≡C), 78.4 (≡C),
(≡C), 77.9 (≡C), 89.3 (≡CH), 92.2 (≡C), 119.4, 123.0,
89.3 (≡C), 92.1 (≡C), 119.5, 123.1, 131.2 (2CH), 133.4
131.1 (2CH), 133.4 (2CH). Найдено, %: C 56.80; H
(2CH). Найдено, %: C 52.78; H 5.11; Br 23.11; N
5.70; Br 20.60; N 3.41. C18H21BrClNO. Вычислено,
3.97. C15H17BrClNO. Вычислено, %: C 52.55; H
%: C 56.47; H 5.49; Br 20.91; N 3.66.
4.96; Br 23.36; N 4.09.
Хлорид
4-гидроксибут-2-инил[3-(4-бром-
Хлорид диэтил-4-гидроксибут-2-инил[3-(4-
фенил)проп-2-инил]морфолиния
(2е). Выход
0.92 г (80%), белые кристаллы, т.пл. 178-180°C
бромфенил)проп-2-инил]аммония
(2b). Выход
1 г (90%), белые кристаллы, т.пл. 162-164°C (абс.
(абс. EtOH). ИК спектр, ν, см-1: 3350-3100, 1040
EtOH). ИК спектр, ν, см-1: 3340-3100, 1040 (группа
(группа ОН),
3050,
1610,
1580 (ароматическое
кольцо), 2230 (двузамещенная ацетиленовая связь),
ОН),
3030,
1600 (ароматическое кольцо),
2230
(двузамещенная ацетиленовая связь), 840-810 (п-
840-810 (п-замещенное бензольное кольцо). Спектр
замещенное бензольное кольцо). Спектр ЯМР 1Н,
ЯМР 1Н, δ, м.д.: 3.82-3.87 м [4Н, O(CH2)2], 4.02-4.08
м [4Н, N(CH2)2], 4.18 уш.т (2Н, J 1.8 Гц, CH2OН),
δ, м.д.: 1.42 т (6Н, J 7.2 Гц, CH3), 3.68 к (4Н, J
7.2 Гц, CH2CH3), 4.16 уш.д.т (2Н, J 4.8, 1.8 Гц,
4.88 уш.т (2Н, J 1.8 Гц, NCH2C≡CCH2O), 5.15 с
OCH2), 4.55 уш.т (2H, J 1.8 Гц, CH2C≡CH), 4.81 с
(2H, CH2C≡CAr), 5.57 ш.с (1H, OH), 7.53-7.60 м
(4H, C6H4). Спектр ЯМР 13C, δ, м.д.: 48.9 [N(CH2)2],
(2H, CH2C≡CAr), 5.63 уш.т (1H, J 4.8 Гц, OH), 7.50-
7.59 м (4H, C6H4). Спектр ЯМР 13C, δ, м.д.: 7.9
50.1 (NCH2), 50.4 (NCH2), 56.1 (CH2ОH), 59.5 [О
(2CH3),
48.8
(2CH2CH3),
48.9
(2CH2C≡C),
54.1
(CH2)2], 71.0 (≡C), 77.6 (≡C), 89.8 (≡CH), 92.7 (≡C),
119.4, 123.1, 131.2 (2CH), 133.5 (2CH). Найдено, %:
(ОCH2), 71.4 (≡C), 78.2 (≡C), 88.9 (≡C), 91.9 (≡C),
119.5, 123.1, 131.2 (2CH), 133.4 (2CH). Найдено, %:
C 53.41; H 4.75; Br 20.51; N 3.84. C17H19BrClNO2.
Вычислено, %: C 53.06; H 4.94; Br 20.81; N 3.64.
C 55.46; H 5.36; Br 21.24; N 4.00. C17H21BrClNO.
Вычислено, %: C 55.06; H 5.67; Br 21.59; N 3.78.
Внутримолекулярное циклоприсоединение
солей 2а-с с последующей внутримолекулярной
Хлорид дипропил-4-гидроксибут-2-инил[3-(4-
рециклизацией циклических продуктов (oбщая
бромфенил)проп-2-инил]аммония
(2c). Выход
методика). К раствору 2.6 ммоль соли 2а-с в
0.96 г (80%), белые кристаллы, т.пл. 139-140°C
0.6 мл воды прибавляли 0.2 мл 3н раствора КОН
(абс. EtOH). ИК спектр, ν, см-1: 3330-3100, 1040
(молярное соотношение соль:основание,
5:1).
(группа ОН), 3050, 1590 (ароматическое кольцо),
Саморазогревание не наблюдалось. К раствору
2230 (двузамещенная ацетиленовая связь), 820 (п-
ступенчато прибавляли двукратное мольное
замещенное бензольное кольцо). Спектр ЯМР 1Н,
количество КОН на моль исходной соли.
δ, м.д.: 1.04 т (6Н, J 7.2 Гц, CH3), 1.78-1.92 м (4Н,
Температура реакционной смеси от
30°С
CH2CH3), 3.51-3.58 м (4Н, NCH2C2H5), 4.16 уш.т
саморазогреванием поднялась до 70-75°С и сразу в
(2H, J 1.8, OCH2), 4.57 уш.т (2H, J 1.8 Гц, CH2C≡C),
реакционной колбе наблюдалось образование слоя
4.84 с (2H, CH2C≡CAr), 5.58 ш.с (1H, OH), 7.50-
аминного продукта. Для обеспечения полноты
7.58 м (4H, C6H4). Найдено, %: C 57.55; H 6.05; Br
рециклизации смесь в течение
15-20 мин
20.35; N 3.23. C19H25BrClNO. Вычислено, %: C
нагревали до 60-65°С. Затем смесь экстрагировали
57.21; H 6.27; Br 20.07; N 3.51.
эфир:метиленхлоридом в объемном соотношении
Хлорид
4-гидроксибут-2-инил[3-(4-бром-
1:1 (3×25 мл) и выделяли продукты рециклизации -
фенил)проп-2-инил]пиперидиния (2d). Выход 1 г
амины 4а-с. Экстракт промывали водой, высушили
(87%), белые кристаллы, т.пл.
163-165°C (абс.
над сульфатом магния. После упаривания
EtOH). ИК спектр, ν, см-1: 3340-3100, 1040 (группа
растворителя амины 4а-с из остатка выделяли
ОН), 3030, 1600, 1570 (ароматическое кольцо),
вакуумной перегонкой.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
570
ЧУХАДЖЯН и др.
4-Диметиламинометил-8-бром-1,3-дигидро-
Внутримолекулярное циклоприсоединение
нафто[1,2-с]фуран (4а). Выход 0.4 г (50%), т.кип.
солей
2d, e (общая методика). К раствору
163°C
(1 мм рт.ст.), т.пл.
72-74°C (гексан),
2.6 ммоль соли 2d, e в 0.6 мл воды при 25°С
кристаллизуется при комнатной температуре, т.пл.
прибавляли 0.2 мл 3н раствора КОН (молярное
пикрата 192-193°C (абс. EtOH), т.пл. хлоргидрата
соотношение соль:основание,
5:1). В течение
214-216°C (абс. EtOH). ИК спектр, ν, см-1: 3060,
10 мин саморазогревание не наблюдалось.
3040, 1580 (ароматическое кольцо), 1080,
1040
Реакционную смесь выдерживали при 45-50°C в
(группа -CH2-О-CH2-), 870, 820 (1,2,4- и пентазаме-
течение
10-15 мин, после чего температура
щенное бензольное кольцо). Спектр ЯМР 1Н, δ,
реакционной смеси саморазогреванием поднялась
м.д.: 2.23 с (6Н, CH3), 3.48 с (2Н, NCH2), 5.23 т (2H,
до
80-85°C. Остывшую смесь экстрагировали
J 2.9 Гц, ОCH2), 5.35 т (2H, J 2.9 Гц, ОCH2), 7.51 д.д
эфир:метиленхлоридом в объемном соотношении
(1H, J 8.7, 1.9 Гц, =CH, C6H3), 7.62 с (1H, =CH),
1:1
(2×20 мл). В экстракте титрованием
0.1н
7.74 д (1H, J 8.7, 1.9 Гц, =CH, C6H3), 7.77 д (1H, J
раствором H2SO4 обнаружили продукты
8.7 Гц, =CH, C6H3). Спектр ЯМР 13C, δ, м.д.: 44.8
рециклизации 4d, е с выходом 10-13%, кристаллы
(CH3), 62.0 (NCH2), 72.1 (ОCH2), 73.3 (ОCH2), 119.4
которых не давали депрессии т.пл. с кристаллами
(CH), 125.4 (CH), 126.5 (CH), 127.4 (CH), 128.2
аминов 4d, е, полученных при рециклизаци солей
(CH),
129.5 (CH),
131.2,
131.7,
133.8,
137.4.
3d, e в водно-щелочной среде при комнатной
Найдено, %: C 58.49 ; H 5.03; Br 26.45; N 4.85.
температуре. После экстракции аминов 4d, e из
C15H16BrNO. Вычислено, %: C 58.82; H 5.23; Br
реакционной смеси фильтрованием выделяли
26.14; N, 4.57.
циклические соли 3d, e.
4-Диэтиламинометил-8-бром-1,3-дигидро-
Хлорид
2,2-пентаметилен-4-гидроксиметил-
нафто[1,2-с]фуран (4b). Выход 0.7 г (82%), т.кип.
6-бромбензо[f]изоиндолиния
(3d). Выход 0.6 г
180°C (1 мм рт.ст.), т.пл. пикрата 181-183°C (абс.
(60%), белые кристаллы, т.пл. 283-285°C (H2O).
EtOH). ИК спектр, ν, см-1: 3040, 1600 (аромати-
ИК спектр, ν, см-1: 3450-3200, 1080, 1050, (группа
ческое кольцо), 1060, 1030 (группа -CH2-О-CH2-),
ОН), 3080, 1580 (ароматическое кольцо), 890, 805
870,
830
(1,2,4- и пентазамещенное бензольное
(1,2,4- и пентазамещенное бензольное кольцо). Спектр
кольцо). Спектр ЯМР 1Н, δ, м.д.: 1.03 т (6Н, J
ЯМР 1Н, δ, м.д.: 1.59-1.69 м (2Н, CH2), 1.83-1.99 м
7.1 Гц, CH3), 2.49 к (4Н, J 7.1 Гц, CH2CH3), 3.60 с
(4Н, CH2), 3.59 т [4Н, J 5.6 Гц, N(CH2)2], 4.93 д (2Н,
(2Н, NCH2), 5.23-5.25 м (2H, ОCH2), 5.32-5.35 м
J 5.6 Гц, ОCH2), 5.04 уш.с (2H, NCH2), 5.22 уш.с
(2H, ОCH2), 7.50 д.д (1H, J 8.7, 2.0 Гц, =CH,
(2H, NCH2), 5.71 т (H, J 5.6 Гц, ОH), 7.70 д.д (1H, J
C6H3),7.60 уш.с (1H, =CH), 7.73 д (1H, J 2.0 Гц,
8.7, 1.9 Гц, =CH, C6H3), 7.92 уш.с (1H, =CH), 7.96 д
=CH, C6H3), 7.75 д (1H, J 8.7 Гц, =CH, C6H3).
(1H, J 8.7 Гц,=CH, C6H3), 8.37 д (1H, J 1.9 Гц, =CH,
Найдено, %: C 61.45; H 5.77; Br 23.62; N 4.44.
C6H3). Спектр ЯМР 13C, δ, м.д.: 20.6 (CH2), 20.7
C17H20BrNO. Вычислено, %: C 61.08; H 5.99; Br
(2CH2), 57.9 (ОCH2), 60.0 [N(CH2)2], 65.4 (NCH2),
23.95; N 4.19.
66.0 (NCH2), 120.2, 122.0 (CH), 126.5 (CH), 129.3
(CH), 130.6 (CH), 130.9, 131.8,131.9, 132.3, 132.5.
4-Дипропиламинометил-8-бром-1,3-дигид-
Найдено, %: C 56.13; H 5.28; Br 21.22; N 3.91.
ронафто[1,2-с]фуран (4с). Выход 0.58 г (62%),
C18H21BrClNO. Вычислено, %: C 56.47; H 5.49; Br
медообразное вещество, т.кип. 207°C (1 мм рт.ст.),
20.91; N 3.66.
т.пл. пикрата 193-195°C (абс. EtOH). ИК спектр, ν,
см-1: 3040, 1580 (ароматическое кольцо), 1060,
Хлорид спиро[4-гидроксиметил-6-бромбензо-
1040 (группа
-CH2-О-CH2-),
880,
820
(1,2,4- и
[f]изоиндолин]-2,4'-морфолиния
(3е). Выход
пентазамещенное бензольное кольцо). Спектр ЯМР
0.62 г (62%), белые кристаллы, т.пл. 205-207°C
1Н, δ, м.д.: 0.84 т (6Н, J 7.4 Гц, CH3), 1.40-1.53 м
(H2O). ИК спектр, ν, см-1: 3500-3200, 1070, 1050
(4Н, CH2CH3), 2.33-2.38 м [4Н, N(CH2)2], 3.59 д
(группа ОН),
3080,
3060,
1600 (ароматическое
(2Н, J 0.7 Гц, NCH2), 5.23 т (2H, J 3.0 Гц, ОCH2),
кольцо), 870, 820 (1,2,4- и пентазамещенное бен-
5.34 т (2H, J 3.0, ОCH2), 7.50 д.д (1H, J 8.7, 2.0 Гц,
зольное кольцо). Спектр ЯМР 1Н, δ, м.д.: 3.68 т
=CH, C6H3), 7.61 уш.с (1H, =CH), 7.74 д (1H, J
[4Н, J 4.7 Гц, О(CH2)2], 3.98-4.09 м [4Н, N(CH2)2],
2.0 Гц, =CH, C6H3), 7.76 д (1H, J 8.7 Гц, =CH, C6H3).
4.95 д (2Н, J 5.5 Гц, ОCH2), 5.16 уш.с (2H, NCH2),
Найдено, %: C 62.63; H 6.43; Br 22.41; N 4.12.
5.33 уш.с (2H, NCH2), 5.61 т (1H, J 5.5 Гц, ОH), 7.72
C19H24BrNO. Вычислено, %: C 62.98; H 6.63; Br
д.д (1H, J 8.7, 1.9 Гц, =CH, C6H3), 7.95 уш.с (1H,
22.10; N 3.87.
=CH), 7.98 д (1H, J 8.7 Гц, =CH, C6H3), 8.38 д (1H, J
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
КАТАЛИЗИРУЕМОЕ ОСНОВАНИЕМ ВНУТРИМОЛЕКУЛЯРНОЕ ЦИКЛОПРИСОЕДИНЕНИЕ
571
1.9 Гц, =CH, C6H3). Спектр ЯМР 13C, δ, м.д.: 57.9
8.7 Гц, =CH, C6H3). Спектр ЯМР 13C, δ, м.д.: 53.0
(ОCH2), 58.8 [N(CH2)2], 61.4 [О(CH2)2], 65.7 (NCH2),
[N(CH2)2], 61.2 (NCH2), 66.0 [О(CH2)2], 72.1 (ОCH2),
66.1 (NCH2), 120.2, 122.1 (CH), 126.5 (CH), 129.4
73.4 (ОCH2), 119.4, 125.4 (CH), 126.8 (CH), 127.4
(CH), 130.5, 130.6 (CH), 131.3, 131.9, 132.3, 132.7.
(CH), 128.3 (2CH), 129.5 (CH), 130.7, 130.9, 134.0,
Найдено, %: C 53.41; H 4.73; Br 20.50; N 3.89.
137.4. Найдено, %: C 58.95; H 5.37; Br 22.68; N
C17H19BrClNO2. Вычислено, %: C 53.06; H 4.94; Br
3.77. C17H18BrNO2. Вычислено, %: C 58.62; H 5.17;
20.81; N 3.64.
Br 22.99; N 4.02.
Рециклизация солей 3d, e (общая методика). К
КОНФЛИКТ ИНТЕРЕСОВ
раствору
1.3 ммоль соли
3d, e прибавляли
двукратное мольное количество КОН на моль соли.
Авторы заявляют об отсутствии конфликта
В течение 10-15 мин при комнатной температуре
интересов.
выделяли амины рециклизации
4d, e в
кристаллическом виде. Для обеспечения полноты
СПИСОК ЛИТЕРАТУРЫ
реакции смесь в течение 10-15 мин нагревали до
55-65°C. Экстрагированием смесью эфир:метилен-
1. Hafner K. Angew. Chem. 1963, 76, 1041. doi 10.1002/
хлорид в объемном соотношении 1:1 (2×30 мл)
ange.19630752202
выделяли амины 4d, e. Экстракт промывали водой,
2. Dimroth O. Ann.
1909,
364,
183. doi
10.1002/
высушивали MgSO4. После отгонки растворителя
jlac.19093640204
получили кристаллы аминов 4d, e.
3. Boulton J.A., Katrizky A.R., Majid-Hamid A. J. Chem.
4-Пентаметиленаминометил-8-бром-1,3-ди-
Soc. (C). 1967, 2005. doi 10.1039/J39670002005
гидронафто[1,2-с]фуран (4d). Выход 0.25 г (55%),
4. Dewar M.J.S. J. Am. Chem. Soc. 1974, 96, 6148. doi
10.1021/ja00826a030
т.пл. 68-69°C (гексан), т.пл. пикрата 200°C (абс.
EtOH), т.пл. хлоргидрата 220°C (абс. эфир). ИК
5. Kost A.N., Sagitullin R.S., Gromov S.P. Heterocycles.
1977, 7, 997. doi 10.3987/S-1977-02-0997
спектр, ν, см-1: 3060, 3030, 1580 (ароматическое
6. Литвинов В.П. Усп. Хим. 1999, 68, 45. [Litvinov B.P.
кольцо), 1040, 1080 (группа -CH2-О-CH2-), 870, 830
Russ. Chem. Rev.,
1998,
68,
39.] doi
10.1070/
(1,2,4- и пентазамещенное бензольное кольцо).
RC1999v068n01ABEH000273
Спектр ЯМР 1Н, δ, м.д.: 1.40-1.50 м (2Н, CH2),
7. Абаев В.Т. Трушков И.В., Учускин М.Г. ХГС. 2016,
1.50-1.61 м (4Н, CH2), 2.32-2.42 м [4Н, N(CH2)2],
52, 973. [Abaev V.T., Trushkov I.V., Uchuskin M.G.
3.51 уш.с (2Н, NCH2), 5.25 т (2H, J 3.0 Гц, ОCH2),
Chem. Heterocycl. Compd. 2016, 52, 973.] doi 10.1007/
5.34 т (2H, J 3.0 Гц, ОCH2), 7.51 д.д (1H, J 8.7,
s10593-017-1996-x
1.9 Гц, =CH, C6H3), 7.59 уш.с (1H, =CH), 7.75 д (1H,
8. Voskressensky L.G., Kulikova L.N., Kleimenov A., Gura-
J 1.9 Гц, =CH, C6H3), 7.77 д (1H, J 8.7 Гц, =CH,
nova N.I., Borisova T.N., Varlamov A.V. Tetrahedron Lett.
C6H3). Спектр ЯМР 13C, δ, м.д.: 23.8 (CH2), 25.5
2009, 50, 4851. doi 10.1016/j.tetlet.2009.06.036
(2CH2), 53.9 [N(CH2)2], 61.6 (NCH2), 72.1 (ОCH2),
9. Varlamov A.V., Guranova N.I., Borisova T.N., Toze
73.5 (ОCH2), 119.3, 125.4 (CH), 126.5 (CH), 127.3
Flavien A.A., Ovcharov M.V., Kristancho S.,
(CH), 128.2 (2CH), 129.5 (CH), 131.0, 131.8, 133.8,
Voskressensky L.G. Tetrahedron, 2015, 71, 1175. doi
137.5. Найдено, %: C 62.78; H 5.98; Br 22.82; N
10.1016/j.tet.2015.01.022
3.80. C18H20BrNO. Вычислено, %: C 62.43; H 5.78;
10. Chukhajian E.O., Gevorkyan H.R., Chukhajian El.O.,
Br 23.12; N 4.05.
Shahkhatuni K.G., Panosyan H.A., Tamazyan R.A.
J. Heterocycl. Chem. 2003, 40, 1059. doi 10.1002/
4-Морфолинометил-8-бром-1,3-дигидронафто-
jhet.5570400614
[1,2-c]фуран (4е). Выход 0.26 г (58%), т.пл. 143-
11. Хачатрян А.А. ХГС. 2011, 47, 1328. [Khachatryan A.A.
145°C (гексан), т.пл. пикрата 194°C (абс. EtOH).
Chem. Heterocycl. Compd.
2011,
47,
1091.] doi
ИК спектр, ν, см-1: 3050, 1580 (ароматическое
10.1007/s10593-011-0879-9
кольцо), 1060, 1030 (группа -CH2-О-CH2-), 880, 830
12. Чухаджян Э.О., Хачатрян А.А., Геворкян А.Р.,
(1,2,4- и пентазамещенное бензольное кольцо).
Паносян Г.А. ХГС. 2007, 43, 834. [Chukhajian E.O.,
Спектр ЯМР 1Н, δ, м.д.: 2.35-2.45 м [4Н, N(CH2)2],
Khachatryan A.A., Gevorkyan A.R., Panosyan G.A.
3.57 с (2Н, NCH2), 3.55-3.65 м [4Н, О(CH2)2], 5.27 т
Chem. Heterocycl. Compd. 2007, 43, 701.] doi 10.1007/
(2H, J 3.1 Гц, ОCH2), 5.36 т (2H, J 3.1 Гц, ОCH2),
s10593-007-0114-x
7.52 д.д (1H, J 8.7, 1.9 Гц, =CH, C6H3), 7.63 с (1H,
13. Чухаджян Э.О., Айрапетян Л.В., Чухаджян Эл.О.,
=CH), 7.76 д (1H, J 1.9 Гц, =CH, C6H3), 7.79 д (1H, J
Паносян Г.А. ХГС. 2010, 46, 187. [Chukhadzhyan E.O.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
572
ЧУХАДЖЯН и др.
Ayrapetyan L.V., Chukhadzhyan,El.O., Panosyan G.A.
Shahkhatuni K.G., Mkrtchyan А.S., Panosyan G.А.
Chem. Heterocycl. Compd. 2010, 46, 151.] doi 10.1007/
Russ. J. Org. Chem. 2018, 54, 1156.] doi 10.1134/
s10593-010-0486-1
S1070428018080067
14. Чухаджян Э.О., Геворкян А.Р., Хачатрян А.А.,
17. Dupont G., Dulou R., Lefebvre G. Bull. Soc. Chim. Fr.
Чухаджян Эл.О., Паносян Г.А. ХГС. 2006, 42, 1329.
1954, 6, 816.
[Chukhadzhyan E.O., Gevorkyan H.R., Khachatryan A.A.,
18. Чухаджян Э.О., Геворкян А.Р., Чухаджян Эл.О.,
Chukhadzhyan El.O., Panosyan G.A. Chem. Heterocycl.
Киноян Ф.С. ЖОрХ. 2005, 41, 369. [Chukhadzhyan E.O.,
Compd. 2006, 42, 1151.] doi 10.1007/s10593-006-0219-7
Gevorkyan A.R., Chukhadzhyan El.O., Kinoyan F.S.
15. Чухаджян Э.О., Геворкян А.Р., Шахатуни К.Г.,
Russ. J. Org. Chem. 2005, 41, 358.] doi 10.1007/
Чухаджян Эл.О., Айрапетян Л.В., Хачатрян А.А.
s11178-005-0170-6
ЖОрХ.
2018,
54,
519.
[Chukhadzhyan E.O.,
19. Chukhajian E.O., Nalbandyan M.K., Gevorkyan H.R.,
Gevorgyan H.R., Shahkhatuni K.G., Chukhad-
Chukhajian El.O., Panosyan H.A., Ayvazyan A.G.,
zhyan El.O., Ayrapetyan L.V., Khachatryan A.A. Russ.
Tamazyan R.A. J. Heterocycl.Chem. 2008, 45, 687. doi
J. Org. Chem.
2018,
54,
517.] doi
10.1134/
10.1002/jhet.5570450309
S1070428018040012
20. Атомян А.В., Чуркина Н.П., Кислина И.С.,
16. Чухаджян Э.О., Геворкян А.Р., Айрапетян Л.В.,
Винник М.И. Изв. АН СССР Х.Н. 1981, 30, 525.
Чухаджян Эл.О., Шахатуни К.Г., Мкртчян А.С.,
[Atomyan A.V., Churkina N.P., Kislina I.S., Vinnik M.I.
Паносян Г.А. ЖОрХ. 2018, 54, 1147. [Chukhadzhian E.О.,
Bull. Acad. Sci. USSR, Div. Chem. Sci. 1981, 30, 371.]
Gevorgyan H.R., Ayrapetyan L.V., Chukhadzhian El.О.,
doi 10.1007/BF00949577
Base Catalyzed Intramolecular Cycloaddition of Dialkyl-4-
hydroxybut-2-ynyl[3-(4-bromophenyl)prop-2-ynyl]ammonuim
Chlorides and Recyclization of Obtained Products
E. O. Chukhajiana, H. R. Gevorgyana, c, *, K. G. Shahkhatunia,
El. O. Chukhajiana, and H. A. Panosyanb
a Institute of Organic Chemistry, Scientific and Technological Center of Organic and Pharmaceutical Chemistry,
NAS, Republic of Armenia, 0014, Armenia, Yerevan, pr. Azatutyana 26
*e-mail: hasmikgevorgyan973@gmail.com
b Molecular Structure Research Center, Scientific and Technological Center of Organic and Pharmaceutical Chemistry,
NAS, Republic of Armenia, 0014, Armenia, Yerevan, pr. Azatutyana 26
c National Polytechnic University of Armenia, 0009, Armenia, Yerevan, ul. Teryana 105
Received October 17, 2018
Revised October 28, 2018
Accepted December 14, 2018
Dialkyl-4-hydroxybut-2-ynyl[3-(4-bromophenyl)prop-2-ynyl]ammonium chlorides in the presence of two- fold
molar amount of potassium hydroxide at room temperature with self-heating undergo intramolecular
cycloaddition followed by intramolecular recyclization of cyclic products. Piperidinium and morpholinium salts,
like other 4-hydroxybut-2-ynyl analogs, with pre-heating to 45-50°C for 10-15 minutes in the presence of
0.2 mol alkali per mole of the initial salt undergo intramolecular cycloaddition with self-heating. Under these
conditions recyclization of cyclic products also takes place in 10-13% yields. 2,2-pentamethylene-4-hydroxy-
methyl-6-bromobenzo[f]isoindolinium and spiro[4-hydroxymethyl-6-bromobenzo[f]isoindoline]-2,4'-morpholinium
chlorides under the influence of double molar amount of KOH at room temperature within 10-15 min undergo
intramolecular recyclization with forming of -8-bromo-1,3-dihydronaphtho[1,2-c]furans.
Keywords: intramolecular cycloaddition, intramolecular recyclization, dialkyl-4-hydroxybut-2-ynyl[3-(4-
bromophenyl)prop-2-ynyl]ammonium chlorides,
2,2-dialkyl-4-hydroxymethyl-6-bromobenzo[f]isoindoline
chlorides, 2,2-pentamethylene-4-hydroxymethyl-6-bromobenzo[f]isoindoline chloride, spiro[4-hydroxymethyl-
6-bromobenzo[f]isoindoline]-2,4'-morpholinium chloride, dialkylaminomethyl-8-bromo-1,3-dihydronaphto[1,2-
c]furans
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019