ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 4, с. 583-590
УДК 547.853.7
СИНТЕЗ АМИДОВ 10,10-ДИОКСОФЕНОКСАТИИН-
2,8-ДИКАРБОНОВОЙ КИСЛОТЫ
© 2019 г. Ж. В. Игнатович, А. Л. Ермолинская, В. К. Ольховик,
Ю. В. Матвеенко, Е. В. Королева*
ГНУ «Институт химии новых материалов НАН Беларуси», 220141, Беларусь, г. Минск, ул. Ф.Скорины 36
*e-mail: evk@ichnm.basnet.by
Поступила в редакцию 7 ноября 2018 г.
После доработки 11 ноября 2018 г.
Принята к публикации 28 декабря 2018 г.
Новые амиды и сульфамиды
10,10-диоксофеноксатиин-2,8-дикарбоновой кислоты, содержащие
фрагменты алкил- и гетероциклических аминов, синтезированы на основе производных
2-арил-
аминопиримидинов, N-метилпиперазина, морфолина и
4-нитро-10,10-диоксо-10λ6-феноксатиин-2,8-
дикарбоновой кислоты. Феноксатииндикарбоновая кислота получена путем внутримолекулярной
циклизации
4-[4-карбокси-2-(хлорсульфонил)окси]-3-нитробензойной кислоты под действием
хлорсульфоновой кислоты. Обсуждается реакционноспособность хлорангидридов
10,10-
диоксофеноксатиин-2,8-дикарбоновой кислоты в реакции ацилирования аминов.
Ключевые слова: амид, сульфамид,
2-ариламинопиримидин, N-метилпиперазин, морфолин,
феноксатииндикарбоновая кислота.
DOI: 10.1134/S0514749219040128
Достижения современной фармакологии во
ариламинопиримидиновый амид пиперазинил-
многом определяются синтезом биологически
бензойной кислоты, на основе которого был
активных органических соединений, на основе
разработан один из первых представителей нового
которых создаются новые лекарства. Аминный
класса противоопухолевых препаратов иматиниб [1].
фрагмент является ключевым элементом
Из-за возникающей на поздних стадиях
структуры и во многом определяет биологическое
химиотерапии устойчивости к лекарственному
действие использующихся в лекарственной
веществу, обусловленной мутацией киназ, особое
терапии природных и синтетических производных
внимание уделяется созданию противоопухолевых
аминов. Среди многообразия азотсодержащих
препаратов с мультикиназным профилем
гетероциклических соединений значительный
активности. Воздействуя на более чем одно звено
интерес представляют производные пиримидина.
цепи опухолевого процесса, в том числе на
Обнаруженная у соединений пиримидинового ряда
мутированные ферменты, они могут обеспечить
способность блокировать процессы канцерогенеза
большую эффективность лечения. Дизайн
путем ингибирования протеинкиназ - ферментов,
химической структуры, в которой путем
катализирующих продуцирование опухолевых
комбинации фрагментов известных соединений с
клеток, обусловила постоянный интерес к
разными видами фармакологической активности
развитию методов синтеза данного класса
может быть реализован специфический профиль
соединений и определяет практическую важность
селективности, в настоящее время является
этого направления исследований. Производные 2-
неотъемлемым звеном цепи разработки новых
ариаминопиримидина, обладающие антикиназной
биологически активных соединений [1, 2].
активностью, являются действующими веществами
наиболее востребованных в лечебной практике
Одними из самых востребованных в качестве
эффективных лекарственных препаратов, с
действующих веществ фармацевтических
которыми связаны успехи химиотерапии онко-
препаратов являются амиды, широко представ-
логических заболеваний последних десятилетий.
ленные в арсенале современных лекарственных
Среди них ингибитор тирозинкиназы Bcr-Abl - 2-
средств. Настоящая работа посвящена синтезу
583
584
ИГНАТОВИЧ и др.
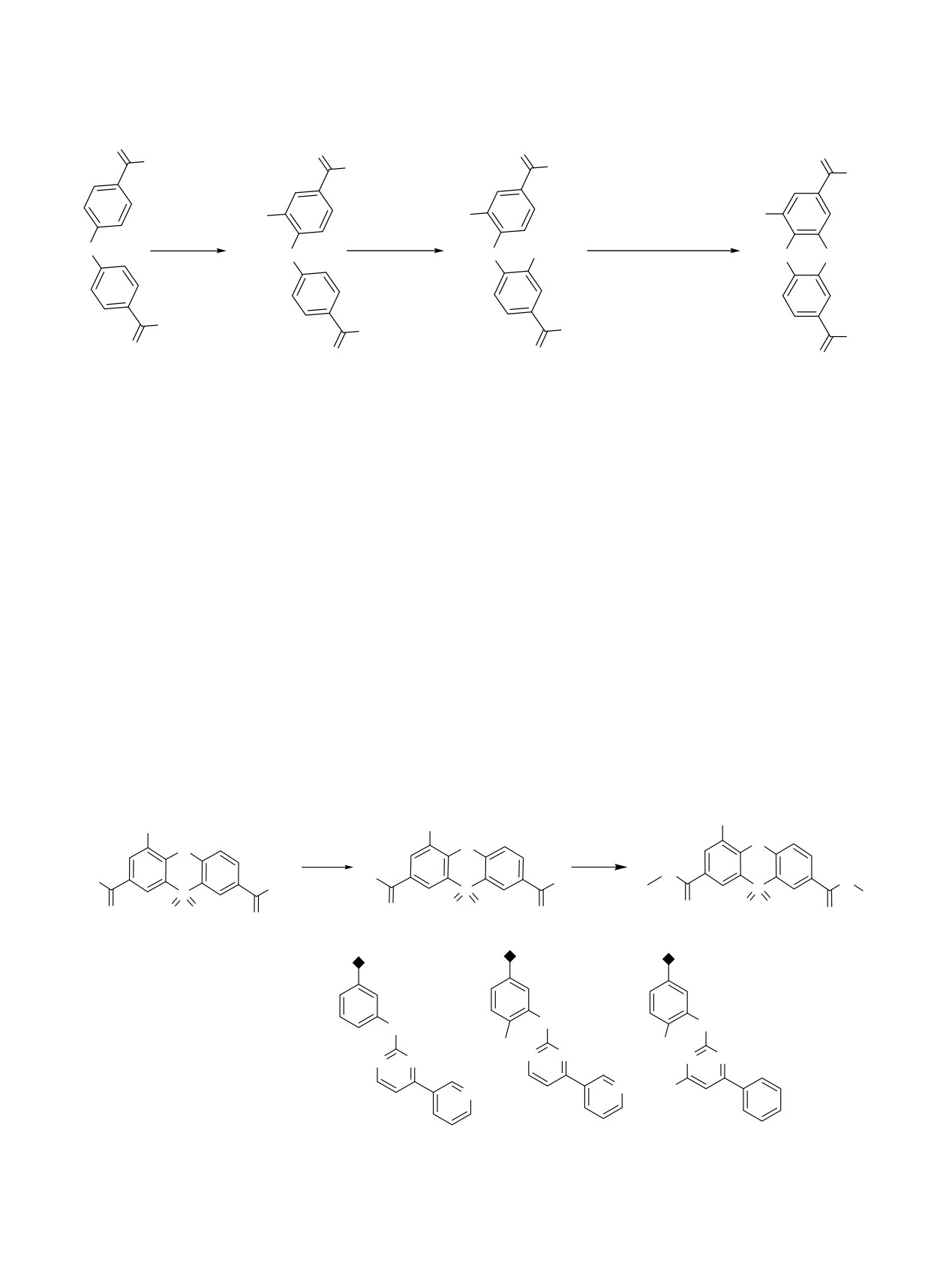
Схема 1.
O
O
O
O
OH
OH
OH
OH
ClO2S
O2N
O2N
HSO3Cl
HNO3/H2SO4
HSO3Cl или SO3/H2SO4
O
SO2Cl
O
O
O
SO2
OH
OH
OH
OH
O
O
O
O
2
3
4
1
новых амидов и сульфамидов на основе 4-нитро- и
(хлорсульфонил)окси]-3-нитробензойной кислоты
4-сульфонил-10,10-диоксофеноксатиин-2,8-дикар-
4 под действием хлорсульфоновой кислоты или
боновых кислот.
олеума при температуре 120-130°С [8] (cхема 1).
В ряду производных феноксатиина найдены
Наиболее используемыми синтетическими
соединения с инсектицидным, антибактериальным
предшественниками амидной связи являются
действием, селективные ингибиторы ферментов
алкиловые сложные эфиры, ангидриды (хлоран-
[3-7]. С учетом этих данных синтез новых
гидриды), активированные эфиры карбоновых
производных феноксатиина, содержащих амидный
кислот. Ацилирование аминов хлорангидридами
фрагмент и остатки гетероциклических аминов,
кислот является стандартной реакцией образования
представляется актуальной и перспективной
амидной связи. Получение амидов из метиловых
задачей.
(алкиловых) эфиров кислот является одним из
Исходную
4-нитро-10,10-диоксо-10λ6-фенокса-
самых простых способов, однако, в случае
тиин-2,8-дикарбоновую кислоту
1 получали по
использованных в работе ароматических или
описанной нами ранее методике из коммерчески
гетероциклических аминов
(3-морфолинпропил-
доступной
4,4'-оксидибензойной кислоты
2,
амин,
1-метилпиперазин, замещенный
2-арил-
формируя феноксатииновый гетероцикл путем
аминопиримидин) целевые соединения получить
внутримолекулярной циклизации 4-[4-карбокси-2-
не удалось.
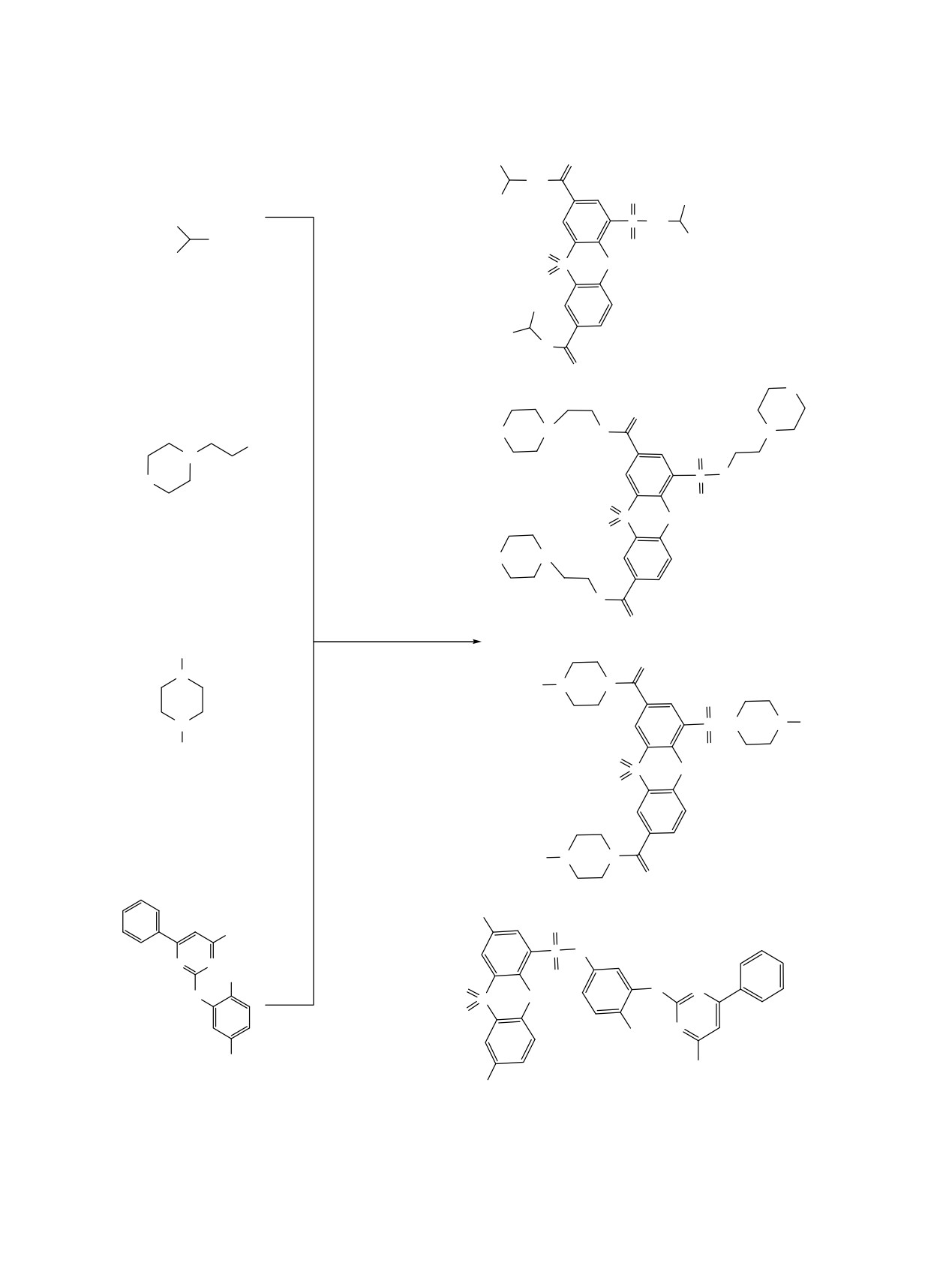
Схема 2.
NO2
NO2
NO2
RNH2
O
O
O
SOCl
2
6_8
H
N
H
HO
Cl
Cl
N
OH
S
R
S
S
R
O
O
O
O O
O
O O
O
O
O
O
1
5
9_11
1
1
1
NH
NH
NH
H3C
H3C
R =
N N
N N
N N
N
H3C
N
6, 9
7, 10
8, 11
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
СИНТЕЗ АМИДОВ 10,10-ДИОКСОФЕНОКСАТИИН-2,8-ДИКАРБОНОВОЙ КИСЛОТЫ
585
Схема 3.
SO2Cl
Et2N
SO2
O
Et2NH, THP
O
O
O
S
Et2N
NEt2
SO2Cl
SOCl2
O2
S
Cl
Cl
O2
O
O
O
12
15, 51%
O
O
S
O
2
OH
OH
13
1) MeOH, NEt3, 40oC
2) NaCl
HSOCl3
SO3Na
O
2
O
O
S
O
2
OMe
OMe
14
Синтез новых арил(гетарил)замещенных амидов
трихлорангидридом 12 получены соответствующие
9-11, содержащих в структуре феноксатииновый
триамиды: N2,N8-диизопропил-3-(N-изопропилсуль-
фрагмент, осуществлен путем ацилирования
фамоил)-10,10-феноксатиин-2,8-дикарбоксамид-
арилпиримидиновых аминов
6-8 дихлорангид-
10,10-диоксид (19), N2,N8-бис(2-морфолиноэтил)-3-
ридом
5
4-нитро-10,10-диоксо-10λ6-феноксатиин-
(N-(2-морфолиноэтил)-сульфамид-10,10-фенокса-
2,8-дикарбоновой кислоты
1. Соответствующие
тиин-2,8-дикарбоновой кислоты (20), {3-[(4-метил-
амиды 9-11 получены с выходами 45-50% (cхема 2).
пиперазин-1-ил)сульфонил]-10,10-диоксофенокса-
тин-2,8-диил}бис[(4-метилпиперазин-1-ил)мета-
С целью синтеза новых пиримидиновых амидов
нон] (21) (cхема 4).
нами также исследована реакция ацилирования
аминов 6, 16-18 трихлорангидридом 12 4-хлор-
В реакции ацилирования пиримидиновых
сульфонил-10,10-диоксофеноксатиин-2,8-дикарбо-
аминов хлорангидридные группы соединения 12
новой кислоты
13. Кислоту
13 получали по
были инертны, вследствие чего в реакции аци-
разработанному ранее методу нагреванием 4,4'-
лирования амина 6 выделен только сульфамид 22.
оксидибензойной кислоты 2 с хлорсульфоновой
Строение синтезированных амидов подтверж-
кислотой [8].
дено данными элементного анализа, спектров ЯМР
Различие в ацилирующей способности
1Н и 13С, ИК и масс-спектров. Наличием пика
хлорангидридных и сульфонилхлоридных групп
молекулярного иона [M]+ (Iотн, 2-39%) в масс-
соединения 12 проявилось в реакциях со спиртами
спектрах подтвержден брутто-состав продуктов. В
и аминами. Ранее при взаимодействии
ИК спектрах амидов присутствуют полосы
сульфохлорида 13 с первичными и вторичными
валентных колебаний групп NH в области 3380-
аминами был выделен только растворимый в воде
3460 см-1, связи С=О амидного фрагмента в
продукт - соответствующая сульфокислота, а в
интервале
1670-1686 см-1 и полосы дефор-
реакции с метанолом в присутствии триэтиламина
мационных колебаний связанной с ней группы NH
получен диэфир сульфокислоты 14, выделенный в
в области 1580-1583см-1.
виде натриевой соли. Ацилирование диэтиламина
В спектрах ЯМР 1Н сигналы атомов водорода
трихлорангидридом
12, полученным реакцией
групп NH проявляются в виде синглетов в области
сульфохлорида 13 с тионилхлоридом, проходило с
6.10-8.8 м.д. (NH), в области 8.60-10.90 м.д. (HN-
образованием триамида 15 [8] (cхема 3).
C=O, HN-SO2). Протоны ароматических протонов
Ацилированием диизопропиламина 16, 2-мор-
феноксатиинового, арильного и пиримидинового
фолиноэтан-1-амина 17 и 1-метилпиперазина
18
циклов дают сигналы в области 6.20-9.80 м.д.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
586
ИГНАТОВИЧ и др.
Схема 4.
H3C
O
NH
O
CH3
H3C
CH3
S
NH
NH2
CH3
O
O
CH3
S
O
O
16
CH3
H3C
HN
O
19
O
O
O
N
HN
N
NH
2
O
N
S
NH
O
O
O
S
O
17
O
O
N
HN
12, диоксан, 30_40oС
O
20
H
O
N
H3C
N
N
O
N
S N
N
CH3
CH3
O
O
S
O
18
O
H3C
N
N
O
21
HO2C
O
3
CH
S
NH
N
N
CH
3
O
H
O
N N
HN
S
O
O
N
CH3
NH2
CH3
6
HO2C
22
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
СИНТЕЗ АМИДОВ 10,10-ДИОКСОФЕНОКСАТИИН-2,8-ДИКАРБОНОВОЙ КИСЛОТЫ
587
Спектры соединений 10, 11, 19, 21, 22 содержат
перемешивали в течение 1 ч, выливали на лед,
также один или два синглета протонов метильных
выпавший осадок отфильтровывали, промывали
групп в области 2.24-2.26 м.д. В спектрах ЯМР 13С
водой и высушивали в эксикаторе над СаСl2.
сигнал в области
165.00-161.00 м.д., отсутст-
Выход 2.67 г (79%) белый порошок, т.пл. > 224°С
вующий в dept-спектре, подтверждает наличие
(разл.). ИК спектр (KBr), ν, см-1: 1703 (С=О), 1597
карбонильной группы. В области 16.0-21.0 м.д.
(C-Cаром), 1539 (N-O), 1485 (C-Cаром), 1423, 1378
находятся сигналы атомов углерода метильных
(SO2Cl), 1262 (Ar-O-Ar), 1183. Спектр ЯМР 1Н
заместителей.
(500 МГц, DMSO-d6), δ, м.д. (J, Гц): 6.87 д (1Н, J
8.5, Hаром), 7.20 д (1Н, J 8.5, Hаром), 7.98 д.д (1Н, J
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
8.5, 2.0, Hаром), 8.08 д (1Н, J 8.5, 2.0, Hаром), 8.42 д
(1Н, J
2.0, Hаром),
8.44 д
(1Н, J
2.0, Hаром).
В работе использовали 4,4'-оксидибензойную
Спектр ЯМР 13С (DMSO-d6), δ, м.д.: 120.55, 122.86,
кислоту (ОДБК) производства
«Chemicalpoint»
125.64,
126.86,
128.19,
131.20,
132.69,
135.62,
Германия; хлорсульфоновую кислоту фирмы «Sigma-
140.29, 140.72, 140.77, 154.69, 165.87, 166.90. Масс-
Aldrich». Для нитрования использовалась азотная
спектр, m/z (Iотн, %): 382 [M - Н]- (сульфокислота).
кислота (56%) с содержанием HNO3 12.484 ммоль/мл.
Найдено, %: С 41.58; Н 2.09; N 3.48; S 8.16.
Контроль за протеканием реакций и чистотой
C14H8ClNO9S. Вычислено, %: С 41.86; Н 2.01; N
синтезированных соединений осуществляли
3.49; S 7.98.
методом ТСХ на пластинах Merck Cromatofolios
AL TLC 20×20 см Silica gel 60 F254, элюент этанол
4-Нитро-10,10-диоксо-10,λ6-феноксатиин-2,8-
либо системы этанол-этилацетат или толуол-
дикарбоновая кислота
(1). Смешивали 1.00 г
этилацетат от 5:1 до 1:5, проявление УФ светом с
(2.50 ммоль) нитропроизводного 4, 30 мл (20%
частотой 365 нм. Cпектры ЯМР 1Н и 13С записаны
SO3) олеума (или 30 мл HSO3Cl). Смесь нагревали
на спектрометре Bruker Аvance-500 в DMSO-d6,
при 120°С в течение 2 ч (или при 150°С в течение
CDCl3, D2SO4 внутренний стандарт - ТМС, рабочая
4 ч) и выливали на лед, выпавший осадок
частота 500 МГц для 1Н и 125 МГц для 13С.
отфильтровывали, промывали Н2О до нейтральной
Константы спин-спинового взаимодействия
среды и высушивали в эксикаторе над CaCl2.
приведены в герцах (Гц), значения химических
Выход
0.72 г
(79%), белый кристаллический
сдвигов приведены в миллионных долях (м.д.) по
порошок, т.пл. 321-323°С. ИК спектр (KBr), ν, см-1:
шкале δ от ТМС (0 м.д.), ДМСО (2.50 м.д.), CDCl3
1710 (С=О),
1602 (C-Cаром),
1544 (N-O),
1308
(7.26 м.д.), в ЯМР 1Н и от DMSO (39.43 м.д.) - в
(S=O), 1272 (Ar-O-Ar), 1161. Спектр ЯМР 1Н (500
спектрах ЯМР
13С. Запись масс-спектров
МГц, DMSO-d6), δ, м.д. (J, Гц): 7.79 д (1Н, J 9.0,
соединений производились на приборах Accela-
Н6), 8.35 д.д (1Н, J 9.0, 1.5, Н7), 8.50 д (1Н, J 1.5,
LCQ Fleet (в режиме ионизации APCI или ESI) и
Hаром), 8.68 д (1Н, J 1.5, Hаром), 8.82 д (1Н, J 1.5,
Hewlett-Packard HP
6850/5973. ИК спектры
Hаром). Спектр ЯМР 13С (DMSO-d6), δ, м.д.: 120.55,
получены на ИК Фурье спектрометре фирмы
124.05,
124.15,
126.52,
126.63,
127.97,
129.26,
«Bruker Tensor 27» (в таблетках KBr) в диапазоне
130.58,
135.98,
139.07,
146.68,
152.84,
163.67,
4000-400 см-1. Температуру плавления измеряли
164.81. Масс-спектр, m/z (Iотн, %): 364 [M - Н]-.
на блоке Кофлера с электронным термометром
Найдено, %: С 41.58; Н 2.09; N 3.48; S 8.16.
Hanna HI 93530. Элементный анализ выполняли на
C14H8ClNO9S. Вычислено, %: С 41.86; Н 2.01; N
элементном анализаторе «Vario Micro».
3.49; S 7.98.
Синтез замещенных 2-фениламинопиримидинов
10,10-Диоксо-4-нитро-10λ6-феноксатиин-2,8-
6-8 описан в работе [9].
дикарбонил]дихлорид (5) и [4-хлорсульфонил-
4-[4-Карбокси-2-(хлорсульфонил)окси]-3-
10,10-диоксо-10-λ6-феноксатиин-2,8-дикарбонил]
нитробензойная кислота
(4). Смесь
3.00 г
дихлорид (12). Смесь 1.00 г 4-нитро- 1 или 4-
(8.40 ммоль) сульфохлорида 3 [8] и 35 мл H2SO4
хлорсульфонил-
13
10,10-диоксо-10λ6-феноксати-
перемешивали при комнатной температуре до
ин-2,8-дикарбоновой кислоты,
30 мл SOСl2 и
полного растворения, охлаждали до
0°С и
2 капли ДМФА перемешивали при 75°С в течение
прикапывали нитрующую смесь (5 мл конц. Н2SO4
1.5 ч до полного растворения кислоты. Затем
и 0.7 мл 56% НNO3) при температуре реакционной
упаривали SOCl2 на роторном испарителе,
среды не выше
2°С. Реакционную смесь
полученный осадок промывали гексаном
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
588
ИГНАТОВИЧ и др.
(2×10 мл). Выход
55-60%. Соединение
5. ИК
(С=О), 1580, 1532, 1450, 1406, 1310, 1260, 1200,
спектр (KBr), ν, см-1: 1758 (C=O), 1540 (NO2), 1376
1163. Спектр ЯМР 1Н (ДMСO-d6), δ, м.д. (J, Гц):
(SO2Cl), 1319 (S=O), 1214 (Ar-O-Ar), 1170. Спектр
2.21 с (3Н), 2.24 д (3Н, J 4.5), 6.85 д.д (1Н, J 8.0,
ЯМР 1Н (500 МГц, DMSO-d6), δ, м.д. (J, Гц): 7.85 д
1.8), 7.20 д (1Н, J 8.1), 7.25 т (1Н, J 8.8), 7.46-7.47 м
(1Н, J 9.0, Н6), 8.54 д (1Н, J 2.6, Hаром), 8.66 д (1Н, J
(3Н), 7.51-7.57 м (3Н), 7.84 д (1Н, J 8.8), 8.45 ш.с
2.6, Hаром), 8.77 д.д (1Н, J 9.0, 2.6, Н7), 8.84 д (1Н, J
(1Н), 8.52-8.47 м (3Н), 8.53 м (2Н), 8.68 д (1Н, J
2.6, Hаром). Соединение 12. ИК спектр (KBr), ν, см-1:
4.5), 8.70 д (1Н, J 3.3), 8.82 д (1Н, J 2.1), 8.97 с (1Н),
1758 (C=O), 1376 (SO2Cl), 1319 (S=O), 1214 (Ar-O-
9.02 д (1Н, J 4.3), 9.05 д (1Н, J 2.2), 9.08 д (1Н, J
Ar), 1170. Спектр ЯМР 1Н (500 МГц, DMSO-d6), δ,
2.1), 9.27 д (1Н, J 1.7), 9.29 с (1Н), 10.63 с (1Н),
м.д. (J, Гц): 7.67 д (1Н, J 9.0, Н6), 8.37 д.д (1Н, J 9.0,
10.80 с (1Н). Спектр ЯМР 13С (ДMСO-d6), δ, м.д.:
2.5, Н7), 8.44 д (1Н, J 2.5, Hаром), 8.48 д (1Н, J 2.5,
17.20, 108.12, 108.17, 108.47, 116.75, 116.80, 117.40,
Hаром), 8.64 д (1Н, J 2.5, Hаром). Масс-спектр, m/z
117.81,
124.37,
124.47,
130.66,
131.49,
130.74,
(Iотн, %): 455.9 [M - Н]-. Найдено, %: С 36.85; Н
132.63,
132.73,
135.11,
138.39,
139.05,
146.44,
1.15; Cl 23.43; O 24.55; S 14.15. C14H5Cl3O7S2. Вы-
148.53,
151.73,
151.80,
152.58,
159.97,
161.33,
числено, %: С 36.90; Н 1.11; Сl 23.34; O 24.58; S 14.07.
161.61, 162.07, 162.12. Масс-спектр, m/z (Iотн, %):
883.2 [M - Н]-. Найдено, %: C 62.59; H 3.70; N
Общая методика получения амидов фенокса-
17.39; O 12.71; S 3.71 С46Н33N11О7S. Вычислено, %:
тиин-2,8-дикарбоновой кислоты 9-11, 19-22. К
C 62.51; H 3.76; N 17.43; O 12.67; S 3.63.
1.8 ммоль амина 6-8 и 16-18 в 8 мл диоксана в
течение 30 мин прибавляли 0.5 ммоль дихлорангид-
N2,N8-Бис{4-метил-3-[(4-метил-6-фенилпири-
рида 5 или 12. Реакционную смесь перемешивали при
мидин-2-ил)амино]фенил}-4-нитро-10,10-диоксо-
комнатной температуре в течение 5 часов. Образо-
феноксатиин-2,8-дикарбоксиамид
(11). Выход
вавшийся осадок ярко-оранжевого цвета отфильт-
70%, кристаллы желтого цвета, т.пл. 210-212°С.
ровывали, промывали этилацетатом и высушивали.
ИК спектр (KBr), ν, см-1: 3420, 2613, 1685 (С=О),
4-Нитро-N2,N8-бис{3-[(4-(пиридин-3-ил)пири-
1579, 1530, 1467, 1412, 1314, 1265, 1210,
1150.
Спектр ЯМР 1Н (ДMСO-d6), δ, м.д. (J, Гц): 2.26 с
мидин-2-ил)амино]фенил}-10,10-диоксофенокса-
тиин-2,8-дикарбоксиамид
(9).
Выход
79%
(6Н), 2.43 с (6Н), 7.25 т (2Н, J 1.8), 7.37 с (2Н), 7.48
кристаллы желтого цвета, т.пл. 186-188°С. ИК
м (9Н), 8.12 м (1Н), 8.15 м (4Н), 8.26 с (2Н), 8.49 д.д
(1Н, J 8.7, 1.8), 8.82 д (1Н, J 1.8), 9.04 ш.с (1Н), 9.08
спектр (KBr), ν, см-1: 3387, 3265, 2600, 1686 (С=О),
1579, 1540, 1489, 1449, 1305, 1265, 1190. Спектр
с (2Н), 10.69 с (1Н), 10.87 с (1Н). Спектр ЯМР 13С
ЯМР 1Н (ДMСO-d6), δ, м.д. (J, Гц): 6.19 д (1Н, J
(ДMСO-d6), δ, м.д.: 17.36, 23.10, 22.75, 107.53,
108.05,
117.41,
118.62,
120.67,
123.16,
124.49,
7.2), 6.90 с (1Н), 6.92 м (2Н), 7.04 c (1Н), 7.33 c
(2H), 7.40 д (1Н, J 5.1), 7.51-7.49 м (2Н), 7.54 м
126.90,
127.61,
127.72,
128.29,
129.37,
130.36,
(2Н), 8.48-8.47 м (2Н), 8.52 д (1Н, J 5.1), 8.60-8.59
130.65,
130.72,
131.53,
131.71,
133.30,
135.53,
136.91,
137.19,
138.21,
139.35,
146.44,
152.58,
м (4Н), 8.69 м (2Н), 9.29 д (1Н, J 1.9), 9.36 д (2Н, J
2.2), 9.40 с (1Н), 9.83 с (1Н), 9.85 с (1Н), 10.65 с
161.25, 162.77, 164.01, 167.21. Масс-спектр, m/z
(1Н), 10.81 с (1Н). Спектр ЯМР 13С (ДMСO-d6), δ,
(Iотн, %): 881.2 [M - Н]-. Найдено, %: C 65.40; H
м.д.: 104.57, 107.15, 107.31, 107.79, 107.89, 111.44,
3.98; N
14.31; O
12.71; S
3.71 С48Н35N9О7S.
114.06,
119.80,
123.54,
128.28,
128.36,
131.77,
Вычислено, %: C 65.37; H 4.00; N 14.29; O 12.70; S
131.89,
134.28,
134.72,
140.33,
140.49,
147.78,
3.64.
147.86,
147.94,
148.44,
151.02,
151.12,
158.84,
N2,N8-Диизопропил-3-(N-изопропилсульфа-
159.03, 159.81, 159.96, 161.09, 161.25. Масс-спектр,
мидо)-10,10-феноксатиин-2,8-дикарбоксамид
m/z (Iотн, %): 855.2 (24) [M]+. Найдено, %: C 61.64;
10,10-диоксид
(19).
Выход
45%, кристаллы
H 3.48; N 18.10; O 13.12; S 3.71 С44Н29N11О7S.
желтого цвета, т.пл. 193-194°С. ИК спектр (KBr),
Вычислено, %: C 61.75; H 3.42; N 18.00; O 13.09; S
ν, см-1: 3383, 2975, 1644 (С=О), 1596, 1450, 1443,
3.75.
1368, 1262, 1158, 1137, 1066, 1014. Спектр ЯМР 1Н
N2,N8-Бис{4-метил-3-[(4-пиридин-3-ил)пири-
(ДMСO-d6), δ, м.д. (J, Гц): 0.98 д (6Н, J 6.5), 1.19
мидин-2-ил]аминофенил}-4-нитро-10,10-диоксо-
два д (12Н, J 6.7), 3.40 септ. (1Н, J 6.5), 4.14 два
феноксатиин-2,8-дикарбоксамид
(10).
Выход
септ. (2Н, J 6.7), 7.48 с (1Н), 8.18 д (1Н, J 7.7), 8.28
68%, кристаллы желтого цвета, т.пл. 180-182°С.
с (1Н), 8.38 д (1Н, J 2.2), 8.40 д (1Н, J 2.1), 8.66 д
ИК спектр (KBr), ν, см-1: 3425, 3041, 2613, 1680
(1Н, J 2.2), 8.70 д (1Н, J 7.7), 8.73 д (1Н, J 2.2), 8.89
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
СИНТЕЗ АМИДОВ 10,10-ДИОКСОФЕНОКСАТИИН-2,8-ДИКАРБОНОВОЙ КИСЛОТЫ
589
д (1Н, J 2.2), 8.90 д (1Н, J 7.7). Спектр ЯМР 13С
диоксофеноксатиин-2,8-дикарбоновая кислота
(ДMСO-d6), δ, м.д.: 21.77 (СН3), 21.83 (СН3), 22.89
(22). Для выделения продукта ацилирования
(СН3), 41.08 (СН), 41.29 (СН), 45.07 (СН), 119.89
реакционную смесь упаривали, к остатку
(СН), 121.53 (СН), 123.59 (СН), 125.26 (СН), 125.61
приливали 10 мл насыщенного раствора до рН 9,
(СН), 130.66, 131.02, 132.08, 133.47, 134.15, 148.51,
перемешивали в течение 1 ч и отфильтровывали
151.54, 161.12, 162.04. Масс-спектр, m/z (Iотн, %):
выпавший осадок продукта. Полученный твердый
568.1 [M - Н]-. Найдено, %: C 48.50; H 4.98; N 9.80;
осадок сульфамида кристаллизовали из смеси
O 25.29; S 11.25 С23Н28N4О9S2. Вычислено, %: C
тетрагидрофуран-диэтиловый эфир. Выход 57%,
48.58; H 4.96; N 9.85; O 25.32; S 11.28.
кристаллы желтого цвета, т.пл. 200-201°С. ИК
спектр (KBr), ν, см-1: 3422, 3060, 1664, 1581, 1534,
N2,N8-Бис(2-морфолиноэтил)-3-(N-2-морфо-
1485, 1446, 1416, 1379, 1348, 1320, 1250, 1200,
линоэтил)сульфамид-10,10-диоксофеноксатиин-
1158. Cпектр ЯМР 1Н (ДMСO-d6), δ, м.д. (J, Гц):
2,8-дикарбоновой кислоты
(20). Выход
21%,
2.24 с (3Н), 2.39 с (3Н), 7.23 д.д. (1Н, J 8.4, 1.7 ),
кристаллы белого цвета, т.пл.
140-142°С. ИК
7.27 с (1Н), 7.47 м (5Н), 8.12 д.т (2Н, J 5.1, 2.1 ),
спектр (KBr), ν, см-1: 3471, 3080, 2953, 1649 (С=О),
8.21 с (1Н), 8.76 д.д (2Н, J 5.5, 2.4), 10.59 с (1Н,
1599, 1546, 1444, 1314, 1266, 1209, 1116,
1068.
HNCO), 10.70 с (1Н, HNCO). Cпектр ЯМР 13С
Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 2.30 м (4Н),
(ДMСO-d6), δ, м.д.:
17.36,
23.46,
106.42 (СН),
2.47 т (2Н, J 4.7), 2.60 м (8Н), 2.71 кв (4Н), 3.17 т
116.03 (СН), 116.53 (СН), 119.62 (СН), 122.60 (СН),
(2Н, J 4.7), 3.45 м (4Н), 3.65-3.66 м (4Н), 3.77-3.79
122.14, 123.81, 124.52, 126.37 (СН), 127.06, 128.25
м (8Н), 7.46 т (1Н, J 1.9), 7.62 д (1Н, J 8.7), 8.18 д.д
(СН), 129.61 (СН), 130.12 (СН), 130.57 (СН), 131.71
(2Н, J 8.7, 1.9), 8.42 д (1Н, J 1.9), 7.31 т (2Н, J 1.9),
(СН), 132.39 (СН), 134.36 (СН), 136.26, 136.30,
8.65 д (1Н, J 2.0), 8.68 д (1Н, J 2.0). Спектр ЯМР
136.47,
137.86,149.25,
152.43,
160.45,
162.09,
13С (CDCl3), δ, м.д.: 36.21 (СН2), 39.10 (СН2), 36.35
162.13, 162.98, 168.18. Масс-спектр, m/z (Iотн, %):
(СН2), 52.69 (СН2), 53.07 (СН2), 55.96 (СН2), 56.56
717.1 [M - Н]-. Найдено, %: C 53.57; H 3.29; N 9.81;
(СН2), 56.61 (СН2), 66.39 (СН2), 66.53 (СН2), 119.21
O 24.55; S 8.89 С32Н23N5О11S2. Вычислено, %: C
(СН), 122.29 (СН), 124.54 (СН), 126.25 (СН), 126.68
53.55; H 3.23; N 9.76; O 24.52; S 8.94.
(СН), 129.84, 131.55, 132.73, 133.25, 133.71, 149.37,
152.12, 163.21, 163.99. Масс-спектр, m/z (Iотн, %):
КОНФЛИКТ ИНТЕРЕСОВ
781.2 [M - Н]-. Найдено, %: C 49.20; H 5.49; N
12.59; O 24.61; S 8.25 С32Н43N7О12S2. Вычислено,
Авторы заявляют об отсутствии конфликта
%: C 49.16; H 5.54; N 12.54; O 24.56; S 8.20.
интересов.
{3-[(4-Метилпиперазин-1-ил)сульфонил]-
10,10-диоксофеноксатин-2,8-диил}бис[(4-
СПИСОК ЛИТЕРАТУРЫ
метилпиперазин-1-ил)метанон] (21). Выход 70%
1. Королева Е.В., Игнатович Ж.И., Синютич Ю.В.,
кристаллы желтого цвета, т.пл. 245-246°С. ИК
Гусак К.Н. ЖОрХ. 2016, 52, 159. [Koroleva E.V.,
спектр (KBr), ν, см-1: 3425, 2956, 1640 (С=О), 1580,
Ignatovich Zh.I., SinyutichYu.V., Gusak K.N. Russ.
1432, 1311, 1265, 1156,
1102. Cпектр ЯМР 1Н
J. Org. Chem.
2016,
52,
139.] doi
10.1134/
(ДMСO-d6), δ, м.д. (J, Гц): 2.48-2.52 м (8Н). 2.75-
S1070428016020019
2.76 м (16Н), 7.62 д (1Н, J 8.7), 7.99 д.д (1Н, J 8.7,
2. Huggins D.J., Sherman W., Tidor B. J. Med. Chem.
1.9), 8.20 д (1Н, J 1.9), 8.30 д (1Н, J 2.2), 8.57 д (1Н,
2012, 55, 1424. doi 10.1021/jm2010332
J 1.9). Cпектр ЯМР 13С (ДMСO-d6), δ, м.д.: 41.66
3. Aly A.A., Wasfy A.A.F. Indian J. Chem. 2004, 43B, 629.
(СН3), 48.93 (СН3), 49.81 (СН2), 51.17 (СН2), 51.24
4. Aly A.A., Wasfy A.A.F. Chem. Papers. 2004, 58, 126.
(СН2), 51.52 (СН2), 119.59 (СН), 121.84,
121.94
5. Supuran C.T., Scozzafava A., Briganti F., Loloiu G,
(СН), 123.90, 125.83, 127.11, 127.44 (СН), 131.82,
Maior O. Eur. J. Med. Chem. 1998, 33, 821.
132.99 (СН), 134.02 (СН), 148.16, 150.39, 165.02,
6. Behalo M.S. J. Sulfur Chem. 2010, 31, 287. doi
166.10. Масс-спектр, m/z (Iотн, %): 691.2 [M - Н]-.
10.1080/17415993.2010.497537
Найдено, %: C 50.31; H 5.45; N 14.24, О 20.79, S
7. Harfenist M., McGee D.P.C., Reeves M.D., and
9.25 С29Н37N7О9S2. Вычислено, %: C 50.35; H 5.39;
White H.L. J. Med. Chem. 1998, 41, 2118. doi 10.1021/
N 14.17, О 20.82; S 9.27.
jm970862j
3-{N-[4-Метил-3-[(4-метил-6-фенилпирими-
8. Ященко В. С., Пап А. А., Калечиц Г.В., Макей А.В.,
дин-2-ил)амино]фенил]сульфамидо}-10,10-
Ольховик В.К. ХГС. 2014, 50, 1596. [Yashchenko V.S.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
590
ИГНАТОВИЧ и др.
Pap A.A., Kalechits G.V., Makey A.V., Ol’khovik V.K.
9. Королева Е.В., Игнатович Ж.В., Ермолинская А.Л.,
Chem. Heterocycl. Compd.
2015.
50,
1471.] doi
Синютич Ю.В., Барановский А.В., Махнач С.А. Изв.
10.1007/s10593-014-1612-2
НАН Беларуси, Cер. хим. наук. 2013, 79.
Synthesis of Amides of 10,10-Dioxofenoxathiine-2,8-dicarboxylic
Acid
Zh. V. Ignatovich, A. L. Ermolinskaya, V. K. Olhovik, Yu. V. Matveenko, and E. V. Koroleva*
Institute of Chemistry of New Materials, NAS of Belarus, 220141, Republic of Belarus, Minsk, ul. F. Skoriny 36
*e-mail: evk@ichnm.basnet.by
Received November 7, 2018
Revised November 11, 2018
Accepted December 28, 2018
New amides and sulfonylamides of 10,10-dioxofenoxathiine-2,8-dicarboxylic acid, containing fragments of
alkyl- and heterocyclic amines, were synthesized on the basis of derivatives of 2-arylaminopyrimidines, N-
methylpiperazine, morpholine and и 4-nitro-10,10-dioxo-10λ6-fenoxathiine-2,8-dicarboxylic acid. Fenoxathiine-
2,8-dicarboxylic acid was obtained by intramolecular cyclization
4-[4-carboxy-2-(clorosulfonyl)oxy]-3-
nitrobenzoic acid under the action of chlorosulfonic acid. The reactivity of 10,10-dioxofenoxathiin-2,8-
dicarboxylic acid chlorides in the amine acylation reaction is discussed.
Keywords: amide, sulfamide, 2-arylaminopyrimidine, N-methylpiperazine, morpholine, phenoxathiindicar-
boxylic acid
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019