ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 4, с. 635-644
УДК 547.314 + 547.326 + 547.451 + 547.512
ФУНКЦИОНАЛИЗИРОВАННЫЕ 2-ЗАМЕЩЕННЫЕ
АЛЛИЛБРОМИДЫ В РЕАКЦИЯХ АЛЛИЛИРОВАНИЯ ПО
БАРБЬЕ (R)-2,3-О-ИЗОПРОПИЛИДЕНГЛИЦЕРАЛЬДЕГИДА.
ПРИМЕНЕНИЕ В СИНТЕЗЕ С8-С17, С8-С18 И С5-С17
СТРОИТЕЛЬНЫХ БЛОКОВ ЛАУЛИМАЛИДОВ И ИХ
СИНТЕТИЧЕСКИХ АНАЛОГОВ
© 2019 г. И. В. Минеева*
Белорусский государственный университет, 220047, Республика Беларусь, г. Минск, пр. Независимости 4
*e-mail: i.mineyeva@yandex.ru
Поступила в редакцию 18 ноября 2018 г.
После доработки 15 февраля 2019 г.
Принята к публикации 17 февраля 2019 г.
На основании циклопропанольных интермедиатов осуществлен синтез нескольких новых 2-замещенных
аллилбромидов, вовлеченных в реакцию аллилирования по Барбье (R)-2,3-О-изопропилиденглицераль-
дегида при действии цинка в среде тетрагидрофурана и насыщенного водного раствора хлорида
аммония. Продемонстрированы возможности применения полученных таким образом с высокой
диастереоселективностью гомоаллиловых спиртов в синтезе строительных блоков макроциклических
противоопухолевых препаратов лаулималидов и их синтетических аналогов.
Ключевые слова:
2-замещенные аллилбромиды, реакция Барбье, (R)-2,3-О-изопропилиденгли-
церальдегид, сульфонаты циклопропанолов, диастереоселективное аллилирование, гомоаллиловый
спирт, лаулималид.
DOI: 10.1134/S0514749219040207
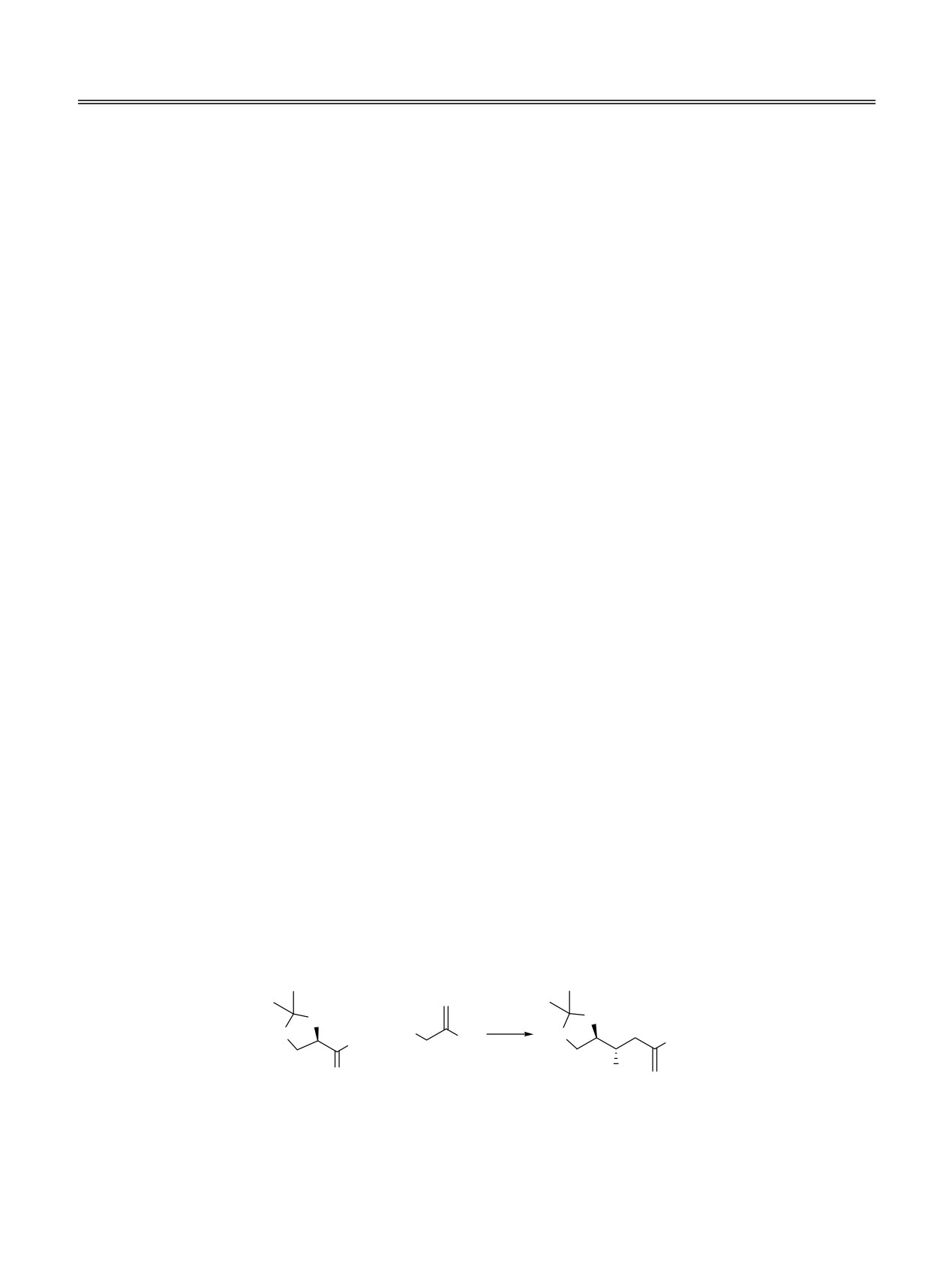
Реакция аллилирования по Барбье позволяет
преобладанию анти- диастереомера относительно
получать гомоаллиловые спирты из карбонильных
гидроксильных групп [1-3].
соединений и аллилгалогенидов (чаще бромидов и
иодидов) в мягких условиях, в водно органической
Так, (R)-2,3-О-изопропилиденглицеральдегид
среде в присутствии активного металла цинка,
(1) (схема 1) по данным литературы эффективно
магния, индия, самария и других [1-3]. В общем
аллилировался незамещенным аллилбромидом как
случае реакция дает рацемический продукт с
при действии самого цинка [1-9], активированного
аллильной перегруппировкой [1-3]. Применение α-
дибромидом цинка [10-12], хлоридом олова [13],
гидроксизамещенных альдегидов в реакции
диаллилцинка [14, 15], магния [16-22], индия [23-
аллилирования при действии цинка приводит к
28], и значительно реже титана, хрома
[29],
Схема 1.
O
O
O
+
X
O
H
R
R
O
OH
1
2_10
11_19
X = Cl, Br, I.
635
636
МИНЕЕВА
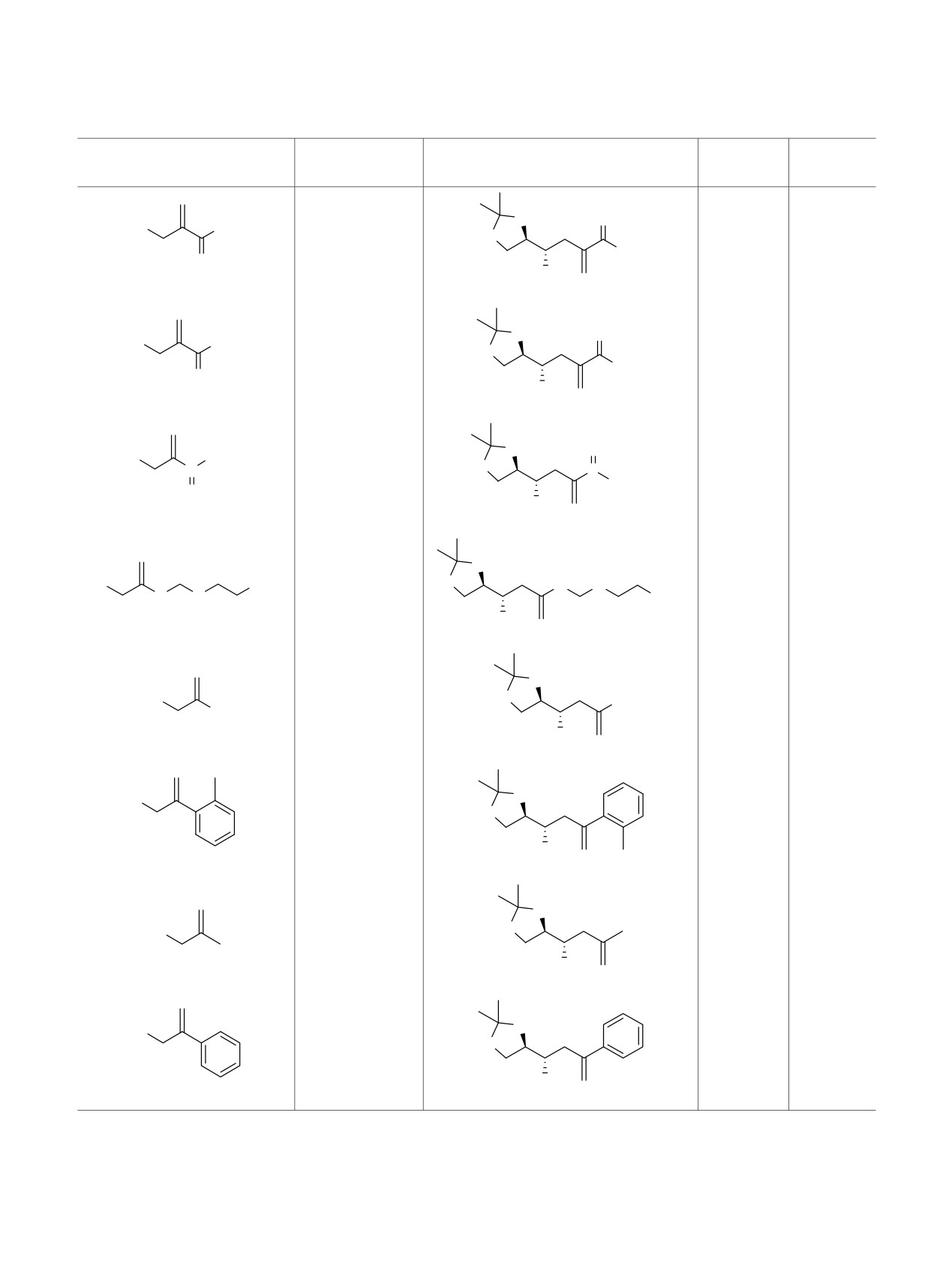
Таблица 1. Аллилирование альдегида 1 2-замещенными аллилгалогенидами.
2-Замещенный
Условия
dr
Продукт реакции
Выход, %
аллилгалогенид
реакции
анти/син
O
O
Br
OEt
Zn, ТГФ, NH4Cl,
O
63
2.8/1
H2O, 0°C [41]
OEt
O
OH
2
11
O
O
Br
OMe
Zn, ТГФ, NH4Cl,
O
78
2.5/1
H2O, к.т. [40]
OMe
O
OH
3
12
Zn-Ag,
O
O
Br
(OEt)2
графитовая
O
P
P
85
-а
поверхность,
(OEt)2
O
ТГФ, -78°С [39]
OH
4
13
O
In, ДМФА,
Br
O
O
O
OMe TBAI, 25°С,
78
5/1
O O
OMe
MS4Å, [43]
5
OH
14
O
Cl
In, ДМФА,
O
Cl
92
7/1
Cl
TBAI, к.т. [42]
6
OH
15
O
I
In, ДМФА, H
2O,
O
40
3/1
к.т. [43]
OH
7
16
O
Zn, SnCl2, H2O,
O
Br
84
5/1
к.т. [13]
8
OH
17
O
Br
Zn, SnCl
2, H2O,
O
78
13/1
к.т. [13]
OH
9
18
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
ФУНКЦИОНАЛИЗИРОВАННЫЕ 2-ЗАМЕЩЕННЫЕ АЛЛИЛБРОМИДЫ
637
Таблица 1. (продолжение)
2-Замещенный
dr
Условия реакции
Продукт реакции
Выход, %
аллилгалогенид
анти/син
Cl
O
Br
Zn, SnCl2, H2O, к.т.
O
81
9/1
[13]
Cl
OH
10
19
а Нет литературных данных.
марганца
[30], диаллилсамария
[31]. Описано
не нашли широкого синтетического применения в
также взаимодействие альдегида 1 с пренилбро-
направленном синтезе природных и биоактивных
мидом [32-34] и с (2Е)-4-бром-1,1,1-трифторбут-2-
соединений.
еном [35-38] при действии менее доступного и
Целью данной работы стал синтез функцио-
более дорогого индия.
нализированных
2-замещенных аллилбромидов,
Примеров аллилирования альдегида 1 2-заме-
вовлечение их в реакцию аллилирования по Барбье
щенными функционализированными аллилброми-
(схема 1) с альдегидом 1 и применение получен-
дами ничтожно мало [13, 39-43] (схема 1), они
ных таким образом хиральных гомоаллиловых
отличаются средним выходом и малой диастерео-
спиртов в синтезе биоактивных природных
селективностью (табл. 1), а полученные продукты
соединений.
Схема 2.
MeO O
OEt O
O
[47_49]
[48, 49]
[49]
Br
EtO
OEt
4 стадии
OMe
3 стадии
2 стадии
O
O
45.6%
48%
OBn
74%
O
O
BnO
20
21
22
25
OH
OMs
OMs
OMs
Br
EtMgBr,
Ti(Oi-Pr)4
MsCl, Et3N
ППТС
AcCl, Py
MgBr2
O
O
ТГФ
Et2O
O
O
MeOH
CH2Cl2
Et2O
AcO
HO
AcO
91%
99%
87%
94%
92%
BnO
BnO
BnO
BnO
BnO
26
27
28
29
23
1. H2, Pd/C, MeOH
2. NaIO4, CH2Cl2
86%
OMs
OMs
Br
[50]
[50]
73%
НO
5 стадий
H
55%
O
O
MeO
O
O
30
31
24
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
638
МИНЕЕВА
Таблица 2. Результаты аллилирования альдегида 1 2-замещенными аллилбромидами 21, 23, 24.
2-Замещенный
Соотношение диастереомеров
Продукт реакции аллилирования
Выход, %
аллилбромид
анти/син
O
O
21
81
9/1
OH
O
OMe
32
O
O
OH
23
73
15/1
AcO
BnO
33
O
O
OH
24
70
15/1
O
O
34
Ранее
2-замещенные функционализированные
После длительного выдерживания в метаноль-
аллилбромиды были получены в нашей
ном растворе в присутствии триэтиламина и
исследовательской группе, используя катионную
постановки тетрагидропиранильной защиты лактон
циклопропилаллильную перегруппировку легко-
22 был превращен в эфир 25 [49] (схема 2). После
доступных сульфонатов циклопопанолов
[44].
стадии восстановительного циклопропанирования
Самые разнообразные по структуре 2-замещенные
эфира
25 и мезилирования полученного
аллилгалогениды, синтезированные с применением
функционализированого циклопропанола 26 был
данной перегруппировки, нашли свое применение
получен мезилат 27. После удаления лабильной
в направленном синтезе природных и биоактивных
тетрагидропиранильной защиты полученный спирт
соединений и их фрагментов [45, 46].
28 был превращен в ацетат
29 (схема
2),
вовлеченный в катионную циклопропил-
Исходя из этилового эфира 3,3-диэтоксипропио-
аллильную изомеризацию также под действием
новой кислоты 20 через ключевые циклопропа-
бромида магния с формированием нового не
нольные интермедиаты и катионную циклопропил-
описанного ранее в литературе
2-замещенного
аллильную перегруппировку
[47] был синтези-
аллилбромида 23.
рован аллилбромид
21
[47,
48]. Последующее
превращение в станнан
[48], аллилирование,
Мезилат 28 в свою очередь после удаления
диастереоселективное восстановление привело к
бензильной защиты был подвергнут окисли-
лактону
22
[49], на основе которого и были
тельному расщеплению с образованием альдегида
получены 2-замещенные функционализированные
30, который в реакции асимметрического
аллилбромиды 23, 24 (схема 2).
аллилирования по Кеку дал спирт
31, прев-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
ФУНКЦИОНАЛИЗИРОВАННЫЕ 2-ЗАМЕЩЕННЫЕ АЛЛИЛБРОМИДЫ
639
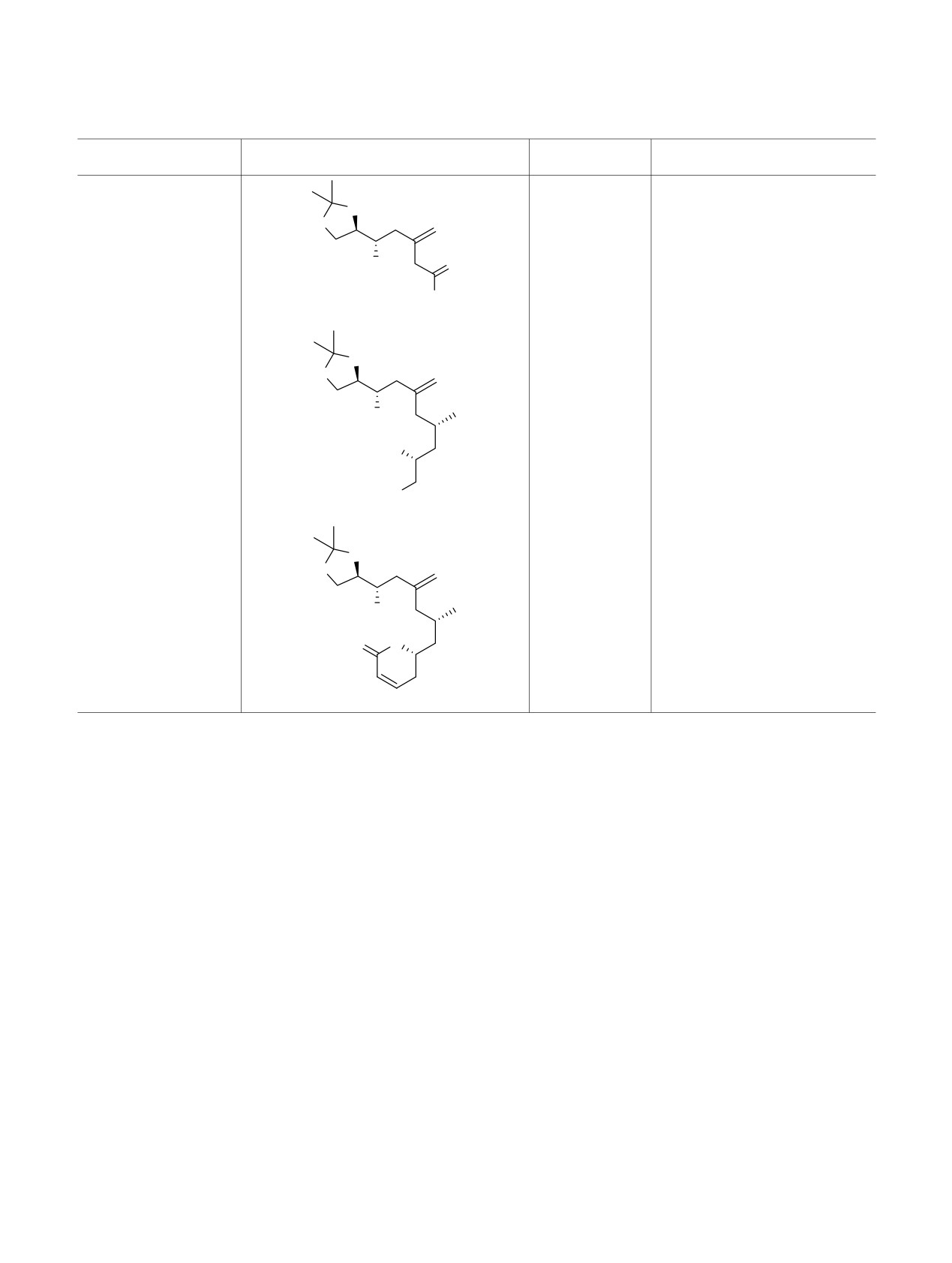
Схема 4.
O
16
EtO
16
17
18
15
13
EtO
15
17
13
O
OPiv
11
11
AcO
AcO
9
9
8
BnO
8
BnO
O
39
36
O
18 стадий
O
15
19 стадий
16
3.2%
O
15
17
5.2%
13
17
16
OH
13
11
OPiv
21 стадия
16 стадий
11
O
O
9
20
AcO
5
3.1%
7.0%
6
9
7
BnO
8
34
35
ращенный далее в аллилбромид
24, ранее
ческими свойствами [52]. Строительные блоки 33,
описанный как С5-С14 фрагмент лаулималидов [50].
35-39 различаются по своим функциональным
возможностям для дальнейшего наращивания
Далее синтезированный из доступного
углерод-углеродных связей и создания эпо-
природного D-маннита альдегид
1
[6,
7] был
ксидного цикла как за счет реакций внутримо-
введен в реакцию Барбье под действием избытка
лекулярного нуклеофильного замещения, так и
цинка, тетрагидрофурана и насыщенного водного
эпоксидирования кратной связи.
раствора хлорида аммония и соответствующих 2-
замещенных аллилбромидов
21,
23,
24 с
Таким образом, в данной работе были получены
преимущественным образованием анти-диастерео-
функционализированные 2-замещенные аллилбро-
меров гомоаллиловых спиртов 32-34 (табл.
2).
миды, показана возможность их вовлечения в
Соотношение диастереомерных спиртов опреде-
реакцию аллилирования при действии цинка в
лялось по интегральным интенсивностям сигналов
смеси тетрагидрофурана и насыщенного водного
протонов кратных связей в спектрах ЯМР 1Н.
раствора хлорида аммония, а также дальнейшее
применение продуктов аллилирования в направ-
Полученные соединения
32-34 потенциально
ленном синтезе. Основные результаты данной
могут найти свое применение в практике
исследовательской работы приведены на схеме 4.
органического синтеза. Так, спирт 33 после защиты
гидроксильной группы становится С8-С17
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
строительным блоком
35 макроциклических
противоопухолевых препаратов лаулималидов [51]
Спектры ЯМР 1H и 13С растворов соединений в
(схема
3). После удаления изопропилиденовой
дейтерохлороформе получены на приборе Bruker
защиты в эфире 35 и окислительной фрагментации
AC 400 с рабочими частотами 400 и 100 МГц
промежуточного диола и последующего
соответственно. ИК спектры в пленке записаны на
олефинирования был получен С8-С18 строительный
спектрофотометре Bruker Alpha (ATR). Элемен-
блок лаулималидов 36. Превращение соединения
тный анализ выполнен полумикрометодом. Хрома-
33 в триол 37, его окислительная фрагментация и
тографическое выделение индивидуальных веществ
последующее олефинирование дали хроматог-
осуществляли на силикагеле (70-230 меш). Все
рафически разделимую смесь соединений 38 и 39.
растворители перед использованием сушили
Соединение 38 может выступить в роли С8-С18
обычными методами и перегоняли.
строительного блока лаулималидов
[51], а
39
является фрагментом синтетического аналога,
Метил
(3R,5R)-6-(бензилокси)-3-метил-5-
обладающего ярко выраженными цитотокси-
(тетрагидро-2Н-пиран-2-илокси)гексаноат
(25).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
640
МИНЕЕВА
Получен по методике из работы [49], спектральные
пониженном давлении. Выход лабильного
характеристики совпали с приведенными в данной
альдегида 0.45 г (86%). Спектральные характе-
работе.
ристики совпали с приведенными в работе [50].
1-[(2R,4R)-5-(Бензилокси)-2-метил-4-(тетра-
Общая методика аллилирования альдегида 1
гидро-2Н-пиран-2-илокси)пентил]-цикло-
аллилбромидами
21,
23,
24. К интенсивно
пропанол (26). Получен по методике из работы
перемешиваемому раствору
0.67 г
(5.0 ммоль)
[53], спектральные характеристики совпали с
альдегида 1, 1.30 г (5.2 ммоль) аллилбромида 21
приведенными для энантиомера в данной работе.
или 1.85 г (5.2 ммоль) аллилбромида 23 или 1.37 г
(5.2 ммоль) аллилбромида 24 в 5 мл ТГФ внесли
1-[(2R,4R)-5-(Бензилокси)-2-метил-4-(тетра-
0.84 г (13.0 ммоль) Zn и добавили по каплям в
гидро-2Н-пиран-2-илокси)пентил]-циклопропил
течение 1 ч 15 мл насыщенного водного раствора
метансульфонат (27). Получен по методике из
NH4Cl. Затем реакционную смесь дополнительно
работы [53], спектральные характеристики совпали
выдержали при очень интенсивном перемешива-
с приведенными для энантиомера в данной работе.
нии ещё 1 ч. Продукт реакции проэкстрагировали
1-[(2R,4R)-5-(Бензилокси)-4-гидрокси-2-
Et2O (3×10 мл), объединенные эфирные вытяжки
метилпентил]циклопропил метансульфонат
промыли насыщенным водным раствором NaHCO3
(28). К раствору 0.54 г (1.1 ммоль) соединения 27 в
(30 мл) и осушили Na2SO4. Растворитель удалили
5 мл MeOH добавили 25 мг ППТС (0.1 ммоль) и
при пониженном давлении, продукт реакции
выдержали при комнатной температуре в течение
выделили хроматографированием (элюент
-
24 ч. После внесения нескольких капель Et3N и
петролейный эфир-этилацетат, 25:1).
отгонки растворителя при пониженном давлении,
продукт выделили хроматографированием (элюент -
Метил
3-{(2S)-2-[(4R)-2,2-диметил-1,3-
петролейный эфир-этилацетат, 3:1). Выход 0.33 г
диоксолан-4-ил]-2-гидроксиэтил}бут-3-еноат
(87%). Спектральные характеристики совпали с
(32). Выход 0.99 г (81%). ИК спектр, ν, см-1: 3462 ш
приведенными для энантиомера в работе [53].
(ОН), 1735 о.с (С=О), 1256 с (С-О), 1213 с (С-О),
1158 с (С-О), 1067 с (С-О). Спектр ЯМР 1H, δ, м.д.:
(1R,3R)-1-[(Бензилокси)метил]-3-метил-4-{1-
1.35 с (3H, CH3С), 1.42 с (3H, CH3С), 2.15 д.д (1Н,
[(метилсульфонил)окси]циклопропил}бутил-
СН2СНОН, J1 14.4, J2 10.6 Гц), 2.46 д.д (1Н,
ацетат (29). Получен по методике из работы [53],
СН2СНОН, J1 14.4, J2 2.6 Гц), 2.54 уш.с (1Н, ОН),
спектральные характеристики совпали с приведен-
3.09-3.18 м (2Н, CH2СO), 3.70 с (3Н, CH3O), 3.75-
ными для энантиомера в данной работе. Выход
3.81 м (1H, СНOH), 3.93-4.00 м (2Н, CH2OС), 4.02-
94%.
4.05 м (1Н, СН2СНОС), 5.06 с (1Н, CH2=), 5.10 с
(1R,3S)-1-[(Бензилокси)метил]-5-(бромметил)-
(1Н, CH2=). Спектр ЯМР 13С, δ, м.д.: 25.2, 26.6,
3-метилгекс-5-ен-1-ил ацетат (23). Получен по
41.0, 41.5, 52.2, 65.8, 70.6, 79.0, 109.1, 118.2, 140.2,
методике синтеза энантиомера [53], спектральные
173.3. Найдено, %: С 59.05; H 8.21. C12H20O5.
характеристики совпали с приведенными в данной
Вычислено, %: C 59.00; H 8.25.
работе. Выход 92%.
(1R,3S)-1-[(Бензилокси)метил]-5-{(2S)-2-[(4R)-
1-[(2S)-2-Метил-4-оксо]циклопропил метан-
2,2-диметил-1,3-диоксолан-4-ил]-2-гидрокси-
сульфонат (30). К раствору 0.82 г (2.4 ммоль)
этил}-3-метилгекс-5-ен-1-ил ацетат (33). Выход
спирта 28 в 10 мл MeOH добавили 0.05 г 5%-ного
1.53 г (73%). ИК спектр, ν, см-1: 3468 ш (ОН), 1735
Pd(OH)2/C и выдержали при интенсивном
с (С=О), 1237 с (С-О), 1063 с (С-О), 1024 с (С-О).
перемешивании в атмосфере H2 в течение 3 ч.
Спектр ЯМР 1H, δ, м.д.: 0.88 д (3Н, СН3СН, J
Реакционную смесь разбавили
50 мл CH2Cl2,
6.6 Гц), 1.36 с (3H, CH3С), 1.42 с (3H, CH3С), 1.63-
катализатор отделили, промыли 30 мл CH2Cl2 и
1.75 м (3Н, СНСН3, СНСН2СНСН3), 1.97-2.19 м
смесь растворителей удалили при пониженном
(4Н, СН2СНОН, ССН2СНСН3), 2.06 с (3Н, CH3СO),
давлении. Полученный диол растворили в смеси
3.48 д.д (2Н, ОСН2СНОСО, J1 5.05, J2 1.8 Гц), 3.68
4 мл ацетонитрила и 1.2 мл H2O, добавили 1.04 г
уш.с (1Н, ОН), 3.75-3.81 м (1H, СНOH), 3.92-4.04
(4.8 ммоль) NаIO4 и выдержали при перемешива-
м (3Н, СН2СНОС, CH2OС), 4.48 д (1Н, ОСН2Ph, J
нии 1 ч. Реакционную смесь разбавили 15 мл
12.1 Гц), 4.57 д (1Н, ОСН2Ph, J 12.1 Гц), 4.87 уш.с
CH2Cl2 и внесли Na2SO4 до полного поглощения
(1Н, СН2=), 4.90 уш.с (1Н, СН2=), 5.16-5.23 м (1Н,
водной фазы, растворитель удалили при
СНОС=О), 7.28-7.36 м (5Н, Ph). Спектр ЯМР 13С,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
ФУНКЦИОНАЛИЗИРОВАННЫЕ 2-ЗАМЕЩЕННЫЕ АЛЛИЛБРОМИДЫ
641
δ, м.д.: 20.7, 25.2, 26.5, 26.9, 28.5, 37.8, 39.5, 43.9,
СНОРiv), 7.28-7.36 м (5Н, Ph). Спектр ЯМР 13С, δ,
68.8, 70.5, 71.7, 73.0, 74.7, 78.3, 109.5, 113.0, 127.6
м.д.: 19.7, 21.1, 25.2, 26.2, 26.9 (3 С), 27.2, 37.6,
(2С), 128.3 (3С), 143.9, 147.1, 170.6. Найдено, %: С
38.5, 38.8, 43.7, 64.9, 67.2, 70.4, 72.1, 73.0, 76.2,
68.62; Н 8.58. C24H36O6. Вычислено, %: С 68.54; Н
109.4, 114.4, 127.6 (3 С), 128.3 (2 С), 138.0, 142.8,
8.63.
170.8, 177.5. Найдено, %: С 69.08; Н 8.72. C29H44O7.
Вычислено, %: С 69.02; Н 8.79.
(6R)-6-((2S)-4-{(2S)-2-[(4R)-2,2-Диметил-1,3-
диоксолан-4-ил]-2-гидроксиэтил}-2-метилпент-
Этил (2E,4S)-6-[(2S,4R)-4-(ацетилокси)-5-(бен-
4-ен-1-ил)-5,6-дигидро-2H-пиран-2-он
(34).
зилокси)-2-метилпентил]-4-[(2,2-диметилпро-
Выход 1.13 г (70%). ИК спектр, ν, см-1: 1720 с (С-
паноил)окси]гепта-2,6-диеноат (36). К раствору
О), 1260 с (С-О), 1214 о.с (С-О), 1139 с (С-О),
0.71 г (1.4 ммоль) соединения 35 в 5 мл MeOH
1067 с (С-О). Спектр ЯМР 1H, δ, м.д.: 0.83 д (3Н,
добавили 25 мг ППТС (0.1 ммоль) и выдержали
CH3СН, J 6.1 Гц), 1.11-1.22 м (1Н, ОСНСН2СН),
при комнатной температуре в течение 24 ч. После
1.27 с (3H, CH3С), 1.33 с (3H, CH3С), 1.45-1.65 м
отгонки растворителя при пониженном давлении
(1Н, ОСНСН2СН), 1.75-1.86 м (1Н, CH3СН), 1.89-
продукт растворили в смеси 2 мл ацетонитрила и
2.08 м (4Н, =ССН2СНОН, =ССН2СНСН3), 2.11-2.29
0.6 мл H2O, добавили 0.52 г (2.4 ммоль) NаIO4 и
м (2Н, СН2СН=), 2.92 уш.с (1Н, ОН), 3.67-3.78 м
выдержали при перемешивании 1 ч. Реакционную
(1Н, ОСН2СНОС), 3.85-4.00 м (3Н, ОСН2СНОС,
смесь разбавили 10 мл CH2Cl2 и внесли Na2SO4 до
СНOH, ОСН2СНОС), 4.40-4.47 м (1Н, СНОСО),
полного поглощения водной фазы, растворитель
4.80 уш.с (1Н, СН2=), 4.83 уш.с (1Н, СН2=), 5.90-
удалили при пониженном давлении. Промежуточ-
5.94 м
(1Н, СН=СНС=О),
6.75-6.81 м
(1Н,
ный альдегид растворили в 20 мл абсолютного
СН=СНС=О). Спектр ЯМР 13С, δ, м.д.: 19.0, 24.9,
CH2Cl2, добавили одной порцией 1.74 г (5.0 ммоль)
26.2, 29.3, 29.8, 42.2, 43.0, 46.9, 65.1, 72.8, 75.3,
(этоксикарбонилметилен)трифенилфосфорана и
78.2,
121.1,
128.2,
131.7,
143.6,
144.8,
161.8.
выдержали
72 ч при комнатной температуре.
Найдено, %: С 66.75; Н 8.59. C18H28O5. Вычислено,
Растворитель удалили при пониженном давлении,
%: С 66.64; Н 8.70.
продукт реакции выделили хроматографированием
(элюент - петролейный эфир-этилацетат, 40:1).
(1S)-3-[(2S,4R)-4-(Ацетилокси)-5-(бен-
Выход 0.52 г (74%). ИК спектр, ν, см-1: 1725 с
зилокси)-2-метилпентил]-1-[(4R)-2,2-диметил-
(С=О), 1237 с (С-О), 1148 с (С-О), 1095 ср (С-О),
1,3-диоксолан-4-ил]бут-3-ен-1-ил пивалат (35). К
1028 ср (С-О). Спектр ЯМР 1H, δ, м.д.: 0.88 д (3Н,
1.68 г (4.0 ммоль) спирта 33 в 10 мл абсолютного
СН3СН, J 6.6 Гц), 1.20 уш.с [9Н, (СН3)3СС=О], 1.28
пиридина добавили 0.47 г (6.0 ммоль) пивалоил
т (3Н, ОСН2CH3, J 7.1 Гц), 1.62-1.74 м (3Н, СНСН3,
хлорида и выдержали при перемешивании в
СНСН2СНОСО), 1.82-2.03 м (2Н, ССН2СНСН3),
течение 12 ч. Реакционную смесь обработали 40 мл
2.26-2.37 м
(2Н,
=ССН2СНОСО),
2.07 с
(3Н,
H2O, продукт реакции экстрагировали Et2O (3×10 мл),
CH3СO), 3.46-3.50 м (2Н, СН2ОСН2Ph), 4.19 кв
объединенные органические вытяжки осушили
(2Н, ОСН2CH3, J 7.1 Гц), 4.48 д (1Н, ОСН2Ph, J
Na2SO4. Растворитель упарили при пониженном
12.4 Гц), 4.58 д (1Н, ОСН2Ph, J 12.4 Гц), 4.82 уш.с
давлении, продукт реакции выделили хроматог-
(1Н, СН2=),4.84 уш.с (1Н, СН2=), 5.16-5.24 м (1Н,
рафированием (элюент
- петролейный эфир-
СНОАс), 5.49-5.55 м (1Н, СНОРiv), 5.92 д (1Н,
этилацетат, 25:1). Выход 1.75 г (87%). ИК спектр,
СН=СНСО2, J 15.7 Гц), 6.87 д.д (1Н, СН=СНСО2, J1
ν, см-1: 1733 с (С=О), 1239 с (С-О), 1156 о.с (С-О),
15.7, J2 4.9 Гц), 7.28-7.36 м (5Н, Ph). Спектр ЯМР
1066 с (С-О). Спектр ЯМР 1H, δ, м.д.: 0.87 д (3Н,
13С, δ, м.д.: 14.1, 19.4, 21.2, 26.8, 27.2 (3 С), 38.8,
СН3СН, J 6.6 Гц), 1.23 уш.с [9Н, (СН3)3СС=О], 1.26
39.5, 40.3, 44.1, 60.6, 70.4, 71.7, 73.0, 75.7, 113.6,
с (3H, CH3С), 1.34 с (3H, CH3С), 1.63-1.74 м (2Н,
121.1, 127.2, 127.6 (2 С), 128.3 (2 С), 137.9, 141.9,
СНСН2СНОСО), 1.84-1.92 м (1Н, СНСН3), 1.95-
145.3, 165.9, 170.8, 177.3. Найдено, %: С 69.35; Н
2.09 м (2Н, ССН2СНСН3), 2.07 с (3Н, CH3СO), 2.17-
8.35. C29H42O7. Вычислено, %: С 69.30; Н 8.42.
2.23 д.д (1Н, =ССН2СНОСО, J1 14.1, J2 9.1 Гц), 2.26-
2.35 м
(1Н,
=ССН2СНОСО),
3.46-3.48 м
(2Н,
(1R,3S)-1-[(Бензилокси)метил]-3-метил-5-
СН2ОСН2Ph), 3.76-3.90 м (1Н, CH2OС), 3.97-4.02 м
[(2S,3R)-2,3,4-тригидроксибутил]-гекс-5-ен-1-ил
(1Н, CH2OС), 4.06-4.12 м (1Н, СН2СНОС), 4.48 д
ацетат
(37). К раствору
0.71 г
(1.4 ммоль)
(1Н, ОСН2Ph, J 12.1 Гц), 4.58 д (1Н, ОСН2Ph, J
соединения 33 в 5 мл MeOH добавили 25 мг ППТС
12.1 Гц), 4.76 уш.с (1Н, СН2=), 4.80 уш.с (1Н,
(0.1 ммоль) и выдержали при комнатной темпе-
СН2=), 5.08-5.15 м (1Н, СНОАс), 5.17-5.24 м (1Н,
ратуре в течение 24 ч. После внесения нескольких
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
642
МИНЕЕВА
капель Et3N и отгонки растворителя при
ОСН2Ph, J 12.4 Гц), 4.93 уш.с (1Н, СН2=),4.94 уш.с
пониженном давлении, продукт выделили
(1Н, СН2=), 5.15-5.20 м (1Н, СНОАс), 6.09 д.д (1Н,
хроматографированием (элюент
- петролейный
СН=СНСО2, J1 15.7, J2 1.5 Гц), 6.92 д.д.д (1Н,
эфир-этилацетат,
2:1).Выход
0.48 г
(90%). ИК
СН=СНСО2, J1 15.7, J2 4.6, J3 2.0 Гц), 7.28-7.39 м
спектр, ν, см-1: 3402 ш (ОН), 1734 с (С=О), 1237 с
(5Н, Ph). Спектр ЯМР 13С, δ, м.д.: 14.4, 19.6, 21.3,
(С-О), 1071 с (С-О), 1023 с (С-О). Спектр ЯМР 1H,
26.9, 37.6, 40.7, 44.1, 60.4, 65.5, 70.5, 71.6, 73.1,
δ, м.д.: 0.88 д (3Н, СН3СН, J 6.6 Гц), 1.62-1.80 м
112.9, 120.3, 127.3, 127.6 (2 С), 128.4 (2 С), 139.2,
(3Н, СНСН2СНОСО, СНСН3), 1.85-1.92 м (2Н,
147.1, 149.0, 166.4, 171.8. Найдено, %: С 68.93; Н
=ССН2СНСН3), 2.07 с (3Н, CH3СO), 2.09-2.15 м (1Н,
8.12. C24H34O6. Вычислено, %: С 68.87; Н 8.19.
=ССН2СНОН), 2.29-2.39 м (1Н, =ССН2СНОН), 2.45
Этил
(2E)-5-[(2S,4R)-4-(ацетилокси)-5-
уш.с (1Н, ОН), 2.84 уш.с (2Н, ОН), 3.47-3.49 м (2Н,
(бензилокси)-2-метилпентил]гекса-2,5-диеноат
СН2ОСН2Ph), 3.54-3.61 м (1Н, CH2OН), 3.71-3.84 м
(39). Выход 0.14 г (45%). ИК спектр, ν, см-1: 1735 с
(3Н, CH2OН, НОСН2СНОН, СНОН), 4.48 д (1Н,
(С=О), 1717 с (С=О), 1236 с (С-О), 1157 ср (С-О),
ОСН2Ph, J 12.1 Гц), 4.58 д (1Н, ОСН2Ph, J 12.1 Гц),
1095 ср (С-О), 1026 ср (С-О). Спектр ЯМР 1H, δ,
4.89 уш.с (1Н, СН2=), 4.92 уш.с (1Н, СН2=), 5.15-
м.д.: 0.88 д (3Н, СН3СН, J 6.3 Гц), 1.29 т (3Н,
5.21 м (1Н, СНОАс), 7.28-7.37 м (5Н, Ph). Спектр
ОСН2CH3, J 7.1 Гц), 1.60-1.74 м (3Н, СНСН3,
ЯМР 13С, δ, м.д.: 19.2, 21.2, 27.1, 37.9, 39.5, 43.8,
СНСН2СНОСО), 1.90 д.д (1Н, =ССН2СНСН3, J1
63.3, 70.8, 71.7, 73.1, 73.6, 76.2, 113.0, 127.3, 127.7
14.1, J2 7.1 Гц), 2.00 д.д (1Н, =ССН2СНСН3, J1 14.1,
(2С), 128.4 (2С), 138.6, 144.1, 171.0. Найдено, %: С
J2
6.8 Гц),
2.07 с
(3Н, CH3СO),
2.82 д
(2Н,
66.34; Н 8.43. C21H32O6. Вычислено, %: С 66.29; Н
=СНСН2С=, J 7.1 Гц), 3.48 д (2Н, СН2ОСН2Ph, J
8.48.
4.8 Гц), 4.19 кв (2Н, ОСН2CH3, J 7.1 Гц), 4.48 д (1Н,
Окислительное расщепление триола
37 с
ОСН2Ph, J 12.1 Гц), 4.58 д (1Н, ОСН2Ph, J 12.1 Гц),
последующим олефинированием. К раствору 0.30 г
4.82 уш.с (2Н, СН2=), 5.16-5.22 м (1Н, СНОАс),
(0.8 ммоль) триола 37 в смеси 2 мл ацетонитрила и
5.82 д (1Н, СН=СНСО2, J 15.7 Гц), 6.93 д.т (1Н,
0.6 мл H2O добавили 0.26 г (1.2 ммоль) NаIO4 и
СН=СНСО2, J1 15.7, J2 7.3 Гц), 7.28-7.36 м (5Н, Ph).
выдержали при перемешивании 1 ч. Реакционную
Спектр ЯМР 13С, δ, м.д.: 14.2, 19.2, 21.2, 26.9, 37.6,
смесь разбавили 10 мл CH2Cl2 и внесли Na2SO4 до
38.3, 44.3, 60.2, 70.4, 71.6, 73.0, 113.6, 122.7, 127.6
полного поглощения водной фазы, растворитель
(3 С), 128.4 (2 С), 138.0, 144.1, 146.3, 166.4, 180.3.
удалили при пониженном давлении. После отгонки
Найдено, %: С 71.16; Н 8.23. C23H32O5. Вычислено,
растворителя при пониженном давлении промежу-
%: С 71.11; Н 8.30.
точный альдегид растворили в 15 мл абсолютного
CH2Cl2, добавили одной порцией 0.87 г (2.5 ммоль)
СПИСОК ЛИТЕРАТУРЫ
(этоксикарбонилметилен)трифенилфосфорана и
перемешивали 72 ч при комнатной температуре.
1. Yamamoto Y., Asao N. Chem. Rev. 1993, 93, 2207. doi
Растворитель удалили при пониженном давлении,
10.1021/cr00022a010
продукты реакции выделили хроматографи-
2. Li C.-J. Tetrahedron. 1996, 52, 5643. doi 10.1016/0040-
рованием (элюент - петролейный эфир-этилацетат,
4020(95)01056-4
50:1).
3. Yus M., Gonzalez-Gomez J.C., Foubelo F. Chem. Rev.
2011, 111, 7774. doi 10.1021/cr1004474
Этил
(2E,4S)-6-[(2S,4R)-4-(ацетилокси)-5-
4. Venkatesham A., Nagaiah K. Tetrahedron: Asymmetry.
(бензилокси)-2-метилпентил]-4-гидроксигепта-
2012, 23, 1186. doi 10.1016/j.tetasy.2012.07.015
2,6-диеноат (38). Выход 0.10 г (30%). ИК спектр, ν,
5. Kageyama M., Miyagi T., Yoshida M., Nagasawa T.,
см-1: 3463 ш (ОН), 1733 с (С=О), 1717 с (С=О),
Ohrui H., Kuwahara S. Biosc. Biotech. Biochem. 2012,
1238 с (С-О), 1100 с (С-О), 1026 с (С-О). Спектр
76, 1219. doi 10.1271/bbb.120134
ЯМР 1H, δ, м.д.: 0.88 д (3Н, СН3СН, J 6.3 Гц), 1.29 т
6. Yadav J., Reddy N.M., Rahman M.A., Prasad
(3Н, ОСН2CH3, J 7.1 Гц), 1.60 уш.с (1Н, ОН), 1.65-
Reddy B.V.S. Tetrahedron.
2013,
69,
8618. doi
1.75 м (3Н, СНСН3, СНСН2СНОСО), 1.86-2.02 м
10.1016/j.tet.2013.07.072
(2Н, =ССН2СНСН3), 2.07 с (3Н, CH3СO), 2.10-2.17
7. Sanyal I., Shukla B., Barman P.D., Banerjee A.K.
м
(1Н,
=ССН2СНОН),
2.26-2.33 м
(1Н,
Tetrahedron Lett.
2013,
54,
2637. doi
10.1016/
=ССН2СНОН), 3.46-3.51 м (2Н, СН2ОСН2Ph), 4.20
j.tetlet.2013.03.035
кв (2Н, ОСН2CH3, J 7.1 Гц), 4.35-4.43 м (1Н,
8. Zimmermann N., Pinard P., Carboni B., Gosselin P.,
СНОН), 4.49 д (1Н, ОСН2Ph, J 12.4 Гц), 4.58 д (1Н,
Gaulon-Nourry C., Dujardin G., Collet S., Lebreton J.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
ФУНКЦИОНАЛИЗИРОВАННЫЕ 2-ЗАМЕЩЕННЫЕ АЛЛИЛБРОМИДЫ
643
Mathe-Allainmat M. Eur. J. Org. Chem. 2013, 2303.
Organomet.Chem. 2001, 624, 223. doi 10.1016/S0022-
doi 10.1002/ejoc.201201728
328X(00)00902-5
9. Holt D., Gaunt M.J. Angew. Chem. Int. Ed. 2015, 54,
31. Bied C., Collin J., Kagan H.B. Tetrahedron. 1992, 48,
7857. doi 10.1002/anie.201501995
3877. doi 10.1016/S0040-4020(01)88468-4
10. Heathcock C.H., Young S.D., Hagen J.P., Pirrung M.C.,
32. Alcaide B., Almendros P., Carrascosa R., Torres M.R.
White C.T., VanDerveer D. J. Org. Chem. 1980, 45,
Adv. Synth. Catal. 2010, 352, 1277. doi 10.1002/
3846. doi 10.1021/jo01307a023
adsc.201000124
11. Hafner A., Duthaler R. O., Marti R., Rihs G., Rothe-
33. Alcaide B., Almendros P., Carrascosa R. Tetrahedron.
Streit P., Schwarzenbach F. J. Am. Chem. Soc. 1992,
2012, 68, 9391. doi 10.1016/j.tet.2012.09.030
114, 2321. doi 10.1021/ja00033a005
34. Sanyal I., Barman P.D., Banerjee A.K. Tetrahedron
12. Solomon M.S., Hopkins P.B. J. Org. Chem. 1993, 58,
Lett. 2015, 56, 789. doi 10.1016/j.tetlet.2014.12.065
2232. doi 10.1021/jo00060a045
35. Chen Q., Qiu X.-L., Qing F.-L. J. Org. Chem. 2006, 71,
13. Pan C.-F., Zhang Z.-H., Sun G.-J., Wang Z.-Y. Org.
3762. doi 10.1021/jo0601157
Lett. 2004, 6, 3059. doi 10.1021/ol049008u
36. Yue X., Wu Y.-Y., Qing F.-L. Tetrahedron. 2007, 63,
14. Solomon M.S., Hopkins P.B. Tetrahedron Lett. 1991,
1560. doi 10.1016/j.tet.2006.12.014
32, 3297. doi 10.1016/S0040-4039(00)92690-X
37. Xu X.-H., You Z.-W., Zhang X., Qing F.-L.
15. Liu B., Zhou W.-S. Org. Lett. 2004, 6, 71. doi 10.1021/
J. Fluor. Chem.
2007,
128,
535. doi
10.1016/
ol036058a
j.jfluchem.2007.01.007
16. Cheung C.-M., Craig D., Todd R.S. Synlett. 2001, 1611.
38. Chen Z.-H., Wang R.-W., Qing F.-L. Tetrahedron Lett.
doi 10.1055/s-2001-17442
2012, 53, 2171. doi 10.1016/j.tetlet.2012.02.062
17. Cossy J., Willis C., Bellosta V., Bouz S. J. Org. Chem.
39. Csuk R., Schroeder C. J. Carbohydr. Chem. 1999, 18,
2002, 67, 1982. doi 10.1021/jo010653d
285. doi 10.1080/07328309908543996
18. Kiren S., Williams L.J. Org. Lett. 2005, 7, 2905. doi
40. Bhalay G., Clough S., McLaren L., Sutherland A.,
10.1021/ol0508375
Willis C.L. J. Chem. Soc., Perkin Trans. 1. 2000, 901.
19. Nakashima K., Kikuchi N., Shirayama D., Miki T.,
doi 10.1039/B200358A
Ando K., Sono M., Suzuki S., Kawase M., Kondoh M.,
41. Kameda Y., Nagano H. Tetrahedron. 2006, 62, 9751.
Sato M., Tori M. Bull. Chem. Soc. Jpn. 2007, 80, 387.
doi 10.1016/j.tet.2006.07.054
doi 10.1246/bcsj.80.387
42. Moral J.A., Moon S.-J., Rodriguez-Torres S.,
20. Xie J., Ma Y., Horne D.A. J. Org. Chem. 2011, 76,
Minehan T.G. Org. Lett. 2009, 11, 3734. doi 10.1021/
6169. doi 10.1021/jo200899v
ol901353f
21. Arthuis M., Beaud R., Gandon V., Roulland E. Angew.
43. Dhanjee H., Minehan T.G. Tetrahedron Lett. 2010, 51,
Chem. Int. Ed.
2012,
51,
10510. doi
10.1002/
5609. doi 10.1016/j.tetlet.2010.08.064
anie.201205479
44. Kozyrkov Yu.Yu., Kulinkovich O.G. Synlett. 2002, 443.
22. Li M., Xiong J., Huang Y., Wang L.-J., Tang Y.,
doi 10.1055/s-2002-20461
Yang G.-X., Liu X.-H., Wei B.-G., Fan H., Zhao Y.,
45. Haym I., Brimble M.A. Org. Biomol. Chem. 2012, 10,
Zhai W.-Z., Hu J.-F. Tetrahedron. 2015, 71, 5285. doi
7649. doi 10.1039/C2OB26082D
10.1016/j.tet.2015.06.020
46. Минеева И.В. ЖOрХ. 2017, 53, 432. [Mineeva I.V.
23. Binder W.H., Prenner R.H., Schmid W. Tetrahedron.
Russ. J. Org. Chem. 2017, 53, 433.] doi 10.1134/
1994, 50, 749. doi 10.1016/S0040-4020(01)80790-0
S1070428017030204
24. Paquette L.A., Mitzel T.M. Tetrahedron Lett. 1995, 36,
47. Минеева И.В., Кулинкович О.Г. ЖOрХ. 2008, 44,
6863. doi 10.1016/0040-4039(95)01439-O
1277.
[Mineeva I.V., Kulinkovich O.G. Russ.
25. Paquette L.A., Mitzel T.M. J. Am. Chem. Soc. 1996,
J. Org. Chem.
2008,
44,
1261.] doi
10.1134/
118, 1931. doi 10.1021/ja953682c
S1070428008090029
26. Chng S.-S., Xu J., Loh T.-P. Tetrahedron Lett. 2003, 44,
48. Mineyeva I.V., Kulinkovich O.G. Tetrahedron Lett.
4997. doi 10.1016/S0040-4039(03)01173-0
2010, 51, 1836. doi 10.1016/j.tetlet.2010.01.120
27. Moral J.A., Moon S.-J., Rodriguez-Torres S., Minehan T.G.
49. Минеева И.В. ЖOрХ. 2014, 50, 408. [Mineeva I.V.
Org. Lett. 2009, 11, 3734. doi 10.1021/ol901353f
Russ. J. Org. Chem. 2014, 50, 398.] doi 10.1134/
28. Schmoelzer C., Fischer M., Schmid W. Eur. J. Org.
S1070428014030178
Chem. 2010, 4886. doi 10.1002/ejoc.201000623
50. Минеева И.В. ЖOрХ. 2016, 52, 376. [Mineeva I.V.
29. Mulzer J., Angermann A. Tetrahedron Lett. 1983, 24,
Russ. J. Org. Chem. 2016, 52, 355.] doi 10.1134/
2843. doi 10.1016/S0040-4039(00)88039-9
S1070428016030118
30. Boucley C., Cahiez G., Carini S., Cere V., Comes-
51. Mülzer J., Öhler E. Chem. Rev. 2003, 80, 3753. doi
Franchini M., Knochel P., Pollicino S., Ricci A. J.
10.1021/cr940368c
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019
644
МИНЕЕВА
52. Trost B.M., Amans D., Seganish W.M., Chung C.K.
53. Минеева И.В. ЖOрХ. 2015, 51, 942. [Mineeva I.V.
Chem. Eur. J.
2012,
18,
2961. doi
10.1002/
Russ. J. Org. Chem. 2015, 51, 920.] doi 10.1134/
chem.201102899
S1070428015070052
Functionalized 2-Substituted Allyl Bromides in Barbier Allylation
Reactions of (R)-2,3-O-isopropylidene glyceraldehyde. Utilizing
in the Synthesis of C8-C17, C8-C18 and C5-C17 building Blocks
of Laulimalides and Their Synthetic Analogues
I. V. Mineyeva*
Belarusian State University, 220047, Republic of Belarus, Minsk, pr. Nezavisimosti 4
*e-mail: i.mineyeva@yandex.ru
Received November 18, 2018
Revised February 15, 2019
Accepted February 17, 2019
Based on cyclopropanol intermediates, several new 2-substituted allyl bromides involved in the Barbier (R)-2,3-
O-isopropylidene glyceraldehyde allylation reaction were synthesized under the action of zinc in tetrahydrofuran
and a saturated aqueous solution of ammonium chloride. The possibilities of using homoallyl alcohols obtained
in such a way with high diastereoselectivity in the synthesis of the building blocks of macrocyclic antitumor
drugs laulimalides and their synthetic analogues are demonstrated.
Keywords:
2-substituted allyl bromides, Barbier reaction, (R)-2,3-O-isopropylidene glyceraldehyde,
cyclopropanol sulfonates, diastereoselective allylation, homoallyl alcohol, laulimalide
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 4 2019