ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 5, с. 677-682
УДК 547.518
АЛКОГОЛИЗ БИНОРА-S СПИРТАМИ ПОД ДЕЙСТВИЕМ
ИОННЫХ ЖИДКОСТЕЙ
© 2019 г. Р. И. Аминов*, Р. И. Хуснутдинов
ФГБУН «Институт нефтехимии и катализа РАН»,
450075, Россия, Республика Башкортостан, г. Уфа, пр. Октября 141
*e-mail: inklab4@gmail.com
Поступила в редакцию 13 июля 2018 г.
После доработки 10 февраля 2019 г.
Принята к публикации 10 февраля 2019 г.
Впервые установлено, что неорганические ионные жидкости катализируют алкоголиз гептациклического
димера норборнадиена - гептацикло[8.4.0.02,12.03,8.04,6.05,9.011,13]тетрадекана (бинора-S) первичными и
вторичными спиртами. Реакция проходит в условиях: 65-100°C за 6-14 ч путем региоизбирательного
разрыва связи С4-С5 циклопропанового кольца бинора-S с образованием 10-экзо-алкоксигексацикло-
[9.2.1.02,7.03,5.04,8.09,13]тетрадеканов с выходами 85-90%.
Ключевые слова: алкоголиз, бинор-S, спирты, неорганические ионные жидкости, катализ.
DOI: 10.1134/S0514749219050021
В последние годы в практику органического
CuSO4,
[Et3NH]+-[Fe2Cl7]-,
[Et3NH]+-[FeCl4]-,
синтеза активно внедряются ионные жидкости [1].
EMIM+-AlCl4-, BMIM+-BF4-, лучшей из которой
Важной областью применения ионных жидкостей
является
[Et3NH]+-[Al2Cl7]- с добавкой CuSO4.
является катализ. В частности, алюминатные
Сульфаты меди, никеля, кобальта при добавлении
ионные жидкости катализируют алкилирование
к ионной жидкости образуют более эффективную
ароматических соединений олефинами
[2-4],
каталитическую систему [19]. Ионные жидкости,
алкилхлоридами [5-6] и ацилирование хлористым
будучи полярными растворителями, являются
ацетилом [7-9], селективное гидрирование [10],
средой, в которой указанные соли легко
алкилирование и изомеризацию алканов [11-13] и
диссоциируют на катионы и анионы, в связи с чем,
полициклических углеводородов [14-16].
вероятно образование комплекса между
компонентами непосредственно при формировании
С целью поиска эффективных катализаторов
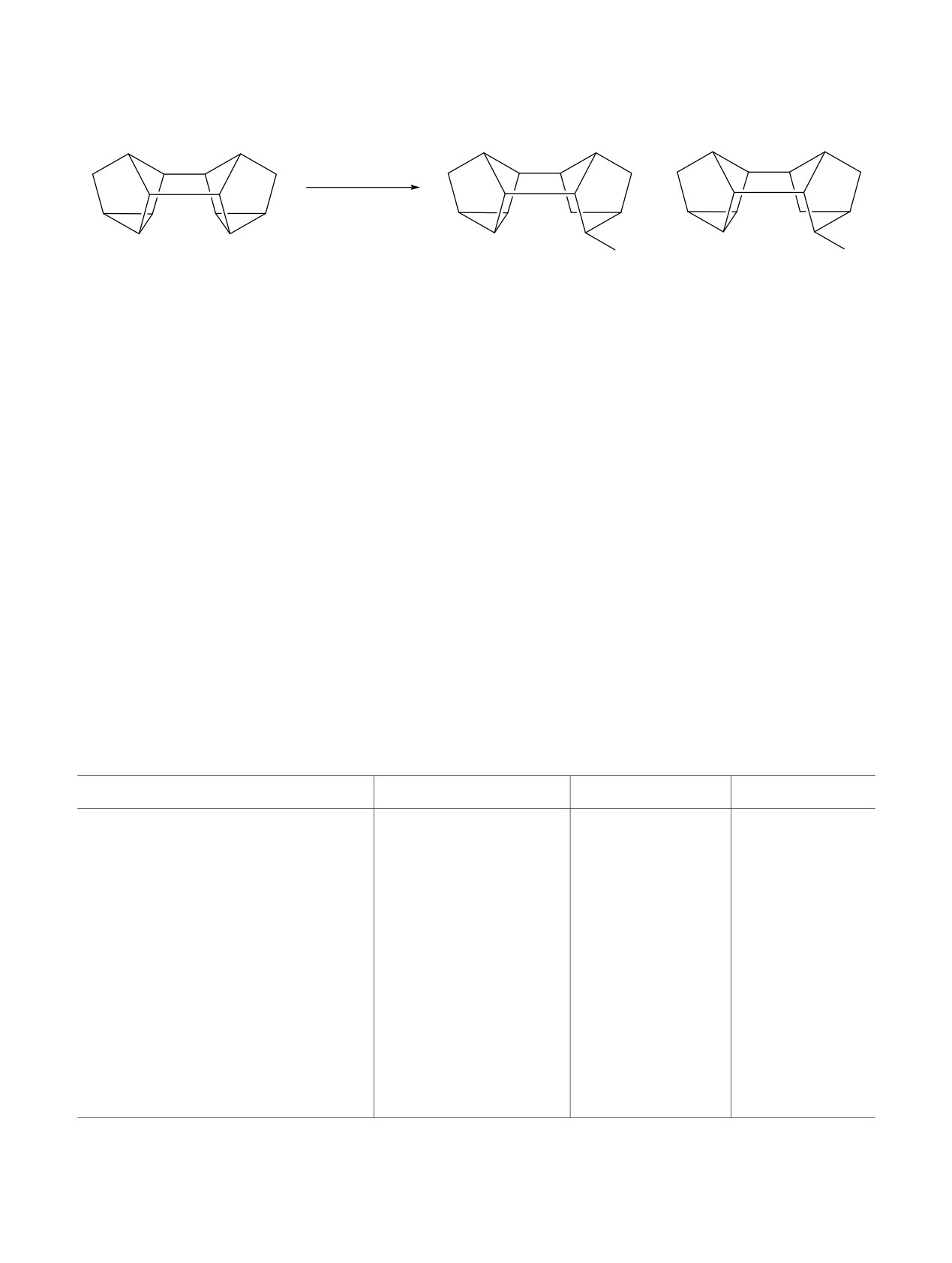
каталитической системы. Лучшее промотирующее
алкоголиза гептацикло[8.4.0.02,12.03,8.04,6.05,9.011,13]-
действие сульфатов меди, никеля и кобальта
тетрадекана (бинора-S) 1 по циклопропановому
можно объяснить их большей полярностью.
кольцу спиртами предпринято исследование в ряду
алюминатных ионных жидкостей.
Реакция проходит путем региоизбирательного
раскрытия связи С4-С5 циклопропанового кольца с
Согласно литературным данным [17, 18], алкоголиз
образованием
10-экзо-алкоксигексацикло-
бинора-S метанолом катализируют соединения
[9.2.1.02,7.03,5.04,8.09,13]тетрадеканов 2-11. Во всех
палладия, родия и платины: PdCl2, Pd(acac)2, RhCl3,
опытах образуется
10-экзо-хлоргексацикло-
Rh(acac)3, H2PtCl6. В результате серии экспери-
[9.2.1.02,7.03,5.04,8.09,13]тетрадекан 12 (выход 8-10%) -
ментов установлено, что алкоголиз бинора-S
продукт взаимодействия бинора-S с HCl, входящего
первичными и вторичными спиртами (метанолом,
в состав катализатора (схема 1).
этанолом, пропан-1-олом, пропан-2-олом, бутан-1-
Соединения 2-11 выделены в индивидуальном
олом, бутан-2-олом, 2-метилпропан-2-олом, пентан-
виде с помощью колоночной хроматографии
1-олом, октан-1-олом, декан-1-олом, циклогекса-
(элюент - петролейный эфир-этилацетат, 10:1).
нолом) катализируют следующие неорганические
ионные жидкости:
[Et3NH]+-[Zn2Cl5]-, [Et3NH]+-
Образование эфиров 2-11 путем селективного
[Sn2Cl5]-,
[Et3NH]+-[Al2Cl7]-,
[Et3NH]+-[Al2Cl7]--
разрыва связи С4-С5 в молекуле бинора-S доказано
677
678
АМИНОВ, ХУСНУТДИНОВ
Схема 1.
1
8
7
13
7
13
10
9
ROH
2
1
2
1
6
12
6
12
14
7
ионная жидкость
2
8
8
9
3
65_100oC
9
+
11
5
4_16 ч
3
11
3
14
11
13
6
5
14
5
10
10
12
4
4
4
OR
Cl
100%
1
2-11 (85_90%)
12 (8_10%)
R = Me (2), Et (3), Pr (4), Bu (5), Am (6), Oct (7), Dec (8), i-Pr (9), s-Bu (10), cyclo-Hex (11).
на основании данных спектров ЯМР 1H и 13C и
В таблице приведены условия реакции, при кото-
сравнением с известными спектрами 10-экзо-мето-
рых достигается полная конверсия бинора-S. Как
ксигексацикло[9.2.1.02,7.03,5.04,8.09,13]тетрадекана
видно из таблицы, продолжительность реакции зави-
[17]. B спектрах ЯМР 1H эфира 2 имеются сигналы
сит от природы спирта. Для первичных спиртов С1-С4
при 3.41 и 3.26 м.д. Oни принадлежат протону при
время реакции составляет 6 ч, в случае высших и вто-
С10 и группе СH3O группе соответственно [17]. B
ричных спиртов для достижения полной конверсии
спектре ЯМР 13С эфира 2 имеются характеристичес-
бинора-S необходимо более длительное нагревание.
кие сигналы углеродного атома С10 при 87.35 м.д.
Максимальная конверсия бинора-S
1
(83.27 м.д. [17]) и группы СH3O при 55.43 м.д.
наблюдается при соотношении
[1]-[ионная
(55.35 м.д.
[17]). Указанный набор сигналов
жидкость]
10:1. При увеличении концентрации
имеется и в спектрах остальных эфиров 3-11.
ионной жидкости (2÷5:1) наблюдается изменение
Опыты с участием спиртов С1-С4 удобно
соотношения продуктов реакции 2-11:12 до 2:1, а
проводить при температурах их кипения. Опыты с
при уменьшении концентрации ионной жидкости
высшими спиртами проводили при
100°C.
(20:1) происходит снижение конверсии бинора-S 1
Дальнейшее увеличение температуры неже-
до
20%. В случае реакции бинора-S с трет-
лательно из-за протекания побочной реакции
бутиловым спиртом конверсия соединения 1 не
межмолекулярной дегидратации спиртов с
превышает 5%. Выход хлорпроизводного 12 не
образованием эфиров и выделением воды, которая
зависит от природы спирта и условий реакции и
дезактивирует катализатор.
составляет 8-10%.
Условия реакции бинора-S 1 со спиртами в присутствии ионной жидкости [Et3NH]+-[Al2Cl7]--CuSO4.
Спирт
Температура реакции, °C
Время, ч
Выход эфира, %
Метанол
65
6
(2) 90
Этанол
75
6
(3) 89
Пропан-1-ол
90
6
(4) 89
Бутан-1-ол
95
6
(5) 89
Пентан-1-ол
95
7
(6) 88
Октан-1-ол
100
8
(7) 87
Декан-1-ол
100
12
(8) 85
Пропан-2-ол
80
10
(9) 88
Бутан-2-ол
95
14
(10) 87
Циклогексанол
100
10
(11) 86
трет-Бутиловый спирта
85
16
(13) 3
а Конверсия соединения 1 ≤5%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
АЛКОГОЛИЗ БИНОРА-S СПИРТАМИ ПОД ДЕЙСТВИЕМ ИОННЫХ ЖИДКОСТЕЙ
679
Учитывая образование хлорпроизводного
2
цикло[8.4.0.02,12.03,8.04,6.05,9.011,13]тетрадекана
1,
можно предположить, что эфиры 2-11 являются
0.85-3 мл (20-80 ммоль) ROH (R = Ме, Et, Pr, i-Pr,
вторичными продуктами, т.е. вначале бинор-S
Bu, s-Bu, t-Bu, C5H11, C8H17, C10H21, цикло-C6H11) и
реагирует с HCl, образуя хлорид
12, который
0.1 г (1 ммоль) ионной жидкости. Реакцию прово-
подвергается алкоголизу. Для проверки данного
дили 4-16 ч при постоянном перемешивании при
предположения были проведены опыты
65-100°С. После завершения реакции реакционную
с заведомо взятым
10-экзо-хлоргексацикло-
массу фильтровали через слой оксида алюминия
[9.2.1.02,7.03,5.04,8.09,13]тетрадеканом 12 со спиртами
(элюент - петролейный эфир). Растворитель отгоняли
в присутствии и в отсутствие ионной жидкости.
на ротационном испарителе. Продукты реакции
Попытки оказались безуспешными: спирты и
выделяли с помощью колоночной хроматографии
хлорпроизводное
12 возвращались из реакции
(силикагель фирмы Acrus
(0.060-0.200 мм,
неизменными.
элюент - петролейный эфир-этилацетат, 10:1).
Таким образом, установлено, что неоргани-
10-экзо-Метоксигексацикло[9.2.1.02,7.03,5.04,8.09,13]-
ческие ионные жидкости катализируют алкоголиз
тетрадекан (2). Выход 0.45 г (90%), т.кип. 85-86°С
бинора-S спиртами по циклопропановому кольцу.
(0.1 мм рт.ст.), 85°С (0.1 мм рт. ст.) [17], n
20 1.5255.
Реакция проходит с селективным разрывом связи
ИК спектр, ν, см-1: 3053, 2930, 1462, 1078, 809.
С4-С5 в молекуле бинора-S 1 с образованием 10-
Спектр ЯМР 1H, δ, м.д.: 0.96 т (1H, 1J 5.2, 2J 4.8 Гц),
экзо-алкоксигексацикло[9.2.1.02,7.03,5.04,8.09,13]-
1.05 т (1H, 1J 4.8, 2J 5.2 Гц), 1.24-1.29 м (1H), 1.11-
тетрадеканов 2-11 с выходом 85-90%.
1.16 м (2H), 1.50-1.60 м (2H), 1.31 с (2H), 1.86-1.89
м (2H), 1.76 с (1H), 2.03-2.05 м (2H), 1.94-1.96 м
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(1H), 2.22 д (1Н, J 4.4 Гц), 3.20-3.28 м (3Н), 3.40 с
(1Н). Спектр ЯМР 13С, δ, м.д.: 14.91, 15.50, 15.93,
Спектры ЯМР
1H,
13С зарегистрированы на
30.49, 32.64, 33.66, 34.60, 35.31, 36.41, 40.49, 41.50,
приборе Bruker Avance-III 400 Ascend (400 МГц
42.36, 44.25, 55.43, 87.35. Масс-спектр, m/z (Iотн, %):
для 1Н и 100 МГц для 13С в CDCl3). Масс-спектры
216 (35) [M]+, 174 (22), 129 (18), 117 (22), 109 (36),
снимали на приборе Shimadzu GCMS-QP2010Plus
108 (20), 96 (100), 91 (37), 79 (19), 71 (39). Найдено,
(капиллярная колонка SPB-5 30 м×0.25 мм, газ
%: C 83.19; H 9.27. C15H20O. Вычислено, %: C
носитель - гелий, температура программирования
83.28; H 9.32.
от 40 до 300°С со скоростью 8 град/мин, темпе-
10-экзо-Этоксигексацикло[9.2.1.02,7.03,5.04,8.09,13]-
ратура испарения
280°С, температура ионного
тетрадекан (3). Выход 0.445 г (89%), т.кип. 92-94°С
источника 200°С, энергия ионизации 70 эВ). ИК
(0.1 мм рт.ст.), n
20 1.5354. ИК спектр, ν, см-1: 3051,
спектры снимали на приборе Bruker Vertex-70v.
2934, 1458, 1082. Спектр ЯМР 1H, δ, м.д.: 0.95-0.96
Элементный состав образцов определяли на
м (1Н), 1.03-1.04 м (2H), 1.15-1.19 м (3Н), 1.30-
элементном анализаторе фирмы Karlo Erba, модель
1.33 м (2Н), 1.51-1.57 м (3Н), 1.74-1.75 м (2Н),
№ 1106. Ход реакции и чистоту полученных
1.86-1.90 м (2H), 2.02-2.04 м (3H), 2.19 д (1Н, J
соединений контролировали методом газо-
4.4 Гц), 3.39-3.44 м (2Н), 3.49 с (1Н). Спектр ЯМР
жидкостной хроматографии на приборе Shimadzu
13С, δ, м.д.: 14.94, 15.49, 15.64, 15.91, 30.60, 32.69,
GC-9A, GC-2014 [колонка 2 м×3 мм, неподвижная
33.66, 34.60, 35.45, 36.43, 40.51, 41.51, 42.91, 44.51,
фаза - силикон SE-30 (5%) на Chromaton N-AW-
62.89, 85.37. Масс-спектр, m/z (Iотн, %): 230 (84) [M]+,
HMDS, температурный режим от 50 до 270°С
201 (17), 185 (9), 138 (14), 92 (28), 45 (31), 29 (100).
со скоростью 8 град/мин, газ-носитель - гелий
Найдено, %: C 83.50; H 9.58. C16H22O. Вычислено,
(47 мл/мин)].
%: C 83.43; H 9.62.
Исходные реактивы - метанол, этанол, пропан-1
10-экзо-Пропокси[9.2.1.02,7.03,5.04,8.09,13]тетра-
-ол, пропан-2-ол, бутан-1-ол, бутан-2-ол, трет-
декан (4). Выход 0.445 г (89%), т.кип. 99-102°С
бутиловый спирт, пентан-1-ол, октан-1-ол, декан-1-
(0.1 мм рт.ст.), n
20 1.5380. ИК спектр, ν, см-1: 3053,
ол, циклогексанол - коммерческие реактивы, тща-
2956, 1461, 1354, 1096, 826. Спектр ЯМР 1H, δ, м.д.:
тельно высушивали по известным методикам [20].
0.91-0.99 м (4Н), 1.04-1.07 м (1Н), 1.13-1.16 м
Реакции бинора-S (1) со спиртами (общая
(2Н), 1.27-1.33 м (2Н), 1.55-1.61 м (5Н), 1.78 с
методика). В стеклянный реактор
(50 мл) в
(1H), 1.89-2.00 м (3H), 2.06 д (2H, J 9.6 Гц), 3.28-
атмосфере аргона загружали 0.5 г (10 ммоль) гепта-
3.42 м (2Н), 2.21 с (1Н), 3.50 с (1Н). Спектр ЯМР
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
680
АМИНОВ, ХУСНУТДИНОВ
13С, δ, м.д.: 10.78, 14.94, 15.50, 15.91, 23.25, 30.60,
(61), 91 (96), 83 (62), 79 (56), 57 (91), 43 (70), 41
32.71, 33.67, 34.61, 35.46, 36.44, 40.54, 41.52, 42.95,
(54). Найдено,
%: C
83.93; H
10.79. C22H34O.
44.51, 69.49, 85.39. Масс-спектр, m/z (Iотн, %): 244
Вычислено, %: C 84.01; H 10.90.
(90) [M]+, 202 (50), 124 (100), 117 (57), 95 (44), 91
10-экзо-(Децилокси)гексацикло-
(94), 82 (43), 79 (51), 57 (75), 43 (45). Найдено, %: C
[9.2.1.02,7.03,5.04,8.09,13]тетрадекан (8). Выход 0.425 г
83.64; H 9.88. C17H24O. Вычислено: C 83.55; H 9.90.
(85%), т.кип. 159-160°С (0.1 мм рт.ст.), n
20 1.5348.
10-экзо-Бутоксигексацикло[9.2.1.02,7.03,5.04,8.09,13]-
ИК спектр, ν, см-1: 3053, 2926, 2855, 1464, 1354,
тетрадекан (5). Выход 0.445 г (89%), т.кип. 108-
1100, 809. Спектр ЯМР 1H, δ, м.д.: 0.88-0.92 м (4Н),
110°С (0.1 мм рт.ст.), n
20 1.5375. ИК спектр, ν, см-1:
0.99 т (1Н, 1J 5.2, 2J 4.8 Гц), 1.07 т (1Н, 1J 4.8, 2J
3053, 2956, 1462, 1354, 1098, 797. Спектр ЯМР 1H, δ,
5.2 Гц), 1.14-1.18 м (2Н), 1.28-1.34 м (15Н), 1.54-
м.д.: 0.90-0.99 м (4Н), 1.04-1.07 м (1Н), 1.13-1.15 м
1.60 м (5Н), 1.79 с (1H), 1.89-1.97 м (3H), 2.06-2.08
(2Н), 1.33-1.38 м (4Н), 1.53-1.58 м (5Н), 1.78 с (1H),
м (2H), 2.23 д (1Н, J 4.4 Гц), 3.38-3.41 м (2Н), 3.51
1.88-1.96 м (3H), 2.05 д (2H, J 9.6 Гц), 2.22 с (1Н),
с (1Н). Спектр ЯМР 13С, δ, м.д.: 14.12, 14.94, 15.50,
3.37-3.40 м (2Н), 3.50 с (1Н). Спектр ЯМР 13С, δ, м.д.:
15.91, 22.69, 26.35, 29.34, 29.52, 29.59, 29.63, 30.08,
13.98, 14.94, 15.50, 15.91, 19.54, 30.60, 32.19, 32.71,
30.61, 31.91, 32.71, 33.68, 34.62, 35.47, 36.45, 40.55,
33.67, 34.61, 35.46, 36.44, 40.54, 41.52, 42.93, 44.52,
41.53, 42.94, 44.53, 67.89, 85.43. Масс-спектр, m/z
67.52, 85.42. Масс-спектр, m/z (Iотн, %): 258 (85) [M]+,
(Iотн, %): 342 (100) [M]+, 222 (62), 202 (69), 117 (49),
138 (87), 129 (44), 117 (58), 95 (49), 91 (99), 82 (43),
95 (57), 91 (78), 83 (60), 79 (46), 57 (69), 43 (72).
79 (53), 57 (100), 41 (52). Найдено, %: C 83.56; H
Найдено, %: C 84.04; H 10.83. C24H38O. Вычислено,
10.23. C18H26O. Вычислено, %: C 83.67; H 10.14.
%: C 84.15; H 11.18.
10-экзо-(Пентилокси)гексацикло-
10-экзо-[(Пропан-2-ил)окси]гексацикло-
[9.2.1.02,7.03,5.04,8.09,13]тетрадекан (6). Выход 0.44 г
[9.2.1.02,7.03,5.04,8.09,13]тетрадекан (9). Выход 0.44 г
20
(88%), т.кип. 116-117°С (0.1 мм рт.ст.), n
20 1.5345.
(88%), т.кип. 93-95°С (0.1 мм рт.ст.), n
1.5356.
ИК спектр, ν, см-1: 3053, 2955, 1462, 1354, 1099,
ИК спектр, ν, см-1: 3052, 2965, 1462, 1332, 1083,
809. Спектр ЯМР 1H, δ, м.д.: 0.90-0.93 м (4Н), 0.98
808. Спектр ЯМР 1H, δ, м.д.: 1.00-1.01 м (1Н), 1.04-
т (1Н, 1J 4.8, 2J 5.2 Гц), 1.06 т (1Н, 1J 5.2, 2J 4.8 Гц),
1.07 м (1Н), 1.13-1.18 м (9Н), 1.28-1.34 м (3Н),
3.51 с (1Н), 1.14-1.18 м (2Н), 1.31-1.35 м (7Н),
1.54-1.62 м (2Н), 1.786 с (1H), 1.89-1.96 м (3H),
1.54-1.61 м (4Н), 1.79 с (1H), 1.89-1.97 м (3H),
2.04-2.08 м (1H), 2.15 д (1H, J 4 Гц), 3.59-3.68 м
2.05-2.08 м (1H), 2.22 д (1Н, J 4 Гц), 3.37-3.40 м
(2Н). Спектр ЯМР 13С, δ, м.д.: 15.01, 15.47, 15.88,
(2Н). Спектр ЯМР 13С, δ, м.д.: 14.08, 14.94, 15.50,
22.63, 23.02, 30.71, 32.68, 33.68, 34.62, 35.48, 36.51,
15.91, 22.59, 28.55, 29.79, 30.61, 32.71, 33.68, 34.62,
40.46, 41.54, 43.56, 45.00, 68.14, 82.58. Масс-спектр,
35.47, 36.45, 40.55, 41.53, 42.94, 44.53, 67.87, 85.43.
m/z (Iотн, %): 244 (36) [M]+, 202 (67), 131 (35), 129
Масс-спектр, m/z (Iотн, %): 272 (88) [M]+, 152 (84),
(36), 124 (37), 117 (50), 105 (32), 91 (100), 79 (52),
129 (48), 117 (56), 95 (54), 91 (100), 82 (53), 79 (58),
57 (75), 43 (34). Найдено, %: C 83.47; H 9.96.
57 (56), 41 (87). Найдено, %: C 83.69; H 10.01.
C17H24O. Вычислено, %: C 83.55; H 9.90.
C18H26O. Вычислено, %: C 83.77; H 10.36.
10-экзо-[(Бутан-2-ил)окси]гексацикло-
10-экзо-(Октилокси)гексацикло-
[9.2.1.02,7.03,5.04,8.09,13]тетрадекан (10). Выход 0.435 г
[9.2.1.02,7.03,5.04,8.09,13]тетрадекан (7). Выход 0.435
(87%), т.кип. 112-114°С (0.1 мм рт.ст.), n
20 1.5320.
20
г (87%), т.кип. 141-143°С
(0.1 мм рт.ст.), n
ИК спектр, ν, см-1: 3051, 2964, 1460, 1358, 1089,
1.5355. ИК спектр, ν, см-1: 3053, 2924, 2853, 1462,
806. Спектр ЯМР 1H, δ, м.д.: 0.90-0.94 м (4Н), 0.99-
1354, 1100, 809, 724. Спектр ЯМР 1H, δ, м.д.: 0.88-
1.05 м (1Н), 1.13-1.15 м (2Н), 1.32-1.34 м (4Н),
0.92 м (4Н), 0.99 т (1Н, 1J 4.8, 2J 5.2 Гц), 1.07 т (1Н,
1.52-1.61 м (5Н), 1.78 с (1H), 1.89-1.97 м (3H),
1J
5.2, 2J 4.8 Гц), 1.14-1.19 м (2Н), 1.30-1.34 м
2.04-2.09 м (1H), 2.15 с (1Н), 3.33-3.38 м (1Н), 3.63
(10Н), 1.54-1.62 м (5Н), 1.80 с (1H), 1.89-1.97 м
с (1Н). Спектр ЯМР 13С, δ, м.д.: 10.26, 15.00, 15.51,
(4H), 2.06-2.08 м (2H), 2.23 д (1Н, J 4.4 Гц), 3.37-
15.89, 20.14, 29.65, 30.65, 32.68, 33.71, 34.62, 35.43,
3.41 м (2Н), 3.51 с (1Н). Спектр ЯМР 13С, δ, м.д.:
36.39, 40.27, 41.53, 43.06, 44.84, 73.24, 82.75. Масс-
14.08, 14.94, 15.50, 15.91, 22.67, 26.36, 29.30, 29.49,
спектр, m/z (Iотн, %): 258 (79) [M]+, 138 (52), 129
30.09, 30.61, 31.85, 32.71, 33.68, 34.62, 35.47, 36.45,
(63), 117 (77), 95 (51), 91 (93), 82 (44), 79 (23), 57
40.55, 41.53, 42.94, 44.53, 67.90, 85.43. Масс-спектр,
(100),
41
(38). Найдено, %: C 83.76; H 10.25.
m/z (Iотн, %): 314 (100) [M]+, 202 (68), 117 (58), 95
C18H26O. Вычислено, %: C 83.67; H 10.14.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
АЛКОГОЛИЗ БИНОРА-S СПИРТАМИ ПОД ДЕЙСТВИЕМ ИОННЫХ ЖИДКОСТЕЙ
681
10-экзо-(Циклогексилокси)гексацикло-
СПИСОК ЛИТЕРАТУРЫ
[9.2.1.02,7.03,5.04,8.09,13]тетрадекан (11). Выход 0.43 г
20
(86%), т.кип. 179-180°С (1 мм рт.ст.), n
1.5312.
1. Koch V.R., Miller L.L., Osteryoung R.A. J. Am. Chem.
ИК спектр, ν, см-1: 2930, 2858, 1731, 1449, 1086,
Soc. 1976, 98, 5277. doi 10.1021/ja00433a037
798. Спектр ЯМР 1H, δ, м.д.: 0.96 т (1Н, 1J 4.8, 2J
2. Qiao K., Deng Y., J. Mol. Catal. A: Chem. 2001, 17, 81.
doi 10.1016/s1381-1169(01)00107-8
5.2 Гц), 1.02 т (1Н, 1J 4.8, 2J 5.2 Гц), 1.11-1.15 м
(2Н), 1.19-1.31 м (8Н), 1.50-1.61 м (4Н), 1.73-1.75
3. Wilkes J.S., Frye J.S., Reynolds G.F. Inorg. Chem.
1983, 22, 3870. doi 10.1021/ic00168a011
м (3H), 1.86-1.93 м (4H), 2.01-2.05 м (2H), 2.13 д
(1Н, J 4 Гц), 3.21-3.24 м (1Н), 3.63 с (1Н). Спектр
4. Xin H., Wu Q., Han M., Wang D., Jin Y. Appl. Catal., A.
2005, 292, 354. doi 10.1016/j.apcata.2005.06.012
ЯМР 13С, δ, м.д.: 15.03, 15.51, 15.90, 24.67, 29.93,
5. Sun X.W., Thao S.Q. Pet. Sci. 2011, 8, 495. doi
30.68, 32.68, 31.16, 33.35, 33.68, 34.62, 35.47, 36.49,
10.1007/s12182-011-0167-4
40.40, 41.56, 43.62, 45.01, 74.91, 82.38. Масс-спектр,
6. Kim D.S., Ahn W.S. Korean J. Chem. Eng. 2003, 20,
m/z (Iотн, %): 284 (30) [M]+, 202 (100), 174 (46), 131
39. doi 10.1007/bf02697182
(30), 117 (42), 105 (29), 91 (68), 79 (39), 55 (65), 41
7. Boon J.A., Levisky J.A., Pflug J.L., Wilkes J.S. J. Org.
(32). Найдено,
%: C
85.04; H
10.01. C20H28O.
Chem. 1986, 51, 480. doi 10.1021/jo00354a013
Вычислено, %: C 84.45; H 9.92.
8. Adams C.J., Earle M.J., Seddon K.R. Chem. Commun.
10-экзо-Хлоргексацикло[9.2.1.02,7.03,5.04,8.09,13]-
1998, 2097. doi 10.1039/a805599h
тетрадекан (12). Выход 0.05 г (10%), т.пл. 38-39°С,
9. Xin-hua Y., Min C., Qi-xun, D., Xiao-nong C. Chem.
38.5-39°С [17]. Спектр ЯМР 1H, δ, м.д.: 0.85-0.91 м
Eng. J. 2009, 146, 266. doi 10.1016/j.cej.2008.09.022
(1H), 0.99-1.01 м (1Н), 1.08 т (1H, J 5.2 Гц), 1.21 т (1H,
10. Adams C.J., Earle M.J., Seddon K.R. Chem. Commun.
J 5.2 Гц), 1.29-1.31 м (1H), 1.34 с (2H), 1.42-1.47 м
1999, 1043. doi 10.1039/a901302d
(1H), 1.66 (1H, J 4.8 Гц), 1.69 д (1H, J 4.8 Гц), 1.72 д
11. Yoo K., Namboodiri V.V., Varma R.S., Smimiotis P.G.
(1H, J 4.8 Гц), 1.77 с (1H), 1.83-1.85 м (1H), 1.91-1.93
J. Catal. 2004, 222, 511. doi 10.1016/j.jcat.2003.11.018
м (1H), 2.05-2.13 м (1Н), 2.40-2.45 м (1Н), 4.12 с (1Н).
12. Zhang J., Huang C., Chen B., Ren P., Pu M. J. Catal.
Спектр ЯМР 13С, δ, м.д.: 14.79, 14.97, 15.86, 32.06,
2007, 249, 261. doi 10.1016/j.jcat.2007.04.019
32.48, 33.81, 34.81, 35.70, 37.85, 40.09, 41.38, 48.03,
13. Rongan X., Rui Z., Xianghai M., Zhichang L.,
48.87, 66.32. Масс-спектр, m/z (Iотн, %): 220 (6) [M]+,
Jiaying M., Chunming X. Pet. Sci. 2011, 8, 219. doi
219 (35), 185 (99), 117 (54), 93 (56), 91 (100), 77
10.1007/s12182-011-0138-9
(38). Найдено,
%: C
76.26; H
7.60; Cl
16.14.
14. Huang M.Y., Wu J.C., Shieu F.S., Lin J.J. Fuel. 2011,
C14H17Cl. Вычислено, %: C 76.18; H 7.76; Cl 16.06.
90, 1012. doi 10.1016/j.fuel.2010.11.041
15. Huang M. Y., Wu J. C., Shieu F. S., Lin J. J. Catal.
БЛАГОДАРНОСТИ
Commun. 2009, 10, 1747. doi 10.1016/j.catcom.2009.05.030
16. Khusnutdinov R.I., Mukminov R.R., Aminov R.I.,
Структурные исследования соединений были
Khalilov L.M., Mesсheryakova E.S., Dzhemilev U.M.
Tetrahedron Lett.
2015,
56,
536. doi
10.1016/
выполнены с использованием уникального обору-
j.tetlet.2014.12.006
дования в Региональном центре коллективного
17. Джемилев У.М., Хуснутдинов Р.И., Муслимов З.С.,
пользования «Агидель».
Толстиков Г.А., Нефедов О.М. Изв. АН СССР. Сер.
хим. 1991, 40, 256. [Dzhemilev U.M., Khusnutdinov R.I.,
ФОНДОВАЯ ПОДДЕРЖКА
Muslimov Z.S, Tolstikov G.A., Nefedov O.M. Russ.
Chem. Bull. 1991, 40, 236.] doi 10.1007/BF00959680
Работа выполнена при финансовой поддержке
18. Хуснутдинов Р.И., Муслимов З.С., Джемилев У.М.,
Российского фонда фундаментальных исследо-
Нефедов О.М. Изв. АН. Сер. хим. 1993, 42, 728.
ваний
(№
17-43-020155 р_а) и стипендии
[Khusnutdinov R.I., Muslimov Z.S, Dzhemilev U.M.,
Президента
Российской Федерации молодым
Nefedov O.M. Russ. Chem. Bull. 1993, 42, 692.] doi
ученым и аспирантам (СП-1601.2018.1).
10.1007/BF00704004
19. Бурдакова Е.С. Дис. …канд. техн. наук. Уфа. 2017.
КОНФЛИКТ ИНТЕРЕСОВ
20. Вайсберг А., Проскауэр Э., Риддик Дж., Тупс Э.
Органические растворители. Физические свойства и
Авторы заявляют об отсутствии конфликта
методы очистки. М.: Иностранной литературы,
интересов.
1958.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
682
АМИНОВ, ХУСНУТДИНОВ
Alcoholysis of Binor-S with Alcohols Under the Action
of Ionic Liquids
R. I. Aminov* and R. I. Khusnutdinov
Institute of Petrochemistry and Catalysis of RAS, 4500075, Russia, Republic of Bashkortostan, Ufa, Prosp. Oktyabrya 141
*e-mail: inklab4@gmail.com
Received July 13, 2018; revised February 10, 2019; accepted February 10, 2018
Inorganic ionic liquids have been first shown to catalyze the alcoholysis reaction of heptacyclo-
[8.4.0.02,12.03,8.04,6.05,9.011,13]tetradecane (heptacyclic dimer of norbornadiene, binor-S) with (by) primary and
secondary alcohols. The reaction occurs under the conditions: 65-100°C for 6-14 h via regioselective cleavage
of the C4-C5 bond in the cyclopropane ring of binor-S to produce 10-exo-alkoxyhexacyclo[9.2.1.02,7.03,5.04,8.09,13]-
tetradecanes in 85-90% yield.
Keywords: alcoholysis, binor-S, alcohols, inorganic ionic liquids, catalysis
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019