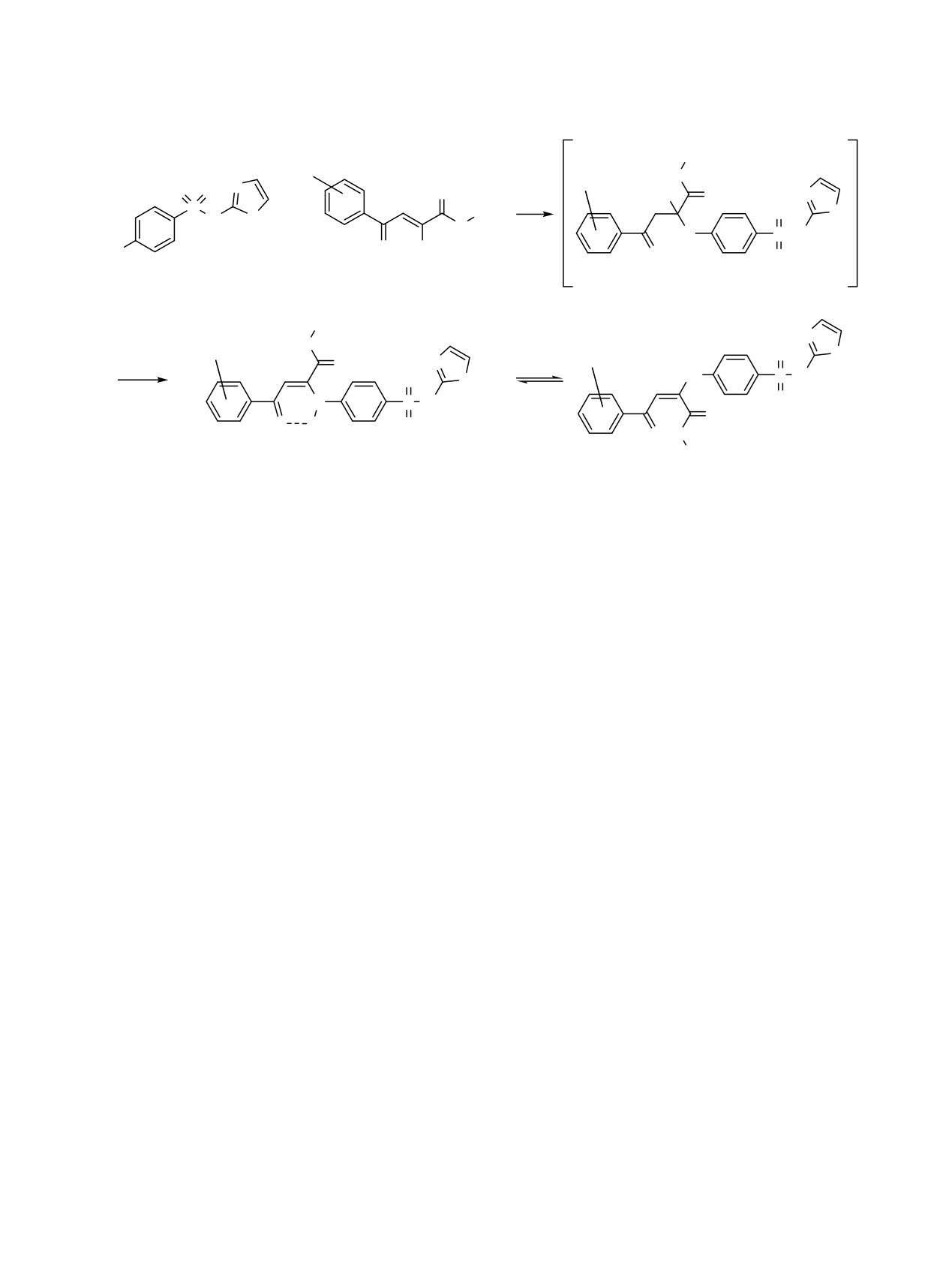ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 5, с. 694-700
УДК 547.551.525.211.1
СИНТЕЗ МЕТИЛ 4-АРИЛ-4-ОКСО-2-{4-[(1,3-ТИАЗОЛ-2-ИЛ)-
СУЛЬФАМОИЛ]ФЕНИЛАМИНО}БУТ-2-ЕНОАТОВ И ИХ
ВЗАИМОДЕЙСТВИЕ С НИНГИДРИНОМ
© 2019 г. В. Л. Гейнa, *, О. В. Бобровскаяa, А. А. Русскихa, М. В. Дмитриевb, А. Н. Янкинc
a ФГБОУ ВО «Пермская государственная фармацевтическая академия», 614990, Россия, г. Пермь, ул. Полевая 2
*e-mail: geinvl48@mail.ru
b ФГБОУ ВО «Пермский государственный национальный исследовательский университет»,
614990, Россия, г. Пермь, ул. Букирева 15
c ФГБОУ ВО «Санкт-Петербургский государственный университет»,
199034, Россия, г. Санкт-Петербург, Университетская набережная 7/9
Поступила в редакцию 13 июня 2018 г.
После доработки 5 марта 2019 г.
Принята к публикации 15 марта 2019 г.
Реакцией метиловых эфиров ароилпировиноградных кислот с 2-(4-аминобензолсульфамидо)тиазолом
(норсульфазолом) в смеси уксусная кислота-этанол в соотношении 1:1 получены метил (2Z)-4-арил-4-
оксо-2-{4-[(1,3-тиазол-2-ил)сульфамоил]фениламино}бут-2-еноаты, при взаимодействии которых с
нингидрином в среде ледяной уксусной кислоты синтезированы
4-ароил-3-{4-[(1,3-тиазол-2-ил)-
сульфамоил]фениламино}спиро[2,5-дигидрофуран-5,2'-индан]-2,1',3'-трионы.
Ключевые слова: метил
(2Z)-4-арил-4-оксо-2-{4-[(1,3-тиазол-2-ил)сульфамоил]фениламино}бут-2-
еноаты, 2-(4-аминобензолсульфамидо)тиазол (норсульфазол), нингидрин, 4-ароил-3-{4-[(1,3-тиазол-2-ил)-
сульфамоил]фениламино}спиро[2,5-дигидрофуран-5,2'-индан]-2,1',3'-трионы, синтез.
DOI: 10.1134/S0514749219050057
Анализ литературных данных показал, что
Также следует отметить, что спирофураноны,
наименее изученными производными ароилпиро-
образующиеся при взаимодействии нингидрина с
виноградных кислот в плане синтетических
метиловыми эфирами ацилпировиноградных
возможностей и биологической активности
кислот, представляют собой полифункциональные
являются метил 4-арил-4-оксо-2-ариламинобут-2-
соединения, которые, как показывает опыт, в
еноаты [1], хотя, как известно, они являются легко
реакции с аминами дают трудноразделяемую смесь
синтезируемыми соединениями [2-8] и удобными
продуктов [16, 17], а в случае взаимодействия
исходными веществами для получения на их
метилового эфира ацетилпировиноградной
основе различных гетероциклических систем [9].
кислоты, нингидрина и метиламина образуется 4-
Известно, что спироциклические соединения
ацетил-2,1',3'-триоксоспиро[2,5-дигидрофуран-5,2'-
представляют собой важный класс природных
индан]-3-олат метиламмония [18].
веществ с высокой биологической активностью
[10, 11]. Спироциклическая система, содержащая в
Ранее были получены метил (2Z)-4-арил-2-[(4-
своем составе фураноновый и циклопентен-1,3-
сульфамоилфенил)амино]-4-оксобут-2-еноаты и их
дионовый фрагмент, входит в состав природных
спирогетероциклические производные [19]. Предс-
соединений класса Pityriarubin C, выделенных из
тавляло интерес синтезировать спирогетероцик-
культур дрожжей рода Malassezia, являющихся
лические соединений фуранонового ряда, содер-
метаболитами и новыми высокоселективными
жащие остаток 2-(4-аминобензолсульфамидо)тиазола
ингибиторами протеинкиназы и дыхательного
(норсульфазола) в положении 3 гетероцикла. Для
процесса, так как могут подавлять высвобождение
этого нами были синтезированы метил (2Z)-4-арил-
активных форм кислорода [12-15].
4-оксо-2-{4-[(1,3-тиазол-2-ил)сульфамоил]фенил-
694
СИНТЕЗ МЕТИЛ 4-АРИЛ-4-ОКСО-2-{4-[(1,3-ТИАЗОЛ-2-ИЛ)СУЛЬФАМОИЛ]-...
695
Схема 1.
CH3
R
O
N
R
O
O
O
HO
O
N
S
O
+
CH3
S
N
S
O
H
HN
S NH
O
OH
H2N
O
O
A
CH3
N
O
R
O
S
O
N
R
NH
S NH
O
S
-H2O
N
S NH
O
O
O
H
O
O O
CH3
Z-1a-f
E-1a-f
R = 4-Cl (1a), Н (1b), 4-Me (1c), 2,4-Cl2 (1d), 4-NO2 (1e), 3-NO2 (1f).
амино}бут-2-еноаты 1а-f и изучено их взаимо-
3447-3097 см-1, сложноэфирной и кетонной
действие с нингидрином с целью синтеза
карбонильных групп (1741-1728 и 1636-1607 см-1),
соединений 2a-d.
группы SO2 при 1376-1309 и 1184-1142 см-1.
Метил
(2Z)-4-арил-4-оксо-2-{4-[(1,3-тиазол-2-
В спектрах ЯМР 1Н соединений 1а-f кроме сигна-
ил)сульфамоил]фениламино}бут-2-еноаты
1а-f
лов ароматических протонов присутствуют синглеты
получены по аналогичной методике [2, 3, 19] при
трех метоксильных протонов
(3.74-3.78 м.д.),
кипячении метиловых эфиров ароилпировиног-
метилиденового протона (6.16-6.61 м.д.), два дублета
радных кислот с 2-(4-аминобензосульфамидо)тиа-
протонов С5Н и С4Н тиазолового цикла в области
золом (норсульфазолом) в течение 10 мин в смеси
6.77-6.80 м.д. и 7.18-7.19 м.д. соответственно (J5,4
уксусная кислота-этанол в соотношении
1:1.
4.55-4.80 Гц), синглеты протонов аминогрупп NНЕ
Синтез соединений 1e, f был описан ранее [3],
(9.83-10.03 м.д.) и NНZ (11.37-11.67 м.д.), уши-
соединения 1a-d получены впервые.
ренный синглет протона SO2NH группы (12.50-
12.54 м.д.).
Вероятно, реакция протекает по механизму,
описанному ранее [2, 4, 8, 19]. На первой стадии
В масс-спектре соединения 1с присутствует пик
ароматическая аминогруппа норсульфазола
молекулярного иона [M + Na]+ с m/z 480 и пики
присоединяется по двойной связи α-карбонильной
фрагментных ионов, подтверждающие указанную
группы исходного метилового эфира
структуру.
ароилпировиноградной кислоты с образованием
По данным спектров ЯМР 1Н, соединения 1а-f
промежуточного соединения А (карбиноламина),
существуют в виде Z- и Е-изомеров с преоб-
дегидратация которого приводит к соединениям 1а
ладанием Z-формы. Исходя из соотношения
-f (схема 1).
значений интегральной интенсивности сигналов
Соединения
1а-f представляют собой ярко-
протона группы NH на Z-форму приходится ~ 90%,
желтые кристаллические вещества, растворимые в
на Е-форму - ~ 10%.
ДМФА, ДМСО, при нагревании
- в этаноле,
Для установления пространственного строения
изопропаноле, диоксане, уксусной кислоте,
соединений 1а-f медленной кристаллизацией из
нерастворимые в воде.
этанола нами был получен монокристалл сое-
В ИК спектрах соединений 1а-f наблюдаются
динения 1d и проведен его рентгеноструктурный
полосы валентных колебаний групп NH в области
анализ (см. рисунок).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
696
ГЕЙН и др.
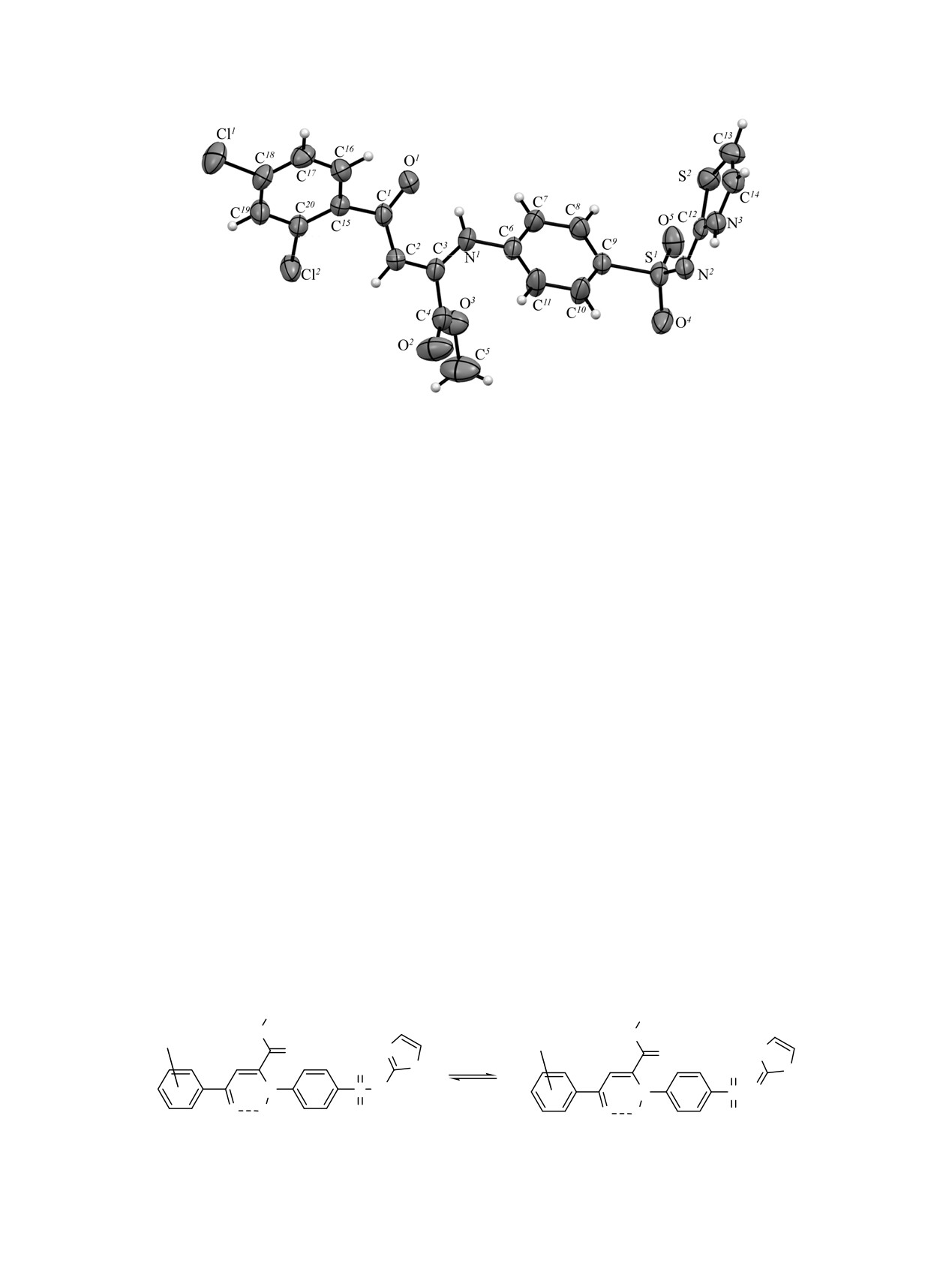
Общий вид молекулы соединения 1d по данным РСА в тепловых эллипсоидах 50%-ной вероятности.
Согласно данным РСА, соединение 1d крис-
фениламино}бут-2-еноатов 1b, d-f по отношению
таллизуется в центросимметричной пространствен-
к нингидрину, нами было установлено, что при
ной группе триклинной сингонии. Длины связей и
кипячении эквимолярных количеств указанных
валентные углы в молекуле лежат в интервалах
веществ в среде ледяной уксусной кислоты в
ожидаемых значений. Енаминокетонный фрагмент
течение
15 мин образуются
4-ароил-3-{4-[(1,3-
O1C1C2C3N1 плоский в пределах 0.01 Å вследствие
тиазол-2-ил)сульфамоил]фениламино}спиро[2,5-
наличия ВВС N1-H1···O1; N1-H1 0.87(3), H1···O1
дигидрофуран-5,2'-индан]-2,1',3'-трионы 2a-d.
2.01(3), N1···O1 2.674(3) Å, угол N1H1O1 133(3)°.
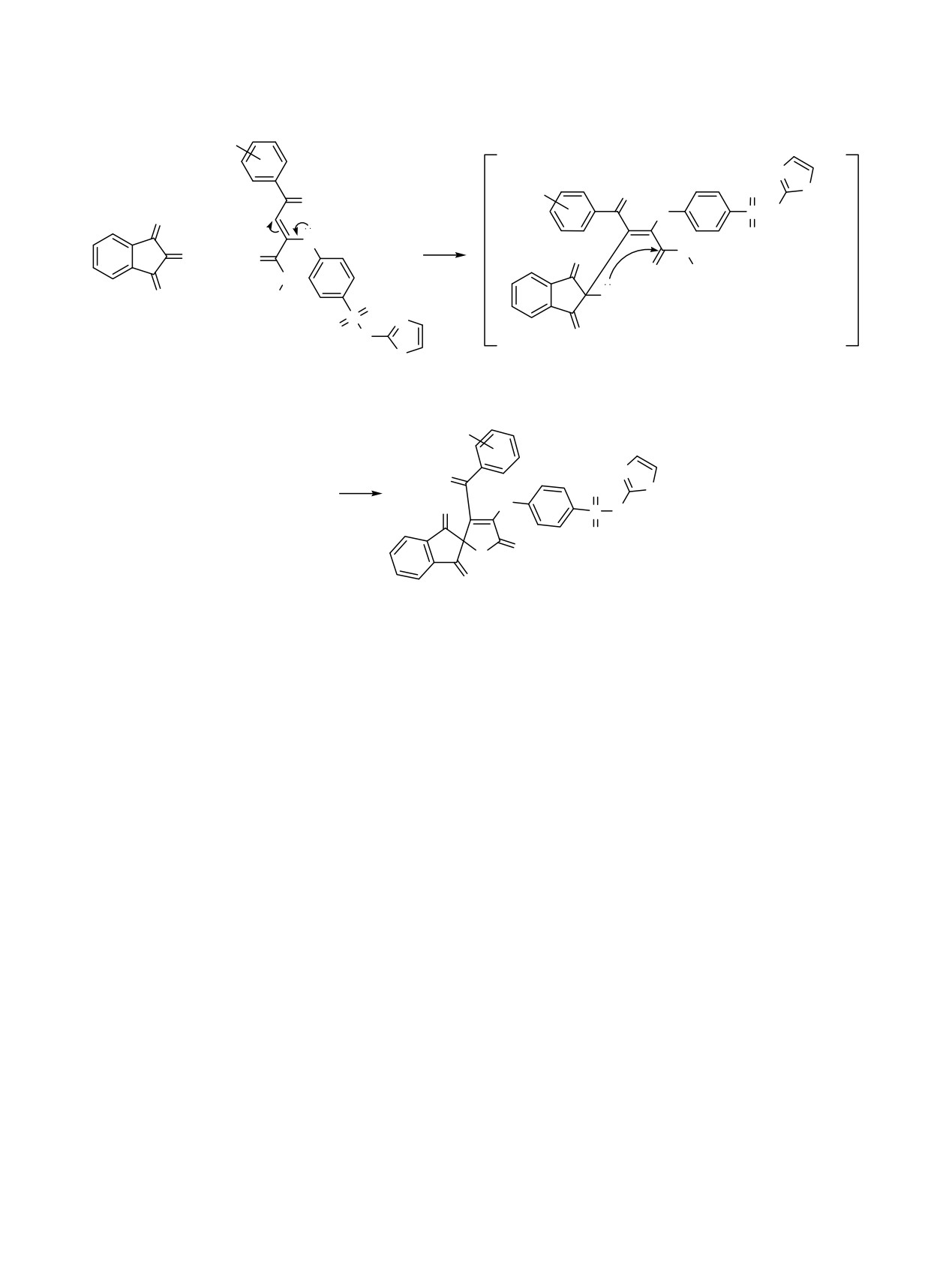
На первой стадии метил (2Z)-4-арил-4-оксо-2-{4
Арильные и сложноэфирный заместители
-[(1,3-тиазол-2-ил)сульфамоил]фениламино}бут-2-
развернуты относительно плоскости O1C1C2C3N1 на
еноаты 1b, d-f присоединяются по двойной связи
35-48°. В кристалле молекулы связаны в
карбонильной группы нингидрина в положении 2 с
центросимметричные димеры посредством МВС
образованием промежуточного соединения D,
N3-H3···N2 [1-x, 1-y, 1-z]; N3-H3 0.84(4), H3···N2
которое циклизуется в соединения 2a-d (схема 3).
2.07(4), N3···N2 2.894(4) Å, угол N3H3N2 165(4)°.
Соединения 2a-d представляют собой красно-
Енаминоэфиры ароилпировиноградных кислот
оранжевые, коричневые или светло-коричневые
1а-f, содержащие
(1,3-тиазол-2-ил)сульфамоиль-
кристаллические вещества, растворимые в ДМСО,
ный фрагмент, могут находиться в двух
ДМФА, при нагревании - в этаноле, пропан-2-оле,
таутомерных формах В и С (схема 2).
уксусной кислоте, диоксане, нерастворимые в
По данным РСА наиболее вероятно сущест-
воде.
вование соединений в кристаллическом состоянии
В ИК спектрах соединений 2a-d наблюдаются
со структурой в форме С, в растворе
- со
полосы валентных колебаний групп NH в области
структурой в форме В.
3447-3296 см-1, лактонной карбонильной группы
Исследуя реакционную способность метил (2Z)-
(1794-1753 см-1), карбонильных групп фрагмента
4-арил-4-оксо-2-{4-[(1,3-тиазол-2-ил)сульфамоил]-
индандиона (1734-1717 см-1), кетонной карбони-
Схема 2.
CH3
CH3
O
O
R
R
O
N
O
NH
O
S
O
S
N
S NH
N
S N
O
H
O
O
H
O
B
C
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
СИНТЕЗ МЕТИЛ 4-АРИЛ-4-ОКСО-2-{4-[(1,3-ТИАЗОЛ-2-ИЛ)СУЛЬФАМОИЛ]-...
697
Схема 3.
R
N
O
S
O
R
O
HN
S NH
O
O
NH
O
O
+
O
O
O
CH3
O
O
H3C
OH
O
S
N
O
HN
O
S
Z-1b, d_f
D
R
N
O
O
S
HN
O
S
NH
O
O
O
O
2a_d
R = 3-NO2 (2a), 4-NO2 (2b), Н (2c), 2,4-Cl2 (2d).
льной группы боковой цепи
(1653-1634 см-1),
стандарт - ТМС. ИК спектры сняты на спектро-
группы SO2 при 1369-1312 и 1180-1139 см-1.
фотометре Specord М-80 и ИК-Фурье спектрометре
IRAffinity-1, фирмы «Shimadzu» (Япония) в KBr.
В спектрах ЯМР 1Н соединений 2a-d присутст-
Масс-спектры высокого разрешения получены на
вуют сигналы ароматических протонов боковой
приборе Bruker micrОTOF. Элементный анализ
цепи в виде мультиплета (6.83-8.05 м.д.), два дублета
проведен на приборе Perkin Elmer
2400.
протонов С5Н и С4Н тиазолового цикла в области
Температуры плавления определены на приборе
6.80-6.84 м.д. и
7.20-7.24 м.д. соответственно
Melting Point М-565.
(J5,4 4.50-4.80 Гц), синглет четырёх ароматических
протонов фрагмента индандиона (8.15-8.17 м.д.),
Рентгеноструктурный анализ соединения
протона аминогруппы NН
(9.83-10.19 м.д.),
(1d) проведен на монокристальном дифрактометре
уширенный синглет протона SO2NH группы (12.45
Xcalibur Ruby с ССD-детектором по стандартной
-12.58 м.д.).
методике (MoKα-излучение, 295(2) K, ω-сканирова-
ние с шагом 1°). Поглощение учтено эмпирически
В масс-спектре соединения 2a присутствует пик
с использованием алгоритма SCALE3 ABSPACK [20].
молекулярного иона [M + Na]+ с m/z 639 и пики фраг-
Сингония кристалла (C20H15Cl2N3O5S2, M 512.37) три-
ментных ионов, подтверждающие указанную
клинная, пространственная группа P-1, a 5.6468(14),
структуру.
b
13.618(2), c
14.5550(19) Å, α
101.763(12), β
Данные спектров соединений 2a-d аналогичны
91.738(15), γ 94.608(17)°, V 1091.0(4) Å3, Z 2, dвыч
таковым, описанным в
[19], строение которых
1.56 г/см3; μ 0.528 мм-1. Структура расшифрована с
доказано с помощью РСА.
помощью программы SHELXS [21] и уточнена
полноматричным МНК по F2 в анизотропном приб-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
лижении для всех неводородных атомов с исполь-
зованием программы SHELXL [22] с графическим
Спектры ЯМР 1H записаны на приборе Bruker
интерфейсом OLEX2 [23]. Атомы водорода групп
AM-300
(300 МГц) в ДМСО-d6, внутренний
NH уточнены независимо в изотропном приб-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
698
ГЕЙН и др.
лижении. При уточнении остальных водородных
m/z: вычислено для С21H19N3O5S2 + Na [M + Na]+
атомов использована модель наездника. Оконча-
480.0658, найдено 480.0633. Найдено, %: С 55.02;
тельные параметры уточнения: R1
0.0536, wR2
Н 4.24; N 9.12; S 14.10. С21H19N3O5S2. Вычислено,
0.1138 [для 3350 отражений с I > 2σ(I)], R1 0.0886,
%: С 55.13; Н 4.19; N 9.18; S 14.02.
wR2 0.1402 (для всех 5041 независимых отраже-
Метил (2Z)-4-оксо-2-{4-[(1,3-тиазол-2-ил)суль-
ний), S 1.039. Результаты РСА зарегистрированы в
фамоил]фениламино}-4-(2,4-дихлорфенил)бут-2-
Кембриджском центре кристаллографических данных
еноат (1d). Выход 3.58 г (70%), т.пл. 131-132°С (EtOH).
под номером CCDC 1843683 и могут быть запрошены
ИК спектр, ν, см-1: 3097 (NН), 1741 (СООСН3), 1614
(С=О), 1376, 1144 (SО2). Спектр ЯМР 1Н (ДМСО-d6),
Метил (2Z)-4-оксо-2-{4-[(1,3-тиазол-2-ил)суль-
δ, м.д.: 3.74 с (3Н, СН3О), 6.16 с (1Н, СН=), 6.80 д
фамоил]фениламино}-4-(4-хлорфенил)бут-2-
(1H, C5Hтиаз, J 4.80 Гц), 7.17-7.80 м (7Наром), 7.18 д (1Н,
еноат (1a). К 2.55 г (0.01 моль) 2-(4-аминобензол-
C4Hтиаз, J 4.80 Гц), 10.03 с (0.1Н, NНЕ-форма), 11.37 с
сульфамидо)тиазола, растворенного при нагревании
(0.9Н, NНZ-форма), 12.54 уш.c (1Н, SO2NH). Найдено, %:
в 15 мл ледяной уксусной кислоты, добавляли 2.40 г
С 46.95; Н 2.93; N 8.16; S 12.57. С20H15Cl2N3O5S2.
(0.01 моль) метилового эфира 4-хлорбензоилпиро-
Вычислено, %: С 46.88; Н 2.95; N 8.20; S 12.52.
виноградной кислоты, растворенного в
15 мл
Соединения 1e, f описаны ранее [3].
этанола. Реакционную смесь кипятили 10 мин.
4-(3-Нитробензоил)-3-{4-[(1,3-тиазол-2-ил)-
Выпавший при охлаждении осадок отфильтро-
сульфамоил]фениламино}спиро[2,5-дигидро-
вывали и перекристаллизовывали из этанола.
фуран-5,2'-индан]-2,1',3'-трион
(2a). К
2.44 г
Выход 3.97 г (83%), т.пл. 158-160°С (EtOH). ИК
(0.005 моль) метил (2Z)-4-(3-нитрофенил)-4-оксо-2-
спектр, ν, см-1: 3422 (NН), 1734 (СООСН3), 1636
{4-[(1,3-тиазол-2-ил)сульфамоил]фениламино}бут-
(С=О), 1309, 1184 (SО2). Спектр ЯМР 1Н (ДМСО-
2-еноата 1f, растворенного при нагревании в 15 мл
d6), δ, м.д.: 3.74 с (3Н, СН3О), 6.54 с (1Н, СН=), 6.77
ледяной уксусной кислоты, добавляли
0.89 г
д (1H, C5Hтиаз, J 4.55 Гц), 7.05-7.97 м (8Наром), 7.19
(0.005 моль) нингидрина, растворенного в 10 мл
д (1Н, C4Hтиаз, J 4.55 Гц), 9.96 с (0.1Н, NНЕ), 11.56 с
ледяной уксусной кислоты. Реакционную смесь
(0.9Н, NНZ), 12.50 уш. c (1Н, SO2NH). Найдено, %:
кипятили 15 мин. Выпавший при охлаждении осадок
С 50.16; Н 3.41; N 8.85; S 13.51. С20H16ClN3O5S2.
отфильтровывали и перекристаллизовывали из этанола.
Вычислено, %: С 50.26; Н 3.37; N 8.79; S 13.42.
Выход 2.31 г (75%), т.пл. 218-220°С (EtOH). ИК
Соединения 1b-f получали аналогично.
спектр, ν, см-1: 3296 (NН), 1788 (СОлакт), 1723 (2СОинд),
1634 (СО), 1350, 1142 (SО2). Спектр ЯМР 1Н (ДМСО-
Метил (2Z)-4-оксо-2-{4-[(1,3-тиазол-2-ил)суль-
d6), δ, м.д.: 6.83 д (1H, C5Hтиаз, J 4.50 Гц), 6.89-8.05 м
фамоил]фениламино}-4-фенилбут-2-еноат
(1b).
(8Наром), 7.23 д (1Н, C4Hтиаз, J 4.50 Гц), 8.17 с (4Нинд),
Выход 3.59 г (81%), т.пл. 191-193°С (EtOH). ИК
10.19 с (1Н, NН), 12.45 уш.c (1Н, SO2NH). Масс-спектр
спектр, ν, см-1: 3447 (NН), 1734 (СООСН3), 1607
HRMS (ESI), m/z: вычислено для С28H16N4O9S2+Na
(С=О), 1325, 1142 (SО2). Спектр ЯМР 1Н (ДМСО-
[M + Na]+ 639.0251, найдено 639.0245. Найдено, %:
d6), δ, м.д.: 3.78 с (3Н, СН3О), 6.61 с (1Н, СН=), 6.80 д
С 54.62; Н 2.67; N 9.05; S 10.33. С28H16N4O9S2.
(1H, C5Hтиаз, J 4.80 Гц), 7.13-7.99 м (9Наром), 7.19 д (1Н,
Вычислено, %: С 54.54; Н 2.62; N 9.09; S 10.40.
C4Hтиаз, J 4.80 Гц), 9.83 с (0.1Н, NНЕ-форма), 11.67 с
(0.9Н, NНZ-форма), 12.50 уш.c (1Н, SO2NH). Найдено,
Соединения 2b-d получали аналогично.
%: С 54.11; Н 3.84; N 9.51; S 14.49. С20H17N3O5S2.
4-(4-Нитробензоил)-3-{4-[(1,3-тиазол-2-ил)су-
Вычислено, %: С 54.16; Н 3.86; N 9.47; S 14.46.
льфамоил]фениламино}спиро[2,5-дигидро-
Метил (2Z)-4-(4-метилфенил)-4-оксо-2-{4-[(1,3-
фуран-5,2'-индан]-2,1',3'-трион (2b). Выход 2.43 г
тиазол-2-ил)сульфамоил]фениламино}бут-2-
(79%), т.пл. 210-212°С (EtOH). ИК спектр, ν, см-1:
еноат (1c). Выход 3.61 г (79%), т.пл. 193-195°С
3447 (NН), 1794 (СОлакт), 1717 (2СОинд), 1653 (СО),
(EtOH). ИК спектр, ν, см-1: 3106 (NН), 1728 (СООСН3),
1321, 1139 (SО2). Спектр ЯМР 1Н (ДМСО-d6), δ,
1619 (С=О), 1316, 1147 (SО2). Спектр ЯМР 1Н
м.д.: 6.80 д (1H, C5Hтиаз, J 4.50 Гц), 6.89-7.89 м
(ДМСО-d6), δ, м.д.: 2.38 с (3Н, СН3) 3.77 с (3Н,
(8Наром), 7.20 д (1Н, C4Hтиаз, J 4.50 Гц), 8.17 с
СН3О), 6.59 с (1Н, СН=), 6.80 д (1H, C5Hтиаз, J 4.65 Гц),
(4Нинд), 10.08 с (1Н, NН), 12.55 уш.c (1Н, SO2NH).
7.11-7.90 м (8Наром), 7.18 д (1Н, C4Hтиаз, J 4.65 Гц),
Найдено, %: С 54.66; Н 2.66; N 9.15; S 10.35.
9.85 с (0.1Н, NНЕ-форма), 11.65 с (0.9Н, NНZ-форма),
С28H16N4O9S2. Вычислено, %: С 54.54; Н 2.62; N
12.52 уш.c (1Н, SO2NH). Масс-спектр HRMS (ESI),
9.09; S 10.40.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
СИНТЕЗ МЕТИЛ 4-АРИЛ-4-ОКСО-2-{4-[(1,3-ТИАЗОЛ-2-ИЛ)СУЛЬФАМОИЛ]-...
699
4-Бензоил-3-{4-[(1,3-тиазол-2-ил)сульфамоил]-
Kovtonogova I.V., Seliverstov G.V., Russkih A.A.,
фениламино}спиро[2,5-дигидрофуран-5,2'-ин-
Belonogova V.D., Anisimova A.G., Yagontseva T.A.
Butlerov Commun. 2016. 48, 26.] doi jbc-02/16-48-12-26
дан]-2,1',3'-трион (2c). Выход 2.35 г (82%), т.пл.
4. Козлов А.П., Варкентин Л.И., Андрейчиков Ю.С.
185-187°С (EtOH). ИК спектр, ν, см-1: 3321 (NН),
ЖОрХ. 1984, 20, 2198.
1753 (СОлакт), 1721 (2СОинд), 1653 (СО), 1369, 1180
5. Козлов А.П., Варкентин Л.И., Андрейчиков Ю.С.
(SО2). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 6.84 д
ЖОрХ. 1989, 25, 1991.
(1H, C5Hтиаз, J 4.65 Гц), 6.83-7.38 м (9Наром), 7.24 д
6. Андрейчиков Ю.С., Козлов А.П., Тендрякова С.П.,
(1Н, C4Hтиаз, J 4.65 Гц), 8.15 с (4Нинд.), 9.83 с (1Н,
Налимова Ю.А. ЖОрХ. 1977, 13, 2559.
NН), 12.55 уш.c (1Н, SO2NH). Найдено, %: С 58.72;
7. Козлов А.П. Автореф. дис. … докт. хим. наук.
Н 2.97; N 7.42; S 11.18. С28H17N3O7S2. Вычислено,
Саратов. 1996.
%: С 58.84; Н 3.00; N 7.35; S 11.22.
8. Андрейчиков Ю.С., Козлов А.П., Токмакова Т.Н.,
3-{4-[(1,3-Тиазол-2-ил)сульфамоил]фенил-
Тендрякова С.П. ЖОрХ. 1978, 14, 163.
амино}-4-(2,4-дихлорбензоил)спиро[2,5-дигидро-
9. Дубовцев А.Ю. Автореф. дис
канд. хим. наук.
фуран-5,2'-индан]-2,1',3'-трион (2d). Выход 2.53 г
Пермь. 2017.
(79%), т.пл. 234-236°С (EtOH). ИК спектр, ν, см-1:
10. Mahdavinia G.H., Mohammadizadeh M.R., Ariapour N.,
3323 (NН), 1784 (СОлакт), 1734 (2СОинд), 1653 (СО),
Alborz M. Tetrahedron Lett. 2014, 55, 1967. doi
1312, 1152 (SО2). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
10.1016/j.tetlet.2013.10.156
6.83 д (1H, C5Hтиаз, J 4.80 Гц), 6.89-7.73 м (7Наром),
11. Han Y., Wu Q., Sun J., Yan C.-G. Tetrahedron. 2012,
7.22 д (1Н, C4Hтиаз, J 4.80 Гц), 8.16 с (4Нинд), 10.09 с
68, 8539. doi 10.1016/j.tet.2012.08.030
(1Н, NН), 12.58 уш.c (1Н, SO2NH). Найдено, %: С
12. Barbier V., Couty F., David O.R.P. Tetrahedron. 2016,
52.64; Н 2.31; N 6.62; S 10.08. С28H15Cl2N3O7S2.
72, 5646. doi 10.1016/j.tet.2016.07.072
Вычислено, %: С 52.51; Н 2.36; N 6.56; S 10.01.
13. Kramer H.J., Kessler D., Hipler U.C., Irlinger B., Hort W.,
Bodeker R.H., Steglich W., Mayser P. Chembiochem.
2005, 6, 2290. doi 10.1002/cbic.200500163
БЛАГОДАРНОСТИ
14. Malassezia and the Skin. Science and Clinical Practice.
Eds T. Boekhout, E. Guého-Kellermann, P. Mayser,
Исследования проведены с использованием
A. Velegraki. Berlin, Heidelberg: Springer-Verlag, 2010.
оборудования ресурсных центров Научного парка
15. VI. Human and Animal Relationships.
2nd Ed.
СПбГУ «Ресурсный Образовательный Центр по нап-
Eds A.A. Brakhage, P. Fzipfel. Berlin, Heidelberg:
равлению химия», «Методы анализа состава вещест-
Springer-Verlag, 2008.
ва» и «Магнитно-резонансные методы исследования».
16. Гейн В.Л., Гейн Л.Ф., Шептуха М.А., Воронина Э.В.
Хим.-фарм. ж. 2005, 39, 30. [Gein V.L., Gein L.F.,
КОНФЛИКТ ИНТЕРЕСОВ
Sheptukha M.A., Voronina E.V. Pharm. Chem. J. 2005,
39, 537.] doi 10.1007/s11094-006-0016-8
Авторы заявляют об отсутствии конфликта
17. Гейн Л.Ф. Автореф. дис. … докт. фарм. наук. Пермь.
интересов.
2009.
18. Гейн В.Л., Гейн Л.Ф., Кузнецова Е.Д., Алиев З.Г.
СПИСОК ЛИТЕРАТУРЫ
ХГС. 2005, 288. [Gein V.L., Gein L.F., Kuznetsova E.D.,
Aliev Z.G. Chem. Heterocycl. Compd. 2005, 41, 255.]
1. Перевалов С.Г., Бургарт Я.В., Салоутин В.И.,
doi 10.1007/s10593-005-0137-0
Чупахин О.Н. Усп. хим. 2001, 70, 1039. [Perevalov S.G.,
19. Гейн В.Л., Бобровская О.В., Дмитриев М.В. ЖОрХ.
Burgart Ya.V., Saloutin V.I., Chupakhin O.N.
2017, 53, 881. [Gein V.L., Bobrovskaya O.V., Dmit-
Russ. Chem. Rev.
2001,
70,
921.] doi
10.1070/
riev M.V. Russ. J. Org. Chem. 2017, 53, 898.] doi
RC2001v070n11ABEH000685
10.1134/S1070428017060148
2. Гейн В.Л., Бобровская О.В., Ковтоногова И.В.,
20. CrysAlisPro, Agilent Technologies, Version 1.171.37.33
Белоногова В.Д., Данилов Ю.Л., Насакин О.Е.,
(release 27-03-2014 CrysAlis171.NET).
Казанцева М.И. ЖОрХ. 2016, 52, 1771. [Gein V.L.,
Bobrovskaya O.V., Kovtonogova I.V., Belonogova V.D.,
21. Sheldrick G.M. Acta Cryst.
2008, A64,
112. doi
Danilov Yu.L., Nasakin O.E., Kazantseva M.I. Russ. J.
10.1107/S0108767307043930
Org. Chem. 2016, 52, 1764.] doi 10.1134/S1070428016120083
22. Sheldrick G.M. Acta Cryst. 2015, C71, 3. doi 10.1107/
3. Гейн В.Л., Бобровская О.В., Ковтоногова И.В.,
S2053229614024218
Селиверстов Г.В., Русских А.А., Белоногова В.Д.,
23. Dolomanov O.V., Bourhis L.J., Gildea R.J,
Анисимова А.Г., Ягонцева Т.А. Бутлеровские
Howard J.A.K., Puschmann H. J. Appl. Cryst.
сообщ. 2016, 48, 26. [Gein V.L., Bobrovskaya O.V.,
2009, 42, 339. doi 10.1107/S0021889808042726
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
700
ГЕЙН и др.
Synhthesis of Methyl 4-Aryl-4-oxo-2-{4-[(1,3-thiazol-2-yl)-
sulfamoyl]phenylamino}but-2-enoates and Their Interaction
with Ninhydrin
V. L. Geina, *, O. V. Bobrovskayaa, A. A. Russkikha, M. V. Dmitrievb, and A. N. Yankinc
a Perm State Pharmaceutical Academy, 614990, Russia, Perm, ul. Polevaya 2
*e-mail: geinvl48@mail.ru
b Perm State National Research University, 614990, Russia, Perm, ul. Bukireva 15
c St. Petersburg State University, 199034, Russia, St. Petersburg, Universitetskaya nab. 7/9
Received June 13, 2018; revised March 05, 2019; accepted March 15, 2019
The reaction of methyl aroylpyruvates with 2-(4-aminobenzenesulfamido)thiazole (norsulfazole) in acetic acid-
ethanol (1:1) afforded methyl (2Z)-4-aryl-4-oxo-2-{4-[(1,3-thiazol-2-yl)sulfamoyl]phenylamino}but-2-enoates
which reacted with ninhydrin in glacial acetic acid to give 4-aroyl-3-{4-[(1,3-thiazol-2-yl)sulfamoyl]-
phenylamino}spiro[2,5-dihydrofuran-5,2'-indane]-2,1',3'-triones.
Keywords: methyl
(2Z)-4-aryl-4-oxo-2-{4-[(1,3-thiazol-2-yl)sulfamoyl]phenylamino}but-2-enoates,
2-(4-
aminobenzenesulfamido)thiazole (norsulfazole), ninhydrin,
4-aroyl-3-{4-[(1,3-thiazol-2-yl)sulfamoyl]-
phenylamino}spiro[2,5-dihydrofuran-5,2'-indane]-2,1',3'-triones, synthesis
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019