ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 5, с. 701-708
УДК 547.655.6
О РЕАКЦИИ 2-БЕНЗИЛАМИНО-1,4-НАФТОХИНОНОВ
С НИТРОЗИЛСЕРНОЙ КИСЛОТОЙ
© 2019 г. Л. М. Горностаевa, *, Э. В. Нуретдиноваa, Т. И. Лавриковаa, Ю. Г. Халявинаa,
О. И. Фоминыхa, Ю. В. Гатиловb, c
a ФГБОУ ВО «Красноярский государственный педагогический университет им. В.П. Астафьева»,
660049, Россия, г. Красноярск, ул. А. Лебедевой 89
*e-mail: gornostaev@kspu.ru
b ФГБУН «Новосибирский институт органической химии им. Н.Н. Ворожцова СО РАН»,
630090, Россия, г. Новосибирск, пр. Академика Лаврентьева 9
c ФГБОУ ВО «Новосибирский государственный университет»,630090, Россия, г. Новосибирск, ул. Пирогова 2
Поступила в редакцию 12 октября 2018 г.
После доработки 10 декабря 2018 г.
Принята к публикации 20 декабря 2018 г.
Реакция 2-бензиламино-1,4-нафтохинона с нитрозилсерной кислотой в уксусной кислоте приводит к
главным продуктам 2,1- и 2,3-гетероциклизаций - (Е)-4-(гидроксиимино)-2-фенилнафто[2,1-d]оксазол-5-
(4H)-ону и
2-фенил-1-гидрокси-1H-нафто[2,3-d]имидазол-4,9-диону. Кроме того, в ходе реакции
получаются также 2-фенилнафто[2,1-d]оксазол-4,5-дион и N-(3-нитро-1,4-диоксо-1,4-дигидронафталин-2
-ил)бензамид. Соотношение образующихся продуктов зависит от температуры. В результате реакции 2-
бензиламино-3-хлор-1,4-нафтохинона с нитрозилсерной кислотой в уксусной кислоте образуются 1,4-
нафтохинон-2,3-диазид и бензальдегид.
Ключевые слова: 2-бензиламино-1,4-нафтохинон, гидроксиимидазол, нафто-1,2-оксазол, оксимы, 1,4-
нафтохинон-2,3-диазид, нитрозилсерная кислота.
DOI: 10.1134/S0514749219050069
2-Амино-1,4-нафтохиноны обладают различными
В то же время, в результате обработки 2-бензил-
видами биологической активности [1-3]. Вызывают
амино- и 2-алкиламино-1,4-нафтохинонов (4a-g)
интерес также различные азотистые гетероцикли-
нитрующей смесью в уксусной кислоте в качестве
ческие производные, получаемые на основе
2-
главных продуктов получаются 2-R-1-гидрокси-1Н
амино-1,4-нафтохинонов. Например, на основе 2-
-нафто[2,3-d]имидазол-4,9-дионы
(7a-g)
[10,
11]
ацетиламино-3-хлор-1,4-нафтохинона в результате
(схема 3).
замещения атома хлора аминами и последующей
Отношение 2-бензиламино-1,4-нафтохинонов к
циклизации получены 1,2-замещенные 1H-нафто-
нитрозилсерной кислоте ранее не изучалось. Нами
[2,3-d]имидазол-4,9-дионы [4]. Подобные конден-
установлено, что
2-бензиламино-1,4-нафтохинон
сированные имидазолы обладают противоопу-
(4e) под действием нитрозилсерной кислоты в
холевой активностью [5, 6]. Из 2-алкиламино-3-
уксусной кислоте превращается в ряд продуктов
хлор-1,4-нафтохинонов (1) получены 1-алкил-4,9-
7-10, представленных на схеме 4.
диоксо-1H-нафто[2,3-d][1,2,3]триазол-2-оксиды (2),
а также их оксимы 3, которые проявляют высокую
В этих условиях, как и в случае обработки 2-
бензиламино-1,4-нафтохинона
(4e) нитрующей
цитотоксическую активность [7, 8] (схема 1).
смесью, главным продуктом реакции является 2-
Ранее было найдено, что
2-алкиламино-1,4-
фенил-1-гидрокси-1H-нафто[2,3-d]имидазол-4,9-
нафтохиноны (4a-d) под действием нитрозилсер-
дион (7e), а не 2-алкилнафто[2,1-d][1,3]оксазол-4,5-
ной кислоты образуют 2-алкилнафто[2,1-d][1,3]-
дион 4-оксим (8) (ср. схема 2). Полагаем, что
оксазол-4,5-дион
4-оксимы
(6a-d) с высоким
превращения 2-бензиламино-1,4-нафтохинона (4e),
выходом [9] (схема 2).
представленные на схеме 4, протекают по катион-
701
702
ГОРНОСТАЕВ и др.
Схема 1.
O
O
O
O
N
O
N
H
N
N
N
R
R
R
NaNO2
NaN3
AcOH
EtOH/DMF
Cl
Cl
N3
O
O
O
1
O
O
R
R
N
N
t
HONH2HCl
N+
O-
N+
O-
C6H6
C5H5N, 115°C
N
N
O
N
OH
2
3
R = Me, Bu, Bn.
Схема 2.
R
R
R
O
O
O
N
N
NaNO2 / H2SO4
N
H
''O''
H
AcOH, 20_22oC
OH
N
O
O
O
4a-d
5
6a-d
(78_87%)
R = Me, Et, Pr, i-Pr.
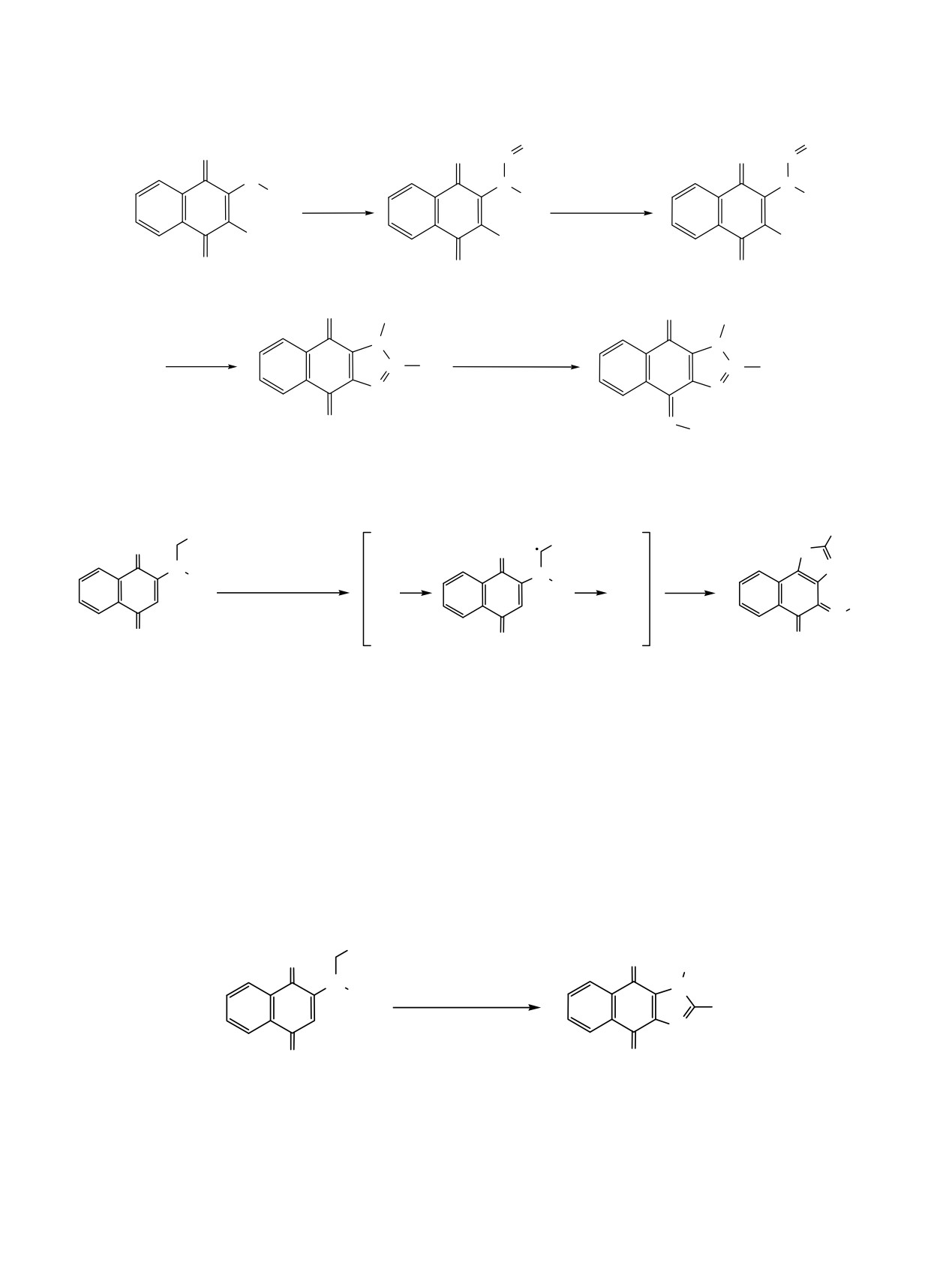
радикальному механизму с участием интерме-
Мы установили, что
2-фенил-1-гидрокси-1H-
диатов 11a-d (схема 5). По-видимому, бóльшая
нафто[2,3-d]имидазол-4,9-дион (7e) и (Е)-4-(гид-
устойчивость радикала 11d (схема 5) по сравнению
роксиимино)-2-фенилнафто[2,1-d]оксазол-5(4H)-он
с радикалом 5 (схема 2) предопределяет изменения
(8) образуются с высоким суммарным выходом при
в направлении реагирования
2-бензиламино-1,4-
обработке 2-бензиламино-1,4-нафтохинона (4e) нитро-
нафтохинона (4e) и 2-алкиламино-1,4-нафтохино-
зилсерной кислотой при температуре
10-12°С.
нов (4a-d).
Обработка гидроксиимидазола 7e или оксазола 8
Схема 3.
R
O
O
OH
N
HNO3 + H2SO4
N
H
R
AcOH, 20_22oC
N
O
O
4a_g
7a_g
(54_74%)
R = Me, Et, Pr, i-Pr, Ph, 4-Me-Ph, 4-Cl-Ph.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
О РЕАКЦИИ 2-БЕНЗИЛАМИНО-1,4-НАФТОХИНОНОВ С НИТРОЗИЛСЕРНОЙ КИСЛОТОЙ
703
Схема 4.
O
O
OH
O
H
N
N
N
NOHSO
4
+
AcOH
N
N OH
O
O
O
4e
7e
8
49% (10oC), 45% (50oC)
40% (10oC), 15% (50oC)
O
O
H
N
N
+
+
O
O
NO2
O
O
9
10
23% (50oC)
5% (50oC)
серной кислотой в среде уксусной кислоты при
обработке 2-бензиламино-1,4-нафтохинона (4e) нит-
температуре 20-60°С не приводит к их взаимо-
розилсерной кислотой при температуре 40-50°С
превращениям. Следовательно, гидроксиимидазол
наряду с веществами 7e и 8 образуются небольшие
7e и оксазол 8 образуются из интермедиатов 11
количества
2-фенилнафто[2,1-d]оксазол-4,5-диона
параллельно по независимым маршрутам. При
(9) и N-(3-нитро-1,4-диоксо-1,4-дигидронафталин-2
Схема 5.
O
H
H
O
H
O
N
N
N
NOHSO4
NO
AcOH
N O
H
O
O
O
4e
11a
11b
O
OH
N
N
O
H
O H
O
N
N
7e
H2SO4
AcOH
N O
N O
O
O
O
N
11c
11d
N OH
O
8
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
704
ГОРНОСТАЕВ и др.
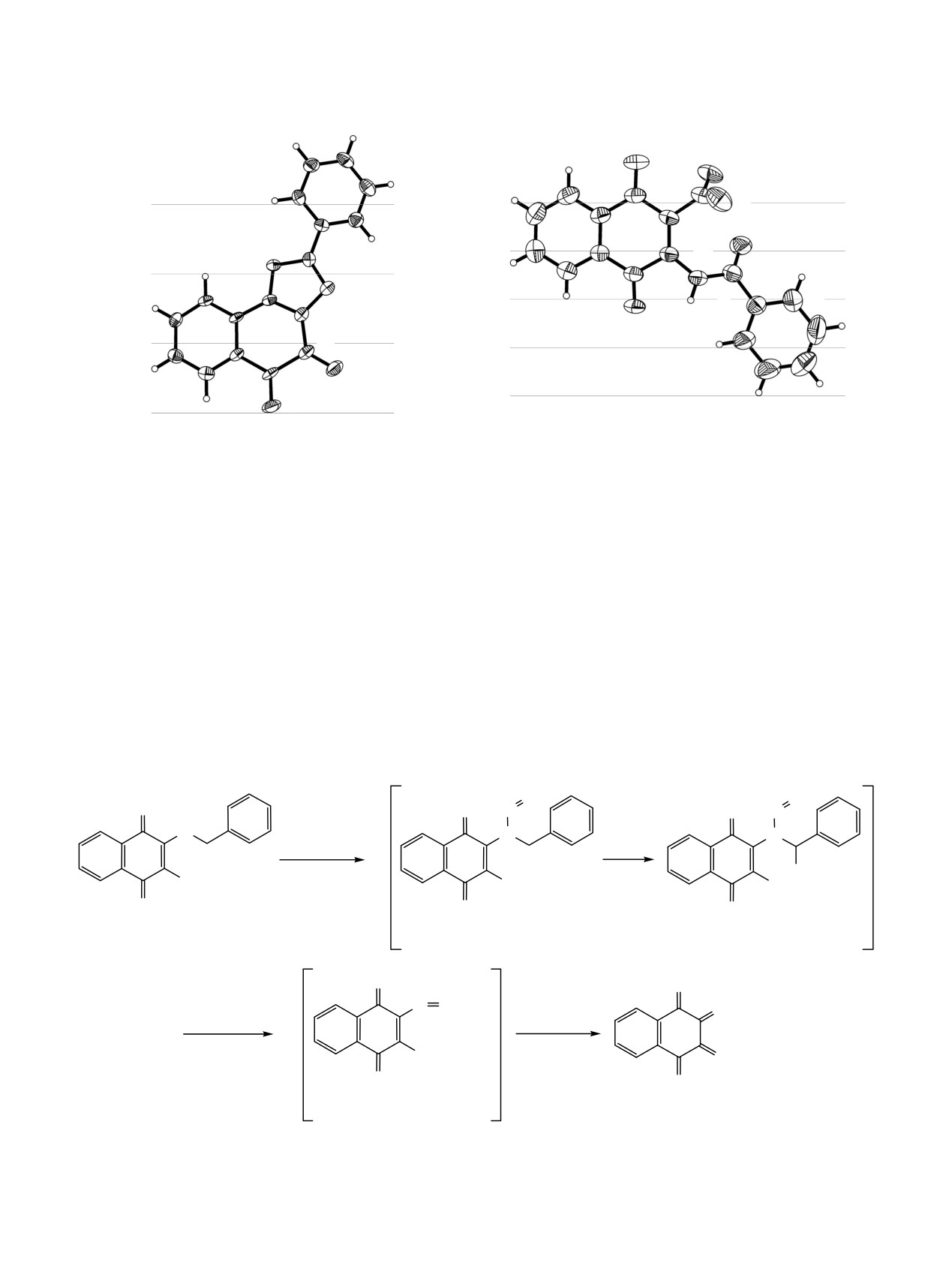
a
b
O2
O4
C5
O5
C10
C11
N2
O3
O1
C2
C1
N1
C2
N3
C10
C9
C9
C11
O1
C4
O2
O3
Структура 2-фенилнафто[2,1-d]оксазол-4,5-диона (9) (a) и N-(3-нитро-1,4-диоксо-1,4-дигидронафталин-2-ил)бензамида (10)
(b) по данным РСА (представлены 50% тепловые эллипсоиды).
-ил)бензамида (10). Эти вещества не получаются
метил-6-метоксинафто[1,2-b]фуран-4,5-дионе [12].
при действии на гидроксиимидазол 7e или оксазол 8
Угол между плоскостями остова и фенила равен
серной кислотой в среде уксусной кислоты. По-ви-
14.5(3)°. Длины связей молекулы 10 близки к ана-
димому, веществами 9-10 образуются непосредст-
логичным длинам в молекуле N-(1,4-диоксо-1,4-
венно из предшественников 11 или азолов 7e и 8
дигидронафталин-2-ил)бензамида
[13]. Нитро и
при действии на них оксидов азота при повышен-
амидная группы вывернуты из плоскости нафта-
ной температуре (50°С).
ленового остова. Соответствующие межплоскост-
ные углы равны 62.4(1) и 30.7(1)°. В отсутствии нитро-
Продукты этих реакций были охарактеризованы
группы [13] амидная группа лежит практически в
различными спектроскопическими методами, а
плоскости остова (угол 4.0°).
также рентгеноструктурным анализом. Кристал-
лические структуры 9 и 10 показаны на рисунке.
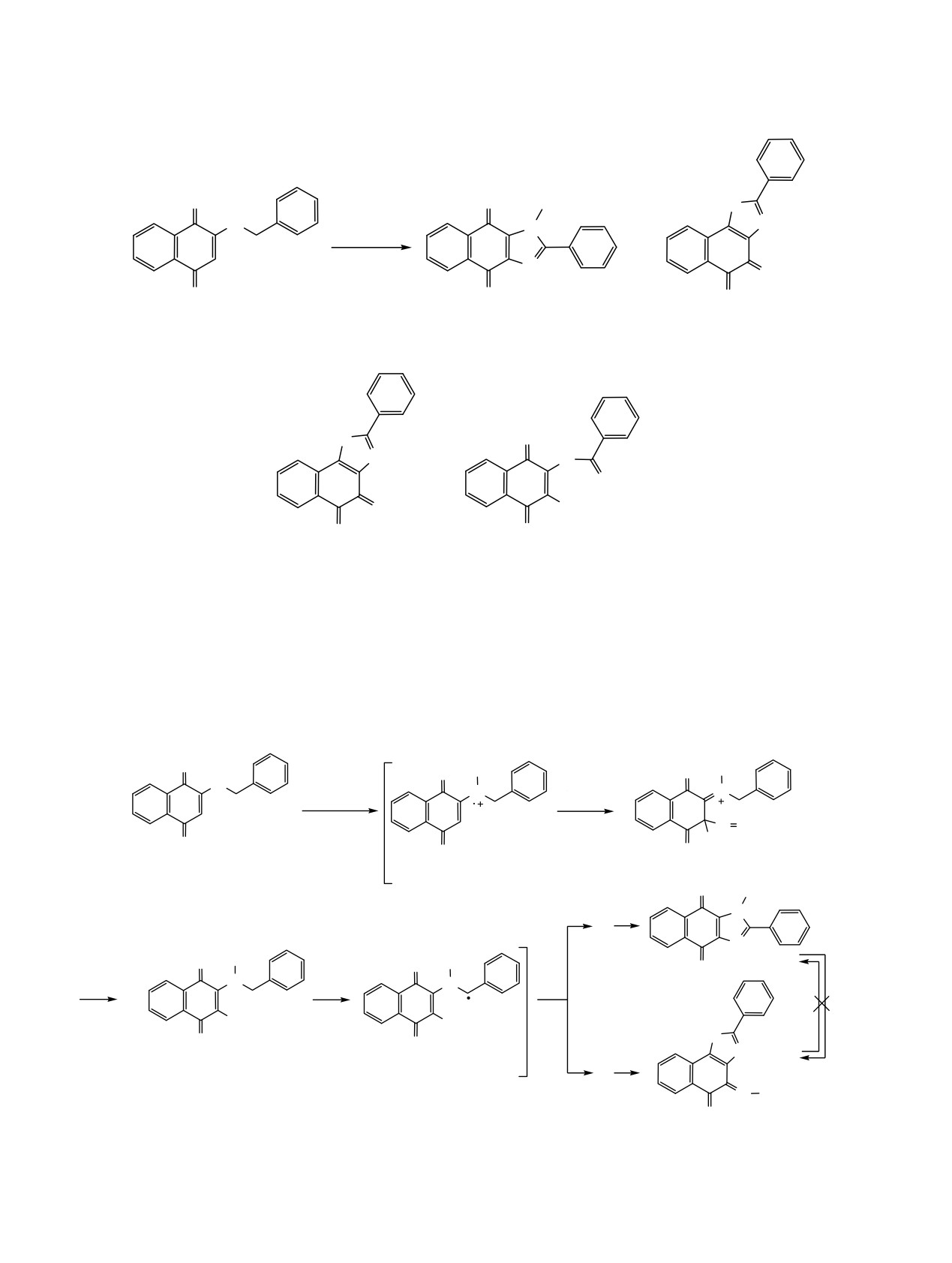
2-Бензиламино-3-хлор-1,4-нафтохинон (12) ведет
Длины связей нафталендионового фрагмента
себя по отношению к нитрозилсерной кислоте
молекулы 9 близки к аналогичным длинам в 2-
иначе. Мы установили, что продуктом реакции
Схема 6.
O
O
O
O
N
O
N
H
N
N
N
NOHSO4
"O"
AcOH, 40oC
OH
Cl
Cl
Cl
O
O
O
12
13a
13b
O
O
N
N OH
N2
H2O
_C6H5COH
H2SO4
Cl
O
O
O
13c
14
(87%)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
О РЕАКЦИИ 2-БЕНЗИЛАМИНО-1,4-НАФТОХИНОНОВ С НИТРОЗИЛСЕРНОЙ КИСЛОТОЙ
705
является 3-диазанафталин-1,2,4(3H)-трион (14). В
масс m/z 50-3000. Использовался шприцевой ввод
качестве побочного продукта этой реакции был
вещества для растворов в ацетонитриле, скорость
выделен бензальдегид с выходом 76%. Учитывая
потока 3 мкл/мин. Газ-распылитель - азот (4 л/
эти данные можно предположить следующий
мин), температура интерфейса 180°С. Элементный
механизм образования хинондиазида
14, вклю-
анализ выполнен на приборе EURO EA 3000. Темпе-
чающий окисление N-нитрозосоединения до
ратуры плавления определены на микронагрева-
спирта оксидами азота (схема 6).
тельном столике Boetius. Ход реакций и чистоту
соединений контролировали методом ТСХ на плас-
Заметим, что другие 2-алкиламино-3-хлор-1,4-
тинах Silufol UV-254 (элюент толуол-ацетон, 4:1).
нафтохиноны при обработке нитрозилсерной
кислотой в уксусной кислоте в таких условиях
Рентгеноструктурное исследование соединений
(~40°С) оставались неизменными. Эти наблюдения
9-10 проведено с использованием дифрактометра
могут свидетельствовать о том, что для 1,2-аннели-
Bruker Kappa Apex II (MoKα-излучение, графито-
рования оксазольного цикла или
2,3-аннелиро-
вый монохроматор). Все расчеты выполнены с
вания гидроксиимидазольного цикла в молекулах 2
помощью комплекса программ SHELX97. Атомы
-R-амино-1,4-нафтохинонов
(4a-g) положение
3
водорода уточнены в модели наездника. Атом
должно быть свободно (см. схемы 2-4).
водорода амидной группы соединения
10
локализован из разностного синтеза и уточнен
По-видимому, 2-бензиламино-3-хлор-1,4-нафто-
изотропно с ограничением на длину связи.
хинон (12) превращается в хинондиазид 14 по
Поправка на поглощение учтена с помощью
маршруту, включающему N-нитрозирование и
программы SADABS. Кристаллографические
последующее окисление метиленовой группы.
данные депонированы в Кембриджскую базу
Далее образующийся N-нитрозамин 13b отщепляет
структурных данных (CCDC 1853605 и 1853606
молекулу бензальдегида, а получающийся при
для 9 и 10 соответственно) и доступны по запросу,
этом 3-хлор-2-диазогидрат 13с гидролизуется до
хинондиазида 14. Отетим, что первым удобным
аминонафтохиноны 4e и 12 были получены по
способом получения хинондиазида
14 является
методикам описанным ранее [18, 19].
взаимодействие 2-амино-3-хлор-1,4-нафтохинонов
с нитрозилсерной кислотой, описанное Мосби [14];
Общая методика взаимодействия 2-бензил-
в работах
[15-16] приводятся другие способы
амино-1,4-нафтохинона (4e) и 2-бензиламино-3-
получения хинондиазида.
хлор-1,4-нафтохинона
(12) с нирозилсерной
кислотой. а. Суспензию 1.32 г 2-бензиламино-1,4-
Таким образом, установлено, что 2-бензиламино-
нафтохинона (4e) (5 ммоль) в CH3COOH (25 мл)
1,4-нафтохинон и 2-бензиламино-3-хлор-1,4-нафто-
охладили до 20°С и при перемешивании прибавили
хинон по-разному реагируют с нитрозилсерной
в течение 10 мин нитрозилсерную кислоту, приго-
кислотой в уксусной кислоте, хотя, возможно, общим
товленную из NaNO3 (0.80 г) и 92% H2SO4 (8 мл).
для этих процессов является повышенная актив-
При этом реакционная смесь нагрелась до 50°С.
ность метиленовой группы бензильного остатка.
После выдержки при этой температуре в течение
одного часа реакционную смесь охладили до 20°С
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
и вылили на 500 г льда с водой. Выпавший осадок
Спектры ЯМР
1Н и
13С записывали на
оранжевого цвета отфильтровали, промыли водой,
спектрометре Bruker DRX (500 и 125 МГц) в
высушили. Полученный осадок массой 1.22 г внесли
ДМСО-d6, внутренний стандарт Ме4Si. УФ спектры
в 40 мл хлороформа и кипятили 20 мин. Затем
регистрировали на приборе Evolution 300 (кюветы
охладили до 20°С и отфильтровали. Осадок на
10 мм) в толуоле при толщине слоя
1 см и
фильтре является практически чистым 2-фенил-1-
концентрации 10-4 моль/л. ИК спектр для соединения
гидрокси-1H-нафто-[2,3-d]имидазол-4,9-дионом
14 получен на спектрофотометре Nicolet iN10.
(7e). Выход 0.60 г (45.3%). Фильтрат разделили на
Масс-спектры регистрировали на приборе Finnigan
силикагеле (элюент - хлороформ). При этом выде-
MAT 8200 (ЭУ, 70 эВ). Масс-спектры высокого
лили 0.20 г (Е)-4-(гидроксиимино)-2-фенилнафто-
разрешения для соединений 10, 14 записаны на
[2,1-d]окса-зол-5(4H)-она
(8)
(15.2%),
0.30 г
2-
приборе Bruker microOTOF II при положительной
фенилнафто[2,1-d]оксазол-4,5-диона (9) (22.7%) и
ионизации электро-распылением (напряжение на
0.07 г N-(3-нитро-1,4-диоксо-1,4-дигидронафталин-
капилляре 4500 В) [17]. Диапазон сканирования
2-ил)бензамида (10) (5.3%).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
706
ГОРНОСТАЕВ и др.
b. Взаимодействие 1.32 г (5 ммоль) 2-бензиламино-
(1С, C5), 160.90 (1С, C2), 146.81 (1С, C9b), 141.83
1,4-нафтохинона (4e) в CH3COOH (30 мл) с нитро-
(1С, C4), 134.91 (1С, C8), 131.42 (1С, C4'), 129.61
зилсерной кислотой, приготовленной из NaNO2
(1С, C1'), 129.50 (1С, C9a), 129.31 (1С, C7), 129.26
(0.80 г) и 92% H2SO4 (8 мл) в течение 10 мин при
(2С, C3'), 128.48 (1С, C6), 126.59 (2С, C2'), 126.43
внешнем охлаждении (10-12°С) и перемешивании в
(1С, C3a), 126.12 (1С, C5a), 121.56 (1С, C9). Масс-
течение 20 мин с последующей обработкой аналогич-
спектр, m/z (Iотн, %): 290 (30.83) [М]+, 274 (2.90),
но предыдущему опыту приводит к 0.64 г гидрокси-
158 (5.31), 129 (7.71), 114 (11.31), 106 (10.81), 105
имидазола 7e (48.5%) и 0.53 г оксазола 8 (40.2%).
(100), 103 (10.11), 102 (5.01), 101 (13.01), 77 (21.52),
76 (8.91), 75 (6.51), 30 (6.51). Найдено, %: С 70.48.;
c. Внесли 5.95 г (20 ммоль) 2-бензиламино-3-
Н 3.47; N 9.20. С17Н10N2O3. Вычислено, %: С 70.34;
хлор-1,4-нафтохинона (12) в CH3COOH (100 мл) и
Н 3.47; N 9.65. M 290.28.
к полученной суспензии при перемешивании
прибавили нитрозилсерную кислоту, приготов-
2-Фенилнафто[2,1-d]оксазол-4,5-дион
(9).
ленную из NaNO2 (3 г) и 94% H2SO4 (30 мл).
Выход 0.30 г (22.7%); т.пл. 138-140°С. УФ спектр
Реакционная смесь разогревалась до 40-45°С и
(толуол), λмакс (lgε), нм:
296
(4.25),
438
(3.08).
перемешивалась при этой температуре в течение
Спектр ЯМР 1Н, δ, м.д.: 8.21-8.19 м (2H, H2',6'), 8.03
2 часов. Цвет раствора при этом изменился с
д (1H, H6, J 7.2 Гц), 7.96 д (1H, H9, J 7.2 Гц), 7.83
красного до бледно-желтого. Реакционную массу
д.т (1H, H8, J 7.6 Гц), 7.67-7.63 м (4H, H3',4',5',7).
вылили в смесь льда с водой (800 г). Выпавший
Спектр ЯМР 13C, δ, м.д.: 178.83 (1С, C5), 172.35
бледно-желтый осадок отфильтровали, промыли
(1C, C4), 161.50 (1С, C2), 157.53 (1С, C9b), 135.02
водой, высушили. Выход полученного 3-диазанаф-
(1С, C3a), 134.98 (1С, C8), 132.08 (1С, C4'), 130.99
талин-1,2,4(3H)-триона (14) составил 3.5 г (87.5%).
(1С, C7), 130.19 (1C, C1'), 129.58 (1С, C6), 129.44
Фильтрат экстрагировали тремя порциями
(2С, C3',5'), 126.88 (2С, C2',6'), 125.44 (1С, C5a), 125.38
хлороформа по 100 мл. Из полученного экстракта
(1С, C9a), 122.84 (1С, C9). Масс-спектр, m/z (Iотн, %):
после отгонки хлороформа выделили
1.62 г
275 (37.14), 247 (22.02), 172 (6.01), 114 (6.61), 104
бензальдегида (76.4%).
(27.93), 89 (20.72), 88 (41.44), 77 (38.24), 76 (100),
74 (10.21), 63 (20.52), 62 (26.23), 51 (23.22),
50
2-Фенил-1-гидрокси-1Н-нафто[2,3-d]имида-
(33.43). Найдено, %: С 74.63; Н 3.68; N 4.68.
зол-4,9-дион (7e) идентичен продукту, синтезиро-
С17Н9NO3. Вычислено, %: С 74.18; Н 3.30; N 5.09.
ванному ранее [11]. Выход 0.64 г (48.5%) при 10°С и
M 275.26.
0.60 г (45.3%) при 50°С, желто-оранжевые кристаллы;
т.пл. 248-250°С. УФ спектр (толуол), λмакс (lgε), нм:
Кристаллы ромбические, температура 200 K, a
286 (4.39), 343 (3.60), 544 (3.19). Спектр ЯМР 1Н, δ,
24.505(8), b 6.881(3), c 7.350(4) Å, Z 4, пространст-
м.д.: 7.55-7.63 м (3Н, Н3',4',5'), 7.86 c (1Н, Н5(8)), 7.85
венная группа Pca21, dвыч 1.475 г/см3, µ 0.103 мм-1,
c (1Н, Н5(8)), 8.10 c (2Н, Н6,7), 8.20 c (2Н, Н2',6'), 13.25
θ ≤ 25.2°, измерено 2143 отражений (1726 незави-
уш.с (1Н, ОH). Спектр ЯМР 13C, δ, м.д.: 178.02 (1С,
симых), R 0.0346 для 1332 отражений с I>2σ, wR2
C4(9)), 173.87 (1С, C4(9)), 147.69 (1С, C2), 138.01 (1С,
0.0880 для всех отражений.
C9a(3a)), 134.01 (1С, C5(8)), 133.86 (1С, C5(8)), 133.02
N-(3-нитро-1,4-диоксо-1,4-дигидронафталин-2
(1С, C4a(8a)), 132.62 (1С, C4a(8a)), 130.75 (1C, C9a(3a)),
-ил)бензамид (10). Выход: 0.07 г (5.3%), светло-
130.67 (1С, C4'), 128.84 (2С, C3',5'), 128.24 (2С, C2',6'),
желтые кристаллы; т.пл. 217-218°С. УФ спектр
127.24 (1С, C1'), 126.45 (1С, C6(7)), 126.09 (1С, C6(7)).
(толуол), λмакс (lgε), нм: 286 (4.05). Спектр ЯМР 1Н,
Найдено, %: С 70.81; Н 3.48; N 9.60. С17Н10N2O3.
δ, м.д.: 10.4 с (NH), 8.13 д (1H, H8, J 6.8 Гц), 8.11 д
Вычислено, %: С 70.34; Н 3.47; N 9.65. M 290.28.
(1H, H5, J 6.8 Гц), 8.00 д (2H, H2',6', J 7.6 Гц), 7.97 т
(Е)-4-(Гидроксиимино)-2-фенилнафто[2,1-d]-
(1H, H7, J 7.4 Гц), 7.94 т (1H, H6, J 7.4 Гц), 7.72 т
оксазол-5(4H)-он (8). Выход 0.53 г (40.2%) при 10°С и
(1H, H4', J 7.5 Гц), 7.6 т (2H, H3',5', J 7.4 Гц). Спектр
0.20 г (15.2%) при 50°С, желто-оранжевые кристаллы;
ЯМР 13C, δ, м.д.: 179.79 (1С, C1), 175.42 (1С, C4),
т.пл. 206-208°С. УФ спектр (толуол), λмакс (lgε), нм:
165.71 (1С, CONH), 137.76 (1С, C3), 135.68 (1С, C7),
313 (4.25), 429 (3.46). Спектр ЯМР 1Н, δ, м.д.: 13.67
134.78 (1С, C6), 133.75 (1С, C2), 133.63 (1С, C4'),
с (NOH), 8.18-8.15 м (2H, H2',6'), 8.10 д (1H, H6, J
131.93 (1С, C1'), 130.13 [1С, C4a(8a)], 130.10 [1С,
7.5 Гц), 7.92 д (1H, H9, J 7.5 Гц), 7.84 дт (1H, H8, J
C4a(8a)], 128.88 (2С, C3',5'), 128.68 (2С, C2',6'), 126.82
7.5, J 1.2 Гц), 7.63-7.60 м (3H, H3',5',4'), 7.58 дт (1H,
(1С, C8), 126.60 (1С, C5). Масс-спектр, m/z (Iотн, %):
H7, J 7.5, J 1.2 Гц). Спектр ЯМР 13C, δ, м.д.: 180.61
276 (8.31), 106 (7.51), 105 (100), 77 (46.25),
76
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
О РЕАКЦИИ 2-БЕНЗИЛАМИНО-1,4-НАФТОХИНОНОВ С НИТРОЗИЛСЕРНОЙ КИСЛОТОЙ
707
(9.21), 51 (11.91). Масс-спектр, m/z: 345.0474 [M +
Lee K.-H. J. Med. Chem. 1996, 39, 1447. doi 10.1021/
Na]+. Найдено,
%: С
63.67; Н
3.17; N
8.51.
jm950247k
С17Н10N2O5. Вычислено, %: С 63.36; Н 3.13; N 8.69.
7. Shtil A.A., Gornostaev L.M., Tsvetkov V.B.,
M 322.27, M + Na 345.0482.
Markova A.A., Lavrikova T.I., Khalyavina Yu.G.,
Kuznetsova A.S., Kaluzhny D.N., Shunayev A.V.,
Кристаллы моноклинные, температура 296 K, a
Tsvetkova M.V., Glazunova V.A., Chernyshev V.V.
5.2751(3), b 13.4961(9), c 20.5594(12) Å, β 97.109(2)°,
Anti-Cancer Agents Med. Chem. 2017, 17, 1814. doi
Z 4, пространственная группа P21/n, dвыч 1.474 г/см3,
10.2174/1871520617666170327112216
µ 0.111 мм-1, θ ≤ 26.1°, измерено 25189 отражений
8. Штиль А.А., Глазунова В.А., Лаврикова Т.И.,
(2877 независимых), R 0.0466 для 2015 отражений
Халявина Ю.Г., Горностаев Л.М. Пат. 2545091 (2014)
с I>2σ, wR2 0.1648 для всех отражений.
РФ. Б. И. 2015, № 9.
9. Горностаев Л.М., Халявина Ю.Г., Лаврикова Т.И.,
3-Диазанафталин-1,2,4(3H)-трион (14). Выход:
Гатилов Ю.В., Сташина Г.А., Фирганг С.И. ЖОрХ.
3.5 г (87.5%), бледно-желтые кристаллы; т.пл. 119-
2014, 50, 1832. [Gornostaev L.M., Khalyavina Yu.G.,
121°C (CHCl3) (лит.121-122°C) [16]. УФ спектр
Lavrikova T.I., Gatilov Yu.V., Stashina G.A., Firgang S.I.
(толуол), λмакс (lgε), нм: 284 (3.90). ИК спектр, ν, см
Russ. J. Org. Chem. 2014, 50, 1814.] doi 10.1134/
-1: 2120-2200 (N=N). Спектр ЯМР 13C, δ, м.д.: 8.13
S1070428014120173
д.т [1H, H6(7), J 7.6, J 1.3 Гц], 8.08-8.11 м [1H, H5(8)],
10. Горностаев Л.М., Нуретдинова Э.В., Лаврикова Т.И.,
7.95 д.т [1H, Н6(7), J 7.6, J 1.3 Гц], 7.89-7.92 м [1H,
Халявина Ю.Г., Крюковская И.С., Гатилов Ю.В.
H5(8)]. Спектр ЯМР 13C, δ, м.д.: 177.54 (1С, C1),
ЖОрХ. 2015, 51, 1767. [Gornostaev L.M., Nuretdino-
176.82 (1С, C4), 172.36 (1С, C2), 142.81 (1С, C3),
va E.V., Lavrikova T.I., Khalyavina Yu.G., Kryu-
135.34 (1С, C6), 135.04 (1С, C8a), 134.85 (1С, C7),
kovskaya I.S., Gatilov Yu.V. Russ. J. Org. Chem. 2015,
51, 1733.] doi 10.1134/S107042801512012X
128.46 (1С, C8), 127.45 (1С, C4a), 126.56 (1С, C5).
Масс-спектр, m/z (Iотн, %): 200 (3.40) [М]+,
172
11. Горностаев Л.М., Вигант М.В., Каргина О.И.,
Кузнецова А.С., Халявина Ю.Г., Лаврикова Т.И.
(69.07), 104 (89.19), 88 (21.12), 77 (13.51), 76 (100),
ЖОрХ. 2013, 49, 1369. [Gornostaev L.M., Vigant M.V.,
74 (18.12), 68 (10.31), 62 (19.92), 50 (41.64). Масс-
Kargina O.I., Kuznetsova A.S., Khalyavina Yu.G.,
спектр, m/z 223.0111 [M + Na]+. Найдено, %: С
Lavrikova T.I. Russ. J. Org. Chem. 2013, 49, 1354.] doi
59.95; Н 2.02; N 13.68. С10Н4N2O3. Вычислено, %: С
10.1134/S1070428013090194
60.01; Н 2.01; N 14.00. M 200.15, M + Na 223.0114.
12. Uno H., Murakami, S., Fujimoto A., Yamaoka Y.
Tetrahedron Lett.
2005,
46,
3997. doi
10.1016/
КОНФЛИКТ ИНТЕРЕСОВ
j.tetlet.2005.04.037
13. Brandy Y., Butcher R.J., Bakare O. Acta Crystallogr.,
Авторы заявляют об отсутствии конфликта
Sect. E: Struct. Rep. Online. 2012, 68, o2775. doi
интересов.
10.1107/S1600536812034150
14. Mosby W.L., Silva M.L. Naphthaquinone Chemistry.
СПИСОК ЛИТЕРАТУРЫ
Part III. J. Chem. Soc., 1964, 3990. doi 10.1039/
JR9640003990
1. Singh M.W., Karmakar A., Barooah N., Baruah Ju.B.
Beilstein J. Org. Chem. 2007, 3, 10. doi 10.1186/1860-
15. Gieiter R., Dobler W. Stufenweise. Chem. Ber. 1985,
5397-3-10
118, 4725. doi 10.1002/cber.19851181208
2. Sharma U., Katoch D., Sood S., Kumar N., Singh B.,
16. Oliveira C.G.T., Miranda F.F., Ferreira V.F., Freitas C.C.,
Thakur A., Gulati A. Indian J Chem. 2013, 52B,
Rabello R.F., Carballido Ju.M., Corrêa L.C.D. J. Braz.
1431.
Chem. Soc.
2001,
12,
339. doi
10.1590/S0103-
3. Lisboa C.S., Santos V.G., Vaz B.G., Lucas N.C.,
50532001000300004
Eberlin M.N., Garden S.J. J. Org. Chem. 2011, 76,
17. Belyakov P.A., Kadentsev V.I., Chizhov A.O.,
5264. doi 10.1021/jo200354u
Kolotyrkina N.G., Shashkov A.S., Ananikov V.P.,
4. Fries K., Billig K. Über Abkömmlinge des Diamino-
Mendeleev Commun.
2010,
20,
125. doi
10.1016/
2,3-naphthochinons-1,4. Ber. Deutsch. Chem. Ges.
j.mencom.2010.05.001
1925, 58, 1128.
18. Bing B.L., Shun-Jun J. Synthetic Commun. 2008, 38,
5. Hoover J.R.E., Day A.R. J. Am. Chem. Soc. 1954, 76,
1201. doi 10.1080/00397910701866254
4148. doi 10.1021/ja01645a028
19. Lien J.-C., Huang L.-J., Wang J.-P., Teng C.-M.,
6. Kuo, S.-C. Ibuka T., Huang L.-J, Lien J.-C., Yean S.-R.,
Lee K.-H., Kuo S.-C. Bioorg. Med. Chem. 1997, 5,
Huang S.-C, Lednicer D., Morris-Natschke S.,
2111. doi 10.1016/S0968-0896(97)00133-8
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
708
ГОРНОСТАЕВ и др.
About the Reaction of 2-Benzylamino-1,4-naphthoquinones
with Nitrosylsulfuri Acid
L. M. Gornostaeva, *, E. V. Nuretdinovaa, T. I. Lavrikovaa, Yu. G. Khalyavinaa,
O. I. Fominyha, and Yu. V. Gatilovb, c
a V.P. Astafiev Krasnoyarsk State Pedagogical University, 660049, Russia, Krasnoyarsk, ul. А. Lebedevoy 89
*e-mail: gornostaev@kspu.ru
b N.N. Vorozhtsov Novosibirsk Institute of Organic Chemistry SB RAS, 630090, Russia, Novosibirsk, pr. Acad. Lavrentiev 9
c Novosibirsk State University, 630090, Russia, Novosibirsk, ul. Pirogova 2
Received October 12, 2018; revised December 10, 2018; accepted December 20, 2018
The reaction of 2-benzylamino-1,4-naphthoquinone with nitrosylsulfuric acid in acetic acid leads to major
products of 2,1- and 2,3-heterocyclizations - (E)-4-(hydroxyimino)-2-phenylnaphtho[2,1-d]oxazol-5(4H)-one
and 2-phenyl-1-hydroxy-1H-naphtho[2,3-d]imidazole-4,9-dione. In addition, 2-phenylnaphtho[2,1-d]oxazol-4,5-
dione and N-(3-nitro-1,4-dioxo-1,4-dihydronaphthalen-2-yl)benzamide are also obtained during the reaction. 1,4-
Naphthoquinone-2,3-diazide and benzaldehyde are formed in the reaction of 2-benzylamino-3-chloro-1,4-
naphthoquinone with nitrosylsulfuric acid in acetic acid.
Keywords:
2-benzylamino-1,4-naphthoquinone, hydroxyimidazole, naphtho-1,2-oxazole, oximes,
1,4-
naphthoquinone-2,3-diazide, nitrosylsulfuric acid
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019