ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 5, с. 714-728
УДК 547.898
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
АЦИКЛИЧЕСКИХ И ЦИКЛИЧЕСКИХ
АЗАДИПЕРОКСИДОВ С УЧАСТИЕМ
Sm-СОДЕРЖАЩИХ КАТАЛИЗАТОРОВ
© 2019 г. Н. Н. Махмудиярова*, Р. Ш. Рахимов, Т. В. Тюмкина, Е. С. Мещерякова,
А. Г. Ибрагимов, У. М. Джемилев
ФГБУН «Институт нефтехимии и катализа РАН»,
450075, Россия, Республика Башкортостан, г. Уфа, пр. Октября 141
*е-mail: natali-mnn@mail.ru
Поступила в редакцию 26 апреля 2018 г.
После доработки 10 февраля 2019 г.
Принята к публикации 14 февраля 2019 г.
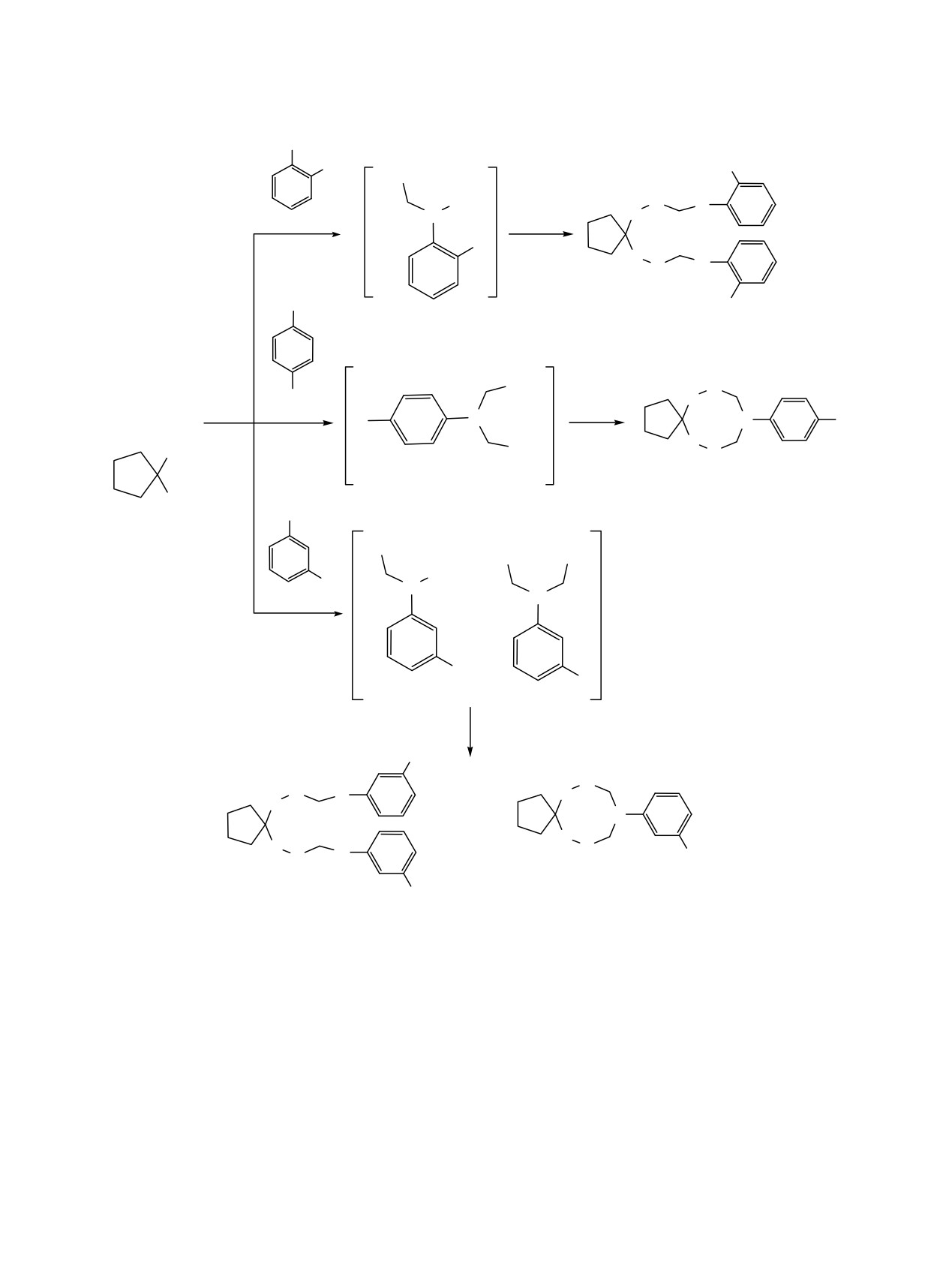
Ациклические диаминодипероксиды и циклические азадипероксиды получены в реакции
1,1-бис
(гидроперокси)циклоалканов с формальдегидом и первичными ариламинами с участием Sm-
катализаторов. Хемоселективность этой трехкомпонентной реакции зависит от положения заместителя
(F, Cl) в бензольном кольце ариламинов. Отнесения сигналов циклических аминопероксидов выполнены
с учетом конформационной динамики тетраоксазоканового цикла с двумя жесткими пероксидными
связями. Структура ациклических диаминодипероксидов надежно установлена методом РСА.
Обнаружена цитотоксическая активность синтезированных ациклических диаминодипероксидов.
Ключевые слова: ациклические диаминодипероксиды, циклические азадипероксиды, ариламины,
катализ, гетероциклизация, хемоселективность, конформационный анализ, РСА, противораковая
активность.
DOI: 10.1134/S0514749219050082
Проявление антималярийной, противораковой,
катализаторов
[SmCl3·6H2O, Sm(NO3)3·6H2O,
антигельминтной активности соединений
SmCl3/γ-Al2O3, Sm(NO3)3/γ-Al2O3].
пероксидного ряда зависит от структуры молекул,
При добавлении при 15-20°С раствора аромати-
а также от присутствия в структуре пероксидов
ческого амина в ТГФ к смеси 1,1-бис(гидроперо-
гетероатомных заместителей [1-13]. Для лечения
кси)циклоалкана и формальдегида в присутствии
малярии наиболее перспективны азотсодержащие
каталитических количеств Sm(NO3)3·6H2O (5 мол %)
несимметричные пероксиды.
за 2-3 мин образуются аминодипероксиды. Направ-
Задача получения азапероксидов сложна и не
ление реакции зависит от положения заместителя
всегда разрешима, что связано с низкой
(F, Cl) в бензольном кольце ариламинов 1a-f. При
устойчивостью пероксигруппы к действию аминов
взаимодействии о-хлор-(фтор)анилина 1a, d с фор-
[14]. Ранее
[15,
16] нами был разработан
мальдегидом и 1,1-бис-(гидроперокси)циклоалканами
селективный метод синтеза аминодипероксидов
2-4 с выходом 63-75% образуются N,N'-[циклоалкан-
реакцией рециклизации пентаоксаканов
[17] с
1,1-диил(биcпе-роксиметандиил)дианилины 5a, d-7a,
помощью первичных аминов. В развитие этого
d. Замена в этой реакции ариламинов 1a, d на п-
исследования, а также с целью разработки
хлор(фтор)-анилин 1c, f приводит к циклическим
эффективного метода синтеза ациклических и
тетра-оксазаспироалканам 8c, f-10c, f с выходами
циклических аминодипероксидов мы изучили
75-87%. С участием м-хлор(фтор)анилина 1b, e трех-
реакцию трехкомпонентной гетероциклизации 1,1-
компонентная конденсация приводит к смеси аци-
бис(гидроперокси)циклоалканов с формальдегидом
клических 11b, e-13b, e и циклических 14b, e-16b,
и первичными ариламинами с участием Sm-
e аминопероксидов в соотношении 1:1 (схема 1).
714
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ АЦИКЛИЧЕСКИХ И ЦИКЛИЧЕСКИХ
715
Схема 1.
NH2
R
R
HO
H
H
O
N
N
O
1a, d
R
( )n
O
O
N
H
NH2
R
5a, d_7a, d
OH
O
2CH2O
R
O
[Sm]
1c, f
R
N
N
R
+
( )n
O
OOH
OH
O
8c, f_10c, f
( )n
OOH
NH2
2_4
HO
HO
OH
H
R
N
1b, e
N
+
R
R
R
H
O
O
N
O
O
+
N
( )n
(
)n
O
O
O
O
N
R
H
R
11b, e_13b, e
14b, e_16b, e
R = Cl (a-с), F (d-f); n = 1 (2, 5, 8, 11, 14), 2 (3, 6, 9, 12,15), 3 (4, 7, 10, 13, 16); [Sm] = Sm(NO3)3·6H2O.
Вероятно, орто-положение заместителя (F, Cl) в
стерические препятствия отсутствуют, и в качестве
бензольном кольце является стерическим препятс-
промежуточного продукта образуется 2-арил-2-аза-
твием для конденсации анилина
1a-f с двумя
1,3-пропандиол, последующее взаимодействие
молекулами формальдегида, и в качестве
которого с
1,1-бис(гидроперокси)циклоалканом
промежуточного продукта образуется аминоспирт,
проходит с формированием циклических перокси-
который в выбранных условиях вступает в
дов. В случае мета-замещённых анилинов реали-
реакцию с 1,1-бис(гидроперокси)циклоалканом с
зуются оба направления реакции с образованием
образованием ациклического соединения 5-7. Если
циклических и ациклических аминопероксидов
заместитель находится в пара-положении,
(схема 1).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
716
МАХМУДИЯРОВА и др.
Схема 2.
R
R
N
1c, f
1a, d
+
8c, f-10c, f
2-4
+
2CH2O
5-7a, d
+
N
R
N N
N N
1b, e
R
R
R
R
18c, f
17a, d
11b, e-13b, e
+
14b, e-16b, e +
N
R
N
N
R
19b, e
R = Cl (a-с), F (d-f).
В отсутствие катализатора в приведенных выше
действии о-хлор(фтор)анилина 1a, d с формаль-
условиях наряду с образованием циклических и
дегидом и 1,1-бис(гидроперокси)циклоалканами 2-
ациклических аминопероксидов, конкурентно
4 образуются ациклические N,N'-[циклоалкан-1,1-
протекает катализируемая 1,1-бис(гидроперокси)-
диил(биcпероксиметандиил)дианилины 5a, d-7a, d
циклоалканами
2-4 слабоосновная конденсация
и
1,3,5-трис(2-галогенофенил)-1,3,5-триазинаны
производных анилина 1a-f с формальдегидом [18],
17a, d в соотношении 1:2 (схема 2, табл.
1).
приводящая к симметричным 1,3,5-триарил-1,3,5-
Проведение трехкомпонентной конденсации с
триазинанам 17a, d, 18c, f и 19b, c. При взаимо-
участием п-галогенанилина
1c, f проходит с
Таблица 1. Выход, %, триазинанов 17a, d, 18c, f, 19b, e, ациклических 5a, d-7a, d, 11b, e-13b, e, циклических 8c, f-10c, f,
14b, e-16b, e аминопероксидов.
n
R
Триазинан
Ациклический диаминодипероксид
Циклический азадипероксид
o-F
50 (17d)
30 (5d)
-
м-F
45 (19e)
23 (11e)
20 (14e)
п-F
60 (18f)
-
29 (8f)
1
o-Cl
52 (17a)
25 (5a)
-
м-Cl
55 (19b)
20 (11b)
18 (14b)
п-Cl
64 (18c)
-
31 (8c)
o-F
49(17d)
24 (6d)
-
м-F
46 (19e)
19 (15e)
15 (15e)
п-F
48 (18f)
-
20 (9f)
2
o-Cl
62 (17a)
25 (6a)
-
м-Cl
50 (19b)
25 (15b)
25 (15b)
п-Cl
53 (18c)
-
20 (9c)
o-F
64(17d)
26 (7d)
-
м-F
60 (19e)
27 (13e)
22 (16e)
п-F
58 (18f)
-
23 (10f)
3
o-Cl
56 (17a)
22 (7a)
-
м-Cl
59 (19b)
20 (13b)
26 (16b)
п-Cl
48 (18c)
-
18 (10c)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ АЦИКЛИЧЕСКИХ И ЦИКЛИЧЕСКИХ
717
13b
12b
12е
9f
Рис. 1. Структуры аминопероксидов 13b, 12b, 12e и 9f согласно рентгеноструктурным данным. Неводородные атомы представлены
эллипсоидами тепловых колебаний (30%).
образованием циклических тетраоксазаспиро-
решеткой, тогда как кристаллическая решетка
алканов 8c, f-10c, f и триазинов 18c, f. С участием
моноклинной сингонии характерна для соединения
м-хлор(фтор)анилина
1b, e трехкомпонентная
12e. В кристалле молекула 13b (рис. 1) занимает
конденсация проходит с образованием смеси
частное положение, где она располагается на оси
ациклических
1,1-бис[N-(пероксиметил)-N-арил-
симметрии С2 проходящей через атом С2 и
амино]циклоалканов 11b, e-13b, e, циклических
середину угла НAС11НB. Расположение молекул в
14b, e-16b, e тетраоксазаспироалканов и 1,3,5-трис-
кристаллах соединений
12e,
12b и
9f
[3-хлор(фтор)фенил]-1,3,5-триазинанов
19b, e в
характеризуется как общее. Молекула амино-
соотношениях, указанных в таблице.
пероксида 13b имеет собственную ось симметрии
второго порядка С2, тогда как в молекулах других
Методом монокристальной рентгеновской диф-
аминопероксидов элементы симметрии отсутст-
рактометрии была установлена структура амино-
вуют, т.е. они обладают только осью первого
пероксидов 13b, 12b, 12e и 9f (рис. 1, табл. 2). Сбор
порядка С1. Циклогексановый фрагмент в
дифракционных данных проводили при комнатной
молекулах 12b, 12e и 9f принимает конформацию
температуре (293 K).
кресло, а семичленный карбоцикл в соединении
Cоединения
13b,
12b и
9f формируют
13b имеет твист-конформацию. Информация о
кристаллы с орторомбической кристаллической
длинах связей и углах содержится в cif-файлах.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
718
МАХМУДИЯРОВА и др.
Таблица 2. Кристаллографические данные и детали уточнения структур 9f, 12b, 12e и 13b.
Параметр
9f
12b
12e
13b
Т, K
293
293
293
293
Брутто-формула
C14H18FNO4
C20H24Cl2N2O4
C20H24F2N2O4
C21H26Cl2N2O4
М, Да
283.29
427.31
394.41
441.34
Сингония
Ромбическая
Ромбическая
Моноклинная
Ромбическая
Пространственная группа
Pbca (№ 61)
P212121 (№ 19)
P21/n (№ 14)
P21212 (№ 18)
a, Å
12.4485(6)
5.8964(4)
12.3217(8)
5.6933(12)
b, Å
10.2927(6)
15.0223(9)
5.7679(6)
15.024(3)
c, Å
21.8055(10)
23.2043(18)
27.155(2)
12.615(3)
α, град
90
90
90
90
β, град
90
90
92.820(12)
90
γ, град
90
90
90
90
Объем, Å3
2793.9(2)
2055.4(2)
1927.6(3)
1079.1(4)
Z
8
4
4
2
dрасч, г/см3
1.347
1.381
1.359
1.358
μ, мм-1
0.107
0.344
0.107
0.330
2θмаx, град
58.06
58.56
62.10
58.40
Число измеренных
14961
13324
4979
6240
отражений
Число независимых отражений
3246(Rint 0.0522)
4882 (Rint 0.0222)
3513 (Rint 0.0131)
2342 (Rint 0.0366)
(Rint)
R1 [I ≥ 2σ(I)]
0.0939
0.0527
0.0903
0.09631
wR2
0.2702
0.1531
0.3009
0.2441
CCDC
1585916
1575320
1575321
1575319
Аминопероксид 9f содержит тетраоксазокановый
спектрах ЯМР 1H метиленовые протоны группы
фрагмент, который принимает конформацию
NCH2, например, в спектре соединения 9с прояв-
«твист-ванна-кресло», а пара-фторарильный
ляются как две пары дублетов при 5.18 и 5.00 м.д.,
заместитель занимает аксиальное положение
2J 14.3 Гц, и при 4.94 и 4.89 м.д., 2J 12.0 Гц, при
относительно указанного фрагмента.
соотношении интенсивностей сигналов ~1:2.7 (рис. 2).
При идентификации циклических аминопе-
По данным HSQC эксперимента, сильно-
роксидов методом спектроскопии ЯМР 1H и 13C
польные дублеты большей интенсивности связаны
установлено, что в растворе при комнатной темпе-
с сильнопольным сигналом атома углерода при
ратуре реализуется поликомпонентное равновесие
85.1 м.д. При понижении температуры до 243 K
конформаций с различной пространственной орга-
происходит коалесценция этого сигнала, а при
низацией цикла. Спектры ЯМР 1H и 13C всего ряда
218 K он расщепляется на два, и в спектре
синтезированных циклических азапероксидных
наблюдаются отдельно три конформера (рис. 2).
соединений содержат удвоенный набор сигналов
Одновременно пара дублетов при 4.93 и 5.15 м.д.,
атомов водорода и углерода как в диметилсуль-
очевидно, соответствующая усредненным сигналам
фоксиде (ДМСО), так и в хлороформе (CDCl3) и
различных конформеров гетероцикла, также
толуоле (Tol-d6). В неполярных растворителях в
трансформируется до двух пар дублетов (рис. 2).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ АЦИКЛИЧЕСКИХ И ЦИКЛИЧЕСКИХ
719
1H
13C
298 K
263 K
B
243 K
A
C
C
A
B
218 K
5.2
5.0
4.8
4.6
м.д.
88.0
87.0
86.0
85.0
м.д.
Рис. 2. Фрагменты спектра ЯМР 1Н и 13С соединения 9с в толуоле (в области фрагмента NCH2O).
С целью определения структуры конформеров
(рис. 4) и расчетами химических сдвигов харак-
мы нашли минимумы на поверхности потен-
теристичных атомов углерода (табл. 3).
циальной энергии (ППЭ) соединения
9c с
В спектрах ЯМР 1H и 13C сигналы остальных
помощью квантовохимического метода B3LYP в
конформеров невозможно отнести с высокой
базисе
6-31G(d,2p) в газовой фазе (программа
степенью надежности из-за близости спектральных
Gausian 09). Оказалось, что восьмичленный N,O-
параметров; кроме того, при понижении
гетероцикл может принимать конформацию кресло
температуры происходит значительное уширение
-кресло А, твист-кресло В и ванна-кресло C,
сигналов циклогексанового фрагмента. По-
причём, для твист формы оптимизируется также
видимому, сигнал углеродного атома при 84.3 м.д.,
конформер B', который находится на ППЭ
который в спектре HSQC связан с метиленовыми
молекулы несколько выше по энергии и отличается
протонами со значительно различающимися
двугранными углами оксазоканового цикла
химическими сдвигами (∆δ 0.6 м.д.) и геминальной
(рис. 3). Наиболее выгодны близкие по энергии
константой
2JВ
9.8 Гц (рис.
2), соответствует
конформеры А и B, последний из которых
конформеру В (или В+В'). Поскольку
кристаллизуется в твердой фазе.
диастереотопность соответствующих протонов в
При соотнесении сигналов конформеров было
конформерах А и С, структура которых
замечено, что для минорного конформера, сигналы
представляет собой сочетание классических
которого находятся в более слабом поле и не
конформаций кресло и ванна, выражена меньше,
изменяются в интервале температур 223-298 K,
значения констант
2J
~14.4 Гц также близки
ярко выражен эффект дезэкранирования сигналов
(рис.
2).
Методом динамической низкотем-
протонов одной из метиленовых групп
пературной спектроскопии ЯМР были определены
спироциклогексанового фрагмента, находящейся в
барьеры инверсии гетероцикла [∆G≠ 12.2 ккал/моль
α-положении к четвертичному атому углерода. Это
(±0.1 ккал/моль)] между структурами В (и/или B')
позволило из теоретически найденных стабильных
и С.
конформеров предложить конформацию кресло-
кресло А, в которой сближены арильный и
Экстраполируя полученные данные на ряд
циклогексановый заместители (dcalc 2.8 Å). Данная
синтезированных циклических соединений 8с, f, 9f,
гипотеза была подтверждена NOE экспериментами
10с, f, а также
14b, e-16b, e, в спектрах ЯМР
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
720
МАХМУДИЯРОВА и др.
А (0.0 ккал/моль)
B (0.3 ккал/моль)
B' (1.4 ккал/моль)
С 3.2 (ккал/моль)
Рис. 3. Устойчивые конформации цикла соединения 9c.
которых наблюдается аналогичная спектральная
типов характеристических фрагментных ионов
картина, мы установили, что при комнатной
[С7H6HlgN + H]+, [С7H6HlgNO + H]+ и [С8H8HlgNO3 +
температуре для восьмичленных аминопероксидов
H]+, общих для данных соединений, а также пики
реализуется конформер кресло-кресло А, в то время
ассоциатов данных ионов с одной или двумя
как конформеры ванна-кресло С и твист-ванна В
молекулами растворителя (ацетонитрил).
находятся в равновесной смеси. Следует отметить,
Кроме этого, в масс-спектрах соединений 9f,
что конформационно жесткие пероксидные
10f,
14b,
15e,
16b и
16e присутствуют пики
фрагменты также обусловливают появление ряда
специфических ионов, характерных для данных
синглетов в протонных спектрах линейных
соединений. Пики ионов [С8H8FNO + H]+, m/z 154,
дипероксидов.
представлены в масс-спектрах соединений 10f и
Масс-спектр положительных ионов химической
16e, что, вероятно, обусловлено присутствием 7-
ионизации при атмосферном давлении (ХИАД) не-
членного цикла и атома фтора в структуре
циклического дипероксида 7a представлен пиками
молекулы (в масс-спектрах соединений 9f и 15e с 6
ионов [С7H7ClN]+• и [С7H7ClNO]+•, образование кото-
-членным циклом, а также хлорзамещённого
рых обусловлено разрывом связей C-O, либо O-O.
соединения
16b пики соответствующих ионов
отсутствуют). В масс-спектре соединения
16b
Исследуемые циклические дипероксиды в
присутствует пик другого, специфического для
условиях ХИАД образуют, главным образом,
данного соединения, иона [С8H8ClN + H]+, m/z 154.
фрагментные положительно заряженные ионы,
В масс-спектрах соединений 9f, 14b и 15e регист-
появление которых связано с одновременным
рируются пики молекулярных ионов [M + H]+, m/z
разрывом связей C-O и O-O, C-O и C-N, C-O и C-O
284, 286 и 284 соответственно, что связано с
при протонировании молекулы в процессе
присутствием
6-членного цикла в структуре
ионизации.
молекулы
(9f,
15e), так как в масс-спектрах
В масс-спектрах ХИАД соединений 9c, 9f, 10f,
соединений 10f и 16e с 7-членным циклом данные
14b, 15b, 15e, 16b и 16e наблюдаются пики трех
пики отсутствуют. На стабильность молекулярного
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ АЦИКЛИЧЕСКИХ И ЦИКЛИЧЕСКИХ
721
иона, вероятно, также влияет присутствие атома
δC 32.6 м.д.
фтора, так как в масс-спектрах соединений 9c и
δH 1.5 м.д.
15b, содержащих в структуре атом хлора, молеку-
лярные ионы не фиксируются. Вероятно, образо-
вание и устойчивость иона [M + H]+ в условиях ХИАД
соединения 14b обусловлены стабилизирующим
влиянием 5-членного цикла в структуре молекулы.
Биологическая активность. Впервые получен-
δC 29.6 м.д.
ные циклические и ациклические аминопероксиды
δH 2.1 м.д.
10f, 13b, 12b и 12e оценивали на их противо-
Рис. 4. Отнесение сигналов ЯМР конформера А по
опухолевую активность in vitro (цитотоксичность)
данным NOESY эксперимента.
по отношению к
60 линиям клеток девяти
различных типов рака человека (легкие, толстой
спектрометре Bruker Avance 400 (400 и 100 МГц
кишки, центральной нервной системы, яичника,
соответственно) в CDCl3 и ДМСО-d6, внутренний
почек, предстательной железы, опухолей
стандарт ТМС. Двумерные гомоядерные (COSY) и
молочных желез, лейкемии и меланомы) согласно
гетероядерные (HSQC, HMBC) эксперименты
протоколам, доступным в Национальном
проводили по стандартным методикам фирмы
институте рака (NCI, Bethesda, США) [19-24] в
Bruker при тех же рабочих частотах. Масс-спектры
концентрации
10-5 моль/л. Каждую клеточную
химической ионизации атмосферы (APCI)
линию инокулиро-вали и предварительно
соединений были получены на масс-спектрометре
инкубировали на микротитро-вальной планшете,
ВЭЖХ LCMS-2010EV (Shimadzu) в режиме
после чего добавляли тестируе-мое соединение и
положительных ионов на потенциале иони-
культуру инкубировали
48 ч. Результаты
зирующего электрода
4.5
кВ. Температура
представлены как процент роста обра-ботанных
интерфейса APCI 250°C, температура нагревателя
клеток по сравнению с необработанными
и линии десольватации 200 и 230°C. Расход газа
контрольными клетками. Согласно критериям NCI
распылителя (азота)
1.5 л·мин-1. Напряжение
(снижение роста любых линий раковых клеток до
высокочастотных линз (Q-массив) 5 В, скорость
~32% или менее), cоединение 10f оказалось неак-
подвижной фазы (ацетонитрил-вода,
83:17)
тивным. Соединения 13b, 12b и 12e, ингибирую-
0.1 мл·мин-1.
щие рост клеток или убивающие клетки некоторых
Элементный анализ проводили на анализаторе
клеточных линий, идентифицированы как «активные».
фирмы Сarlo Erba
1106. Ход реакций конт-
Ациклический диаминодипероксид 13b активен в
ролировали методом ТСХ на пластинах Sorbfil
отношении клетки лейкимии SR (5.27%), клеток
(ПТСХ-АФ-В), элюент - C6H12-EtOAc, 10:1, прояв-
меланомы LOX IMVI (-85.23%), рака яичников
ление парами I2. Для колоночной хроматографии
IGROV1 (7.21%), рака почек UO-31 (-47.31%). Соеди-
использовали силикагель КСК (100-200 мкм).
нение 12b активно в отношении клеток лейкимии
K-562 (-40.99%) и SR (-41.42%), рака молочной
Сбор дифракционных данных проводили на
железы A549/ATCC (3.10%), HOP-92 (-46.34%),
дифрактометре Xcalibur Gemini Еos, обору-
NCI-H522 (14.69%), клеток меланомы LOX IMVI
дованном EOS CCD пространственным детектором
(-86.08%), рака яичников IGROV1 (-33.19%), рака
и монохроматизированным источником MoKα-из-
почки 786-0 (10.78%) и UO-31 (-73.73%). Амино-
лучения (графитовый монохроматор, MoKα-
пероксид 12e подавляет рост клеток лейкимии SR
(31.48%), меланомы LOX IMVI (-68.86%), рака
почек UO-31 (-58.17%). По-видимому, соединения
Таблица 3. Расчётные и экспериметальные химические
13b, 12b и 12e могут быть перспективными в
сдвиги 13С конформеров А, B и C соединения 9f.
качестве потенциальных противоопухолевых веществ
для более подробных исследований in vitro.
Конформер
СH2выч.
СH2эксп.
Cвыч.
Cэксп
А
97.1
87.6
124.6
111.4
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В
92.5
84.3
120.6
108.8
Спектры ЯМР 1Н и 13С зарегистрированы на
С
93.5
85.1
122.3
108.8
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
722
МАХМУДИЯРОВА и др.
излучение, λ 0.71073 Å, ω-сканирование, 2θmax 62°).
5.24-5.20 м (4Н, OН2СN), 6.74-6.77 м (2Н, НС),
Сбор и обработка результатов выполнены с
6.97-6.99 м (2Н, НС), 7.14-7.16 м (2Н, НС), 7.28-
помощью программы CrysAlisPro Oxford Diffraction
7.30 м (2Н, НС). Спектр ЯМР 13С (CDCl3), δ, м.д.:
Ltd.
[25]. Структуры расшифрованы прямым
21.7, 30.1, 85.6, 109.4, 115.2, 117.4, 121.6, 130.1,
методом и уточнены полноматричным методом
135.4, 147.7. Найдено,%: C 55.10; H 5.34; Cl 16.97;
наименьших квадратов в анизотропном приб-
N 6.76. C19H22Cl2N2O4. Вычислено,%: C 55.22; H
лижении для неводородных атомов. Атомы
5.37; Cl 17.15; N 6.78.
водорода локализованы в разностном синтезе
N,N'-[Циклопентан-1,1-диил(биcперокси-
Фурье и уточнены изотропно. Расчеты выполнены
метандиил)]ди(2-фторанилин) (5d). Bыход 0.26 г
по программе SHELX [26].
(70%), cветло-желтое масло. Спектр ЯМР
1Н
Все расчеты проводили с использованием
(CDCl3), δ, м.д.: 1.57-1.75 м (4Н, Н2С), 1.84-1.99 м
программы Gaussian
09
[27]. Оптимизация
(4Н, Н2С), 5.08 д (4Н, OН2СN, J 10 Гц), 5.19 д
геометрических параметров, анализ колебательных
(4Н,OН2СN, J 10 Гц), 6.70-6.96 м (6Н, НС), 7.02-
частот и расчет энтропии и термодинамических
7.08 м (4Н, НС). Спектр ЯМР 13С (CDCl3), δ, м.д.:
поправок к полной энергии проводили методом
24.5, 33.1, 79.9, 110.1, 113.9, 115.1 д (J 15 Гц), 119.0
B3LYP6-31G(d,p)
[28-30]. Термодинамические
д (J 7 Гц), 124.5, 134.3, 151.6 д (J 190 Гц). Найдено,
параметры определены при 298 K. ЯМР сдвиги
%: C 59.96; H 5.81; F 9.90; N 7.33. C19H22F2N2O4.
рассчитывали с использованием метода GIAO [31],
Вычислено, %: C 59.99; H 5.83; F 9.99; N 7.36.
который реализован в программе Gaussian
09.
N,N'-[Циклогексан-1,1-диил(биcперокси-
Обработку квантовохимических данных проводили
метандиил)]ди(2-хлоранилин) (6a). Bыход 0.28 г
с помощью программ ChemCraft [32].
(67%), cветло-желтое масло. Спектр ЯМР
1Н
Противораковая активность in vitro. Метод
(CDCl3), δ, м.д.: 1.32-1.40 м (6Н, Н2С), 1.68-1.76 м
тестирования противоопухолевой активности in
(4Н, Н2С), 5.24-5.29 м (4Н, OН2СN), 6.58-6.62 м
vitro соединений в Национальном институте рака
(2Н, НС), 6.68-6.71 м (2Н, НС), 7.04-7.15 м (2Н,
США описан в работах
[19-24] и на сайте
НС),
7.26-7.28 м
(2Н, НС). Спектр ЯМР
13С
(CDCl3), δ, м.д.: 22.5, 25.3, 30.5, 78.4, 109.4, 113.4,
118.9, 119.0, 128.2, 129.5, 142.6. Найдено, %: C
Гетероциклизация
1,1-бис(гидроперокси)-
56.20; H 5.63; Cl 16.50; N 6.54. C20H24Cl2N2O4.
циклоалканов с формальдегидом и первичными
Вычислено, %: C 56.22; H 5.66; Cl 16.59; N 6.56.
аминами в присутствии катализатора
Sm(NO3)3.6H2O (общая методика). В сосуд
N,N'-[Циклогексан-1,1-диил(биcперокси-
Шленка, установленный на магнитной мешалке,
метандиил)]ди(2-фторанилин) (6d). Bыход 0.29 г
загружали при
~20°С тетрагидрофуран
(5 мл),
(74%), cветло-желтое масло. Спектр ЯМР 1Н (CDCl3),
водный (37%-ный) раствор формальдегида (1.46 мл,
δ, м.д.: 1.32-1.46 м (6Н, Н2С), 1.67-1.73 м (4Н, Н2С),
20 ммоль) и соответствующий
1,1-бис(гидро-
5.18-5.24 м (4Н, Н2С), 6.64-6.68 м (2Н, НС), 6.72-6.79
перокси)алкан, добавляли Sm(NO3)3·6H2O [0.022 г,
м (4Н, НС), 6.94-6.98 м (4Н, НС), 7.02-7.06 м (4Н,
5 мол. % по отношению к 1,1-бис(гидроперокси)-
НС). Спектр ЯМР 13С (CDCl3), δ, м.д.: 22.4, 25.3,
циклоалкану)] и перемешивали
15 мин, затем
30.5, 78.4, 109.2, 115.1 д, (J 15 Гц), 118.1 д (J 6 Гц),
добавляли 1 ммоль ариламина. Реакционную смесь
124.9, 136.3 д (J 88 Гц), 151.3 д (J 189 Гц). Найдено,
перемешивали
6 ч при
~20°С и выпаривали
%: C 60.88; H 6.11; F 9.57; N 7.07. C20H24F2N2O4.
тетрагидрофуран. Добавляли Et2O (10 мл), смесь
Вычислено, %: C 60.90; H 6.13; F 9.63; N 7.10.
промывали водой
(4
×
5 мл). Эфирный слой
N,N'-[Циклогептан-1,1-диил(биcперокси-
сушили MgSO4 и концентрировали с целью выде-
метандиил)]ди(2-хлоранилин) (7a). Bыход 0.3 г
ления аминопероксидов, стабильных при хранении
(72%), cветло-желтое масло. Спектр ЯМР
1Н
при комнатной температуре. Ход реакций
(CDCl3), δ, м.д.: 1.41-1.61 м (8Н, Н2С), 1.89-1.95 м
контролировали с помощью ТСХ, элюент - C6H12-
(4Н, Н2С), 5.19-5.22 м (4Н, NСН2O), 6.71-6.80 м
EtOAc, 5: 1, проявляли парами I2.
(4Н, НС), 7.08-7.11 м (2Н, НС), 7.30-7.33 м (4Н,
N,N'-[Циклопентан-1,1-диил(биcперокси-
НС). Спектр ЯМР 13С (CDCl3), δ, м.д.: 22.7, 30.1,
метандиил)]ди(2-хлоранилин) (5a). Выход 0.31 г
33.2, 78.1, 113.5, 113.6, 114.2, 118.8, 119.0, 128.2,
(75%), желтое масло. Спектр ЯМР 1Н (CDCl3), δ,
129.6, 142.6. Масс-спектр (APCI), m/z (Iотн, %): 197
м.д.: 1.36-1.46 м (4Н, Н2С), 1.60-1.72 м (4Н, Н2С),
(36%)
[C7H6ClNO
+ H + CH3CN]+,
181
(54%)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ АЦИКЛИЧЕСКИХ И ЦИКЛИЧЕСКИХ
723
[C7H6ClN + H + CH3CN]+, 156 (8%) [C7H6ClNO + H]+,
белый порошок, т.пл. 93-94°С. Спектр ЯМР 1Н
140 (100%) [C7H6ClN + H]+. Найдено, %: C 57.12; H
(CDCl3), δ, м.д.: 1.41-1.45 м (4Н, Н2С), 1.50-1.61 м
5.91; Cl 15.97; N 6.32. C21H26Cl2N2O4. Вычислено,
(4Н, Н2С), 1.65-1.81 м (4Н, Н2С), 2.03 уш.с (4Н,
%: C 57.15; H 5.94; Cl 16.06; N 6.35.
Н2С, конформер A), 5.30 и 5.62, д (4Н, OН2СN,
конформер A, J
12 Гц),
5.39 д
(4Н, OН2СN,
N,N'-[Циклогептан-1,1-диил(биcперокси-
конформеры B+C, J 12 Гц), 7.01-7.04 м (2Н, НС),
метандиил)]ди(2-фторанилин) (7d). Bыход 0.27 г
7.25-7.28 м (4Н, НС). Спектр ЯМР 13С (CDCl3), δ,
(68%), cветло-желтое масло. Спектр ЯМР
1Н
м.д.: 22.6, 25.2, 30.1, 85.9, 109.3, 118.6, 129.1, 145.5
(CDCl3), δ, м.д.: 1.43-1.69 м (8Н, Н2С), 1.88-1.99 м
(конформер A), 22.7, 25.1, 29.5, 88.7, 113.0, 119.9,
(4Н, Н2С), 5.20-5.22 м (4Н, Н2С), 6.70-6.79 м (2Н,
129.3,
145.5 (конформеры B+C). Масс-спектр
НС), 6.96-6.99 м (2Н, НС), 7.04-7.13 м (4Н, НС).
(APCI), m/z (Iотн, %): 243 (100%) [C8H8ClNO3 + H +
Спектр ЯМР 13С (CDCl3), δ, м.д.: 22.7, 30.5, 33.5,
CH3CN]+, 238 (13%) [C7H6ClNO + H + 2CH3CN]+,
78.6, 109.0, 113.94, 114.74 д (J 15 Гц), 116,97,
202 (9%) [C8H8ClNO3 + H]+, 197 (47%) [C7H6ClNO +
118.46 д (J 6 Гц), 124.51, 134.10, 151.68 д (J 190 Гц).
H + CH3CN]+, 181 (27%) [C7H6ClN + H + CH3CN]+,
Найдено, %: C 61.73; H 6.40; F 9.25; N 6.83.
156 (11%) [C7H6ClNO + H]+, 140 (28%) [C7H6ClN +
C21H26F2N2O4. Вычислено, %: C 61.75; H 6.42; F
H]+. Найдено, %: C 56.07; H 6.03; Cl 11.80; N 4.63.
9.30; N 6.86.
C14H18ClNO4. Вычислено, %: C 56.10; H 6.05; Cl
9-(4-Хлорфенил)-6,7,11,12-тетраокса-9-аза-
11.83; N 4.67.
спиро[4.7]додекан (8c). Выход 0.21г (75%), светло
10-(4-Фторфенил)-7,8,12,13-тетраокса-10-аза-
-желтый порошок, т.пл. 61-62°С. Спектр ЯМР 1Н
спиро[5.7]тридекан
(9f). Выход
0.23 г
(82%),
(CDCl3), δ, м.д.: 2.11-2.14 м (2H, H2C, конформер
светло-коричневые кристаллы, т.пл.
50-50°С.
A), 1.56-1.69 м (4Н, Н2С), 1.81-1.91 м (4Н, Н2С),
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.35-1.41 м
5.35 и 5.74 д (4Н, OН2СN, конформер A, J 12 Гц),
(2Н, Н2С), 1.43-1.46 м (4Н, Н2С), 1.65-1.66 м (4Н,
5.35-5.38 м (4Н, OН2СN, конформеры B+C), 6.52-
Н2С), 1.90 уш.с (4Н, Н2С, конформер A), 5.36 и 5.76
6.74 м (2Н, НС), 7.04-7.12 м (2Н, НС). Спектр ЯМР
д (4Н, OН2СN, конформер A, J 12 Гц,), 5.36-5.37 м
13С (CDCl3), δ, м.д.: 24.6, 32.9, 86.0 (конформер A),
(4Н, OН2СN, конформеры B+C), 7.07-7.14 м (4Н,
87.0 (конформеры B+C), 115.0, 115.9, 116.8, 129.1,
НС). Спектр ЯМР 13С, (ДМСО-d6), δ, м.д.: 22.7,
144.7. Масс-спектр (APCI), m/z (Iотн, %): 284 (4%)
25.1, 30.1, 86.1, 108.7, 115.8 д (J 17 Гц), 118.7 д (J
[M + H]+, 227 (84%) [C8H8FNO3 + H + CH3CN]+, 186
7 Гц), 143.6, 157.46 д (J 188 Гц, конформер A), 22.8,
(24%) [C8H8FNO3 + H]+, 181 (100%) [C7H6FNO + H
24.9, 29.5, 88.6, 111.0, 116.2 д (J 18 Гц), 119.8 д (J
+ CH3CN]+, 165 (51%) [C7H6FN + H + CH3CN]+, 140
7 Гц), 143.6, 157.5 д (J 188 Гц, конформеры B+C).
(15%) [C7H6FNO+H]+, 124 (26%) [C7H6FN + H]+.
Найдено, %: C 59.33; H 6.35; F 6.67; N 4.91.
Найдено, %: C 54.63; H 5.62; Cl 12.37; N 4.87.
C14H18FNO4. Вычислено, %: C 59.36; H 6.40; F 6.71;
C13H16ClNO4. Вычислено, %: C 54.65; H 5.64; Cl
N 4.94.
12.41; N 4.90.
9-(4-Фторфенил)-6,7,11,12-тетраокса-9-аза-
11-(4-Хлорфенил)-8,9,13,14-тетраокса-11-аза-
спиро[4.7]додекан
(8f). Выход
0.21 г
(79%),
спиро[6.7]тетрадекан (10c). Выход 0.27 г (87%),
бесцветные кристаллы, т. пл.
47-49°С. Спектр
светло-желтое масло. Спектр ЯМР 1Н (ДМСО-d6),
ЯМР 1Н (CDCl3), δ, м.д.: 2.11-2.14 м (2H, H2C,
δ, м.д.: 1.40-1.59 м (8Н, Н2С), 1.85-1.93 м (4Н,
конформер A), 1.56-1.69 м (4Н, Н2С), 1.81-1.91 м
Н2С), 2.06 уш.с (4Н, Н2С, конформер A), 5.24 и 5.36
(4Н, Н2С), 5.35 и 5.74 д (4Н, OН2СN, конформер A,
д (4Н, OН2СN, конформер A, J 12 Гц), 5.25-5.30 м
J 12 Гц), 5.35-5.38 м (4Н, OН2СN, конформеры
(4Н, OН2СN, конформеры B+C), 6.99-7.02 м (2Н,
B+C), 6.52-6.74 м (2Н, НС), 7.04-7.12 м (2Н, НС).
НС),
7.15-7.17 м
(2Н, НС). Спектр ЯМР
13С
Спектр ЯМР 13С (CDCl3), δ, м.д.: 24.3, 32.7, 86.4
(ДМСО-d6), δ, м.д.: 22.7, 30.0, 33.9, 85.9, 114.5,
(конформер A), 87.5 (конформеры B + C), 115.7 д
115.7, 118.6, 128.9, 145.5 (конформер A), 22.8, 30.2,
(J 18 Гц), 119.12 д (J 6 Гц), 119.7, 143. 9 д (J 8 Гц),
34.2, 87.4, 114.9, 116.3, 119.0, 129.2, 144.9 (конфор-
157.58 д (J 189 Гц). Найдено, %: C 57.97; H 5.96; F
меры B+C). Найдено, %: C 57.40; H 6.39; Cl 11.27;
7.05; N 5.17. C13H16FNO4. Вычислено, %: C 57.99; H
N 4.43. C15H20ClNO4. Вычислено, %: C 57.42; H
5.99; F 7.06; N 5.20.
6.42; Cl 11.30; N 4.46.
10-(4-Хлорфенил)-7,8,12,13-тетраокса-10-аза-
11-(4-Фторфенил)-8,9,13,14-тетраокса-11-аза-
спиро[5.7]тридекан
(9c). Выход
0.23 г
(79%),
спиро[6.7]тетрадекан (10f). Выход 0.25 г (85%),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
724
МАХМУДИЯРОВА и др.
светло-желтые кристаллы, т.пл. 79-81°С. Спектр
112.3, 112.8, 117.5, 130.8, 134.0, 148.5. Найдено, %:
ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.36-1.58 м (8Н, Н2С),
C 56.20; H 5.63; Cl 16.57; N 6.53%. C20H24Cl2N2O4.
1.94-1.99 м (2Н, Н2С), 2.00-2.01 м (4Н, Н2С, кон-
Вычислено, %: C 56.22; H 5.66; Cl 16.59; N 6.56.
формер A), 5.36 и 5.60 д (4Н, OН2СN, конформер
N,N'-[Циклогексан-1,1-диил(биcперокси-
A, J 12 Гц), 5.36-5.37 м (4Н, OН2СN, конформеры
метандиил)]ди(3-фторанилин) (12e). Выход 0.17 г
A+B+C), 7.09-7.12 м (4Н, НС). Спектр ЯМР 13С
(45%), бесцветные кристаллы, т.пл.
118-119°С.
(ДМСО-d6), δ, м.д.: 22.6, 29.8, 32.4, 85.9, 113.9,
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.33-1.40 м
115.7 д (J 17 Гц), 118.5 д (J 7 Гц), 143.7, 157.4 д (J
(4Н, Н2С), 1.66-1.67 м (6Н, Н2С), 5.10-5.12 м (4Н,
188 Гц, конформер A), 22.0, 29.6, 31.1, 85.9, 113.9,
NСН2O), 6.42-6.58 м (6Н, НС), 7.09-7.23 м (4Н,
116.2 д (J 17 Гц), 120.3 д (J 7 Гц), 143.7, 157.4 д (J
НС). Спектр ЯМР 13С (ДМСО-d6), δ, м.д.: 22.4, 25.3,
188 Гц, конформеры B+C). Масс-спектр (APCI), m/z
30.6, 78.5, 100.1, 104.2 д (J 17 Гц), 109.2, 109.8,
(Iотн, %): 227 (71%) [C8H8FNO3 + H + CH3CN]+, 222
130.7 д (J 8 Гц), 149.1, 163.6 д (J 191 Гц). Найдено,
(19%)
[C7H6FNO + H + 2CH3CN]+,
186
(18%)
%: C 60.87; H 6.11; F 9.60; N 7.07. C20H24F2N2O4.
[C8H8FNO3 + H]+, 181 (100%) [C7H6FNO + H +
Вычислено, %: C 60.90; H 6.13; F 9.63; N 7.10.
CH3CN]+, 165 (67%) [C7H6FN + H + CH3CN]+, 154
N,N'-[Циклогептан-1,1-диил(биcперокси-
(15%) [C8H8FNO + H]+, 140 (10%) [C7H6FNO + H]+,
124 (39%) [C7H6FN + H]+. Найдено, %: C 60.57; H
метандиил)]ди(3-хлоранилин) (13b). Выход 0.18 г
(43%), бесцветные кристаллы, т.пл.
83-84°С.
6.76; F 6.36; N 4.69. C15H20FNO4. Вычислено, %: C
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.39-1.42 м
60.60; H 6.78; F 6.39; N 4.71.
С), 5.11-5.12 м (4Н,
(8Н, Н2С), 1.76-1.78 м (4Н, Н2
N,N'-[Циклопентан-1,1-диил(биcперокси-
NСН2O), 6.65-6.67 м (2Н, НС), 6.83-6.84 м (2Н,
метандиил)]ди(3-хлоранилин) (11b). Выход 0.18 г
НС), 7.09-7.12 м (2Н, НС), 7.20-7.23 м (2Н, НС).
(44%), светло-желтое масло. Спектр ЯМР
1Н
Спектр ЯМР 13С (ДМСО-d6), δ, м.д.: 22.6, 30.3,
(ДМСО-d6), δ, м.д.: 1.45-1.48 м (4Н, Н2С), 1.56-1.63
33.3, 78.3, 112.3, 112.9, 114.5, 117.5, 130.8, 134.0,
м (4Н, Н2С), 5.11-5.12 м (4Н, NСН2O), 6.95-6.99 м
148.6. Найдено, %: C 57.13; H 5.91; Cl 16.03; N
(2Н, СН, J 10 Гц), 7.05-7.07 м (2Н, НС), 7.26-7.29 м
6.32. C21H26Cl2N2O4. Вычислено, %: C 57.15; H 5.94;
(4Н, НС). Спектр ЯМР 13С (ДМСО-d6), δ, м.д.: 24.3,
Cl 16.06; N 6.35.
32.9, 75.6, 115.4, 116.6, 119.9, 120.8, 130.9, 134.0,
N,N'-[Циклогептан-1,1-диил(биcперокси-
148.4. Найдено, %: C 55.20; H 5.34; Cl 17.12; N
метандиил)]ди(3-фторанилин) (13e). Выход 0.18 г
6.75. C19H22Cl2N2O4. Вычислено, %: C 55.22; H 5.37;
(47%), светло-желтое масло. Спектр ЯМР
1Н
Cl 17.15; N 6.78.
(ДМСО-d6), δ, м.д.: 1.39-1.47 м (4Н, Н2С), 1.59-1.63
N,N'-[Циклопентан-1,1-диил(биcперокси-
м (4Н, Н2С), 1.75-1.76 м (4Н, Н2С), 5.09-5.12 м (4Н,
метандиил)]ди(3-фторанилин) (11e). Выход 0.19 г
NСН2O), 6.40-6.44 м (2Н, НС), 6.54-6.58 м (2Н,
(50%), светло-желтое масло. Спектр ЯМР
1Н
НС), 7.08-7.13 м (2Н, НС), 7.20-7.22 м (2Н, НС).
(ДМСО-d6), δ, м.д.: 1.45-1.48 м (4Н, Н2С), 1.56-1.64
Спектр ЯМР 13С (ДМСО-d6), δ, м.д.: 22.6, 30.2,
м (4Н, Н2С), 5.13-5.14 м (4Н, NСН2O), 6.71-74 м
33.2, 78.4, 100.1, 104.1 д (J 17 Гц), 109.7, 114.4 д (J
(2Н, НС), 6.91-6.94 м (4Н, НС), 7.26-7.30 м (2Н,
20 Гц), 130.7 д (J 9 Гц), 149.7 д (J 8 Гц), 163.7 д (J
НС). Спектр ЯМР 13С (ДМСО-d6), δ, м.д.: 24.3, 33.9,
190 Гц). Найдено, %: C 61.73; H 6.39; F 9.27; N
78.5, 103.1 д (J 25 Гц), 107.2 д (J 21 Гц), 112.7,
6.83. C21H26F2N2O4. Вычислено, %: C 61.75; H 6.42;
119.2, 130.1 д (J 17 Гц), 148.1, 162.7 д (J 191 Гц).
F 9.30; N 6.86.
Найдено, %: C 59.96; H 5.80; F 9.97; N 7.34.
9-(3-Хлорфенил)-6,7,11,12-тетраокса-9-аза-
C19H22F2N2O4. Вычислено, %: C 59.99; H 5.83; F
спиро[4.7]додекан
(14b). Выход
0.15 г
(56%),
9.99; N 7.36.
бесцветные кристаллы, т.пл. 70-71°С. Спектр ЯМР
N,N'-[Циклогексан-1,1-диил(биcперокси-
1Н (ДМСО-d6), δ, м.д.: 1.45-1.48 м (4Н, Н2С), 1.56-
метандиил)]ди(3-хлоранилин) (12b). Выход 0.22 г
1.63 м (4Н, Н2С), 1.98-2.01 м (4Н, Н2С, конформер A),
(55%), бесцветные кристаллы, т.пл.
98-99°С.
5.44 и 5.81 д (4Н, OН2СN, конформер A, J 12 Гц),
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.33-1.41 м
5.43-5.46 д (4Н, OН2СN, конформеры B+C), 6.95-
(6Н, Н2С), 1.66-1.68 м (4Н, Н2С), 5.11-5.13 м (4Н,
6.99 м (1Н, НС), 7.05-7.07 м (1Н, НС), 7.15-7.16 м
NСН2O), 6.64-6.73 м (4Н, НС), 6.84-6.85 м (2Н,
(1Н, НС), 7.26-7.29 м (1Н, НС). Спектр ЯМР 13С
НС),
7.07-7.12 м
(2Н, НС). Спектр ЯМР
13С
(ДМСО-d6), δ, м.д.: 24.3, 33.0, 85.6 (конформер A),
(ДМСО-d6), δ, м.д.: 22.4, 25.3, 30.5, 78.4, 109.2,
87.6 (конформеры B+C), 115.4, 116.6, 119.9, 120.0,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ АЦИКЛИЧЕСКИХ И ЦИКЛИЧЕСКИХ
725
130.9, 134.0, 148.4. Масс-спектр (APCI), m/z (I, %):
формер A), 5.36 и 5.83 д (4Н, OН2СN, конформер
286 (17%) [M + H]+, 243 (81%) [C8H8ClNO3 + H +
A, J 12 Гц), 5.39-5.44 м (4Н, OН2СN, конформеры
CH3CN]+, 238 (14%) [C7H6ClNO + H + 2CH3CN]+,
B+C), 6.70-6.77 м (1Н, НС), 6.88-6.94 м (2Н, НС),
202
(37%)
[C8H8ClNO3
+ H]+,
197
(100%)
7.26-7.32 м (1Н, НС). Спектр ЯМР 13С (ДМСО-d6),
[C7H6ClNO + H + CH3CN]+, 190 (22%) [C7H6ClNO +
δ, м.д.: 21.7, 25.1, 30.1, 85.3, 103.6 д (J 21 Гц), 107.3
Cl]¯, 181 (93%) [C7H6ClN + H + CH3CN]+, 156
д (J 17 Гц), 108.8, 112.4, 130.8 д (J 8 Гц), 148.9,
(19%) [C7H6ClNO + H]+, 154 (100%) [C7H6ClNO -
163.3 д (J 197 Гц, конформер A); 22.7, 24.9, 29.4,
H]¯,
140
(53%)
[C7H6ClN + H]+. Найдено,%: C
87.6, 103.6 д (J 21 Гц), 107.3 д (J 17 Гц), 108.8,
54.63; H
5.62; Cl
12.39; N
4.87. C13H16ClNO4.
113.2, 130.8 д (J 8 Гц), 148.9, 163.3 д (J 197 Гц,
Вычислено, %: C 54.65; H 5.64; Cl 12.41; N 4.90.
конформеры B+C). Масс-спектр (APCI), m/z (Iотн,
%): 284 (7%) [M + H]+, 227 (56%) [C8H8FNO3 + H +
9-(3-Фторфенил)-6,7,11,12-тетраокса-9-аза-
CH3CN]+, 186 (40%) [C8H8FNO3 + H]+, 181 (100%)
спиро[4.7]додекан
(14e). Выход
0.13 г
(50%),
[C7H6FNO + H + CH3CN]+, 165 (71%) [C7H6FN + H +
желтое масло. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
CH3CN]+, 140 (32%) [C7H6FNO + H]+, 124 (50%)
1.45-1.48 м (4Н, Н2С), 1.56-1.64 м (4Н, Н2С), 1.98-
[C7H6FN + H]+. Найдено, %: C 59.34; H 6.38; F 6.68;
2.01 м (4Н, Н2С, конформер A), 5.44 и 5.81 д (4Н,
N 4.91. C14H18FNO4. Вычислено, %: C 59.36; H 6.40;
OН2СN, конформер A, J 12 Гц), 5.43-5.46 м (4Н,
F 6.71; N 4.94.
OН2СN, конформеры B+C), 6.71-6.74 м (1Н, НС),
6.91-6.94 м (2Н, НС), 7.26-7.30 м (1Н, НС). Спектр
11-(3-Хлорфенил)-8,9,13,14-тетраокса-11-аза-
ЯМР 13С (ДМСО-d6), δ, м.д.: 24.3, 33.0, 85.6 (кон-
спиро[6.7]тетрадекан (16b). Выход 0.17 г (57%),
формер A), 87.6 (конформеры B+C), 103.9 д (J 20 Гц),
светло-желтый порошок, т.пл.
60-61°С. Спектр
107.4 д (J 20 Гц), 112.6, 119.9, 130.8 д (J 8 Гц),
ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.35-1.48 м (8Н, Н2С),
148.9 д (J 8 Гц), 163.3 д (J 191 Гц). Найдено, %: C
1.55-1.56 м (4Н, Н2С), 1.92-2.00 м (4Н, Н2С, кон-
57.97; H
5.96; F
7.03; N
5.17. C13H16FNO4.
формер A), 5.34 и 5.79 д (4Н, OН2СN, конформер
Вычислено, %: C 57.99; H 5.99; F 7.06; N 5.20.
A, J 12 Гц), 5.37-5.41 м (4Н, OН2СN, конформеры
B+C), 6.94-6.96 м (1Н, НС), 7.03-7.05 м (1Н, НС),
10-(3-Хлорфенил)-7,8,12,13-тетраокса-10-аза-
7.13-7.14 м (1Н, НС), 7.25-7.29 м (1Н, НС). Спектр
спиро[5.7]тридекан (15b). Выход 0.13 г (45%),
ЯМР 13С (ДМСО-d6), δ, м.д.: 22.7, 29.8, 32.4, 85.1
желтое масло. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
115.2, 116.4, 120.7, 130.9, 134.0, 136.3, 148.04. Масс
1.35-1.42 м (6Н, Н2С), 1.55-1.64 м (4Н, Н2С), 1.84-
-спектр (APCI), m/z (Iотн, %):243 (61%) [C8H8ClNO3
1.85 м (4Н, Н2С, конформер A), 5.35 и 5.84 д (4Н,
+ H + CH3CN]+, 238 (17%) [C7H6ClNO + H +
OН2СN, конформер A, J 12 Гц), 5.39-5.44 м (4Н,
2CH3CN]+, 202 (23%) [C8H8ClNO3 + H]+, 197 (100%)
OН2СN, конформеры B+C), 6.94-6.99 м (1Н, НС),
[C7H6ClNO + H + CH3CN]+, 181 (66%) [C7H6ClN +
7.01-7.06 м (1Н, НС), 7.14-7.15 м (1Н, НС), 7.26-
H + CH3CN]+, 156 (12%) [C7H6ClNO + H]+, 154
7.30 м (1Н, НС). Спектр ЯМР 13С (ДМСО-d6), δ,
(23%) [C8H8ClN + H]+, 140 (39%) [C7H6ClN + H]+.
м.д.: 22.7, 25.1, 30.0, 85.4 108.9, 115.2, 116.3, 120.7,
Найдено, %: C 57.39; H 6.39; Cl 11.27; N 4.44.
130.9, 134.0, 148.3 (конформер A); 22.8, 24.9, 29.4,
C15H20ClNO4. Вычислено, %: C 57.42; H 6.42; Cl
87.7 111.0, 115.9, 117.1, 121.5, 131.3, 134.0, 148.3
11.30; N 4.46.
(конформеры B+C). Масс-спектр (APCI), m/z (Iотн,
11-(3-Фторфенил)-8,9,13,14-тетраокса-11-аза-
%): 243 (45%) [C8H8ClNO3 + H + CH3CN]+, 238
диспиро[6.7]тетрадекан (16e). Выход 0.15 г (53%),
(12%)
[C7H6ClNO
+ H+
2CH3CN]+,
202
(14%)
белый порошок, т.пл. 66-68°С. Спектр ЯМР 1Н
[C8H8ClNO3 + H]+, 197 (100%) [C7H6ClNO + H +
(ДМСО-d6), δ, м.д.: 1.35-1.48 м (8Н, Н2С), 1.54-1.56
CH3CN]+, 181 (67%) [C7H6ClN + H + CH3CN]+, 156
м (4Н, Н2С), 1.93-1.98 м (4Н, Н2С, конформер A),
(18%) [C7H6ClNO + H]+, 140 (47%) [C7H6ClN+H]+.
5.35 и 5.78 д (4Н, OН2СN, конформер A), 5.35-5.40
Найдено, %: C 56.07; H 6.02; Cl 11.80; N 4.62.
м (4Н, OН2СN, конформеры B+C), 6.68-6.72 м (1Н,
C14H18ClNO4. Вычислено, %: C 56.10; H 6.05; Cl
НС), 6.89-6.91 м (2Н, НС), 7.25-7.29 м (1Н, НС).
11.83; N 4.67.
С (ДМСО-d6), δ, м.д.: 22.6, 29.8,
Спектр ЯМР 13
10-(3-Фторфенил)-7,8,12,13-тераокса-10-аза-
32.4,
85.1 (конформер A),
87.56 (конформеры
спиро[5.7]тридекан
(15e). Выход 0.15 г (55%),
B+C), 103.7 д (J 20 Гц), 107.2 д (J 17 Гц), 112.5,
светло-желтый порошок, т.пл.
48-49°С. Спектр
114.0, 130.8 д (J 8 Гц), 148.9 д (J 8 Гц), 163.3 д (J
ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.35-1.44 м (6Н, Н2С),
191 Гц). Масс-спектр (APCI), m/z (Iотн, %): 227
1.55-1.66 м (4Н, Н2С), 1.84-1.85 м (4Н, Н2С, кон-
(40%)
[C8H8FNO3
+ H + CH3CN]+,
222
(10%)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
726
МАХМУДИЯРОВА и др.
[C7H6FNO + H + 2CH3CN]+, 186 (29%) [C8H8FNO3 +
5. Tang Y., Dong Y., Wittlin S., Charman S.A., Chollet J.,
H]+, 181 (100%) [C7H6FNO + H + CH3CN]+, 165
Chiu F.C.K., Charman W.N., Matile H., Urwyler H.,
Dorn A., Bajpai S., Wang X., Padmanilayam M.,
(84%)
[C7H6FN
+ H
+ CH3CN]+,
140
(17%)
Karle J.M., Brun R., Vennerstrom J.L. Bioorg. Med.
[C7H6FNO + H]+, 154 (22%) [C8H8FNO + H]+, 124
Chem. Lett.
2007,
17,
1260. doi
10.1016/
(42%) [C7H6FN + H]+. Найдено, %: C 60.57; H 6.76;
j.bmcl.2006.12.007
F 6.36; N 4.68. C15H20FNO4. Вычислено, %: C 60.60;
6. Zheng W., Wojtas L., Antilla J.C. Angew Chem., Int Ed.
H 6.78; F 6.39; N 4.71.
2010, 49, 6589. doi 10.1002/anie.201002972
1,3,5-Триарил-1,3,5-триазинаны (17a, d), (18c, f),
7. Blumenthal H., Liebscher J. Arkivoc. 2009, xi, 204. doi
и (19b, e). Спектральные данные (ЯМР 1H, ЯМР 13C)
10.3998/ark.5550190.0010.b18
согласуются с описанными в литературе [18].
8. Kienle M., Argyrakis W., Baro A., Laschat S.
Tetrahedron Lett.
2008,
49,
1971. doi
10.1016/
БЛАГОДАРНОСТИ
j.tetlet.2008.01.090
9. Rebek J., McCready R. J. Am. Chem Soc. 1980, 102,
Структурные исследования соединений прово-
5602. doi 10.1021/ja00537a033
дились с использованием уникального оборудо-
10. Rebek J. Heterocycles 1981, 15, 517. doi 10.3987/S-
вания в центре коллективного пользования
1981-01-0517
«Агидель». Масс-спектры APCI соединений
11. Schmidt U., Hausler J. Angew. Chem., Int. Ed. 1976, 15,
регистрировали на оборудовании, установленном в
497. doi 10.1002/anie.197604971
Центре коллективного использования химии
12. Casteel D.A. Nat. Prod. Rep. 1999, 16, 55. doi 10.1039/
«Химия» Уфимского института химии УНЦ РАН.
A705725C
13. Chung L.W., Hayashi S., Lundberg M., Nakatsu T.,
ФОНДОВАЯ ПОДДРЕЖКА
Kato H., Morokuma K. J. Am. Chem. Soc. 2008, 130,
12880. doi 10.1021/ja8052464
Работа выполнена при поддержке Российского
14. Oliveira R., Guedes R.C., Meireles P., Albuquerque I.S.,
фонда фундаментальных исследований (проект
Goncalves L.M., Pires E., Bronze M.R., Gut J.,
Rosenthal P.J., Prudencio M., Moreira R., O’Neill P.M.,
РФФИ № 16-29-10687 офи_м).
Lopes F. J. Med. Chem. 2014, 57, 4916. doi 10.1021/
jm5004528
КОНФЛИКТ ИНТЕРЕСОВ
15. Makhmudiyarova N.N., Khatmullina G.M., Rakhi-
mov R.Sh., Meshcheryakova E.S., Ibragimov A.G.,
Авторы заявляют об отсутствии конфликта
Dzhemilev U.M. Tetrahedron. 2016, 72, 3277. doi
интересов.
10.1016/j.tet.2016.04.055
16. Tyumkina T.V., Makhmudiyarova N.N., Kiyamutdi-
СПИСОК ЛИТЕРАТУРЫ
nova G.M., Meshcheryakova E.S., Bikmukhame-
tov K.Sh., Abdullin M.F., Khalilov L.M., Ibragimov A.G.,
1. Amewu R.K., Chadwick J., Hussain A., Panda S.,
Dzhemilev U.M. Tetrahedron. 2018, 74, 1749. doi
Rinki R., Janneh O., Ward S.A., Miguel C., Burrell-
10.1016/j.tet.2018.01.045
Saward H., Vivas L., O’Neill P.M. Bioorg. Med. Chem.
17. Makhmudiyarova N.N., Khatmullina G.M., Rakhi-
2013, 21, 7392. doi 10.1016/j.bmc.2013.09.047
mov R.Sh., Ibragimov A.G., Dzhemilev U.M. Arkivoc.
2. Tang Y., Dong Y., Karle J.M., DiTusa C.A.,
2016, 427. doi 10.24820/ark.5550190.p009.565
Vennerstrom J.L. J. Org. Chem. 2004, 69, 6470. doi
18. Giumanini A.G., Verardo G., Zangrando E., Lassiani L.
10.1021/jo040171c
Z. Prakt. Chem. (Leipzig) 1987, 329, 1087. doi 10.1002/
3. Dong Y., Chollet J., Matile H., Charman S.A.,
prac.19873290619
Chiu F.C.K., Charman W.N., Scorneaux B., Urwyler H.,
19. Alley M.C., Scudiero D.A., Monks P.A., Hursey M.L.,
Tomas J.S., Scheurer C., Snyder C., Dorn A., Wang X.,
Czerwinski M.J., Fine D.L., Abbott B.J., Mayo J.G.,
Karle J.M., Tang Y., Wittlin S., Brun R., Vennerstrom J.L.
Shoemaker R.H., Boyd M.R. Cancer Res. 1988, 48, 589.
J. Med. Chem.
2005,
48,
4953. doi
10.1021/
20. Grever M.R., Schepartz S.A., Chabner B.A. Semin
jm049040u
Oncol. 1992, 19, 622.
4. Dong Y., Tang Y., Chollet J., Matile H., Wittlin S.,
21. Boyd M.R., Paull K.D. Drug. Dev. Res. 1995, 34, 91.
Charman S.A., Charman W.N., Tomas J.S., Scheurer C.,
doi 10.1002/ddr.430340203
Snyder C., Scorneaux B., Bajpai S., Alexander S.A.,
Wang X., Padmanilayam M., Cheruku S.R., Brun R.,
22. Shoemaker R.H. Nat. Rev. 2006, 6, 813. doi 10.1038/
Vennerstrom J.L. Bioorg. Med. Chem. 2006, 14, 6368.
nrc1951
doi 10.1016/j.bmc.2006.05.041
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ АЦИКЛИЧЕСКИХ И ЦИКЛИЧЕСКИХ
727
23. Weinstein J.N., Myers T.G., O’Connor P.M.,
Peralta Jr.J.E., Ogliaro F., Bearpark M., Heyd J.J.,
Friend S.H., Fornace A.J.Jr., Kohn K.W., Fojo T.,
Brothers E., Kudin K.N., Staroverov V.N., Keith T.,
Bates S.E., Rubinstein L.V., Anderson N.L.,
Kobayashi R., Normand J., Raghavachari K., Rendell A.,
Buolamwini J.K., van Osdol W.W., Monks A.P.,
Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Rega N.,
Scudiero D.A., Sausville E.A., Zaharevitz D.W.,
Millam J.M., Klene M., Knox J.E., Cross J.B., Bakken V.,
Bunow B., Viswanadhan V.N., Johnson G.S.,
Adamo C., Jaramillo J., Gomperts R., Stratmann R.E.,
Wittes R.E., Paull K.D. Science. 1997, 5298, 343. doi
Yazyev O., Austin A.J., Cammi R., Pomelli C.,
10.1126/science.275.5298.343
Ochterski J.W., Martin R.L., Morokuma K.,
24. Monks A., Scudiero D., Skehan P., Shoemaker R.,
Zakrzewski V.G., Voth G.A., Salvador P.,
Paull K., Vistica D., Hose C., Langley J., Cronise P.,
Dannenberg J.J., Dapprich S., Daniels A.D., Farkas O.,
Vaigro-Wolff A., Gray-Goodrich M., Campbell H.,
Foresman J.B., Ortiz J.V., Cioslowski J., Fox D.J.
Mayo J., Boyd M.J. Nat. Cancer. Inst. 1991, 83, 757.
Gaussian
09, Revision D.01. Gaussian, Inc.,
doi 10.1093/jnci/83.11.757
Wallingford CT, 2013.
25. Technologies. A. CrysAlis PRO.
2012, Yarnton,
28. Becke A.D. J. Chem. Phys.
1993,
98,
5648. doi
Oxfordshire, England.
10.1063/1.464913
26. Sheldrick G.M. Acta Cryst.
2008, A64,
112. doi
29. Lee C., Yang W., Parr R.G. Phys. Rev. B. 1988, 37, 785.
10.1107/S0108767307043930
doi 10.1103/PhysRevB.37.785
27. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
30. Stephens P.J., Devlin F.J., Chabalowski C.F.,
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
Frisch M.J. J. Phys. Chem. 1994, 98, 11623. doi
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
10.1021/j100096a001
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
31. Wolf S.K., Ziegler T. J. Chem. Phys. 1998, 109, 895.
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y.,
Kitao O., Nakai H., Vreven T., Montgomery J.A.,
32. Zhurko G.A., Zhurko D.A. ChemCraft. 2009.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
728
МАХМУДИЯРОВА и др.
Synthesis and Biological Activity of Acyclic and Cyclic
Azadiperoxides with the Presence of Sm-Containing Catalysts
N. N. Makhmudiyarova*, R. Sh. Rakhimov, T. V. Tyumkina, E. S. Meshcheryakova,
A. G. Ibragimov, and U. M. Dzhemilev
Institute of Petrochemistry and Catalysis, RAS,
450075, Russia, Republic of Bashkortostan, Ufa, prosp. Oktyabrya 141
*e-mail: natali-mnn@mail.ru
Received January 26, 2018; revised February 10, 2019; accepted February 14, 2019
The synthesis of acyclic diaminodiperoxides and cyclic azadiperoxides has been carried out with the reaction of
1,1-bis(hydroperoxy)cycloalkanes with formaldehyde and primary arylamines in the presence of Sm-containing
catalysts (SmCl3·6H2O, Sm(NO3)3·6H2O, SmCl3/γ-Al2O3, Sm(NO3)3/γ-Al2O3). Chemoselectivity of this three-
component reaction depends on the position of a substituent (F,Cl) in the phenyl ring of the primary arylamines.
Signals of the cyclic aminoperoxides were assigned considering the conformation dynamics of the
tetraoxazocane cycle with two rigid peroxide bonds. The structure of acyclic diaminodiperoxides has been
reliably determined by X-ray diffraction method. Anticancer activity of the synthesized acyclic
diaminodiperoxides was discovered.
Keywords: acyclic diaminodiperoxides, cyclic azadiperoxides, arylamines, catalysis, heterocyclization,
chemoselectivity, conformational analysis, X-ray diffraction, anticancer activity
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019