ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 5, с. 787-790
КРАТКИЕ СООБЩЕНИЯ
УДК 547.722 + 547.869.2
РАСЩЕПЛЕНИЕ ЦИКЛА ФУРАНДИОНА
О-АМИНОТИОФЕНОЛОМ:
СИНТЕЗ 2Н-1,4-БЕНЗОТИАЗИН-2,3(4Н)-ДИОНА
© 2019 г. Н. А. Третьяков, М. В. Дмитриев, А. Б. Шеин, А. Н. Масливец*
ФГБОУ ВО «Пермский государственный национальный исследовательский университет»,
614990, Россия, г. Пермь, ул. Букирева 15
*e-mail: koh2@psu.ru
Поступила в редакцию 28 марта 2018 г.
После доработки 4 марта 2019 г.
Принята к публикации 15 марта 2019 г.
5-Арил-4-(3-арилхиноксалин-2-ил)фуран-2,3-дионы реагируют с о-аминотиофенолом с образованием 2Н-
1,4-бензотиазин-2,3(4Н)-диона и (2Z)-1-арил-2-[3-арилхиноксалин-2(1H)-илиден]этан-1-онов.
Ключевые слова: 5-арилфуран-2,3-дион, 5-арил-4-(3-арилхиноксалин-2-ил)фуран-2,3-дион, о-аминотио-
фенол, 1,4-бензотиазин-2,3-дион, РСА.
DOI: 10.1134/S0514749219050173
4-Незамещенные 5-арилфуран-2,3-дионы реаги-
замещенных
5-арилфуран-2,3-дионов с о-амино-
руют с о-аминотиофенолом с первоначальной атакой
тиофенолом ранее не изучались.
аминогруппой реагента карбонильной группы в
положении 2 фурандионового цикла, раскрытием
При взаимодействии 5-арил-4-(3-арилхинокса-
этого цикла по связи О1-С2 и дальнейшей атакой
лин-2-ил)фуран-2,3-дионов 1a, b [2, 3] с о-амино-
меркаптогруппой реагента карбонильной группы в
тиофенолом в безводном хлороформе при 20°С
положении 3, отщеплением молекулы воды и обра-
образуются
2Н-1,4-бензотиазин-2,3(4Н)-дион
2,
зованием 3-(2-оксо-2-фенилэтилиден)-3,4-дигидро-
структура которого подтверждена РСА, и (2Z)-1-
2Н-1,4-бензотиазин-2-онов [1]. Реакции 4-гетерил-
арил-2-[3-арилхиноксалин-2(1H)-илиден]этан-1-оны
Схема 1.
N
Ar
NH2
N Ar
O
O
SH
N Ar
H
S
N
SH
N
O
N
NH
H
N
O
O
H
OH
Ar
O
Ar
O
O
Ar
1a, b
4a, b
H
N Ar
N
O
+
N
S O
H
O Ar
2
3a, b
Ar = Ph (a), C6H4Ме-4 (b).
787
788
ТРЕТЬЯКОВ и др.
однако осадок выпадал через несколько часов.
O2
Спустя 12 ч осадок соединения 2 отфильтровы-
1
C8
N
вали. Выход 0.49 г (92%), т.пл. 249-251°C (EtOAc);
C7
C2
C3
180°C (MeOH) [5]. ИК спектр, ν, см-1: 3191 (NH),
1682,
1657 (С=О). Спектр ЯМР
1H, δ, м.д.:
7.19 д.д.д (1Н, J1 1.4, J2 7.2, J3 8.0 Гц), 7.29 д.д.д
(1Н, J1 0.5, J2 1.4, J3 8.2 Гц), 7.37 д.д.д (1Н, J1 1.4,
C6
J2 7.2, J3 8.2 Гц), 7.44 д.д.т (1Н, J1 0.5, J2 1.4, J3
C4
C1
8.0 Гц), 12.02 с (1Н, NН). Спектр ЯМР 13С, δ,
O1
м.д.: 116.0, 117.6, 123.2, 125.6, 127.7, 133.1, 151.2
C5
S1
(C3=O), 179.9 (C2=O). Найдено, %: C 53.57; H
2.89; N 7.87; O 17.81; S 17.96. C8H5NO2S. Вычис-
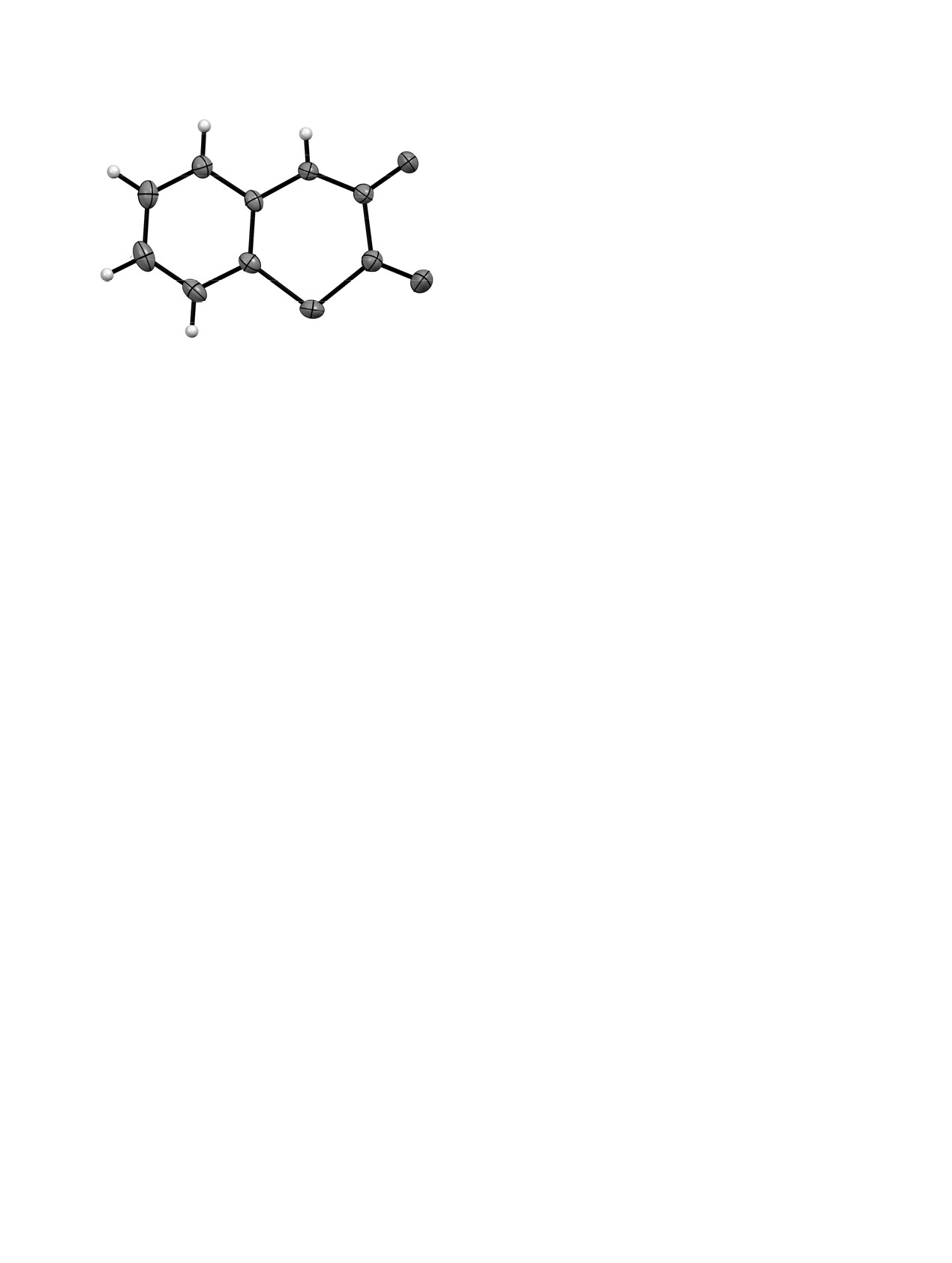
Общий вид молекулы
2Н-1,4-бензотиазин-2,3(4Н)-
лено, %: C 53.62; H 2.81; N 7.82; O 17.86; S
диона 2 по данным РСА в тепловых эллипсоидах 30%
вероятности.
17.89.
Маточный раствор упаривали досуха, остаток
3a, b, (схема 1) идентифицированные путем сравнения
перекристаллизовывали из этанола, выход
с заведомо известными образцами, полученными
соединения
3a
0.89 г
(92%), т.пл.
156-158°C
встречным синтезом из диароилацетиленов и о-
(EtOH) [4]. ИК спектр, ν, см-1: 3057 ш (NH в ВВС),
фенилендиамина по известному методу [4].
1582 ш (С=О в ВВС). Спектр ЯМР 1H, δ, м.д.:
Согласно данным РСА (рис. 1), соединение
2
6.28 с (1Н, =СН), 7.19-7.89 м (14Н, 2Ph + С6Н4),
кристаллизуется в центросимметричной пространс-
15.58 с (1Н, NН). Спектр ЯМР 13С, δ, м.д.: 90.5
твенной группе моноклинной сингонии. Кон-
(=CH), 120.2-137.3 , 147.1, 156.1, 179.0 (C=O).
формация тиазинового цикла может быть описана
Найдено, %: C 81.46; H 4.97; N 8.64; O 4.93.
как планарная с небольшим вкладом конформации
C22H16N2O. Вычислено, %: C 81.51; H 4.94; N 8.61;
полукресло. Атомы N1, C3, C4, S1 лежат в одной
O 4.94.
плоскости, атомы карбонильных групп откло-
Рентгеноструктурный анализ соединения
2
няются в разные стороны от нее на 0.07, 0.16,
выполнен на монокристальном дифрактометре
-0.03 и -0.11 Å (C1, O1, C2 и O2 соответственно).
Xcalibur Ruby с ССD-детектором по стандартной
В кристалле молекулы связаны в центро-
методике (MoKα-излучение, 295(2) K, ω-сканиро-
симметричные димеры за счет МВС N1-H1···O2
вание с шагом 1°). Поглощение учтено эмпирически
[1-x, 1-y, -z].
с использованием алгоритма SCALE3 ABSPACK
На первой стадии взаимодействия происходит,
[6]. Сингония кристалла моноклинная, пространс-
по-видимому, атака аминогруппой реагента
твенная группа P21/c, a 7.568(3), b 12.880(5), c
карбонильной группы в положении
2 фуран-
8.287(3) Å, β
110.04(4)°, V
758.8(5) Å3, Z
4.
дионового цикла соединений
1a, b, раскрытие
Структура расшифрована прямым методом с
этого цикла по связи О1-С2 и дальнейшая атака
помощью программы Superflip
[7] и уточнена
меркаптогруппой реагента карбонильной группы в
полноматричным МНК по F2 в анизотропном
положении 3, как описано выше [1]. Однако на
приближении для всех неводородных атомов с
второй стадии вместо отщепления молекулы воды
использованием программ SHELXL [8] и OLEX2
происходит расщепление связи С-С в
[9]. Атом водорода группы NH уточнен независимо
промежуточных соединениях 4a, b с образованием
в изотропном приближении. При уточнении
соединений 2 и 3a, b.
остальных водородных атомов использована модель
2Н-1,4-Бензотиазин-2,3(4Н)-дион (2) и (2Z)-1-
наездника. Окончательные параметры уточнения:
фенил-2-(3-фенилхиноксалин-2(1H)-илиден)-
R1
0.0576, wR2
0.1333
[для
1180 отражений с
этан-1-он
(3а). К раствору
1.13 г
(3 ммоль)
I
>
2σ(I)], R1
0.0917, wR2
0.1663 (для всех
фурандиона 1а в 15 мл безводного хлороформа при
1767 независимых отражений), S 1.056. Результаты
20°С приливали раствор 0.37 г (3 ммоль) о-амино-
РСА зарегистрированы в Кембриджском центре
тиофенола в 5 мл безводного хлороформа. Об
кристаллографических данных под номером
окончании реакции судили по исчезновению
CCDC 1827889 и могут быть запрошены по адресу
окраски исходных фурандионов (через 5-10 мин),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
РАСЩЕПЛЕНИЕ ЦИКЛА ФУРАНДИОНА О-АМИНОТИОФЕНОЛОМ
789
2Н-1,4-Бензотиазин-2,3(4Н)-дион (2) и (2Z)-1-
КОНФЛИКТ ИНТЕРЕСОВ
(4-метилфенил)-2-[3-(4-метилфенил)хинокса-
лин-2(1H)-илиден]этан-1-он
(3b) получали
Авторы заявляют об отсутствии конфликта
интересов.
аналогично. Выход соединения 2 0.45 г (83%), т.пл.
249-251°C (EtOAc). Выход соединения 3b 0.82 г
СПИСОК ЛИТЕРАТУРЫ
(78%), т.пл. 163-165°C (EtOH) [4]. ИК спектр, ν, см
-1:
3040 ш (NH в ВВС), 1584 ш (С=О в ВВС).
1. Андрейчиков Ю.С., Тендрякова С.П., Налимова Ю.А.,
Спектр ЯМР 1H, δ, м.д.: 2.32 с (3Н, Me), 2.42 с (3Н,
Воронова Л.А. ХГС. 1977, 6, 755. [Andreichikov Yu.S.,
Me), 6.35 с (1Н, =СН), 7.13-8.08 м (12H, 2C6H4 +
Tendryakova S.P., Nalimova Yu.A., Voronova L.A.
4H), 15.74 с (1Н, NН). Спектр ЯМР 13С, δ, м.д.: 21.0
Chem. Heterocycl. Compd. 1977, 13, 611.] doi 10.1007/
(CH3), 90.5(=CH), 118.8-147.0, 156.4, 181.3(C=O).
BF00480663
Найдено, %: C 81.79; H 5.72; N 7.95; O 4.54.
2. Масливец А.Н., Лисовенко Н.Ю., Головнина О.В.,
C24H20N2O. Вычислено, %: C 81.74; H 5.76; N 7.99;
Востров Е.С., Тарасова О.П. ХГС. 2000, 36, 556.
O 4.52.
[Maslivets A.N., Lisovenko N.Yu., Golovnina O.V.,
Vostrov E.S., Tarasova O.P. Chem. Heterocycl. Compd.
ИК спектры полученных соединений записаны
2000, 36, 483.] doi 10.1007/BF02269553
на спектрофотометре Perkin Elmer Spectrum Two в
3. Масливец А.Н., Лисовенко Н.Ю., Красных О.П.,
вазелиновом масле. Спектры ЯМР 1Н и 13С запи-
Тарасова О.П., Алиев З.Г., Атовмян Л.О. Изв. АН, Cер.
саны на спектрометре Bruker Avance III HD 400
Хим. 2002, 51, 785. [Maslivets A.N., Lisovenko N.Yu.,
[рабочая частота 400 (1Н) и 100 (13С) МГц] в ДМСО
Krasnykh O.P., Tarasova O.P., Aliev Z.G., Atovmyan L.O.
-d6, внутренний стандарт - ТМС. Элемен-тный
Russ. Chem. Bull.
2002,
51,
850.] doi
10.1023/
A:1016097120253
анализ выполняли на анализаторе vario MICRO
4. Бабенышева А.В., Лисовская Н.А., Белевич И.О.,
cube. Полноту протекания реакций опреде-ляли
Лисовенко Н.Ю. Хим.-фарм. ж.
2006,
40,
31.
методом ультра-ВЭЖХ-МС, колонка Acquity UPLC
[Babenysheva A.V., Lisovskaya N.A., Belevich I.O.,
BEH C18 1.7 мкм, подвижные фазы - ацетонитрил-
Lisovenko N.Yu. Pharm. Chem. J. 2006, 40, 611.] doi
вода, скорость потока 0.6 мл/мин, детектор ESI MS
10.1007/s11094-006-0204-6
Xevo TQD. Индивидуальность синтезированных
5. Shahwar D., Sana U., Ahmad N. Turk. J. Chem. 2013,
соединений подтверждена методом ТСХ на
37, 262. doi 10.3906/kim-1207-67
пластинках Merck Silica gel 60 F254, элюенты -
6. CrysAlisPro, Agilent Technologies, Version 1.171.37.33
бензол-этилацетат, 5:1, проявляли парами иода.
(release 27-03-2014 CrysAlis171 .NET).
7. Palatinus L., Chapuis G. J. Appl. Cryst. 2007, 40, 786.
ФОНДОВАЯ ПОДДЕРЖКА
doi 10.1107/S0021889807029238
8. Sheldrick G.M. Acta Cryst. 2015, C71, 3. doi 10.1107/
Работа выполнена при финансовой поддержке
S2053229614024218
Минобрнауки России (проекты
4.6774.2017/8.9,
9. Dolomanov O.V., Bourhis L.J., Gildea R.J, Howard J.A.K.,
4.5894.2017/7.8) и Правительства Пермского края.
Puschmann H. J. Appl. Cryst. 2009, 42, 339. doi
10.1107/S0021889808042726
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019
790
ТРЕТЬЯКОВ и др.
Splitting of the Furandione Cycle with O-Aminothiophenol:
Synthesis of 2H-1,4-Benzothiazine-2,3(4H)-dione
N. A. Tretyakov, M. V. Dmitriev, A. B. Shein, and A. N. Maslivets*
Perm State National Research University, ul. Bukireva 15, Perm, 614990 Russia
*e-mail: koh2@psu.ru
Received March 28, 2018; revised March 04, 2019; accepted March 15, 2019
5-Aryl-4-(3-arylquinoxalin-2-yl)furan-2,3-diones react with o-aminothiophenol to form 2H-1,4-benzothiazin-2,3-
(4H)-dione and (2Z)-1-aryl-2-[3-arylquinoxalin-2(1H)-ylidene]ethan-1-ones.
Keywords:
5-arylfuran-2,3-dione,
5-aryl-4-(3-arylquinoxalin-2-yl)furan-2,3-dione, o-aminothiophenol,
1,4-
benzothiazin-2,3-dione, X-ray
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 5 2019