ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 6, с. 879-890
К 85-летнему юбилею академика РАН О.Н. Чупахина
УДК 547.854.83
АЛКИЛИРОВАНИЕ 6-ПОЛИФТОРАЛКИЛ-
2-ТИОУРАЦИЛОВ ГАЛОГЕНАЛКАНАМИ
© 2019 г. О. Г. Худинаa, А. Е. Ивановаa, Я. В. Бургартa, М. Г. Первоваa, Т. В. Шатуноваa,
С. С. Борисевичb, С. Л. Хурсанb, В. И. Салоутинa, *
a ФГБУН «Институт органического синтеза им. И.Я. Постовского Уральского отделения РАН»,
620990, Россия, г. Екатеринбург, ул. С. Ковалевской/Академическая 22/20
*e-mail: saloutin@ios.uran.ru
b ФГБУН «Уфимский Институт химии РАН», 450054, Россия, Республика Башкортостан, г. Уфа, пр. Октября 71
Поступила в редакцию 15 апреля 2019 г.
После доработки 23 апреля 2019 г.
Принята к публикации 25 апреля 2019 г.
Строение и реакционная способность нуклеофильных центров 6-полифторалкил-2-тиоурацилов оценены
с помощью квантово-химических расчетов. Экспериментально найдено, что метилирование
6-
полифторалкил-2-тиоурацилов приводит сначала к S-монозамещенному пиримидин-4-ону, а затем к S,N3-
и S,O-диметилированным производным. Для селективного получения S,N3-изомера наиболее
оптимальным оказалось кипячение в t-BuOH/Cs2CO3. Этилирование 6-полифторалкил-2-тиоурацилов
приводило к образованию S,N3- и S,O-изомеров примерно в равных соотношениях. При нагревании S,N3-
диметилзамещенных пиримидинов в этаноле в присутствии К2CO3 получены калиевые соли урацилов в
результате нуклеофильного замещения метилсульфанильного фрагмента на спиртовый остаток и
последующего его деалкилирования.
Ключевые слова: 6-полифторалкил-2-тиоурацилы, метилирование, этилирование, квантово-химические
расчеты, нуклеофильное замещение, деалкилирование.
DOI: 10.1134/S0514749219060077
Структуру пиримидина имеют важнейшие
[1-(пиперидин-1-ил)этанон]-6-трифторметилпири-
лекарственные препараты: барбитураты (фено-
мидин-4-оны проявляют высокую ингибирующую
барбитал, гексенал), сульфаниламиды (сульфа-
активность в отношении белков, связывающих
диметоксин, сульфадиазин), противовирусные
жирные кислоты, что может быть эффективно в
средства (зидовудин, ламивудин), стимуляторы
лечении диабета второго типа [5]. N-[4-(1Н-Бен-
метаболических процессов (метилурацил,
зимидазол-2-ил)фенил]-2-{[4-(гидрокси)-6-(три-
пентоксил). Современные противоопухолевые
фторметил)пиримидин-2-ил]сульфонил}ацетамид
средства включают производные пиримидинов,
показывает высокую противогрибковую активность
которые действуют как антиметаболиты нуклеино-
в отношении Candida albicans, Candida lunata,
вого обмена (допан, фторурацил) [1, 2]. Введение в
Aspergillus niger и Aspergillus flavus [6]. Этил 3-[4-
пиримидиновый остов полифторалкильного и
гидрокси-6-(трифторметил)пиримидин-2-ил]суль-
тионного фрагментов также приводит к прояв-
фанил}-пропаноат обладает противовоспалительной
лению этими соединениями широкого спектра
активностью, селективно ингибирует ферменты
биологической активности. Так, 6-трифторметил-2-
циклооксигеназы-1/2) и липоксигеназы in vitro [7].
тиоурацил обладает высокой антипаразитарной
2-[(2-Нафталенилметил)сульфанил]-6-(трифтор-
активностью против Toxoplasma gondii в экспе-
метил)-пиримидин-4-амин ингибирует обратную
риментах in vitro и in vivo [3], а 6-гептафтор-
транскриптазу ВИЧ-1 [8].
пропил-2-тиоурацил рекомендован в качестве
антитиреоидного препарата [4]. Алкилированные
Широкий спектр биологической активности 2-
по тионному фрагменту S-(4-метоксибензил)- и S-
тиоурацилов и их S-замещенных аналогов побудил
879
880
ХУДИНА и др.
Схема 1.
F3C
O
F3C
O
F3C
O
F3C
OH
5
5
5
5
4
6
4
6
4
6
4
6
1
3
1
3
1
1
3
HN 2 NH
HN 2 N
N 23NH
N
2
NH
S
SH
SH
S
1a, A
1a, B
1a, C
1a, D
ΔG, кДж/моль
0.0
66.1
24.4
79.5
F3C
OH
F3C
O
F3C
OH
F3C
OH
5
5
5
5
6
4
6
4
6
4
6
4
1
3
3
1
HN123N
N 2 NH
N12 N
N 23N
S
S
S
SH
1a, E
1a, F
1a, G
1a, H
ΔG, кДж/моль
53.4
66.6
136.4
27.4
нас к изучению реакционной способности
Данные ИК, ЯМР спектроскопии гетероциклов
нуклеофильных центров полифторалкилсодержа-
1а, b и РСА, выполненного для кристалла трифтор-
щих
2-тиоурацилов
1 с помощью квантово-
метилсодержащего соединения 1а [10], также свиде-
химических расчетов и реакций алкилирования.
тельствуют об их существовании в кристаллах и
Как известно, фторорганические соединения предс-
растворах в виде 2-тиоксо-2,3-дигидропиримидин-
тавляют особый интерес для создания новых
4(1Н)-онов (схема 1, таутомерная форма A). Так, в
лекарственных препаратов и материалов из-за
их ИК спектрах присутствует полоса поглощения
отличительных свойств электроотрицательных
C=O лактамной группы как в твердом состоянии
атомов фтора, способных модулировать хими-
(при 1683-1689 см-1), так и в растворе ацетонит-
ческие, физические и биологические характерис-
рила (при 1717-1719 см-1). В спектрах ЯМР 1Н
тики создаваемых фторсодержащих молекул [9].
сигналы метиновых протонов в области 6.37-6.41 м.д.
и слабопольные синглетные сигналы при 12.76-
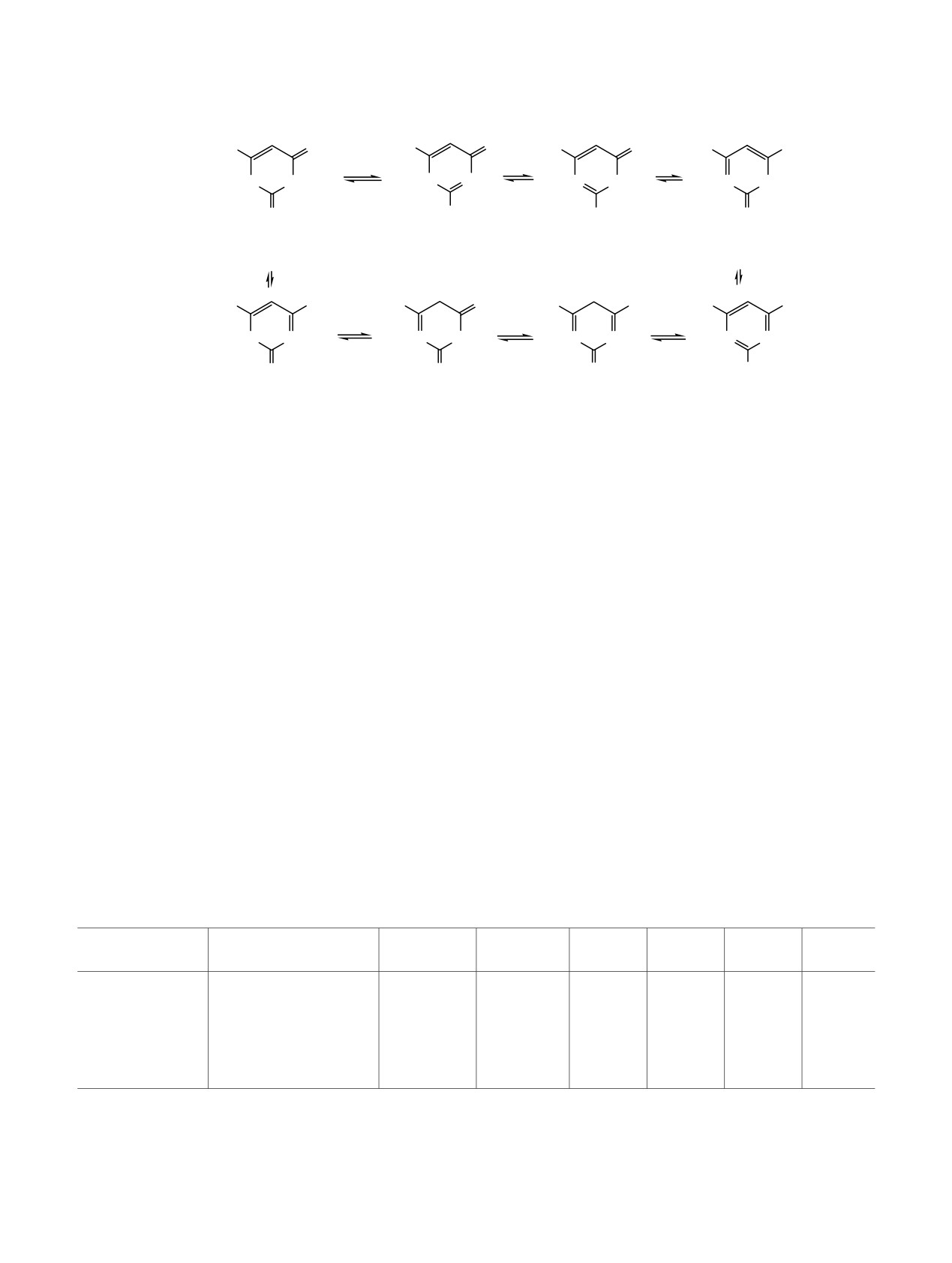
Теоретически 2-тиоурацилы 1 могут сущест-
12.85 и 13.40-13.48 м.д., характерные для протонов
вовать в виде 8 различных таутомерных форм A-H,
двух NH-групп, говорят в пользу таутомерной
что обусловлено подвижностью двух протонов
формы A соединений 1а, b в растворе ДМСО-d6.
(схема 1). Для оценки термодинамической стабиль-
Присутствие в спектре ЯМР 13С тиоурацила 1а сиг-
ности таутомерных форм A-H мы провели ряд
налов атома углерода тионной группы при 176.8 м.д.
квантово-химических расчетов. Согласно резуль-
и карбонильного атома углерода при 159.9 м.д.
татам теоретических исследований для 6-трифтор-
также является доказательством существования в
метил-2-тиоурацила
1а наиболее термодина-
растворе ДМСО-d6 таутомерной формы A.
мически стабильной является форма A (на схеме 1
указана разница значений энергии Гиббса в
2-Тиоурацилы 1 имеют пять альтернативных
условиях идеального газа).
нуклеофильных центров (N1, N3, S, O и С5), в связи
Таблица 1. Значение функций Фукуи для реакционных центров таутомера A тиоурацила 1аа.
Соединение,
Атом
qN+1
qN
qN-1
fi+
fi-
Δf
таутомер
1а, A
C(5)
-0.412
-0.305
-0.258
0.107
0.047
0.060
S
-0.382
-0.133
0.458
0.249
0.591
-0.342
O
-0.702
-0.563
-0.446
0.139
0.117
0.022
N(1)
-0.576
-0.584
-0.543
-0.008
0.041
-0.049
N(3)
-0.648
-0.618
-0.583
0.030
0.035
-0.005
а qN, qN-1, qN+1 - заряды на атомах в молекуле, катион радикале и анион радикале; fi+, fi- - индексы Фукуи для нуклеофильной и
электрофильной атаки, соответственно; ∆f - двойные дескрипторы Фукуи, если значение ∆f > 0, то эти реакционные центры
молекулы «привлекательны» для нуклеофильной атаки, если ∆f < 0 - то для электрофильной.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019
АЛКИЛИРОВАНИЕ 6-ПОЛИФТОРАЛКИЛ-2-ТИОУРАЦИЛОВ ГАЛОГЕНАЛКАНАМИ
881
с чем для них в реакциях алкилирования возможно
[13] конденсацией эфира
4,4,4-трифтор-3-
образование четырех региоизомерных продуктов
оксобутановой кислоты с сернокислой S-метил-изо-
монозамещения, а также шести дизамещенных
тиомочевиной в водном растворе K2CO3,
производных. Для теоретической оценки реак-
спектральные характеристики таких пиримидинов,
ционной способности нуклеофильных центров 6-
полученных разными методами, совпадают.
трифторметил-2-тиоурацила
1а в таутомерной
При метилировании тиоурацилов
1а, b
форме A рассчитаны локальные индексы реакцион-
трехкратным избытком MeI в ацетонитриле в
ной способности нуклеофильных центров в
присутствии K2CO3 получено два типа диметил-
приближении идеального газа (табл. 1).
замещенных гетероциклов 3а, b (выходы 68-74%)
Оказалось, что для таутомера A гетероцикла 1а
и 4а, b (выходы 5-9%) (схема 2). С целью опреде-
наиболее нуклеофильным является S-центр, менее
ления условий для селективного получения одного
из продуктов нами опробованы различные системы
нуклеофильными - центры N1 и N3, в то время как
атомы О и С5 должны проявлять слабоэлектро-
для метилирования тиоурацилов
1а, b MeI с
фильный характер.
анализом данных методом ГХ-MC. Наилучшие
результаты с максимальным суммарным выходом
Для экспериментальной оценки реакционной
продуктов в различных условиях даны в табл. 2.
способности нуклеофильных центров
2-тиоура-
Найдено, что наиболее полная конверсия 99%
цилов 1 были изучены реакции алкилирования
наблюдается при алкилировании соединений 1а, b
(метилирование и этилирование).
MeI в ацетоне или ацетонитриле в присутствии
Анализ литературных данных показал, что
K2CO3 или Cs2CO3, при этом всегда преобладают
метилирование при комнатной температуре
6-
продукты 3а, b. Соотношение изомеров 3: 4 в этих
трифторметил-2-тиоурацила 1а MeI в основных
условиях изменяется незначительно (3.6-4.6:1) для
условиях в ТГФ
[11] и Me2SO4 в щелочных
3а:4a и (5.4-5.8:1) для 3b:4b, однако при приме-
условиях (NaOH, H2O) [12] проходит по атому
нении Na2CO3 конверсия и скорость реакции
серы с образованием S-метилзамещенного продукта
уменьшаются, а соотношение изомеров
3a:4a
2. Выполненное нами метилирование тиоурацила
увеличивается
(6.2-6.8:1). В спиртах картина
1а избытком (3 экв.) MeI в ТГФ в присутствии
меняется, реакция протекает более селективно,
K2CO3 при 20°С или избытком (3 экв.) MeI в ацето-
однако в этом случае суммарный выход продуктов
нитриле в присутствии K2CO3 при охлаждении до
3a и
4a уменьшается и зависит от природы
-10÷-15°С привело к тем же результатам,
используемого спирта. При этом при проведении
поскольку в обоих случаях был выделен S-
реакции в EtOH суммарный выход почти не
метилзамещенный пиримидинон 2 (схема 2). Это
зависит от типа металла в добавляемом карбонате
же соединение 2 было синтезировано нами ранее
(40-46%), тогда как в t-BuOH выход существенно
Схема 2.
F3C
O
MeI, K2CO3, ТГФ, 20оС
или MeI, K2CO3, MeCN, _15оС
N NH
SMe
2, 52%, 74%
F
R
O
изб. AlkI,
O
RF
OR
RF
1
3
K2CO3, MeCN, т.кип.
HN NH
Alk = Me, Et
N N
+ N N
R
S
1a, b
SR
SR
3a_c, 25_74%
4a_c, 5_51%
MeI, K2CO3, MeCN, 25оС
2
+
3a
+
4a
1: RF = CF3 (a), C3F7 (b); 3,4: R = Me, RF = CF3 (a), C3F7 (b); R = Et, RF = CF3 (c).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019
882
ХУДИНА и др.
Таблица 2. Результаты анализа реакций метилирования тиоурацилов 1a, b методом ГХ.
Соотношение
Т.кип.
Выход продуктов,
Тиоурацил
Условия реакции
Время реакции, ч
продуктов
раство-рителя, °С
3 + 4, %
3:4
1а
Me2CO/Na2CO3
56
4
6.8:1
88
Me2CO/K2CO3
56
2
4.6:1
99
Me2CO/Cs2CO3
56
4
3.7:1
99
MeCN/Na2CO3
82
6
6.2:1
78
MeCN/K2CO3
82
1
4.1:1
99
MeCN/Cs2CO3
82
2
3.6:1
99
ТГФ/K2CO3
66
6
17:1
86
EtOH/Na2CO3
78
5
16.5:1
40
EtOH/K2CO3
78
5
12.5:1
43
EtOH/Cs2CO3
78
5
14.9:1
46
t-BuOH/Na2CO3
83
3
1:0
3
t-BuOH/K2CO3
83
5
49.7:1
38
t-BuOH/Cs2CO3
83
7
40.5:1
85
t-BuOH/NaOH
83
5
3.2:1
5
1,4-диоксан/К2СО3
101
1
Реакция не идет
1b
Me2CO/K2CO3
56
1
5.8:1
99
MeCN/K2CO3
82
1
5.4:1
99
EtOH/K2CO3
78
2
15.4:1
40
увеличивается от 3 до 85% с ростом радиуса
3а и 4а (cхема 2). Мы также провели реакцию
катиона металла соли. Наилучший результат мы
метилирования в MeCN/K2CO3 при
25°С. В
наблюдали в системе t-BuOH/Cs2CO3, в которой
реакционной массе через 3 ч нами методом ГХ
соотношение изомеров 3a:4a равнялось 40.5:1, а
была зафиксирована смесь трех соединений 2:3а:4a
суммарный выход составил 85% (табл. 2). Эти
в соотношении (24:65:11). Результаты, полученные
условия являются оптимальными для селективного
при комнатной температуре, являются экспери-
получения изомера 3а.
ментальным доказательством механизма прохож-
дения реакции: сначала образуется калиевая соль
Таким образом, нами показано, что алкили-
тиоурацила 1, которая метилируются в первую
рование тиоурацила 1а избытком MeI в ацетонит-
очередь по самому нуклеофильному центру
-
риле в присутствии K2CO3 при охлаждении до
атому S, а затем метилирование S-монозаме-
-10÷-15°С приводит к S-метилзамещенному
щенных производных проходит по конкурентным
продукту 2, а при кипячении в ацетонитриле уже
центрам N3 и O с доминирующим образованием
образуется смесь диметилзамещенных продуктов
изомера 3а (схема 3).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019
АЛКИЛИРОВАНИЕ 6-ПОЛИФТОРАЛКИЛ-2-ТИОУРАЦИЛОВ ГАЛОГЕНАЛКАНАМИ
883
Схема 3.
F3C
O
N N
Me
SMe
F3C
O
F3C
O
F3C
O
3a
K
2CO3
изб. MeI
изб. MeI
HN NH
N NH
N NH
+
MeCN, 25oC
F3C
OMe
S
K
S
SMe
N N
1a
I
2
SMe
4a
Данных по этилированию
6-трифторметил-2-
соотношения изомеров 3c:4c. Если в ацетоне и
тиоурацила 1а в литературе не обнаружено, хотя
ацетонитриле в присутствии Na2CO3 наблюдается
для синтеза S-этилзамещенного 6-трифторметил-
небольшой избыток изомера
3c, соотношение
пиримидин-4-она предложено использовать
продуктов 3c:4c равно 1.1-1.4:1, то в присутствии
циклизацию этил-4,4,4-трифтор-3-оксобутаноата с
К2CO3 и Сs2CO3 незначительно преобладает уже
S-этил-изо-тиомочевиной [14].
изомер 4c, соотношение изомеров 3c:4c составляет
1:1.3-1.9. В спиртах суммарный выход продуктов
Для реакции этилирования тиоурацила 1а EtI
3c и 4c падает до 35-41%, хотя реакция протекает
нами также опробованы различные условия с
более селективно, соотношение изомеров 3c:4c при
анализом данных методом ГХ-MC. Наилучшие
этом составляет 4.2-21.4:1 (табл. 3).
результаты с максимальным суммарным выходом
продуктов в различных условиях приведены в
Для установления региоизомерного строения
табл.
3. Использование EtI для алкилирования
диалкилзамещенных продуктов
3а-с и
4а-с
тиоурацила
1а приводит к выравниванию
полезными оказались данные ИК спектроскопии,
Таблица 3. Результаты анализа реакций этилирования тиоурацила 1a методом ГХ.
Соотношение
Т.кип.
Выход продуктов,
Тиоурацил
Условия реакции
Время реакции, ч
продуктов
растворителя, °С
3с + 4с, %
3с:4с
1а
Me2CO/Na2CO3
56
5
1.4:1
68
Me2CO/K2CO3
56
4
1:1.3
82
Me2CO/Cs2CO3
56
3
1:1.6
94
MeCN/Na2CO3
82
6
1.1:1
40
MeCN/K2CO3
82
3
1:1.9
91
MeCN/Cs2CO3
82
1
1:1.3
92
EtOH/Na2CO3
78
1
17.9:1
40
EtOH/K2CO3
78
3
21.4:1
41
EtOH/Cs2CO3
78
3
4.2:1
35
t-BuOH/Cs2CO3
83
3
5:1
36
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019
884
ХУДИНА и др.
поскольку в спектрах S,О-диметил- изомеров 4а-с
заместитель находится при атоме азота N3
отсутствует полоса поглощения С=О лактамной
лактамной группы.
группы, тогда как в спектрах S,N-диметилиро-
Следует отметить, что S,O-диметилзамещенный
ванных производных
3а-с она фиксируется в
пиримидин 4а был получен ранее [15] другим
области
1696-1699 см-1. В спектрах ЯМР
1Н
способом из
2-метилтио-6-трифторметил-4-хлор-
продуктов 3а, b и 4а, b, измеренных в СDCl3,
пиримидина, но охарактеризован только элемент-
сигналы протонов MeS-групп наблюдаются в
ным анализом и температурой плавления.
интервале δ 2.56-2.63 м.д., в то время как сигнал
протонов MeN-заместителя S,N-изомеров
3а, b
Для сравнения в литературе описано, что
резонирует при δ 3.54-3.55 м.д., а сигнал протонов
метилирование 6-метил-2-тиоурацила MeI в ацетоне
MeO-группы S,O-изомеров 4а, b регистрируется
в присутствии КОН приводит к образованию двух
при δ 4.03 м.д.
S,N1- и S,N3-диметил-изомерных пиримидинонов
[16], хотя авторы [17] сообщали об образовании
В спектрах ЯМР
1Н S,N- и S,О-диэтил-
только одного S,N3-изомера в этой реакции.
содержащих продуктов 3c и 4c в СDCl3 наблю-
Получение S,O-диметил-изомера реализовано
дается незначительная разница в сдвигах метиле-
путем метоксилирования
6-метил-2-метилтио-4-
новых протонов EtS-заместителя (δ 3.15 и 3.23 м.д.)
хлорпиримидина [18].
и EtN- и EtO-групп (δ 4.11 и 4.47 м.д.), соответст-
венно. Химические сдвиги ядер углерода метиле-
Нами установлено, что низкий суммарный
новых групп в спектрах ЯМР 13С гетероцикла 3c
выход продуктов 3b и 4b (40%, табл. 1) в реакции
наблюдаются при δC
26.91 и
40.12 м.д., что
алкилирования тиоурацила
1b MeI в EtOH в
соответствует ядрам углерода SCH2- и NCH2-
присутствии К2СО3 обусловлен дальнейшими
групп, а у пиримидина 4с регистрируются сигналы
превращениями S,N3-изомера
3b. Так, в
ядер углерода метиленовых групп при δC 25.42 и
реакционной массе через 2 ч методом ГХ-МС был
63.42 м.д., что характерно для SCH2- и ОCH2-
зарегистрирован пик m/z 322 [M]+ 2-этоксизаме-
фрагментов.
щенного пиримидинона J (RF = C3F7), а последую-
щий мониторинг этой реакции через 4 ч показал
В спектрах ЯМР
19F соединений 3а, c не
присутствие 3-метил-6-гептафторпропилурацила K
наблюдается расщепления сигнала CF3-
(RF = C3F7) с пиком m/z 294 [M]+ (схема 4).
заместителя или его сдвига (δ 89.91, 89.80 м.д. в
CDCl3) по сравнению с
2-метилсульфанил-6-
Целенаправленное кипячение соединений 3a, b
трифторметилпиримидин-4(3Н)-оном (δ 89.88 м.д.
в абсолютном EtOH в присутствии K2CO3 привело
в CDCl3) [13], которое имело бы место при его
к образованию калиевых солей урацилов 6a, b. При
близком расположении с алкильным заместителем
этом из реакции S,N-диметилзамещенного пирими-
при N1. Отсюда можно заключить, что алкильный
динона 3а нам удалось выделить промежуточный
Схема 4.
F
R
O
RF
O
RF
O
HN N
N N
N N
Me
Me
Me
O
K
O
OEt
K2CO3
3a, b
J
K
6a, b, 66_73%
EtOH (абс),
т.кип.
F3C
O
N N
Me
OEt
5, 32%
3, 6: RF = CF3 (a), C3F7 (b).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019
АЛКИЛИРОВАНИЕ 6-ПОЛИФТОРАЛКИЛ-2-ТИОУРАЦИЛОВ ГАЛОГЕНАЛКАНАМИ
885
продукт - 3-метил-6-трифторметил-2-этоксипири-
сигнал MeN-группы при 3.06 м.д. и протона СН=
мидин-4-он 5 (схема
4). Спектр ЯМР 1Н этого
при 5.47 м.д. В спектре ЯМР 13C соли 6b регист-
продукта наряду с синглетным сигналом MeN-
рируется сигнал ядра углерода метильной группы
группы при 3.44 м.д. содержит триплетный сигнал
при 26.54 м.д., что является характерным для MeN-
при 1.45 м.д. и квартетный сигнал при 4.54 м.д.,
фрагмента.
характерные для EtO-заместителя.
Для калиевых солей 6a, b можно предположить
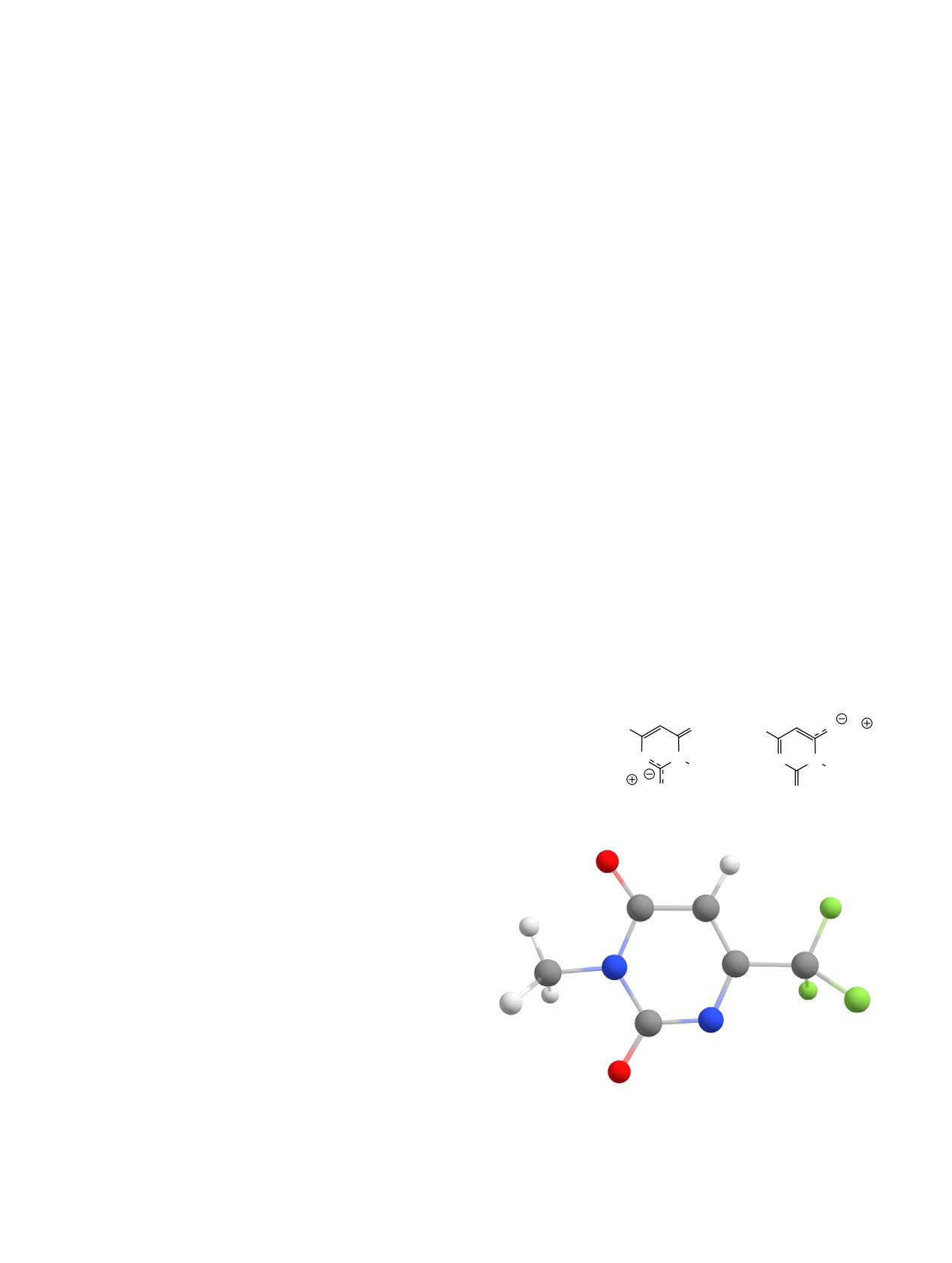
Кислотно-катализируемый гидролиз MeS-
различное строение из-за разной локализации
группы в пиримидинах широко используется для
отрицательного заряда. Достоверно установить их
получения урацилов [19, 20]. Однако, мы полагаем,
строение с помощью физико-химических методов
что в исследуемых нами превращениях образо-
нам не удалось. Выполненные квантово-
вание урацилов 6a, b проходит иначе. Очевидно,
химические расчеты показали, что отрицательный
что сначала реализуется нуклеофильное замещение
заряд в урацильном анионе соли 6а сильно дело-
MeS-группы на EtO-фрагмент растворителя с
кализован (см. рисунок). Исходя из анализа распре-
промежуточным образованием 2-этоксипиримиди-
деления электронной плотности отрицательного
нонов J (продукт 5 выделен). Нуклеофугность SMe-
заряда в анионе соли 6а, можно предположить два
группы хорошо известна. Так, нами ранее [13]
наиболее вероятных положения катиона калия:
была показана возможность замещения MeS-
между атомом кислорода О2 и азотом N3 (соль L)
функции в положении 2 6-(полифторалкил)пири-
или при атоме кислорода О6 (соль M). Оценка
мидин-4-онов на фрагмент гидразина или морфо-
термодинамической стабильности солей L и M
лина. Описано замещение 2-MeS-группы в пиридо-
показала предпочтительность существования соли
[3,4-d]пиримидин-4-оне на EtO-остаток при нагре-
L (cхема 5).
вании в растворе этилата натрия в условиях
Таким образом, в результате выполненного
микроволнового облучения [21].
исследования показано, что
6-полифторалкил-2-
Мы полагаем, что далее протекает деалкили-
тиоурацилы согласно квантово-химическим
рование этоксильного заместителя в 3-метил-2-
расчетам и экспериментальным данным сущест-
этоксипиримидинонах J под действием EtOH как
вуют в виде 2-тиоксо-6-полифторалкил-2,3-дигид-
нуклеофила по α-С или β-С этильной группы с
ропиримидин-4(1Н)-онов. Наши и литературные
последующим прохождением реакции по SN2 или
E2 механизму, давая урацилы K как интермедиаты,
Схема 5.
которые выделить нам не удалось из-за быстрого
6
F3C
O
F3C
O
K
образования из них калиевых солей 6a, b (схема 4).
3
1
Возможность реализации деалкилирования по
N N
или
N N
Me
Me
предложенной схеме описана для
3-бензил-2-
2
K
O
O
этоксихиназолин-4-она при нагревании с бензил-
L
M
амином до 150°С или морфолином до 100°С [22].
ΔGo(6a), кДж/моль
0.0
23.2
Авторы этой работы считают, что стерические
затруднения в
3-бензил-2-этоксихиназолин-4-оне
являются причиной предпочтительной атаки
-0.402
нуклеофилов - бензиламина и морфолина не по
положению
2 гетероцикла, а по α-С или β-С
этильной группы с образованием 3-бензилхиназо-
лин-2,4-диона.
Соли 6a, b охарактеризованы методами ИК,
-0.116
ЯМР спектроскопии и элементным анализом. Так,
в ИК спектрах гетероциклов 6a, b присутствует
полоса поглощения С=О лактамной группы при
-0.206
1654-1668 см-1, которая имеет батохромный сдвиг
по сравнению с полосой поглощения С=О лак-
-0.404
тамов 3a, b. В спектрах ЯМР 1Н соединений 6a, b,
измеренных в ДМСО-d6, наблюдается синглетный
Распределение отрицательного заряда в анионе соли 6а.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019
886
ХУДИНА и др.
данные [6-8, 11, 12] свидетельствуют о перво-
(полидиметилсилоксан, 5 мас% фенильных групп),
начальном алкилировании полифторалкилсодер-
длиной 30 м, диаметром 0.25 мм, толщиной пленки
жащих тиоурацилов по самому нуклеофильному
0.25 мкм. Температура колонки - начальная 40°C
центру - атому S. Однако в этой работе нами
(изотерма 3 мин), программирование со скоростью
найдено, что в основных условиях (особенно при
10°С·мин-1 до 280°С (изотерма 30 мин), темпе-
нагревании) проходит дальнейшее алкилирование
ратура испарителя - 250°С, детектора - 300°С. Газ-
S-монозамещенных производных по конкурентным
носитель - азот, деление потока 1:30, расход через
центрам N3 и O. При этом при метилировании
колонку 1.0 мл/мин. Масс-спектры образующихся
наблюдается преимущественное образование S,N3-
соединений регистрировали с помощью газового
изомеров, а при этилировании S,N3- и S,O-изомеры
хроматографа/масс-спектрометра «Trace GC Ultra
регистрируются в примерно равном соотношении.
DSQ II» с кварцевой капиллярной колонкой
Такое изменение в направлении этилирования
Thermo TR-5MS (полидиметилсилоксан, 5 мас %
может быть обусловлено стерическими факторами,
фенильных групп) длиной 30 м, диаметром 0.25 мм
поскольку введение в S-положение более
с толщиной пленки 0.25 мкм и квадрупольным
объемного по сравнению с метильной группой
масс-спектрометрическим детектором (ГХ/МС).
этильного заместителя может затруднять атаку
Масс-спектры записывали в условиях электронной
алкилирующего реагента по соседнему атому
ионизации (ЭИ) c энергией ионизации 70 эВ при
азота. Кроме того, установлено, что S,N3-
сканировании в диапазоне
20-1000 Да.
диметилзамещенные пиримидины при нагревании
Температура колонки начальная 40°С (изотерма
в абсолютном этаноле в основных условиях
3 мин), программирование 10°С·мин-1 до 280°С
подвергаются нуклеофильному замещению
(изотерма 40 мин), температура испарителя - 250°С,
метилсульфанильной группы на этоксильный
переходной линии - 230°С, масс-спектрометричес-
фрагмент с последующим его деалкилированием и
кого источника - 200°С. Газ-носитель - гелий, деле-
образованием калиевых солей урацилов.
ние потока 1:50, расход через колонку 1.0 мл/мин.
Квантово-химические расчеты. Теоретичес-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
кие расчеты (оптимизация геометрических пара-
метров и решение колебательной задачи) прово-
Спектры ЯМР записаны на спектрометрах
дили с помощью программного обеспечения
«Bruker DRX-400» [400 МГц (1Н) относительно
GAUSSIAN C09 [23] с использованием TPSS [24] c
SiMe4, 376 МГц (19F) относительно С6F6] и «Avance
базисным набором
6-311+G(d,p)
[25]. Термоди-
500» [500 МГц (1H) относительно SiMe4, 470 МГц
намические параметры таутомерных форм, а также
(19F) относительно С6F6, 126 МГц (13C) относи-
NBO анализ реакционных центров тиоурацила 1а
тельно сигнала растворителя] в CDCl3 и DMSO-d6.
проводили в приближении газовой фазы, а
ИК спектры записаны на ИК-Фурье спектрометре
калиевых солей 6а, b в условиях эксперимента
«Perkin Elmer Spectrum One» в интервале 4000-
(поляризованная модель континуума
[26]),
400 см-1 с помощью приставки диффузного
температура 298.15 К и давление 1 атм, в качестве
отражения (ДО), на ИК-Фурье спектрометре
растворителя рассматривали этанол.
«Thermo Electron Corporation Nicolet
6700» с
помощью приставки нарушенного
полного
Определение функции Фукуи [26] для реак-
внутреннего отражения (НПВО) или
в слое.
ционного центра может быть записано как: fA+ =
Элементный анализ (С, Н, N) выполнен на
qAN + qAN+1 - для нуклеофильной атаки, f
– = qAN-1 -
анализаторе
«Perkin Elmer PE
2400 series II».
qAN - для электрофильной атаки, где qAN - заряд на
Температуры плавления измерены в открытых
атоме в молекуле, а qAN+1 - заряд атома в анион-
капиллярах на аппарате для определения точки
радикале, qAN-1 - заряд на катион-радикале.
плавления «Stuart SMP30». Колоночную хроматог-
Расчет двойного дескриптора функций Фукуи:
рафию проводили на силикагеле 60 (0.063-0.02 мм)
марки «Merck».
ΔfA = fA+ - fA = (qAN - qAN+1) - (qAN-1 - qAN) =
2qAN - qAN+1 - qAN-1.
Контроль за ходом взаимодействий проводили с
использованием газового хроматографа «Shimadzu
2-Тиоксо-6-(трифторметил)-2,3-дигидропи-
GC 2010Plus» с пламенно-ионизационным детек-
римидин-4(1H)-он (1а) синтезирован по методу
тором (ГХ), кварцевой капиллярной колонкой ZB-5
[10]. Нами сняты ИК и ЯМР спектры тиоурацила
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019
АЛКИЛИРОВАНИЕ 6-ПОЛИФТОРАЛКИЛ-2-ТИОУРАЦИЛОВ ГАЛОГЕНАЛКАНАМИ
887
1а, поскольку в более ранних работах [10, 27] эти
в. Смесь тиоурацила 1а, b (1 ммоль), галоген-
данные не были приведены. ИК спектр (ДО), ν, см-1:
алкана (3 ммоля) и К2СО3 (276 мг, 2 ммоля) в
3128, 3064, 2968, 2895 (NHвал, СН), 1689 (С=O),
ацетонитриле (15 мл) кипятили 1-3 ч. Осадок
1655, 1582 (C=N, С=С, NHдeф), 1090-1210 (C-F).
отфильтровывали, маточный раствор концентри-
Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 6.41 д (1Н, H5, J
ровали. Диметилзамещенные тиоурацилы 3 и
4
1.4 Гц), 12.85 с (1Н, NH), 13.48 уш.с (1Н, NH). Спектр
очищали колоночной хроматографией, элюент -
ЯМР 13С (ДМСО-d6), δ, м.д.: 105.17 к (C5, J 3.8 Гц),
гексан-этилацетат (4:1) использовали для разделе-
118.85 к (СF3, J 275 Гц), 140.57 к (С6, J 36 Гц), 159.86
ния изомеров 3a, c и 4а, с, элюент - гексан-
(С=О), 176.85 (C=S). Спектр ЯМР 19F (ДМСО-d6),
этилацетат
(6:1) применяли для выделения
δ, м.д.: 94.47 (3F, CF3). Масс-спектр (ЭИ, 70 эВ), m/z
продуктов 3b и 4b.
(Iотн, %): 196 (83) [M]+·, 177 (3) [M - F]+, 163 (4) [M -
2-(Метилсульфанил)-6-(трифторметил)пири-
HS]+, 149 (4) [M - CH2SH]+, 138 (29) [M - NCS]+, 69
мидин-4(3H)-он
(2). Выход
109 мг
(52%) по
(13) [CF3]+, 68 (100) [C2H2NCO]+, 45 (3) [CHS]+.
методу а,
155 мг
(74%) по методу б, белый
2-Тиоксо-6-(гептафторпропил)-2,3-дигидропи-
порошок, т.пл. 178-180°С (т.пл. 178-179°С [13]).
римидин-4(1H)-он (1b). Смесь этил 4,4,5,5,6,6,6-
Масс-спектр (ЭИ, 70 эВ), m/z (Iотн, %): 210 (100)
гептафтор-3-оксогексаноата (4.262 г, 15 ммоль),
[M]+·, 190 (16) [M - HF]+, 177 (2) [M - HS]+, 163
тиомочевины (1.52 г, 20 ммоль) и 2 М этанольного
(40) [M - CH3S]+, 138 (14) [M - NCS,CH2]+, 69 (9)
раствора этилата натрия
(15 мл) кипятили в
[CF3]+, 68 (16) [C2H2NCO]+, 46 (9) [CH2S]+.
течение 20 ч. Растворитель удаляли под вакуумом.
3-Метил-2-(метилсульфанил)-6-(трифтор-
Осадок растворяли в дистиллированной воде.
метил)пиримидин-4(3H)-он (3а). Выход 152 мг
Раствор подкисляли ледяной уксусной кислотой и
(68%) по методу в, белый порошок, т.пл. 83-85°С.
оставляли на ночь. Выпавший осадок отфильтро-
ИК спектр (ДО), ν, см-1: 3065, 2937 (СН), 1696
вывали, промывали водой и перекристаллизо-
(С=O), 1519 (С=N, C=C), 1136-1173 (C-F). Спектр
вывали из уксусной кислоты. Выход 2.088 г (47%),
ЯМР 1H (CDCl3), δ, м.д.: 2.63 с (3Н, SCH3), 3.54 с
белый порошок, т.пл.
229-231°С. ИК спектр
(3Н, NCH3), 6.55 с
(1H, H5). Спектр ЯМР 19F
(НПВО), ν, см-1: 3128, 3072, 2952, 2883 (NHвал, СН),
(CDCl3), δ, м.д.: 89.91 с (CF3). Масс-спектр (ЭИ, 70 эВ),
1683 (С=O),
1122-1233 (C-F). Спектр ЯМР 1H
m/z (Iотн, %): 224 (40) [M]+·, 209 (6) [M - CH3]+, 205
(ДМСО-d6), δ, м.д.: 6.37 с (1Н, H5), 12.76 с (1Н,
(7) [M - F]+, 196 (1) [M - CO]+, 191 (3) [M - HS]+,
NH), 13.40 уш.с (1Н, NH). Спектр ЯМР 19F (ДМСО-
179 (100) [M - CHS]+, 138 (3) [M - NCS,C2H4]+, 69
d6), δ, м.д.: 37.15 м (2F, CF2), 46.92 м (2F, CF2),
(12)
[CF3]+, 68 (4) [C2H2NCO]+, 45 (11) [CHS]+.
82.97 т (3F, CF3, J 9.3 Гц). Масс-спектр (ЭИ, 70 эВ),
Найдено, %: С 37.66; Н 3.13; N 12.35. С7Н7F3N2ОS.
m/z (Iотн, %): 296 (41) [M]+·, 263 (2) [M - HS]+ (2),
Вычислено, %: С 37.50; Н 3.15; N 12.49.
249 (2) [M - CH2SH]+, 238 (22) [M - NCS]+, 69 (16)
6-(Гептафторпропил)-3-метил-2-(метил-
[CF3]+,
68
(100)
[C2H2NCO]+,
45
(4)
[CHS]+.
сульфанил)пиримидин-4(3H)-он (3b). Выход 240 мг
Найдено, %: С 28.56; Н 1.12; N 9.39. С7Н3F7N2ОS.
(74%) по методу в, белый порошок, т.пл. 29-30°С.
Вычислено, %: С 28.39; Н 1.02; N 9.46.
: 3085, 2939 (СН), 1699
ИК спектр (НПВО), ν, см-1
Метилирование тиоурацилов 1. а. Смесь тио-
(С=O), 1516 (С=N, C=C), 1100-1227 (C-F). Спектр
урацила 1а (200 мг, 1 ммоль), MeI (426 мг, 3 ммоля)
ЯМР 1H (CDCl3), δ, м.д.: 2.60 с (3Н, SCH3), 3.55 с
и К2СО3 (276 мг, 2 ммоля) в ТГФ (15 мл) переме-
(3Н, NCH3), 6.59 с
(1H, H5). Спектр ЯМР 19F
шивали 40 мин при 20°С. Осадок отфильтровы-
(CDCl3), δ, м.д.: 35.50 м (2F, CF2), 43.92 м (2F, CF2),
вали, избыток MeI и растворитель отгоняли под
81.42 т (3F, CF3, J 9.2 Гц). Масс-спектр (ЭИ, 70 эВ),
вакуумом. Продукт 2 выделяли колоночной хрома-
m/z (Iотн, %): 324 (30) [M]+·, 309 (4) [M - CH3]+, 305
тографией, элюент - хлороформ-этилацетат, 1:1.
(<1) [M - F]+, 295 (1) [M - HCO]+, 291 (2) [M - HS]+,
279 (100) [M - CHS]+, 238 (5) [M - NCS,C2H4]+, 69
б. Смесь тиоурацила 1а (200 мг, 1 ммоль), MeI
(29)
[CF3]+, 68 (15) [C2H2NCO]+, 45 (17) [CHS]+.
(426 мг, 3 ммоля) и К2СО3 (276 мг, 2 ммоля) в
Найдено, %: С 33.61; Н 2.19; N 8.45. С9Н7F7N2ОS.
ацетонитриле (15 мл) перемешивали 3 ч при -10÷
Вычислено, %: С 33.34; Н 2.18; N 8.64.
-15°С. Осадок отфильтровывали, избыток MeI и
растворитель отгоняли под вакуумом. Продукт 2
3-Этил-2-(этилсульфанил)-6-(трифторметил)-
выделяли колоночной хроматографией, элюент -
пиримидин-4(3H)-он (3с). Выход 63 мг (25%) по
хлороформ-этилацетат, 1:1.
методу в, бесцветное масло, т.пл. 21-22°С. ИК
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019
888
ХУДИНА и др.
спектр (в слое), ν, см-1: 2981, 2937 (СН), 1698
H5). Спектр ЯМР 13С (CDCl3), δ, м.д.: 14.04 (CH3),
(С=O), 1505 (С=N, C=C), 1070-1183 (C-F). Спектр
14.23 (CH3), 25.42 (SCH2), 63.42 (ОCH2), 100.41 к
ЯМР 1H (CDCl3), δ, м.д.: 1.34 т (3Н, SCH2CH3, J
(С5, J 3.1 Гц), 120.33 к (CF3, J 274.7 Гц), 155.91 к
7.3 Гц), 1.41 т (3Н, NCH2CH3, J 7.3 Гц), 3.23 к (2Н,
(С6, J 35.5 Гц), 169.47 (С4), 173.56 (C2). Спектр
SCH2CH3, J 7.3 Гц), 4.11 к (2Н, NCH2CH3, J 7.3 Гц),
ЯМР 19F (CDCl3), δ, м.д.: 91.15 с (CF3). Масс-спектр
6.52 с (1H, H5). Спектр ЯМР 13С (CDCl3), δ, м.д.:
(ЭИ,
70 эВ), m/z (Iотн, %): 252 (98) [M]+·, 233 (10)
12.13 (CH3),
13.60 (CH3),
26.91 (SCH2),
40.12
[M - F]+, 223 (68) [M - C2H5]+, 219 (23) [M - HS]+,
(NCH2), 107.31 к (С5, J 3.5 Гц), 120.34 к (CF3, J
191 (100) [M - C2H5S]+, 138 (83) [M - NCS,C4H8]+,
274.7 Гц), 150.44 к (С6, J 35.5 Гц), 161.13 (С4),
109 (21) [M - C2H5O,C2H5,CF3]+, 69 (16) [CF3]+, 68
164.70 (C2). Спектр ЯМР 19F (CDCl3), δ, м.д.: 89.80
(40) [C2H2NCO]+, 45 (16) [CHS]+. Найдено, %: С
с (CF3). Масс-спектр (ЭИ, 70 эВ), m/z (Iотн, %): 252
42.62; Н 4.49; N 11.01. С9Н11F3N2ОS. Вычислено,
(23) [M]+·, 233 (8) [M - F]+, 224 (25) [M - CO]+, 223
%: С 42.85; Н 4.40; N 11.11.
(79) [M - C2H5]+, 219 (15) [M - HS]+, 191 (40) [M -
Нуклеофильное замещение в гетероцикле 3а.
C2H5S]+, 163 (100)
[C5H2F3N2O]+, 138 (21) [M -
Смесь соединения 3a, b (1 ммоль) и К2СО3 (414 мг,
NCS,C4H8]+, 69 (17) [CF3]+, 68 (31) [C2H2NCO]+, 45
3 ммоля) в абсолютном этаноле (15 мл) кипятили
(12) [CHS]+. Найдено, %: С 43.06; Н 4.33; N 11.17.
3 ч. Осадок отфильтровывали, маточный раствор
С9Н11F3N2ОS. Вычислено, %: С 42.85; Н 4.40; N
концентрировали. Продукт 5 выделяли колоночной
11.11.
хроматографией, элюент - гексан-этилацетат, 4:1.
2-(Метилсульфанил)-4-метокси-6-(трифтор-
3-Метил-6-(трифторметил)-2-этоксипирими-
метил)пиримидин
(4а). Выход 20 мг (9%) по
дин-4(3H)-он (5). Выход 71 мг (32%), бесцветное
методу в, бесцветное масло (т.пл. 36-37°С [15]).
масло. ИК спектр (ДО), ν, см-1: 3068, 2996 (СН),
Спектр ЯМР 1H (CDCl3), δ, м.д.: 2.58 с (3Н, SCH3),
1697 (С=О), 1556, 1507 (С=N, C=C), 1071-1163 (C-F).
4.03 с (3Н, OCH3), 6.69 с (1H, H5). Спектр ЯМР 19F
Спектр ЯМР
1H (CDCl3), δ, м.д.: 1.45 т
(3Н,
(CDCl3), δ, м.д.: 91.17 с (CF3). Масс-спектр (ЭИ, 70 эВ),
CH2CH3, J 7.1 Гц), 3.44 c (3H, NCH3), 4.54 к (2Н,
m/z (Iотн, %): 224 (100) [M]+·, 209 (59) [M - CH3]+,
OCH2CH3, J 7.1 Гц), 6.48 с (1H, H5). Спектр ЯМР
205 (9) [M - F]+, 191 (<1) [M - HS]+, 178 (32) [M -
19F (CDCl3), δ, м.д.: 89.72 с (CF3). Масс-спектр (ЭИ,
CH2S]+, 138 (11) [M - NCS,C2H4]+, 109 (18) [M -
70 эВ), m/z (Iотн, %): 222 (30) [M]+·, 207 (10 [M -
CH3O,CH3,CF3]+, 69 (12) [CF3]+, 68 (9) [C2H2NCO]+,
CH3]+, 203 (8) [M - F]+, 194 (100) [M - C2H4]+·, 178
45 (11) [CHS]+.
(23) [M - OC2H4]+, 166 (19) [M - COC2H4]+, 137 (59)
[M - COC2H4,NCH3]+, 108 (13) [M - OC2H5,CF3,]+,
4-(Гептафторпропил)-2-(метилсульфанил)-6-
69 (9) [CF3]+, 68 (41) [C2H2NCO]+. Найдено, %: С
метоксипиримидин (4b). Выход 16 мг (5%) по
42.97; Н 4.03; N 12.44. С8Н9F3N2О2. Вычислено, %:
методу в, бесцветное масло. ИК спектр (НПВО), ν,
С 43.25; Н 4.08; N 12.61.
см-1: 1586, 1558 (С=N, C=C), 1123-1227 (C-F).
Спектр ЯМР 1H (CDCl3), δ, м.д.: 2.56 с (3Н, SCH3),
Синтез калиевых солей урацилов 6a, b. Смесь
4.03 с (3Н, OCH3), 6.72 с (1H, H5). Спектр ЯМР 19F
соединения 3a, b (1 ммоль) и К2СО3 (414 мг, 3 ммоля)
(CDCl3), δ, м.д.: 36.22 м (2F, CF2), 45.51 м (2F, CF2),
в этаноле (15 мл) кипятили 3 ч. Осадок отфильтро-
82.35 т (3F, CF3, J 9.3 Гц). Масс-спектр (ЭИ, 70 эВ),
вывали, маточный раствор концентрировали.
m/z (Iотн, %): 324 (100) [M]+·, 309 (54) [M - CH3]+,
Остаток перекристаллизовывали из ацетонитрила
305 (11) [M - F]+, 291 (<1) [M - HS]+, 278 (33) [M -
для очистки продукта 6а или из смеси этанол-
CH2S]+, 238 (18) [M - NCS,C2H4]+, 69 (33) [CF3]+, 68
хлороформ (1:2) для очистки гетероцикла 6b.
(24)
[C2H2NCO]+, 45 (17) [CHS]. Найдено, %: С
Калий
1-метил-6-оксо-4-(трифторметил)-1,6-
33.49; Н 2.09; N 8.60. С9Н7F7N2ОS. Вычислено, %:
дигидропиримидин-2-олат
(6а). Выход 153 мг
С 33.34; Н 2.18; N 8.64.
(66%), белый порошок, т.пл. 364-365°С (разл.). ИК
4-Этокси-2-(этилсульфанил)-6-(трифтор-
спектр (ДО), ν, см-1: 3152, 3097 (СН), 1668 (С=О),
метил)пиримидин (4с). Выход 129 мг (51%) по
1643, 1624, 1600, 1568 (С=N, C=C), 1107-1207
методу в, бесцветное масло. ИК спектр (НПВО), ν,
(C-F). Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 3.06 с
см-1: 2985, 2934 (СН), 1590, 1558 (С=N, C=C), 1101-
(3Н, NCH3), 5.47 с
(1H, H5). Спектр ЯМР 19F
1185 (C-F). Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.41 т
(ДМСО-d6), δ, м.д: 92.37 с (CF3). Найдено, %: С
(6Н, 2 CH2CH3, J 7.2 Гц), 3.15 к (2Н, SCH2CH3, J
30.89; Н 1.75; N 12.01. С6Н4F3KN2О2. Вычислено,
7.2 Гц), 4.47 к (2Н, NCH2CH3, J 7.2 Гц), 6.66 с (1H,
%: С 31.04; Н 1.74; N 12.06.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019
АЛКИЛИРОВАНИЕ 6-ПОЛИФТОРАЛКИЛ-2-ТИОУРАЦИЛОВ ГАЛОГЕНАЛКАНАМИ
889
Калий
4-(гептафторпропил)-1-метил-6-оксо-
6. Gullpelli K., Bhaskar P., Muralikrishna T.,
1,6-дигидропиримидин-2-олат (6b). Выход 242 мг
Brahmeshwari G. Int. J. Pharm. Biol. Sci. 2014, 4, 59.
(73%), белый порошок, т.пл. 372-374°С (разл.). ИК
7. Lokwani D., Azad R., Sarkate A., Reddanna P.,
спектр (ДО), ν, см-1: 3089, 2952 (СН), 1654 (С=О),
Shinde D. Bioorg. Med. Chem. 2015, 23, 4533. doi
10.1016/j.bmc.2015.06.008
1590, 1567 (С=N, C=C), 1116-1232 (C-F). Спектр
ЯМР 1H (ДМСО-d6), δ, м.д.: 3.06 с (3Н, NCH3), 5.47
8. Nugent R.A., Schlachter S.T., Murphy M.J., Cleek G.J.,
Poel T.J., Wishka D.G., Graber D.R., Yagi Y.,
с (1H, H5). Спектр ЯМР 13С (ДМСО-d6), δ, м.д.:
Keiser B.J., Olmsted R.A., Kopta L.A., Swaney S.M.,
26.54 (NCH3), 92.94 т (С5, J 4.6 Гц), 108.67 т.секст.
Poppe S.M., Morris J., Tarpley W.G., Thomas R.C. J.
(CF2, J 266, 37 Гц), 112.56 т.т (СF2, J 255.1, 28.9 Гц),
Med. Chem. 1998, 41, 3793. doi 10.1021/JM9800806
117.62 (CF3, J 287.5, 34.3 Гц), 153.08 т (С4, J 23.5 Гц),
9. Smart B.E. J. Fluor. Chem. 2001, 109, 3. doi 10.1016/
158.88 (С2), 165.30 (C6). Спектр ЯМР 19F (ДМСО-
S0022-1139(01)00375-X
d6), δ, м.д.: 36.77 м (2F, CF2), 46.02 м (2F, CF2),
10. Худина О.Г., Иванова А.Е., Бургарт Я.В., Слепу-
82.64 т (3F, CF3, J 9 Гц). Найдено, %: С 28.72; Н
хин П.А., Салоутин В.И., Чупахин О.Н., Кравчен-
1.43; N 8.22. С8Н4F7KN2О2. Вычислено, %: С 28.92;
кo М.А. Изв. АН. Сер. Хим. 2013, 62, 1059. [Khudi-
Н 1.21; N 8.43.
na O.G., Ivanova A.E., Burgart Y.V., Slepukhin P.A.,
Saloutin V.I., Chupakhin O.N., Kravchenko M.A. Russ.
БЛАГОДАРНОСТИ
Chem. Bull. 2013, 62, 1060.] doi 10.1007/s11172-013-
0142-x
Работа выполнена с использованием оборудо-
11. Ringom R., Axen E., Uppenberg J., Lundback T.,
вания Центра коллективного пользования «Спект-
Rondahld L., Barf T. Bioorg. Med. Chem. Lett. 2004,
14, 4449. doi 10.1016/j.bmcl.2004.06.058
роскопия и анализ органических соединений» (ЦКП
«САОС»). Квантово-химические расчеты выпол-
12. Huang T.H., Tu H.Y., Aibibu Z., Hou C.J., Zhang A.D.
Arkivoc. 2011, ii, 1. doi 10.3998/ark.5550190.0012.201
нены на кластерном суперкомпьютере Уфимского
13. Худина О.Г., Бургарт Я.В., Салоутин В.И. ХГС.
института химии УФИЦ РАН.
2014, 928. [Khudina O.G., Burgart Ya.V., Saloutin V.I.
Chem. Heterocycl. Compd. 2014, 50, 856.] doi 10.1007/
ФОНДОВАЯ ПОДДЕРЖКА
s10593-014-1539-7
14. Bergmann E.D., Cohen S., Shahak I. J. Chem. Soc.
Работа выполнена в рамках государственной
1959, 3278. doi 10.1039/jr9590003278
темы АААА-А19-119011790132-7, при поддержке
15. Gershon H., Grefig A.T., Scala A.A. J. Heterocycl.
Минобрнауки России (госзадание АААА-А17-
Chem. 1983, 20, 219. doi 10.1002/jhet.5570200145
117011910028-7).
16. Bhabak K.P., Mugesh G. Chem. Eur. J. 2010, 16, 1175.
doi 10.1002/chem.200902145
КОНФЛИКТ ИНТЕРЕСОВ
17. Еркин А.В., Крутиков В.И. ЖОХ. 2007, 77, 133.
[Erkin A.V., Krutikov V.I. Russ. J. Gen. Chem. 2007,
Авторы заявляют об отсутствии конфликта
77, 124.] doi 10.1134/S1070363207010173
интересов.
18. Senda S., Suzui A. Chem. Pharm. Bull. 1958, 6, 479.
doi 10.1248/cpb.6.479
СПИСОК ЛИТЕРАТУРЫ
19. Matsukawa T., Ohta B. Yakugaku Zasshi 1950, 70, 134;
С.А., 1950, 44, 30180.
1. Lagoja I.M. Chem. Biodiversity.
2005,
2,
1. doi
20. Lee H.-J., Kim D.-H., Kim T.-K., Yoon Y.-A., Sim J.-Y.,
10.1002/cbdv.200490173
Cha M.-H., Jung E.-J., Ahn K.-K., Lee T.-A.
2. Verma A., Sahu L., Chaudhary N., Dutta T., Dewangan D.,
Междунар. Заявка WO 2012115478. С.А. 2012, 157,
Tripathi D.K. Asian J. Biochem. Pharm. Res. 2012, 2, 1.
438379.
3. Choi H.-J., Yu S.-T., Lee K.-I., Choi J.-K., Chang B.-Y.,
21. Westaway S.M., Preston A.G.S., Barker M.D.,
Kim S.-Y., Ko M.-H., Song H.-O., Park H.
Brown F., Brown J.A., Campbell M., Chung C.,
Exp. Parasitol.
2014,
143,
24. doi
10.1016/
Drewes G., Eagle R., Garton N., Gordon L., Haslam C.,
j.exppara.2014.05.002
Hayhow T.G., Humphreys P.G., Joberty G., Katso R.,
4. Abdullah M.E., Aboul-Enein H.Y., Hassan M.M.A.,
Kruidenier L., Leveridge M., Pemberton M., Rioja I.,
Taha S.A. Proc. Int. Symp. Appl. Technol. Ioniz. Radiat.
Seal G.A., Shipley T., Singh O., Suckling C.J., Taylor J.,
1983, 1, 531; С.А., 1984, 100, 17232.
Thomas P., Wilson D.M., Lee K., Prinjha R.K.
5. Gupta S., Pulman D.A., Rho T. Междунар. Заявка WO
J. Med. Chem.
2016,
59,
1370. doi
10.1021/
2004008859. С.А. 2004, 140, 124046.
acs.jmedchem.5b01538
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019
890
ХУДИНА и др.
22. Dean W.D., Papadopoulos E.P. J. Heterocycl. Chem.
Austin A.J., Cammi R., Pomelli C., Ochterski J.W.,
1982, 19, 1117. doi 10.1002/jhet.5570190527
Martin R.L., Morokuma K., Zakrzewski V.G., Voth G.A.,
Salvador P., Dannenberg J.J., Dapprich S., Daniels A.D.,
23. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Farkas Ö., Foresman J.B., Ortiz J.V., Cioslowski J.,
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
Fox D.J. Gaussian 09, Revision C.01. Gaussian, Inc.:
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
Wallingford CT, 2010.
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
24. Tao J.M., Perdew J.P., Staroverov V.N., Scuseria G.E.
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
Phys. Rev. Lett.
2003,
91,
146401. doi
10.1103/
Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y.,
PhysRevLett.91.146401
Kitao O., Nakai H., Vreven T., Montgomery J.A.,
25. McLean A. D., Chandler G. S. J. Chem. Phys. 1980, 72,
Peralta J.E., Ogliaro F., Bearpark M., Heyd J.J.,
Brothers E., Kudin K.N., Staroverov V.N., Kobayashi R.,
5639. doi 10.1063/1.438980
Normand J., Raghavachari K., Rendell A., Burant J.C.,
26. Tomasi J., Mennucci B., Cammi R. Chem. Rev. 2005,
Iyengar S.S., Tomasi J., Cossi M., Rega N., Millam J.M.,
105, 2999. doi 10.1021/cr9904009
Klene M., Knox J.E., Cross J.B., Bakken V., Adamo C.,
27. Miller W.H., Dessert A.M., Anderson G.W. J. Am.
Jaramillo J., Gomperts R., Stratmann R.E., Yazyev O.,
Chem. Soc. 1948, 70, 500. doi 10.1021/ja01182a020
Alkylation of 6-Polyfluoroalkyl-2-thiouracils with Halogenalkanes
O. G. Khudinaa, A. E. Ivanovaa, Y. V. Burgarta, M. G. Pervovaa,
T. V. Shatunovaa, S. S. Borisevichb, S. L. Khursanb, and V. I. Saloutina, *
a Postovsky Institute of Organic Synthesis, UB, RAS, 620990, Russia, Yekaterinburg, ul. S. Kovalevskoi/Akademicheskaya 22/20
*e-mail: saloutin@ios.uran.ru
b Ufa Institute of Chemistry, RAS, 450054, Russia, Republic of Bashkortostan, Ufa, pr. Octyabrya 71
Received April 15, 2019; revised April 23, 2019; accepted April 25, 2019
The structure and reactivity of the nucleophilic centers of 6-polyfluoroalkyl-2-thiouracils were evaluated using
quantum-chemical calculations. It has been experimentally found that the methylation of 6-polyfluoroalkyl-2-
thiouracils leads first to the S-monosubstituted pyrimidin-4-one, and then to S,N3- and S,O-dimethylated
derivatives. The most optimal conditions for the selective synthesis of S,N3-isomer were refluxing in t-BuOH/
Cs2CO3. Ethylation of 6-polyfluoroalkyl-2-thiouracils resulted in the formation of S,N3- and S,O-isomers in
approximately equal proportions. We obtained potassium salts of uracils from S,N3-dimethylsubstituted
pyrimidines under heating in ethanol in the presence of K2CO3. It occurred due to a nucleophilic substitution of
the methylsulfanyl fragment for an alcohol moiety and its subsequent dealkylation.
Keywords: 6-polyfluoroalkyl-2-thiouracils, methylation, ethylation, quantum-chemical calculations, nucleo-
philic substitution, dealkylation
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019