ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 6, с. 891-895
УДК 547.022:547.551.2 + 547.541.513
РЕАКЦИОННАЯ СПОСОБНОСТЬ ИМИДА
2-СУЛЬФОБЕНЗОЙНОЙ КИСЛОТЫ
И БЕНЗОЛСУЛЬФОНАМИДА
В АРЕНСУЛЬФОНИЛИРОВАНИИ
© 2019 г. Т. П. Кустова*, М. А. Агафонов, А. А. Круглякова, Л. Б. Кочетова
ФГБОУ ВО «Ивановский государственный университет», 1530250, Россия, г. Иваново, ул. Ермака 39
*e-mail: kustova_t@mail.ru
Поступила в редакцию 20 октября 2017 г.
После доработки 1 марта 2019 г.
Принята к публикации 15 марта 2019 г.
На основе экспериментального изучения кинетики взаимодействия имида 2-сульфобензойной кислоты
(сахарина) и бензолсульфонамида с 3-нитробензолсульфонилхлоридом в смеси вода (20 масс. %)-1,4-
диоксан при 298-318 К установлено, что оба соединения обладают низкой реакционной способностью
(k298 1.66×10-4 и 3.37×10-3 л·моль-1·с-1). Активационные барьеры реакций превышают 50 кДж/моль.
Водный диоксан может быть рекомендован для синтеза сульфонилированного бензолсульфонамида с
выходом продукта до 87%.
Ключевые слова: кинетика, аренсульфонилирование, имид 2-сульфобензойной кислоты, бензолсуль-
фонамид, 3-нитробензолсульфонилхлорид, 1,4-диоксан.
DOI: 10.1134/S0514749219060089
Среди многообразия органических соединений
хорошими прогностическими свойствами и позво-
особый интерес представляют сульфонилзаме-
ляют предсказывать константы скорости широкого
щенные азотсодержащие системы, которые
круга реакций ацильного переноса с участием
относятся к «привилегированным структурам» в
производных ароматических сульфоновых кислот.
ряду объектов QSAR. В настоящее время активно
Это существенно облегчает построение комбина-
создаются и тестируются на биоактивность ком-
торных библиотек сульфонамидов, т.к. позволяет
бинаторные библиотеки сульфонамидов, насчиты-
проводить процессы в оптимальных условиях
вающие сотни тысяч лекарственных кандидатов.
(температура, растворитель), снижая финансовые и
Активно изучается ингибирующее действие соеди-
временные затраты. Среди перспективных для
нений этого класса на целый ряд важных фермен-
сульфонилирования аминосоединений практически
тов: карбоангидразы (участвует в образовании
неизученными остаются амиды и имиды
раковых опухолей), бета-секретазы (катализирует
ароматических карбоновых и сульфоновых кислот,
формирование амилоидных бляшек при болезни
реакционная способность которых в ацилировании
Альцгеймера), деацетилазы гистонов и др. [1].
невысока в связи с наличием вблизи аминогруппы
электрофильных центров (СО и SO2). Известно
Нашей группой на протяжении ряда лет ведутся
[3, 4], что функциональные производные имида
систематические исследования кинетики и
2-сульфобензойной кислоты (сахарина) и бен-
механизма сульфонилирования аминосоединений
золсульфонамида используются в качестве
[2]: алифатических, ароматических, смешанных
фунгицидов, гербицидов, антибактериальных
аминов, α-аминокислот и дипептидов, а также
лекарственных веществ, катализаторов, мономеров
гидразидов ароматических карбоновых и сульфо-
в поликонденсационных процессах, в связи с
новых кислот. Созданные нами на основе экспе-
чем исследование их реакционной способности
риментальных кинетических данных и дескрип-
в сульфонилировании представляется нам актуаль-
торов разных уровней QSPR-модели обладают
ным.
891
892
КУСТОВА и др.
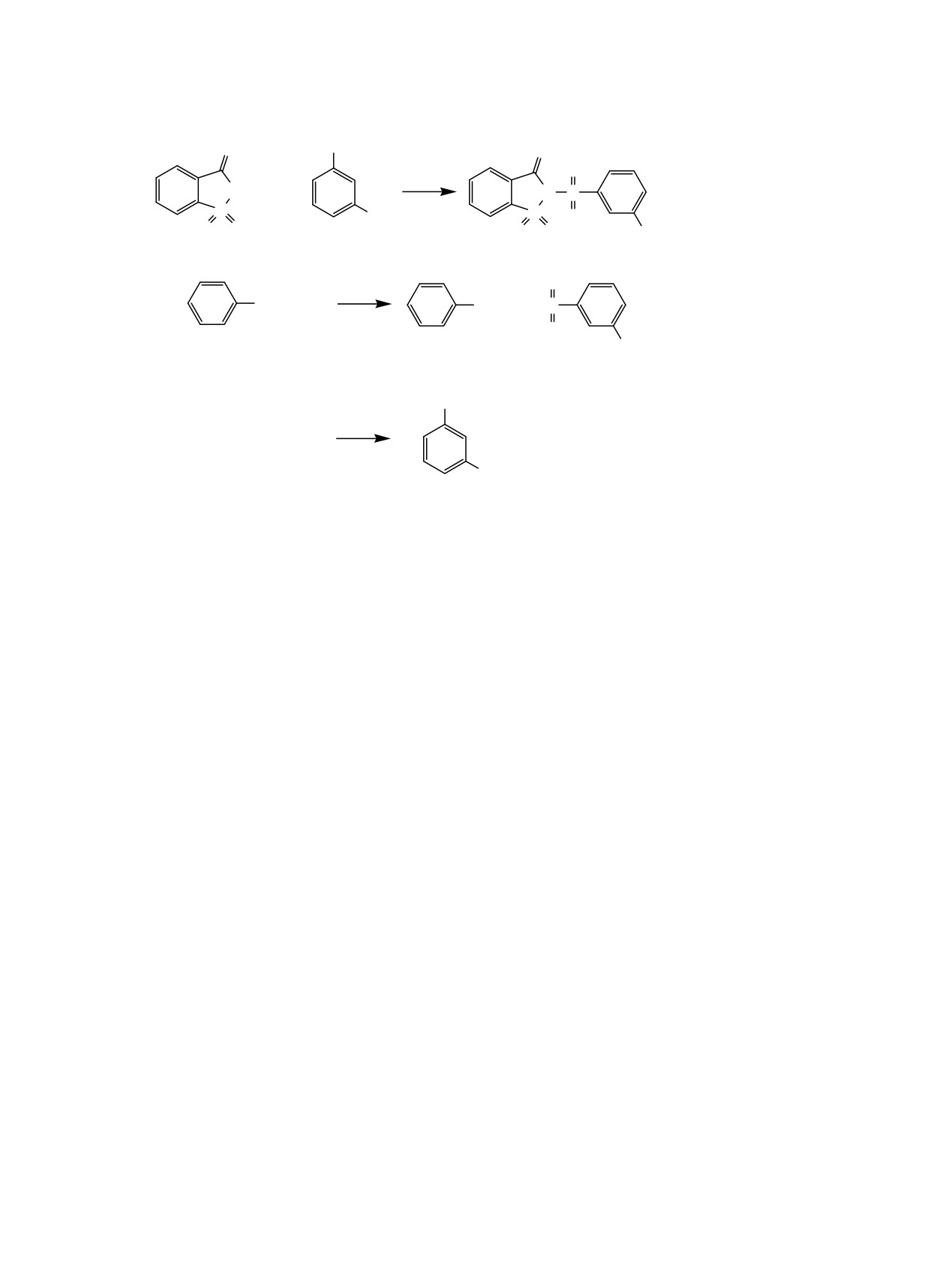
Схема 1.
SO2Cl
O
O
O
NH
+
N
S
+
HCl
(1)
S
S
NO
2
O
O O
O O
NO2
1
3
O
3
SO2NH2
SO2NH S
+ HCl
(2)
O
NO2
2
Схема 2.
SO3H
H2O
3
+ HCl
(3)
NO2
Целью настоящей работы является исследова-
(5)
kац = (kг[ek(cсх - x) - cсх]) / [2cсх(cсх - x)(1 - ek)],
ние кинетики взаимодействия сахарина 1 и бензол-
(ссх - х) = ссх (c∞ - ct) / (c∞ - c0).
(6)
сульфонамида
2 с
3-нитробензолсульфонилхло-
ридом 3 в среде водного 1,4-диоксана в интервале
В уравнении (6) c0, ct, c∞ - электропроводности
температур 298-318 К [схема 1, уравнения (1) и (2)].
реакционной смеси в начальный момент времени
τ0, в момент времени t и после окончания реакции
В качестве ацилирующего агента выбран
соответственно; с
сх
- начальная концентрация 3;
хлорангидрид 3-нитробензолсульфоновой кислоты
х - изменение концентрации 3 к моменту времени
3, отличающийся высокой реакционной способ-
t. Константа скорости гидролиза 3 (kг) была взята
ностью в сульфонилировании по сравнению с
из экспериментальных данных [6].
другими галогенангидридами
[5]. Ранее мы
установили, что сульфонилирование аминосоеди-
Экспериментально определённые кинетические
нений в полярных средах (органических и водно-
характеристики реакций (1)-(3) сведены в табл. 1.
органических) протекает количественно с образо-
Полученные данные свидетельствуют о том, что
ванием N-сульфонильных производных, а скорости
скорость сульфонилирования 1 крайне мала и на
этих процессов описываются кинетическим
порядок ниже скорости реакции (2), что является
уравнением реакции второго порядка
[5]. В
закономерным с учётом электронных эффектов,
качестве побочного процесса в водном 1,4-диоксане
которые оказывают две электрофильные группы
протекает гидролиз
3
[схема 2, уравнение (3)],
(карбонильная и сульфонильная) на нуклеофиль-
скорость которого учитывалась при расчете
ные свойства иминного азота.
констант скорости реакций (1) и (2).
Температурные зависимости констант скорости
Кинетика реакций (1)-(3) описывается уравне-
реакций
(1)
и
(2) подчиняются уравнению
нием (4):
Аррениуса (табл. 2).
- dccх/dt = kацccсх + kгcсх.
(4)
Сопоставление значений активационных
Здесь с и ссх - текущие концентрации 1 (или 2) и 3
параметров реакций
(1)
и
(2)
позволяет
соответственно, t - время (с), kац - константа ско-
предположить, что ключевую роль в понижении
рости реакции второго порядка (л·моль-1·с-1), kг -
реакционной способности 1 по сравнению с
2
константа скорости гидролиза хлорангидрида (с-1).
играет повышение активационного барьера
Уравнение для расчета константы скорости ацили-
реакции (почти на 10 кДж/моль), в то время как
рования 1 и 2 с учетом гидролитического потока
изменение энтропии активации, характеризующее
реакции и при условии с0 = 2ссх имеет вид (5):
степень упорядоченности активированного комп-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019
РЕАКЦИОННАЯ СПОСОБНОСТЬ ИМИДА 2-СУЛЬФОБЕНЗОЙНОЙ КИСЛОТЫ
893
Таблица 1. Значения констант скорости сульфонилирования (1) и (2) и констант скорости гидролиза 3 в растворителе
вода - 1,4-диоксан; ωН2О = 20 масс. %.
kац×103, л·моль-1·с-1
T, К
kг×104, с-1 [6]
1
2
298
0.166 ± 0.008
3.37 ± 0.17
1.70 ± 0.04
303
0.348 ± 0.017
4.71 ± 0.24
2.29 ± 0.03
308
0.574 ± 0.028
7.19 ± 0.36
3.11 ± 0.03
313
0.643 ± 0.032
9.95 ± 0.50
4.16 ± 0.02
318
0.908 ± 0.045
13.35 ± 0.67
5.53 ± 0.03
Таблица 2. Активационные параметры сульфонилирования 1 и 2 в среде водного 1,4-диоксана.
ΔН298,
-ΔS298,
Реакция
ΔТ, К
n
r
кДж/моль
Дж·моль-1·К-1
20
5
0.966
(1)
61 ± 2
110 ± 7
20
5
0.995
(2)
52 ± 2
115 ± 7
лекса, практически не изменяется в пределах
температуры целесообразно до 313 К, т.к. при этой
ошибки определения этой величины.
температуре достигается максимальный выход
целевого продукта 87% (при начальной концент-
Поскольку в системе параллельно с аци-
рации соединения 3 0.5 моль/л).
лированием амина (имина) протекает побочный
процесс гидролиза
3
(3), наряду с продуктами
Сахарин и бензолсульфонамид содержащие
сульфонилирования в системе всегда содержится
99.95% основного вещества (Aldrich) были исполь-
примесь
3-нитробензолсульфоновой кислоты.
зованы в работе без дополнительной очистки.
Используя полученные нами кинетические данные
Остальные реактивы и растворитель были
реакций (1)-(3) (табл. 1), путём решения системы
очищены до полного соответствия их физических
дифференциальных уравнений
(7),
(8) методом
параметров (температура кипения/плавления и
Рунге-Кутта
4-го порядка выполнен расчёт
показатель преломления) литературным данным. 3-
выходов продуктов аренсульфонилирования 1 и 2
Нитробензолсульфонилхлорид квалификации «ч»
(αац) и гидролиза 3 (αг) в изученном растворителе
перекристаллизовывали из смеси гексан-2-
при различных начальных концентрациях
пропанол (10:1). 1,4-Диоксан квалификации «хч» в
реагентов.
течение семи дней выдерживали над гидроксидом
калия, затем осуществляли его перегонку при
dац/d = 2kац c0х(1 _ ац _ г)2,
(7)
атмосферном давлении в присутствии металли-
ческого натрия с целью удаления органических
dг/d = kг(1 _ ац _ г).
(8)
перекисей. Для приготовления бинарного раст-
ворителя использовали деионизованную воду,
Результаты расчета выхода продуктов реакций
полученную на деионизаторе воды
«ДВ-1».
(1)-(2) при полном их завершении приведены в
Рабочие растворы
1 и
2 в бинарном водно-
табл. 3.
диоксановом растворителе и рабочий раствор 3 в
Из данных табл. 3 видно, что в случае суль-
безводном
1,4-диоксане готовили по точной
фонилирования 1 с увеличением температуры до
навеске и помещали в двухкамерный сосуд
308 К выход целевого продукта немного увели-
смешения. Начальные концентрации реагентов
чивается до 44% (при начальной концентрации 3
составляли: 0.03 моль/л для растворов 1 и 2 и
0.5 моль/л), затем наблюдается его незначительное
0.015 моль/л для 3. Растворы термостатировали в
снижение, однако, основной процесс - ацилирова-
сосуде смешения в течение 30 мин при температуре
ние имида - во всем изученном температурном
опыта, затем, одновременно с запуском секун-
диапазоне перекрывается побочным процессом
домера, содержимое сосуда энергично встряхивали и
гидролиза 3. Для реакции с участием 2 увеличение
помещали в кювету для измерения электропро-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019
894
КУСТОВА и др.
Таблица 3. Результаты расчета выходов продуктов ацилирования 1 и 2 в растворителе вода-1,4-диоксан; t = 18000 с.
αац
T, К
cсх, моль/л
1
2
0.1
0.126
0.605
298
0.5
0.327
0.849
0.1
0.139
0.606
303
0.5
0.398
0.851
0.1
0.152
0.628
308
0.5
0.435
0.863
0.1
0.129
0.633
313
0.5
0.396
0.866
0.1
0.135
0.635
318
0.5
0.408
0.866
водности. В связи с тем, что в ходе реакций (1)-(3)
Чарушин В.Н., Чупахин О.Н., Климочкин Ю.Н.,
образуется сильный электролит - хлороводород,
Климочкина А.Ю., Курятников В.Н., Малиновс-
кая Ю.А., Левина А.С., Журавлев О.Е., Ворончи-
концентрация которого эквимолярна концентрации
хина Л.И., Фисюк А.С., Аксенов А.В., Аксенов Н.А.,
продукта сульфонилирования
- электропровод-
Аксенова И.В. ЖОрХ. 2017, 53, 1257. [Antipin I.S.,
ность рабочего раствора возрастала. Изменение
Kazymova M.A., Kuznetsov M.A., Vasilyev A.V.,
удельной электропроводности фиксировали с
Ishchenko M.A., Kiryushkin A.A., Kuznetsova L.M.,
помощью измерителя иммитанса Е7-14, обору-
Makarenko S.V., Ostrovskii V.A., Petrov M.L., Solod O.V.,
дованного кольцевым платиновым электродом ОК-
Trishin Yu.G., Yakovlev I.P., Nenaidenko V.G.,
9023 на частоте 1 кГц.
Beloglazkina E.K., Beletskaya I.P., Ustynyuk Yu.A.,
Solov’ev P.A., Ivanov I.V., Malina E.V., Sivova N.V.,
КОНФЛИКТ ИНТЕРЕСОВ
Negrebetskii V.V., Baukov Yu.I., Pozharskaya N.A.,
Traven’ V.F., Shchekotikhin A.E., Varlamov A.V.,
Авторы заявляют об отсутствии конфликта
Borisova T.N., Lesina Yu.A., Krasnokutskaya E.A.,
Rogozhnikov S.I., Shurov S.N., Kustova T.P., Klyuev M.V.,
интресов.
Khelevina O.G., Stuzhin P.A., Fedorov A.Yu.,
Gushchin A.V., Dodonov V.A., Kolobov A.V.,
СПИСОК ЛИТЕРАТУРЫ
Plakhtinskii V.V., Orlov V.Yu., Kriven’ko A.P.,
Fedotova O.V., Pchelintseva N.V., Charushin V.N.,
1. Panek D., Więckowska A., Wichur T., Bajda M.,
Chupakhin O.N., Klimochkin Yu.N., Klimochkina A.Yu.,
Godyń J., Jończyk J., Mika K., Janockova J., Soukup O.,
Kuryatnikov V.N., Malinovskaya Yu.A., Levina A.S.,
Knez D., Korabecny J., Gobec S., Malawska B.
Zhuravlev O.E., Voronchikhina L.I., Fisyuk A.S.,
J. Med. Chem.
2017,
125,
676. doi
10.1016/
Aksenov A.V., Aksenov N.A., Aksenova I.V. Russ. J. Org.
j.ejmech.2016.09.078
Chem. 2017, 53, 1.] doi 10.1134/S1070428017090019
2. Антипин И.С., Казымова М.А., Кузнецов М.А.,
3. Мельников Н.Н. Пестициды. Химия, технология и
Васильев А.В., Ищенко М.А., Кирюшкин А.А.,
применение. М.: Химия, 1987.
Кузнецова Л.М., Макаренко С.В., Островский В.А.,
4. Машковский М.Д. Лекарственные средства. М.:
Петров М.Л., Солод О.В., Тришин Ю.Г., Яковлев И.П.,
Новая Волна, 2006.
Ненайденко В.Г., Белоглазкина Е.К., Белецкая И.П.,
Устынюк Ю.А., Соловьев П.А., Иванов И.В.,
5. Курицын Л.В., Кустова Т.П., Садовников А.И.,
Малина Е.В., Сивова Н.В., Негребецкий В.В.,
Калинина Н.В., Клюев М.В. Кинетика реакций
Бауков Ю.И., Пожарская Н.А., Травень В.Ф.,
ацильного переноса. Ред. Л.В. Курицын. Иваново:
Щекотихин А.Е., Варламов А.В., Борисова Т.Н.,
изд-во Иван. гос. ун-та, 2006.
Лесина Ю.А., Краснокутская Е.А., Рогожников С.И.,
6. Кустова Т.П., Смирнова Е.Г., Кочетова Л.Б., Кали-
Шуров С.Н., Кустова Т.П., Клюев М.В., Хелевина О.Г.,
нина Н.В. ЖПХ. 2014, 87,
1280.
[Kustova T.P.,
Стужин П.А., Федоров А.Ю., Гущин А.В., Додо-
Smirnova E.G., Kochetova L.B., Kalinina N.V. Russ.
нов В.А., Колобов А.В., Плахтинский В.В., Орлов В.Ю.,
J. Appl. Chem.
2014,
87,
1274.] doi
10.1134/
Кривенько А.П., Федотова О.В., Пчелинцева Н.В.,
S1070427214090146
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019
РЕАКЦИОННАЯ СПОСОБНОСТЬ ИМИДА 2-СУЛЬФОБЕНЗОЙНОЙ КИСЛОТЫ
895
Reactivity of 2-Sulphobenoic Acid Imide and Benzolsulphonamide
in Arensulphonilation
T. P. Kustova*, M. A. Agafonov, A. A. Kruglyakova, and L. B. Kochetova
Ivanovo State university, 1530250, Russia, Ivanovo, ul. Ermaka 39
*e-mail: kustova_t@mail.ru
Received October 20, 2017; revised March 1, 2019; accepted March 15, 2019
Based on an experimental study of the kinetics of the interaction of 2-sulfobenzoic acid imide (saccharin) and
benzenesulfonamide with 3-nitrobenzenesulfonyl chloride in a mixture of water (20 wt %)-1,4-dioxane at 298-
318 K, it was found that both compounds have a low reactivity (k298 1.66×10-4 and 3.37×10-3 L·mol-1·sec-1).
Reactions activation barriers exceed 50 kJ/mol. Aqueous dioxane can be recommended for the synthesis of
sulfonylated benzenesulfonamide with a yield of up to 87%.
Keywords: kinetics, arenesulfonylation, 2-sulfobenzoic acid imide, benzenesulfonamide, 3-nitrobenzenesulfonyl
chloride, 1,4-dioxane
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 6 2019