ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 7, с. 1055-1062
УДК 547.873
АЛКИЛИРОВАНИЕ 3-трет-БУТИЛПИРИМИДО[4',5':3,4]-
ПИРАЗОЛО[5,1-с][1,2,4]-ТРИАЗИН-4,10(1H,9H)-ДИОНОВ
(ДИТИОНОВ)
© 2019 г. Л. М. Мироновичa, *, С. М. Ивановb, Е. Д. Даеваb
a ФГБОУ ВО «Юго-Западный государственный университет», 305040, Россия, г. Курск, ул.50 лет Октября 94
*e-mail: lm.myronovych@mail.ru
b ФГБУН «Институт органической химии им. Н.Д. Зелинского», 119991, Россия, г. Москва, Ленинский пр. 47
Поступила в редакцию 10 декабря 2018 г.
После доработки 31 марта 2019 г.
Принята к публикации 12 апреля 2019 г.
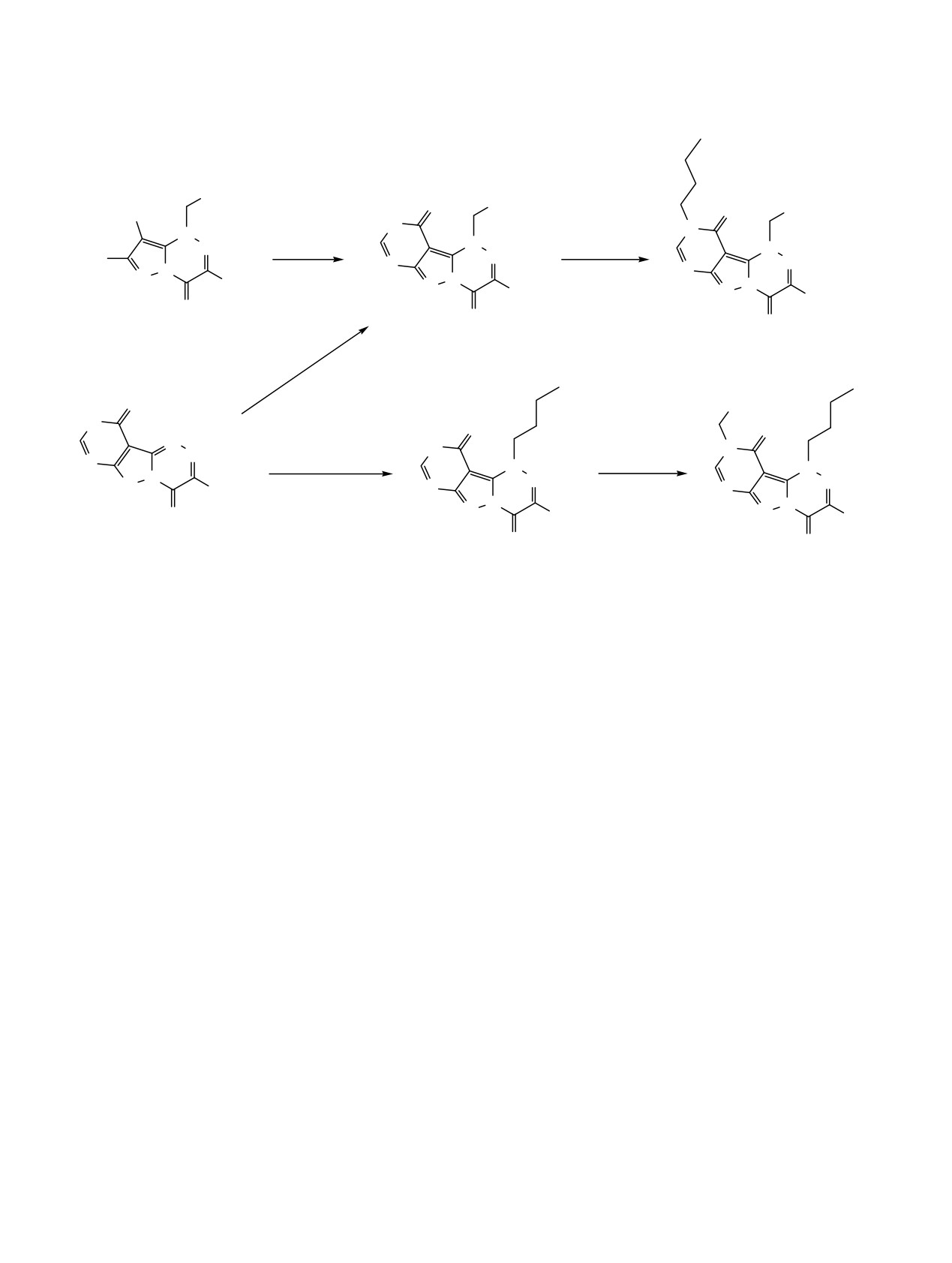
Конденсацией 7-амино-1-R-3-трет-бутил-4-оксо-1,4-дигидропиразоло[5,1-c][1,2,4]триазин-8-карбонитрила
с муравьиной кислотой получен 1-R-3-трет-бутилпиримидо[4',5':3,4]пиразоло[5,1-c][1,2,4]триазин-4,10-
(1H,9H)-дион, который образуется и при алкилировании 3-трет-бутилпиримидо[4',5':3,4]пиразоло[5,1-c]-
[1,2,4]триазин-4,10(1H,9H)-диона. Дальнейшее взаимодействие с алкилгалогенидами в жестких условиях
приводит к замещению водорода при атоме N9 гетероцикла с образованием 1-R, 9-R1-производных.
Продукты алкилирования по тиоксогруппе выделены при действии алкилирующих агентов в щелочной
среде на 3-трет-бутил-8-R2-пиримидо[4',5':3,4]пиразоло[5,1-c][1,2,4]триазин-4,10(1H,9H)-дитионы.
Ключевые слова: пиримидо[4’,5’:3,4]пиразоло[5,1-с][1,2,4]триазин; пиразоло[5,1-c][1,2,4]триазин;
конденсация; алкилирование.
DOI: 10.1134/S0514749219070061
Различные виды активности, которые прояв-
7-Амино-1-бензил-3-трет-бутил-4-оксо-1,4-
ляют производные пиразоло[5,1-с][1,2,4]триазинов,
дигидропиразоло[5,1-c][1,2,4]триазин-8-карбонит-
привлекают химиков к исследованию их хими-
рил (1) получен алкилированием 7-амино-3-трет-
ческих превращений [1,2]. Разнообразные транс-
бутил-4-оксо-1,4-дигидропиразоло[5,1-c][1,2,4]-
формации соединений данного ряда представлены
триазин-8-карбонитрила бензилхлоридом [7]. Ки-
в недавних работах. Описано получение 8-азидо-
пячение соединения 1 в муравьиной кислоте при-
карбонил- и 7-азидопиразоло[5,1-c][1,2,4]триазинов
вело к замыканию цикла с образованием 1-бензил-
различными методами [3-5]. На основе 7-азидо-
3-трет-бутилпиримидо[4',5':3,4]пиразоло-[5,1-c]-
производных синтезированы 1,2,3-триазолил заме-
[1,2,4]триазин-4,10(1H,9H)-диона
(2). Бензильная
щенные пиразоло[5,1-c][1,2,4]триазинов [6], а алки-
группа при атоме азота создала существенные
лирование по атому N1 азота триазинового цикла
стерические препятствия, что привело к заметному
активирует систему к восстановлению реактивами
увеличению времени реакции с 6 ч для прос-
Гриньяра [7]. Алкилирование производных, содер-
тейшего аналога 4 со свободным положением N1 до
жащих в своем составе 1,2,4-триазиновый цикл, рас-
10 сут в случае N1-защищённого соединения 1.
смотрено в [8]. Действие димера малононитрила
Трициклический гетероцикл 2 выделен с хорошим
приводит к замыканию цикла с образованием пири-
выходом после осуществления процедур хрома-
до[2',3':3,4]пиразоло[5,1-c][1,2,4]триазина [9]. Поиск
тографической очистки (схема 1). Соединение 2
новых путей синтеза и получение ранее неопи-
получено и при обработке бензилхлоридом соот-
санных соединений ряда пиразоло[5,1-c][1,2,4]триа-
ветствующнго диона
4 в среде органического
зинов по-прежнему является актуальной задачей.
растворителя в присутствии триэтиламина (ТЭА),
Целью настоящего исследования явилось изучение
алкилирование по атому N9 не происходило (в
реакций N-, S-алкилирования производных пири-
спектре ЯМР
1Н синглет протона группы NH
мидо[4',5':3,4]пиразоло[5,1-с][1,2,4]триазина.
расположен при 12.16 м.д.).
1055
1056
МИРОНОВИЧ и др.
Схема 1.
Ph
O
Ph
NC
O
Ph
HN
N
N
N
HCO2H
N
n-BuBr
N
H2N
N
N
N
N
NaH, THF,
N
N
N
Bu-t
N
HMPA, 60oC
N
Bu-t
N
Bu-t
O
O
O
1
2
3
PhCH2Cl
O
Ph
HN
O
O
N
HN
N
N
n-BuBr
PhCH2Cl
N
N
N
N
N
N
CH3CN, EtOAc,
NaH, THF,
N
Bu-t
N
N
H
Et3N, 25oC
N
HMPA, 60oC
N
N
N
O
Bu-t
Bu-t
O
O
4
5
6
В ИК спектре продукта реакции появляется
присутствии ТЭА привело к продукту алки-
полоса поглощения группы С=О при 1687 см-1,
лирования по атому N1 - 3-трет-бутил-1-бутил-
отсутствующая в исходном соединении
1. В
пиримидо[4',5':3,4]пиразоло[5,1-c][1,2,4]триазин-
спектре ЯМР 1Н соединения 2 наблюдаются также
4,10(1H,9H)-диону (5). Алкилирование по атому
синглет протонов группы СН2 при 6.24 м.д. и
азота N9 гетероцикла происходило в случае N1
мультиплет протонов фенильного заместителя при
замещенного производного 2. Действительно, при
7.25-7.5 м.д., а сигнал атома углерода в спектре
обработке соединения 5 бензилхлоридом в смеси
ЯМР 13С группы СН2 расположен при 60.18 м.д.
ТГФ и ГМФТА в присутствии NaH (60% суспензия
Масс-спектр высокого разрешения подтвердил
в минеральном масле) в течение 10 ч нами выделен
заявленную структуру 2: m/z 373.1385 [М + Na]+.
продукт 6, изомерный соединению 3 (протекание
реакции контролировали с помощью ТСХ). Масс-
Алкилирование соединения
2 метилиодидом
спектры высокого разрешения содержали ожидае-
приводило к образованию сложной смеси продуктов,
мые пики ионов с m/z 339.1549 [М + Na]+ (соеди-
которые нам не удалось идентифицировать.
нение 5) и m/z 429.2006 [М + Na]+ (соединение 6).
Однако применение н-бутилбромида в качестве
Спектры ЯМР 1Н и 13С содержали все ожидаемые
менее активного алкилирующего агента позволило
сигналы. Сравнение спектров ЯМР 1Н соединений
синтезировать
1-бензил-3-трет-бутил-9-бутилпи-
3, 5 и 6 показало, что триплет протонов группы
римидо[4',5':3,4]пиразоло[5,1-c][1,2,4]триазин-4,10-
N1-СН2- расположен при 4.94 м.д. (соединения 5 и
(1H,9H)-дион
(3). При этом не наблюдалось
6) и группы N9-СН2- соединения 3 при 4.03 м.д., а
алкилирование по атомам кислорода гетероцикла.
синглеты протонов группы -СН2Ph при 6.31 и
В ЯМР-спектрах продукта 3 сигналы группировки
5.17 м.д., соответственно, для соединений 3 и 6. В
N9-CH2 наблюдались при 4.03 м.д.
(1Н, т) и
спектрах ЯМР 13С имеются сигналы атомов угле-
46.61 м.д. (13С), что подтверждает его строение.
рода группы N-CH2Ph при 60.76 м.д. (соединение 3)
Масс-спектр высокого разрешения содержал
и 58.08 м.д. (соединение 6). При 46.61 м.д. (соеди-
ожидаемый пик иона с m/z 407.2186 [М + Н]+.
нение 3), 49.16 м.д. (соединение 6) и 57.46 м.д.
Взаимодействие соединения
4 с н-бутилбро-
(соединение
5) расположены сигналы атомов
мидом в смеси ацетонитрила и этилацетата в
углерода группы NCH2CH2CH2CH3.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 7 2019
АЛКИЛИРОВАНИЕ 3-трет-БУТИЛПИРИМИДО[4',5':3,4]ПИРАЗОЛО[5,1-с][1,2,4]-...
1057
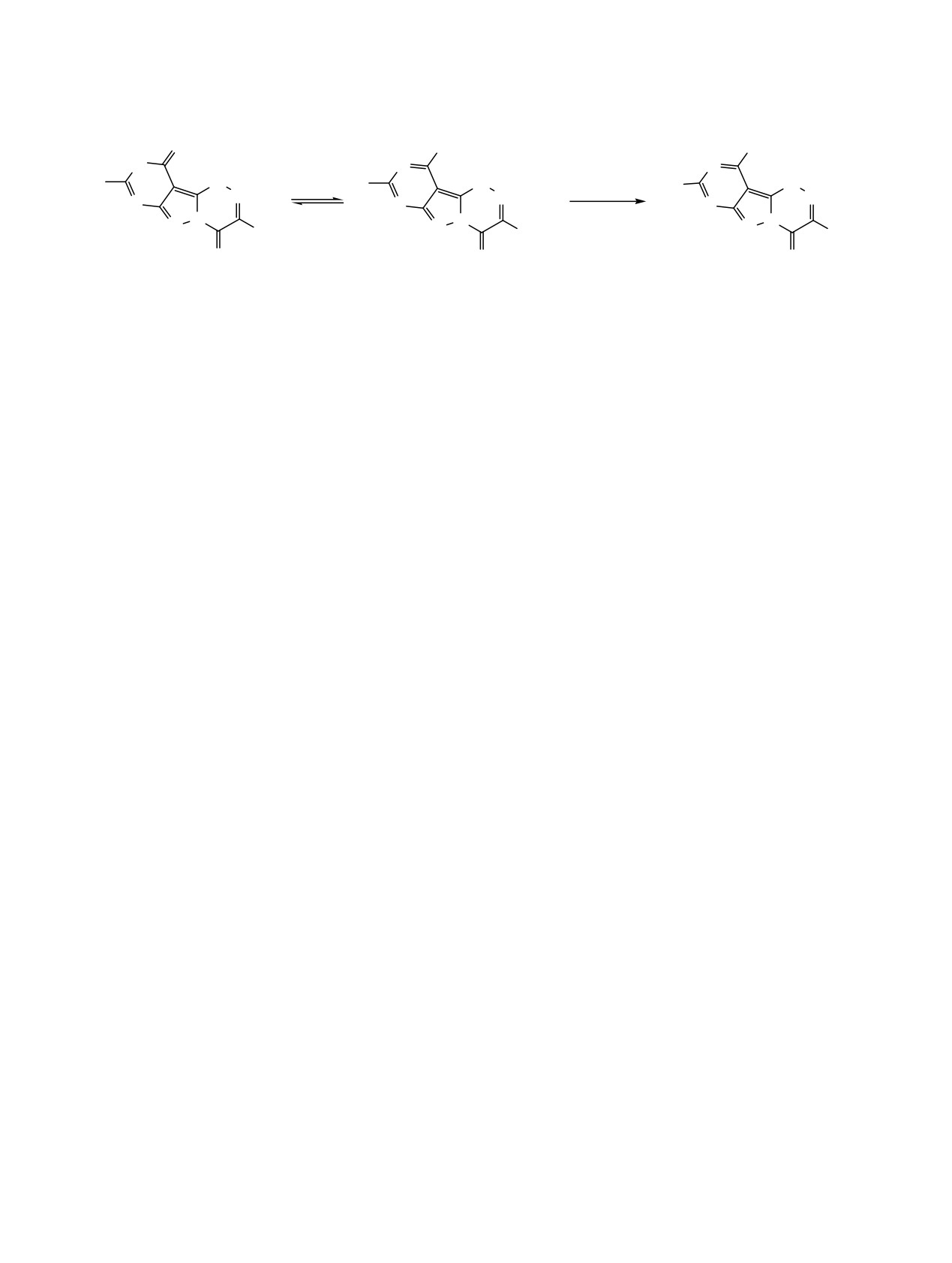
Схема 2.
S
SH
SMe
HN
N
N
H
H
H
_
R
N
R
N
R
N
OH
MeJ
N
N
N
N
N
N
60oC
N
N
N
N
N
N
Bu-t
Bu-t
Bu-t
S
S
S
7, 8
7a, 8a
9, 10
R = H (7, 7a, 9); Me (8, 8a, 10).
Ранее нами обработкой Р2S5 в среде пиридина 3-
отсутствующая в ИК спектре исходного соеди-
трет-бутил-8-R-пиримидо[4',5':3,4]пиразоло[5,1-с]-
нения 7, и исчезает полоса поглощения тионной
[1,2,4]триазин-4(6Н),10(9Н)дионов получены соот-
группы. Масс-спектр высокого разрешения соеди-
ветствующие дитионы (7, 8), которые представляли
нения 11 содержал ожидаемые пики ионов с m/z
собой желтые кристаллические вещества [11]. В
333.1422 [M + Н]+, 355.1301 [M + Na]+.
ИК спектрах имеются характеристические полосы
В спектре ЯМР 1Н соединения 11 наблюдается
поглощения тионных групп при 1272, 1175 см-1
синглет протонов метильной группы при 0.9 м.д. и
(соединение 7) и 1199, 1123 см-1 (соединение 8).
синглет протонов трет-бутильного заместителя
Наличие тионных групп, находящихся в щелочной
при 1.45 м.д. При 2.65-2.8 м.д. расположен муль-
среде в тиольной форме соединений
7а,
8а,
типлет протонов интенсивностью 4Н группы СН2·
позволяет проводить реакции алкилирования по
СН2СН2СН3, и триплет протонов при 3.4-3.45 м.д.
тиоксогруппе. В качестве алкилирующих агентов
(2Н, СН2СН2СН2СН3). Синглет протона С8-Н интен-
использованы йодистый метил, н-бутилбромид и н-
сивностью 1Н находится при 8.8 м.д., а синглет
бутиловый эфир монохлоруксусной кислоты. Во
при 13.4 м.д. отнесен к протону группы NH.
всех случаях получены продукты алкилирования
9-12, представляющие собой кристаллические
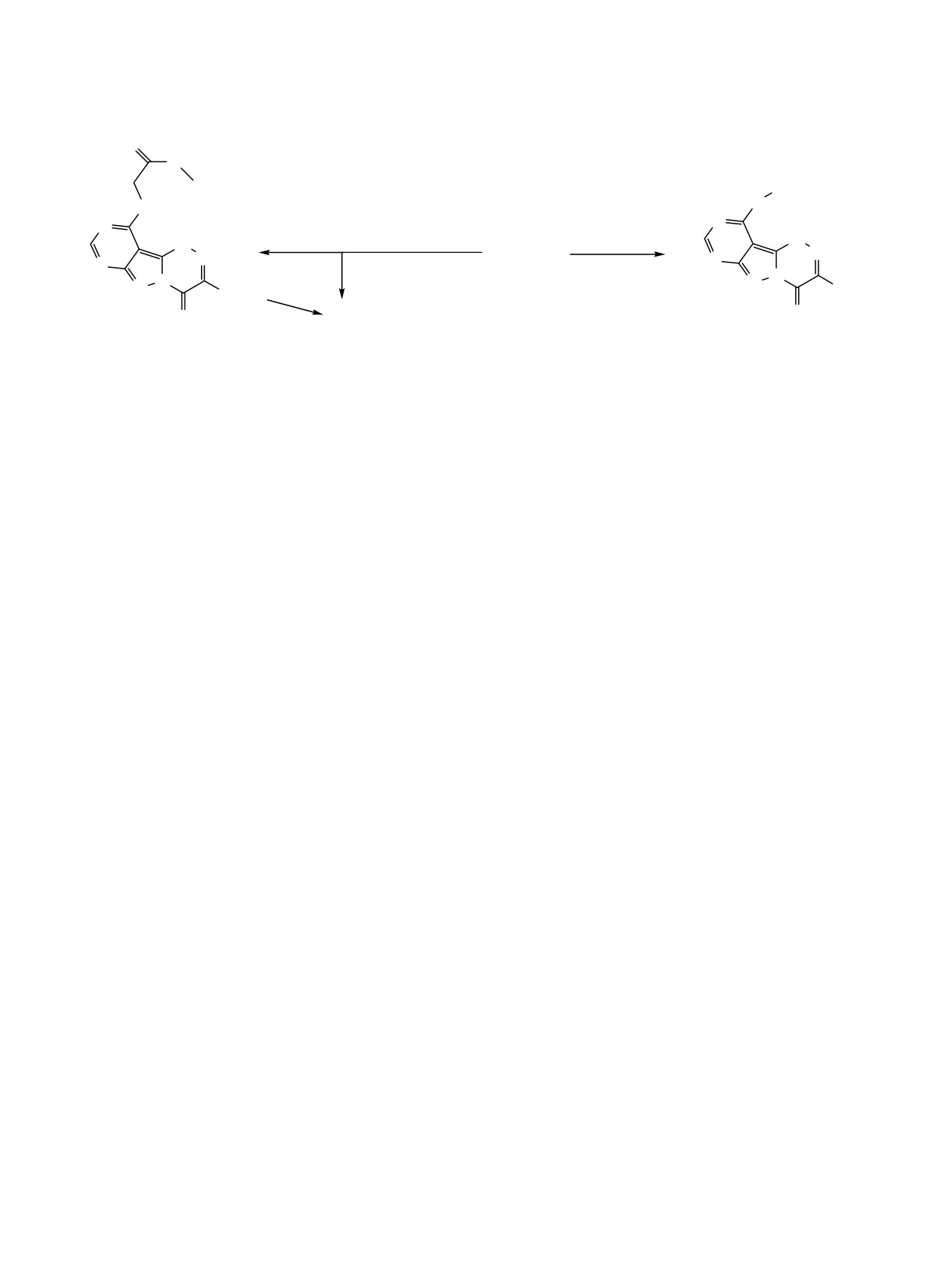
Неожиданные результаты получены при взаимо-
вещества, нерастворимые в воде и кислородсодер-
действии соединения
7 с н-бутиловым эфиром
жащих органических растворителях.
монохлоруксусной кислоты (схема 3). В качестве
продуктов реакции в зависимости от температуры
Метилирование йодистым метилом не затраги-
процесса выделены бутил-2-[(3-трет-бутил-4-
вает тиоксогруппу в положении 4 гетероцикла
тиоксо-4,6-дигидропиримидо[4',5':3,4]пиразоло-
(схема 2). Продукт реакции выпадал в осадок по
[5,1-с][1,2,4]триазин-10-ил)тио]ацетат
(12) и
3-
мере метилирования (хроматографический контроль
трет-бутил-10-метилмеркаптопиримидо[4',5':3,4]-
прохождения реакции).
пиразоло[5,1-с][1,2,4]триазин-4(6Н)-тион
(9).
В ИК спектрах соединений 9, 10 сохраняется
Вероятно, повышение температуры реакции в
полоса поглощения при 1147 и 1156 см-1, отнесен-
условиях щелочной среды приводит к гидролизу
ная к колебаниям тионной группы С4=S. В спектре
сложноэфирной связи с последующим декарбокси-
ЯМР 1Н соединения 10 синглет протонов метил-
лированием. Встречным синтезом - гидролизом
меркаптогруппы расположен при
2.75 м.д., а
соединения 12 - при нагревании в щелочной среде
метильного заместителя - при 2.65 м.д. с интенсив-
получено соединение 9. В ИК спектре соединения
ностями 3Н.
12 появляется характеристическая полоса погло-
щения карбонильной группы при
1699 см-1 и
Алкилирование н-бутилбромидом привело к
сохраняется полоса поглощения при
1232 см-1
выделению 3-трет-бутил-10-(н-бутилмеркапто)пи-
(C4=S).
римидо[4',5':3,4]пиразоло[5,1-с][1,2,4]триазин-4-
(6Н)-она (11) вместо ожидаемого 3-трет-бутил-10-
В результате исследования реакций алкилиро-
(н-бутилмеркапто)пиримидо[4',5':3,4]пиразоло[5,1-
вания производных пиримидо[4',5':3,4]пиразоло-
с][1,2,4]триазин-4(6Н)-тиона (cхема
3). В ИК
[5,1-с][1,2,4]триазин-4(6Н),11(10Н)-дионов уста-
спектре соединения 11 появляется характеристи-
новлено, что алкилирование проходит по атому N1
ческая полоса поглощения при 1709 см-1 (С=О),
гетероцикла, а если это положение занято, то по
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 7 2019
1058
МИРОНОВИЧ и др.
Схема 3.
O
O
Bu-n
Bu-n
S
S
N
N
_
_
H
H
25oC
ClCH2COOBu-n, OH
n-BuBr, OH
N
N
7
N
N
N
N
20
oC
40oC
N
N
N
N
Bu-t
Bu-t
O
S
9
12
11
атому N9. В случае тиоаналогов алкилирование не
(разл.) (R=Me)] по методике [10], соединение
1
затрагивает атомов азота и проходит в мягких
[т.пл. 194.6-195.2°С (разл.)] по методике [7], сое-
условиях по тиоксогруппе в положении 10 гете-
динение 7 (т.пл. 289-290°С) и соединение 8 (т.пл.
роцикла с образованием алкилмеркаптозамещенных
159-160°С) по методике [11].
производных.
1-Бензил-3-трет-бутилпиримидо[4',5':3,4]-
пиразоло[5,1-c][1,2,4]триазин-4,10(1H,9H)-дион
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(2). а. Соединение 1 (0.5 г, 1.55 ммоль) кипятили в
50 мл муравьиной кислоты в течение 10 сут в
УФ спектры регистрировали на спектрофото-
атмосфере аргона. Охлаждали, растворитель
метре Shimadzu UV-1800. ИК спектры записаны на
упаривали в вакууме досуха. Остаток очищали с
Фурье-спектрометре Agilent Cary
660 FTIR в
помощью хроматографии (элюент этилацетат-
тонком слое. Спектры ЯМР 1Н, 13С (APT, тест на свя-
гексан, 1:1-1:0). Получали белый порошок с т.пл.
занные протоны) регистрировали на приборе «Bruker
232.1-232.8°С. Выход 0.45 г (83%).
AM-300» или «Bruker DRX-500», рабочие частоты
б. К раствору соединения 4 (0.2 г, 0.77 ммоль) в
соответственно 300 (1Н), 75 или 125 (13С) МГц.
смеси ацетонитрила (10 мл) и этилацетата (5 мл)
Внутренний стандарт - ДМСО-d6 или CDCl3. Масс-
добавляли ТЭА
(0.3
мл,
2.15 ммоль) и
спектры высокого разрешения записаны на при-
бензилхлорид (0.15 мл, 1.30 ммоль). Полученный
боре «Bruker micrOTOF II» методом электрорас-
раствор перемешивали 2 сут при 20-25°С. Затем
пылительной ионизации. Измерения выполнены на
добавляли воду (100 мл), перемешивали и прово-
положительных (напряжение на капилляре - 4500 В)
дили экстракцию этилацетатом (5×30 мл). Объеди-
или отрицательных (напряжение на капилляре -
нённые органические фазы сушили безводным
3200 В) ионах. Температуры плавления определяли
MgSO4, отфильтровывали и фильтрат упаривали в
на приборе STUART фирмы «Melting point SMP30».
вакууме. Остаток очищали как в методе а.
Чистоту соединений контролировали методом ТСХ
Получали белый порошок с т.пл. 232.1-232.8°С.
на пластинках Silufol UV-254 в системе хлоро-
Выход 0.24 г (89%). УФ спектр, λmax (log ε), нм:
форм-метанол (4:1), этилацетат-гексан (1:1-1:0),
266.00 (0.316), 309 (0.278). ИК спектр, ν, см-1: 3231
проявляли УФ светом. Для хроматографии исполь-
(NH), 2966, 2908 (CH), 1687, 1605 (2CO), 1572,
зовали Merck Silica gel for chromatography 60-200 μm.
1533, 1502, 1458, 1389, 1356, 1305, 1269, 1206,
Реагенты, растворители и газы (чистота 90.0-99.9%)
1108, 1086, 1015, 961, 911, 825, 789, 761, 719, 698,
получены из коммерческих источников («Химмед»,
666, 614, 561, 540. Спектр ЯМР 1Н (300 МГц,
«Acros», «Sigma-Aldrich») и при необходимости
ДМСО-d6), δ, м.д.: 1.38 с (9Н, t-Bu), 6.24 с (2Н,
подвергались дополнительной очистке до дости-
PhCH2), 7.25-7.50 м (5Н, Ph), 8.20 c (1H, C8-H),
жения аналитической чистоты стандартным
12.16 с (1Н, NH). Спектр ЯМР 13С (125 МГц,
образом непосредственно перед использованием.
ДМСО-d6), δ, м.д.: 160.53, 158.51, 151.08 (C8-H),
Получали 3-трет-бутил-9-R-пиримидо[4',5':3,4]-
149.17, 147.04, 142.15, 136.29 (C четвертичн. Ph),
пиразоло[5,1-с][1,2,4]триазин-4(6Н),11(10Н)-дионы
128.91, 128.78, 128.42 (соотв. о-, м- и п-СНPh),
[т.пл. 221-222°С (соединение 4); т.пл. > 310°C
90.34 (C10a), 60.18 (PhCH2), 37.59 [C(CH3)3], 27.91
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 7 2019
АЛКИЛИРОВАНИЕ 3-трет-БУТИЛПИРИМИДО[4',5':3,4]ПИРАЗОЛО[5,1-с][1,2,4]-...
1059
[C(CH3)3]. Масс-спектр, m/z 373.1385 [М + Na]+.
перемешивали 5 сут при 20-25°С. Затем добавляли
Найдено, %: С 61.68; Н 5.19; N 24.02. C18H18N6O2.
воду (100 мл), перемешивали и проводили экстрак-
Вычислено, %: C, 61.70; H, 5.18; N, 23.99. [М + Na]+
цию этилацетатом
(5×30 мл). Объединённые
373.1383.
органические фазы сушили безводным MgSO4,
отфильтровывали и фильтрат упаривали в вакууме.
1-Бензил-3-трет-бутил-9-бутилпиримидо-
Остаток очищали с помощью хроматографии (элюент
[4',5':3,4]пиразоло[5,1-c][1,2,4]триазин-4,10-
этилацетат-гексан,
1:1-2:1). Получали белый
(1H,9H)-дион (3). В атмосфере аргона к раствору
порошок с т.пл.178.2-178.8°С. Выход 0.33 г (90 %).
0.25 г соединения 2 (0.71 ммоль) в смеси 30 мл
УФ спектр, λmax (log ε), нм: 253 (0.357). ИК спектр,
ТГФ и 1.5 мл ГМФТА добавляли NaH (60% сус-
ν, см-1: 3221 (NH), 2960, 2932 (CH), 1688 (2CO),
пензия в минеральном масле, 40 мг, 1.0 ммоль) в
1606, 1571, 1527, 1480, 1361, 1303, 1209, 1087, 957,
одну порцию. Наблюдалось выделение газа.
916, 788, 662, 592, 559. Спектр ЯМР 1Н (300 МГц,
Перемешивали 5 мин при 20°С, затем добавляли н-
ДМСО-d6), δ, м.д.: 0.89 т (3Н, J 7.3 Гц, NCH2CH2·
бутилбромид (0.30 мл, 2.78 ммоль). Полученную
CH2CH3), 1.25-1.40 м (2Н, NCH2CH2CH2CH3), 1.40
смесь кипятили в атмосфере аргона 6 ч. Охлаждали
с (9Н, t-Bu), 1.71-1.90 м (2Н, NCH2CH2CH2CH3),
и медленно при перемешивании добавляли к охлаж-
4.94 т (2Н, J 7.0 Гц, NCH2CH2CH2CH3), 8.14 д (1H,
дённому до 0°С раствору KH2PO4 (1 г, 7.35 ммоль)
J 3.8 Гц, C8-H), 12.03 д (1Н, NH, J 3.2 Гц). Спектр
в 100 мл воды. Проводили экстракцию этилаце-
ЯМР 13С (125 МГц, ДМСО-d6), δ, м.д.: 160.58,
татом (5×30 мл). Объединённые органические фазы
158.17, 151.03 (C8-H), 148.53, 147.25, 142.11, 90.28
промывали последовательно 1% водным раствором
(C10a),
57.46 (NCH2CH2CH2CH3),
37.47 (CMe3),
HCl (1×100 мл), водой (1×50 мл), сушили безвод-
31.51 (NCH2CH2CH2CH3),
27.94
[C(CH3)3],
19.18
ным MgSO4, отфильтровывали и фильтрат упари-
(NCH2CH2CH2CH3),
13.98 (NCH2CH2CH2CH3).
вали в вакууме. Остаток очищали с помощью хро-
Масс-спектр, m/z 339.1549 [М + Na]+. Найдено, %:
матографии (элюент этилацетат-гексан, 1:5-1:2).
С 56,47; Н 6.54; N 26.85. C15H20N6O2. Вычислено,
Получали вязкую оранжевую жидкость, т.пл. < 0°С.
%: C, 56.95; H, 6.37; N, 26.56. [М + Na]+ 339.1540.
Выход 0.21 г (72%). УФ спектр, λmax (log ε), нм: 256
(0.309). ИК спектр, ν, см-1: 2959, 2930 (CH), 1709,
9-Бензил-3-трет-бутил-1-бутилпиримидо-
1672 (2CO), 1603, 1562, 1533, 1475, 1456, 1378,
[4',5':3,4]пиразоло[5,1-c][1,2,4]три-азин-4,10-
1357, 1305, 1189, 1163, 1116, 1091, 1027, 1007, 935,
(1H,9H)-дион (6). В атмосфере аргона к раствору
821, 786, 759, 718, 699, 616, 536. Спектр ЯМР 1Н
соединения 5 (0.2 г, 0.63 ммоль) в смеси 10 мл ТГФ
(300 МГц, CDCl3), δ, м.д.: 1.01 т (3Н, J 7.3 Гц,
и 0.5 мл ГМФТА добавляли NaH (60% суспензия в
NCH2CH2CH2CH3),
1.35-1.50 м
(2Н, NCH2CH2·
минеральном масле, 40 мг, 1.0 ммоль) в одну
CH2CH3), 1.48 с (9Н, t-Bu), 1.71-1.85 м (2Н, NCH2CH2·
порцию. Наблюдалось выделение газа. Перемеши-
CH2CH3), 4.03 т (2Н, J 7.3 Гц, NCH2CH2CH2CH3),
вали 5 мин при 20°С, затем добавляли бензил-
6.31 с (2Н, PhCH2), 7.29-7.37 м, 7.43-7.50 м (5Н, Ph),
хлорид (0.15 мл, 1.30 ммоль). Полученную смесь
8.14 с (1H, C8-H). Спектр ЯМР 13С (APT, 75 МГц,
кипятили в атмосфере аргона 10 ч. Охлаждали и
CDCl3), δ, м.д.:
160.02,
157.74,
152.38 (C8-H),
медленно при перемешивании добавляли к охлаж-
150.30, 146.60, 141.67, 135.32 (C четвертичн. Ph),
дённому до 0°С раствору KH2PO4 (1 г, 7.35 ммоль)
128.86, 128.78, 128.66 (соотв. о-, м- и п-СН Ph),
в 100 мл воды. Проводили экстракцию этилаце-
90.27 (C10a),
60.76 (PhCH2),
46.61 (NCH2CH2·
татом (5×30 мл). Объединённые органические фазы
CH2CH3), 37.99 (CMe3), 31.82 (NCH2CH2CH2CH3),
промывали последовательно 1% водным раствором
27.82
[C(CH3)3], 19.87 (NCH2CH2CH2CH3),
13.69
HCl (1×100 мл), водой (1×50 мл), сушили безвод-
(NCH2CH2CH2CH3). Масс-спектр, m/z 407.2186 [М +
ным MgSO4, отфильтровывали и фильтрат упари-
Н]+. Найдено,
%: С
65.04; Н
6.43; N
20.67.
вали в вакууме. Остаток очищали с помощью хро-
C22H26N6O2. Вычислено, %: C, 65.01; H, 6.45; N,
матографии (элюент этилацетат-гексан, 1:3-1:1).
20.68. [М + Н]+ 407.2190.
Получали вязкую бесцветную жидкость с т.пл. < 0°С.
3-трет-Бутил-1-бутилпиримидо[4',5':3,4]-
Выход 0.17 г (66%). УФ спектр, λmax (log ε), нм: 262
пиразоло[5,1-c][1,2,4]триазин-4,10(1H,9H)-дион
(0.389). ИК спектр, ν, см-1: 2956 (CH), 1680 (2CO),
(5). К раствору соединения 4 (0.3 г, 1.15 ммоль) в
1601, 1566 1529, 1475, 1456, 1361, 1301, 1236, 1181,
смеси ацетонитрила (15 мл) и этилацетата (5 мл)
1137, 1080, 1024, 917, 787, 719, 700, 605, 580, 561.
добавляли ТЭА (0.5 мл, 3.59 ммоль) и н-бутил-
Спектр ЯМР 1Н (300 МГц, CDCl3), δ, м.д.: 0.96 т
бромид (0.6 мл, 5.55 ммоль). Полученный раствор
(3Н, J 7.3 Гц, NCH2CH2CH2CH3), 1.30-1.46 м (2Н,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 7 2019
1060
МИРОНОВИЧ и др.
NCH2CH2CH2CH3), 1.48 с (9Н, t-Bu), 1.82-1.95 м
спектр, ν, см-1: 3333, 2959, 2929, 1615, 1565, 1480,
(2Н, NCH2CH2CH2CH3),
5.06 т
(2Н, J
7.0 Гц,
1458, 1388, 1361, 1249, 1147 (C=S), 1077, 1035, 946,
NCH2CH2CH2CH3), 5.17 с (2Н, PhCH2), 7.26-7.40 м
775. Спектр ЯМР 1Н, δ, м.д.: 1.45 c (9H, t-Bu), 2.65
(5Н, Ph), 8.20 с (1H, C8-H). Спектр ЯМР 13С (APT,
с (3Н, Me), 2.75 с (3H, SMe). Найдено, %: C 48.68;
125 МГц, CDCl3), δ, м.д.: 160.00, 157.28, 152.19
H 4.97; N 26.30. C13H16N6S2. Вычислено, %: С
(C8-H), 149.73, 146.64, 141.90, 135.71 (C четвер-
48.73; Н 5.03; N 26.23. M 320.43
тичн. Ph), 129.07, 128.36, 127.76 (соотв. о-, м- и п-
3-трет-Бутил-10-(н-бутилмеркапто)пири-
СНPh), 90.01 (C10a), 58.08 (PhCH2), 49.16 (NCH2·
мидо[4',5':3,4]пиразоло[5,1-с][1,2,4]-триазин-4-
CH2CH2CH3),
37.75 (CMe3),
31.78 (NCH2CH2·
(1Н)-он
(11). В водно-метанольном растворе
CH2CH3),
27.74
[C(CH3)3],
19.31 (NCH2CH2CH2·
щелочи (метанол:вода = 1:1) при комнатной темпе-
CH3), 13.70 (NCH2CH2CH2CH3). Масс-спектр, m/z
ратуре растворяли 0.6 г (2 ммоль) соединения 7 и
429.2006 [М + Na]+. Найдено, %: С 65.23; Н 6.56; N
прибавляли 0.7 г (5 ммоль) бромистого н-бутила.
20.82. C22H26N6O2. Вычислено, %: C, 65.01; H, 6.45;
Перемешивали 8 ч при комнатной температуре. К
N, 20.68. [М + Na]+ m/z 429.2009.
раствору прибавляли 7% водный HCl до рН 6-7.
3-трет-Бутил-10-метилмеркаптопиримидо-
Осадок отфильтровывали, промывали дистиллиро-
[4',5':3,4]пиразоло[5,1-с][1,2,4]триазин-4(6Н)-
ванной водой до нейтральной среды промывных
тион (9). а. В водно-метанольном растворе щелочи
вод, метанолом
(1×2 мл), сушили на воздухе.
(метанол-вода, 1:1) растворяли 0.3 г (1 ммоль)
Получали белое кристаллическое вещество с т.пл.
соединения
7 и при комнатной температуре
200-210°С (разл.). Выход 0.46 г (69%). Элюент для
прибавляли 0.1 мл (1.5 ммоль) CH3I, перемешивали
хроматографии хлороформ:метанол
(4:1). УФ
3 ч. Осадок отфильтровывали, промывали дистил-
спектр, λmax (log ε), нм: 364.8 (1.018), 334.8 (0.996),
лированной водой до рН 6-7 промывных вод,
299.6
(1.257),
214.8
(1.956). ИК спектр, ν, см-1:
метанолом
(1×2 мл) и сушили на воздухе.
3045, 2958, 2930, 2871, 1709 (C=O), 1640, 1614,
Получали белые кристаллы с т.пл. > 300°С. Выход
1584, 1541, 1507, 1482, 1455, 1407, 1361, 1336,
0.47 г (78%). Элюент для хроматографии хлоро-
1184, 1158, 1119,1063, 1004, 875, 769, 736. Спектр
форм-метанол (4:1).
ЯМР 1Н, δ, м.д.: 0.9-1.0 м (3Н, СН2СН2СН2СН3),
1.45 с (9H, Bu-t), 2.65-2.8 м (4H, СН2СН2СН2СН3),
б. Кипятили 0.4 г (1 ммоль) соединения 12 в
3.4-3.45 т (2Н, СН2СН2СН2СН3), 8.8 c (1H, CH),
водном растворе н-бутилового спирта 3 ч. Охлаж-
13.4 уш.с (1Н, NH). Масс-спектр, m/z 333.1422 [М +
дали, осадок отфильтровывали, промывали водой
Н]+. Найдено,
%: C
54.40; H
6.09; N
25.50.
до рН 6-7 промывных вод, сушили на воздухе.
C15H20N6ОS. Вычислено, %: C 54.20; H 6.06; N
Получали белые кристаллы с т.пл. > 300°С. Выход
25.28. [М + Н]+ 333.1492.
0.19 г (66%). УФ спектр, λmax (log ε), нм: 353.8
(1.088), 301.4 (0.611), 260.2 (0.997), 223.4 (1.522).
Бутил-2[(3-трет-бутил-4-тиоксо-1,4-дигидро-
ИК спектр, ν, см-1: 3370, 2966, 1614, 1588, 1546,
пиримидо[4',5':3,4]пиразоло[5,1-с][1,2,4]триазин-
1525, 1485, 1445, 1389, 1355, 1327, 1300, 1238, 1156
10-ил)тио]ацетат (12). К 0.87 г (3 ммоль) сое-
(C=S), 1116, 1085, 943, 801, 704. Спектр ЯМР 1Н, δ,
динения 7 в водно-метанольном растворе щелочи
м.д.: 1.45 с (9H, t-Bu), 2.63 c (3H, Me), 8.5 c (1H, CH).
(метанол-вода, 1:1) при комнатной температуре
Найдено, %: C 47.09; H 4.70; N 27.42. C12H14N6S2.
прибавляли 0.7 мл (5 ммоль) н-бутилового эфира
Вычислено, %: C 47.04; H 4.61; N 27.43. М+ 306.42
монохлоруксусной кислоты и перемешивали 24 ч.
Реакционную смесь нейтрализовали 7% водной
Образцы соединений, полученных по
HCl. Осадок отфильтровывали, промывали
описанным выше методам, не давали температуры
дистиллированной водой до нейтральной среды
депрессии при смешивании образцов, а
промывных вод, метанолом (1×2 мл), сушили на
температуры плавления совпадали.
воздухе. Получали светло-коричневое кристалли-
3-трет-Бутил-8-метил-10-метилмеркапто-
ческое вещество с т.пл. 280-285°С (осм.). Выход
пиримидо[4',5':3,4]пиразоло[5,1-с][1,2,4]триазин-
0.67 г (55%). Элюент для хроматографии хлоро-
4(6Н)-тион (10). Получали аналогично соедине-
форм-метанол (4:1). УФ спектр, λmax (log ε), нм:
нию 9 по методу а бурое кристаллическое вещество
348.8
(0.437),
256.0
(0.779). ИК спектр, ν, см-1:
с т.пл. 117-120°С (разл.). Выход 0.39 г
(61%).
2962, 2928, 1699 (С=О), 1581, 1536, 1510, 1453,
Элюент для хроматографии хлороформ-метанол
1387, 1346, 1232 (C=S), 1171, 1137, 1081, 999, 945,
(4:1). УФ спектр, λmax (log ε), нм: 252.6 (1.911). ИК
815, 790, 788. Спектр ЯМР 1Н, δ, м.д.: 0.8-1.1 м
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 7 2019
АЛКИЛИРОВАНИЕ 3-трет-БУТИЛПИРИМИДО[4',5':3,4]ПИРАЗОЛО[5,1-с][1,2,4]-...
1061
(3Н, СН2СН2СН2СН3), 1.4 с (9H, Bu-t), 2.7 c (2Н,
Korlyukov A.A., Tikhomirov A.S., Shchekotikhin A.E.,
SCH2C), 3.5-3.9 м (4H, СН2СН2СН2СН3), 4.1-4.3 т
Traven’ V.F., Voskresenskii
L.G., Zubkov F.I.,
Golubchikov O.A., Semeikin A.S., Berezin D.B.,
(2Н, СН2СН2СН2СН3), 8.6 c (1H, CH), 13 уш.с (1Н,
Stuzhin P.A., Filimonov V.D., Krasnokutskaya E.A.,
NH). Найдено,
%: C
50.33; H
5.52; N
20.63.
Fedorov A.Yu., Nyuchev A.V., Orlov V.Yu., Begunov R.S.,
C17H22N6О2S2. Вычислено, %: C 50.23; H 5.46; N
Rusakov A.I., Kolobov A.V., Kofanov E.R., Fedotova O.V.,
20.67. М 406.52.
Egorova A.Yu., Charushin V.N., Chupakhin O.N.,
Klimochkin Yu.N., Osyanin V.A., Reznikov A.N.,
КОНФЛИКТ ИНТЕРЕСОВ
Fisyuk A.S., Sagitullina G.P., Aksenov A.V., Akse-
nov N.A., Grachev M.K., Maslennikova V.I.,
Авторы заявляют об отсутствии конфликта
Koroteev M.P., Brel’ A.K., Lisina S.V., Medvedeva S.M.,
интересов.
Shikhaliev Kh.S., Suboch G.A., Tovbis M.S.,
Mironovich L.M., Ivanov S.M., Kurbatov S.V.,
Kletskii M.E., Burov O.N., Kobrakov K.I., Kuznetsov D.N.,
СПИСОК ЛИТЕРАТУРЫ
Russ. J. Org. Chem.
2018,
157.] doi:
10.1134/
S107042801802001X
1. Миронович Л.М., Иванов С.М. Пиразоло[1,2,4]-
3. Миронович Л.М., Иванов С.М., Чижов А.О., Даева Е.Д.
триазины: синтез и химические свойства.
ЖОрХ. 2017, 53, 571. [Mironovich L.M., Ivanov S.M.,
Актуальные вопросы технических наук: теорети-
Chizhov A.O., Daeva E.D. Russ. J. Org. Chem. 2017,
ческий и практический аспекты. Коллективная
53, 577.] doi 10.1134/S10704280170401334
монография. Уфа. АЭТЕРНА, 2017, 51.
4. Ivanov S.M., Mironovich L.M., Solyev P.N.,
2. Коновалов А.И., Антипин И.С., Бурилов В.А.,
Rodinovskaya L.A., Shestopalov A.M. J. Heterocycl.
Маджидов Т.И., Курбангалиева А.Р., Немтарев А.В.,
Chem. 2018, 55, 545. doi 10.1002/jhet.3064
Соловьева С.Е., Стойков И.И., Мамедов В.А.,
5. Ivanov S.M., Mironovich L.M., Rodinovskaya L.A..
Захарова Л.Я., Гаврилова Е.Л., Синяшин О.Г.,
Shestopalov A.M. Tetrahedron Lett. 2017, 58, 1851. doi
Балова И.А., Васильев А.В., Зенкевич И.Г.,
10.1016/j.tetlet.2017.03.083
Красавин М.Ю., Кузнецов М.А., Молчанов А.П.,
6. Иванов С.М., Миронович Л.М., Родиновская Л.А.,
Новиков М.С., Николаев В.А., Родина Л.Л.,
Шестопалов А.М. Изв. АН. Сер. Хим. 2018, 67, 1482.
Хлебников А.Ф., Белецкая И.П., Вацадзе С.З.,
[Ivanov S.M., Mironovich L.M., Rodinovskaya L.A.,
Громов С.П., Зык Н.В., Лебедев А.Т., Леменовс-
Shestopalov A.M. Russ. Chem. Bull. Int. Ed. 2018, 67,
кий Д.А., Петросян В.С., Ненайденко В.Г.,
1482.] doi 10.1007/s11172-018-2243-z
Негребецкий В.В., Бауков Ю.И., Шмиголь Т.А.,
Корлюков А.А., Тихомиров А.С., Щекотихин А.Е.,
7. Иванов С.М., Миронович Л.М., Родиновская Л.А.,
Травень В.Ф., Воскресенский Л.Г., Зубков Ф.И.,
Шестопалов А.М. Изв. АН. Сер. Хим. 2018, 67, 1487.
Голубчиков О.А., Семейкин А.С., Березин Д.Б.,
[Ivanov S.M., Mironovich L.M., Rodinovskaya L.A.,
Стужин П.А., Филимонов В.Д., Краснокутская Е.А.,
Shestopalov A.M. Russ. Chem. Bull. Int. Ed. 2018, 67,
Федоров А.Ю., Нючев А.В., Орлов В.Ю., Бегунов Р.С.,
1487.] doi 10.1007/s11172-018-2244-y
Русаков А.И., Колобов А.В., Кофанов Е.Р., Федото-
8. Charushin V., Rusinov V., Chupakhin O. Comprehen-
ва О.В., Егорова А.Ю., Чарушин В.Н., Чупахин О.Н.,
sive Heterocyclic Chemistry III. Katritzky A.R.,
Климочкин Ю.Н., Осянин В.А., Резников А.Н.,
Ramsden C.A. Scriven E.F.V., Taylor R.J.K., Eds.
Фисюк А.С., Сагитуллина Г.П., Аксенов А.В.,
Oxford: Elsevier.
2008,
9,
95. doi
10.1016/B978-
Аксенов Н.А., Грачев М.К., Масленникова В.И.,
008044992-0.00802-6.9
Коротеев М.П., Брель А.К., Лисина С.В., Медведе-
9. Иванов С.М., Миронович Л.М., Родиновская Л.А.,
ва С.М., Шихалиев Х.С., Субоч Г.А., Товбис М.С.,
Шестопалов А.М. Изв. АН. Сер. Хим. 2017, 66, 1126.
Миронович Л.М., Иванов С.М., Курбатов С.В.,
[Ivanov S.M., Mironovich L.M., Rodinovskaya L.A.,
Клецкий М.Е., Буров О.Н., Кобраков К.И., Кузне-
Shestopalov A.M. Russ. Chem. Bull. Int. Ed. 2017, 66,
цов Д.Н. ЖОрХ. 2018, 54,
161.
[Konovalov A.I.,
1126.] doi 10.1007/s11172-017-1865-x
Antipina I.S., Burilov V.A., Madzhidov T.I.,
10. Миронович Л.М., Костина М.В., Подольникова А.Ю.
Kurbangalieva A.R., Nemtarev A.V., Solovieva S.E.,
ЖОрХ. 2013, 49, 775. [Mironovich L.M., Kostina M.V.,
Stoikov I.I., Mamedov V.A., Zakharova L.Ya.,
Podol’nikova A.Yu. Russ. J. Org. Chem. 2013, 49,
Gavrilova E.L., Sinyashin O.G., Balova I.A., Vasilyev A.V.,
758.] doi 10.1134/S1070428013050230
Zenkevich I.G., Krasavin M.Yu., Kuznetsov M.A.,
11. Миронович Л.М., Подольникова А.Ю. ЖОрХ. 2015,
Molchanov A.P., Novikov M.S., Nikolaev V.A.,
51, 411. [Mironovich L.M., Podol’nikova A.Yu. Russ.
Rodina L.L., Khlebnikov A.F., Beletskaya I.P.,
J. Org. Chem.
2015,
51,
397.] doi
10.1134/
Vatsadze S.Z., Gromov S.P., Zyk N.V., Lebedev A.T.,
S1070428015030197
Lemenovskii D.A., Petrosyan V.S., Nenaidenko V.G.,
Negrebetskii V.V., Baukov Yu.I., Shmigol’ T.A.,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 7 2019
1062
МИРОНОВИЧ и др.
Alkylation of 3-tert-Butylpyrimido[4',5':3,4]pyrazolo-
[5,1-c][1,2,4]triazine-4,10(1H,9H)-diones(dithiones)
L. M. Mironovicha, *, S. M. Ivanovb, and E. D. Daevab
a Southwest State University, 305040, Russia, Kursk, 50 let Oktyabrya 94
*e-mail: lm.myronovych@mail.ru
b Zelinsky Institute of Organic Chemistry, 119991, Russia, Moscow, Leninskij pr. 47
Received December 10, 2018; revised March 31, 2019; accepted April 12, 2019
Condensation of
7-amino-1-R-3-tert-butyl-4-oxo-1,4-dihydropyrazolo[5,1-c][1,2,4]triazin-8-carbonitrile with
formic acid led to formation of 1-R-3-tert-butylpyrimido[4',5':3,4]pyrazolo[5,1-c][1,2,4]triazin-4,10(1H,9H)-
diones. The latter could also be prepared from 3-tert-butylpyrimido[4',5':3,4]pyrazolo[5,1-c][1,2,4]triazin-4,10
(1H,9H)-dione and alkyl halides. Further alkylation in harsh reaction conditions proceeded at the N9 ring
position, with formation of 1-R, 9-R1-substituted derivatives. Interaction of 3-tert-butyl-8-R2-pyrimido[4',5':3,4]
pyrazolo[5,1-c][1,2,4]triazin-4,10(1H,9H)-dithiones with alkyl halides in alkaline medium led to isolation of the
corresponding S-alkylsubstituted products.
Keywords: pyrimido[4',5':3,4]pyrazolo[5,1-c][1,2,4]triazine, pyrazolo[5,1-c][1,2,4]triazine, condensation, alkylation
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 7 2019