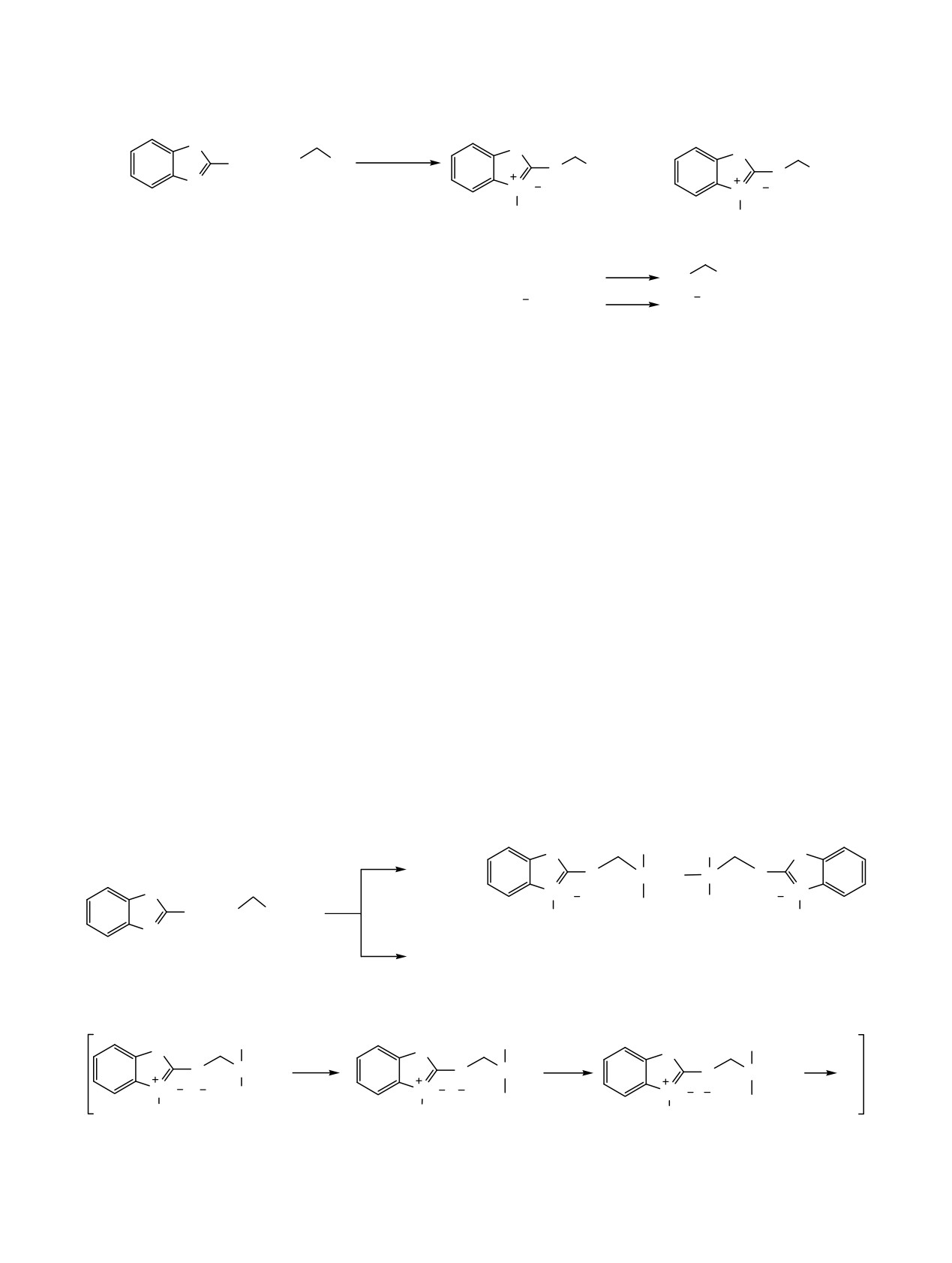ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 8, с. 1157-1162
УДК 547.781.1:547.1.1':547.789.61
СИНТЕЗ S- И S-S-КРЕМНИЙОРГАНИЧЕСКИХ
ПРОИЗВОДНЫХ 2-МЕРКАПТОБЕНЗОТИАЗОЛА
© 2019 г. Н. О. Ярош*, Л. В. Жилицкая, Л. Г. Шагун, И. А. Дорофеев, Л. И. Ларина
ФГБУН «Иркутский институт химии им. А.Е. Фаворского СО РАН», 664033, Россия, г. Иркутск, ул. Фаворского 1
*e-mail: yarosh.nina@irioch.irk.ru
Поступила в редакцию 01 ноября 2018 г.
После доработки 13 мая 2019 г.
Принята к публикации 15 мая 2019 г.
По реакции
2-меркаптобензотиазола и ди(2-бензотиазолил)дисульфида с иодметилсиланами,
содержащими в молекуле экзоциклический и эндоциклический атомы кремния, в присутствии
молекулярного иода синтезированы кремнийорганические иодиды и полииодиды бензотиазолия и
дисульфония.
Ключевые слова: 2-меркаптобензотиазол, ди(2-бензотиазолил)дисульфид, иодметил(диметил)фенил-
силан, 1-иодметил-1-метилсилолан, дисульфоний-дикатионы, полииодиды, алкилирование.
DOI: 10.1134/S0514749219080019
Бициклические молекулы, содержащие два
Первые кремнийорганические производные 2-
гетероатома, как правило, обладают несколькими
меркаптобензoтиазола, в которых атом кремния
видами биологической активности широкого
соединен с гетероциклом фрагментом
-S-СH2,
фармакологического спектра действия. Так,
получены при взаимодействии 2-меркаптобензо-
органические производные
2-меркаптобензотиа-
тиазола с иодметилпрозводными силоксанов в
зола проявляют противогрибковую, антибакте-
отсутствие основных сред
[19] или его S-
риальную, противосудорожную, противовоспали-
натриевых производных с триорганил(хлорметил)-
тельную, противоопухолевую, антиоксидантную,
силанами в системе бензол-ДМФА,
1:1
[13].
противоаллергическую активности [1-10]. В про-
Продолжая исследования в этой области, мы
мышленности их производные применяются в
впервые изучили реакцию 2-меркаптобензотиазола
кожевенной и резинотехнической промышленнос-
(1) с иодметилсиланами, содержащими в молекуле
ти при производстве автомобильных шин, рези-
экзоциклический и эндоциклический атомы
новых нитей и обуви [11, 12]. Алкоксисилановые
кремния [иодметил(диметил)фенилсилан (2а) и 1-
производные 2-меркаптобензотиазола используют-
(иодметил)-1-метилсилолан (2b)] при комнатной
ся в синтезе силатранов и силсесквиоксанов.
температуре в отсутствие основных сред.
Последние обладают эффективной избирательной
При взаимодействии 2-меркаптобензотиазола (1)
сорбционной активностью по отношению к
с иодметил(диметил)фенилсиланом
(2а) обра-
благородным металлам золота, палладия, платины
зуется иодид диметил(фенил)силилметилтиобензо-
в высших степенях окисления [13].
тиазолия (3а) - продукт региоселективного заме-
Несмотря на значительное количество иссле-
щения атома водорода меркаптогруппы. Выде-
дований в этой области кремнийорганические
лившийся в процессе S-алкилирования иодово-
производные
2-меркаптобензотиазола остаются
дород расходуется не только на образование
малоизученными. Интерес к таким соединениям,
моноиодида 3а, но и на восстановление иодсилана
прежде всего, обусловлен их потенциальной воз-
2а до триметилфенилсилана, о чем свидетельствует
можностью придавать промышленным изделиям
появление в спектрах ЯМР 1Н и 13С реакционной
эластичность, прочность, химическую инертность
смеси сигналов протонов при 0.32 м.д. и атомов
и биосовместимость [14-18].
углерода при
-4.11 м.д. метильной группы.
1157
1158
ЯРОШ и др.
Схема 1.
S
tкомн., 20_22 ч
S
S
SH
+
I
R
_HI
S
R
S
R
+
N
N I
N
I3
H
H
1
2a, b
3a, b
4a, b
2a, b + HI
Me
R
I
+ I2
I3
R = SiMe2Ph (a), SiMe(CH2)4 (b).
Образовавшийся в процессе восстановления
лабильные интермедиаты А и А' в процессе
молекулярный иод далее легко вступает в реакцию
выделения легко подвергаются гидролизу влагой
с иодид анионом соли 3а, образуя трииодид анион
воздуха или растворителя с образованием соот-
соли 4а. Реакция 2-меркаптобензотиазола (1) с 1-
ветствующих иодсиланолов B и B'. Их межмо-
иодметил-1-метилсилоланом (2b) протекает анало-
лекулярная конденсация в конечном итоге приво-
гично приводя к моно- и трииодиду 2-[(1-метил-1-
дит к дииодиду 2-{[3-(1,3-бензотиазол-2-илсульфа-
силоланилметил)тио]-1,3-бензотиазолия
3b и
4b
нил)метил]-1,1,3,3-тетраметилдисилоксанилметил}-
(схема 1).
сульфанил-1,3-бензотиазолия (5) (схема 3), физико-
химические константы и спектральные характерис-
При проведении этой реакции в присутствии
тики которого совпадают с дииодидом, синтези-
эквимольного количества иода, необходимого для
рованным нами ранее по реакции 2-меркаптобензо-
формирования трииодид-аниона, выход кремний-
тиазола с
1-(иодметил)-1,1,3,3,3-пентаметилдиси-
органических ионных жидкостей
4а, b увели-
локсаном или
1,3-бис(иодметил)-1,1,3,3-тетра-
чивается с 13 и 17% до 41 и 50% соответственно.
метилдисилоксаном [19]. Этот факт свидетельст-
При повышении температуры до 90°С время ее
вует о том, что для получения силоксановых
проведения сокращается в три раза, однако в этих
производных
2-меркаптобензотиазола возможно
условиях в продуктах 3а, 4а происходит частичное
использование 1-иодметил(диметил)фенилсилана в
расщепление связи Si-Csp2 под действием выде-
качестве альтернативного алкилирующего агента.
лившегося иодоводорода (схема 2), причем иод в
этом случае может выступать в качестве ката-
Выделение солей 3a, b, 4a, b и 5 осуществляли с
лизатора
[20-23]. Образующиеся при этом
учетом существенного различия их растворимости
Схема 2.
Me
Me
S
S
6 ч
3a + 4a
+
S
S
Si O
Si
+
+
S
N
N
90oC
I
Me
Me
I
SH +
I
R
+ I2
H
H
N
5
7 ч
3b + 4b
1
2a, b
R = SiMe2Ph (a), SiMe(CH2)4 (b).
Схема 3.
Me
Me
Me
S
S
S
HI, I2
H2O
S
Si Ph
S
Si I
S
Si OH
5
_C6H6
_HI
N
N
I
(I3 )
Me
I
N
(I3)
Me
I
(I3)
Me
H
H
H
3a, 4a
A (A')
B (B')
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
СИНТЕЗ S- И S-S-КРЕМНИЙОРГАНИЧЕСКИХ ПРОИЗВОДНЫХ 2-МЕРКАПТОБЕНЗОТИАЗОЛА
1159
в ацетоне. При его добавлении к реакционой смеси
двумерных спектрах ЯМР {1H-15N}HMBC солей
иодиды 3a, b, и 5 легко осаждались, однако их
7а, b отсутствует кросс-пик атома азота с
хорошая растворимость в полииодидах
4a, b
протонами метиленового фрагмента.
затрудняла очистку, что потребовало многократ-
Полииодиды 4а, b и 7а, b представляют собой
ного переосаждения реакционой смеси.
новый тип кремнийорганических ионных жид-
При взаимодействии 2-меркаптобензотиазола (1)
костей, которые могут найти применение в
с иодметилсиланами 2а, b в присутствии иода в
качестве ПАВ, катализаторов и растворителей в
спектрах ЯМР 1Н реакционной смеси обнаружены
органическом синтезе. Соли
7а и b являются
сигналы протонов метиленовой группы слабой
первыми представителями устойчивых кремний-
интенсивности при 2.29 и 2.30 м.д., которые можно
органических дисульфоний-дикатионов, которые
отнести к побочным продуктам алкилирования.
могут быть использованы в качестве электро-
Обсуждая путь их образования мы предположили
фильных реагентов для получения разнообразных
возможность окисления
2-меркаптобензотиазола
классов элементоорганических соединений в
(1) иодом до ди(2-бензотиазолил)дисульфида 6 и
реакциях с С-нуклеофилами [24-28]. Их неста-
его последующего N- или S-алкилирования
бильные аналоги были зафиксированы в качестве
иодметилсиланами 2а, b. Для подтверждения этого
интермедиатов при электрохимическом окисле-
предположения мы исследовали взаимодействие ди-
нии β-силилзамещенных алкиларилсульфидов
(2-бензотиазолил)дисульфида (6) с иодметилсила-
[29].
нами 2а, b в присутствии двумольного количества
Состав и строение синтезированных соединений
элементного иода. Реакция протекает по двум
3а, b, 4а, b, 5 и 7а, b подтверждено совокупностью
атомам серы дисульфидного мостика с образо-
данных элементного анализа, двумерных спектров
ванием полииодидов 1,2-ди(бензотиазол-2-ил)-1,2-
гомо- и гетероядерного ЯМР на ядрах 1Н, 13С, 15N и
бис{[диметил(фенил)силил]метил}- и
1,2-ди(1,3-
29Si, а также УФ-спектроскопии. В спектрах ЯМР
бензотиазол-2-ил)-1,2-бис[(1-метилсилоланил)ме-
1Н и 13С этих соединений наблюдаются сигналы
тил]-1,2-дисульфония (7а, b) с выходом 58 и 52%
протонов и атомов углерода фениленового фраг-
(схема 4). На их образование указывает появление
мента 2-меркаптобензотиазола, а также протонов и
в спектрах ЯМР 13С сигнала углерода С2 при 182 и
атомов углерода фрагмента MeSi. В их двумерных
187 м.д. и исчезновение сигнала С2 дисульфида 6
спектрах ЯМР {1H-15N}HMBC присутствует кросс-
при 159.80 м.д. Дополнительным аргументом в
пик атома азота с протоном в положении
4
пользу предполагаемого строения солей
7а, b
фениленового кольца. УФ спектры моноиодидов
является смещение в сильное поле сигналов
3а, b имеют одинаковый вид с максимумами
протонов и атомов углерода метиленовых
поглощения при 214 и 216 нм. В УФ спектрах
фрагментов в спектрах ЯМР 1Н, 13С (2.29, 2.30 и
трииодидов 4а, b и 7а, b наблюдаются характерные
14.97, 15.40 м.д. соответственно) по сравнению с
для аниона I3¯ полосы поглощения в области 291-
N-алкилированными продуктами [18]. В солях 3а,
292 и 362-364 нм [30].
b и 4а, b, не имеющих заряда на экзоциклических
атомах серы, эти значения в спектрах ЯМР 1Н и 13С
Таким образом, установлено, что 2-меркапто-
находятся при 3.01, 3.24 и 20.14, 27.27 м.д. В
бензотиазол взаимодействует с иодметилсиланами,
Схема 4.
S
S
30oC
S
S
S
S
N
N
+
2 2a, b
+
2 I2
N
N
N
N
S S
S
S
S
S
6
I
I
I3
I3
R
R
R
R
I
+ I2
I3
C (C')
7 a, b
R = SiMe2Ph (a), SiMe(CH2)4 (b).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
1160
ЯРОШ и др.
содержащими в молекуле экзоциклический и
добавляли
20 мл эфира. Далее выделение
эндоциклический атомы кремния, с образованием
продуктов по методике а.
новых типов S-кремнийорганических иодидов. В
в. К суспензии 2.00 ммоль ди(2-бензотиазолил)-
случае иодметил(диметил)фенилсилана при
дисульфида 6 в ацетоне прибавляли порциями 4
повышенной температуре происходит расщепление
ммоль силана 2а, b в ацетоне и 4 ммоль элемент-
Si-Csp2 cвязи выделившимся in situ иодоводородом
ного иода. Реакционную смесь перемешивали 6-7 ч
и образование S-силоксановых производных
2-
при 30°С до полной конверсии алкилирующего
меркаптобензотиазола. Кремнийорганические S-S-
агента
2а, b (контроль ЯМР
1Н,
13С). К реак-
дисульфоний-дикатионовые производные
2-
ционной смеси добавляли 20 мл эфира. Далее
меркаптобензотиазола образуются при взаимо-
выделение продуктов по методике а.
действии иодметилсиланов с ди(2-бензотиазолил)-
дисульфидом в присутствии элементного иода.
Иодид
2-(диметилфенил)силил(метилтио)-
1,3-бензотиазолия (3а). Выход 0.46 г (52%) (а),
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
0.12 г (13%) (б), порошок, т.пл. 205-208°С. Спектр
ЯМР 1Н (DMSO-d6), δ, м.д.: 0.54 с (6Н, CH3), 3.11 с
Спектры ЯМР 1Н, 13С, 29Si и 15N зарегистри-
(2Н, СН2S), 7.41 м (3Н, о,п-Ph), 7.59 д.д (1Н, Н6,
рованы на спектрометрах Bruker DPX-400 и Bruker
3JHH 7.7, 8.0 Гц), 7.66 м (3Н, Н5, м-Рh), 7.89 д (1Н,
AV-400 с рабочими частотами
400.13,
100.61,
Н4, 3JHH 7.9 Гц), 8.16 д (1Н, Н7, 3JHH 8.0 Гц). Спектр
161.98,
40.56 МГц соответственно, внутренний
ЯМР 13С (DMSO-d6), δ, м.д.: -3.51 (CH3), 20.51 (CH2S),
стандарт - ТМС. Двумерные спектры ЯМР {1Н-
117.78 (С4), 123.35 (м-Ph), 126.70 (С6), 128.40 (п-Ph),
15N} сняты с использованием методики HMBC-gp
128.98 (С7), 130.08 (С5), 131.30 (С8), 134.11 (о-Ph),
1H-15N. УФ спектры записаны на спектрометре
135.19 (ипсо-Ph), 144.17 (C9), 180.85 (C2). Спектр ЯМР
UV-Vis Lambda 35 в МеСN. Элементный анализ
15N (DMSO-d6), δ, м.д.: -164.6. Спектр ЯМР 29Si
выполнен на автоматическом CHNS-анализаторе
(DMSO-d6), δ, м.д.: -2.3. УФ cпектр (CH3CN), λмакс,
Thermo Scientific Flash 2000. Содержание иода
нм: 216 (I-). Найдено, %: C 42.96; H 4.05; I 26.98; N
определено меркурометрическим методом объем-
3.18; S 14.16; Si 6.12. C16H18INS2Si. Вычислено, %:
ного анализа, содержание кремния
- методом
C 43.34; H 4.09; I 28.61; N 3.16; S 14.46; Si 6.33.
сухого сожжения. Температуры плавления опре-
Трииодид
2-(диметилфенил)силил(метил-
делены на приборе Micro-Hot-Stage PolyTherm A.
тио)-1,3-бензотиазолия (4а). Выход 0.08 г (6%)
Ход реакций контролировали методами ЯМР 1Н,
(а), 0.57 г (41%) (б), темно-красное масло. Спектр
13С, 29Si, 15N и ТСХ на пластинах Silufol UV-254
ЯМР 1Н (ацетон-d6), δ, м.д.: 0.61 с (6Н, CH3), 3.24 с
(элюент
- ацетон, визуализация хроматограмм
(2Н, СН2S), 7.45 м (3Н, о,п-Ph), 7.71 д.д (3Н, Н6,
парами иода).
м-Рh), 7.81 м (1Н, Н5), 7.99 д (Н, Н7, 3JHH 8.0 Гц),
Реакция 2-меркаптобензотиазола или ди(2-
8.31 д
(1Н, Н4, 3JHH
7.9 Гц). Спектр ЯМР 13С
бензотиазолил)дисульфида с иодметилпроиз-
(ацетон-d6), δ, м.д.: -3.23 (CH3), 21.50 (CH2S),
водными силанов (общая методика). а. Раствор
115.27 (С4), 124.19 (м-Ph), 127.83 (С6), 128.82 (п-
2.00 ммоль 2-меркаптобензотиазола 1 и 2.00 ммоль
Ph), 129.92 (С5), 130.83 (С7), 134.54 (С8), 134.92 (о-
силана 2а, b в ацетоне перемешивали 20-22 ч при
Ph), 135.14 (ипсо-Ph), 141.97 (C9), 184.80 (C2).
комнатной температуре до полной конверсии алки-
Спектр ЯМР 15N (ацетон-d6), δ, м.д.: -165.7. Спектр
лирующего агента 2а, b (контроль ЯМР 1Н, 13С).
ЯМР 29Si (ацетон-d6), δ, м.д.: -2.3. УФ cпектр
Выпавший осадок продуктов
3а, b отфильтро-
(CH3CN), λмакс, нм: 291, 362 (I–). Найдено, %: C
вывали, промывали ацетоном, эфиром, высуши-
27.46; H 2.55; I 55.08; N 2.18; S 9.02; Si 3.98.
вали. К ацетоновому фильтрату добавляли 30 мл
C16H18I3NS2Si. Вычислено, %: C 27.56; H 2.60; I
эфира. Выпавшее красное масло соли 4а, b отде-
54.60; N 2.01; S 9.20; Si 4.03.
ляли, промывали эфиром, высушивали в вакууме.
Иодид
2-[(1-метил-1-силоланилметил)тио]-
б. К раствору
2.00 ммоль
2-меркаптобензо-
1,3-бензотиазолия (3b). Выход 0.41 г (51%) (а),
тиазола 1 и 2.00 ммоль силана 2а, b в ацетоне
0.06 г (7%) (б), порошок, т.пл. 225-227°С. Спектр
прибавляли порциями
2.00 ммоль элементного
ЯМР 1Н (DMSO-d6), δ, м.д.: 0.40 c (3H, CH3), 0.75 м
иода. Реакционную смесь перемешивали 6-7 ч при
(2Н, СН2S), 0.89 м (2Н, СН2Si), 1.66 м (4Н, СН2),
90°С до полной конверсии алкилирующего агента
3.12 с (2Н, СН2S), 7.67 д.д (1Н, Н6, 3JHH 7.8, 8.1 Гц),
2а, b (контроль ЯМР 1Н, 13С). К реакционной смеси
7.70 д.д (1Н, Н5, 3JHH 7.8, 8.2 Гц), 8.01 д (1Н, Н4,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
СИНТЕЗ S- И S-S-КРЕМНИЙОРГАНИЧЕСКИХ ПРОИЗВОДНЫХ 2-МЕРКАПТОБЕНЗОТИАЗОЛА
1161
3JHH 8.2 Гц), 8.30 д (1Н, Н7, 3JHH 8.1 Гц). Спектр
8.27 д
(2Н, Н7, 3JHH
8.3 Гц). Спектр ЯМР 13С
ЯМР 13С (DMSO-d6), δ, м.д.: -4.05 (CH3), 11.43
(ацетон-d6), δ, м.д. : -3.42 (CH3), 14.97 (CH2S),
(CH2Si), 20.14 (CH2S), 26.81 (CH2), 116.49 (С4),
117.20 (С4), 123.49 (м-Ph), 127.59 (С6), 128.04 (п-
123.59 (С6), 127.15 (С7), 129.53 (С5), 130.80 (С8),
Ph), 129.53 (С7), 130.39 (С5), 134.11 (С8), 134.92 (о-
141.89 (С9), 184.13 (C2). Спектр ЯМР 15N (DMSO-
Ph),
136.87 (ипсо-Ph),
143.39 (C9) 182.49 (C2).
d6), δ, м.д.: -188.6. Спектр ЯМР 29Si (DMSO-d6), δ,
Спектр ЯМР 15N (ацетон-d6), δ, м.д.: -186.9. Спектр
м.д.: 21.0. УФ cпектр (CH3CN), λмакс, нм: 214 (I-).
ЯМР 29Si (ацетон-d6), δ, м.д.: -1.5. УФ cпектр
Найдено, %: C 38.46; H 4.25; I 30.98; N 3.48; S
(CH3CN), λмакс, нм: 291, 361 (I–). Найдено, %: C
15.42; Si
6.87. C13H18INS2Si. Вычислено,
%: C
27.46; H 2.35; I 56.08; N 2.18; S 9.11; Si 4.43.
38.42; H 4.45; I 31.14; N 3.45; S 15.74; Si 6.89.
C32H34I6N2S4Si2. Вычислено, %: C 27.60; H 2.46; I
54.68; N 2.01; S 9.21; Si 4.03.
Трииодид
2-[(1-метил-1-силоланилметил)-
тио]-1,3-бензотиазолия (4b). Выход 0.22 г (17%)
Полииодид
1,2-ди(1,3-бензотиазол-2-ил)-1,2-
(а), 0.65 г (50%) (б), темно-красное масло. Спектр
бис[(1-метилсилоланил)метил]-1,2-дисульфония
ЯМР 1Н (ацетон-d6), δ, м.д.: 0.64 c (3H, CH3), 0.98 м
(7b). Выход 1.37 г (52%), темно-красное масло.
(2Н, СН2Si), 1.11 м (2Н, СН2Si), 1.96 м (4Н, СН2),
Спектр ЯМР 1Н (ацетон-d6), δ, м.д.: 0.55 c (6H,
3.09 с (2Н, СН2S), 7.74 д.д (1Н, Н6, 3JHH 7.5, 7.9 Гц),
CH3), 1.01 м (4Н, СН2Si), 1.16 м (4Н, СН2Si), 1.92 м
7.85 д.д (1Н, Н5, 3JHH 7.5, 7.7 Гц), 8.21 д (1Н, Н4,
(8Н, СН2), 2.30 с (4Н, СН2S), 7.15 м (2Н, Н6), 7.22 м
3JHH 7.7 Гц), 8.35 д (1Н, Н7, 3JHH 7.9 Гц). Спектр
(2Н, Н5), 7.70 м (2Н, Н4), 7.76 м (1Н, Н7). Спектр
ЯМР 13С (ацетон-d6), δ, м.д.: -2.78 (CH3),
11.97
ЯМР 13С (ацетон-d6), δ, м.д. : -1.26 (CH3), 7.18
(CH2Si), 17.64 (CH2S), 27.27 (CH2), 121.40 (С4),
(CH2Si), 15.41 (CH2S), 23.72 (CH2), 117.13 (С4),
122.18 (С6), 124.74 (С7), 126.89 (С5), 135.14 (С8),
123.48 (С6), 126.98 (С7), 129.32 (С5), 130.53 (С8),
153.44 (С9), 170.47 (C2). Спектр ЯМР 15N (ацетон-
143.25 (С9), 182.24 (C2). Спектр ЯМР 15N (ацетон-
d6), δ, м.д.: -184.3. Спектр ЯМР 29Si (ацетон-d6), δ,
d6), δ, м.д.: -184.9. Спектр ЯМР 29Si (ацетон-d6), δ,
м.д.: 18.5. УФ cпектр (CH3CN), λмакс, нм: 292, 361
м.д.: 6.2. УФ cпектр (CH3CN), λмакс, нм: 292, 361 (I–).
(I–). Найдено, %: C 23.56; H 2.45; I 57.49; N 2.28; S
Найдено, %: C 22.86; H 2.45; I 57.58; S 9.34; Si 4.48.
9.44; Si 4.32. C13H18I3NS2Si. Вычислено, %: C 23.61;
C26H34I6N2S4Si2. Вычислено, %: C 23.65; H 2.60; I
H 2.74; I 57.57; N 2.12; S 9.71; Si 4.25.
57.67; N 2.12; S 9.72; Si 4.25.
Дииодид 2-{[3-(1,3-бензотиазол-2-илтио)метил]-
БЛАГОДАРНОСТИ
1,1,3,3-тетраметилдисилоксанил-метил}тио-1,3-
бензотиазолия (5). Выход 0.25 г (33%), порошок,
Исследования выполнены с использованием
т.пл. 146-147°С. Спектр ЯМР 1Н (DMSO-d6), δ,
материально-технической базы Байкальского
м.д.: 0.24 c (12H, CH3), 2.66 с (4Н, СН2S), 7.31 д.д
аналитического центра коллективного пользования
(2Н, Н6, 3JHH 7.6, 8.2 Гц), 7.42 д.д (2Н, Н5, 3JHH 7.6,
СО РАН.
7.9 Гц), 7.78 д (2Н, Н4, 3JHH 7.9 Гц), 7.92 д (2Н, Н7,
3JHH 8.2 Гц), 8.32 уш.с (1Н, NH). Спектр ЯМР 13С
КОНФЛИКТ ИНТЕРЕСОВ
(DMSO-d6), δ, м.д.: 0.71 (CH3), 19.76 (CH2S), 121.44
(С4), 122.19 (С6), 124.68 (С7), 126.81 (С5), 135.20
Авторы заявляют об отсутствии конфликта
(С8), 153.49 (C9),
170.00 (C2). Спектр ЯМР 15N
интересов.
(DMSO-d6), δ, м.д.:
-170.9. Спектр ЯМР
29Si
(DMSO-d6), δ, м.д.: 5.6. УФ cпектр (CH3CN), λмакс,
СПИСОК ЛИТЕРАТУРЫ
нм: 210 (I-). Найдено, %: C 32.10; H 3.25; I 33.78; N
1. Cano N.H., Ballari M.S., López A.G., Santiago A.N.
3.58; S 16.93; Si 8.03. C20H26I2N2ОS4Si2. Вычислено,
J. Agric. Food Chem. 2015, 63, 3681. doi 10.1021/
%: C 32.08; H 3.50; I 33.90; N 3.75; S 17.13; Si 7.50.
acs.jafc.5b00150
Полииодид
1,2-ди(бензотиазол-2-ил)-1,2-бис-
2. Azam M.A., Suresh B. Sci. Pharm. 2012, 80, 789. doi
[(диметил(фенил)силил)метил]-1,2-дисульфония
10.3797/scipharm.1204-27
(7а). Выход 1.61 г (58%), темно-красное масло.
3. Wang F., Cai Sh., Wang Zh., Xi Ch. Org. Lett. 2011,
Спектр ЯМР 1Н (ацетон-d6), δ, м.д.: 0.42 c (12H, CH3),
13, 3202. doi 10.1021/ol2011105
2.29 с (4Н, СН2S), 7.35 м (6Н, о,п-Ph), 7.67 д.д (2Н,
4. Chen W., Huang Y., Gundala S.R., Yang H., Li M.,
Н6, 3JHH 7.8, 8.3 Гц), 7.70 м (4Н, м-Ph), 7.77 д.д (2Н,
Tai P.C., Wang B. Bioorg. Med. Chem. 2010, 18, 1617.
Н5, 3JHH 7.8, 8.3 Гц), 7.97 д (2Н, Н4, 3JHH 8.3 Гц),
doi 10.1016/j.bmc.2009.12.074
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
1162
ЯРОШ и др.
5. Jiang L.-L., Tan Y., Zhu X.-L., Wang Z.-F., Zuo Y.,
19. Zhilitskaya L.V., Yarosh N.O., Shagun L.G., Dorofeev I.A.,
Chen Q., Xi Z., Yang G.-F. J. Agric. Food Chem. 2010,
Larina L.I. Mendeleev Commun. 2017, 27, 352. doi
58, 2643. doi 10.1021/ jf9026298
10.1016/j.mencom.2017.07.010
6. Cressier D., Prouillac C., Hernander P. Bioorg. Med.
20. Uhlig W. J. Organomet. Chem. 1993, 452, 29. doi
Chem. 2009, 7, 5275. doi 10.1016/j.bmc.2009.05.039
10.1016/0022-328X(93)83168-U
7. Franchini C., Muraglia M., Corbo F., Florio M.A.,
21. Воронков М.Г., Милешкевич В.П., Южелевский Ю.А.
Mola A.D., Rosato A., Matucci R., Nesi M., Bambeke F.,
Силоксановая связь. Ред. М.Г. Воронков.
Vitali C. Arch. Pharm. Chem. Life Sci. 2009, 342, 605.
Новосибирск: Наука, 1976, с. 89.
doi 10.1002/ardp.200900092
22. Жилицкая Л.В., Ярош Н.O., Шагун Л.Г., Дорофеев И.A.,
8. Huang W., Yang G.F. Bioorg. Med. Chem. 2006, 14,
Ларина Л.И. ХГС. 2015, 51, 381. doi 10.1007/s10593-
8280. doi 10.1016/j.bmc.2006.09.016
015-1711-8
9. Стрелец Л.Н., Красовский A.Н., Грин В.A., Самура Б.A.,
23. Ярош Н.O., Жилицкая Л.В., Шагун Л.Г.,
Дорофеев И.A., Ларина Л.И. ЖОрХ. 2017, 53, 1053.
Линенко В.И, Звягинцев Ю.Г., Стеблюк П.Н.,
Сорока И.И., Жила Н.И. Хим.-фарм. ж. 1984, 18,
[Yarosh N.O., Zhilitskaya L.V., Shagun L.G.,
Dorofeev I.A., Larina L.I. Russ. J. Org. Chem. 2017, 53,
946. doi 10.1007/BF00779274
1066.] doi 10.1134/S107042801707017X
10. Holbova E., Sidoova E., Zemanova M., Drobnicova I.
24. Al-Mohammed N.N., Hussen R.S.D., Alias Y.,
Chem. Papers.
1990,
44,
363. doi
10.1002/
Abdullah Z. RSC Adv. 2015, 5, 2869. doi 10.1039/
chin.199119162
C4RA14027C
11. Ramadas K., Janarthanan N., Synth Commun. 1999, 29,
25. Myles L., Gore R.G., Gathergood N., Connon S.J.
1003. doi 10.1080/00397919908086063
Green Chem. 2013, 15, 2740. doi: 10.1039/c3gc40975a
12. Lee J.H., Kim J.D. Bull. Korean Chem. Soc. 1997, 18,
26. Ненайденко В.Г., Шевченко Н.Е., Баленкова Е.С.
442.
ЖОрХ. 1999, 35, 275. [Nenajdenko V.G., Shevchenko N.E.,
13. Воронков М.Г., Чернов Н.Ф., Трофимова О.М.,
Balenkova E.S. Russ. J. Org. Chem. 1999, 35, 256.]
Аксаментова Т.Н. Изв. АН. Сер. Хим., 1993, 1965.
27. Nenajdenko V.G., Shevchenko N.E., Balenkova E.S.
14. Zdrahala R.J., Zdrahala I.J. J. Biomater. Appl. 1999, 14,
J. Org. Chem. 1998, 63, 2168. doi 10.1021/jo971801w
67. doi 10.1177/0885322829901400104
28. Nenajdenko V.G., Shevchenko N.E., Balenkova E.S.
15. Bernacca G.M., Straub I., Wheatley D.J. J. Biomat.
Tetrahedron. 1998, 54, 5353. doi 10.1016/S0040-4020
Mater. Res. 2002, 61, 138. doi 10.1002/jbm.10149
(98)00210-5
16. Hyde J.A.J., Chinn J.A., Philips R.E. J. Heart Valve
29. Jouikov V., Fattahova D. Electrochim. Acta. 1998, 43,
Dis. 1999, 8, 331.
1811. doi S0013-4686(97)00299-5
17. Воронков М.Г., Зелчан Г.И., Лукевиц Э.Я. Кремний
30. Reiller P., Mercier-Bion F., Gimenez N., Barre N.,
и жизнь. Рига: Зинатне. 1978, 588.
Miserque F. Radiochim. Acta. 2006, 94, 739. doi:
18. Hufnagel C.A. Med. Instrum. 1977, 11, 74.
10.1524/ract.2006.94.9.739
Synthesis of S- and S-S-Organosilicon Derivatives
of 2-Mercaptobenzothiazole
N. O. Yarosh*, L. V. Zhilitskaya, L. G. Shagun, I. A. Dorofeev, and L. I. Larina
Favorskii Irkutsk Institute of Chemistry, Siberian Branch, Russian Academy of Sciences,
ul. Favorskogo 1, Irkutsk, 664033 Russia
*e-mail: yarosh.nina@irioch.irk.ru
Received November 1, 2018; revised May 13, 2019; accepted May 15, 2019
The reaction of 2-mercaptobenzothiazole and di(2-benzothiazolyl)disulfide with iodomethylsilanes, bearing
exocyclic and endocyclic silicon atoms, occurs in the presence of molecular iodine to afford organosilicon
iodides and polyiodides of benzothiazolium and disulfonium.
Keywords:
2-mercaptobenzothiazole, di(2-benzimidazolyl)disulfide, iodomethyl(dimethyl)phenylsilane,
1-
(iodomethyl)-1-methylsilolane disulfonium-dications, polyodides, alkylation
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019