ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 8, с. 1188-1192
УДК 547.8
ГЕКСАГИДРОГЕКСААЗАГЕПТАЛЕНОБИС[1,10-ab]-
ФЕНАЛЕНЫ - НОВЫЙ ТИП АЗАПОЛИЦИКЛОВ
© 2019 г. Е. Б. Рахимова*, В. Ю. Кирсанов, А. Г. Ибрагимов, У. М. Джемилев
Институт нефтехимии и катализа - обособленное структурное подразделение Федерального государственного
бюджетного научного учреждения Уфимского федерального исследовательского центра РАН (ИНК УФИЦ РАН)
450075, Россия, Республика Башкортостан, г. Уфа, пр. Октября 141
*е-mail: rakhimovaelena@mail.ru
Поступила в редакцию 18 февраля 2019 г.
После доработки 26 марта 2019 г.
Принята к публикации 12 апреля 2019 г.
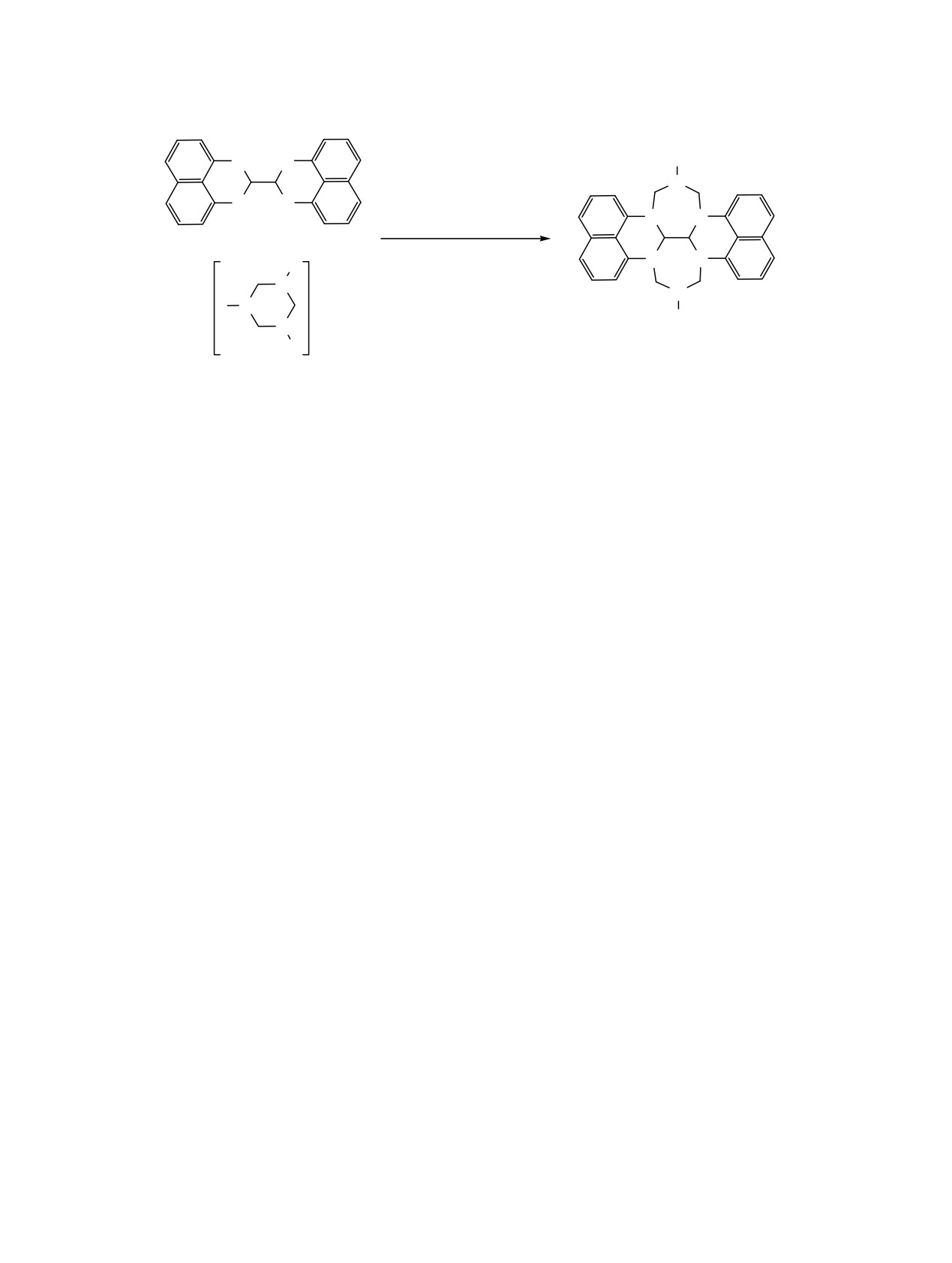
Впервые предложен метод синтеза 8,17-дизамещенных 8,9,15c,15d,17,18-гексагидро-6b,8,9a,15b,17,18a-
гексаазагепталенобис[1,10-ab]феналенов - представителей новых азаполициклов - реакцией 2,2',3,3'-
тетрагидро-1H,1'H-2,2'-биперимидина с 1,3,5-трициклоалкил-1,3,5-триазинанами с участием в качестве
катализатора NiCl2·6H2O.
Ключевые слова: катализ, гетероциклизация, 1,3,5-триазинаны, перимидины, феналены.
DOI: 10.1134/S051474921908007X
В мировой литературе описаны методы синтеза
15%. Для повышения выхода целевого гетероцикла
три- и тетраазациклопента[c,d]феналенов [1-3], в
2 реакцию 1,3,5-трициклопропил-1,3,5-триазинана
том числе их серосодержащих аналогов [4, 5].
с
2,2',3,3'-тетрагидро-1H,1'H-2,2'-биперимидином
Согласно [1], синтез 1H-1,5,7-триазациклопента[c,d]-
осуществили в присутствии хлорида никеля, как
феналенов осуществляют реакцией ацетилпери-
наиболее активного катализатора в подобных
мидинов с 1,3,5-триазинами в присутствии азида
реакциях рециклизации [10-12]. Под действием
натрия в полифосфорной кислоте. Подобные
5 мол. % NiCl2·6H2O гетероциклизация 1,3,5-три-
полициклические соединения, в том числе
циклопропил-1,3,5-триазинана с 2,2',3,3'-тетрагидро-
производные перимидина, представляют интерес в
1H,1'H-2,2'-биперимидином в среде MeOH про-
качестве соединений с широким спектром
ходит с образованием
8,17-дициклопропил-
биологической активности [6], а также могут найти
8,9,15c,15d,17,18-гексагидро-6b,8,9a,15b,17,18a-
применение в качестве фотохимических зондов [7]
гексаазагепталенобис[1,10-ab]феналена (2) с выхо-
и быть использованы в нанотехнологии [8].
дом 58%. Повышение концентрации катализатора
до 10 мол. % NiCl2·6H2O не приводит к существен-
В продолжение проводимых нами исследований
ному увеличению выхода целевого гетероцикла.
[9-13] в области синтеза аннелированных полиаза-
Выбор MeOH в качестве растворителя обусловлен
полициклов, а также с целью разработки эффек-
хорошей растворимостью в последнем исходных
тивного способа получения дизамещенных гекса-
реагентов. Аналогичные результаты мы получили
гидрогексаазагепталенобис[1,10-ab]феналенов, мы
при замене циклопропильных остатков у атомов
изучили реакцию гетероциклизации 2,2',3,3'-тетра-
азота в молекуле
1,3,5-триазинана на другие
гидро-1H,1'H-2,2'-биперимидина с 1,3,5-тризамещен-
циклоалкильные заместители (R = циклопентил,
ными 1,3,5-триазинанами, используемых нами в
циклогексил, циклогептил, циклооктил). Следует
качестве эффективных циклоаминометилирующих
отметить, что 1,3,5-трициклоалкил-1,3,5-триазина-
реагентов [14-17]. Предварительными эксперимен-
ны были получены in situ [10] и далее вовлечены в
тами установили, что некаталитическое взаимо-
реакцию гетероциклизации без предварительного
действие 1,3,5-трициклопропил-1,3,5-триазинана с
выделения с целью более эффективного синтеза
гидрированным бис-перимидином 1 [18] при 20°С
целевых гексагидрогексаазагепталенобис[1,10-ab]-
приводит к образованию гексагидрогексаазагепта-
феналенов. В разработанных условиях (5 мол. %
ленобис[1,10-ab]феналена 2 с выходом не более
NiCl2·6Н2О, 20°С, 3 ч, растворитель MeOH) гетеро-
1188
ГЕКСАГИДРОГЕКСААЗАГЕПТАЛЕНОБИС[1,10-ab]-ФЕНАЛЕНЫ
1189
Схема 1.
NH HN
R
N
9
10
11
5
6
7
8
NH
HN
9b
5 мол. % NiCl2 . 6H2O
4
6a
9a
N6b N
12
MeOH, 20oC, 3 ч
1
3a
3b
15d
15c
12b
12a
18b
+
15a
3
N N
13
R
18a
15b
17
N
2
1
18
16
15
14
N
R
N
R
N
R
in situ
R = цикло-C3H5 (2, 58%), цикло-C5H9 (3, 56%), цикло-C6H11 (4, 63%), цикло-C7H13 (5, 47%), цикло-C8H15 (6, 52%).
циклизация 2,2',3,3'-тетрагидро-1H,1'H-2,2'-бипери-
Полученные экспериментальные результаты
мидина с 1,3,5-трициклоалкил-1,3,5-триазинанами
[10-12] и литературные данные [22, 23] позволили
проходит с селективным образованием
8,17-
предположить, что каталитический цикл реакции
дициклоалкил-8,9,15c,15d,17,18-гексагидро-
между бис-перимидином 1 и 1,3,5-трициклоалкил-
6b,8,9a,15b,17,18a-гексаазагепталенобис[1,10-ab]-
1,3,5-триазинаном включает стадию координации
феналенов 3-6 с выходами 47-63% (схема
1).
гетероатома с ионом центрального атома катали-
Гидрированный бис-перимидин является перспек-
затора [24], что способствует сдвигу электронной
тивным строительным блоком для конструиро-
плотности от гетероатома к иону металла и
вания сложных молекулярных структур с уникаль-
приводит к образованию карбокатионов. После-
ными физико-химическими свойствами. Синтези-
дующее нуклеофильное присоединение вторичного
рованные с помощью тетрагидробиперимидина поли-
атома азота
2,2',3,3'-тетрагидро-1H,1'H-2,2'-
азаполициклы содержат в себе гетероциклическое
биперимидина к иону иминия, образующегося в
ядро и два фрагмента нафталена. Высокая основ-
условиях реакции, приводит к гетероциклизации с
ность [19, 20], носителем которой в гетероциклах
получением гексагидрогексаазагепталенобис[1,10-
служат атомы азота, может оказать значительное
ab]феналенов.
влияние на комплексообразующую способность
Таким образом, нами впервые показано, что
[21] подобных молекулярных ансамблей.
катализируемая NiCl2·6H2O гетероциклизация
В спектрах ЯМР 1Н соединений 2-6 характе-
2,2',3,3'-тетрагидро-1H,1'H-2,2'-биперимидина с
ристичными являются два уширенных синглета в
1,3,5-трициклоалкил-1,3,5-триазинанами является
области 3.95-4.06 и 4.44-4.70 м.д., относящихся к
эффективным методом синтеза ранее неописанных
протонам углеродных атомов, расположенных между
8,17-дициклоалкил-8,9,15c,15d,17,18-гексагидро-
атомами азота в положениях H15c,15d и H7,9,16,18
6b,8,9a,15b,17,18a-гексаазагепталенобис[1,10-ab]-
соответственно. Для соединений 2-6 в спектрах
феналенов, представляющих новый тип азапо-
ЯМР 13С характерно наличие двух сигналов в
лициклов.
области 48.7-51.8 и 64.3-68.3 м.д., принадлежащих
углеродным атомам гексаазаполициклического
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
каркаса в положениях С15c,15d и С7,9,16,18. Отнесение
сигналов проведено на основа-нии двумерных
Одномерные спектры ЯМР 1Н и 13С, а также
гомо- (COSY) и гетероядерных (HSQC, HMBC)
двумерные гомо- (COSY) и гетероядерные (HSQC,
экспериментов ЯМР. Предложен-ные структуры
HMBC) спектры регистрировали на спектрометре
соединений
2-6 подтверждаются регистрацией
Bruker Avance 500 [500.17 (1Н), 125.78 (13C) МГц] в
молекулярных пиков в масс-спектрах положитель-
CDCl3 по стандартным методикам фирмы Bruker,
ных ионов, полученных ионизацией с помощью
внутренний стандарт ТМС. Mасс-спектры MALDI
лазерной десорбции из матрицы, с регистрацией их
TOF/TOF положительных ионов (матрица
-
времени пролёта в отражательном режиме (MALDI
синапиновая кислота) записаны на масс-спектро-
TOF/TOF, разрешение 0.001 а.е.).
метре Bruker АutoflexTM III Smartbeam. Подготовку
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
1190
РАХИМОВА и др.
проб для регистрации масс-спектров проводили по
спектр, см-1: 2952, 1583, 1209, 1148, 803, 750. Спектр
методике «сухая капля»: в отдельной пробирке
ЯМР 1H (CDCl3), δ, м.д. (J, Гц): 1.48-1.62 м (8H, CH2,
смешивали растворы матричного и анализируемого
H2′,2′′,3′,3′′,4′,4′′,5′,5′′), 1.72-1.82 м (4H, CH2, H3′,3′′,4′,4′′),
веществ (50:1-100:1), после этого каплю раствора
1.91-1.99 м (4H, CH2, H2′,2′′,5′,5′′), 3.03-3.09 м (2H,
наносили на мишень и высушивали потоком
CH, H1′,1′′), 4.01 уш.с (2H, CH, H15c,15d), 4.55 уш.с
теплого воздуха. Пробу с мишени переводили в
(8H, CH2, H7,9,16,18), 6.80 д (4H, CH, H2,5,11,14, 3J 7.2),
газовую фазу с помощью лазерных импульсов
6.87 д (4H, CH, H1,6,10,15, 3J 8.4,), 7.08 д (4H, CH,
(200 импульсов с частотой 100 Гц). В качестве
H3,4,12,13, 3J 8.4). Спектр ЯМР 13С (CDCl3), δ, м.д.:
источника лазерного излучения применяли твердо-
23.8 (C3′,3′′,4′,4′′), 31.3 (C2′,2′′,5′,5′′), 51.1 (C15с,15d),
59.7
тельный УФ лазер с длиной волны излучения
(C1′,1′′),
66.3 (C7,9,16,18),
114.5 (C2,5,11,14),
119.3
355 нм. ИК спектры снимали на спектрометре
(C3,4,12,13),
122.0 (C3b,12b),
126.2 (C1,6,10,15),
132.7
Bruker Vertex 70V в суспензии в вазелиновом
(C6a,9b,15a,18b), 134.1 (C3a,12a). Масс-спектр, m/z (Iотн,
масле. Элементный анализ образцов проводили на
%): 555 [M - H]+ (100). Найдено, %: С 77.53; H
анализаторе фирмы Сarlo Erba 1106. Использован-
7.19; N 15.02. C36H40N6. Вычислено, %: С 77.66; H
ные в работе реактивы приобрели в компаниях
7.24; N 15.10.
Sigma-Aldrich и Acros Organics.
8,17-Дициклогексил-8,9,15c,15d,17,18-гекса-
Гетероциклизация бис-перимидина с
1,3,5-
гидро-6b,8,9a,15b,17,18a-гексаазагепталенобис-
трициклоалкил-1,3,5-триазинанами (общая
[1,10-ab]фенален
(4). Выход 0.37 г (63%). ИК
методика). В круглодонную колбу, установленную
спектр, см-1: 2924, 1586, 1267, 1197, 805,
749.
Спектр ЯМР 1H (CDCl3), δ, м.д. (J, Гц): 1.17-1.28 м
на магнитной мешалке, при комнатной темпера-
туре ~20°С помещали 0.34 г (1 ммоль) 2,2',3,3'-
(10H, CH2, H2′,2′′,3′,3′′,4′,4′′,5′,5′′,6′,6′′),
1.58-1.65 м (2H,
тетрагидро-1H,1'H-2,2'-биперимидина в
10 мл
CH2, H4′,4′′), 1.75-1.82 м (4H, CH2, H3′,3′′,5′,5′′), 1.91-
1.98 м (4H, CH2, H2′,2′′,6′,6′′), 2.58-2.65 м (2H, CH,
MeOH, полученного по известной методике [18],
0.012 г (0.05 ммоль) NiCl2·6H2O и 2.00 ммоль соот-
H1′,1′′), 4.03 уш.с (2H, CH, H15c,15d), 4.57 уш.с (8H,
ветствующего
1,3,5-трициклоалкил-1,3,5-триазина
CH2, H7,9,16,18), 6.77 д (4H, CH, H2,5,11,14, 3J 7.5), 6.86
в 10 мл MeOH, полученного in situ [10]. Реак-
д (4H, CH, H1,6,10,15, 3J 8.5), 7.03 д (4H, CH, H3,4,12,13,
ционную смесь перемешивали в течение
3 ч.
3J
8.5). Спектр ЯМР 13С (CDCl3), δ, м.д.:
25.2
Образующиеся осадки отфильтровывали, дважды
(C3′,3′′,5′,5′′), 25.7 (C4′,4′′), 30.9 (C2′,2′′,6′,6′′), 48.7 (C15с,15d),
промывали метанолом
(2×10 мл) и получали
57.5 (C1′,1′′), 64.3 (C7,9,16,18), 114.6 (C2,5,11,14),
118.9
индивидуальные соединения 2-6, представляющие
(C3,4,12,13),
122.3 (C3b,12b),
126.0 (C1,6,10,15),
133.0
собой темно-коричневые тугоплавкие (т.пл. > 350°C)
(C6a,9b,15a,18b), 134.1 (C3a,12a). Масс-спектр, m/z (Iотн,
порошкообразные вещества.
%): 583 [M - H]+ (100). Найдено, %: С 77.95; H
7.51; N 14.30. C38H44N6. Вычислено, %: С 78.05; H
8,17-Дициклопропил-8,9,15c,15d,17,18-гекса-
7.58; N 14.37.
гидро-6b,8,9a,15b,17,18a-гексаазагепталенобис-
8,17-Дициклогептил-8,9,15c,15d,17,18-гекса-
[1,10-ab]фенален (2). Выход 0.29 г (58%). ИК спектр,
гидро-6b,8,9a,15b,17,18a-гексаазагепталенобис-
см-1: 2923, 1582, 1149, 804, 754. Спектр ЯМР 1H
[1,10-ab]фенален
(5). Выход 0.29 г (47%). ИК
(CDCl3), δ, м.д.: 0.64 уш.с (8H, CH2, H2′,2′′,3′,3′′), 2.21-
спектр, см-1: 2924, 1584, 1266, 1190, 806,
753.
2.28 м (2H, CH, H1′,1′′), 4.06 уш.с (2H, CH, H15c,15d),
Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.40-1.47 м (4H,
4.70 уш.с (8H, CH2, H7,9,16,18), 6.92-6.99 м (8H, CH,
CH2, H3′,3′′,6′,6′′),
1.51-1.59 м (8H, CH2, H4′,4′′,5′,5′′),
H1,2,5,6,10,11,14,15),
7.18-7.25 м
(4H, CH, H3,4,12,13).
1.62-1.75 м (8H, CH2, H2′,2′′,7′,7′′, Hb3′,3′′,6′,6′′), 1.79-1.88
Спектр ЯМР 13С (CDCl3), δ, м.д.: 7.2 (C2′,2′′,3′,3′′), 33.2
м (4H, CH2, H2′,2′′,7′,7′′), 2.87-2.95 м (2H, CH, H1′,1′′),
(C1′,1′′), 51.8 (C15с,15d), 68.3 (C7,9,16,18), 113.1 (C2,5,11,14),
3.95 уш.с (2H, CH, H15c,15d), 4.44 уш.с (8H, CH2,
121.0 (C3,4,12,13), 122.0 (C3b,12b), 126.5 (C1,6,10,15), 130.9
H7,9,16,18), 6.46-6.52 м (4H, CH, H2,5,11,14), 6.76-6.87 м
(C6a,9b,15a,18b), 133.9 (C3a,12a). Масс-спектр, m/z (Iотн,
(4H, CH, H1,6,10,15), 7.05-7.12 м (4H, CH, H3,4,12,13).
%): 499 (100) [M - H]+. Найдено, %: С 76.68; H
Спектр ЯМР 13С (CDCl3), δ, м.д.: 24.6 (C3′,3′′,6′,6′′),
6.36; N 16.71. C32H32N6. Вычислено, %: С 76.77; H
28.0 (C4′,4′′,5′,5′′), 31.6 (C2′,2′′,7′,7′′), 48.8 (C15с,15d),
60.5
6.44; N 16.79.
(C1′,1′′),
65.0 (C7,9,16,18),
114.0 (C2,5,11,14),
119.4
8,17-Дициклопентил-8,9,15c,15d,17,18-гекса-
(C3,4,12,13),
122.2 (C3b,12b),
126.0 (C1,6,10,15),
132.2
гидро-6b,8,9a,15b,17,18a-гексаазагепталенобис-
(C6a,9b,15a,18b), 133.9 (C3a,12a). Масс-спектр, m/z (Iотн,
[1,10-ab]фенален
(3). Выход 0.31 г (56%). ИК
%): 611 [M - H]+ (100). Найдено, %: С 78.30; H
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
ГЕКСАГИДРОГЕКСААЗАГЕПТАЛЕНОБИС[1,10-ab]-ФЕНАЛЕНЫ
1191
7.81; N 13.64. C40H48N6. Вычислено, %: С 78.39; H
Lyakhovnenko A.S., Spicin A.N., Aksenova I.V. Chem.
7.89; N 13.72.
Heterocycl. Compd. 2011, 47, 1180.] doi 10.1007/
s10593-011-0891-0
8,17-Дициклооктил-8,9,15c,15d,17,18-гекса-
3. Щербаков С.В., Лобач Д.А., Рубин М., Аксенов А.В.
гидро-6b,8,9a,15b,17,18a-гексаазагепталенобис-
ХГС. 2014, 50, 821. [Shcherbakov S.V., Lobach D.A.,
[1,10-ab]фенален
(6). Выход 0.33 г (52%). ИК
Rubin M., Aksenov A.V. Chem. Heterocycl. Compd.
спектр, см-1: 2924, 1584, 1266, 1152, 802,
753.
2014, 50, 757.] doi 10.1007/s10593-014-1531-2
Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.41-1.52 м (10H,
4. Аксенов А.В., Щербаков С.В., Лобач Д.А.,
CH2, H3′,3′′,4′,4′′,5′,5′′,6′,6′′,7′,7′′),
1.54-1.68 м (10H, CH2,
Летичевская Н.Н., Васильева Е.А. ХГС. 2014, 50,
H2′,2′′,8′,8′′,
Hb3′,3′′,5′,5′′,7′,7′′),
1.75-1.89 м
(8H, CH2,
737. [Aksenov A.V., Shcherbakov S.V., Lobach D.A.,
H2′,2′′,4′,4′′,6′,6′′,8′,8′′), 2.92 уш.с (2H, CH, H1′,1′′), 3.97 уш.с
Letichevskaya N.N., Vasil’eva E.A. Chem. Heterocycl.
Compd. 2014, 50, 677.] doi 10.1007/s10593-014-1520-5
(2H, CH, H15c,15d), 4.49 уш.с (8H, CH2, H7,9,16,18), 6.77
уш.с (4H, CH, H2,5,11,14), 6.87 уш.с (4H, CH, H1,6,10,15),
5. Щербаков С.В., Лобач Д.А., Аксенов А.В. ХГС.
2014,
50,
327.
[Shcherbakov S.V., Lobach D.A.,
7.05-7.11 м (4H, CH, H3,4,12,13). Спектр ЯМР 13С
Aksenov A.V. Chem. Heterocycl. Compd. 2014, 50,
(CDCl3), δ, м.д.: 24.3 (C4′,4′′,6′,6′′), 25.9 (C5′,5′′),
27.1
300.] doi 10.1007/s10593-014-1476-5
(C3′,3′′,7′,7′′), 29.5 (C2′,2′′,8′,8′′), 49.0 (C15с,15d), 58.4 (C1′,1′′),
6. Пожарский А.Ф., Дальниковская В.В. Усп. хим.
64.6 (C7,9,16,18), 114.8 (C2,5,11,14), 118.7 (C3,4,12,13), 122.4
1981, 50, 1559. [Pozharskii A.F., Dal’nikovskaya V.V.
(C3b,12b), 125.9 (C1,6,10,15), 133.1 (C6a,9b,15a,18b),
134.1
Russ. Chem. Rev.
1981,
50,
816.] doi
10.1070/
(C3a,12a). Масс-спектр, m/z (Iотн, %): 680 [M + К]+
RC1981v050n09ABEH002688
(100). Найдено, %: С 78.61; H 8.10; N 13.04.
7. Stafforst T., Stadler J.M. Angew. Chem., Int. Ed. 2013,
C42H52N6. Вычислено, %: С 78.71; H 8.18; N 13.11.
52, 12448. doi 10.1002/anie.201306150
8. Vostrowsky O., Hirsch A. Chem. Rev. 2006, 106, 5191.
БЛАГОДАРНОСТИ
doi 10.1021/cr050561e
9. Rakhimova E.B., Ismagilov R.A., Meshcheryakova E.S.,
Структурные исследования соединений проведе-
Khalilov L.M., Ibragimov A.G., Dzhemilev U.M.
ны в Центре коллективного пользования «Агидель»
Tetrahedron Lett.
2014,
55,
6367. doi
10.1016/
при ИНК УФИЦ РАН.
j.tetlet.2014.09.122
10. Rakhimova E.B., Kirsanov V.Yu., Zainullin R.A.,
ФОНДОВАЯ ПОДДЕРЖКА
Ibragimov A.G., Dzhemilev U.M. Hindawi J Chem.
2016, Article ID 8406172. doi 10.1155/2016/8406172
Работа выполнена в соответствии с планами
11. Rakhimova E.B., Kirsanov V.Yu., Meshcheryakova E.S.,
научно-исследовательских работ ИНК УФИЦ РАН
Khalilov L.M., Kutepov B.I., Ibragimov A.G.,
по теме «Металлокомплексный и гетерогенный
Dzhemilev U.M. Tetrahedron. 2017, 73, 6880. doi
катализ в конструировании макрогетероциклов и
10.1016/j.tet.2017.10.048
гетероатомных соединений» № Гос. Регистрации
12. Rakhimova E.B., Kirsanov V.Yu., Meshcheryakova E.S.,
AAAA-A19-119022290010-9 (2019-2021), а также
Khalilov L.M., Ibragimov A.G., Dzhemilev U.M.
при финансовой поддержке Российского фонда
Synlett. 2018, 29, 1861. doi 10.1055/s-0037-1610201
фундаментальных исследований (грант № 18-33-
13. Рахимова Е.Б., Кирсанов В.Ю., Ибрагимов А.Г.,
00528-мол_а) и Стипендии Президента РФ моло-
Джемилев У.М. ЖОрХ. 2018, 54, 1078. [Rakhimova E.B.,
дым ученым и аспирантам (СП-197.2019.4).
Kirsanov V.Yu., Ibragimov A.G., Dzhemilev U.M.
Russ. J. Org. Chem. 2018, 54, 1085.] doi 10.1134/
S1070428018070199
КОНФЛИКТ ИНТЕРЕСОВ
14. Ji D., Sun J. Org. Lett. 2018, 20, 2745. doi 10.1021/
Авторы заявляют об отсутствии конфликта
acs.orglett.8b00951
интересов.
15. Zhu C., Xu G., Sun J. Angew. Chem., Int. Ed. 2016, 55,
11867. doi 10.1002/anie.201606139
СПИСОК ЛИТЕРАТУРЫ
16. Peng S., Cao S., Sun J. Org. Lett. 2017, 19, 524. doi
10.1021/acs.orglett.6b03691
1. Aksenov A.V., Lyakhovnenko A.S., Andrienko A.V.,
17. Garve L.K.B., Jones P.G., Werz D.B. Angew. Chem.,
Levina I.I. Tetrahedron Lett. 2010, 51, 2406. doi
Int. Ed. 2017, 56, 9226. doi 10.1002/anie.201704619
10.1016/j.tetlet.2010.02.129
18. Пожарский А.Ф., Старщиков Н.М. ХГС. 1978, 14,
2. Аксенов А.В., Ляховненко А.С., Спицын А.Н.,
1418. [Pozharskii A.F., Starshikov N.M. Chem. Heterocycl.
Аксенова И.В. ХГС. 2011, 47, 1429. [Aksenov A.V.,
Compd. 1978, 14, 1156.] doi 10.1007/BF00469962
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
1192
РАХИМОВА и др.
19. Пожарский А.Ф. Усп. хим.
1998,
67,
3.
22. Мокров Г.В., Лихошерстов А.М., Лезина В.П.,
[Pozharskii A.F. Russ. Chem. Rev. 1998, 67, 1.] doi
Гудашева Т.А., Бушмаринов И.С., Антипин М.Ю.
10.1070/RC1998v067n01ABEH000377
Изв. АН Сер. Хим. 2010, 59, 1228. [Mokrov G.V.,
20. Пожарский А.Ф., Озерянский В.А., Филатова Е.А.
Likhosherstov A.M., Lezina V.P., Gudasheva T.A.,
ХГС. 2012, 48, 208. [Pozharskii A.F., Ozeryanskii V.A.,
Bushmarinov I.S., Antipin M.Yu. Russ. Chem. Bull., Int.
Filatova E.A. Chem. Heterocycl. Compd. 2012, 48,
Ed. 2010, 59, 1254.] doi 10.1007/s11172-010-0230-0
200.] doi 10.1007/s10593-012-0983-5
23. Krohn K., Cludius-Brandt S. Synthesis. 2010, 8, 1344.
21. Пуховская С.Г., Иванова Ю.Б., Семейкин А.С.,
doi 10.1055/s-0029-1218658
Голубчиков О.А. Макрогетероциклы. 2018, 11, 73.
24. Кукушкин Ю.Н. Реакционная способность коорди-
doi 10.6060/mhc180167p
национных соединений. Л.: Химия, 1987, 288 с.
Hexahydrohexaazaheptalenobis[1,10-ab]phenalenes - A New Type
of Azapolycycles
E. B. Rakhimova*, V. Yu. Kirsanov, A. G. Ibragimov, and U. M. Dzhemilev
Institute of Petrochemistry and Catalysis of Russian Academy of Sciences,
450075 Russia, Republic Bashkortostan, Ufa, pr. Oktyabrya 141
*e-mail: rakhimovaelena@mail.ru
Received February 18, 2019; revised March 26, 2019; accepted April 12, 2019
A method has been developed for the first synthesis of 8,17-disubstituted 8,9,15c,15d,17,18-hexahydro-
6b,8,9a,15b,17,18a-hexaazaheptalenobis[1,10-ab]phenalenes by the reaction of 2,2',3,3'-tetrahydro-1H,1'H-2,2'-
biperimidine with 1,3,5-tricycloalkyl-1,3,5-triazinanes in the presence of NiCl2·6H2O as a catalyst.
Keywords: catalysis, heterocyclization, 1,3,5-triazinanes, perimidines, phenalenes
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019