ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 8, с. 1215-1222
УДК 547.61 + 547.333.4 + 547.712.2 + 547.61
СИНТЕЗ БРОМИДОВ 6-БРОМ-3а,4-ДИГИДРОБЕНЗО[f]-
ИЗОИНДОЛИНИЯ И ИХ ВОДНО-ЩЕЛОЧНОЕ
РАСЩЕПЛЕНИЕ
© 2019 г. Э. О. Чухаджян, Л. В. Айрапетян*, А. С. Мкртчян, Э. О. Чухаджян, Г. А. Паносян
Институт органической химии научно-технологического центра органической и фармацевтической химии НАН
Республики Армения, 0014, Армения, г. Ереван, пр. Азатутян 26
*е-mail: shhl@mail.ru
Поступила в редакцию 15 марта 2018 г.
После доработки 10 мая 2019 г.
Принята к публикации 15 мая 2019 г.
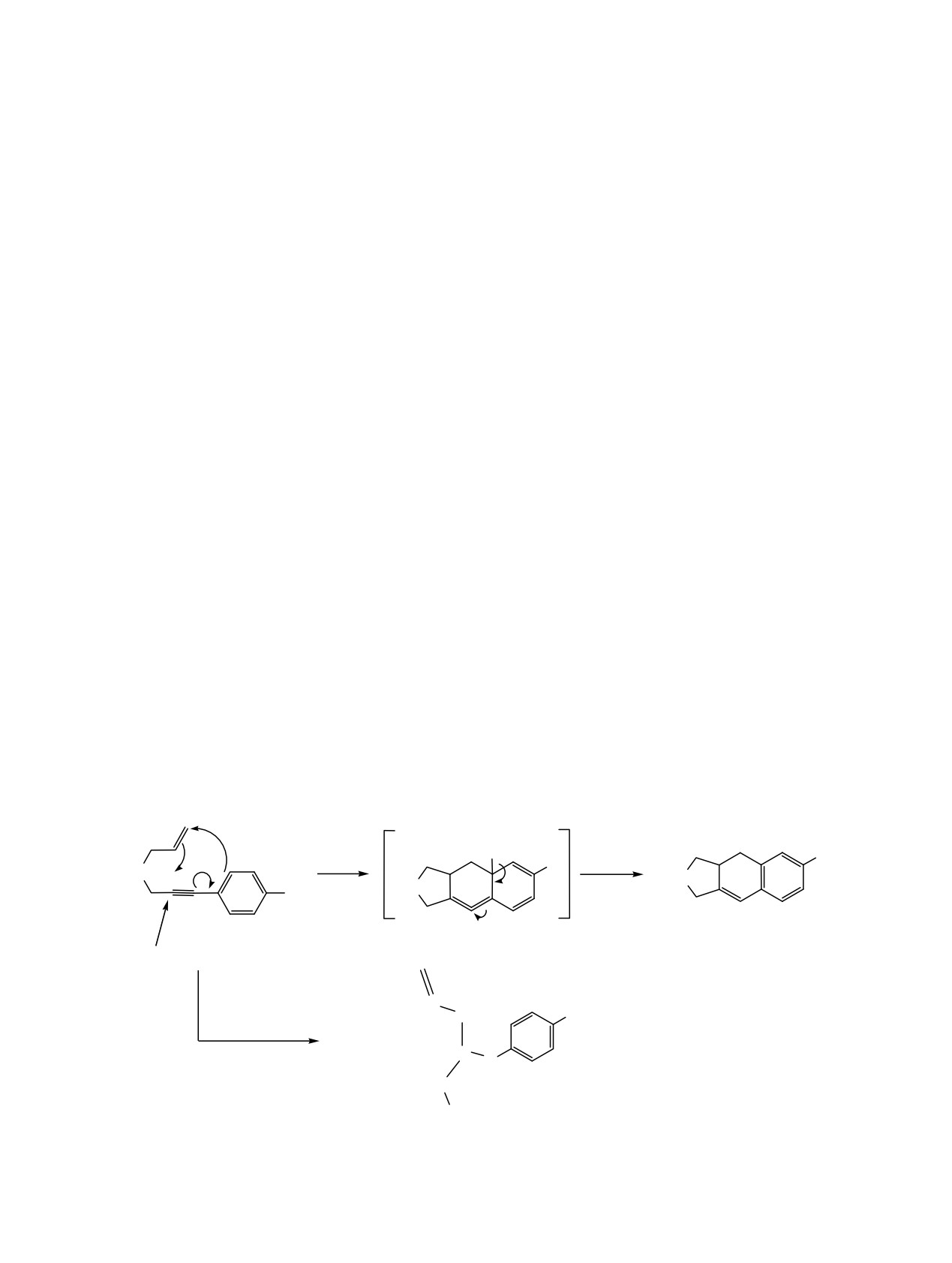
Циклизация бромидов аллил[3-(4-бромфенил)проп-2-инил]аммония в условиях основного катализа, в
отличие от пропаргильных аналогов, реализуется при нагревании реакционной смеси 90-92°C, в этих
условиях наряду с циклизацией, которая является основным направлением, имеет место также
перегруппировка-расщепление с образованием
1-аллил-п-бромкоричного альдегида. В ходе
исследования выявлено благоприятное действие заместителей, находящихся у атома азота и брома в 4-ом
положении ароматического кольца, на циклизацию и перегруппировку-расщепление.
Ключевые слова: 1-аллил-п-бромкоричный альдегид, бромиды аллил[3-(4-бромфенил)проп-2-инил]-
аммония, бромиды 6-бром-3а,4-дигидробензо[f]изоиндолиния, водно-щелочное расщепление, изомерные
2-диалкиламинометил-3-метил-,
3-диалкиламинометил-2-метил-7-бромнафталины, катализируемая
основанием внутримолекулярная циклизация, перегруппировка-расщепление.
DOI: 10.1134/S051474921908010X
Ранее было показано, что бромиды пропаргил[3-
реализуется при нагревании реакционной смеси
(4-бромфенил)проп-2-инил]аммония, за исключе-
при 40-45°C в течение 6-15 мин. В этих условиях
нием диметильного аналога, в присутствии 0.2 моль
гетерогенная система превращается гомогенную и
щелочи на моль исходной соли при комнатной
сразу же имеет место циклизация с саморазог-
температуре саморазогреванием подвергаются
реванием
[7,
8]. Циклические продукты полу-
циклизации, образуя с высокими выходами
чаются с высокими выходами.
бромиды 6-бромбензо[f]изоиндолиния [1, 2].
На основании полученных данных можно
сказать, что фенильная группа, находящаяся в
Известно, что для циклизации солей аммония,
третьем положении аллильного звена, благоприят-
содержащих группу аллильного типа наряду с
но действует на циклизацию аналогично бис(3-
различными
3-арилпроп-2-инильными фрагмен-
фенилпроп-2-иниль)ным солям [9]. Наблюдаемое
тами в присутствии 0.2 моль щелочи на моль
явление является единственным случаем в области,
исходной соли, необходимо нагревание реакцион-
катализируемой основанием внутримолекулярной
ной смеси в течение 2 ч при 90-92°C [3-5], наряду
циклизации солей аммония, содержащих наряду с
с циклизацией, которая является основным направ-
3-арилпроп-2-инильной аллильную группу [3-6].
лением, имеет место также реакция перегруп-
пировки-расщепления. Следует отметить, что в
Полученные данные говорят в пользу меха-
случае [3-(3-α-нафтил)проп-2-инильных] аналогов
низма циклизации [10, 11], а также соответствуют
в вышеуказанных условиях имеет место лишь
литературным данным, согласно которым при
циклизация [6]. Недавно было установлено, что
диеновом синтезе имеет место нуклеофильное
циклизация бромидов
(3-фенилпроп-2-енил)(3-
присоединение диена к диенофилу. Так как
арилпроп-2-инил)аммония, в отличие от вышеука-
фенильная группа, находящаяся в третьем
занных солей [6] в условиях основного катализа
положении аллильного звена, по сравнению с
1215
1216
ЧУХАДЖЯН и др.
атомом водорода увеличивает положительный
Циклические продукты диметил- 2а, диэтил-6-
заряд диенофила, следовательно, облегчается процесс
бром-3а,4-дигидробензо[f]изоиндолиния 2b, 6-бром-
нуклеофильного присоединения диена к диенофилу.
3а,4-дигидробензо[f]пирролидиния
2с,
-пипе-
ридиния 2d, -морфолиния 2е получаются с 70, 85,
С целью развития и расширения области
80, 72, 71%-ми выходами соответственно.
катализируемой основанием внутримолекулярной
циклизации, в данной работе нами планировалось
Наряду с циклизацией имеет место также
изучить циклизацию бромидов аллил[3-(4-бром-
реакция перегруппировки-расщепления, приво-
фенил)проп-2-инил]аммония. При удачном исходе
дящая к формированию 1-аллил-п-бромкоричного
можно было синтезировать потенциально био-
альдегида, с 15, 20, 18, 20%-ми выходами соот-
активные бромиды
6-бром-3а,4-дигидробензо[f]-
ветственно. В случае соли
1b продукт перег-
изоиндолиния, соединения, синтез которых
руппировки-расщепления получается лишь на 6%.
другими химическими методами трудно осу-
То обстоятельство, что в случае соли
1b
ществить. В ходе исследования можно было
циклический продукт получается с 85% выходом, а
выявить также влияние заместителей, находящихся
продукт перегруппировки-расщепления лишь на
у атома азота и в ароматическом кольце, на
6% говорит в пользу того, что этильные замес-
циклизацию и на перегруппировку-расщепление, и
тители у атома азота благоприятно действуют на
получить новые данные, утверждающие механизм
циклизацию. Этот факт находится в согласии с
внутримолекулярной циклизации. Для достижения
механизмом циклизации
[10,
11], а также с
вышеуказанной цели алкилированием диметил-,
результатами кинетических исследований, прове-
диэтил-, и пирролидиния, пиперидиния, мор-
денных с целью выявления механизма циклизации,
фолиния с бромистым аллилом в среде
согласно которым скорость циклизации соли 1b
ацетонитрила были синтезированы испытуемые
намного превышает скорость циклизации других
соли: бромиды диметил-
1а, диэтилаллил[3-(4-
аналогов [12]. Следует отметить, что в случае
бромфенил)проп-2-инил]аммония
1b,
-пирро-
пиперидиниевого аналога 1d ступенчато прибав-
лидиния 1с, -пиперидиния 1d и -морфолиния 1е.
ляется 0.3 моль щелочи на 1 моль исходной соли.
Циклизация солей
1а-е реализуется согласно
Так как щелочь расходуется на перегруппировку-
механизму циклизации [10, 11]. Так на основании
расщепление, поэтому часть исходной соли не
ИК спектральных исследований, проведенных с
успевает подвергаться циклизации. На основании
целью установления механизма циклизации,
выходов циклических продуктов можно сказать,
ениновый фрагмент непосредственно вовлекается
что наличие алкильных заместителей у атома азота
во внутримолекулярную циклизацию в качестве π4-
благоприятно действует на циклизацию [11] (схема 1).
фрагмента
[10], а щелочь является движущей
Сравнительно низкие выходы циклических
силой циклизации [11].
продуктов, полученных при циклизации пипери-
Схема 1.
H
Br
+
OH-
Br
+
R2N
+
R2N
R2N
Br
Br-
Br-
Br-
1a-e
2a-e
OH-
CH
2
HC
CH
Br
2
R2NH
+
HC C
H
O C
H
1, 2 R = Me (а), R = Et (b), R2 = -(CH2)4- (c), R2 = -(CH2)5- (d), R2 = -(CH2)2O(CH2)2- (e).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
СИНТЕЗ БРОМИДОВ 6-БРОМ-3а,4-ДИГИДРОБЕНЗО[f]ИЗОИНДОЛИНИЯ
1217
Схема 2.
CH2
Me
Br
Br
1,2-
H
R2N
R2N
Br
+
3a, b, d, e
R2N
Br-
1,6-
Br
Br
R2N
2a, b, d, e
R2N
H
Me
CH2
4a, b, d, e
3, 4, R = Me (a), R = Et (b), R2 = -(CH2)5- (d), R2= -(CH2)2O(CH2)2- (e).
диниевого и морфолиниевого аналогов можно
и 4а, b, d, e и для отнесения в спектрах ЯМР 1Н и
объяснить тем, что наличие атома брома
13С сигналов использованы методы ИК, ЯМР
благоприятно действует на перегруппировку-
спектроскопии 1Н и 13С. Для отнесения сигналов в
расщепление.
спектрах ЯМР применены методы двойного
резонанса, а также двумерные корреляционные
На основании проведенных исследований
методы DEPT, HMQC, NOESY.
разработан доступный способ получения потен-
циально биоактивных бромидов
2,2-диалкил-6-
Таким образом, бромиды диалкилаллил[3-(4-
бром-3а,4-дигидробензо[f]изоиндолиния,
6-бром-
бромфенил)проп-2-инил]аммония, -пирролидиния,
3а,4-дигидробензо[f]пирролидиния,
-пиперидиния
-пиперидиния и -морфолиния в условиях основ-
и
6-бром-3а,4-дигидро[спиробензо[f]изоиндолин]-
ного катализа предпочтительно подвергаются
2,4'-морфолиния.
циклизации с образованием бромидов 6-бром-3а,4-
дигидробензо[f]изоиндолиния с высокими выхо-
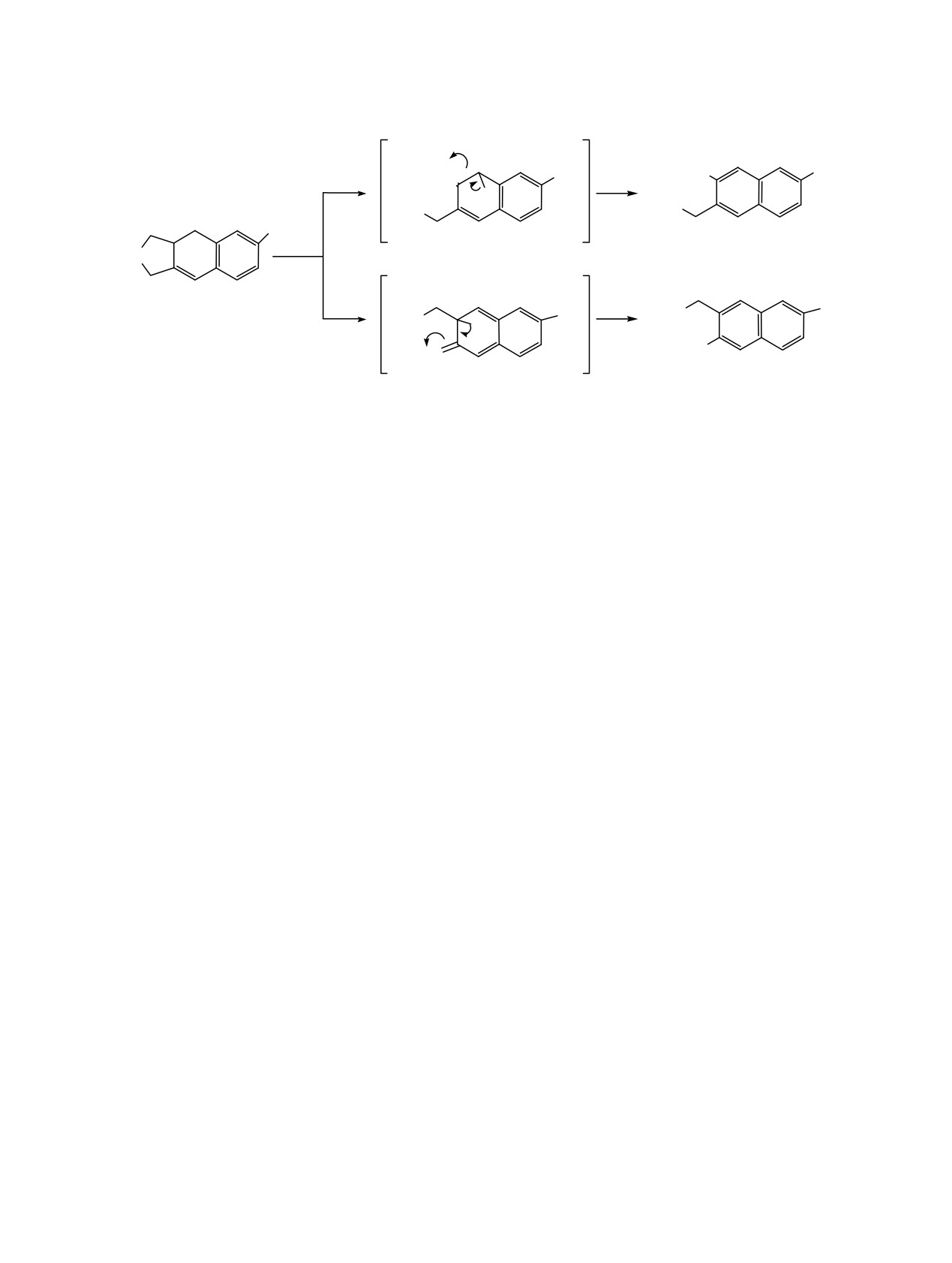
Изучение водно-щелочного расщепления солей
дами, соединений, синтез которых другими хи-
2а, b, d, e показало, что последние довольно гладко
мическими методами трудно осуществить. Наряду
подвергаются водно-щелочному расщеплению по
с циклизацией имеет место также перег-
1,2- и 1,6-направлениям, приводящее к образо-
руппировка-расщепление. Установлено, что выше-
ванию смеси изомерных 3-диалкиламинометил-2-
указанные циклические соли довольно гладко
метил- и
2-диалкиламинометил-3-метил-7-бром-
подвергаются водно-щелочному расщеплению по
нафталинов с 57-60% общими выходами.
направлениям 1,2- и 1,6-.
Согласно данным спектроскопии ЯМР 1Н и 13С
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
соотношение изомерных аминов в смеси
составляет 3а:4а = 5.5:4.5; 3b:4b = 4.4:5.6; 3d:4d =
ИК спектры зарегистрированы на спектрометре
6:4; 3e:4e = 6:4. Известно, что хлоргидраты, анало-
Specord 75 IR в CHCl3. Спектры ЯМР 1Н и 13С
гичных диалкиламинометилнафталинов, обладают
записаны на спектрометре Varian Mercury 300 VX
антиацетилхолиновой, антигистаминовой актив-
(300 и 75 МГц соответственно) в смеси DMSO-d6-
ностью, а также активностью подобной папави-
CCl4, 1:3, внутренний стандарт ТМС. Элементный
рину и атропину [13]. Не исключено, что полу-
анализ С, Н, N проведён на компактном элемент-
ченные диалкиламинометилнафталины 3а, b, d, e и
ном анализаторе vario MICRO cube, 1371 анализ
4а, b, d, e могут обладать вышеуказанными
содержания ионов Br- проводили методом
активностями.
Абрамяна и Саргсяна [14]. Температуры плавления
При установлении структуры [3-(4-бромфенил-
определены на приборе VEB Wägetechnik Rapido
проп-2-инил)]пирролидина, исходных солей 1а-е,
Radebeul Betrieb des VEB Kombinat NAGEMA
продуктов их циклизации 2а-е, 1-аллил-п-бромко-
DDR. Чистоту циклических солей контролировали
ричного альдегида и изомерных аминов 3а, b, d, e
методом ТСХ на пластинах Sulifol UV-254, элюент
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
1218
ЧУХАДЖЯН и др.
n-BuOH-EtOH-H2O-AcOH,
10:2:1:5, проявление
спектр, ν, см-1: 3020, 3010, 1580 (ароматическое
парами иода.
кольцо), 2230 (дизамещенная ацетиленовая связь),
1640, 995, 925 (несопряженная двойная связь), 840-
Исходные диалкил[3-(4-бромфенил)проп-2-
810 (п-замещенное бензольное кольцо). Спектр
инил]амины синтезированы согласно методике [2].
ЯМР 1Н (300.09 МГц, ДМСО-d6 + CCl4), δ, м.д. (J,
Неописанный ранее
[3-(4-бромфенил)проп-2-
Гц): 3.31 c [6H, N(CH3)2], 4.34 д (2H, CH2-CH=CH2,
инил]пирролидин получали взаимодействием 2.8 г
J 7.4), 4.81 c (2H, CH2-C≡C), 5.70 д.д (1H, =CH2, J
(4 ммоль) пирролидин амина, 1.2 г (4 ммоль)
10.0, 1.7), 5.79 д.д (1H, =CH2, J 16.8, 1.6), 6.16 д.д.т
параформа, 7 г (4 ммоль) п-бромфенилацетелена в
(1H, =CH, J 16.8, 10.0, 7.4), 7.50-7.58 м (4Hаром).
70 мл диоксана в присутствии 0.15 г диацетата
Спектр ЯМР 13C (75.47 МГц, ДМСО-d6 + CCl4), δ,
меди и 0.2 г хлорида железа (III). Реакционную
м.д.: 49.1 (CH3), 53.6 (CH2), 64.8 (CH2), 78.4 и 89.2
смесь выдерживали в течение 70 ч при 90-95°С.
(C≡C), 119.4 (C6H4), 123.1 (C6H4),
125.3
(=СН2),
Затем реакционную смесь подкисляли 25% раст-
127.8
(=CH),
131.2
(2-СН, C6H4),
133.3
(2-СН,
вором соляной кислоты до кислой реакции и при
C6H4). Найдено, %: C 47.04; H 4.89; Br 44.72; N
пониженном давлении отгоняли растворитель. После
3.74. C14H17Br2N. Вычислено, %: C 46.83; H 4.77; Br
этого смесь экстрагировали эфиром (2×60 мл) для
44.5; N 3.9.
выделения непрореагировавшего п-бромфенил-
Бромид диэтил-3-аллил-[3-(4-бромфенил)-
ацетилена. Затем остаток подщелачивали и
проп-2-инил]аммония (1b). Выход 2.7 г (89%),
экстрагировали эфиром
(3×70 мл), эфирный
белые кристаллы, т.пл. 155-157°C (абс. EtOH). ИК
экстракт высушиваюли MgSO4. После отгонки
спектр, ν, см-1: 3010, 1600 (ароматическое кольцо),
эфира вакуумной перегонкой выделяли
[3-(4-
2230 (дизамещенная ацетиленовая связь),
1640,
бромфенилпроп-2-инил)]пирролидин. Выход 5 г
995, 920 (несопряженная двойная связь), 845-825
(47%), т.кип.
139-140°С
(3-4 мм рт.ст.), т.пл.
(п-замещенное бензольное кольцо). Спектр ЯМР
пикрата 172°С (EtOH). ИК спектр, ν, см-1: 2230
1Н (300.09 МГц, ДМСО-d6 + CCl4), δ, м.д. (J, Гц):
(дизамещенная ацетиленовая связь), 840-810 (п-
1.42 т (6H, CH3, J 7.2), 3.57 к (4H, CH2-CH3, J 7.2),
замещенное бензольное кольцо). Спектр ЯМР 1Н
4.21 уш.д (2H, CH2алл, J 7.2), 4.69 c (2H, CH2-C≡C),
(300.09 МГц, ДМСО-d6 + CCl4), δ, м.д. (J, Гц): 1.70-
5.67 д.д (1H, =CH2, J 10.1, 1.6), 5.81 д.д (1H, =CH2,
1.84 м (4H, β,β'-CH2), 2.52-2.64 м (4H, α,α'-CH2),
J 16.8, 1.6), 6.15 д.д.т (1H, =CH, J 16.8, 10.1, 7.2),
3.55 c (2H, CH2-C≡C), 7.25-7.30 м (2Hаром), 7.42-
7.49-7.58 м (4Hаром). Спектр ЯМР 13C (75.47 МГц,
7.46 м
(2Hаром). Спектр ЯМР
13C
(75.47 МГц,
ДМСО-d6 + CCl4), δ, м.д.: 7.3 (CH3), 48.8 (CH2алл),
ДМСО-d6 + CCl4), δ, м.д.: 23.3 (β-CH2), 42.7 (CH2-
53.7 (CH2-CH3), 60.2 (CH2-C≡C), 78.3 (C≡C), 88.9
C≡C), 51.5 (α-CH2), 82.7 и 86.5 (C≡C), 121.2, 121.8,
(C≡C), 119.4 (CBr), 123.1 (Cипсо), 125.1 (=CHалл),
130.9 (2-CH) и 132.5 (2-СН). Найдено, %: С 59.39;
127.1
(=СН2алл),
131.2
(2-СН),
133.3
(2-СН).
H 5.44; N 5.15; Br 30.46. C13H14NBr. Вычислено, %:
Найдено, %: C 49.86; H 5.61; Br 41.48; N 3.51.
С 59.11; H 5.34; N 5.30; Br 30.25.
C16H21Br2N. Вычислено, %: C 49.64; H 5.47; Br
Синтез бромидов
2,2-диалкилаллил[3-(4-
41.28; N 3.62.
бромфенил)проп-2-инил]аммония, аллил[3-(4-
Бромид
3-аллил[3-(-4-бромфенил)проп-2-
бромфенил)проп-2-инил]пирролидиния,
-пипе-
инил]пирролидиния
(1с). Выход
2.5 г
(80%),
ридиния и морфолиния (общая методика). К
белые кристаллы, т.пл. 145-146°C (абс. EtOH). ИК
раствору 8 ммоль соответствующего диалкил[3-(4-
спектр, ν, см-1: 3020, 1580 (ароматическое кольцо),
бромфенил)проп-2-инил]амина, в 5 мл MeCN и
2230 (дизамещенная ацетиленовая связь),
1640,
10 мл абс. Et2O добавляли 1.45 г (12 ммоль) фенил-
990, 925 (несопряженная двойная связь), 845-820
аллилбромида [15] и оставляли смесь при ком-
(п-замещенное бензольное кольцо). Спектр ЯМР
натной температуре. Отметим, что в случае пирро-
1Н (300.09 МГц, ДМСО-d6 + CCl4), δ, м.д. (J, Гц):
лидиниевого 1с и морфолиниевого 1е аналогов
2.19-2.32 м (4H, β-CH2), 3.76-3.89 м (4H, α-CH2),
солеобразование проходило в среде MeCN. Через
4.29-4.40 м (2H, CH2алл), 4.74 c (2H, CH2-C≡C), 5.67
2-3 ч во всех случаях фильтрованием были
д.д (1H, =CH2, J 10.1, 1.7), 5.81 д.д.т (1H, =CH2, J
выделены белые кристаллы солей 1а-е.
16.8, 1.7, 1.0), 6.18 д.д.т (1H, =CH, J 16.8, 10.1, 7.2),
Бромид диметил-3-аллил-[3-(4-бромфенил)-
7.50-7.57 м (4Hаром). Спектр ЯМР 13C (75.47 МГц,
проп-2-инил]аммония (1a). Выход 2.9 г (98%),
ДМСО-d6
+ CCl4), δ, м.д.:
21.7 (β-CH2),
50.9
белые кристаллы, т.пл. 185-187°C (абс. EtOH). ИК
(CH2алл), 61.0 (α-CH2), 62.5 (CH2-C≡C), 79.1 (C≡C),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
СИНТЕЗ БРОМИДОВ 6-БРОМ-3а,4-ДИГИДРОБЕНЗО[f]ИЗОИНДОЛИНИЯ
1219
88.3 (C≡C), 119.4, 123.1, 126.0 (=CH), 127.1 (=СН2),
гировали эфиром (2×35 мл) для удаления побочных
131.2 (2-СНаром), 133.3 (2-СНаром). Найдено, %: C
продуктов. Фильтрованием из водного раствора
49.85; H
5.58; Br
41.49; N
3.51. C16H21Br2N.
реакционной смеси выделяли циклические соли
Вычислено, %: C 49.64; H 5.47; Br 41.28; N 3.62.
2а-e. В эфирном экстракте по титрации
обнаружили 10-20% вторичных аминов. Так как
Бромид
3-аллил[3-(-4-бромфенил)проп-2-
вторичные амины экстрагировали из водного
инил]пиперидиния (1d). Выход 2.7 г (85%), белые
раствора реакционной смеси, следовательно,
кристаллы, т.пл.
135-136°C (абс. EtOH). ИК
вторичные амины невозможно было полностью
спектр, ν, см-1: 3010, 1610 (ароматическое кольцо),
выделить из водного раствора. Эфирный экстракт
2230 (дизамещенная ацетиленовая связь),
1630,
подкисляли соляной кислотой, подщелачиванием
995, 925 (несопряженная двойная связь), 840, 825
соляно-кислого раствора с последующим
(п-замещенное бензольное кольцо). Спектр ЯМР
экстрагированием выделяли вторичные амины-
1Н (300.09 МГц, ДМСО-d6 + CCl4), δ, м.д. (J, Гц):
диметил-, пирролидин, пиперидин, морфолин.
1.69-1.80 м (2H, CH2), 1.90-2.06 м (4H, α-CH2),
Пикраты последних плавились при температуре
3.65-3.79 м [2H, N(CH2)2], 4.35 уш.д (2H, CH2-
154-155, 130, 145, 140°С соответственно и не
CН=CH2, J 7.3), 4.79 c (2H, CH2-C≡C), 5.68 уш.д.д
давали депрессии температуры плавления с
(1H, =CH2, J 10.0, 1.7), 5.82 уш.д.д (1H, =CH2, J
известными образцами. Хлоргидрат диэтиламина
16.8, 1.7), 6.15 д.д.т (1H, =CH, J 16.8, 10.0, 7.3), 7.53
плавился при 223-224°С и не давал депрессии
с (4Hаром). Спектр ЯМР 13C (75.48 МГц, ДМСО-d6 +
температуры плавления с известным образцом.
CCl4), δ, м.д.: 19.1 (2-CH2), 20.3 (CH2), 49.6 (NCH2),
Эфирный экстракт, содержащий неаминный
57.4 [N(CH2)2], 60.8 (NCH2), 78.1 (C≡C), 89.3 (C≡C),
продукт, промывали водой и высушивали CaCl2.
119.5 (CBr), 123.1, 124.7 (=CH), 127.6 (=СН2), 131.2
После отгонки эфира
выделили неаминный
(2-СН), 133.3 (2-СН). Найдено, %: C 51.36; H 5.42;
продукт-1-аллил-п-бромкоричный альдегид.
Br 40.24; N 3.43. C17H21Br2N. Вычислено, %: C
51.15; H 5.3; Br 40.03; N 3.51.
После отгонки эфира из остатка вакуумной
перегонкой выделили
1-аллил-п-бромкоричный
Бромид
3-аллил[3-(-4-бромфенил)проп-2-
альдегид, который в случае солей 2а-е получается
инил]морфолиния (1е). Выход 2.6 г (82%), белые
с
15%,
6%,
20%,
18%,
20% выходами
кристаллы, т.пл.
185-186°C (абс. EtOH). ИК
соответственно.
спектр, ν, см-1: 3020, 1580 (ароматическое кольцо),
2230 (дизамещенная ацетиленовая связь), 1630, 990,
1-Аллил-п-бромкоричный альдегид. Т.кип.
925 (несопряженная двойная связь), 840, 820 (п-
88-94°С (2-3 мм рт.ст.), т.пл. гидразона 193-195°С.
замещенное бензольное кольцо). Спектр ЯМР 1Н
ИК спектр, ν, см-1: 3090, 1590 (ароматическое
(300.09 МГц, ДМСО-d6 + CCl4), δ, м.д. (J, Гц): 3.69-
кольцо), 1700 (карбонильная группа, сопряженная
3.83 м [4H, О(CH2)2], 4.00-4.15 м [4H, N(CH2)2],
с двойной связью),
1630,
840,
800 (концевая
4.51 д (2H, CH2-CН=CH2, J 7.3), 4.95 c (2H, CH2-
винильная связь),
880,
840,
800 (п-замещенное
C≡C), 5.71 уш.д.д (1H, =CH2, J 9.9, 1.7), 5.86 уш.д.д
бензольное кольцо). Согласно данным ЯМР 1Н и
(1H, =CH2, J 16.9, 1.7), 6.18 д.д.т (1H, =CH, J 16.9,
13С выделили два стереоизомера в соотношении
9.9, 7.3), 7.51-7.59 м
(4Hаром). Спектр ЯМР 13C
95:5. Спектр ЯМР 1Н (300.09 МГц, ДМСО-d6 +
(75.47 МГц, ДМСО-d6 + CCl4), δ, м.д.: 50.1 (CH2),
CCl4), δ, м.д. (J, Гц): 3.21 д.т (2Н, CH2, J 5.6, 1.8),
56.3
[N(CH2)2],
59.5
[O(CH2)2], 61.1 (CH2),
77.8
5.01 д.т.д (1H, =CH2, J 17.2, 1.8, 1.6), 5.05 д.т.д (1H,
(C≡C), 89.7 (C≡C), 119.4 (CBr), 123.1, 124.4 (=CH),
=CH2, J 10.3, 1.8, 1.6), 5.87 д.т.д (1H, =CHалл, J 17.2,
128.1 (=СН2), 131.2 (2-СН), 133.4 (2-СН). Найдено,
10.3, 5.6), 7.45 уш.с (1H, =CH), 7.43-7.48 м (2Наром);
%: C 48.12; H 4.89; Br 40.01; N 3.38. C16H19Br2NO.
7.55-7.60 м (2Наром), 9.56 с (1Н, СНО). Спектр ЯМР
Вычислено, %: C 47.91; H 4.77; Br 39.84; N 3.49.
13C
(75.47 МГц, ДМСО-d6 + CCl4), δ, м.д.: 28.0
(CH2),
115.4
(=CH2), 123.2,
130.9
(2-СН, С6Н4),
Внутримолекулярная циклизация солей 1a-e
131.3 (2-СН, С6Н4), 133.1, 133.5 (=CH), 139.4, 148.5
(общая методика). К раствору 6 ммоль соли 1а-e в
(=CH), 193.2 (CHO). Найдено, %: C 57.61; H 4.61;
3.5 мл воды прибавляли 0.4 мл 3н раствора КОН
Br 32.03; O 6.54. C12H11BrO. Вычислено, %: C 57.4;
(молярное соотношение соль-основание,
5:1).
H 4.42; Br 31.82; O 6.37.
Саморазогревание не имело место. Реакционную
смесь нагревали при температуре
75-80°С в
Бромид
2,2-диметил-6-бром-3а,4-дигидро-
течение 2.5 ч. Затем реакционную смесь экстра-
бензо[f]изоиндолиния (2а). Выход 1.5 г (70%),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
1220
ЧУХАДЖЯН и др.
белые кристаллы, т.пл. 247-250°C (абс. EtOH). ИК
NCH2), 4.24 д.д (1H, NCH2, J 11.2, 7.9), 6.59 д.т (1H,
спектр, ν, см-1: 1610, 1580 (ароматическое кольцо),
=CH, J 2.5, 2.2), 7.06 д (1H, C6H3, J 8.0), 7.30 д.д.д
880-875,
825-805
(1,2,4-замещенное бензольное
(1H, C6H3, J 8.0, 2.0, 0.8), 7.34 уш.д (1Н, C6H3, J
кольцо). Спектр ЯМР 1Н (300.09 МГц, ДМСО-d6 +
2.0). Спектр ЯМР 13C (75.47 МГц, ДМСО-d6 +
CCl4), δ, м.д. (J, Гц): 2.68 т (1H, CH2, J 15.6, 15.2),
CCl4), δ, м.д.: 21.3 (β-CH2), 21.5 (β'-CH2), 30.7, 35.8,
3.01 д.д (1H, CH2, J 15.2, 6.3), 3.17 с (3H, CH3),
62.4, 62.9, 64.3, 65.8, 119.9, 120.1, 127.5, 129.3,
3.21-3.44 м (1H, CH), 3.30 с (3H, CH3), 3.58 д.д (1Н,
130.3, 132.3, 135.6, 136.5. Найдено, %: C 50.25; H
NCH2CH, J 11.3, 10.5), 4.01 д.д (1H, NCH2CH, J
4.93; Br 41.83; N 3.53. C16H18Br2N. Вычислено, %: C
11.3, 8.0), 4.37 д.т (1H, NCH2=CH, J 16.2, 2.3), 4.46
50.03; H 4.72; Br 41.6; N 3.65.
уш.д (1H, NCH2=CH, J 16.2), 6.63 к (1H, =CH, J
Бромид
2,2-пентаметилен-6-бром-3а,4-ди-
2.4), 7.13 д (1H, C6H3, J 8.0), 7.40 д.д (1H, C6H3, J
гидробензо[f]изоиндолиния
(2d). Выход
1.7 г
8.0, 1.9), 7.44 уш.с (1H, C6H3). Спектр ЯМР 13C
(72%), белые кристаллы, т.пл.
235-236°C (абс.
(75.47 МГц, ДМСО-d6 + CCl4), δ, м.д.: 30.5 (CH2),
EtOH). ИК спектр, ν, см-1: 3040, 1600 (аромати-
35.5 (CH), 51.8 (CH3), 52.4 (CH3), 67.1 (NCH2), 68.8
ческое кольцо),
885-870,
825-805
(1,2,4-заме-
(NCH2), 119.9, 120.3 (=CH), 128.0 (CHаром), 129.7
щенное бензольное кольцо). Спектр ЯМР
1Н
(CHаром),
130.5 (CHаром),
132.6,
136.1,
137.1.
(300.09 МГц, ДМСО-d6 + CCl4), δ, м.д. (J, Гц): 1.54-
Найдено, %: C 47.17; H 4.72; Br 44.84; N 3.79.
1.66 м (2H, γ-СН2), 1.77-1.90 м (4H, β,β'-СН2), 2.67
C14H16Br2N. Вычислено, %: C 46.96; H 4.5; Br 44.63;
т (1H, CH2, J 15.2), 3.00 д.д (1H, CH2, J 15.2, 6.4),
N 3.91.
3.22-3.37 м (1H, CH), 3.43 уш.т (2H, CH2, J 5.7),
Бромид 2,2-диэтил-6-бром-3а,4-дигидробензо-
3.51 д.д (1H, CH2, J 11.5, 10.5), 3.54 уш.т (2H, CH2,
[f]изоиндолиния (2b). Выход 2.0 г (85%), белые
J 5.7), 4.14 уш.д.д (1H, CH2, J 11.5, 8.0), 4.36 уш.д.т
кристаллы, т.пл.
218-220°C (абс. EtOH). ИК
(1H, N+CH2, J 16.4, 2.2), 4.57 уш.д (1H, N+CH2, J
спектр, ν, см-1: 3030, 1590 (ароматическое кольцо),
16.4), 6.60 уш.к (1Н, =CH, J 2.3), 7.14 д (1H, C6H3, J
820-805,
885-875
(1,2,4-замещенное бензольное
8.0), 7.40 д.д.д (1H, C6H3, J 8.0, 2.0, 0.7), 7.46 уш.с (1Н,
кольцо). Спектр ЯМР 1Н (300.09 МГц, ДМСО-d6 +
C6H3). Спектр ЯМР 13C (75.47 МГц, ДМСО-d6 +
CCl4), δ, м.д. (J, Гц): 1.35 т (3H, CH3, J 7.3), 1.38 т
CCl4), δ, м.д.: 20.4 (γ-CH2), 20.6 (β-CH2), 21.0 (β'-
(3H, CH3, J 7.3), 2.83 д.д (1H, CH2, J 15.2, 15.0), 2.98
CH2), 30.6 (СН2), 34.4 (СН), 59.3 (СН2), 61.3 (СН2),
д.д (1H, CH2, J 15.2, 6.5), 3.26-3.42 м (1H, CH),
63.7 (СН2), 66.3 (СН2), 120.0, 120.1 (=CH), 128.0
3.44-3.58 м (2H, СН2CH3), 3.66 к (2H, СН2CH3, J
(=CH),
129.7
(=CH),
130.5
(=CH), 132.6, 136.0,
7.3), 3.73 д.д (1H, NCH2, J 11.6, 10.0), 4.21 д.д (1H,
136.6. Найдено, %: C 51.49; H 5.15; Br 40.37; N
NCH2, J 11.6, 8.4), 4.57 д.т (1H, NCH2, J 16.5, 2.2),
3.39. C17H20Br2N. Вычислено, %: C 51.28; H 5.06; Br
4.60 д.т (1H, NCH2, J 16.5, 2.0), 6.61 уш.с (1H,
40.14; N 3.52.
=CH), 7.06 д (1H, C6H3, J 8.0), 7.30 д.д (1H, C6H3, J
Бромид спиро[6-бром-3а,4-дигидробензо[f]-
8.0, 1.8), 7.34 уш.с (1H, C6H3). Спектр ЯМР 13C
изоиндолин-2,4']морфолиния (2e). Выход 1.7 г
(75.47 МГц, ДМСО-d6 + CCl4), δ, м.д.: 8.2 и 8.4 (2-
(71%), белые кристаллы, т.пл.
275-276°C (абс.
CH3), 31.0 (CH2), 34.9 (CH), 53.4 (NCH2),
54.8
EtOH). ИК спектр, ν, см-1: 3040, 1580 (аромати-
(NCH2), 63.9 (NCH2), 64.8 (NCH2), 120.0,
120.4
ческое кольцо),
885-870,
825-805
(1,2,4-заме-
(CH), 127.5 (CH), 129.3 (CH), 130.3 (CH), 132.2,
щенное бензольное кольцо). Спектр ЯМР
1Н
135.7, 136.1. Найдено, %: C 49.97; H 5.33; Br 41.59;
(300.09 МГц, ДМСО-d6 + CCl4), δ, м.д. (J, Гц): 2.69
N 3.41. C16H20Br2N. Вычислено, %: C 49.77; H 5.22;
т (1H, CH2, J 15.3), 3.01 д.д (1H, CH2, J 15.3, 6.5),
Br 41.38; N 3.63.
3.23-3.39 м (1H, CH), 3.51-3.56 м (2H, NCH2), 3.59-
Бромид
2,2-тетраметилен-6-бром-3а,4-ди-
3.67 м (3H, CH2), 3.86-4.01 м [4H, О(CH2)2], 4.27
гидробензо[f]изоиндолиния
(2с). Выход
1.8 г
д.д (1H, CH2, J 11.5, 8.1), 4.47 д.т (1H, CH2, J 16.4,
(80%), белые кристаллы, т.пл.
235-237°C (абс.
2.3), 4.74 уш.д (1H, CH2, J 16.4), 6.62 уш.к (1Н,
EtOH). ИК спектр, ν, см-1: 3010, 1600 (аромати-
=CH, J 2.3), 7.15 д (1H, C6H3, J 8.1), 7.40 д.д.д (1H,
ческое кольцо),
885-875,
825-805
(1,2,4-заме-
C6H3, J 8.1, 2.0, 0.8), 7.46 уш.с (1Н, C6H3). Спектр
щенное бензольное кольцо). Спектр ЯМР
1Н
ЯМР 13C (75.47 МГц, ДМСО-d6 + CCl4), δ, м.д.: 30.4
(300.09 МГц, ДМСО-d6 + CCl4), δ, м.д. (J, Гц): 2.15-
(CH2),
34.3 (CH),
58.3 (СН2),
59.8 (СН2),
61.0
2.31 м (4H, β,β'-СН2), 2.79 уш.т (1H, CH2, J 15.3),
(ОСН2), 61.5 (ОСН2), 63.6 (СН2), 66.8 (СН2), 120.0,
3.00 д.д (1H, CH2, J 15.3, 6.4), 3.22-3.38 м (1H, CH),
120.3
(=CH),
128.0
(=CH),
129.7
(=CH),
130.5
3.63-3.75 м (2H, α-CH2), 3.79-3.93 м (3H, α'-CH2 и
(=CH), 132.5, 135.9, 136.0. Найдено, %: C 48.25; H
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
СИНТЕЗ БРОМИДОВ 6-БРОМ-3а,4-ДИГИДРОБЕНЗО[f]ИЗОИНДОЛИНИЯ
1221
4.73; Br 40.16; N 3.38. C16H18Br2NО. Вычислено, %:
ЯМР 13C смеси соединений 3b и 4b (75.47 МГц,
C 48.03; H 4.53; Br 39.94; N 3.50.
ДМСО-d6 + CCl4), δ, м.д.: 11.4 (2-CH3), 18.95 и
18.99 (CH3),
46.2
[N(CH2СН3)2],
55.89 и
55.96
Водно-щелочное расщепление солей 2a, b, d, e
(NCH2), 117.84 и 118.37, 126.30, 126.52, 127.16,
(общая методика). К 2 ммоль соли 2a, b, d, e в 2-3 мл
127.37,
127.48,
127.87,
128.04,
128.08,
128.60,
Н2О прибавляли 0.3 г KОН. Расщепление прово-
128.68,
129.71,
130.51,
132.46,
133.28,
135.56,
дилось при 110-120°С с отгонкой воды, перио-
136.32, 136.83, 137.50. Найдено, %: С 62.96; Н 6.79;
дически добавляя воду (10-15 мл воды) к нагре-
N 4.43; Br 26.31. C16H20NBr. Вычислено, %: С
ваемой массе. Для обеспечения полноты, расщеп-
62.75; Н 6.58; N 4.57; Br 26.09.
ления температуру реакционной смеси на 5-7 мин
поднимали до
140-145°С. Продолжительность
2-Метил-3-пиперидинометил-7-бромнафта-
расщепления составляло 1.5 ч. Затем реакционную
лин (3d) и 3-метил-2-пиперидинометил-7-бром-
смесь и отогнанную часть экстрагировали Et2O
нафталин
(4d). Общий выход
0.4 г
(59%),
(3×50 мл). Полученный экстракт промывали водой
медообразное вещество. ИК спектр, ν, см-1: 3040,
и высушивали MgSO4, после удаления эфира из
1620, 1580 (ароматическое кольцо), 885-875, 820-
остатка вакуумной перегонкой получали смесь
805 (1,2,4- и 1,2,4,5-замещенное бензольное кольцо).
изомерных аминов 3a, b, d, e и 4a, b, d, e.
Согласно данным ЯМР 1Н соотношение изомерных
3-Диметиламинометил-2-метил-7-бромнаф-
аминов 3d:4d в смеси составляет 4:6, δ, м.д.: 1.41-
талин (3а) и 2-диметиламинометил-3-метил-7-
1.59 м (6Н, 3-СН3), 2.37-2.43 м (4Н, α,α'-СН2), 2.50
бромнафталин (4а). Общий выход 0.3 г (60%),
с (1.7Н, CH3), 2.52 с (1.3Н, СН3), 3.49 с (0.8Н, CH2),
20
3.50 с (1.2Н, СН2), 7.42 д.д (0.4Н, C6H3, J 8.7, 2.0),
т.кип. 110-120°С (2-3 мм рт.ст.), п
1.5970. ИК
спектр, ν, см-1: 3040, 1600, 1570 (ароматическое
7.43 д.д (0.6Н, C6H3, J 8.7, 2.0), 7.49 уш.с (0.4Н, =CH,
кольцо), 885-870, 825-805 (1,2,4- и 1,2,4,5-заме-
C6H2), 7.54 уш.с (0.6Н, =CH, C6H2), 7.57 уш.с (0.6H,
щенное бензольное кольцо). Согласно данным
=CH, C6H2), 7.62 уш.с (0.4Н, =CH, C6H2), 7.61 д (0.4Н,
ЯМР 1Н соотношение изомерных аминов 3а:4а в
C6H3, J 8.7), 7.64 д (0.4Н, C6H3, J 8.7), 7.86 д (0.4Н,
смеси составляет 5.5:4.5. Спектр ЯМР 1Н смеси
C6H3, J 2.0), 7.91 д (0.6Н, C6H3, J 2.0). Найдено, %:
соединений 3а и 4а, δ, м.д.: 2.23 с [6Н, (CH3)2], 2.50
С 64.38; Н 6.45; N 4.28; Br 25.32. C17H20NBr.
д (1.65Н, CH3, J 0.9), 2.52 д (1.35Н, CH3, J 0.9), 3.47
Вычислено, %: С 64.16; Н 6.33; N 4.4; Br 25.1.
уш.с (0.9Н, CH2), 3.48 уш.с (1.1Н, СН2), 7.43 д.д
N-[(2-метил-7-бром-3-нафтил)метил]-
(3е) и
(0.45Н, =CH, J 8.7, 2.0) и 7.44 д.д (0.55Наром, =CH, J
N-[(3-метил-7-бром-2-нафтил)метил]морфолин
8.7, 2.0), 7.50 уш.с (0.45H, =CH), 7.56 уш.с (0.55Н,
(4е). Общий выход 0.4 г
(58%), медообразное
=CH), 7.58-7.67 м (2Hаром), 7.88 д (0.45Наром, J 2.0) и
вещество. ИК спектр, ν, см-1: 3060 (CHаром); 1640,
7.91 д (0.55Наром, J 2.0). Найдено, %: С 60.69; Н
1580 (ароматическое кольцо), 885-870, 825-805 (1,2,4-
5.91; N 5.15; Br 28.91. C14H16NBr. Вычислено, %: С
и 1,2,4,5-замещенное бензольное кольцо). Согласно
60.45; Н 5.8; N 5.03; Br 28.72.
данным ЯМР 1Н соотношение изомерных аминов
3-Диэтиламинометил-2-метил-7-бромнаф-
3е и 4е в смеси составляет 4:6, δ, м.д.: 2.41-2.46 м
талин
(3b) и
2-диэтиламинометил-3-метил-7-
(4Н, NCH2морф), 2.52 д (1.8Н, CH3, J 0.8), 2.54 д
бромнафталин (4b). Общий выход 0.35 г (57%), т.
(1.2Н, CH3, J 0.8), 3.56 с (0.8Н, CH2), 3.57 с (1.2Н,
20
кип.
142-143°С (2-3 мм рт.ст.), п
1.5670. ИК
СН2), 3.57-3.61 м (4Н, ОСН2морф), 7.43 д.д (0.4Н,
спектр, ν, см-1: 3020, 1610, 1580 (ароматическое
C6H3, J 8.7, 2.0), 7.45 д.д (0.6Н, C6H3, J 8.7, 2.0),
кольцо), 880-875, 825-805 (1,2,4- и 1,2,4,5-заме-
7.51 уш.с (0.4Н, =CH, C6H2), 7.57 уш.с (0.6Н, =CH,
щенное бензольное кольцо). Согласно данным
С6Н2), 7.60 уш.с (0.6Н, =CH, C6H2), 7.63 уш.с (0.4Н,
ЯМР 1Н соотношение изомерных аминов 3b:4b в
=CH, С6Н2), 7.62 д (0.6Н, C6H3, J 8.7), 7.65 д (0.4Н,
смеси составляет 4.4:5.6. Спектр ЯМР 1Н смеси
C6H3, J 8.7), 7.88 д (0.4Н, C6H3, J 2.0), 7.92 д (0.6Н,
соединений 3b и 4b, δ, м.д.: 1.04 т (6H, 2-CH3, J
C6H3, J 2.0). Найдено, %: С 60.23; Н 5.88; N 4.26; Br
7.1), 2.50 и 2.52 с (3Н, СН3), 2.53 к [4Н, N(CH2)2, J
25.16. C16H18NОBr. Вычислено, %: С 60.01; Н 5.67;
7.1], 3.62 и 3.63 с (2Н, NCH2), 7.42 д.д (0.44Н, C6H3,
N 4.37; Br 24.95.
J 8.7, 1.8), 7.4 д.д (0.56Н, C6H3, J 8.7, 1.8), 7.48 уш.с
(0.44H, =CH), 7.54 уш.с (0.56Н, =CH), 7.61 д (0.56H,
КОНФЛИКТ ИНТЕРЕСОВ
CH3, J 8.7), 7.65 д (0.44H, CH3, J 8.7), 7.65 уш.с
(0.56Н, =CH), 7.69 уш.с (0.44Н, =CH), 7.87 д (0.44H,
Авторы заявляют об отсутствии конфликта
C6H3, J 1.8), 7.91 д.д (0.56Н, C6H3, J 1.8). Спектр
интересов.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
1222
ЧУХАДЖЯН и др.
СПИСОК ЛИТЕРАТУРЫ
Армянского Химического Общества (с междуна-
родным участием)
«Актуальные задачи фун-
1. Gevorgyan H.R., Chukhajian E.O., Shahkhatuni K.G.,
даментальной и прикладной химии», 3-7 окт. 2017,
Chukhajian El.O. 4th International Scientific Conference
Ереван, 63.
“Advances in Synthesis and Complexing”, April 24-28,
8. Чухаджян Э.О., Айрапетян Л.В., Чухаджян Эл.О.,
2017, Moscow, RUDN University, 64.
Паносян Г.А. ХГС, 2013, 49, 1367. [Chukhajian, E.O.;
2. Чухаджян Э.О., Геворкян А.Р., Айрапетян Л.В.,
Ayrapetyan, L.V.; Chukhajian, El.O.; Panosyan. H.A.
Чухаджян Эл.О., Шахатуни К.Г., Хачатрян А.А.
Chem. Heterocycl. Compd.
2013,
49,
1274.] doi
ЖОрХ.
2018,
54,
519.
[Chukhadzhyan, Em.O.,
10.1007/s10593-013-1375-1
Gevorgyan, H.R., Shahkhatuni, K.G., Chukhadzhyan, El.O.,
9. Бабаян А.Т., Чухаджян Э.О., Чухаджян Эл.О. ЖОрХ.
Ayrapetyan, L.V., Khachatryan, A.A. Russ. J. Org.
1973, 9, 467.
Chem., 2018, 54, 517.] doi 10.1134/S1070428018040012
10. Чухаджян Э.О., Налбандян М.К., Геворкян А.Р.,
3. Бабаян А.Т., Чухаджян Э.О., Бабаян Г.Т.,
Киноян Ф.С. Арм. хим. ж. 2007, 60, 83.
Чухаджян Эл.О., Киноян Ф.С. Арм. хим.ж. 1970, 23,
11. Chukhajian E.O., Nalbandyan M.K., Gevorkyan H.R.,
149.
Chukhajian El.O., Panosyan H.A., Ayvazyan A.G.,
4. Чухаджян Эл.О., Чухаджян Э.О., Бабаян А.Т. ЖОрХ.
Tamazyan R.A. J. Heterocycl.Chem. 2008, 45, 687. doi
1974, 10, 46.
10.1002/jhet.5570450309
5. Бабаян А.Т., Чухаджян Э.О., Манасян Л.А. Арм.
12. Абрамян-Бабаян И.А., Бабаян А.Т. Арм. хим. журн.
хим.ж. 1978, 31, 489.
1972, 25, 19.
6. Чухаджян Э.О., Чухаджян Эл.О., Шахатуни К.Г.,
13. Ohta K. Yakugaku Zasshi. 1965, 85, 14. doi 10.1248/
Бабаян А.Т. ХГС 1989, 25, 615. [Chukhajian, E.O.,
yakushi1947.85.1_14
Chukhajian, El.O., Shahkhatuni K.G., Babayan A.T.
Chem. Heterocycl. Compd.,
1989,
25,
512.] doi
14. Абрамян А.А. Количественный микроэлементарный
10.1007/BF00482495
анализ органических соединений,
1963, Ереван:
Айпетрат, с. 178 (на арм. яз.).
7. Ayrapetyan L.V., Chukhajian E.O., Shahkhatuni K.G.,
Chukhajian
El.O. V Научная Конференция
15. Gredy M. Bull. Soc. Chim. Fr., Mem. 1936, 3, 1098.
Synthesis of 6-Bromo-3a,4-dihydrobenzo[f]isoindolinium
Bromides and Their Water-Base Cleavage
E. O. Chukhajian, L. V. Ayrapetyan*, H. S. Mkrtchyan, El. O. Chukhajian, and H. A. Panosyan
The Institute of Organic Chemistry of the Scientific Technological Centre of Organic and Pharmaceutical Chemistry of NAS of
Republic of Armenia, 0014, Armenia, Yerevan, pr. Azatutyan 26
*е-mail: shhl@mail.ru
Received March 15, 2018; revised May 10, 2019; accepted May 15, 2019
Cyclization of allyl[3-(4-bromophenyl)prop-2-ynyl]ammonium bromides under basic catalysis conditions, unlike
propargyl analogs, is realized by heating the reaction mixture at 90-92°C, under these conditions, along with
cyclization, which is the main direction, is also take place a rearrangement-cleavage to the formation of 1-allyl-
p-bromocinnamic aldehyde. In the study was established the favorable effect of substituents which has been at
the nitrogen and bromine atom in the fourth position of the aromatic ring on the cyclization and rearrangement-
cleavage.
Keywords: 1-allyl-p-bromocinnamic aldehyde, allyl[3-(4-bromophenyl)prop-2-ynyl]ammonium bromides, -6-
brom-3a,4-dyhydrobenzo[f]isoindolinium bromides, base-catalyzed intramolecular cyclization, isomeric 2-
dyalkylaminomethyl-3-methyl-, 3-dyalkylaminomethyl-2-methyl-7-bromnaphthalines, rearrangement-cleavage,
water-base cleavage
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019