ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 8, с. 1223-1228
УДК 547.917 + 547.728
ХИРАЛЬНЫЕ БЛОКИ ДЛЯ ПРОСТАНОИДОВ
ТОПОЛОГИИ 7-ОКСАБИЦИКЛО[2.2.1]ГЕПТАНА
© 2019 г. З. Р. Валиуллинаa, Н. А. Ивановаa, О. В. Шитиковаb, **, М. С. Мифтаховa, *
а ФГБУН «Уфимский Институт химии УФИЦ РАН»,
450054, Россия, Республика Башкортостан, г. Уфа, пр. Октября 69
*e-mail: regi_79@mail.ru; bioreg@anrb.ru
b ФГБОУ ВО «Уфимский государственный нефтяной технический университет»,
450062, Россия, Республика Башкортостан, г. Уфа, ул. Космонавтов 1
**e-mail: ovs11@mail.ru
Поступила в редакцию 15 марта 2019 г.
После доработки 31 мая 2019 г.
Принята к публикации 31 мая 2019 г.
Осуществлен синтез метил-(Z)-3-[(2R,3R,4S,5S)-5-(2-метокси-2-оксоэтил)-3,4-изопропилидендиокси-
тетрагидрофурил]-2-пропеноата и изучена его реакция внутримолекулярной карбоциклизации. Показано,
что данная реакция гладко и быстро протекает при действии t-BuOK в ТГФ с образованием трициклов с
транс-ориентированными боковыми метокси- и метоксикарбонилметильными заместителями.
Предложена постадийная схема образования метил-(1R,2R,6S,7R,8R,9R)-9-(2-метокси-2-оксоэтил)-4,4-
диметил-3,5,10-триоксатрицикло[5,2,1,02,6]декан-8-карбоксилата и метил-(1R,2R,6S,7R,8S,9S)-9-(2-метокси-
2-оксоэтил)-4,4-диметил-3,5,10-триоксатрицикло[5,2,1,02,6]декан-8-карбоксилата с транс-расположением
боковых заместителей. Наблюдаемый стереохимический результат реакции интерпретирован как
следствие эпимеризации в С1- и С4-центрах метил-(Z)-3-[(2R,3R,4S,5S)-5-(2-метокси-2-оксоэтил)-3,4-
изопропилидендиокситетрагидрофурил]-2-пропеноата, что в итоге приводит к циклизуемым β,β'-цис-
диастереомеру метил-(Z)-3-[(2R,3R,4S,5S)-5-(2-метокси-2-оксоэтил)-3,4-изопропилидендиокситетрагидро-
фурил]-2-пропеноата и соответствующему α,αʹ-цис-диастереомеру, ведущему к метил-
(1R,2R,6S,7R,8S,9S)-9-(2-метокси-2-оксоэтил)-4,4-диметил-3,5,10-триоксатрицикло[5,2,1,02,6]декан-8-кар-
боксилату.
Ключевые слова: D-рибоза, метоксикарбонилметилентрифенилфосфоран, реакция Виттига, внутри-
молекулярная карбоциклизация, функционализированные 7-оксабицикло[2.2.1]гептаны.
DOI: 10.1134/S0514749219080111
Хиральные функционализированные аддукты
ацетонида 2 [7-10], метоксикарбонилметилентри-
Дильса-Альдера фурана с активированными диено-
фенилфосфораном (5). Вначале реакцией Виттига
филами использованы в синтезе простаноидов
альдегида
4 с фосфораном
5 в CH2Cl2 при
топологии 7-оксабицикло[2.2.1]гептана [1], канта-
комнатной температуре с умеренным выходом
ридина [2], замещенных циклогексанов [3] и др.
была получена Z,E-изомерная смесь
3 в
[4]. Нами синтезирован новый ключевой блок 1 для
соотношении 1:1.
SQ-27986 - агониста простагландиновых DP-ре-
С учетом литературных данных и полученных
цепторов, эффективно снижающего внутриглазное
нами предварительных результатов о предпочти-
давление и ингибирующего агрегацию тромбо-
цитов (схема 1) [5].
Схема 1.
Разработанный подход к бициклу
1 из С-
O
O
гликозида 2 поясняет схема 2. Ключевой стадией
O
CO2H
CO2Me
подхода является внутримолекулярная анионот-
O
ропная циклизация по Михаэлю диэфира 3, полу-
CO2Me
HO
ченного олефинированием альдегида
4
[6] из
1
SQ-27986
1223
1224
ВАЛИУЛЛИНА и др.
Схема 2.
O
O
MeO2C
O
а
б
HO
CO2Me
O
CO2Me
CO2Me
O O
O O
O O
2
4
3
(Z/E = 2:1)
10
O
O
3
4
1
1'
2'
O
2
9
O
в
CO2Me
CO2Me
O
+
O
5
7
CO2Me
6
8
CO2Me
1
6
O
1:6 = 3:2
O
O
CO2Me
CO2Me
7
а, CrO3, Py, CH2Cl2, 20°C, 15 мин; б, Ph3P=CHCO2Me (5), MeOH, -78°C, 1 ч (40% из 2); в, t-BuOK, ТГФ, 0°C, 15 мин.
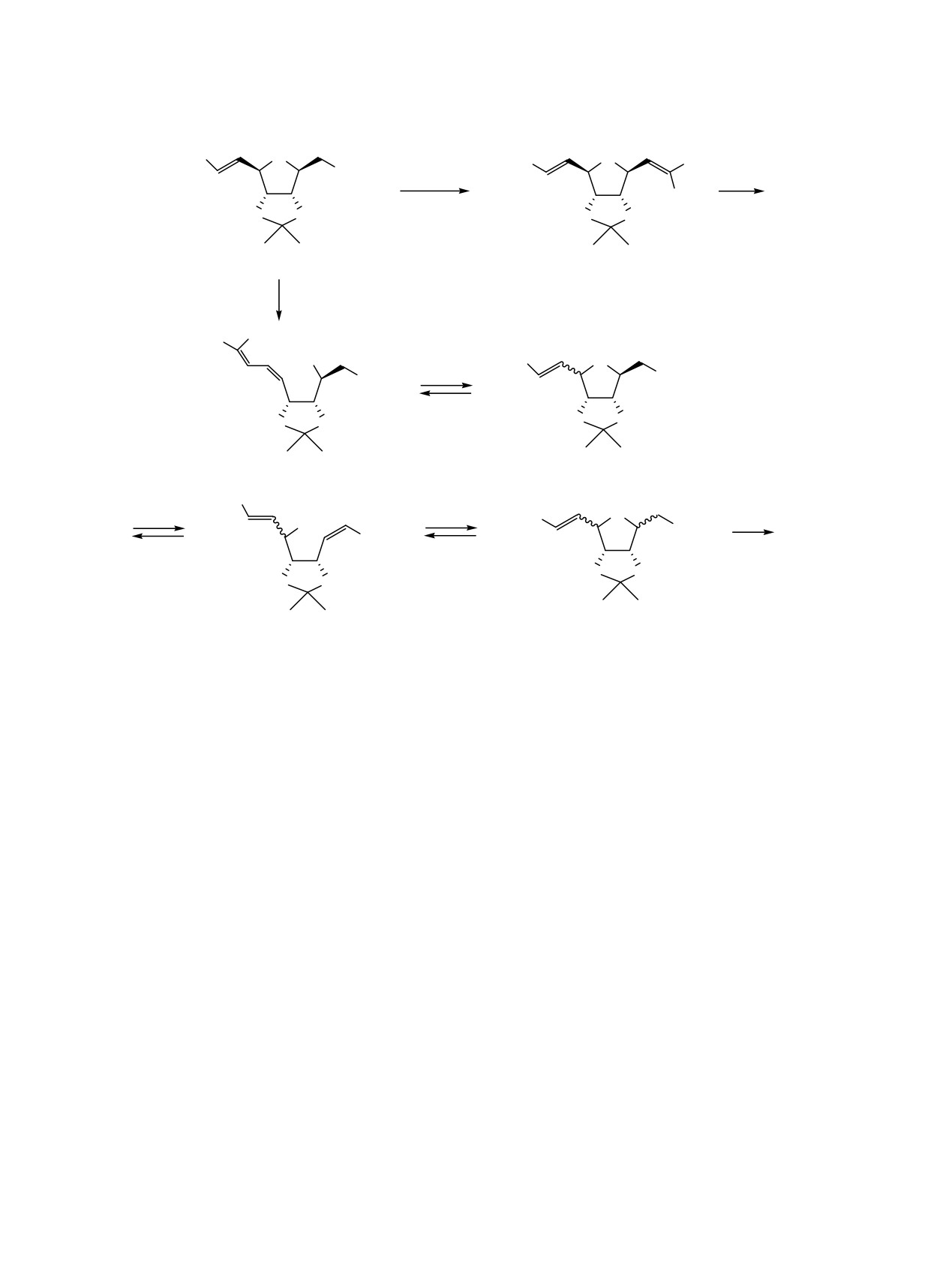
тельности использования в реакциях внутримоле-
химических сдвигов рассматриваемых протонов в
кулярной циклизации Z-изомера
3 дальнейшие
спектрах ЯМР 1Н и химических сдвигов атомов С1′,
исследования были направлены на повышение
С2 и СOOMe, С6 в спектрах ЯМР 13С. Изомер 1 с 8-
селективности олефинирования в сторону образо-
эндо,9-экзо-расположением заместителей имеет
вания Z-изомера
3. При проведении реакции
сильнопольный сдвиг сигнала Н9 и более слабо-
Виттига альдегида 4 с фосфораном 5 в MeOH при -
польные сдвиги сигналов С1′, С2 и Н8 по сравнению
78°С [11] нам удалось достигнуть Z/E соотно-
с 8-экзо,9-эндо-изомером 6 благодаря разным 1,3-
шения, равного 2:1. После хроматографического
цис-взаимодействиям в молекуле. Дополнительным
разделения на колонке с SiO2 каждый изомер
доказательством стереохимического отнесения
соединения 3 был введен в реакцию циклизации.
изомеров служит КССВ протонов Н9 и Н8 с
При этом Е-изомер
3 не вступал в реакцию
узловыми протонами Н1 и Н7соответственно. В
циклизации, а продукт циклизации Z-изомера 3,
случае эндо-ориентации заместителя при С8 протон
полученный с выходом 52 %, представлял собой
экзо-Н8 резонирует в виде дублета дублетов с J7,8
смесь 2 бициклических соединений 1 и 6 (3:2, ЯМР
5.8 Гц, в то время как протон эндо-Н9 не имеет
1Н). Критерием установления стереохимии молекул
КССВ с узловым протоном Н1, что согласуется с
служили величины константы спин-спинового
литературными данными [12].
взаимодействия (КССВ) протонов Н2, Н6 и Н8, Н9.
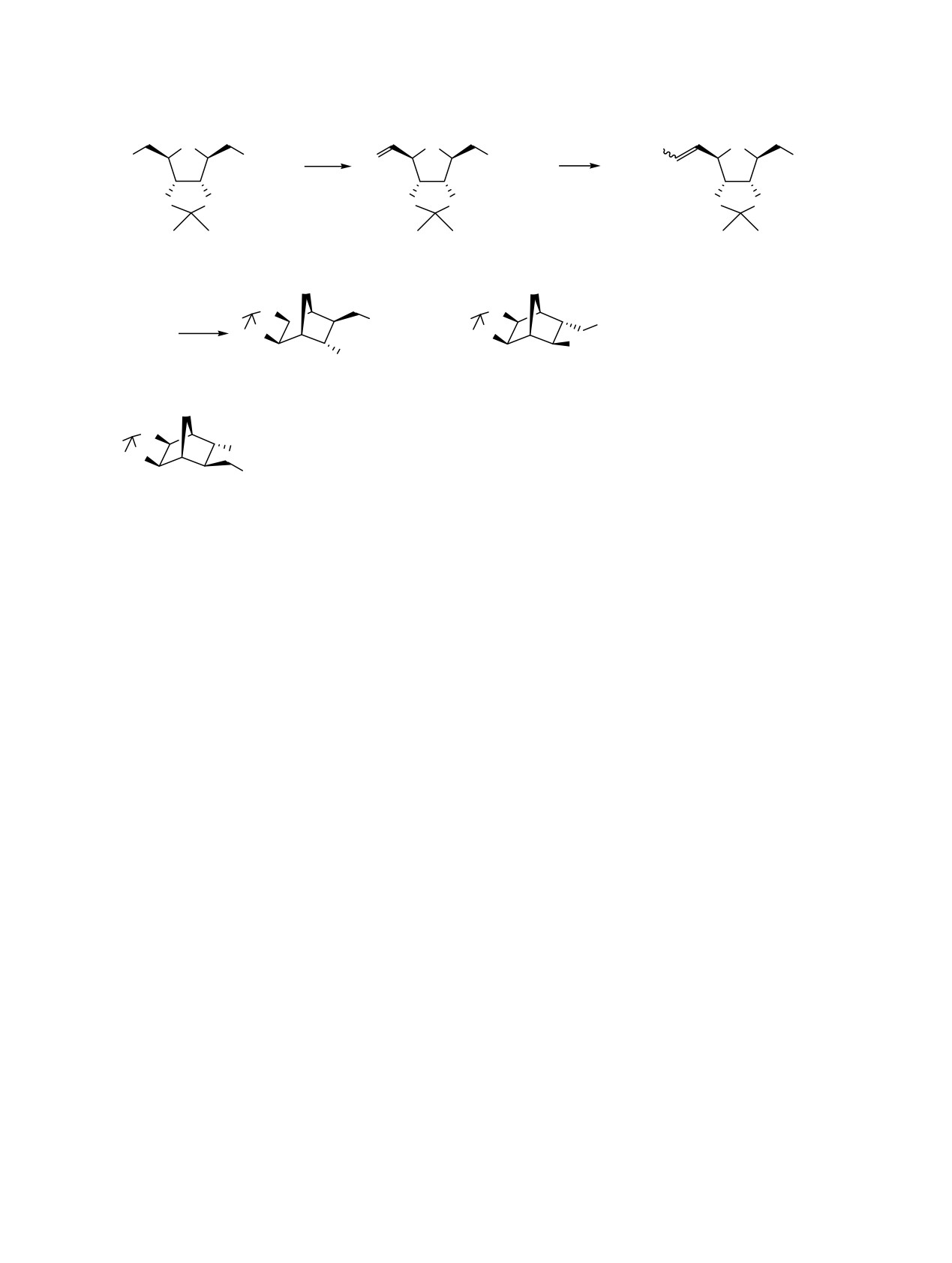
Величины J2,6 10.9 Гц и J2,6 10.0 Гц соединений 1 и
Объяснение образования бициклов
1 и
6 с
6 соответственно свидетельствуют об экзо-ориен-
транс-расположением заместителей при С8 и С9
тации
2,6-ацетонидной группы. О транс- (или
заключается в следующем. На пути к соединению 1
эндо-экзо)-расположении боковых заместителей
генерируемый из эфира 3 карбанион А инициирует
свидетельствуют J8,9 4.5 Гц и J8,9 5.4 Гц (лит.
внутримолекулярную циклизацию с сохранением
данные [12]: Jэкзо,эндо 2.5-5.0 Гц, Jдиэндо 9-9.5 Гц,
конфигурации при С4. В образовании 6 необходима
Jдиэкзо 12.5 Гц). Основной изомер 1 имеет эндо-
инверсия в С4- и С1-центрах соединения 3. Поста-
СО2Ме-, экзо-СН2СО2Ме-ориентацию заместителей,
дийный маршрут к 6 поясняет схема 3. Здесь гене-
что соответствует стереохимии в целевом соедине-
рируется диенолят В, следующие за этим стадии
нии SQ-27986; минорный изомер 6 - экзо-СО2Ме-,
циклизации и дециклизации А→В→С→D→F
эндо-СН2СО2Ме-ориентацию. Данное отнесение
приводят к изомерной смеси F, в которой цикли-
изомеров сделано на основании сопоставления
зуются лишь 1,4-цис-изомеры с образованием 1 и
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
ХИРАЛЬНЫЕ БЛОКИ ДЛЯ ПРОСТАНОИДОВ ТОПОЛОГИИ 7-ОКСАБИЦИКЛО[2.2.1]ГЕПТАНА
1225
Схема 3.
_
MeO2C
O
4
1
MeO2C
O
O
CO2Me
t-BuOK
3
2
1
OMe
O O
O O
3
A
t-BuOK
_
O
MeO
HO
MeO2C
O
CO2Me
CO2Me
O O
O O
B
C
MeO2C
MeO2C
O
OH
CO2Me
1 + 6
CO2Me
O O
O O
D
F
6. При этом кажущаяся возможной в этой
налов остаточных протонов в CDCl3 (δН 7.27 м.д.).
«ситуации» структура 7 исключается из рассмот-
Углы вращения измерены на поляриметре «Perkin-
рения, поскольку она энантиомерна соединению 1
Elmer 341 M» (США). Элементный анализ выпол-
(схема 2).
нен на CHNS-анализаторе «Evro-EA 3000» (Италия).
Протекание реакций контролировали методом ТСХ
Таким образом, нами продемонстрирована
на пластинах «Sorbfil» (Россия) с обнаружением
возможность внутримолекулярной карбоцикли-
веществ с помощью
10% раствора анисового
зации полученного из D-рибозы блока 3 с выходом
альдегида в этаноле с добавкой серной кислоты.
к ожидаемым оптически активным трициклам,
Очистка растворителей осуществлена по стандарт-
представляющим интерес в качестве ключевых
ным методикам [13]. Исходное соединение было
синтонов в синтезе аналогов простаноидов с 7-
синтезировано из коммерчески доступной D-рибозы
оксабицикло[2.2.1]гептановым остовом, полигид-
фирмы
«Lancaster» согласно
[7-10]. Продукты
роксициклогексенов и др.
синтеза выделяли методом колоночной хроматог-
рафии на силикагеле фирмы Macherey-Nayel
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(Германия) (30-60 г адсорбента на 1 г вещества).
ИК спектры сняты на спектрофотометре
Превращение С-гликозида 2 в олефины Z-3 и
«Shimadzu IRPrestige-21» (Япония) в пленке или
E-3. К раствору 25 мл безводного CH2Cl2 и 1.64 мл
вазелиновом масле. Спектры ЯМР записаны на
безводного пиридина добавляли 1.01 г (10.1 ммоль)
спектрометре Bruker AM-300 (Германия) [рабочие
растертого CrO3 в течение 10 мин в атмосфере
частоты 300.13 (1H) и 75.47 (13С) МГц] в CDCl3, в
аргона и перемешивали смесь 40 мин, добавляли
спектре ЯМР 13С за внутренний стандарт принято зна-
по каплям раствор 0.20 г (0.80 ммоль) спирта 2 в 2 мл
чение сигналов CDCl3 (δС 77.00 м.д.), в спектре ЯМР
безводного CH2Cl2. Реакционную смесь перемеши-
1H за внутренний стандарт принято значение сиг-
вали 20 мин и выливали в холодный насыщенный
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
1226
ВАЛИУЛЛИНА и др.
раствор NaHCO3. Органический слой отделяли, из
ОМе), 3.74 с (3Н, ОМе), 4.36 д.д.д (1Н, Н5', 3J5',4' 3.9,
водного слоя продукт экстрагировали CH2Cl2. В
3J5',1"B
5.7, 3J5',1"A
6.7), 4.49 м (2Н, Н3', Н4'), 4.75 м
объединенные органические экстракты добавляли
(1Н, Н2'), 6.08 д.д (1Н, Н2, 4J2,2' 1.5, 3J2,3 15.7), 6.96
1.00 г SiO2, активированного угля и перемешивали
д.д.д (1Н, Н3, 3J3,2' 4.6, 3J3,2 15.7). Спектр ЯМР 13C
15 мин, затем добавляли Na2SO4, перемешивали
(CDCl3), δ, м.д.: 25.51 (Ме), 27.39 (Ме), 38.07 (С1"),
10 мин, фильтровали, упаривали.
51.72 (ОМе), 51.92 (ОМе), 80.82 (С5'), 83.27 (С2'),
84.20 (С4'), 84.55 (С3'), 115.11 (Сi-Pr), 121.56 (С2),
а. К раствору сырого альдегида 4 в 10 мл CH2Cl2
144.62 (С3), 166.43 (С=О), 170.65 (С=О). Найдено,
порциями добавляли 0.40 г (1.20 ммоль) метокси-
%: C 55.94; H 6.75. C14H20O7. Вычислено, %: C
карбонилметилентрифенилфосфорана
(5)
при
55.99; H 6.71.
комнатной температуре и перемешивали 15 мин.
После концентрирования раствора остаток хрома-
Взаимодействие олефинов Z-3 и E-3 с t-BuOK.
тографировали на SiO2 (петролейный эфир - этил-
а. К раствору 0.19 г (0.62 ммоль) олефинов Z-3 и
ацетат,
95:5). Получали
0.048 г
(20%) смеси
E-3 в 10 мл безводного ТГФ добавляли 0.1 г
олефинов Z-3 и E-3 в соотношении 1:1 (ЯМР H1).
(0.92 ммоль) t-BuOK при 0°С. Реакционную смесь
перемешивали 20 мин и отфильтровывали. После
б. К раствору сырого альдегида 4 в 10 мл MeOH
концентрирования раствора на роторном
порциями добавляли 0.40 г (1.20 ммоль) метокси-
испарителе остаток разбавляли этилацетатом,
карбонилметилентрифенилфосфорана (5) при -78°С
промывали H2O, насыщенным раствором NaCl,
и перемешивали
1 ч. После концентрирования
сушили Na2SO4. После упаривания раствора и
раствора остаток хроматографировали на SiO2
очистки остатка колоночной хроматографией на
(петролейный эфир-этилацетат,
95:5). Получали
SiO2 (петролейный эфир-этилацетат, 95:5) получали
0.064 г (26.6%) Z-олефина Z-3 и 0.032 г (13.3%) E-
0.047 г (25%) смеси бициклов 1, 6 в соотношении
олефина E-3.
3:2 (ЯМР H1) и 0.019 г (10%) исходного олефина
Метил-(Z)-3-[(2R,3R,4S,5S)-5-(2-метокси-2-
E-3.
оксоэтил)-3,4-изопропилидендиокси-тетрагид-
б. В аналогичных условиях из 0.12 г (0.39 ммоль)
рофурил]-2-пропеноат (Z-3). Rf
0.48 (петро-
20
Z-изомера Z-3 получали
0.062 г
(52%) смеси
лейный эфир-этилацетат, 7:3, 3 прогона),
[α]
бициклов 1, 6 в соотношении 3:2 (ЯМР 1H).
–34.4° (c 0.45, CHCl3). ИК спектр, ν, см-1: 832 (цис
HC=CH),
1730,
1740 (С=О). Спектр ЯМР
1Н
Метил-(1R,2R,6S,7R,8R,9R)-9-(2-метокси-2-
(СDCl3), δ, м.д. (J, Гц): 1.34 с (3Н, Ме), 1.61 с (3Н,
оксоэтил)-4,4-диметил-3,5,10-триокса-трицикло-
Ме), 2.61 д.д (1Н, H1"A, 3J1"A,5' 7.2, 2J1"A,1"В 15.6), 2.70
[5,2,1,02,6]декан-8-карбоксилат (1). Rf 0.51 (петро-
20
д.д (1Н, H1"B, 3J1"B,5' 5.7, 2J1"A,1"В 15.6), 3.72 с (3Н,
лейный эфир-этилацетат, 7:3, 2 прогона),
[α]
ОМе), 3.75 с (3Н, ОМе), 4.38 д.д.д (1Н, Н5', 3J5',4' 3.4,
+28.3° (c 0.82, CHCl3). ИК спектр, ν, см-1: 1150
3J5'1"B 5.7, 3J5',1"A 7.2), 4.54 м (2Н, Н3', Н4'), 5.48 д.д.д
(C-O-С),
1714,
1740 (C=O). Спектр ЯМР
1Н
(1Н, Н2', 4J2',2 1.6, 3J2',3' 3.3,3J2',3 7.7), 5.91 д.д (1Н, Н2,
(СDCl3), δ, м.д. (J, Гц): 1.28 с (3Н, Ме), 1.65 с (3Н,
4J2,2' 1.6, 3J2,3 11.7), 6.18 д.д.д (1Н, Н3, 3J3,2' 7.7, 3J3,2
Me), 2.35 д.д (1Н, H1'A, 3J1'A,9 10.0, 2J1'A,1'В 17.6), 2.57
11.7). Спектр ЯМР 13C (CDCl3), δ, м.д.: 25.69 (Ме),
д.д (1Н, H1'B, 3J1'B,9 10.0, 2J1'B,1'A 17.6), 2.45 м (1Н,
27.39 (Ме), 38.31 (С1"), 51.69 (ОМе), 51.96 (ОМе),
H9), 2.63 д.д (1H, H8, 3J8,9 4.5, 3J8,7 5.8), 3.67 с (3H,
81.00 (С5'), 81.14 (С2'), 84.58 (С4'), 86.57 (С3'), 114.53
OMe), 3.73 с (3H, OMe), 4.20 с (1Н, H1), 4.33 д (1Н,
(Сi-Pr), 121.62 (С2), 146.97 (С3), 165.84 (С=О), 170.77
H6, 3J6,2 10.9), 4.36 д (1Н, H2, 3J2,6 10.9), 4.55 д (1Н,
(С=О). Найдено, %: C 55.94; H 6.75. C14H20O7.
H7, 3J7,8 5.8). Спектр ЯМР 13C (CDCl3), δ, м.д.: 25.00
Вычислено, %: C 55.99; H 6.71.
(Ме), 25.79 (Ме), 37.34 (С1'), 37.98 (С9), 50.09 (С8),
51.75 (OMe), 52.24 (OMe), 79.30 (С2), 79.97 (С6),
Метил-(E)-3-[(2R,3R,4S,5S)-5-(2-метокси-2-
81.50 (С1), 84.18 (С7), 111.48 (Сi-Pr), 171.24 (С=O),
оксоэтил)-3,4-изопропилидендиокси-тетрагид-
172.03 (С=O). Найдено,
%: C
55.95; H
6.77.
рофурил]-2-пропеноат (E-3). Rf
0.54 (петро-
20
C14H20O7. Вычислено, %: C 55.99; H 6.71.
лейный эфир-этилацетат, 7:3, 3 прогона),
[α]
+3.4° (c 1.0, CHCl3). ИК спектр, ν, см-1: 935 (транс
Метил-(1R,2R,6S,7R,8S,9S)-9-(2-метокси-2-
HC=CH),
1714,
1735 (C=O). Спектр ЯМР
1Н
оксоэтил)-4,4-диметил-3,5,10-триокса-трицикло-
(СDCl3), δ, м.д. (J, Гц): 1.33 с (3Н, Ме), 1.55 с (3Н,
[5,2,1,02,6]декан-8-карбоксилат (6). Rf 0.36 (петро-
20
Ме), 2.63 д.д (1Н, H1"A, 3J1"A,5' 6.7, 2J1"A,1"В 15.8), 2.70
лейный эфир-этилацетат, 7:3, 2 прогона),
[α]
д.д (1Н, H1"B, 3J1"B,5' 5.7, 2J1"B,1"A 15.8), 3.72 с (3Н,
-18.1° (c 1, CHCl3). ИК спектр, ν, см-1: 1185 (C-O-С),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
ХИРАЛЬНЫЕ БЛОКИ ДЛЯ ПРОСТАНОИДОВ ТОПОЛОГИИ 7-ОКСАБИЦИКЛО[2.2.1]ГЕПТАНА
1227
1715, 1749 (C=O). Спектр ЯМР 1Н (СDCl3), δ, м.д.
3. Mueller R.H., Wang S., Pansegrau P.D., Jannotti J.Q.,
(J, Гц): 1.29 с (3Н, Ме), 1.47 с (3Н, Me), 2.03 д (1Н,
Poss M.A., Thottathil J.K., Singh J., Humora M.J.,
Kissick T.P., Boyhan B. Org. Proc. Res. Dev. 1997, 1,
H8, 3J8,9
5.4), 2.38 д.д (1Н, H1'A, 3J1'A,9
8.6, 2J1'A,1'В
14. doi 10.1021/op960034k
15.7), 2.52 д.д (1Н, H1'B, 3J1'B,9 8.6, 2J1'B,1'A 15.7), 2.80
4. Misra R.N., Brown B.R., Han W.Ch., Harris D.N.,
т.т (1Н, H9, 3J9,8 5.4, 3J9,4 5.4, 3J9,1'A 8.6, 3J9,1'B 8.6),
Hedberg A., Webb M.L., Hall S.E. J. Med. Chem. 1991,
3.70 с (3H, OMe), 3.72 с (3H, OMe), 4.30 д (1Н, H6,
34, 2882. doi 10.1021/jm00113a030
3J6,2 10.0), 4.50 д (1Н, H2, 3J2,6 10.0), 4.62 с (1Н, H7),
5. Seiler S., Brassard C.L., Federichi M.E. Prostaglandins.
4.99 д (1Н, H1, 3J1,9 5.4). Спектр ЯМР 13C (CDCl3), δ,
1990, 40, 119. doi 10.1016/0090-6980(90)90078-A
м.д.: 25.20 (Ме), 25.82 (Ме), 34.31 (С1'), 38.75 (С9),
6. Chir J., Wub P., Zou W., BhasinM., Juang W.-Fu,
48.56 (OMe), 51.75 (OMe), 53.37 (С8), 78.41 (С2),
Guo Ch.-Qi, Wu A.-T. Carbohydr. Res. 2009, 344,
80.98 (С6), 81.79 (С7), 81.96 (С1), 111.86 (Сi-Pr),
1639. doi 10.1016/j.carres.2009.05.029
171.44 (С=O), 172.31 (С=O).
7. Ohrui H., Jones G.H., Moffatt J.G., Maddox M.L.,
Christensen A.T., Byram S.K. J. Am. Chem. Soc. 1975,
БЛАГОДАРНОСТИ
97. 4602. doi 10.1021/ja00849a023
8. Carstensen E.V., Duyustee H.I., Van der Marel G.A.,
Анализы выполнены на оборудовании ЦКП
Van Boom J.H., Nielsen J., Overkleeft H.S., Overhand M.
«Химия» УфИХ РАН.
J. Carbohydr. Chem. 2003, 22, 241. doi 10.1081/CAR-
120021703
ФОНДОВАЯ ПОДДЕРЖКА
9. Иванова Н.А., Валиуллина З.Р., Шитикова О.В.,
Мифтахов М.С.Изв. АН. Сер. хим. 2005, 54, 2610.
[Ivanova, N.A., Valiullina, Z.R., Shitikova, O.V.,
Работа выполнена по теме АААА-А17-
Miftakhov M.S. Russ. Chem. Bull. 2005, 54, 2698.] doi
117011910032-4 госзадания.
10.1007/s11172-006-0179-1
10. Иванова Н.А., Валиуллина З.Р., Шитикова О.В.,
КОНФЛИКТ ИНТЕРЕСОВ
Мифтахов М.С. ЖОрХ. 2006, 42, 1713. [Ivanova, N.A.,
Valiullina, Z.R., Shitikova, O.V., Miftakhov M.S. Russ.
Авторы заявляют об отсутствии конфликта
J. Org. Chem.
2006,
42,
1701.] doi
10.1134/
интересов.
S1070428006110169
11. Krief A., Dumont W. Tetrahedron Lett. 1988, 29, 1083.
СПИСОК ЛИТЕРАТУРЫ
doi 10.1016/0040-4039(88)85341-3
12. Pretsch E., Clerc T., Seibl J., Simon W. Spectral Data
1. Vogel P., Cossy J., Plument J., Arjona O. Tetrahedron.
for Structure Determination of Organic Compounds. Berlin,
1999, 55, 13521. doi 10.1016/S0040-4020(99)00845-5
Heidelberg, New York, Tokyo: Springer-Verlag, 1983. 265.
2. Baba Y., Hirukawa N., Tanohira N., Sodeoka M .J. Am.
13. Гордон А., Форд Р. Спутник химика. М.: Мир, 1976.
Chem. Soc. 2003, 125, 9740. doi 10.1021/ja034694y
542.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
1228
ВАЛИУЛЛИНА и др.
Chiral Blocks for Prostanoids of 7-Oxabicyclo[2.2.1]heptane
Topology
Z. R. Valiullinaа, N. A. Ivanovaа, O. V. Shitikovab, **, M. S. Miftakhovа, *
а Ufa Institute of Chemistry UFRS RAS, 450054, Russia, Republic of Bashkortostan, Ufa, pr. Oktyabrya 69
*e-mail: bioreg@anrb.ru
б Ufa State Petroleum Technological University, 450062, Russia, Republic of Bashkortostan, Ufa, St. Kosmonavtov 1
**e-mail:ovs11@mail.ru
Received March 15, 2019; revised May 31, 2019; accepted May 31, 2019
Methyl-(Z)-3-[(2R,3R,4S,5S)-5-(2-methoxy-2-oxoethyl)-3,4-isopropylidenedioxytetrahydro-furyl]-2-propenoate
was synthesized and its intramolecular carbacyclization reaction was studied. This reaction proceeds smoothly
and quickly under the action of t-BuOK in THF, leading to three cycles with trans-oriented methoxy and
methoxycarbonylmethyl side substituents. A stepwise route for the formation of methyl-(1R,2R,6S,7R,8R,9R)-9-
(2-methoxy-2-oxoethyl)-4,4-dimethyl-3,5,10-trioxatricyclo
[5,2,1,02,6]decane-8-carboxylate and methyl-
(1R,2R,6S,7R,8S,9S)-9-(2-methoxy-2-oxoethyl)-4,4-dimethyl-3.5,10-trioxatricyclo[5,2,1,02,6]decane-8-carboxylate
with trans position of side substitutes is proposed. The observed stereochemical result of the reaction is
interpreted as a consequence of epimerization in the C1 and C4 centers of methyl-(Z)-3-[(2R,3R,4S,5S)-5-(2-
methoxy-2-oxoethyl)-3,4-isopropylidenedioxytetrahydrofuryl]-2-propenoate which ultimately leads to the
cyclizable β,βʹ-cis-diastereomer of methyl-(Z)-3-[(2R,3R,4S,5S)-5-(2-methoxy-2-oxoethyl)-3,4-isopropylidene-
dioxytetrahydrofuryl]-2-propenoate and the corresponding α,αʹ-cis diastereomer leading to methyl-
(1R,2R,6S,7R,8S,9S)-9-(2-methoxy-2-oxoethyl)-4,4-dimethyl-3,5,10-trioxatricyclo[5,2,1,02,6]decane-8-carboxylate.
Keywords: D-ribose, methoxycarbonylmethylenetriphenylphosphorane, Wittig reaction, intramolecular carba-
cyclization, functionalized 7-oxabicyclo [2.2.1] heptanes
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019