ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 8, с. 1261-1272
УДК 547.239
СИНТЕЗ БИЦИКЛИЧЕСКИХ ИЗОЦИАНАТОВ И
БИОИЗОСТЕРИЧЕСКИХ 1,3-ДИЗАМЕЩЕННЫХ
МОЧЕВИН НА ИХ ОСНОВЕ - ИНГИБИТОРОВ
РАСТВОРИМОЙ ЭПОКСИДГИДРОЛАЗЫ
© 2019г. В. В. Бурмистровa, В. С. Дьяченкоa, b, *, Е. В. Рассказоваb, Г. М. Бутовa
a Волжский политехнический институт (филиал) ФГБОУ ВО ВолгГТУ,
404121, Россия, г. Волжский, ул. Энгельса д. 42а
b ФГБОУ ВО «Волгоградский государственный технический университет»,
400005, Россия, г. Волгоград, пр. Ленина д. 28
*e-mail: butov@volpi.ru
Поступила в редакцию 28 марта 2019 г.
После доработки 8 мая 2019 г.
Принята к публикации 30 мая 2019 г.
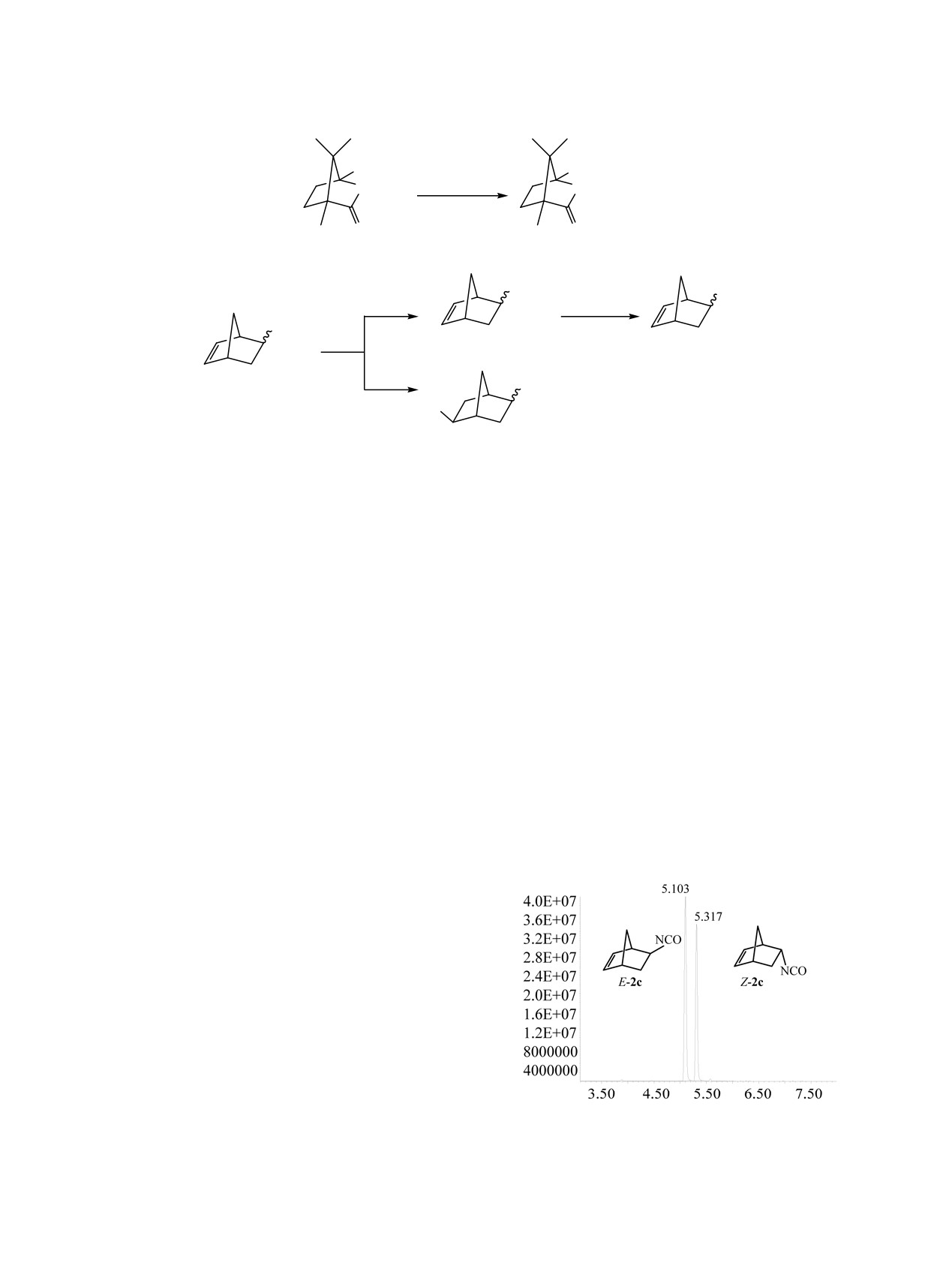
По реакции Курциуса из соответствующих карбоновых кислот получены (1S)-4,7,7-триметил-3-оксо-2-
оксабицикло[2.2.1]гептан-1-изоцианат и бицикло[2.2.1]гепт-5-ен-2-изоцианат. На основе синтезирован-
ных изоцианатов получены две серии биоизостерических 1,3-дизамещеных мочевин - потенциальных
ингибиторов растворимой эпоксидгидролазы человека. Выходы целевых продуктов составили 74-93%.
Ключевые слова: изоцианаты, 1,3-дизамещенные мочевины, растворимая эпоксидгидролаза, sEH.
DOI: 10.1134/S0514749219080160
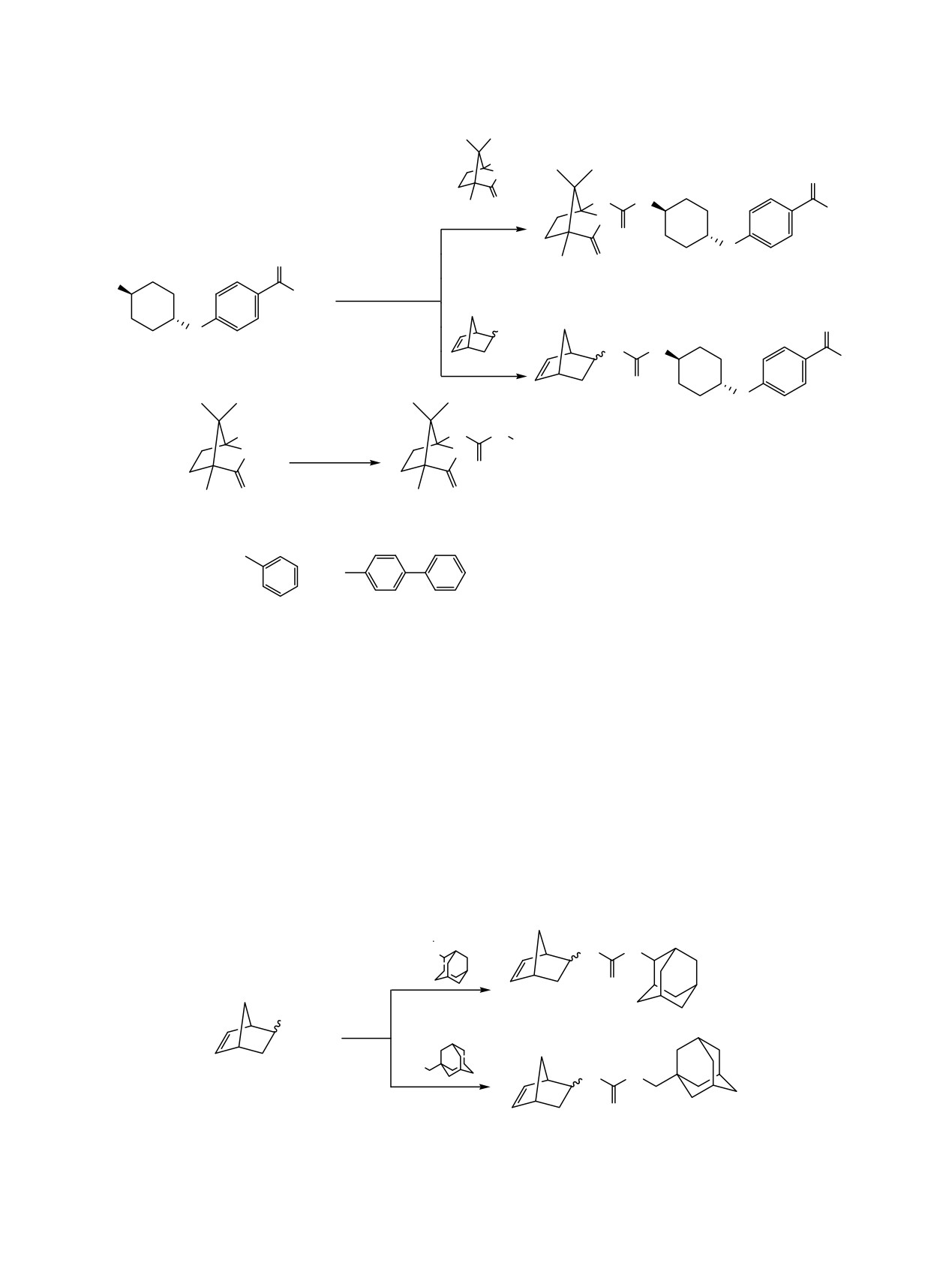
В последние годы перспективной мишенью для
ков ингибиторов предпринимаются попытки по моди-
лечения воспалительных процессов является
фикации адамантильного радикала и введению
растворимая эпоксидгидролаза (sEH) [1]. Кроме
мостиковых групп между уреидной группой [6-9].
того ингибирование sEH позволяет сохранить высо-
кую концентрацию метаболитов арахидоновой кисло-
Липофильность одного из фрагментов моле-
ты, что может быть использовано в лечении заболе-
кулы ингибиторов sEH (так называемая «левая»
ваний почек и гипертонической болезни [2, 3]. Функ-
часть молекулы [10] является необходимым требо-
циональные производные адамантана широко приме-
ванием для достижения высокой ингибирующей
няются в медицинской химии [4], поэтому не удиви-
активности [11]. Она же является причиной низкой
тельно, что адамантилсодержащие 1,3-дизамещен-
водорастворимости и делает такие молекулы
ные мочевины систематически исследуются в качест-
мишенями для цитохромов P450 [6]. На наш взгляд
ве ингибиторов sEH [5, 6]. Однако, такие соедине-
липофильность адамантильной группы не всегда
ния характеризуются низкой водорастворимостью
является оптимальной при связывании в полости
и быстрым метаболизмом. Для устранения недостат-
фермента (схема 1).
Схема 1.
1
O
1
O
R
1
N
N
H
H
O
1
2
3
Левая часть
Правая часть
1261
1262
БУРМИСТРОВ и др.
Таблица 1. Расчетные значения коэффициента липофильности для фрагментов 1 и 2, и адамантильного радикала 3.
Фрагмент
miLogPа
LogPб
1, С9Н13О2
0.80
1.68
2, С7Н9
2.11
1.21
3, С10Н15
3.73
2.54
В последнее время в медицинской химии в
Расчётные коэффициенты липофильности,
дизайне биологически активных молекул широко
полученные по двум независимым алгоритмам,
используются подходы, основанные на биоизосте-
показывают, что адамантильный радикал 3 являет-
рической замене различных групп
[12]. Такие
ся наиболее липофильным из трех представленных
замены позволяют регулировать как непосредст-
структур (табл. 1).
венно биологическую активность, так и физико-
Для синтеза
1,3-дизамещенных мочевин из
химические свойства исследуемых молекул. По
хлорангидрида
(1S)-4,7,7-триметил-3-оксо-2-окса-
нашему мнению, высоких значений ингибирующей
бицикло[2.2.1]гептан-1-карбоновой кислоты (1a) и
активности можно достигнуть, проведя биоизосте-
бицикло[2.2.1]гепт-5-ен-2-карбоновой кислоты (2a)
рическую замену адамантана на менее липофиль-
по реакции Курциуса
[13] были получены
ные фрагменты.
соответствующие изоцианаты 1b и 2c (схема 2).
Исследования по оценке влияния липофиль-
Очистку продуктов реакции осуществляли вакуум-
ности «левой» части молекулы на связывание в
ной перегонкой. Чистоту соединений контролиро-
гидрофобном кармане sEH ранее не проводились.
вали методом хромато-масс-спектрометрии, состав
В качестве кандидатов на такую замену нами были
и строение - ЯМР-спектроскопией на ядрах 1Н и
выбраны (1S)-4,7,7-триметил-2-оксабицикло[2.2.1]-
13С, масс-спектрометрией и элементным анализом.
гептанон-3 (1) и бицикло[2.2.1]гептен-2 (2, норбор-
Высокий выход соединения 1b 89% свидете-
неновый фрагмент).
льствует об устойчивости лактамной связи в усло-
Замена адамантильной группы на указанные
виях реакции к хлористому тионилу, высокой
фрагменты
1 и
2 позволяет реализовать два
селективности, а также подтверждает эффектив-
принципиально различных подхода к снижению
ность усовершенствованной нами ранее реакции
липофильности «левой» части ингибитора. Так,
Курциуса [13].
фрагмент 1, хотя и превышает по молекулярной
Синтез изоцианата 2с из норборненовой кисло-
массе адамантильный радикал, имеет в своей
ты 2a и хлористого тионила, осуществляемый двух
структуре два атома кислорода, которые являются
стадийным методом, протекал не так селективно,
акцепторами водородных связей (HBA), а также
как для изоцианата 1b. Методом хромато-масс-
содержит меньшее количество атомов углерода.
спектрометрии в продуктах реакции обнаружен
Снижение липофильности норборненового
хлорангидрид 2d в соотношении 2b:2d ~19:1. По-
фрагмента 2 происходит за счет уменьшения числа
видимому, выделяющийся в процессе реакции
углеродных атомов с десяти для адамантильной
хлористый водород вступал в реакцию по двойной
группы до семи в фрагменте 2. Норборненовый
связи. Поэтому, полученный хлорангидрид
фрагмент
2 содержит также двойную связь,
бицикло[2.2.1]гепт-5-ен-2-карбоновой кислоты 2b,
которая ранее не исследовалась в ингибиторах.
очищали от примеси хлорангидрида 2d перегонкой
Кроме того, наличие двойной связи позволяет
в вакууме.
провести ее дальнейшую модификацию липофиль-
ной части для регулирования свойств ингибиторов.
Очищенный хлорангидрид 2b в растворе толуола
Общим для фрагментов 1 и 2 является также их
добавляли к суспензии азида натрия и осуществ-
большая конформационная подвижность, по
ляли перегруппировку Курциуса. ХМС-спектромет-
сравнению с жесткой каркасной структурой
рия изоцианата 2с показала наличие смеси двух эндо-
адамантильной группы, что может обеспечить
и экзо-изомеров (см. рисунок), так как исходная кар-
лучшее связывание в полости фермента.
боновая кислота
2а представляла собой также
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
СИНТЕЗ БИЦИКЛИЧЕСКИХ ИЗОЦИАНАТОВ
1263
Схема 2.
C(O)Cl
NaN3,
NCO
толуол, 2 ч
O
O
O
O
1a
1b
C(O)ClNaN
NCO
3,
толуол, 2 ч
COOHSOCl2
2 ч
2b, 95%
2c
_SO2
_HCl
C(O)Cl
2a
Cl
2d, 5%
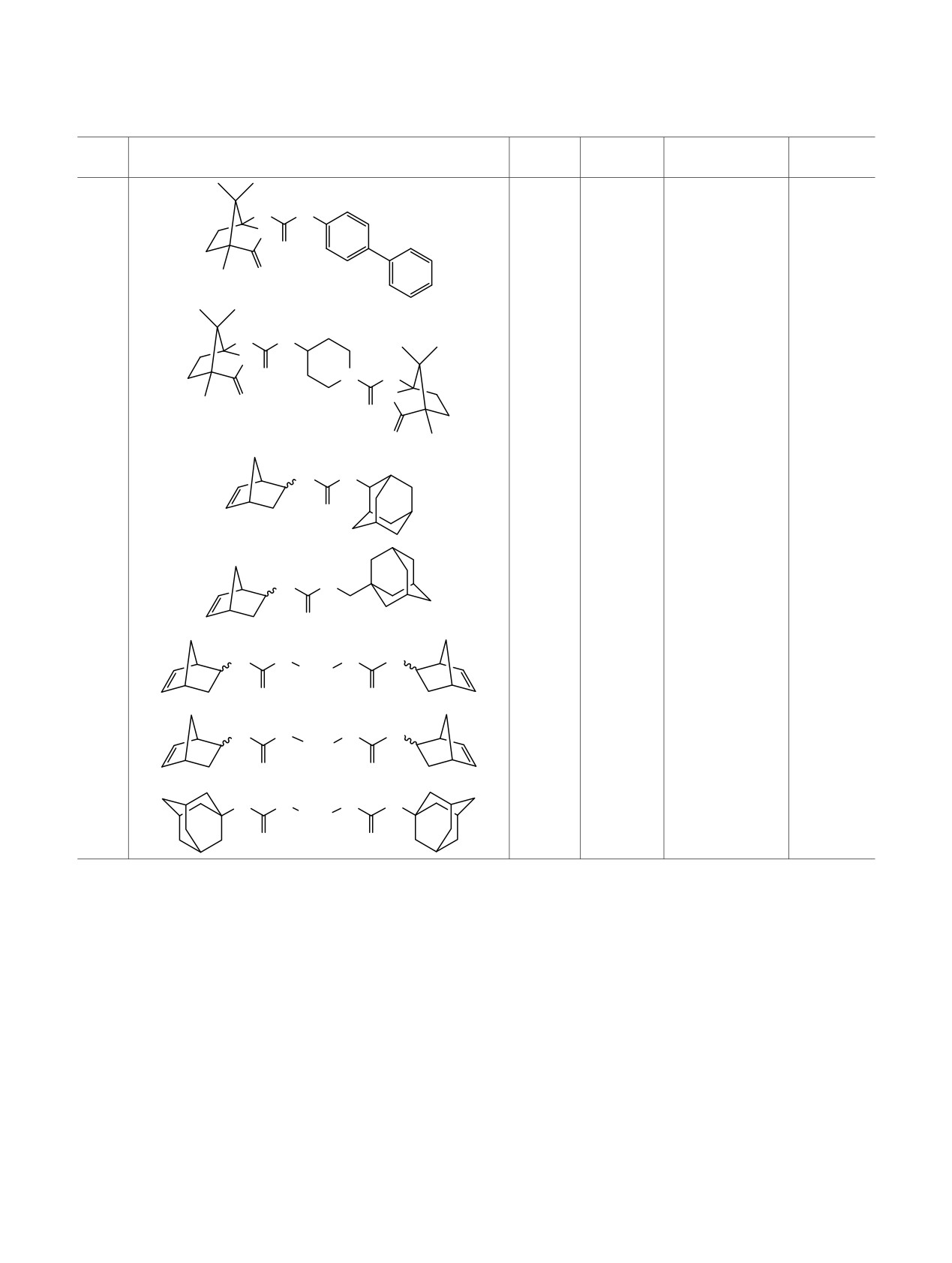
смесь эндо- и экзо-изомеров в примерно равном
Кроме того, в реакцию с изоцианатом 2c вводили
соотношении. На хроматограмме (см. рисунок) время
2-аминоадамантан и
1-аминометиладамантан
удерживания эндо- и экзо-изомеров изоцианата 2с
(схема 4). Таким образом, совместное присутствие
отличается на 14 с. Таким образом, синтез изоциа-
в структуре ингибитора норборненового и адаман-
ната 2с по реакции Курциуса не привел к какому-
тильного фрагмента, позволит изучать конкурент-
либо изменению соотношения изомеров E-2с и Z-2c.
ную ориентацию липофильной части молекулы
Масс-спектры изомеров E-2с и Z-2c идентичны
ингибитора в активном центре фермента.
[(Iотн, %): 135 (0.6) [M]+, 107 (11.8) [M - CO]+, 91 (10.3)
2-Аминоадамантан вводился в реакцию в виде
[M - HNCO]+, 66 (100) [M - CH2-CH-NCO]+].
гидрохлорида, а 1-аминометиладамантан в виде
Известно [14], что экзо-изомеры производных
свободного основания. При синтезе мочевины 4c
норборнена менее стерически затруднены, и,
сразу после смешения реагентов наблюдалось
следовательно, будут выходить из хроматогра-
обильное выпадение осадка целевой мочевины, что
фической колонки перед эндо-изомерами. Изомер-
говорило о высокой скорости реакции, которая
ные изоцианаты находятся в соотношении 55.5%
завершилась за 4 ч с образованием мочевины 4с с
(экзо-) и 44.5% (эндо-). В дальнейших реакциях с
выходом 82%. Реакция с участием гидрохлорида 2-
аминами изоцианат 2с использовался в качестве
аминоадамантана протекала значительно медлен-
смеси изомеров E-, Z- без их разделения.
нее (12 ч), однако выход мочевины 4b оказался
более высоким - 93%.
В числе аминов, использованных в реакциях с
изоцианатами 1b и 2c, была использована транс-4-
аминоциклогексилоксибензойная кислота, так как,
ингибиторы, содержащие данный фрагмент, пока-
зывали очень высокую ингибирующую активность
в предыдущих исследованиях [6]. Другие исходные
амины, содержали в своей структуре фенильный и
4-бифенильный заместители, позволяющие выпол-
нить сопоставительный анализ активности ингиби-
рования при замене адамантильного радикала, не
зависящий от связывания
«правой» части
молекулы ингибитора (схема 3).
Выходы мочевин 3a-c и 4а составляли 74-90%.
Все полученные соединения - твердые вещества,
Хроматограмма (Е,Z)бицикло[2.2.1]гепт-5-ен-2-изоциа-
плавящиеся без разложения (табл. 2).
натa 2c.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
1264
БУРМИСТРОВ и др.
Схема 3.
NCO
O
O
H
H
O
N
N
OH
1b
O
O
O
O
O
H
2
N
DMF, Et3N
3a
OH
tкомн., 12 ч
NCO
O
O
H
H
N
N
OH
2c
O
O
H
H
4a
NCO
R-NH2
N
N
R
O
DMF, Et3N, 12 ч
O
O
O
O
1b
3b, 3c
R =
(b),
(c).
Ранее нами были получены симметричные
твердые вещества, плавящиеся без разложения
димочевины с адамантильным радикалом, показав-
(табл. 2).
шие высокую ингибирующую активность
[15].
Анализ спектров ЯМР 1H соединений 5а и 5b
Наличие второй мочевинной группы позволяет
показал, что эндо/экзо изомерия норборненового
таким соединениям образовывать дополнительные
фрагмента исходного изоцианата оказывает
водородные связи с остатком Ser374 в активном
влияние и на строение полученных мочевин 5а и
центре фермента [16], что приводит к возрастанию
5b. В спектрах ЯМР 1Н присутствуют два сигнала,
их активности. В этой связи, синтезированы
соответствующих протонам ближней к норборне-
биоизостерически замещенные димочевины по
новому фрагменту NH-группы (5.53 м.д. для эндо-
реакции изоцианата 2с с диаминами (схема 5).
и 5.62 для экзо-изомера). Сигнал протона NH-
Выходы мочевин 5а и 5b составляли 86% и 82%
группы, соединенной с углеводородным мостиком
соответственно. Все полученные соединения
-
Z не подвержен влиянию эндо-/экзо-изомерии и
Схема 4.
HCl
H
H
H2N
N
N
O
12 ч
NCO
DMF,
4b
Et3N
H2N
H
H
N
N
2c
4 ч
O
4c
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
СИНТЕЗ БИЦИКЛИЧЕСКИХ ИЗОЦИАНАТОВ
1265
Схема 5.
4d
δ endo
5.53
δ exo
5.62
δ 5.77
NCO
Z
H
H
H
H
H2N
NH2
N
N
N
N
Z
DMF, Et3N, tкомн., 12 ч
O
O
2c
Z = (CH2)4 (5a); (CH2)10 (5b).
составляет 5.77 м.д. Для адамантильного аналога
уреидные группы ранее наблюдалось для
соединения 5а (n = 4), сдвиги протонов NH-групп
диадамантилсодержащих димочевин [16]. Замена
составляют 5.42 (ближняя к адамантилу) и 5.61 м.д.
адамантильного фрагмента на норборненовый
[15]. Смещение сигналов Н-N1 в более слабое поле
также привела к снижению температуры плавления
у мочевины 5а, по-видимому, обусловлен более
более чем на 110°C.
слабым донорным эффектом норборненового
Ранее было установлено, что активность 1,3,3-
фрагмента, по сравнению с адамантильной
тризамещенных мочевин приблизительно в 5-15
группой.
раз ниже, чем у их 1,3-дизамещенных аналогов.
Температура плавления соединения 5b (n = 10;
Таким образом, наличие в молекуле ингибитора
148-149°C) на 100°C ниже чем у соединения 5а (n =
одновременно
1,3-дизамещенной и
1,3,3-триза-
4; 248-249°C). Подобное снижение температуры
мещенной мочевинных групп, позволит заранее
плавления при удлинении цепи соединяющей две
прогнозировать ориентацию таких молекул в
Таблица 2. Коэффициенты липофильности, температуры плавления и выходы синтезированных соединений и их
аналогов.
Температура
№
Структура
Mr
LogPа
Выход, %
плавления, °C
O
H
H
N
N
OH
3a
O
430
4.20
260-261
90
O
O
O
O
H
H
N
N
4a
OH
370
3.77
143-144
85
O
O
O
H
H
N
N
OH
412
5.18
250-255 [5]
85 [5]
O
O
H
H
N
N
3b
O
288
3.39
144-145
89
O
O
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
1266
БУРМИСТРОВ и др.
Таблица 2. (продолжение).
Температура
№
Структура
Mr
LogPа
Выход, %
плавления, °C
H
H
N
N
O
3c
364
5.18
178-179
74
O
O
H
H
N
N
O
H
3d
O
N
N
490
4.26
235-236
91
O
O
O
O
H
H
N
N
4b
286
4.03
263-264
93
O
H
H
4c
N
N
300
4.20
223-224
82
O
H
H
H
H
N
N
N
N
5а
358
2.75
248-249
86
(CH2)4
O
O
H
H
H
H
N
N
N
N
5b
442
5.78
148-149
82
(CH2)10
O
O
H
H
H
H
N
N
N
N
(CH2)4
443
5.57
251-253 [15]
98 [15]
O
O
активном центре фермента. При этом возможность
ную группу и n-децильный мостик Z) соответст-
образования дополнительных водородных связей
венно). При сравнении с аналогами, содержащими
сохранится. Соединение такого типа
3e было
адамантильный фрагмент, заметна более низкая
получено взаимодействием изоцианата
1b с
4-
липофильность бициклических соединений 3c и 4a.
аминопиперидином (схема 6).
Так коэффициент липофильности адамантановых
аналогов соединений 3c (cLogP 4.20) и 4a (cLogP
Выход мочевины 3d составил 91%. Коэффи-
3.77) находится в пределах 5.18-5.59 [10].
циент липофильности практически всех синтези-
рованных соединений меньше 5, что соответствует
Таким образом синтезированы 4,7,7-триметил-3
правилу Липински
[17]. Соединения
3b и
5b
-оксо-2-оксабицикло[2.2.1]гептан-1-изоцианат и
содержат помимо бициклического
радикала,
бицикло[2.2.1]гепт-5-ен-2-изоцианат с выходом
другие высоколипофильные фрагменты (бифениль-
89% и 83% соответственно. На основе синтези-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
СИНТЕЗ БИЦИКЛИЧЕСКИХ ИЗОЦИАНАТОВ
1267
Схема 6.
NH2
H
H
NCO
N
N
N
O
H
O
H
O
N
N
DMF, Et3N, 12 ч
O
O
O
O
O
1b
3d
рованных изоцианатов получены две серии биоизо-
триметил-3-оксо-2-оксабицикло[2.2.1]гептан-1-кар-
стерических 1,3-дизамещеных мочевин - потен-
боновой кислоты (1a) в 20 мл безводного толуола в
циальных ингибиторов растворимой эпоксидгидро-
течение 1 ч. После окончания добавления соеди-
лазы человека. Выходы целевых мочевин
нения 1a, реакционную смесь перемешивали еще
составили 74-93%.
1 ч при той же температуре. После охлаждения
осадок отфильтровывали, а растворитель упари-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
вали. Выход 4.00 г (89%). Спектр ЯМР 1Н (DMSO-
d6), δ, м.д.: 0.91 c (3H, CH3), 0.93 c (3H, CH3), 0.98 с
Исходные хлорангидрид (1S)-4,7,7-триметил-3-
(3H, CH3), 1.45-1.52 м (1H, CH2), 2.03-2.11 м (1H,
оксо-2-оксабицикло[2.2.1]гептан-1-карбоновой
CH2), 2.72-2.79 м (1H, CH), 7.12-7.27 м (1H, CH-
кислоты (CAS
39637-74-6, оптическая чистота
NCO). Спектр ЯМР 13C (DMSO-d6), δ, м.д.: 9.85
99%), бицикло[2.2.1]гепт-5-ен-2-карбоновая кислота
(CH3), 16.46 (CH3), 16.75 (CH3), 28.34 (CH2), 30.45
(CAS 120-74-1, смесь эндо- и экзо-изомеров с
(CH2), 52.02 [C(CH3)2], 52.67 [C(O)-C-CH3], 99.05
преобладанием эндо-), анилин, 1,4-диаминобутан,
(C-NCO),
128.80 (NCO),
177.75
[C(O)-C-CH3].
1,10-диаминодекан, 4-аминобифенил, 4-аминопи-
Масс-спектр, m/z (Iотн, %): 195 (1) [М]+, 166 (35) [М -
перидин и
2-аминометилфуран производства
2CH3]+, 152 (10) [М - NCO]+, 136 (100) [M - (O-
фирмы «Aldrich» использовали без очистки. транс-
NCO)]+, 124 (20), 109 (19), 96 (70), 82, 67, 55, 41.
Аминоциклогексилокси бензойная кислота [5], 2-
Найдено, %: С 61.55; Н 6.67; N 7.21. C10H13NО3.
аминоадамантан
[18] и
1-аминометиладамантан
Вычислено, %: С 61.53; Н 6.71; N 7.18. М 195.22.
[19] получены по известным методикам.
Бицикло[2.2.1]гепт-5-ен-2-изоцианат
(2c). К
Строение полученных соединений подтверж-
10 г (72 ммоль) бицикло[2.2.1]гепт-5-ен-2-карбоно-
дали с помощью ЯМР-спектроскопии на ядре 1Н,
вой кислоты прибавляли 6.4 мл (10.3 г, 86 ммоль)
хромато-масс-спектрометрии и элементного
хлористого тионила и перемешивали реакционную
анализа. Масс-спектры регистрировали на хромато-
смесь при комнатной температуре в течение 4 ч.
масс-спектрометре Agilent GC
5975/MSD
7820.
Избыток хлористого тионила отгоняли и остаток
Капиллярная кварцевая колонка HP-5MS (длина 30 м,
вакуумировали. Полученный хлорангидрид би-
диаметр 0.25 мм, толщина слоя 0.5 мкм), газ-
цикло[2.2.1]гепт-5-ен-2-карбоновой кислоты
носитель - гелий. Программируемый нагрев колонки
очищали от примеси хлорангидрида
5-хлорби-
от 80 до 280°С, температура испарителя 250°С.
цикло[2.2.1]гептан-2-карбоновой кислоты перегон-
Спектры ЯМР 1H зарегистрированы на спектро-
кой в вакууме. Полученный хлорангидрид бицикло-
метре Bruker DRX500 (500 МГц) в растворителе
[2.2.1]гепт-5-ен-2-карбоновой кислоты растворяли
DMSO-d6; химические сдвиги 1H приведены отно-
в 30 мл безводного толуола и в течение часа прика-
сительно SiMe4. Элементный анализ выполнен на
пывали к суспензии 6.5 г (100 ммоль) азида натрия
приборе Perkin-Elmer Series II 2400.
в 150 мл безводного толуола при температуре его
4,7,7-Триметил-3-оксо-2-оксабицикло[2.2.1]-
кипения. После окончания добавления хлоран-
гептан-1-изоцианат
(1b). К суспензии
2.5 г
гидрида, реакционную смесь перемешивали еще 1 ч
(38.5 ммоль) азида натрия в 80 мл безводного
при той же температуре. После охлаждения осадок
толуола при температуре его кипения добавляли по
отфильтровывали, а растворитель упаривали. Продукт
каплям раствор 5 г (23 ммоль) хлорангидрида 4,7,7-
перегоняли в вакууме. Выход 8.12 г (83%). Спектр
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
1268
БУРМИСТРОВ и др.
ЯМР 1Н (DMSO-d6), δ, м.д.: 0.52 д.т (1H, эндо-CH-
Н 6.98; N 6.55. C23H30N2О6. Вычислено, %: С 64.17;
СH2-CH-NCO, J1 11.7 Гц, J2 3.2 Гц), 1.07 д.т (1H,
Н 7.02; N 6.51. М 430.49.
экзо-CH-СH2-CH-NCO, J1 11.9 Гц, J2 3.4 Гц), 1.28
1-Фенил-3-(4,7,7-триметил-3-оксо-2-оксаби-
к (2Н, эндо-CH2, J 8.3 Гц), 1.40 к (2Н, экзо-CH2, J
цикло[2.2.1]гепт-1-ил)мочевина
(3b) получена
8.4 Гц), 1.78-1.84 м (1H, эндо-CH-CH-NCO), 2.02-
аналогично соединению 3a из 0.2 г (1.02 ммоль)
2.08 м (1H, экзо-CH-CH-NCO), 2.57 c (1H, эндо-
изоцианата 1b, 0.095 г (1.02 ммоль) свежеперег-
CH-СH2-CH-NCO), 2.75 c (1H, экзо-CH-СH2-CH-
нанного анилина и 0.1 г (1.0 ммоль, 0.14 мл) три-
NCO), 2.79 c (1H, эндо-CH-СH2-CH-NCO), 2.84 c
этиламина в 5 мл безводного ДМФА. Выход 0.26 г
(1H, экзо-CH-СH2-CH-NCO),
3.39-3.44 м
(1H,
(89%), т.пл. 144-145°C. Спектр ЯМР 1Н (DMSO-
эндо-CH-NCO), 4.12-4.18 м (1H, экзо-CH-NCO),
d6), δ, м.д.: 0.89 c (3H, CH3), 0.91 c (3H, CH3), 0.99 с
5.98 к (1H, эндо-CH=CH-CH-CH-NCO, J 2.8 Гц),
(3H, CH3), 1.45-1.52 м (1H, CH2), 2.05-2.12 м (1H,
6.04 к (1H, экзо-CH=CH-CH-CH-NCO, J 2.8 Гц),
CH2), 2.71-2.78 м (1H, CH), 5.51 c (1H, NH), 5.91 д
6.11 к (1H, эндо-CH=CH-CH-CH-NCO, J 2.8 Гц),
(1H, O-CH-NH, J 7.8 Гц), 7.29-7.54 м (5Hаром), 7.62
6.32 к (1H, экзо-CH=CH-CH-CH-NCO, J 2.9 Гц).
с (1H, NH-Ph). Масс-спектр, m/z (Iотн, %): 288 (1.2)
Спектр ЯМР 13C (DMSO-d6), δ, м.д.: 36.71 (эндо-
[М]+, 170 (20.8) [М - Ph-NCO]+, 153 (7.1) [М - Ph-
CH2-CH-NCO), 37.18 (экзо-CH2-CH-NCO), 41.13
NH-C(O) -NH]+, 136 (100) [Ph-NH-C(O)-NH2]+,
(эндо-CH-CH2-CH-NCO), 42.74 (экзо-CH-CH2-CH-
110 (70), 93 (20) [Ph-NH2]+, 55, 41. Найдено, %: С
NCO), 45.93 (эндо-CH-NCO), 47.80 (экзо-CH-NCO),
66.70; Н 7.02; N 9.68. C16H20N2О3. Вычислено, %: С
48.09 (эндо-CH2мост),
50.18 (экзо-CH2мост),
52.95
66.65; Н 6.99; N 9.72. М 288.34.
(эндо-CH-CH-NCO),
53.38 (экзо-CH-CH-NCO),
1-(Бифенил-4-ил)-3-(4,7,7-триметил-3-оксо-2-
131.43 (эндо-NCO),
133.32 (экзо-NCO),
139.66
оксабицикло-[2.2.1]гепт-1-ил)мочевина
(3c)
(эндо-CH=CH), 139.89 (экзо-CH=CH). Масс-спектр,
получена аналогично соединению
3a из
0.2 г
m/z (Iотн, %): 135 (2) [М]+, 120 (4) [М - CH3]+, 107
(1.02 ммоль) изоцианата 1b, 0.175 г (1.03 ммоль)
(12) [М - 2CH2]+, 93 (10) [M - NCO+], 79 (22), 66
бифенил-4-амина и 0.1 г (1.0 ммоль, 0.14 мл)
(100) [М - CH2-CH-NCO]+, 53, 40. Найдено, %: С
триэтиламина в 5 мл безводного ДМФА. Выход
71.12; Н 6.67; N 10.39. C8H9NО. Вычислено, %: С
0.27 г (74%), т.пл. 178-179°C. Спектр ЯМР 1Н
71.09; Н 6.71; N 10.36. М 135.16.
(DMSO-d6), δ, м.д.: 0.89 c (3H, CH3), 0.94 c (3H,
CH3), 0.98 с (3H, CH3), 1.45-1.52 м (1H, CH2), 2.03-
1-(транс-Циклогексил-4-оксибензойная кис-
2.11 м (1H, CH2), 2.72-2.79 м (1H, CH), 5.51 c (1H,
лота)-3-(4,7,7-триметил-3-оксо-2-оксабицикло-
NH), 5.91 д (1H, O-CH-NH, J 7.8 Гц), 7.28-7.71 м
[2.2.1]гепт-1-ил)мочевина (3a). К 0.4 г (2.04 ммоль)
(9Hаром), 8.70 с (1H, NH-Ph). Масс-спектр, m/z (Iотн,
4,7,7-триметил-3-оксо-2-оксабицикло[2.2.1]гептан-
%): 364 (5.0) [М]+, 336 (16.3) [М - 2CH3]+, 195 (57.2)
1-изоцианата
(1b) в
10 мл безводного ДМФА
[Ph-Ph-NCO]+, 167 (21.2) [Ph-Ph-NH]+, 153 (6.1)
прибавляли
0.5 г
(2.12 ммоль) транс-4-амино-
[Ph-Ph]+, 136 (74.5) [Ph-NH-C(O)-NH2]+, 110 (100).
циклогексилоксибензойной кислоты и
0.29 г
Найдено, %: С 72.45; Н 6.59; N 7.75. C22H24N2О3.
(2.87 ммоль, 0.4 мл) триэтиламина. Реакционную
Вычислено, %: С 72.50; Н 6.64; N 7.69. М 364.44.
смесь выдерживали при комнатной температуре в
течение 12 ч. После добавления 10 мл 1н HCl,
4-{3-(5,7,7-Триметил-4-оксо-3-оксабицикло-
смесь перемешивали в течение 1 ч. Выпавший
[3.1.1]гепт-2-ил)уреидо}-N-(5,7,7-триметил-4-
белый осадок отфильтровывали и промывали водой.
оксо-3-оксабицикло[3.1.1]гепт-2-ил)пиперидин-
Выход 0.79 г (90%), т.пл. 260-261°C. Спектр ЯМР
1-карбоксамид
(3d) получен аналогично
1Н (DMSO-d6), δ, м.д.: 0.86 c (3H, CH3), 0.92 c (3H,
соединению 3a из 0.2 г (1.02 ммоль) изоцианата 1b,
CH3), 0.96 с (3H, CH3), 1.23-1.32 м (4H, 2CH2), 1.40-
0.058 г (0.5 ммоль) пиперидин-4-илметиламина и
1.49 м (1H, CH2), 1.83-1.89 м (4H, 2CH2), 1.99-2.07
0.05 г (0.5 ммоль, 0.07 мл) триэтиламина в 5 мл
м (1H, CH2), 2.72-2.79 м (1H, CH), 4.38-4.45 м (2H,
безводного ДМФА. Выход 0.22 г (91%), т.пл. 235-
2CH), 5.34 c (2H, 2NH), 5.91 д (1H, O-CH-NH, J
236°C. Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 0.89 c
7.8 Гц), 7.02 д (2Hаром, J 8.9 Гц), 7.86 д (2Hаром, J
(6H, 2CH3), 0.91 c (6H, 2CH3), 0.99 с (6H, 2CH3),
8.9 Гц), 12.58 уш.с (1H, COOH). Масс-спектр, m/z
1.11-1.16 м (4H, 2CH2), 1.45-1.52 м (2H, 2CH2),
(Iотн, %): 430 (0.5) [М]+, 261 (7.0) [C13H16O3-NCO]+,
1.80-1.88 м (4H, 2CH2), 2.03-2.11 м (2H, 2CH2),
141 (100), 138 (40) [HO-Ph-COOH]+, 121 (27.9)
2.72-2.79 м (2H, 2CH), 4.38-4.45 м (1H, CH), 5.53 c
[Ph-COOH] +, 98 (28), 81 (42). Найдено, %: С 64.13;
(3H, 3NH), 5.91 д (2H, 2O-CH-NH, J 7.8 Гц). Масс-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
СИНТЕЗ БИЦИКЛИЧЕСКИХ ИЗОЦИАНАТОВ
1269
спектр, m/z (Iотн, %): 336 (32.9) [М - C9H13O2]+, 170
1-(Адамант-2-ил)-3-(бицикло[2.2.1]гепт-5-ен-
(29.1)
[C9H13O2-NH2]+,
136
(96.7),
110
(100).
2-ил)мочевина (4b) получена аналогично соеди-
Найдено, %: С 61.17; Н 7.85; N 11.40. C25H38N4О6.
нению 4a из 0.2 г (1.48 ммоль) изоцианата 2b, 0.28 г
Вычислено, %: С 61.21; Н 7.81; N 11.42. М 490.59.
(1.49 ммоль) гидрохлорида 2-аминоадамантана и
0.37 г (3.6 ммоль, 0.5 мл) триэтиламина в 5 мл
1-(транс-Циклогексил-4-оксибензойная кис-
безводного ДМФА. Выход 0.39 г (93%), т.пл. 263-
лота)-3-(бицикло[2.2.1]гепт-5-ен-2-ил)мочевина
264°C. Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 0.52 д.т
(4a). К 0.2 г (1.48 ммоль) бицикло[2.2.1]гепт-5-ен-
(1H, эндо-CH-СH2-CH-NH, J1 11.7 Гц, J2 3.2 Гц),
2-изоцианата
(2b) в
5 мл безводного ДМФА
1.07 д.т (1H, экзо-CH-СH2-CH-NH, J1 11.9 Гц, J2
прибавляли 0.4 г (1.70 ммоль) транс-4-амино-цикло-
3.4 Гц), 1.28 к (2Н, эндо-CH2, J 8.3 Гц), 1.40 к (2Н,
гексилоксибензойной кислоты и 0.37 г (3.6 ммоль,
экзо-CH2, J 8.4 Гц), 1.47-1.80 м (14H, Ad), 1.78-
0.5 мл) триэтиламина. Реакционную смесь выдер-
1.84 м (1H, эндо-CH-CH-NH), 2.02-2.08 м (1H,
живали при комнатной температуре в течение 12 ч.
экзо-CH-CH-NH), 2.57 c (1H, эндо-CH-СH2-CH-
После добавления 10 мл 1н HCl, смесь переме-
NH), 2.75 c (1H, экзо-CH-СH2-CH-NH), 2.79 c (1H,
шивали в течение 1 ч. Выпавший белый осадок
эндо-CH-СH2-CH-NH), 2.84 c (1H, экзо-CH-СH2-
отфильтровывали и промывали водой. Выход 0.47 г
CH-NH), 3.39-3.44 м (1H, эндо-CH-NH), 3.65 т
(85%), т.пл. 143-144°C. Спектр ЯМР 1Н (DMSO-
(1H, Ad, J 10.4 Гц), 4.12-4.18 м (1H, экзо-CH-NH),
d6), δ, м.д.: 0.53 д.т (1H, эндо-CH-СH2-CH-NH, J1
5.41 д (1H, эндо-NH, J 8.4 Гц), 5.96 д (1H, экзо-NH,
11.7 Гц, J2 3.2 Гц), 1.10 д.т (1H, экзо-CH-СH2-CH-
J 8.4 Гц), 5.98 к (1H, эндо-CH=CH-CH-CH-NH, J
NH, J1 11.9 Гц, J2 3.4 Гц), 1.18-1.23 м (4H, 2CH2),
2.8 Гц), 6.03 д (1H, NH-Ad, J 8.5 Гц), 6.04 к (1H,
1.28 к (2Н, эндо-CH2, J 8.3 Гц), 1.47 к (2Н, экзо-
экзо-CH=CH-CH-CH-NH, J 2.8 Гц), 6.11 к (1H,
CH2, J 8.4 Гц), 1.78-1.84 м (1H, эндо-CH-CH-NH),
эндо-CH=CH-CH-CH-NH, J 2.8 Гц), 6.32 к (1H,
1.83-1.89 м (4H, 2CH2), 1.99-2.06 м (1H, экзо-CH-
экзо-CH=CH-CH-CH-NH, J 2.9 Гц). Спектр ЯМР
CH-NH), 2.59 c (1H, эндо-CH-СH2-CH-NH), 2.74 c
13C (DMSO-d6), δ, м.д.: 26.81 д (Ad, J 12.5 Гц), 31.23
(1H, экзо-CH-СH2-CH-NH), 2.76 c (1H, эндо-CH-
т (Ad, J 7.5 Гц), 32.37 (Ad), 34.53 (эндо-CH2-CH-
СH2-CH-NH), 2.79 c (1H, экзо-CH-СH2-CH-NH),
NH),
35.33 (экзо-CH2-CH-NH),
36.96 д (Ad, J
3.39-3.45 м (1H, эндо-CH-NH), 4.12-4.18 м (1H,
7.5 Гц), 37.28 (Ad), 40.33 (эндо-CH-CH2-CH-NH),
экзо-CH-NH), 4.38-4.45 м (2H, 2CH), 5.28 уш.с
42.06 (экзо-CH-CH2-CH-NH),
45.62 (эндо-CH-
(1H, эндо-NH), 5.70 уш.с (1H, экзо-NH), 5.98 к (1H,
NH), 46.09 (экзо-CH-NH), 48.02 (эндо- + экзо-
эндо-CH=CH-CH-CH-NH, J 2.8 Гц), 5.95 уш.с (1H,
CH2мост), 48.88 (эндо-CH-CH-NH), 49.48 (экзо-CH-
NH), 6.04 к (1H, экзо-CH=CH-CH-CH-NH, J 2.8 Гц),
CH-NH), 52.68 д (NH-CH Ad, J 5.0 Гц), 132.20
6.12 к (1H, эндо-CH=CH-CH-CH-NH, J 2.8 Гц),
(эндо-CH=CH), 134.85 (эндо-CH=CH), 138.31 (экзо-
6.32 к (1H, экзо-CH=CH-CH-CH-NH, J 2.9 Гц),
CH=CH),
138.70 (экзо-CH=CH),
157.07 д
[NH-
7.03 д (2H, 2CHаром), 7.86 д (2H, 2CHаром, J 8.6 Гц),
C(O)-NH, J 3.7 Гц]. Масс-спектр, m/z (Iотн, %): 286
12.60 уш.с (1H, COOH). Спектр ЯМР 13C (DMSO-d6),
(28.4)
[М]+, 221 (84.1) [М - циклопентен]+, 135
δ, м.д.: 29.77 (2CH2циклогексан), 30.35 (2CH2циклогексан),
(11.0) [Ad]+, 109 (9.5) [M - AdNCO]+, 79 (8.4), 66
34.33 (эндо-CH2-CH-NH), 35.24 (экзо-CH2-CH-NH),
(9.6), 43 (100). Найдено, %: С 75.52; Н 9.10; N 9.81.
40.32 (эндо-CH-CH2-CH-NH), 42.04 (экзо-CH-CH2-
C18H26N2О. Вычислено, %: С 75.48; Н 9.15; N 9.78.
CH-NH),
45.58 (эндо-CH-NH),
46.05 (экзо-CH-
М 286.41.
NH), 47.07 д (CH-NHциклогексан, J 16.3 Гц),
48.00
(эндо- + экзо-CH2мост), 48.94 (эндо-CH-CH-NH), 49.57
1-[(Адамант-1-ил)метил]-3-(бицикло[2.2.1]-
(экзо-CH-CH-NH), 74.45 д (CH-Oциклогексан, J 7.5 Гц),
гепт-5-ен-2-ил)мочевина (4c) получена аналогич-
115.12 (2CHаром), 122.68 (C-COOH), 131.41 (2CHаром),
но соединению 4a из 0.25 г (1.85 ммоль) изоциа-
132.12 (эндо-CH=CH),
134.87 (эндо-CH=CH),
ната 2b, 0.31 г (1.87 ммоль) 1-аминометилада-
138.34 (экзо-CH=CH), 138.77 (экзо-CH=CH), 157.18
мантана и 0.145 г (1.43 ммоль, 0.2 мл) триэтил-
[NH-C(O)-NH], 161.15 (C-Oаром), 167.02 (COOH).
амина в 5 мл безводного ДМФА. Выход 0.45 г
Масс-спектр, m/z (Iотн, %): 370 (10.1) [М]+,
305
(82%), т.пл. 223-224°C. Спектр ЯМР 1Н (DMSO-
(28.0) [М - циклопентен]+, 178 (34.9) [(CH3)2CH-O-
d6), δ, м.д.: 0.52 д.т (1H, эндо-CH-СH2-CH-NH, J1
Ph-COOH]+, 138 (41.8) [HO-Ph-COOH]+, 113 (49.8)
11.8 Гц, J2 3.3 Гц), 1.08 д.т (1H, экзо-CH-СH2-CH-
[NH-C6H10-O]+, 66 (91.6), 43 (100). Найдено, %: С
NH), 1.28 к (2Н, эндо-CH2, J 8.4 Гц), 1.39 д (6H, Ad,
68.11; Н 7.03; N 7.60. C21H26N2О4. Вычислено, %: С
J 9.5 Гц), 1.50 к (2Н, экзо-CH2, J 8.4 Гц), 1.62 д.д
68.09; Н 7.07; N 7.56. М 370.44.
(6H, Ad, J1 44.2 Гц, J2 11.8 Гц), 2.01-2.07 м (1H,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
1270
БУРМИСТРОВ и др.
эндо-CH-CH-NH), 2.57 c (1H, эндо-CH-СH2-CH-
6.31 к (2H, экзо-2CH=CH-CH-CH-NH, J 3.0 Гц).
NH), 2.64-2.73 м (1H, экзо-CH-CH-NH), 2.75 c (1H,
Спектр ЯМР 13C (DMSO-d6), δ, м.д.: 27.66 д (NH-
экзо-CH-СH2-CH-NH), 2.78 c (1H, эндо-CH-СH2-
CH2-CH2-CH2-CH2-NH, J 5.0 Гц), 34.25 (эндо-CH2-
CH-NH), 2.85 c (1H, экзо-CH-СH2-CH-NH), 3.11 c
CH-NH), 35.13 (экзо-CH2-CH-NH), 39.00 д (NH-
(2H, CH2-Ad), 3.38-3.43 м (1H, эндо-CH-NH), 4.11-
CH2-CH2-CH2-CH2-NH, J 12.5 Гц), 40.33 (эндо-CH-
4.17 м (1H, экзо-CH-NH), 5.30 д (1H, эндо-NH, J
CH2-CH-NH), 42.04 (экзо-CH-CH2-CH-NH), 45.52
8.4 Гц), 5.60 т (1H, эндо NH-CH2-Ad, J
6.2 Гц),
(эндо-CH-NH), 46.05 (экзо-CH-NH), 48.00 (эндо- +
5.69 т (1H, экзо-NH-CH2-Ad, J 6.0 Гц), 5.96 д (1H,
экзо-CH2мост), 49.07 (эндо-CH-CH-NH), 49.71 (экзо-
экзо-NH, J 8.4 Гц), 5.96 к (1H, эндо-CH=CH-CH-
CH-CH-NH), 132.10 (эндо-CH=CH), 134.89 (эндо-
CH-NH, J 3.3 Гц), 6.04 к (1H, экзо-CH=CH-CH-CH-
CH=CH),
138.32 (экзо-CH=CH),
138.69 (экзо-
NH, J 3.1 Гц), 6.11 к (1H, эндо-CH=CH-CH-CH-
CH=CH), 157.80 [NH-C(O)-NH]. Масс-спектр, m/z
NH, J 2.8 Гц), 6.32 к (1H, экзо-CH=CH-CH-CH-
(Iотн, %): 358 (3.3) [М]+, 292 (100) [М - циклопентен]+,
NH, J 3.0 Гц). Спектр ЯМР 13C (DMSO-d6), δ, м.д.:
250
(94.8)
[М
- C7H10NH2]+,
226
(19.3)
[M
-
27.77 (Ad), 33.42 д (Ad, J 8.8 Гц), 34.41 (эндо-CH2-
2циклопентен]+, 184 (11.7) [OCN-(CH2)4-NH-C(O)-
CH-NH),
35.21 (экзо-CH2-CH-NH),
36.69 (Ad),
NH-CH2-CH3]+, 66 (6.4). Найдено, %: С 61.05; Н
39.82 (NH-C Ad), 40.34 (эндо-CH-CH2-CH-NH),
8.39; N 15.65. C20H30N4О2. Вычислено, %: С 61.01;
42.06 (экзо-CH-CH2-CH-NH),
45.57 (эндо-CH-
Н 8.44; N 15.63. М 358.48.
NH), 46.03 (экзо-CH-NH), 47.99 (эндо- + экзо-
1,1'-(Декан-1,10-диил)бис{3-(бицикло[2.2.1]-
CH2мост), 49.09 (эндо-CH-CH-NH), 49.66 (экзо-CH-
гепт-5-ен-2-ил)мочевина)}
(5b) получена
CH-NH), 51.06 (NH-CH2-Ad), 132.20 (эндо-CH=CH),
аналогично соединению 4a из 0.5 г (3.7 ммоль)
134.85 (эндо-CH=CH), 138.31 (экзо-CH=CH), 138.70
изоцианата 2b, 0.3 г (1.75 ммоль) 1,10-диамино-
(экзо-CH=CH), 157.07 д [NH-C(O)-NH, J 3.7 Гц].
декана и 0.36 г (3.59 ммоль, 0.5 мл) триэтиламина в
Масс-спектр, m/z (Iотн, %): 300 (16.3) [М]+,
235
5 мл безводного ДМФА. Выход 0.63 г (82%), т.пл.
(95.9)
[М - циклопентен]+, 149 (5.4) [Ad-CH2]+,
148-149°C. Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 0.52
135 (19.3) [Ad]+), 93 (8.1), 79 (8.6), 66 (10.8), 43
д.т (2H, эндо-2CH-СH2-CH-NH, J1 11.6 Гц, J2
(100). Найдено,
%: С
76.00; Н
9.35; N
9.36.
3.1 Гц), 1.10 д.т (2H, экзо-2CH-СH2-CH-NH, J1
C19H28N2О. Вычислено, %: С 75.96; Н 9.39; N 9.32.
12.0 Гц, J2 3.2 Гц), 1.24 уш.с (12H, 6CH2), 1.28 к
М 300.44.
(4Н, эндо-2CH2, J 8.5 Гц), 1.31-1.37 м (4H, 2CH2-
1,1'-(Бутан-1,4-диил)бис{3-(бицикло[2.2.1]-
CH2-NH), 1.41 к (4Н, экзо-2CH2, J 8.7 Гц), 1.46-
гепт-5-ен-2-ил)мочевина} (5a) получена аналогич-
1.51 м (2H, эндо-2CH-CH-NH), 2.00-2.07 м (2H,
но соединению 4a из 0.3 г (2.22 ммоль) изоцианата
экзо-2CH-CH-NH), 2.57 c (2H, эндо-2CH-СH2-CH-
2b, 0.1 г (1.13 ммоль) 1,4-диаминобутана и 0.22 г
NH), 2.74 c (2H, экзо-2CH-СH2-CH-NH), 2.77 c
(2.15 ммоль, 0.3 мл) триэтиламина в 5 мл безвод-
(2H, эндо-2CH-СH2-CH-NH), 2.84 c (2H, экзо-2CH-
ного ДМФА. Выход 0.34 г (86%), т.пл. 248-249°C.
СH2-CH-NH), 2.92-3.01 м (4H, 2CH2-CH2-NH),
Спектр ЯМР 1Н (DMSO-d6), δ, м.д.: 0.55 д.т (2H,
3.36-3.43 м (2H, эндо-2CH-NH), 4.10-4.16 м (21H,
эндо-2CH-СH2-CH-NH, J1 11.8 Гц, J2 3.1 Гц), 1.12
экзо-2CH-NH), 5.25 д (2H, эндо-2NH-СH2, J 8.3 Гц),
д.т (2H, экзо-2CH-СH2-CH-NH, J1 11.9 Гц, J2
5.63 т (2H, эндо-2NH, J 5.3 Гц), 5.73 т (2H, экзо-
3.2 Гц), 1.28 к (4Н, эндо-2CH2, J 8.5 Гц), 1.31-1.37
2NH, J 5.3 Гц), 5.95 д (2H, экзо-2NH-СH2, J 8.3 Гц),
м (4H, 2CH2-CH2-NH), 1.41 к (4Н, экзо-2CH2, J
5.96 к (2H, эндо-2CH=CH-CH-CH-NH, J 3.0 Гц),
8.7 Гц), 1.46-1.52 м (2H, эндо-2CH-CH-NH), 2.01-
6.03 к (2H, экзо-2CH=CH-CH-CH-NH, J 3.0 Гц),
2.07 м (2H, экзо-2CH-CH-NH), 2.59 c (2H, эндо-
6.11 к (2H, эндо-2CH=CH-CH-CH-NH, J 3.0 Гц),
2CH-СH2-CH-NH), 2.74 c (2H, экзо-2CH-СH2-CH-
6.31 к (2H, экзо-2CH=CH-CH-CH-NH, J 3.0 Гц).
NH), 2.77 c (2H, эндо-2CH-СH2-CH-NH), 2.86 c
Спектр ЯМР 13C (DMSO-d6), δ, м.д.: 26.45 [NH-
(2H, экзо-2CH-СH2-CH-NH),
2.92-3.01 м
(4H,
(CH2)2-CH2-(CH2)4-CH2-(CH2)2-NH],
28.85
[NH-
2CH2-CH2-NH), 3.38-3.43 м (2H, эндо-2CH-NH),
(CH2)3-CH2-(CH2)2-CH2-(CH2)3-NH],
29.05
[NH-
4.10-4.17 м (21H, экзо-2CH-NH), 5.09 т (2H, эндо-
(CH2)4-CH2-CH2-(CH2)4-NH], 30.09 [NH-CH2-CH2-
2NH, J 7.0 Гц), 5.53 с (2H, эндо-2NH-СH2), 5.62 c (2H,
(CH2)6-CH2-CH2-NH],
34.22 (эндо-CH2-CH-NH),
экзо-2NH-СH2), 5.77 т (2H, экзо-2NH, J 7.0 Гц),
35.11 (экзо-CH2-CH-NH), 39.15 д [NH-CH2-(CH2)8-
5.95 к (2H, эндо-2CH=CH-CH-CH-NH, J 3.0 Гц),
CH2-NH, J 15.0 Гц], 40.32 (эндо-CH-CH2-CH-NH),
6.03 к (2H, экзо-2CH=CH-CH-CH-NH, J 3.0 Гц),
42.03 (экзо-CH-CH2-CH-NH),
45.51 (эндо-CH-
6.10 к (2H, эндо-2CH=CH-CH-CH-NH, J 3.0 Гц),
NH), 46.04 (экзо-CH-NH), 47.99 (эндо-
+ экзо-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
СИНТЕЗ БИЦИКЛИЧЕСКИХ ИЗОЦИАНАТОВ
1271
CH2мост), 49.05 (эндо-CH-CH-NH), 49.69 (экзо-CH-
6. Burmistrov V., Morisseau C., Harris T.R., Butov G.,
CH-NH),
132.08 (эндо-CH=CH),
134.889 (эндо-
Hammock B.D. Bioorg. Chem. 2018, 76, 510. doi
10.1016/j.bioorg.2017.12.024
CH=CH),
138.32 (экзо-CH=CH),
138.70 (экзо-
7. Burmistrov V., Morisseau C., D’yachenko V., Rybakov V.B.,
CH=CH), 157.80 [NH-C(O)-NH]. Масс-спектр, m/z
Butov G.M., Hammock B.D. J. Fluor. Chem. 2019, 220,
(Iотн, %): 442 (7.4) [М]+, 376 (81.1) [М - цикло-
48. doi 10.1016/j.jfluchem.2019.02.005
пентен]+, 334 (50.8) [М - C7H10NH2]+, 310 (12.7) [M -
8. Бутов Г.М., Бурмистров В.В., Дьяченко В.С. ЖОрХ.
2циклопентен]+, 267 (30.1) [OCN-(CH2)10-NH-C(O)-
2017,
53,
965.
[Butov G.M., Burmistrov V.V.,
NH-CH2-CH3]+, 242 (70) [H2N-(CH2)10-NH-C(O)-
D’yachenko V.S. Russ. J. Org. Chem. 2017, 53, 977.]
NH-CH2-CH3]+, 199 (11.0) [OCN-(CH2)10-NH2]+, 66
doi 10.1134/S107042801707003X
(92.5), 43 (100). Найдено, %: С 70.59; Н 9.53; N
9. Бурмистров В.В., Бутов Г.М. ЖОрХ. 2018, 54, 1296.
12.70. C26H42N4О2. Вычислено, %: С 70.55; Н 9.56;
[Burmistrov V.V., Butov G.M. Russ. J. Org. Chem.
N 12.66. М 442.64.
2018, 54, 1307.] doi 10.1134/S1070428018090063
10. Бутов Г.М., Бурмистров В.В., Данилов Д.В. Изв. АН
ФОНДОВАЯ ПОДДЕРЖКА
Сер. хим. 2017, 66, 1876. [Butov G.M., Burmistrov V.V.,
Danilov D.V. Russ. Chem. Bull. 2017, 66, 1876.] doi
Работа выполнена при финансовой поддержке
10.1007/s11172-017-1961-y
Минобрнауки РФ в рамках базовой части госу-
11. Shen H.C., Hammock B.D. J. Med. Chem. 2012, 55,
дарственного задания на 2017-2019 гг. (проект
1789. doi 10.1021/jm201468j
4.7491.2017/БЧ) и грант РФФИ (№ 18-43-343002,
12. Shishov D.V., Nurieva E.V., Zefirov N.A., Mamaeva A.V.,
р_мол_а).
Zefirova O.N. Mendeleev Commun. 2014, 24, 370. doi
10.1016/j.mencom.2014.11.021
13. Бутов Г.М., Бурмистров В.В., Питушкин Д.А.
КОНФЛИКТ ИНТЕРЕСОВ
ЖОрХ. 2017, 53, 667. [Butov G.M., Burmistrov V.V.,
Pitushkin D.A. Russ. J. Org. Chem. 2017, 53, 673.] doi
Авторы заявляют об отсутствии конфликта
10.1134/S1070428017050050
интересов.
14. Commarieu B., Claverie J.P. Chem. Sci. 2015, 6, 2172.
doi 10.1039/c4sc03575e
СПИСОК ЛИТЕРАТУРЫ
15. Burmistrov V., Morisseau C., Lee K.S.S., Shihadih D.S.,
Harris T.R., Butov G.M., Hammock B.D. Bioorg. Med.
1. Schmelzer K.R., Kubala L., Newman J.W., Kim I.H.,
Chem. Lett. 2014, 24, 2193. doi 10.1016/j.bmcl.2014.03.016
Eiserich J.P., Hammock B.D. Proc. Natl. Acad.
16. Бутов Г.М., Бурмистров В.В., Данилов Д.В.,
Sci. U.S.A.
2005,
102,
9772. doi
10.1073/
Питушкин Д.А., Мориссье К., Хэммок Б.Д. Изв. АН
pnas.0503279102
Сер. хим. 2015, 7, 1569. [Butov G.M., Burmistrov V.V.,
2. Fleming I., Rueben A., Popp R., Fisslthaler B.,
Danilov D.V., Pitushkin D.A., Morisseau C.,
Schrodt S., Sander A., Haendeler J., Falck J.R.,
Hammock B.D. Russ. Chem. Bull. 2015, 64, 1569.] doi
Morisseau C., Hammock B.D., Busse R. Arterioscler.
10.1007/s11172-015-1043-y
Thromb Vasc. Biol. 2007, 27, 2612. doi 10.1161/
17. Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J.
ATVBAHA.107.152074
Adv. Drug Del. Rev. 2001, 46, 3. doi 10.1016/S0169-
3. Imig J.D. Expert Opin. Drug Metab. Toxicol. 2008, 4,
409X(00)00129-0
165. doi 10.1517/17425255.4.2.165
18. Лаврова Л.Н., Климова Н.В., Шмарьян М.И.,
4. Wanka L., Iqbal K., Schreiner P.R. Chem. Rev. 2013,
Ульянова О.В., Вихляев Ю.И., Сколдинов А.П.
113, 3516. doi 10.1021/cr100264t
ЖОрХ. 1974, 10, 761. [Lavrova L.N., Klimova N.V.,
5. Hwang S.H., Wecksler A.T., Zhang G., Morisseau C.,
Shmar’yan M.I., Ul’yanova O.V., Vikhlyaev Y.I.,
Nguyen L.V., Fu S.H., Hammock B.D. Bioorg.
Skoldinov A.P. Zh. Org. Khim. 1974, 10, 761.]
Med. Chem. Lett.
2013,
23,
3732. doi
10.1016/
19. Бутов Г.М., Першин В.В., Бурмистров В.В. Пат.
j.bmcl.2013.05.011
2440971 (2010). РФ. Б.И. 2012, № 3.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019
1272
БУРМИСТРОВ и др.
Synthesis of Bicyclic Isocyanates and Bioisosteric
1,3-Disubstituted Ureas - Soluble Epoxide Hydrolase Inhibitors
V. V. Burmistrova, V. S. D'yachenkoa, b, *, E. V. Rasskazovab, and G. M. Butova
a Volzhsky Polytechnic Institute (Branch) of Volgograd State Technical University,
404121, Russia, Volzhsky, ul. Engelsa 42a
b Volgograd State Technical University,400005, Russia, Volgograd, pr. Lenina 28
*e-mail: butov@volpi.ru
Received March 28, 2019; revised May 8, 2019; accepted May 30, 2019
(1S)-4,7,7-Trimethyl-3-oxo-2-oxabicyclo[2.2.1]heptane-1-isocyanate and bicyclo[2.2.1]hept-5-ene-2-isocyanate
were prepared by the Curtius rearragement reaction from the corresponding carboxylic acids. Two series of
bioisosteric 1,3-disubstituted ureas - potential human soluble epoxide hydrolase inhibitors were synthesized
from the reported isocyanates with 74-93% yield.
Keywords: isocyanates, 1,3-disubstituted ureas, soluble epoxide hydrolase, sEH
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 8 2019