ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2019, том 55, № 9, с. 1359-1366
УДК 547.537.9
СИНТЕЗ НОВЫХ ЦИКЛОПЕНТЕНОФУЛЛЕРЕНОВ
С НОРБОРНЕНОВЫМ ФРАГМЕНТОМ
© 2019 г. И. М. Сахаутдинов, А. Ф. Мухаметьянова*
ФГБУН «Уфимский Институт химии УФИЦ РАН»,
450054, Россия, Республика Башкортостан, г. Уфа, пр. Октября 69
*e-mail: afmhim@bk.ru
Поступила в редакцию 8 февраля 2019 г.
После доработки 28 марта 2019 г.
Принята к публикации 12 апреля 2019 г.
Синтезированы имиды эндикового ангидрида путем прямого сплавления с различными аминокислотами.
Дальнейшие трансформации полученных кислот дали новые алленоаты с норборненовым фрагментом. В
результате фосфин-катализируемого
[3+2]-присоединения алленоатов к фуллереновому каркасу
синтезированы новые моноаддукты фуллерена С60.
Ключевые слова: эндиковый ангидрид, норборнен, аминокислоты, имиды, фуллерен, циклопентено-
фуллерены.
DOI: 10.1134/S0514749219090039
Известно, что фуллерен С60 и многие его
Дальнейшие трансформации полученных кислот
производные обладают необычно высокой способ-
3a-e и 5a-d приводят к образованию кетенов,
ностью улавливать свободные радикалы. Экспери-
олефинирование которых реакцией с метил 2-(три-
менты на животных показывают повышение их
фенилфосфоранилиден)ацетатом в присутствии
устойчивости к оксидативным стрессам и пре-
триэтиламина по Виттигу дает новые алленоаты с
пятствуют протеканию нейродегеративных процес-
норборненовым фрагментом (схема 2).
сов, что может снизить риск возникновения
Строение соединения
6а-e и 7a-d доказано
болезни Паркинсона и синдром Альцгеймера[1, 2].
cпектральными методами анализа. В спектре ЯМР
Интерес к химии соединений, включающих
1Н характерные сигналы двух протонов алленового
норборненовый (бицикло[2.2.1]гепт-2-еновый)
фрагмента наблюдаются в области от δ 5.56 м.д до
фрагмент обусловлен разнообразным биологичес-
δ 5.92 м.д., однако для алленоата полученного из
ким действием производных промышленно
глицина данные сигналы проявляются в виде двух
доступного ангидрида бицикло[2.2.1]гепт-5-ен-
синглетов при δ 6.05 м.д и δ 6.91 м.д. В спектре
эндо-2,3-дикарбоновой (эндиковой) кислоты 1. В
ЯМР
13С характерные сигналы терминальных
частности многочисленные имиды на основе
алленовых углеродов наблюдются в области от δ
ангидрида 1 обладают психотропным, антидепрес-
88.17 до
96.06 м.д. В случае α-аминокислот
сантным действием, используются как противо-
(аланин, валин, лейцин, β-фенилаланин) четвер-
аритмические, жаропонижающие, седативные и
тичный атом углерода
4' проявляется в более
противовоспалительные средства [3, 4].
слабом поле в области выше
105 м.д. Также
наблюдается сигнал центрального алленового
Цель настоящей работы - синтез новых конъю-
углеродного атома всех алленоатов в области от
гатов фуллерена путем фосфин-катализируемого
208.69 м.д. до δ 212.54 м.д. [5-8].
[3+2]-циклоприсоединения алленоатов из энди-
кового ангидрида. Для получения новых аллено-
Известно, что алленоаты активированные
атов с норборненовым фрагментом нами синтези-
нуклеофильной атакой фосфина по центральному
рованы имиды эндикового ангидрида путем
sp-гибридизованному атому успешно применяются
прямого сплавления с различными аминокисло-
как трехатомные строительные блоки [9] в реак-
тами (схема 1).
циях циклоприсоединения к электронодефицитным
1359
1360
САХАУТДИНОВ, МУХАМЕТЬЯНОВА
Схема 1.
O
O
O
OH
OH
O
+ NH2
n
N
n
O
O
O
1
2a_e
3a_e
n = 1 (a); 2 (b); 3 (c); 4 (d); 5 (e).
O
O
O
R
N
O
+ H2N
OH
OH
R
O O
O
1
4a_d
5a_d
R = CH3 (a); CH(CH3)2 (b); CH2CH(CH3)2 (c); CH2-Ph (d).
алкенам с образованием ненасыщенных пятичлен-
катализируемой реакцией
[3+2] циклоприсоеди-
ных циклов
[10-12]. В результате фосфин-
нения к фуллереновой сфере делают данный
катализируемого [3+2]-присоединения алленоатов
подход конкурентноспособным для получения
к фуллереновому каркасу, как диполярофилу,
монозамещенных производных фуллерена. Струк-
синтезированы с хорошим выходом новые, хорошо
туры выделенных соединений доказаны комп-
растворимые в органических растворителях моно-
лексом физико-химических методов, включающим
аддукты фуллерена С60 8b-e. Вещества выделяли в
ЯМР 2D эксперименты HSQC и HMBC (cм. рисунок).
индивидуальном виде колоночной хроматографией
на силикагеле на силикагеле (схема 3).
Таким образом, путем фосфин-катализируемой
функционализации ядра С60 алленоатами, мы
Циклопентенофуллерены на основе аллени-
показали возможность синтеза новых конъюгатов
мидов синтезированных из α-аминокислот 6а, 7a-d
фуллерена С60 с норборненовым фрагментом. Соеди-
получить не удалось, что, по-видимому, объяс-
нения отличаются хорошей растворимостью в органи-
няется стерическими затруднениями.
ческих растворителях, что расширяет перспективы
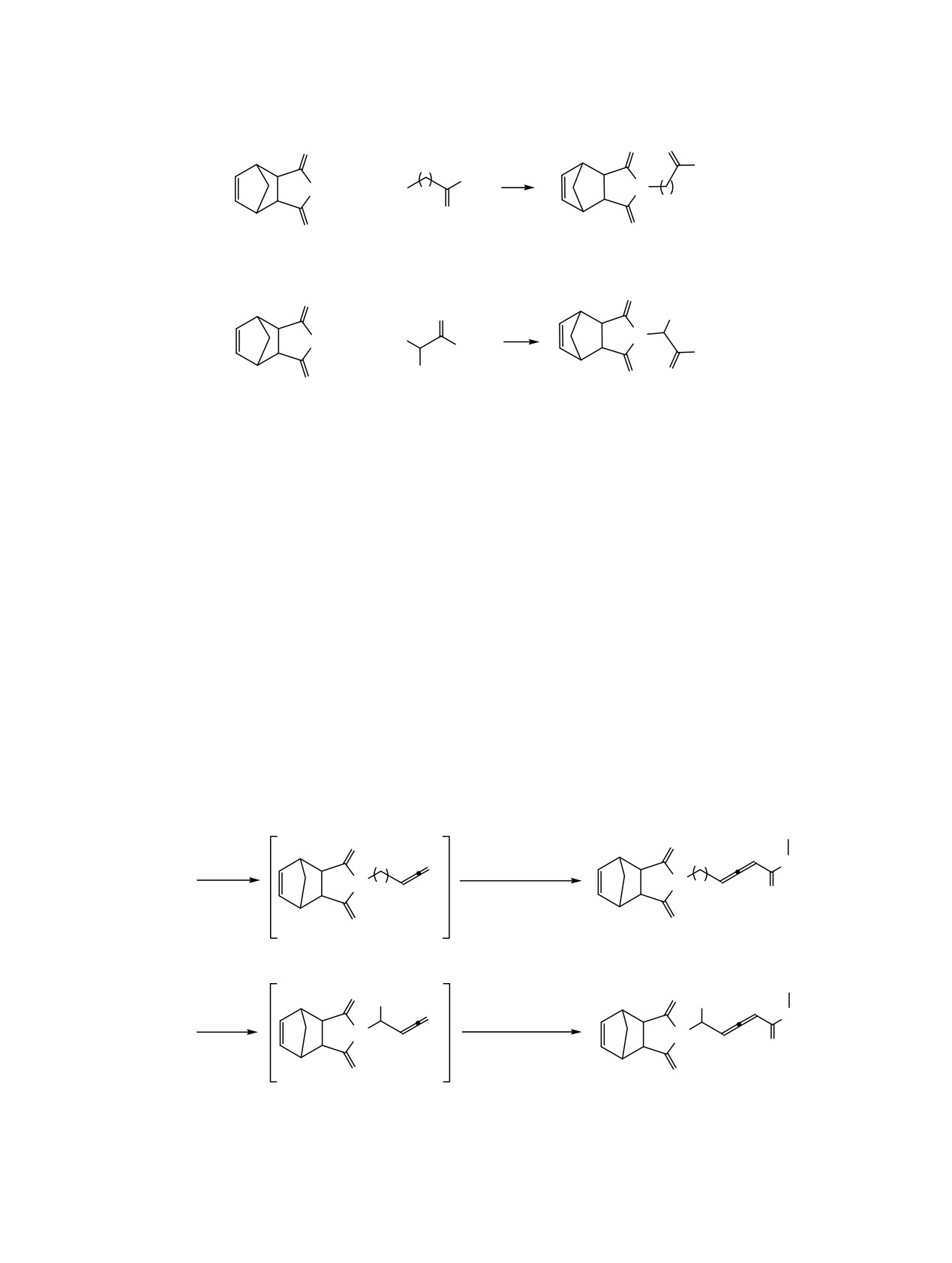
Однореакторное получение алленоатов и
последующих трансформаций и рассмотрения их в
хорошие выхода конъюгатов фуллерена С60 фосфин-
качестве перспективных мономеров.
Схема 2.
O
O
1. SOCl2,
O
O
2. (Et)3N
(Ph)3P=CHCOOMe
3a_e
N n-1
N n-1
CH2Cl2
O
O
O
6
n = 1 (a); 2 (b); 3 (c); 4 (d); 5 (e).
O
O
1. SOCl2,
R
R
2. (Et)3N
O
(Ph)3P=CHCOOMe
O
5a_d
N
N
CH2Cl2
O
O
O
7
R = CH3 (a); CH(CH3)2 (b);
CH2CH(CH3)2 (c); CH2-Ph (d).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 9 2019
СИНТЕЗ НОВЫХ ЦИКЛОПЕНТЕНОФУЛЛЕРЕНОВ С НОРБОРНЕНОВЫМ ФРАГМЕНТОМ
1361
Схема 3.
O
O
N O
O
n-1
O
O
P(Ph)3
N
C60
n-1
O
110oC
O
6b_e
8b, 55%;
8c, 40%;
8d, 70%;
8e, 80%.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
режиме химической ионизации при атмосферном
давлении (ХИАД). Температуру плавления опреде-
ляли на нагревательном столике Buetius. Продукты
ИК спектры записывали на приборе IR-Prestige-21
реакции выделяли с помощью колоночной хрома-
(Fourier Transform Spectrophotometer - Shimadzu) в
тографии на силикагеле «Chemapol» с размером
вазелиновом масле. Спектры ЯМР получены на
частиц 40/100 мкм. Элементный анализ выполнен с
спектрометре Bruker-AM 500 с рабочей частотой
помощью автоматического CHNS-анализатора
500.13 (1Н), 125.76 (13С) МГц, внутренний стан-
EURO EA - 3000.
дарт-тетраметилсилан (ТМС). За ходом реакции
следили с использованием тонкослойной хроматог-
Общая методика получения N-замещенных
рафии на пластинках Sorbfil ПТСХ-АФ-А, вещества
аминокислот эндиковым ангидридом. 10 ммоль
обнаруживали с помощью УФ-облучения, паров
эндикового ангидрида и 10 ммоль аминокислоты
йода, опрыскивания пластинок раствором нингид-
тщательно растерли в фарфоровой ступке, затем
ринового проявителя или раствором анисового
проводим реакцию прямого сплавления на мас-
альдегида с последующим нагреванием при 100-
ляной бане при температуре 150°С в течение 1 ч.
120°С. Масс-спектры получены на хроматомасс-
После охлаждения реакционной массы до ком-
спектрометре LCMS-2010EV фирмы Shimadzu в
натной температуры, растворяли в чистом ацетоне
7.67
H
H
O
O
5.31
H
H
H
H
H
H
H
H
H
C10,
163.88
H
41.81
C79, 52.36
C15,
136.61
154.07
O
C11
O
56.05
H
H
3.93
W
C13
77.05
72.28
A
B
Данные корреляции HMBC циклопентенового фрагмента молекулы 8b. А - при С15, С79; B - при С11.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 9 2019
1362
САХАУТДИНОВ, МУХАМЕТЬЯНОВА
и выделяли колоночной хроматографией на
1Нa, C8H2), 1.70 д (1Нb, С8Н2, J 8.8), 2.31т (2Н,
силикагеле (элюент - сухой ацетон).
С2'Н2, J 7.3), 3.22 с (2Н, С3a,7aН), 3.31 т (2Н, С5'Н2, J
7.4), 3.35 c (2H, 2C4,7H), 6.06 с (2H, C5,6H), 10.64 c
(1,3-Диоксо-1,3,3a,4,7,7a-гексагидро-2H-4,7-
(1H, OH). Спектр ЯМР 13С, δ, м.д.: 21.80 (C3'H2),
метаноизоиндол-2-ил)уксусная кислота
(3a).
27.03 (C4'H2), 33.31 (C2'H2), 37.78 (C5'H2),
44.84
Выход 1.39 г (63%). Белые кристаллы, т.пл. 139-
(C3a,7aH), 45.68 (C4,7H), 52.22 (C8H2), 134.42 (C5,6H),
141°С. ИК спектр (вазелиновое масло), ν, см-1:
177.9 (C1,3=O), 178.93 (C1'=O). Найдено, %: С 63.89;
1233, 1377, 1461, 1709, 1746, 3180. Спектр ЯМР 1Н
Н 6.54; N 5.33. C14H17NO4. Вычислено, %: С 63.87;
(CDCl3), δ, м.д. (J, Гц): 1.57 д (1Нa, C8H2, J 8.6), 1.74
H 6.51; O 24.31; N 5.32. M 263.29.
д (1Нb, С8Н2, J 8.6), 3.39 с (4Н, 2С7,4Н, 2C7a,3aH),
4.12 с (2Н, С2Н2), 6.08 c (2H, 2C5,6H), 8.73 c (1H,
6-(1,3-Диоксо-1,3,3a,4,7,7a-гексагидро-2H-4,7-
OH). Спектр ЯМР 13С, δ, м.д.: 38.98 (C2'H2), 44.99
метаноизоиндол-2-ил)гексановая кислота
(3e).
(C3a,7aH), 46.11 (C4,7H), 52.25 (C8H2), 134.67 (C5,6H),
Выход 2.07 г (75%). Желтое масло. ИК спектр
170.15 (C1'=O), 177.94 (C1,3=O). Найдено, %: С
(вазелиновое масло), ν, см-1: 725, 1227, 1552, 1695,
59.72; Н 5.00; N 6.35. C11H11NO4. Вычислено, %: С
1731, 3273. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц):
59.73; H 5.01; O 28.93; N 6.33. M 221.21.
1.19-1.57 м (6Н, C3',4',5'H2, 1Нa, C8H2), 1.66 д (1Нb,
С8Н2, J 8.7), 2.23 т (2Н, С2'Н2, J 7.3), 3.17 с (2Н,
3-(1,3-Диоксо-1,3,3a,4,7,7a-гескагидро-2H-4,7-
С3a,7aН), 3.24 т (2Н, С6'Н2, J 7.4 Гц), 3.31 c (2H,
метаноизоиндол-2-ил)пропановая кислота (3b).
2C4,7H), 6.03 с (2H, C5,6H), 10.98 c (1H, OH). Спектр
Выход 1.84г (79%). Густое желтое маслообразное
ЯМР 13С, δ, м.д.: 24.12 (C4'H2), 26.18 (C3'H2), 27.35
вещество. ИК спектр (вазелиновое масло), ν, см-1:
(C5'H2), 33.77 (C2'H2), 37.99 (C6'H2), 44.8 (C3a,7aH),
1229, 1462, 1680, 1738,
3163. Спектр ЯМР 1Н
45.61 (C4,7H), 52.15 (C8H2), 134.33 (C5,6H), 177.95
(CDCl3), δ, м.д. (J, Гц): 1.56 д (1Нa, C8H2, J 8.7), 1.73
(C1,3=O), 178.51 (C1'=O). Найдено, %: С 64.98; Н
д (1Нb, С8Н2, J 8.7), 2.54 т (2Н, C2'H2, J 8.7), 3.29с
6.93; N 5.03. C15H19NO4. Вычислено, %: С 64.97; H
(2Н, С3a,7aН), 3.39 c (2H, 2C4,7H), 3.65 т (2H, C3H2, J
6.91; O 23.08; N 5.05. M 277.32.
7.5), 6.09 c (2H, 2C5,6H), 10.08 c (1H, OH). Спектр
ЯМР 13С, δ, м.д.: 31.76 (C3'H2), 33.63 (C2'H2), 44.91
2-(1,3-Диоксо-1,3,3a,4,7,7a-гексагидро-2H-4,7-
(C3a,7aH), 45.65 (C4,7H), 52.15 (C8H2), 134.38 (C5,6H),
метаноизоиндол-2-ил)пропановая кислота (5a).
175.92 (C1'=O), 177.57 (C1,3=O). Найдено, %: С
Выход 1.72 г (73%). Белые кристаллы, т.пл. 144-
61.28; Н 5.60; N 5.93. C12H13NO4. Вычислено, %: С
146°С. ИК спектр (вазелиновое масло), ν, см-1: 736,
61.27; H 5.57; O 27.21; N 5.95. M 235.08.
1223, 1463, 1674, 1743,
3286. Спектр ЯМР 1Н
4-(1,3-Диоксо-1,3,3a,4,7,7a-гексагидро-2H-4,7-
(CDCl3), δ, м.д. (J, Гц): 1.56 д (1Нa, C8H2, J 8.5 Гц),
метаноизоиндол-2-ил)бутановая кислота
(3c).
1.67 д (1Нb, С8Н2, J 8.5), 1.36 д (3H, C3'H3, J 6.9),
Выход 0.057 г (75%). Густое желтое маслообразное
3.28 с (2Н, С3a,7aН), 3.36 c (2H, 2C4,7H), 4.62 м (1H,
вещество. ИК спектр (вазелиновое масло), ν, см-1:
C2'H), 6.06 c (2H, 2C5,6H), 10.53 c (1H, OH). Спектр
725, 1229, 1571, 1681, 1736, 1762, 3294. Спектр
ЯМР 13С, δ, м.д.: 14.21 (C3'H3), 44.96 (C3a,7aH), 45.77
ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1.47 д (1Нa, C8H2, J
(C4,7H), 47.04 (C2'H), 52.11 (C8H2), 134.46 (C5,6H),
8.7), 1.61 д (1Нb, С8Н2, J 8.7), 1.69 м (2Н, C3'H2),
174.14 (C1'=O), 176.90 (C1,3=O). C12H13NO4, 235.24.
2.17 м (2Н, C2'H2), 3.18 с (2Н, С3a,7aН), 3.32 м (4H,
Найдено, %: С 61.25; Н 6.00; N 5.93. Вычислено, %:
2C4,7H, C4'H2), 6.02 м (2H, C5,6H), 11.1 c (1H, OH).
С 61.27; H 5.57; O 27.21; N 5.95.
Спектр ЯМР 13С, δ, м.д.: 22.84 (C3'H2), 31.22 (C2'H2),
2-(1,3-Диоксо-1,3,3a,4,7,7a-гексагидро-2H-4,7-
37.63 (C4'H2), 44.79 (C3a,7aH), 45.62 (C4,7H),
52.18
метаноизоиндол-2-ил)-3'метилбутановая кислота
(C8H2),
134.4 (C5,6H),
176.85 (C1'=O),
177.83
(5b). Выход 1.89 г (72%). Белые кристаллы, т.пл.
(C1,3=O). Найдено, %: С 62.66; Н 6.09; N 5.63.
107-109°С. ИК спектр (вазелиновое масло), ν, см-1:
C13H15NO4. Вычислено, %: С 62.64; H 6.07; O 25.27;
721, 1193, 1213, 1404, 1512, 1676, 1708,
3225.
N 5.62. M 249.26.
Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 0.74 д (3H,
5-(1,3-Диоксо-1,3,3a,4,7,7a-гексагидро-2H-4,7-
CH3, J 6.9), 0.96 д (3H, CH3, J 6.7), 1.54 д (1Нa,
метаноизоиндол-2-ил)пентановая кислота (3d).
C8H2, J 8.5), 1.72 д (1Нb, С8Н2, J 9.0), 2.46 м (3H,
Выход 1.78 г (68%). Белые кристаллы, т.пл. 117-
C3'H3), 3.29 с (2Н, С3a,7aН), 3.35 c (2H, 2C4,7H), 4.22
119°С. ИК спектр (вазелиновое масло), ν, см-1: 720,
д (1H, C2'H, J 8.0), 6.09 c (2H, 2C5,6H), 10.8 c (1H,
1230, 1551, 1692, 1713,
3435. Спектр ЯМР 1Н
OH). Спектр ЯМР 13С, δ, м.д.: 19.36 (C4'H3), 20.76
(CDCl3), δ, м.д. (J, Гц): 1.42-1.56 м (4Н, C3',4'H2,
(C5'H3), 27.75 (C3'H), 44.88 (C3a,7aH), 45.91 (C4,7H),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 9 2019
СИНТЕЗ НОВЫХ ЦИКЛОПЕНТЕНОФУЛЛЕРЕНОВ С НОРБОРНЕНОВЫМ ФРАГМЕНТОМ
1363
52.67 (C8H2), 57.64 (С2'H), 134.93 (C5,6H),
173.01
мешивали в течение 2 ч. Растворитель отгоняли,
(C1'=O), 177.39 (C1,3=O). Найдено, %: С 63.89; Н
продукты реакции выделяли колоночной хроматог-
6.49; N 5.35. C14H17NO4. Вычислено, %: С 63.87; H
рафией на силикагеле (элюент
- петролейный
6.51; O 24.31; N 5.32. M 263.29.
эфир-этилацетат, 4:1).
2-(1,3-Диоксо-1,3,3a,4,7,7a-гексагидро-2H-4,7-
Метил-4-(1,3-диоксо-1,3,3a,4,7,7a-гексагидро-
метаноизоиндол-2-ил)-4-метилпентановая
2H-4,7-метаноизоиндол-2-ил)бута-2,3-диеноат
кислота (5c). Выход 2.61 г (94%). Светло-желтые
(6a). Выход 0.53 г (45%). Желтое масло. ИК спектр,
кристаллы, т.пл. 109-111°С. ИК спектр (вазели-
ν, см-1: 719, 1170, 1380, 1456, 1598, 1704. Спектр
новое масло), ν, см-1: 720, 1228, 1462, 1562, 1680,
ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1.51 д (1Нa, C8H2, J
1747, 3280. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц):
8.9), 1.69 д (1Нb, С8Н2, J 8.8), 3.29 с (2Н, С3a,7aН),
0.84 м (6H, 2CH3), 1.32 м (1H, C4'H), 1.51 д (1Нa,
3.36 c (2H, 2C4,7H), 3.68 c (3H, C1''H3), 6.05 c (1H,
C8H2, J 8.7), 1.69 д (1Нb, С8Н2, J 8.8), 1.75 м (1Hb,
C5'H), 6.09 c (2H, 2C5,6H), 6.91 c (1H, C3'H). Спектр
C3'H2), 1.94 м (1Ha, C3'H2), 3.26 с (2Н, С3a,7aН), 3.35 c
ЯМР 13С, δ, м.д.: 45.24 (C3a,7aH), 45.88 (C4,7H), 52.16
(2H, 2C4,7H), 4.57 м (1H, C2'H), 6.04 c (2H, 2C5,6H),
(OС1''H3), 52.31 (C8H2), 91.31 (=С4'Н), 96.06 (=С2'Н),
10.53 c (1H, OH). Спектр ЯМР 13С, δ, м.д.: 20.82
134,56 (C5,6H), 164.43 (С1'=О), 174.14 (С1,3=О),
(C1''H3), 23.01 (C5'H3), 24.62 (C4'H), 36.43 (C3'H2),
210.13 (=С=). Найдено, %: С 64.84; H 5.08, N 5.42.
44.87 (C3a,7aH), 45.90 (C4,7H), 46.01 (C2'H),
52.67
C14H13NO4. Вычислено, %: С, 64.86; H, 5.05; O
(C8H2),134.76 (C5,6H),
174.12 (C1'=O),
177.28
24.68; N 5.40. M 259.26.
(C1,3=O). Найдено, %: С 65.00; Н 6.89; N 5.25.
Метил-5-(1,3-диоксо-1,3,3a,4,7,7a-гексагидро-
C15H19NO4. Вычислено, %: С 64.97; H 6.91; O 23.08;
2H-4,7-метаноизоиндол-2-ил)пента-2,3-диеноат
N 5.05. M 263.29.
(6b). Прозрачное масло. Выход 1.12 г (96%). ИК
спектр, ν, см-1: 728, 1172, 1336, 1389, 1413, 1704,
2-[1,3-Диоксо-3a,4,7,7a-тетрагидро-1H-4,7-
1722, 2104. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц):
метаноизоиндол-2(3H)-ил]-3-фенилпропановая
1.46 д (1Нa, C8H2, J 8.9), 1.67д (1Нb, С8Н2, J 8.8),
кислота (5d). Выход 2.49 г (80%). Белые крис-
3.18 с (2Н, С3a,7aН), 3.34 c (2H, 2C4,7H), 3.67 c (3H,
таллы, т.пл. 152-154°С. ИК спектр (вазелиновое
C1''H3), 4.01 м (2H, C6'H2), 5.52 м (1H, C3'H), 5.62 м
масло), ν, см-1: 721, 1224, 1456, 1684, 1752, 3251.
(1H, C5'H), 6.06 c (2H, 2C5,6H). Спектр ЯМР 13С, δ,
Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1.4 д (1Нa,
м.д.: 35.35 (C5'H), 45.03 (C3a,7aH), 45.74 (C4,7H),
C8H2, J 8.6), 1.57 д (1Нb, С8Н2, J 8.5), 3.10 с (2Н,
52.08 (OС1''H3), 52.12 (C8H2), 89.96 (=С4'Н), 90.36
С3a,7aН), 3.22 c (2H, 2C4,7H), 3.37 м (2H, C3'H2), 5.01
(=С2'Н),
134,46 (C5,6H),
165.38 (С1'=О),
176.79
м (1H, C2'H), 5.68 c (2H, 2C5,6H), 7.1-7.26 м (5H,
(С1,3=О), 212.54 (=С=). Найдено, %: С 65.90; H 5.53;
C6H5), 10.36 c (1H, OH). Спектр ЯМР 13С, δ, м.д.:
N 5.15. C15H15NO4. Вычислено, %: С 65.92; H 5.53;
33.50 (C3'H2), 44.85 (C3a,7aH), 45.82 (C4,7H),
52.11
O 23.42; N 5.13. M 273.28.
(C8H2), 52.48 (C2'H), 126.91 (C4''H), 128.57 (C3''5''H),
129.01 (C2'',6''H),
134.24 (C5,6H),
136.14 (C1''H),
Метил-6-(1,3-диоксо-1,3,3a,4,7,7a-гексагидро-
173.29 (C1'=O), 177.14 (C1,3=O). Найдено, %: С
2H-4,7-метаноизоиндол-2-ил)гекса-2,3-диеноат
69.46; Н 5.52; N 4.48. C18H17NO4. Вычислено, %: С
(6с). Густое желтое масло. Выход 0.91 г (87%). ИК
69.44; H 5.50; O 20.56; N 4.50. M 263.29.
спектр, ν, см-1: 726, 1164, 1262, 1397, 1436, 1498,
1767, 1962. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц):
Общая методика получения алленоатов
1.12 м (2H, C6'H2), 1.44 д (1Нa, C8H, J 8.7), 1.61 д
межмолекулярной реакцией Виттига. К
(1Нb, С8Н2, J 7.3), 2.17 м (2H, C5'H2), 3.24 с (2Н,
суспензии 1 г кислоты в 10 мл сухого хлористого
С3a,7aН), 3.34 c (2H, 2C4,7H), 3.58 c (3H, C1''H3), 5.46
метилена добавляли пятикратный избыток окса-
м (2H, C2',4'H), 5.96 c (2H, 2C5,6H). Спектр ЯМР 13С,
лилхлорида и оставили на ночь. Растворитель и
δ, м.д.: 25.80 (C5'H), 35.94 (C6'H), 45.71 (C3a,7aH),
избыток оксалилхлорида упаривали на роторном
45.62 (C4,7H), 52.05 (OС1''H3), 52.36 (C8H2), 89.29
испарителе. Хлорангидрид далее использовали без
(=С2'Н),
91.87
(=С4'Н),
134.34 (C5,6H),
165.93
дополнительной очистки. К раствору метил (три-
(С1'=О), 177.47 (С1,3=О), 212.31 (=С=). Найдено, %:
фенилфосфоранилиден)ацетата в CH2Cl2 прикапы-
С 66.87; H 5.99; N 4.90. C16H17NO4. Вычислено, %:
вали эквимольное количество Et3N, раствор охлаж-
С 66.89; H 5.96; O 22.27; N 4.88. M 287.31.
дали до -5°С. К этому раствору медленно по каплям
добавляли охлажденный раствор хлорангидрида N-
Метил-7-(1,3-диоксо-1,3,3a,4,7,7a-гексагидро-
замещенной аминокислоты. Реакционную массу пере-
2H-4,7-метаноизоиндол-2-ил)гепта-2,3-диеноат
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 9 2019
1364
САХАУТДИНОВ, МУХАМЕТЬЯНОВА
(6d). Прозрачное масло. Выход 1.03 г (90%). ИК
(3H, C6'H3, J 6.8), 1.01 д (3H, C7'H3, J 7.0), 1.53 д
спектр, ν, см-1: 728, 1162, 1263, 1398, 1439, 1688,
(1Нa, C8H2, J 8.9), 1.72 д (1Нb, С8Н2, J 8.8), 2.73 м
1763, 1975. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц):
(1H, C5'H), 3.29 с (2Н, С3a,7aН), 3.41 c (2H, 2C4,7H),
1.51-1.61 м (4Н, 2C6',7'H2), 1.62 д (1Нa, C8H2, J 8.7),
3.72 c (3H, C1''H3),5.92 м (1H, C2'H, C4'), 6.13 c (2H,
1.71 д (1Нb, С8Н2, J 7.3), 2.08 м (2H, C5'H2), 3.23 с
2C5,6H). Спектр ЯМР 13С, δ, м.д.: 19.95 (C6',7'H2),
(2Н, С3a,7aН), 3.36 c (2H, 2C4,7H), 3.71 c (3H, C1''H3),
28.70 (C5'H2), 45.30 (C3a,7aH), 45.97 (C4,7H),
52.21
5.58 м (2H, C2',4'H), 6.03 c (2H, 2C5,6H). Спектр ЯМР
(OС1''H3),
52.23 (C8H2),
94.17
(=С2'Н),
113.55
13С, δ, м.д.: 24.87 (C6'H), 25.82 (C7'H), 26.79 (C5'H),
(=С4'Н),
134.72 (C5,6H),
164.59 (С1'=О),
175.73
44.90 (C3a,7aH), 45.71 (C4,7H), 52.02 (OС1''H3), 52.24
(С1,3=О), 209.80 (=С=). Найдено, %: С 67.78; H 6.33;
(C8H2), 88.57 (=С2'Н), 94.32 (=С4'Н), 134.42 (C5,6H),
N 4.67. C17H19NO4. Вычислено, %: С 67.76; H 6.36;
164.44 (С1'=О),
177.68 (С1,3=О),
212.23
(=С=).
O 21.24; N 4.65. M 301.34.
Найдено, %: С 67.78; H 6.38; N 4.67. C17H19NO4.
Метил-4-(1,3-диоксо-1,3,3a,4,7,7a-гексагидро-
Вычислено, %: С 67.76; H 6.36; O 21.24; N 4.65. M
2H-4,7-метаноизоиндол-2-ил)-6-метилгепта-2,3-
301.34.
диеноат (7c). Желтое масло. Выход 0.42 г (35%).
Метил-8-(1,3-диоксо-1,3,3a,4,7,7a-гексагидро-
ИК спектр, ν, см-1: 727, 1163, 1386, 1437, 1684,
2H-4,7-метаноизоиндол-2-ил)окта-2,3-диеноат
1710. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 0.71 м
(6e). Прозрачное масло. Выход 0.5 г (50%). ИК
(6H, 2C7',8'H3, J 6.8), 1.41 м (1Нa, C8H2, 1Н, C6'H),
спектр, ν, см-1: 724, 1162, 1263, 1398, 1437, 1698,
1.53 д (1Нb, С8Н2, J 9.0), 1.95 м (1H, C6'H), 2.02 м
1763, 1959. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц):
(2H, C5'H2), 3.14 с (2Н, С3a,7aН), 3.21 c (2H, 2C4,7H),
1.31-1.43 м (6H, 3C6',7',8'H2), 1.48 д (1Нa, C8H2, J 8.6),
3.54 c (3H, C1''H3), 5.69 м (1H, C2'H, C4'), 5.93 c (2H,
1.68 д (1Нb, С8Н2, J 8.6), 2.08 м (2H, C5'H2), 3.19 с
2C5,6H); Спектр ЯМР 13С, δ, м.д.: 20.79 (С7',8'H3),
(2Н, С3a,7aН), 3.34 c (2H, 2C4,7H), 3.68 c (3H, C1''H3),
24.30 (C6'H), 36.18 (C5'H2), 45.40 (C3a,7aH),
45.92
5.52 м (2H, 2C2',4'H), 6.03 c (2H, 2C5,6H). Спектр
(C4,7H), 52.02 (OС1''H3), 52.30 (C8H2), 92.40 (=С2'Н),
ЯМР 13С, δ, м.д.: 25.75 (C6'H2), 26.85 (C7'H2), 26.97
106.34
(=С4'Н),
134.50 (C5,6H),
164.23 (С1'=О),
(C5'H2), 37.92 (C8'H2), 44.85 (C3a,7aH), 45.67 (C4,7H),
176.26 (С1,3=О), 210.86 (=С=). Найдено, %: С 69.26;
51.98 (OС1''H3), 52.20 (C8H2), 88.17 (=С2'Н), 94.86
H 7.06; N 4.24. C18H21NO4. Вычислено, %: С 69.28;
(=С4'Н),
134.40 (C5,6H),
166.51 (С1'=О),
177.52
H 7.04; O 19.43; N 4.25. M 329.39.
(С1,3=О), 212.28 (=С=). Найдено, %: С 68.58; H 6.73;
Метил-4-(1,3-диоксо-1,3,3a,4,7,7a-гексагидро-
N 4.46. C18H21NO4. Вычислено, %: С 68.55; H 6.71;
2H-4,7-метаноизоиндол-2-ил)-5-фенилпента-2,3-
O 20.29; N 4.44. M 315.36.
диеноат
(7d). Выход
0.54 г
(51%). Белые
Метил-4-(1,3-диоксо-1,3,3a,4,7,7a-гексагидро-
кристаллы, т.пл. 89-91°С. ИК спектр, ν, см-1: 717,
2H-4,7-метаноизоиндол-2-ил)пента-2,3-диеноат
1162, 1269, 1349, 1456,
1710. Спектр ЯМР 1Н
(7a). Прозрачное масло. Выход 0.47 г (40%). ИК
(CDCl3), δ, м.д. (J, Гц): 1.41 д (1Нa, C8H2, J 8.7), 1.56
спектр, ν, см-1: 721, 1157, 1417, 1568, 1722,1742 .
д (1Нb, С8Н2, J 8.8), 3.16 с (2Н, С3a,7aН), 3.25 c (2H,
Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 1.26 д (3H,
2C4,7H), 3.37 м (2H, C3'H2), 3.76 c (3H, C1''H3), 5.51 м
CH3, J 7.0), 1.51 д (1Нa, C8H2, J 8.7), 1.74 д (1Нb,
(1H, C2'H, C4'), 5.93 c (2H, 2C5,6H), 7.1-7.26 (5H,
С8Н2, J 8.8), 3.28 с (2Н, С3a,7aН), 3.43 c (2H, 2C4,7H),
C6H5). Спектр ЯМР 13С, δ, м.д.: 36.16 (C5'H2), 45.09
3.68 c (3H, C1''H3), 4.58 м (1H, C2'H), 6.12 c (2H,
(C3a,7aH), 45.82 (C4,7H), 51.88 (OС1''H3), 52.37 (C8H2),
2C5,6H). Спектр ЯМР 13С, δ, м.д.: 14.21 (C3'H3),
93.00 (=С2'Н), 105.91 (=С4'Н), 126.09 (C4''H), 128.29
45.28 (C3a,7aH), 45.93 (C4,7H), 52.24 (OС1''H3), 52.24
(C3','5''H), 129.27 (C2'',6''H), 134.11 (C5,6H),
135.61
(C8H2), 88.74 (=С2'Н), 110.79 (=С4'Н), 134.50 (C5,6H),
(C6H5),
164.41 (С1'=О),
175.34 (С1,3=О),
211.13
166.96 (С1'=О),
176.83 (С1,3=О),
208.69
(=С=).
(=С=). Найдено,
%: С 72.17; H
5.51; N
4.03.
Найдено, %: С 65.94; H 5.55; N 5.15. C15H15NO4.
C21H19NO4. Вычислено, %: С 72.19; H 5.48; O 18.32;
Вычислено, %: С 65.92; H 5.53; O 23.42; N 5.13. M
N 4.01. M 349.38.
273.28.
Методика получения циклопентенофуллере-
Метил-4-(1,3-диоксо-1,3,3a,4,7,7a-гескагидро-
нов С60 8b-e. Фуллерен С60 0.14 ммоль (100 мг)
2H-4,7-метаноизоиндол-2-ил)-5-метилгекса-2,3-
предварительно (за
12 ч) растворяли в 35 мл
диеноат (7b). Желтое масло. Выход 0.48 г (48%).
толуола. Алленоаты 0.14 ммоль, растворенные при
ИК спектр, ν, см-1: 722, 1170, 1377, 1469, 1593,
комнатной температуре в 5 мл толуола, добавляли
1708. Спектр ЯМР 1Н (CDCl3), δ, м.д. (J, Гц): 0.97 д
к фуллерену С60. Затем вводили эквимольное
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 9 2019
СИНТЕЗ НОВЫХ ЦИКЛОПЕНТЕНОФУЛЛЕРЕНОВ С НОРБОРНЕНОВЫМ ФРАГМЕНТОМ
1365
количество PPh3 и кипятили с обратным холодиль-
1'-Метилкарбонил-3'-{3'-[1,3-диоксо-3a,4,7,7a-
ником на магнитной мешалке
(300 об/мин) в
тетрагидро-1H-4,7-метаноизоиндол-2(3H)-ил]н-
течение 12 ч. Соединения 8b-e выделяли в индиви-
пропил}-1'-циклопентено[4',5':1f,2f][60]фулле-
дуальном виде с помощью флэш хроматографии
рен (8d). Выход 0.1 г (70%). Спектр ЯМР 1Н
(элюент - петролейный эфир-этилацетат, 4:1).
(CDCl3), δ, м.д. (J, Гц): 1.51 м (2H, C2''H2), 1.57 д
(1Нa, C8H2, J 7.4), 1.72 д (1Нb, С8Н2, J 9.0), 2.02 м
1'-Метилкарбонил-3'-{[1,3-диоксо-3a,4,7,7a-
(1H, C3''Ha), 2.48 м (1H, C3''Hb), 3.36 с (2Н, 2С4,7Н),
тетрагидро-1H-4,7-метаноизоиндол-2(3H)-ил]ме-
3.37 м (2H, C1''H2), 3.54 с (2H, 2C3a,7aH), 3.71 c (3H,
тил}-1'-циклопентено[4',5':1,2][60]фуллерен (8b).
CH3), 4.62 м (1H, C1'H), 6.07 c (2H, 2C5,6H), 7.65 м
Выход 0.071 г (55%). Спектр ЯМР 1Н (CDCl3), δ,
(1H, C2'H). Спектр ЯМР 13С, δ, м.д.: 24.89, 26.81,
м.д. (J, Гц): 1.71 д (1Нa, C8H2, J 8.5), 1.91 д (1Нb,
32.63, 45.64 (C4,7H), 45.77 (C3a,7aH), 52.27 (OСH3),
С8Н2, J 9.0), 3.49 с (2Н, 2С4,7Н), 3.58 с (2H,
52.68 (C8H2), 57.06, 76.22 (C4'), 77.24 (C5'), 128.46,
2C3a,7aH), 3.78 c (3H, CH3), 4.39 д (1Нb, С1''Н2, J 5.0),
128.56,
131.20,
132.07,
132.15,
133.93,
134.41,
4.41 д (1Нa, С1''Н2, J 5.0), 5.03 м (1H, C1'H), 6.38 c
134.53,
134.62,
134.79,
134.95,
135.95 (C5,6H),
(2H, 2C5,6H), 7.56 м (1H, C2'H). Спектр ЯМР 13С, δ,
135.56,
135.95,
136.14,
139.28,
139.40,
139.83,
м.д.: 42.26 (C1''H2), 45.26 (C4,7H), 46.04 (C3a,7aH),
140.15,
141.57,
141.65,
141.91,
142.02,142.16,
52.42 (OСH3), 52.68 (C8H2), 55.23 (С1'H3),
72.22
142.24,
142.43,
142.63,
142.68,
142.73,
143.07,
(C4'), 72.27 (C5'), 128.57, 128.68, 131.80, 131.88,
143.10, 144.37, 145.25 (C3'H), 145.88, 146.07, 147.22,
134.29, 134.46, 134.71, 135.05 (C5,6H), 135.58, 135.69,
147.29, 147.99, 148.11 (C2'), 150.49, 150.86, 156.72,
136.55,
136.67,
139.35,
139.41,
139.81,
140.44,
163.98 (С1'=О), 177.57 (С1,3=О). Найдено, %: С
141.61,
141.72,
141.83,
141.89,
141.94,
142.25,
90.51; H 1.88; N 1.39. C77H19NO4. Вычислено, %: С
142.46, 142.67, 142.72, 142.73, 142.79, 143.11, 143.13,
90.49; H 1.87; O 6.26; N 1.37. M 1021.98.
144.33, 144.46, 144.50, 144.57, 145.20, 145.29 (C2'H),
145.35,
145.44,
145.53,
145.63,
145.89,
145.90,
1'-Метилкарбонил-3'-{4'-[1,3-диоксо-3a,4,7,7a-
146.06,
146.16,
146.26,
146.29,
146.32,
146.39,
тетрагидро-1H-4,7-метаноизоиндол-2(3H)-ил]н-
147.29, 147.41, 148.08 (C3'), 150.46, 150.52, 150.77,
бутил}-1'-циклопентено[4',5':1f,2f][60]фуллерен
156.14, 163.90 (С1'=О), 177.53 (С1,3=О). Найдено, %:
(8e). Выход 0.136 г (80%). Спектр ЯМР 1Н (CDCl3),
С 90.58; H 1.72; N 1.41. C75H15NO4. Вычислено, %:
δ, м.д. (J, Гц): 1.22 c (2H, C1''H2), 1.50 м (2H, C3''H2),
С 90.56; H 1.70; O 6.35; N 1.39. M 1007.95.
1.66 д (1Нa, C8H2, J 7.4), 1.71 д (1Нb, С8Н2, J 9.0),
1'-Метилкарбонил-3'-{2'-[1,3-диоксо-3a,4,7,7a-
2.12 м (1H, C2''Ha), 2.58 м (1H, C2''Hb), 3.27 с (2Н,
тетрагидро-1H-4,7-метаноизоиндол-2(3H)-ил]-
2С4,7Н), 3.39 м (2H, C4''H2), 3.56 с (2H, 2C3a,7aH),
этил}-1-циклопентено[4,5:1f,2f][60]фуллерен
3.70 c (3H, CH3), 5.24 м (1H, C1'H), 6.02 c (2H,
(8c). Выход 0.056 г (40%).Спектр ЯМР 1Н (CDCl3),
2C5,6H), 7.62 м (1H, C2'H). Спектр ЯМР 13С, δ, м.д.:
δ, м.д. (J, Гц): 1.74 д (1Нa, C8H2, J 8.5), 1.91 д (1Нb,
19.87 (C1''H2), 20.02 (C2''H2), 29.26 (C3''H2),
32.47
С8Н2, J 9.0), 2.33 м (1H, C2''Ha), 2.68 м (1H, C2''Hb),
(C4''H2), 44.88 (C4,7H), 45.70 (C3a,7aH), 52.27 (OСH3),
3.21 с (2Н, 2С4,7Н), 3.33 м (2H, C1''H2), 3.52 с (2H,
53.50 (C8H2), 69.47 (С1'H3), 76.22 (C4'), 77.24 (C5'),
2C3a,7aH), 3.55 м (1H, C3''H), 3.72 c (3H, CH3), 6.09 c
94.54, 120.71, 128.54, 128.64, 131.71, 132.07, 132.44,
(2H, 2C5,6H) , 7.26 м (1H, C4''H). Спектр ЯМР 13С, δ,
133.47,
134.09,
134.42,
134.53,
134.62,
134.79,
м.д.: 25.78 (C2''H2), 36.96 (C1''H2), 45.03 (C4,7H), 45.93
134.95,
135.95 (C5,6H),
135.56,
135.95,
136.14,
(C3a,7aH), 52.16 (OСH3), 52.52 (C8H2), 54.69 (С3''H3),
139.28,
139.40,
139.83,
140.15,
141.57,
141.65,
76.22 (C4'), 77.24 (C5'), 128.46, 128.56, 131.20, 132.07,
141.91,
142.02,
142.16,
142.24,
142.43,
142.63,
132.15,
133.93,
134.41,
134.53,
134.62,
134.79,
142.68, 142.73, 143.07, 143.10, 144.37, 145.25 (C2'H),
134.95,
135.95 (C5,6H),
135.56,
135.95,
136.14,
145.88, 146.07, 147.22, 147.29, 147.99, 148.11 (C3'),
139.28, 139.40, 139.83, 140.15, 141.57, 141.65, 141.91,
150.49,
150.86,
156.72,
166.30 (С1'=О),
177.68
142.02,142.16,
142.24,
142.43,
142.63,
142.68,
(С1,3=О). Найдено, %: С 90.45; H 2.06; N 1.34.
142.73,
143.07,
143.10,
144.41,
144.47,
144.51,
C78H21NO4. Вычислено, %: С 90.43; H 2.04; O 6.18;
145.14,
145.27,
145.47,
145.59,
145.92,
145.99,
N 1.35. M 1021.98.
146.12, 146.21, 146.29, 146.32, 146.39, 146.71 (C4''H),
147.25, 147.38, 148.22 (C3'), 150.54, 150.82, 152.03,
БЛАГОДАРНОСТИ
156.49, 164.08 (С1'=О), 177.68 (С1,3=О). Найдено,%:
С 90.54; H 1.72; N 1.37. C76H17NO4. Вычислено, %:
Спектральная часть исследования проведена на
С 90.56; H 1.70; O 6.35; N 1.39. M 1007.95.
оборудовании ЦКП «Химия» УфИХ РАН.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 9 2019
1366
САХАУТДИНОВ, МУХАМЕТЬЯНОВА
ФОНДОВАЯ ПОДДЕРЖКА
5. Malikova R.N., Sakhautdinov I.M., Abdullin M.F.,
Mukhametyanova A.F., Yunusov M.S. Chem.
Работа выполнена в соответствии с планом научно-
Nat. Compd., 2017, 53, 341. doi 10.1007/s10600-017-
исследовательских работ ФГБУН Уфимского инс-
1984-5
титута химии РАН по теме «Синтез биологически
6. Sakhautdinov I.M., Gumerov A.M., Batyrshin I.R.,
активных гетероциклических и терпеноидных
Fatykhov A.A., Suponitsky K.Yu., Yunusov M.S.
Heterocycles. 2014, 89, 641. doi 10.3987/COM-13-
соединений»
(№ Гос. Регистрации АААА-А17-
12910
117011910025-6).
7. Sakhautdinov I.M., Gumerov A.M., Gibadullina G.G.,
КОНФЛИКТ ИНТЕРЕСОВ
Zakiryanova O.V., Yunusov M.S. Chem. Nat. Compd.
2015, 2, 332. doi 10.1007/s10600-015-1292-x
Авторы заявляют об отсутствии конфликта
8. Sakhautdinov I.M., Gumerov A.M., Malikova R.N.,
интересов.
Fatykhov A.A., Yunusov M.S. Chem. Nat. Compd.
2016, 4, 562. doi 10.1007/s10600-016-1731-3
СПИСОК ЛИТЕРАТУРЫ
9. Krause N., Hashmi A.S., Weinheim K. Modern Allene
Chemistry, 2004.
1. Wharton T., Wilson L. J. Bioorg. Med. Chem. 2002, 10,
10. Ikuma N., Inaba S., Kokubo K., Oshima T. Chem.
3545.
Commun. 2014, 50, 581. doi 10.1039/C3CC45783D
2. Трошина О.А. Дис. канд. хим. наук. Черноголовка.
11. Sakhautdinov I.M., Malikova R.N., Akchurina O.V.,
2007.
Petrova S.F., Yunusov M.S. Lett. Org. Chem. 2017, 14,
3. Пальчиков В.А., Зленко Е.Т., Дульнев П.Г., Касьян А.О.,
575. doi 10.2174/1570178614666170614091621
Крищик О.В., Пришляк И.С., Тарабара И.Н.,
12. Sakhautdinov I.M., Malikova R.N., Nugumanov T.R.,
Касьян Л.И. Ж. Орг. Фарм. Хим. 2011, 9, 36.
Biglova Yu.N., Atangulov A.B., Yunusov M.S.
4. Тарабара И.Н., Зленко Е.Т., Бондаренко Я.С., Кри-
Chem. Nat. Compd. 2018, 54, 481. doi 10.1007/s10600-
щик О.В., Касьян Л.И. Ж. Орг. Фарм. Хим. 2006, 4, 14.
018-2384-1
Synthesis of New Cyclopentenofullerenes
with Norbornene Fragment
I. M. Sakhautdinov and A. F. Mukhametyanova*
Ufa Institute of Chemistry UFIC RAS, 450054, Russia, Republic of Bashkortostan, Ufa, pr. Oktyabrya 69
*e-mail: afmhim@bk.ru
Received February 8, 2019; revised March 28, 2019; accepted April 12, 2019
Endic anhydride imides were synthesized by direct fusion with different amino acids. Further transformations of
the obtained acids yielded new allenoates with the norbornene fragment. New mono-adducts of fullerene C60
have been synthesized, by phosphine-catalyzed [3+2]-addition of allenates to the fullerene frame.
Keywords: endic anhydride, norbornene, amino acids, imides, fullerene, cyclopentenofullerenes
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 55 № 9 2019