ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 1, с. 52-64
УДК 547.556.9 + 547.789.61
СИНТЕЗ, СПЕКТРАЛЬНЫЕ, ЭЛЕКТРОХИМИЧЕСКИЕ И
АНТИОКСИДАНТНЫЕ СВОЙСТВА
2-{5-(АРИЛ)-6-R-3-ФЕНИЛ-5,6-ДИГИДРО-
4H-[1,2,4,5]ТЕТРАЗИН-1-ИЛ}БЕНЗОТИАЗОЛОВ
© 2020 г. Т. Г. Федорченкоa, *, Г. Н. Липуноваa, b, А. В. Щепочкинa, b, М. С. Валоваa,
А. Н. Цмокалюкb, П. А. Слепухинa, b, О. Н. Чупахинa, b
a ФГБУН «Институт органического синтеза им. И.Я. Постовского УрО РАН»,
620219, Россия, г. Екатеринбург, ул. Софьи Ковалевской 22/Академическая 20
*e-mail: deryabina@ios.uran.ru
b ФГАОУ ВО «Уральский федеральный университет им. первого Президента России Б.Н. Ельцина»,
Институт Химической Технологии,
620002, Россия, г. Екатеринбург, ул. Мира 28
Поступила в редакцию 10 июня 2019 г.
После доработки 14 ноября 2019 г.
Принята к публикации 22 ноября 2019 г.
Новые 2-[5-(арил)-6-R-3-фенил-5,6-дигидро-4H-[1,2,4,5]тетразин-1-ил]бензотиазолы синтезированы из
соответствующих формазанов алкилированием и последующей циклизацией N-алкилпроизводных.
Продукты охарактеризованы методами спектроскопии ЯМР 1H, 13C, ИК, масс-спектрометрии и рент-
геноструктурного анализа. Изучены электрохимические свойства и антиоксидантная активность
полученных бензотиазолов.
Ключевые слова: 2-[5-(арил)-6-R-3-фенил-5,6-дигидро-4H-[1,2,4,5]тетразин-1-ил]-бензотиазолы, дигидро-
тетразины, циклическая вольтамперометрия, электрохимические свойства, антиоксидантная активность.
DOI: 10.31857/S0514749220010073
Процессы окислительной деструкции биологи-
Цель данной работы - изучение электрохими-
ческих компонентов в организме, индуцированные
ческих и антиоксидантных свойств вновь
свободными радикалами, часто приводят к
синтезированных
2-[5-(арил)-6-R-3-фенил-5,6-
окислительному стрессу, который является при-
дигидро-4H-[1,2,4,5]тетразин-1-ил]-бензотиазолов
чиной многих дегенеративных заболеваний [1, 2].
2-5 и влияния структурных факторов на эти
Чтобы предотвратить или уменьшить воздействие
свойства.
окислительного стресса на клетки, используют
Соединения 2-5 получены алкилированием 1-
антиоксиданты, соединения, обладающие способ-
арил-5-(бензтиазол-2-ил)-3-фенилформазанов
1
ностью тушить свободные радикалы [3]. В ка-
галогеналканами в спиртово-щелочной среде и
честве таких соединений широко известны произ-
последующей циклизацией N-алкилпроизводных
водные фенолов, аминов, как биогенных, так и
(схема 1) по описанной ранее методике [10]. Все
синтетических, и азотистых гетероциклов (индола,
соединения охарактеризованы данными элемент-
карбазола, дигидропиридина, дигидроакридинов и
ного анализа, 1Н и 13С ЯМР, ИК спектроскопии,
других)
[4-8]. Ранее сообщалось об антиокис-
масс-спектрометрии и РСА на примере производ-
лительной активности тетразолилпроизводных 5,6-
ного 4b (рис. 1). Производные 2а, 3а и 4а получены
дигидро-4Н-[1,2,4,5]тетразина, прекурсоров для
и описаны нами ранее
[11], в данной работе
получения вердазилов
[9]. Большинство анти-
приведены для сравнения.
оксидантов являются электрохимически активны-
ми соединениями, способными превращаться в
В спектрах ЯМР 1Н производных 2-5 при-
стабильные свободные радикалы.
сутствует синглет NH протона при 9.52-9.62 м.д.
52
СИНТЕЗ, СПЕКТРАЛЬНЫЕ, ЭЛЕКТРОХИМИЧЕСКИЕ И АНТИОКСИДАНТНЫЕ СВОЙСТВА
53
Схема 1.
X
X
1. RCH2Hlg,
N
N R
NaOH
EtOH,
S
NH
N
S
N N
2. heptane,
N N
N NH
Ph
Ph
1a-e
2a-f, 3a-e, 5a-e
1, X = H (a), F (b), Cl (c), Br (d), I (e); 2, R = H; X= H (a), F (b), Cl (c), Br (d), I (e), MeO (f); 3, R = Me; X= H (a), F (b),
Cl (c), Br (d), I (e); 4, R = Et; X = H (a), F (b), Cl (c), Br (d), I (e); 5, R = CH2=CH-; X = H (a), F (b), Cl (c), Br (d), I (e).
Широкий синглет CH2 группы в спектре соеди-
няется и в ряду производных 3а-е: 66.71 (3а), 67.19
нениий 2a-f наблюдается при 5.38-5.49 м.д. Сиг-
(3b), 66.64-66.39 (3c-e) м.д. и для производных 4а-е:
нал протона у C6 в соединениях 3а-е смещен в сла-
71.73 (4а), 72.24 (4b), 71.64-71.39 (4c-e) м.д. Сле-
бое поле по сравнению с незамещёнными 2a-е и
дует отметить, что сигналы C6 в соединениях 5а-е
проявляется в области 6.32-6.40 м.д.; в соедине-
(R = СН=СН2) близки таковым для соединений 4а-е:
ниях 4а-е - в области 6.08-6.18 м.д. В ряду соеди-
71.19 (5а), 71.70 (5b), 71.06, 70.93 (5d, e) м.д.
нений 3-4-5 наблюдается сильнопольный сдвиг
В ИК спектрах соединений 2-5 проявляется
протона в положении С6, для соединений 5a-e он
полоса валентных колебаний NH группы в области
проявляется в виде мультиплета в области 6.02-
3150-3260 см-1. В масс-спектрах соединений 2-5
6.05 м.д. Причём, в рядах соединений 3a-e и 4a-e
регистрируется пик иона (М + Н)+.
наибольшее влияние галогена на положение сиг-
нала протона при С6 в спектре наблюдается для F-
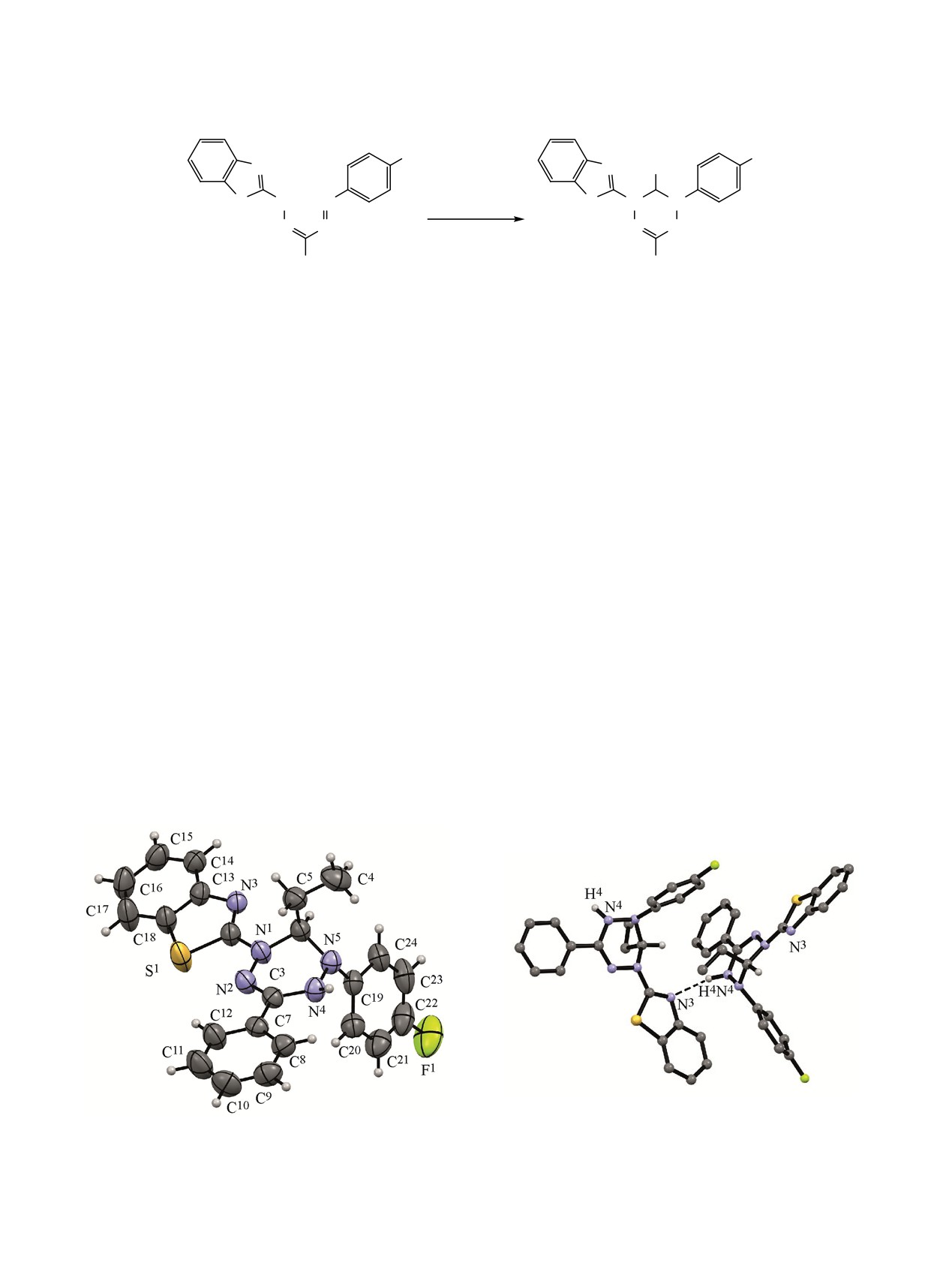
Структура соединения 4b подтверждена дан-
замещённых 3b и 4b, тогда как в ряду соединений
ными РСА (рис. 1а), соединение кристаллизуется в
5a-е таких отличий не зафиксировано. Положение
центросимметричной пространственной группе
сигнала C6 в соединениях 2-5 в спектрах ЯМР 13C
моноклинной системы. Тетрагидротетразиновый
зависит от заместителя R. В ряду производных 2a-f
цикл неплоский, атом углерода С6 выходит из
введение атома фтора приводит к смещению δC6 от
среднеквадратичной плоскости остальных пяти
61.99 до 62.89 м.д., переход от фтор- к иодпроиз-
атомов цикла на 0.619 Å, прочие атомы цикла
водному сопровождается смещением δC6 в сильное
отклоняются от плоскости не более чем на 0.04 Å.
поле до 61.73 м.д. Эта же закономерность сохра-
Фенильный заместитель ориентирован приблизи-
(a)
(b)
Рис. 1. Молекулярная структура соединения 4b (а) и ММВС в кристалле соединения 4b (b).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020
54
ФЕДОРЧЕНКО и др.
Схема 2.
I
N
N
S
N
N
S
N N
O
N N
N N
6
7
тельно в плоскости гетероцикла (торсионный угол
N4H···N3 [-x+1/2, y-1/2, -z+1/2] c расстоянием N···N
С7С3N2N1 175.9°). Бензотиазольный цикл незна-
2.996Å и углом N4H4N3 160° (рис. 1b). Данные
чительно отклоняется от плоскости тетразина
связи объединяют молекулы в полимерные ленты,
(торсионный угол N2N1С2N3 169.9°). Атом N1,
ориентированные вдоль оси 0b.
соединяющий две системы π-электронной плот-
Ранее [10, 12] было показано, что электроно-
ности уплощён, но отклоняется от плоскости
акцепторный заместитель Х в ароматическом фраг-
соседних атомов N2С2С6 на 0.196 Å. При этом
менте у N1 в исходных формазанах 1 способствует
одинарные и двойные связи в системе сопряжения
дальнейшему алкилированию соединений
2,
хорошо различимы, разница их длин достигает
которые можно рассматривать как производные
0.1 Å. Любопытно, что большие различия длин связей
дигидротетразина. В случае Х = I (соединение 1e)
С-N бензтиазольного цикла [C2-N3 = 1.301(3) Å,
колоночной хроматографией продуктов цикли-
N3-C13 = 1.397(3) Å] не сопровождаются возникно-
зации наряду с соединением 5e нами был выделен
вением асимметрии С-S связей [S1-C2 = 1.741(2) Å,
продукт, который по данным масс-спектрометрии
S1-C18 = 1.743(3) Å].
и ЯМР 1Н спектроскопии (отсутствует сигнал NH
Этильный и фторфенильный заместители распо-
протона и регистрируются сигналы аллильного
лагаются в (псевдо)аксиально в транс-конфи-
фрагмента), соответствует структуре 2-{4-аллил-5-
гурации. Атомы азота N4 и N5 имеют тригонально-
(4-иодфенил)-3-фенил-6-винил-5,6-дигидро-4H-
пирамидальную конфигурацию. Молекулярная крис-
[1,2,4,5]тетразин-1-ил}-бензотиазола (6).
таллическая упаковка характеризуется наличием
Следует отметить, что замещение по NH группе
межмолекулярных водородных связей (ММВС)
может протекать и в других условиях. Так, при
попытке получения комплекса меди с производ-
ным дигидротетразина 2а в ацетоне, колоночной
хроматографией реакционной массы был выделен
продукт 7, структура которого была определена
рентгеноструктурным анализом (рис. 2).
По данным РСА в этом соединении атом N2
связан с пропан-2-оном. Соединение 7 кристалли-
зуется в центросимметричной пространственной
группе триклинной системы. Тетрагидротетра-
зиновый цикл неплоский, конформационно
существенно отличается от рассмотренного выше.
Атомы N1N2C3C6 лежат практически в одной
плоскости (с отклонением не более 0.025 Å), атом
N4 выходит из данной плоскости на 0.330 Å, а атом
N5 - на 0.847 Å. Атомы N4 и N5 имеют тригона-
льно-пирамидальную геометрию, заместители при
данных атомах располагаются (псевдо)аксиально в
Рис. 2. Молекулярная структура соединения 7.
транс-конфигурации. Фенил при С3 развёрнут
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020
СИНТЕЗ, СПЕКТРАЛЬНЫЕ, ЭЛЕКТРОХИМИЧЕСКИЕ И АНТИОКСИДАНТНЫЕ СВОЙСТВА
55
относительно плоскости тетразина, торсионный угол
N2C3C16С17 составляет 32.9°. Распределение длин
связей в системе сопряжения с участием гидра-
зонного фрагмента тетрагидротетразина близко к
рассмотренному выше. В кристаллах наблюдаются
укороченные контакты S···S [1-x, 1-y, -z] (3.40 Å,
на 0.20 Å меньше суммы радиусов Ван-дер-Ваальса).
В спектре ЯМР 1Н производного 7 сигнал протонов
СН2 группы при С6 сдвинут в сильное поле (4.33 м.д.),
а СН2 группа пропанона регистрируется в виде
двух уширенных синглетов (4.93 и 6.36 м.д.).
Рис. 3. Циклическая вольтамперограмма соединения 4a.
Электрохимические свойства производных
дигидротетразинов 2-5 были изучены в ацето-
вание их в течение 400, 600 и 900 с. Полученные
нитриле с использованием циклической вольтампе-
продукты исследовали на ЭПР спектрометре,
рометрии, данные суммированы в таблице 1. Для
измеряли концентрацию парамагнитных частиц в
всех соединений характерны два пика окисления:
исследуемом растворе, зависимость концентрации
первый при потенциале в области 0.10-0.18 В, за
от времени генерирования представлена на рис. 4.
исключением соединения 2f, второй при потен-
Сравнение спектра ЭПР электрохимически
циалах 0.60-0.81 В и только один пик восстанов-
генерированных парамагнитных частиц и спектра
ления. В качестве примера приведена циклическая
вердазила 9, полученного химическим окислением
вольтамперограмма соединения 4а на рис. 3а.
соединения 4а [11], показало, что они практически
Для изучения первой стадии процесса окис-
идентичны (рис. 5). На основании этого и с учетом
ления на примере соединения 4а регистрировали
того, что ЦВ проводили в атмосфере аргона, можно
циклическую вольтамперограмму, в которой
было предположить, что одним из продуктов пер-
потенциал анода не превышал значений второй
вого процесса окисления является катион-радикал
стадии окисления. Следует отметить, что площадь
8 (схема 3). Спиновая плотность на ядрах азота
пика окисления больше площади пика восстанов-
этого продукта и вердазила 9, вероятно, близкая, а
ления в 1.6 раза, потенциалы пиков восстановления
возможное влияние водорода при N4 у электро-
и окисления отличаются на 160 мВ. Поэтому мы не
химически окисленной формы 4а в ЭПР спектре не
можем идентифицировать процесс даже как квази-
проявляется из-за плохой разрешенности спектра,
обратимый. Можно предположить, что окисление
зарегистрированного при комнатной температуре.
соединения 4а при потенциалах близких к первой
Для уточнения структуры парамагнитного про-
стадии происходит с переносом большего числа
дукта электрохимического окисления соединения
электронов, чем в процессе восстановления.
4a проведены квантово-химические расчеты
Для изучения природы продуктов окисления
спектров ЭПР катион-радикала 8 и вердазила 9,
было выполнено электрохимическое генериро-
выполненные в рамках теории функциональной
Рис. 4. Зависимость концентрации парамагнитных частиц
Рис. 5. ЭПР спектры: 1 - электрохимически окисленной
от времени генерирования.
формы соединения 4а; 2 - вердазила 9.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020
56
ФЕДОРЧЕНКО и др.
Схема 3.
N
N
N
_e
S
N N
S
N
N
S
N N
+e
N NH
N NH
N N
Ph
Ph
Ph
4a
8
9
плотности (DFT) c геометрической оптимизацией
[17] или в процессе синтеза вердазилов как
на основании метода UB3LYP в базисном наборе
побочный продукт
[18], причем, в последнем
6-31+G(d). Константы сверхтонкого взаимо-
случае структура замещенного триазола подтверж-
действия (СТВ) вычисляли по методу UB3LYP в
дена методом РСА.
базисе IGLO-III [13]. Вычисления выполнены в
Природа заместителя R и атома галогена слабо
программе ORCA [14]. Моделирование спектров
влияет на значения потенциалов окисления (см.
ЭПР проводили с помощью программы EasySpin
таблицу). Для соединений 5а-е (R = СН=СН2)
[15]. Сравнение расчетных спектров с эксперимен-
наблюдается небольшой сдвиг первого процесса к
тальным (рис. 6) показывает, что спектр окис-
более положительному потенциалу по сравнению с
ленной формы соединения 4a и расчётный спектр
соответствующим процессом для соединений 2а-е
вердазила 9 практически совпадают. На основании
(R = Н). В ряду соединений 2а-f наименее положи-
полученных данных можно сделать вывод, что
тельный потенциал первого процесса имеет соеди-
продуктом электрохимического окисления соеди-
нение с наиболее электронодонорной группой 2f
нения 4a при потенциале, соответствующем первому
(Х = ОМе).
пику окисления, является вердазил 9, а не катион-
вердазила 8. Можно предположить, что стабили-
Антиоксидантную активность (АОА) дигидро-
зация вердазила в этих условиях имеет место в
тетразинов изучали в ряду соединений 2a-f, на
результате депротонирования катион-радикала под
которых можно было проследить влияние замес-
влиянием полярной среды (ацетонитрила).
тителя Х, и соединений
2-5а, чтобы выявить
Второй процесс окисления необратимый. Наи-
влияние заместителя R. Оценку АОА проводили
более вероятный вариант, что в этом случае имеет
спектрофотометрическим методом, основанным на
место трансформация тетрагидротетразинового
реакции переноса атома водорода к стабильному
цикла в триазольный. Описаны примеры образо-
хромоген-радикалу - 2,2-дифенил-1-пикрилгидра-
вания производных триазола из формазанов [16],
зилу (ДФПГ)
[19]. В качестве стандарта был
из вердазилов как продукта автотрансформации
выбран Витамин С (Vc). К растворам дигидро-
(a)
(b)
Рис. 6. ЭПР спектры: 1 - электрохимически окисленной формы соединения 4а; (экспериментальный); 2 - радикала 9
(расчётный) (а); 3 - катион-вердазила 8 (расчётный) (b).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020
СИНТЕЗ, СПЕКТРАЛЬНЫЕ, ЭЛЕКТРОХИМИЧЕСКИЕ И АНТИОКСИДАНТНЫЕ СВОЙСТВА
57
Электрохимические параметры соединений 2-5.
Соединение
Eox1, В
Eox2, В
Соединение
Eox1, В
Eox2, В
2a
0.10
0.66
4a
0.11
0.70
2b
0.13
0.73
4b
0.11
0.74
2c
0.14
0.70
4c
0.11
0.62
2d
0.14
0.70
4d
0.12
0.75
2e
0.15
0.70
4e
0.14
0.72
2f
0.03
0.60
5a
0.16
0.73
3a
0.12
0.73
5b
0.16
0.76
3b
0.12
0.75
5c
0.17
3c
0.13
0.75
5d
0.17
0.81
3d
0.13
0.74
5e
0.18
0.72
3e
0.15
0.74
тетразинов (концентрация от 5 до 50 μM) в мета-
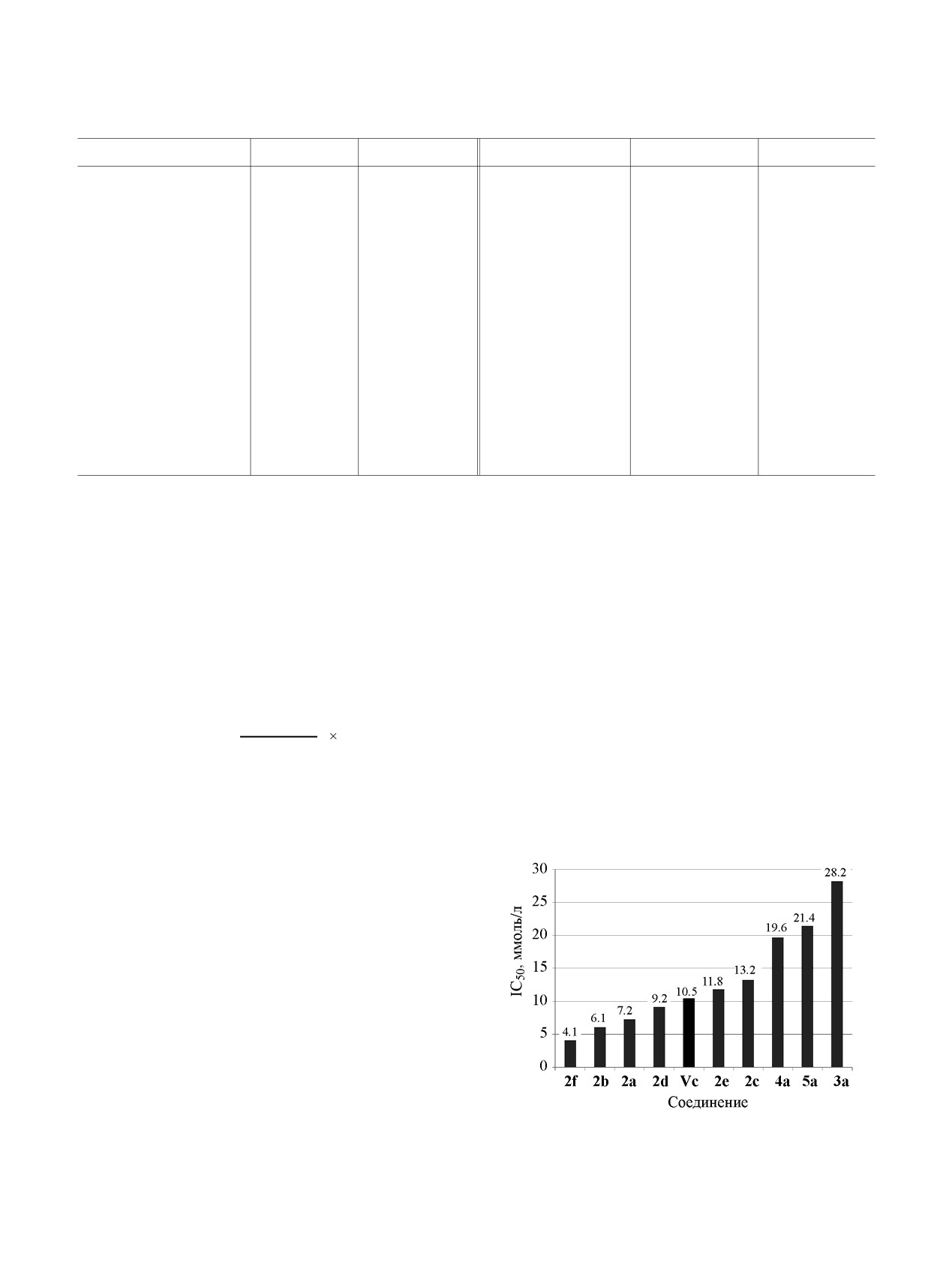
Влияние заместителя Х в ароматическом фраг-
ноле добавляли растворённый в метаноле ДФПГ
менте тетрагидротетразинового цикла опреде-
(200 μM). Реакционную пробирку, завёрнутую в
ляется его донорно-акцепторными свойствами, чем
фольгу, выдерживали 30 мин при 30°С. Оптичес-
сильнее выражены электронодонорные свойства,
кую плотность измеряли при длине волны 517 нм,
тем выше АОА. Она уменьшается в ряду MeO >
соответствующей максимуму поглощения ДФПГ.
F > H > Br > Vc > I > Cl (рис. 8b). Несмотря на
Значение АОА исследуемых веществ вычисляли по
большой отрицательный индуктивный эффект
формуле:
атома фтора, положительный мезомерный эффект
где Аисслед.р.
- оптическая плотность раствора,
оказывается более значимым настолько, что фтор-
содержащего ДФПГ и исследуемое соединение;
замещённый дигидротетразин 2b (IC50 = 6.1) лишь
немного уступает в антиоксидантной активности
Aисслед.р.
AOA = ( 1 _
)
100%,
метокси-замещённому дигидротетразину 2f (IC50 =
контр.р.
A
4.1) и значительно превосходит Витамин С.
Аконтр.р. - оптическая плотность раствора ДФПГ, не
Как и следовало ожидать, наиболее электрохи-
содержащего исследуемое соединение. Эффек-
мически активные дигидротетразины 2f, а, b, d
тивную ингибирующую концентрацию (IC50), сни-
жающую концентрацию ДФПГ на 50% от перво-
начальной, получали из кривой зависимости про-
цента ингибирования ДФПГ от концентрации образца
с использованием программы OriginPro 8.5 (Model
DoseResp). Данные представлены на рисунках 7, 8.
При рассмотрении влияния заместителя R на
АОА установлено, что более эффективно взаимо-
действует с ДФПГ незамещённый дигидротетразин
2a (IC50 = 7.2 μM), соединения с этильным и вини-
льным заместителями показывают близкие резуль-
таты [19.6 (4a) и 21.4 (5a) μM], существенно усту-
пая Витамину С (IC50 = 10.5 μM) (рис. 8а). Нео-
жиданно, что метил-замещённый дигидротетразин
3а оказался в этом ряду самым неактивным (IC50 =
28.2 μM).
Рис. 7. Значения IС50 дигидротетразинов 2a-f и 2-5а.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020
58
ФЕДОРЧЕНКО и др.
Рис. 8. Зависимость процента ингибирования ДФПГ от концентрации дигидротетразинов (a) 2-5а: 1 - Vc, 2 - 2a, 3 - 3a, 4 -
4a, 5 - 5a; и (б) 2a-f: 1 - Vc, 2 - 2a, 3 - 2b, 4 - 2c, 5 - 2d, 6 - 2e, 7 - 2f.
показали более высокую антиоксидантную актив-
(Perkin Elmer Instruments). ЭПР спектры были
ность по сравнению с остальными исследуемыми
записаны с помощью спектрометра Bruker Elexsys E
соединениями.
500 X-band, оборудованного системой ER4131VT.
Растворы образцов в ацетонитриле были разбав-
Таким образом, новые 2-{5-(арил)-6-R-3-фенил-
лены до концентрации около 10-4 M.
5,6-дигидро-4H-[1,2,4,5]тетразин-1-ил}-бензотиазо-
Рентгеноструктурные исследования проведены
лы легко окисляются и обладают антирадикальной
на оборудовании ЦКП «CAOC» ИОС УрО РАН.
активностью.
Эксперименты проведёны на автоматическом
четырёх-кружном дифрактометре с CCD-детек-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
тором
«Xcalibur
3» по стандартной процедуре
[МоKα-излучение, графитовый монохроматор, ω-
Все использованные растворители были высу-
сканирование с шагом 1° при Т 295(2) К]. Введена
шены и перегнаны по стандартной процедуре. Все
эмпирическая поправка на поглощение. Структуры
использованные реагенты были заказаны в «Sigma-
соединений 4b и 7 определены прямым статисти-
Aldrich» и использованы без предвари-тельной
ческим методом и уточнены полноматричным
подготовки. Температуры плавления определены с
МНК по F2 в анизотропном приближении для всех
помощью аппарата Stuart SMP3. Контроль за ходом
неводородных атомов. Атомы водорода С-Н связей
реакций и чистотой полученных продуктов
помещены в геометрически рассчитанные поло-
осуществлен методом ТСХ на пластинах Sorbfil
жения, протоны NH-групп уточнены независимо в
ПТСХ-АФ-А-УФ. Колоночная хроматография про-
изотропном приближении. Все расчеты проведены
ведена с использованием силикагеля Kieselgel 60
c использованием программного пакета SHELXTL
(размер частиц
0.040-0.063 мм,
230-400 меш).
[20].
Спектры ЯМР получали на спектрометре Bruker
Avance III-500 MГц. ИК спектры поглощения запи-
Циклическую вольтамперометрию проводили с
сывали с помощью приставки DRA на спектрофо-
помощью потенциостата Metrohm Autolab
тометре Spectrum One (Perkin Elmer). УФ спектры
PGSTAT128N со стандартной трёхэлектродной
зарегистрированы на спектрофотометре UV2600
конфигурацией. Трёхэлектродная ячейка состоит
фирмы Shimadzu (Япония) в метаноле. Масс-
из рабочего электрода со стеклоуглеродным диском
спектры записаны на приборе Bruker Daltonics
(d 2 мм), электрода сравнения Ag/AgNO3 (0.01 M) и
maXis impact HD, метод ионизации ESI. Элемент-
стеклоуглеродного стержневого противоэлектрода.
ный анализ проведён с помощью автоматического
Измерения проводили в безводном ацетонитриле с
элементного анализатора CHNS РЕ 2400, серия II
тетрабутиламмония тетрафторборатом (0.1 M) в
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020
СИНТЕЗ, СПЕКТРАЛЬНЫЕ, ЭЛЕКТРОХИМИЧЕСКИЕ И АНТИОКСИДАНТНЫЕ СВОЙСТВА
59
качестве вспомогательного электролита в атмо-
130.85, 131.26, 145.04, 148.47, 152.08, 166.69. Масс-
сфере аргона с шагом сканирования 100 мВ/с.
спектр: m/z: 406.0880 [M + Н]+. Найдено, %: C
Потенциал электрода Ag/AgNO3 откалиброван с
62.12; H 3.96; N 17.23. C21H16ClN5S. Вычислено, %:
помощью ферроцен/ферроцениум окислительно-
C 62.14; H 3.97; N 17.25.
восстановительной пары (Fc/Fc+).
2-{5-(4-Бромфенил)-3-фенил-5,6-дигидро-4Н-
Формазаны
1a-e были синтезированы по
[1,2,4,5]тетразин-1-ил}-бензотиазол
(2с). Выход
известным методикам [10, 21, 22].
187 мг (52%), т.пл. 182-184°С (MeOH). ИК спектр,
ν, см-1: 3143, 1597, 1532, 1502, 1445, 1279, 1165,
Общая методика получения
2-(5-арил-3-
1058, 745, 689. Спектр ЯМР 1Н, δ, м.д.: 5.49 уш.с (2H,
фенил-5,6-дигидро-4Н-[1,2,4,5]тетразин-1-ил)-
CH2), 7.09 т (1Наром, J 7.3 Гц), 7.24-7.31 м (3Наром),
бензотиазолов 2-5. К суспензии 5-(бензотиазол-2-
7.47-7.58 м (6Наром), 7.77 д (1Наром, J 7.7 Гц), 7.87-
ил)-1-арил-3-фенилформазана (0.8 ммоль) в 20 мл
7.91 м (2Наром), 9.57 уш.с (1H, NH). Спектр ЯМР 13С,
этанола добавляли
30% водный раствор гид-
δ, м.д.: 61.86, 114.29, 119.04, 119.62, 121.34, 121.46,
роксида натрия (0.9 ммоль). К полученному тёмно-
125.81,
126.06,
128.62,
130.67,
130.86,
131.26,
фиолетовому раствору добавляли соответствую-
145.02, 148.91, 152.08, 166.69. Масс-спектр, m/z:
щий алкил-галогенид (8.0 ммоль), смесь кипятили
450.0256 [M + Н]+. Найдено, %: C 55.98; H 3.55; N
15 минут. Растворитель отгоняли под вакуумом. К
15.53. C21H16BrN5S. Вычислено, %: C 56.01; H 3.58;
реакционной массе добавили 30 мл гептана, кипя-
N 15.55.
тили в течение часа. Гептан отгоняли под вакуу-
мом. Продукт выделяли из реакционной массы ко-
2-{5-(4-Иодфенил)-3-фенил-5,6-дигидро-4Н-
лоночной хроматографией на силикагеле (гексан-
[1,2,4,5]тетразин-1-ил}-бензотиазол
(2с). Выход
хлороформ, 2:1).
215 мг (54%), т.пл. 175-177°С (MeOH). ИК спектр,
ν, см-1: 3161, 1594, 1525, 1500, 1446, 1278, 1170,
2-(3,5-Дифинил-5,6-дигидро-4Н-[1,2,4,5]тет-
1058, 751, 691. Спектр ЯМР 1Н, δ, м.д.: 5.48 уш.с
разин-1-ил)-бензотиазолы
2a,
3a,
4a описаны
(2H, CH2), 7.08-7.14 м (3Наром), 7.29 т (1Наром, J 7.5),
ранее [11].
7.50-7.64 м (4Наром), 7.62 д (2Наром, J 8.8 Гц), 7.77 д
2-{3-Фенил-5-(4-фторфенил)-5,6-дигидро-4Н-
(1Наром, J 7.7 Гц), 7.87-7.91 м (2Наром), 9.56 уш.с
[1,2,4,5]тетразин-1-ил}-бензотиазол
(2b). Выход
(1H, NH). Спектр ЯМР 13С, δ, м.д.: 61.73, 85.97,
137 мг (44%), т.пл. 171-173°С (MeOH). ИК спектр,
119.04,
119.92,
121.37,
121.47,
125.82,
126.06,
ν, см-1: 3144, 1598, 1530, 1503, 1447, 1280, 1171,
128.63,
130.67,
130.86,
131.27,
137.77,
144.99,
1059, 762, 685. Спектр ЯМР 1Н, δ, м.д.: 5.45 уш.с
149.46, 152.09, 166.67. Масс-спектр, m/z: 498.0240
(2H, CH2), 7.08-7.17 м (3Наром), 7.56-7.50 м (4Наром),
[M + Н]+. Найдено, %: C 50.70; H 3.22; N 14.07.
7.76 д (1Наром, J 7.1 Гц), 7.89-7.91 м (2Наром), 9.56
C21H16IN5S. Вычислено, %: C 50.71; H 3.24; N
уш.с (1H, NH). Спектр ЯМР 13С, δ, м.д.: 55.15,
14.08.
62.89, 115.67, 115.86, 118.99, 119.37, 119.43, 121.34,
2-{5-(4-Метоксифенил)-3-фенил-5,6-дигидро-
125.79,
126.04,
128.61,
130.63,
130.85,
131.32,
4Н-[1,2,4,5]тетразин-1-ил}-бензoтиазол (2f). Вы-
145.17, 145.96, 152.11, 156.98, 158.88, 166.75. Масс-
ход 135 мг (42%), т.пл. 191-193°С (MeOH). ИК
спектр, m/z: 390.1183 [M + Н]+. Найдено, %: C
спектр, ν, см-1: 3331, 1595, 1530, 1508, 1444, 1278,
64.74; H 4.11; N 17.95. C21H16FN5S. Вычислено, %:
1177, 1064, 755, 686. Спектр ЯМР 1Н, δ, м.д.: 3.66 с
C 64.76; H 4.14; N 17.98.
(3Н, OСН3), 5.38 уш.с (2H, CH2), 6.87 д (2Наром, J
2-{3-Фенил-5-(4-хлорфенил)-5,6-дигидро-4Н-
9.1 Гц), 7.07 т (1Наром, J 7.3 Гц), 7.17 д (2Наром, J
[1,2,4,5]тетразин-1-ил}-бензотиазол
(2с). Выход
9.1 Гц), 7.27 т (1Наром, J 7.3 Гц), 7.49 д (1Наром, J
201 мг (62%), т.пл. 191-193°С (MeOH). ИК спектр,
7.8 Гц), 7.52-7.55 м (3Наром), 7.75 (1Наром, J 7.3 Гц)
ν, см-1: 3136, 1595, 1533, 1503, 1446, 1279, 1166,
7.86-7.90 м (2Наром), 9.52 уш.с (1H, NH). Спектр
1058, 744, 687. Спектр ЯМР 1Н, δ, м.д.: 5.49 уш.с (2H,
ЯМР 13С, δ, м.д.: 55.15, 62.89, 114.39, 118.91,
CH2), 7.07 т (1Наром, J 7.7 Гц), 7.24-7.39 м (5Наром),
119.21,
121.29,
125.75,
126.01,
128.56,
130.54,
7.47-7.59 м (4Наром), 7.77 д (1Наром, J 7.6 Гц), 7.85-
130.83, 131.43, 142.98, 145, 145.27, 152.17, 155.09,
7.95 м (2Наром), 9.58 уш.с (1H, NH). Спектр ЯМР
166.59. Масс-спектр, m/z:
400.1230
[M
- Н]+.
13С, δ, м.д.: 62.89, 119.03, 119.20, 121.34, 121.46,
Найдено, %: C 65.78; H 4.73; N 17.42. C22H19N5OS.
125.80,
126.06,
126.35,
128.61,
129.06,
130.66,
Вычислено, %: C 65.81; H 4.77; N 17.44.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020
60
ФЕДОРЧЕНКО и др.
2-{6-Метил-3-фенил-5-(4-фторфенил)-5,6-
ИК спектр, ν, см-1: 3165, 1595, 1525, 1505, 1447,
дигидро-4Н-[1,2,4,5]тетразин-1-ил}-бензoтиазол
1274, 1191, 1011, 751, 694. Спектр ЯМР 1Н, δ, м.д.:
(3b). Выход 164 мг (51%). т.пл. 197-199°С (MeOH).
1.50 д (3H, CH3, J 6.2 Гц), 6.40 к (1H, CH, J 6.2 Гц),
ИК спектр, ν, см-1: 3154, 1594, 1526, 1503, 1446,
7.29 т (1Наром, J 7.9 Гц), 7.07 и 7.77 AB (2Наром, J
1276, 1179, 1011, 754, 693. Спектр ЯМР 1Н, δ, м.д.:
7.3 Гц), 7.11 и 7.62 AA'BB' (4Наром, J 8.5 Гц), 7.48-
1.50 д (3H, CH3, J 6.2 Гц), 6.32 к (1H, CH, J 6.2 Гц),
7.58 м (4Наром), 7.91 д (1Наром, J 8.5 Гц), 7.88-7.96 м
7.07 т (1Наром, J 7.6 Гц), 7.14 т (2Наром, J 9.0 Гц),
(2Наром), 9.61 уш.с (1H, NH). Спектр ЯМР 13С, δ,
7.23-7.36 м (3Наром), 7.47-7.61 м (4Наром), 7.75 д
м.д.: 15.84, 66.39, 118.95, 120.15, 121.25, 121.33,
(1Наром, J 7.6 Гц), 7.88-7.97 м (2Наром), 9.60 уш.с
125.69,
125.87,
128.59,
130.55,
130.67,
130.98,
(1H, NH). Спектр ЯМР 13С, δ, м.д.: 16.00, 67.19,
137.73, 143.92, 150.00, 152.18, 165.94. Масс-спектр,
115.62,
115.80,
118.91,
119.64,
119.71,
121.24,
m/z: 512.0395 [M + Н]+. Найдено, %: C 51.65; H
121.29,
125.68,
125.87,
128.59,
130.53,
130.67,
3.54; N 13.66. C22H18IN5S. Вычислено, %: C 51.67;
131.05,
144.12,
146.60,
152.21,
156.99,
158.89,
H 3.55; N 13.69.
166.03. Масс-спектр, m/z:
404.1336
[M
+ Н]+.
2-{3-Фенил-5-(4-фторфенил)-6-этил-5,6-
Найдено, %: C 65.47; H 4.48; N 17.34. C22H18FN5S.
дигидро-4Н-[1,2,4,5]тетразин-1-ил}-бензoтиазол
Вычислено, %: C 65.49; H 4.50; N 17.36.
(4b). Выход 127 мг (38%). т.пл. 211-213°С (MeOH).
2-{6-Метил-3-фенил-5-(4-хлорфенил)-5,6-
ИК спектр, ν, см-1: 3160, 1603, 1535, 1501, 1447,
дигидро-4Н-[1,2,4,5]тетразин-1-ил}-бензoтиазол
1278, 1182, 988, 749, 693. Спектр ЯМР 1Н, δ, м.д.:
(3c). Выход 141 мг (42%). т.пл. 203-205°С (MeOH).
1.11 т (3H, CH3, J 7.3 Гц), 1.73-1.88 м (2H, CH2),
ИК спектр, ν, см-1: 3178, 1595, 1529, 1507, 1447,
6.05-6.11 м (1H, CH), 7.06 т (1Наром, J 7.4 Гц), 7.13 т
1277, 1186, 1011, 750, 696. Спектр ЯМР 1Н, δ, м.д.:
(2Наром, J 8.6 Гц), 7.19-7.31 м (3Наром), 7.45-7.62 м
1.51 д (3H, CH3, J 6.2 Гц), 6.40 к (1H, CH, J 6.2 Гц),
(4Наром), 7.73 д (1Наром, J 7.8 Гц), 7.85-7.94 м
7.09 т (1Наром, J 7.6 Гц), 7.22-7.41 м (5Наром), 7.45-
(2Наром), 9.55 уш.с (1H, NH). Спектр ЯМР 13С, δ,
7.64 м (4Наром), 7.76 д (1Наром, J 7.6 Гц), 7.88-7.99 м
м.д.:
9.61, 22.81,
72.24,
115.71,
115.88,
118.87,
(2Наром), 9.62 уш.с (1H, NH). Спектр ЯМР 13С, δ,
119.70,
119.70,
121.23,
121.26,
125.72,
125.95,
м.д.: 15.88, 66.64, 118.95, 119.46, 121.26, 121.34,
128.66,
130.64,
130.69,
131.06,
144.55,
146.72,
125.70,
125.89,
126.46,
128.61,
129.03,
130.58,
152.28, 156.99, 158.89, 166.21. Масс-спектр, m/z:
130.68, 130.99, 143.97, 149.03, 152.18, 165.98. Масс-
418.1496 [M + Н]+. Найдено, %: C 66.15; H 4.81; N
спектр, m/z: 420.1008 [M + Н]+. Найдено, %: C
16.78. C23H20FN5S. Вычислено, %: C 66.17; H 4.83;
62.92; H 4.32; N 16.68. C22H18ClN5S. Вычислено, %:
N 16.77.
C 62.92; H 4.32; N 16.68.
Основные кристаллографические параметры
соединения 4b: кристалл моноклинный, P21/n, a
2-{5-(4-Бромфенил)-6-метил-3-фенил-5,6-
10.4546(9) Å, b 11.2072(9) Å, c 17.7583(16) Å, β
дигидро-4Н-[1,2,4,5]тетразин-1-ил}-бензoтиазол
91.670(8)°, V 2079.8(3) Å3, для вещества брутто-
(3d). Выход 144 мг (39%). т.пл. 205-207°С (MeOH).
формулы C23H20FN5S, Z 4, μ 0.184 мм-1. На углах
ИК спектр, ν, см-1: 3173, 1596, 1527, 1506, 1447,
3.48 < θ < 30.82° собрано 13448 отражений, из них
1275, 1189, 1011, 750, 695. Спектр ЯМР 1Н, δ, м.д.:
независимых
5534 (Rint
0.0439). Окончательные
1.50 д (3H, CH3, J 6.2 Гц), 6.40 к (1H, CH, J 6.2 Гц),
параметры уточнения: R1 0.1391, wR2 0.1634 (по
7.08 т (1Наром, J 7.5 Гц), 7.24 и 7.47 AA'BB' (4Наром,
всем отражениям), R1
0.0566, wR2
0.1170
[по
J 8.9 Гц), 7.28 т (1Наром, J 7.5 Гц), 7.50-7.62 м
отражениям с I > 2σ(I)], GooF 1.004. Пики оста-
(4Наром), 7.76 д (1Наром, J 7.6 Гц), 7.84-7.98 м
точной электронной плотности 0.175/-0.344 ēÅ-3.
(2Наром), 9.62 уш.с (1H, NH). Спектр ЯМР 13С, δ,
м.д.: 15.90, 66.59, 114.46, 118.99, 119.20, 121.33,
Полный набор рентгеноструктурных данных
121.40,
125.77,
125.94,
128.67,
130.65,
130.71,
депонирован в Кембриджском банке структурных
131.00, 131.97, 143.97, 149.50, 152.22, 166.00. Масс-
данных (CCDC 1965415).
спектр, m/z: 464.0364 [M + Н]+. Найдено, %: C
2-{3-Фенил-5-(4-хлорфенил)-6-этил-5,6-ди-
56.88; H 3.90; N 15.06. C22H18BrN5S. Вычислено, %:
гидро-4Н-[1,2,4,5]тетразин-1-ил}-бензoтиазол
C 56.90; H 3.91; N 15.08.
(4c). Выход 111 мг (32%). т.пл. 243-245°С (MeOH).
2-{5-(4-Иодфенил)-6-метил-3-фенил-5,6-
ИК спектр, ν, см-1: 3155, 1595, 1534, 1503, 1447,
дигидро-4Н-[1,2,4,5]тетразин-1-ил}-бензoтиазол
1277, 1190, 987, 750, 693. Спектр ЯМР 1Н, δ, м.д.:
(3e). Выход 143 мг (35%). т.пл. 196-198°С (MeOH).
1.11 т (3H, CH3, J 7.4 Гц), 1.69-1.98 м (2H, CH2),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020
СИНТЕЗ, СПЕКТРАЛЬНЫЕ, ЭЛЕКТРОХИМИЧЕСКИЕ И АНТИОКСИДАНТНЫЕ СВОЙСТВА
61
6.13-6.22 м (1H, CH), 6.96 т (1Наром, J 7.8 Гц), 7.13 т
7.24-2.26 м (5Наром), 7.47-7.58 м (4Наром), 7.75 д
(2Наром, J 8.6 Гц), 7.24-7.32 м (3Наром), 7.32-7.41 м
(1Наром, J 7.6 Гц), 7.85-7.92 м (2Наром), 9.59 уш.с
(2Наром), 7.50 д (1Наром, J 8.3 Гц), 7.45-7.60 м
(1H, NH). Спектр ЯМР 13С, δ, м.д.: 71.19, 79.17,
(3Наром), 7.74 д (1Наром, J 7.8 Гц), 7.85-7.99 м
117.74,
118.54,
118.96,
121.34,
122.74,
125.77,
(2Наром), 9.57 уш.с (1H, NH). Спектр ЯМР 13С, δ,
125.99,
128.63,
129.29,
130.62,
130.76,
131.09,
м.д.:
9.54, 22.69,
71.64,
118.91,
119.51,
121.28,
131.52, 144.81, 149.65, 152.21, 166.36. Масс-спектр,
125.74,
125.97,
126.39,
128.67,
129.09,
130.69,
m/z: 398.1434 [M + Н]+. Найдено, %: C 69.48; H
130.99, 144.38, 149.21, 152.24, 166.15. Масс-спектр,
4.83; N 17.60. C23H19N5S. Вычислено, %: C 69.50; H
m/z: 434.1201 [M + Н]+. Найдено, %: C 63.64; H
4.82; N 17.62.
4.64; N 16.13. C23H20ClN5S. Вычислено, %: C 63.66;
2-{6-Винил-3-фенил-5-фторфенил)-5,6-ди-
H 4.65; N 16.14.
гидро-4Н-[1,2,4,5]тетразин-1-ил}-бензoтиазол
2-{5-(4-Бромфенил)-3-фенил-6-этил-5,6-ди-
(5b). Выход 142 мг (43%). т.пл. 198-200°С (MeOH).
гидро-4Н-[1,2,4,5]тетразин-1-ил}-бензoтиазол
ИК спектр, ν, см-1: 3203, 1599, 1526, 1502, 1447,
(4d). Выход 141 мг (37%). т.пл. 234-236°С (MeOH).
1278, 1183, 1012, 749, 695. Спектр ЯМР 1Н, δ, м.д.:
ИК спектр, ν, см-1: 3150, 1596, 1531, 1502, 1446,
5.26-5.48 м (2Н, СН2), 5.96-6.10 м (1Н, СН), 6.75-
1276, 1192, 987, 750, 692. Спектр ЯМР 1Н, δ, м.д.:
6.84 м (1Н, СН), 6.95-7.00 м (1Наром), 7.08 т (1Наром, J
1.10 т (3H, CH3, J 7.3 Гц), 1.72-1.96 м (2H, CH2),
7.5 Гц), 7.15 т (2Наром, J 8.8 Гц), 7.24-2.36 м (3Наром),
6.13-6.23 м (1H, CH), 7.08 т (1Наром, J 7.9 Гц), 7.23 и
7.45-7.58 м (4Наром), 7.76 д (1Наром, J 7.5 Гц), 7.84-
7.47 AA'BB' (4Наром, J 9.3 Гц), 7.27 т (1Наром, J 7.9 Гц),
7.90 м (2Наром), 9.61 уш.с (1H, NH). Спектр ЯМР
7.47-7.59 м (4Наром), 7.74 д (1Наром, J 7.9 Гц), 7.88-
13С, δ, м.д.: 71.70, 115.74, 115.93, 118.59, 118.98,
7.95 м (2Наром), 9.57 уш.с (1H, NH). Спектр ЯМР
119.74,
119.79,121.34,
121.39,
125.78,
125.99,
13С, δ, м.д.: 9.54,
22.67,
71.52, 114.34,
118.92,
128.62,
130.66,
130.77,
131.03,
131.43,
144.85,
119.92,
121.28,
125.74,
125.97,
128.67,
130.68,
146.09, 152.18, 157.08, 158.99, 166.45. Масс-спектр,
130.69, 130.98, 144.35, 149.64, 152.24, 166.14. Масс-
m/z: 416.1340 [M + Н]+. Найдено, %: C 66.48; H
спектр, m/z: 478.0696 [M + Н]+. Найдено, %: C
4.35; N 16.84. C23H18FN5S. Вычислено, %: C 66.49;
57.73; H 4.18; N 14.62. C23H20BrN5S. Вычислено, %:
H 4.37; N 16.86.
C 57.74; H 4.21; N 14.64.
2-{6-Винил-3-фенил-5-хлорфенил)-5,6-ди-
2-{5-(4-Иодфенил)-3-фенил-6-этил-5,6-ди-
гидро-4Н-[1,2,4,5]тетразин-1-ил}-бензoтиазол
гидро-4Н-[1,2,4,5]тетразин-1-ил}-бензoтиазол
(5c). Выход 152 мг (44%). т.пл. 200-203°С (MeOH).
(4e). Выход 130 мг (31%). т.пл. 233-235°С (MeOH).
ИК спектр, ν, см-1: 3195, 1593, 1525, 1504, 1446,
ИК спектр, ν, см-1: 3126, 1595, 1529, 1500, 1447,
1275, 1189, 1012, 749, 694. Спектр ЯМР 1Н, δ, м.д.:
1276, 1194, 988, 750, 693. Спектр ЯМР 1Н, δ, м.д.:
5.29-5.40 м (2Н, СН2), 5.97-6.09 м (1Н, СН), 6.85-
1.09 т (3H, CH3, J 7.3 Гц), 1.69-1.94 м (2H, CH2),
6.93 м (1Н, СН), 7.08 т (1Наром, J 7.5 Гц), 7.28 т
6.12-6.21 м (1H, CH), 7.07 т (1Наром, J 7.8 Гц), 7.09 и
(1Наром, J 7.5 Гц), 7.36 и 7.33 AA'BB' (4Наром, J 9.4 Гц),
7.61 AA'BB' (4Наром, J 9.0 Гц), 7.27 т (1Наром, J 7.9 Гц),
7.50 д (1Hаром, J 7.8 Гц) 7.51-7.57 м (2Наром), 7.83-
7.47-7.59 м (4Наром), 7.74 д (1Наром, J 7.4 Гц), 7.87-
7.91 м (2Наром), 9.62 уш.с (1H, NH). Спектр ЯМР
7.93 м (2Наром), 9.56 уш.с (1H, NH). Спектр ЯМР
13С, δ, м.д.: 71.09, 115.15, 115.72, 118.63, 119.08,
13С, δ, м.д.: 9.54,
22.65,
71.39, 118.91,
120.20,
119.84,
121.36,
121.40,
125.83,
126.02
128.74,
121.28,
125.74,
125.96,
128.66,
130.66,
130.68,
130.75,
130.82,
131.13,
131.99,
144.78,
148.10,
130.98, 137.78, 144.33, 150.19, 152.24, 166.12. Масс-
152.19, 166.43. Масс-спектр, m/z: 432.1024 [M + Н]+.
спектр, m/z: 526.0548 [M + Н]+. Найдено, %: C
Найдено, %: C 63.93; H 4.17; N 16.20. C23H18ClN5S.
52.57; H 3.81; N 13.32. C23H20IN5S. Вычислено, %:
Вычислено, %: C 63.95; H 4.20; N 16.21.
C 52.58; H 3.84; N 13.33.
2-{5-Бромфенил-6-винил-3-фенил)-5,6-ди-
2-{6-Винил-3,5-дифенил-5,6-дигидро-4Н-
гидро-4Н-[1,2,4,5]тетразин-1-ил}-бензoтиазол
[1,2,4,5]тетразин-1-ил}-бензoтиазол
(5a). Выход
(5d). Выход 156 мг (41%). т.пл. 200-202°С (MeOH).
165 мг (52%). т.пл. 177-178°С (MeOH). ИК спектр,
ИК спектр, ν, см-1: 3195, 1593, 1525, 1504, 1446,
ν, см-1: 3203, 1594, 1526, 1506, 1447, 1277, 1180,
1275, 1189, 1012, 749, 694. Спектр ЯМР 1Н, δ, м.д.:
1011, 750, 693. Спектр ЯМР 1Н, δ, м.д.: 5.33-5.37 м
5.28-5.44 м (2Н, СН2), 5.97-6.08 м (1Н, СН), 6.84-
(2Н, СН2), 6.01-6.07 м (1Н, СН), 6.84-6.89 м (1Н,
6.93 м (1Н, СН), 7.09 т (1Наром, J 7.3 Гц), 7.25-7.33 м
СН), 6.95-7.00 м (1Наром), 7.07 т (1Наром, J 7.3 Гц),
(3Наром), 7.46-7.52 м (6Наром), 7.77 д (1Hаром, J 7.8 Гц),
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020
62
ФЕДОРЧЕНКО и др.
7.84-7.91 м (2Наром), 9.62 уш.с (1H, NH). Спектр
ночной хроматографии (элюент - хлороформ). Вы-
ЯМР 13С, δ, м.д.: 71.06, 114.61, 118.72, 119.02, 119.95,
ход 55 мг (32%). т.пл. 204-206°С (MeOH). Спектр
121.39,
121.46,
125.81,
126.02,
128.64,
130.71,
ЯМР 1Н, δ, м.д.: 2.05 c (3H, CH3), 4.17-4.46 м (2Н,
130.78,
130.96,
131.21,
132.04,
144.68,
149.02,
СН2), 4.79-5.08 м (1Н, СН), 6.23-6.52 м (2Н, СН2),
152.16, 166.38. Масс-спектр, m/z: 476.0539 [M + Н]+.
6.94 т, 7.11 т (2Hаром, J 7.3 Гц), 7.23-7.35 м (3Наром),
Найдено, %: C 57.98; H 3.78; N 14.69. C23H18BrN5S.
7.37-7.44 м (2Наром), 7.50-7.62 м (4Наром), 7.72-7.82
Вычислено, %: C 57.99; H 3.81; N 14.70.
м (3Наром). Масс-спектр, m/z: 428.1543 [M + Н]+.
Найдено, %: C 67.41; H 4.94; N 16.39. C24H21N5OS.
2-{6-Винил-5-иодфенил-3-фенил)-5,6-ди-
Вычислено, %: C 67.43; H 4.95; N 16.38.
гидро-4Н-[1,2,4,5]тетразин-1-ил}-бензoтиазол
(5e). Выход 163 мг (39%). т.пл. 194-196°С (MeOH).
Основные кристаллографические параметры сое-
ИК спектр, ν, см-1: 3164, 1595, 1530, 1502, 1447,
динения 7: кристалл триклинный, P-1, a 8.8591(9) Å,
1275, 1194, 1010, 751, 692. Спектр ЯМР 1Н, δ, м.д.:
b 9.6878(10) Å, c 13.9252(19) Å, α 107.923(13)°, β
5.26-5.49 м (2Н, СН2), 5.94-6.12 м (1Н, СН), 6.83-
107.267(10)°, γ
94.244(8)°, V
1067.8(2) Å3, для
6.93 м (1Н, СН), 7.09 т (1Наром, J 7.2 Гц), 7.15 и 7.63
вещества брутто-формулы C24H21N5OS, Z
2, μ
AA'BB' (4Наром, J 8.7 Гц), 7.29 т (1Наром, J 7.2 Гц),
0.178 мм-1. На углах 3.20 < θ < 33.70° собрано
7.48-7.59 м (4Наром), 7.77 д (1Hаром, J 8.1 Гц), 7.82-
16033 отражений, из них независимых 7294 (Rint
7.92 м (2Наром), 9.61 уш.с (1H, NH). Спектр ЯМР
0.0343). Окончательные параметры уточнения: R1
13С, δ, м.д.: 70.93, 118.72, 119.02, 120.23, 121.38,
0.1316, wR2 0.0867 (по всем отражениям), R1 0.0443,
121.45,
125.81,
126.01,
128.64,
130.69,
130.78,
wR2 0.0814 [по отражениям с I > 2σ(I)], GooF 1.002.
130.97,
131.19,
137.85,
144.66,
149.57,
152.16,
Пики остаточной электронной плотности 0.324/
166.36. Масс-спектр, m/z: 524.0392 [M + Н]+. Най-
–0.261 ē Å-3.
дено, %: C 52.77; H 3.45; N 13.39. C23H18IN5S. Вы-
Полный набор рентгеноструктурных данных
числено, %: C 52.78; H 3.47; N 13.38.
депонирован в Кембриджском банке структурных
2-[4-Аллил-6-винил-5-(4-иодфенил)-3-фенил-
данных (CCDC 1965416).
5,6-дигидро-1,2,4,5-тетразин-1(4H)-ил]-бензо[d]-
тиазол (6). Выделен в качестве побочного про-
БЛАГОДАРНОСТИ
дукта при синтезе тетразина 5е. Выход 16 мг
(3.4%). т.пл. 88-90°С (MeOH). ИК спектр, ν, см-1:
Работа выполнена с использованием обо-
3161, 1592, 1528, 1506, 1446, 1275, 1194, 1009, 748,
рудования Центра коллективного пользования
693. Спектр ЯМР 1Н, δ, м.д.: 3.89-4.01 м (2Н, СН2),
«Спектроскопия и анализ органических соеди-
5.12 и 5.43 д и д (2H, СН2, J 10.2 Гц), 5.15 и 5.29 д и
нений» на базе Института органического синтеза
д (2H, СН2, J 17.1 Гц), 5.85-6.00 м (1Н, СН), 6.20-
им. И.Я. Постовского УрО РАН.
6.33 м (1Н, СН), 6.97-7.00 м (1Наром), 7.09 и 7.28 т и
т (2Hаром, J 7.6 Гц), 7.27 д (1Hаром, J 8.8 Гц), 7.46-
ФОНДОВАЯ ПОДДЕРЖКА
7.54 м (2Наром), 7.54-7.60 м (2Наром), 7.54-7.99 м
(2Наром), 7.63 д (2Hаром, J 8.8 Гц), 7.72-7.78 м
Работа выполнена в рамках тем госзадания
(2Наром). Масс-спектр, m/z:
564.0715
[M + Н]+.
№№ АААА-А19-119012290117-6, АААА-А19-
Найдено, %: C 55.41; H 3.92; N 12.41. C26H22IN5S.
119012490006-1, АААА-А19-119011790130-3 и при
Вычислено, %: C 55.42; H 3.94; N 12.43.
финансовой поддержке Программы УрО РАН
(проект № 18-3-3-16).
1-{4-(Бензо[d]тиазол-2-ил)-2,6-дифенил-3,4-
дигидро-1,2,4,5-тетразин-1(2H)-ил}-пропан-2-он
КОНФЛИКТ ИНТЕРЕСОВ
(7). К горячему раствору 100 мг тетразина 2a
(0.26 ммоль) в 5 мл ацетона, прилили при переме-
Авторы заявляют об отсутствии конфликта
шивании горячий раствор 67 мг хлорида меди(II)
интересов.
(0.28 ммоль) в 4 мл ацетона. Перемешивали при
комнатной температуре в течение суток. Раство-
СПИСОК ЛИТЕРАТУРЫ
ритель отогнали в вакууме. Остаток пропустили
через 50 мл силикагеля смесью хлороформ-ацетон
1. Valko M., Leibfritz D., Moncol J., Cronin M.T.D.,
(10:1). Растворитель отогнали под уменьшенным
Mazur M., Telser J. Int. J. Biochem. Cell. Biol. 2007,
давлением, остаток очищали с помощью коло-
39, 44-84. doi 10.1016/j.biocel.2006.07.001
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020
СИНТЕЗ, СПЕКТРАЛЬНЫЕ, ЭЛЕКТРОХИМИЧЕСКИЕ И АНТИОКСИДАНТНЫЕ СВОЙСТВА
63
2. Ai Pham-Huy L., He H., Pham-Huyc C. Int. J. Biomed.
11. Fedorchenko T.G., Lipunova G.N., Shchepochkin A.V.,
Sci. 2008, 4, 89-96.
Tsmokalyuk A.N., Slepukhin P.A., Chupakhin O.N.
3. Hussain H.H., Babic G., Durst T., Wright J., Flueraru M.,
Mendeleev Commun. 2018, 28, 297-299. doi 10.1016/
Chichirau A., Chepelev L.L. J. Org. Chem. 2003, 68,
j.mencom.2018.05.023
7023-7032. doi 10.1021/jo0301090
12. McConnachie G., Neugebauer F.A. Tetrahedron.
4. Sarbu C., Casoni D., Cent. Eur. J. Chem. 2013, 11, 679-
1975,
31,
555-560. doi
10.1016/0040-4020(75)
688. doi 10.2478/s11532-013-0210-y
85029-0
5. Николаева Н.С., Солдатова Ю.В., Смолина А.В.,
13. Barilone J., Neese F. Appl. Magn. Reson. 2015, 46,
Аксиненко А.Ю., Соколов В.Б., Кинзирский А.С.,
117-139. doi 10.1007/s00723-014-0627-2
Котельникова Р.А., Штолко В.Н., Котельников А.И.
14. Neese F. Wiley Interdiscip. Rev.: Comput. Mol. Sci.
Изв. АН. Сер. хим. 2017, 66, 870-874. [Nikolaeva N.S.,
2012, 2, 73-78. doi 10.1002/wcms.81
Soldatova Yu.V., Smolina A.V., Aksinenko A.Yu.,
15. Stol S., Schweiger A. J. Magn. Reson. 2006, 178, 42-
Sokolov V.B., Kinzirsky A.S., Kotel’nikova R.A.,
55. doi 10.1016/j.jmr.2005.08.013
Shtolko V.N., Kotel’nikov A.I. Russ. Chem. Bull. 2017,
16. Neugebauer F.A., Otting W., Smith H.O. Trischmann H.
66, 870-874.] doi 10.1007/s11172-017-1821-9
Eur. J. Inorg. Chem. 1972, 105, 549-553. doi 10.1002/
6. Милаева Е.З., Шпаковский Д.Б., Маклакова И.А.,
cber.19721050220
Зуфанов К.А., Неганова М.Е., Шевцова Е.Ф.,
17. Щипанов В.П., Клюев Н.А. ХГС.
1981,
17,
Чураков А.В., Бабкова В.А., Бабков Д.А., Косола-
1560-1562.
[Schipanov V.P., Klyuev N.A. Chem.
пов В.А., Спасов А.А. Изв. АН. Сер. хим. 2018, 67,
Heterocycl. Comp. 1981, 17, 1145-1147.] doi 10.1007/
2025-2034. [Milaeva E.R., Shpakovsky D.B., Mak-
BF00506470
lakova I.A., Rufanov K.A., Neganova M.E., Shevtso-
va E.F., Churakov A.V., Babkova V.A., Babkov D.A.,
18. Schnakenburg G., Meyer A. Acta Cryst. 2018, E74,
Kosolapov V.A., Spasov A.A. Russ. Chem. Bull. 2018,
292-297. doi 10.1107/S2056989018001913
67, 2025-2034.] doi 10.1007/s11172-018-2324-z
19. Sharma O.P., Bhat T.K. Food Chem. 2009, 113, 1202-
7. El-Mekabaty A., El-Shora H.M. Chem. Heterocyclic
1205. doi 10.1016/j.foodchem.2008.08.008
Compd. 2018, 54, 618-624.
20. Sheldrick G.M. Acta Cryst. 2008, A64, 112-122. doi
8. Makhaeva G.F., Lushchekina S.V., Boltneva N.P.,
10.1107/S0108767307043930
Serebryakova O.G., Rudakova E.V., Ustyugov A.A.,
21. Клюев Н.А., Жильников В.Г., Александров Г.Г.,
Bachurin S.O., Shchepochkin A.V., Chupakhin O.N.,
Грандберг И.И., Липунова Г.Н. ЖОрХ. 1983, 19,
Charushin V.N., Richardson R.J. Bioorg. Med. Chem.
2615-2618.
2017, 25, 5981-5994. doi 10.1016/j.bmc.2017.09.028
22. Федорченко Т.Г., Липунова Г.Н., Щепочкин А.В.,
9. Козлова З.Г., Щипанов В.П., Цепалов В.Ф. ЖОрХ.
Цмокалюк А.Н., Валова М.С., Слепухин П.А. ХГС.
1980, 16, 1098.
2019, 55, 560-565. [Fedorchenko T.G., Lipunova G.N.,
10. Ольховикова Н.Б., Русинова Л.И., Шмелев Л.В.,
Shchepochkin A.V., Tsmokalyuk A.N., Valova M.S.,
Липунова Г.Н., Клюев Н.А., Ельцов А.В. ЖОХ.
Slepukhin P.A. Chem. Heterocycl. Compd. 2019, 55,
1988, 58, 1626-1634.
560-565.] doi 10.1007/s10593-019-02496-4
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020
64
ФЕДОРЧЕНКО и др.
Synthesis, Spectral, Electrochemical and Antioxidant Properties
of 2-{5-(Aryl)-6-R-3-phenyl-5,6-dihydro-
4H-[1,2,4,5]tetrazine-1-yl}benzothiazoles
T. G. Fedorchenkoa, *, G. N. Lipunovaa, b, A. V. Shchepochkina, b, M. S. Valovaa,
A. N. Tsmokalyukb, P. A. Slepukhina, b, and O. N. Chupakhina, b
a Postovsky Institute of Organic Synthesis, Ural Branch of the Russian Academy of Sciences,
620219, Russia, Yekaterinburg, ul. S. Kovalevskoy 22 / ul. Akademicheskaya 20
*e-mail: deryabina@ios.uran.ru
b Institute of Chemical Engineering, Ural Federal University, 620002, Russia, Yekaterinburg, ul. Mira 28
Received June 10, 2019; revised November 14, 2019; accepted November 22, 2019
New 2-{5-(aryl)-6-R-3-phenyl-5,6-dihydro-4H-[1,2.4.5]tetrazin-1-yl}benzothiazoles have been synthesized from
the corresponding formazans by alkylation followed by cyclization of N-alkylderivatives. The products were
characterized by 1H, 13C, NMR, IR, mass spectra and X-ray diffraction data. The electrochemical properties and
antioxidant activity of obtained benzothiazoles were studied.
Keywords: 2-{5-(aryl)-6-R-3-phenyl-5,6-dihydro-4H-[1,2,4,5]tetrazin-1-yl}benzothiazoles, dihydrotetrazines, cyclic
voltammetry, electrochemical properties, antioxidant activity
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020