ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 1, с. 83-87
УДК 547.541.1 + 547.412.12
N,N'-БИС(ТРИФТОРМЕТИЛСУЛЬФОНИЛ)АМИДЫ
ДИКАРБОНОВЫХ КИСЛОТ
© 2020 г. Л. Л. Толстикова*, Б. А. Шаинян, И. В. Стерхова, Л. А. Беловежец
ФГБУН «Иркутский институт химии им. А.Е. Фаворского СО РАН», 664033, Россия, г. Иркутск, ул. Фаворского 1
*e-mail: tolstikova@irioch.irk.ru
Поступила в редакцию 26 июня 2019 г.
После доработки 19 ноября 2019 г.
Принята к публикации 22 ноября 2019 г.
Двухосновные глутаровая, адипиновая и себациновая кислоты реагируют с двумя эквивалентами N-
сульфинилтрифламида CF3SO2NSO в присутствии хлористого тионила как катализатора с образованием
N,N'-бис(трифторметилсульфонил)замещённых диамидов CF3SO2NНСO(CH2)nC(O)NHSO2CF3 (n = 3, 4, 8).
Янтарная и 4-нитрофталевая кислоты в этих условиях претерпевают дегидратацию с образованием
соответствующих ангидридов.
Ключевые слова: N-сульфинилтрифламид, дикарбоновые кислоты, бис(трифторметилсульфонил)заме-
щённые диамиды, антимикробная активность.
DOI: 10.31857/S0514749220010115
Реакции фторсодержащих гетерокумуленов,
групп в молекуле в настоящей работе изучено
таких как RFSO2N=S=O, RFSO2N=C=O с сое-
взаимодействие соединения 1 с двухосновными
динениями, содержащими кислый протон, хорошо
кислотами HOOCRCOOH [R = - (2), CH2 (3), (CH2)2
изучены и активно используются в органическом
(4), (CH2)3 (5), (CH2)4 (6), (СН2)8 (7), o-4-NO2C6H3
синтезе [1-3]. Например, при взаимодействии N-
(8), CH=CH (9, 10)] и, для сравнения, с метакри-
сульфинилперфторалкансульфонамидов с одно-
ловой кислотой СН2=С(Ме)СООН (11). Ранее двух-
основными карбоновыми кислотами выделяется
основные кислоты в эти реакции не вовлекались.
SO2 и, после прототропной изомеризации, обра-
Оказалось, что щавелевая кислота 2 не взаимо-
зуются смешанные имиды перфторалкансульфо-
действует с соединением 1 даже в присутствии
новых и карбоновых кислот RFSO2NHC(O)R'.
хлористого тионила при длительном нагревании
Реакция проводится при комнатной температуре
(90-100°С). Малоновая кислота 3 в этих условиях
или при нагревании до 150-160°С в зависимости от
декарбоксилируется до уксусной кислоты; пос-
силы кислоты и катализируется SOCl2 и HCl [2, 3].
ледняя дает с соединением 1 описанный в лите-
На примере реакции RFSO2N=S=O с большим
ратуре смешанный имид CF3SO2NHC(O)CH3 [2],
рядом монокарбоновых кислот был сделан вывод о
что подтверждается наличием в спектрах ЯМР
снижении их реакционной способности по мере
сырого продукта сигналов ацетамидного остатка,
повышения кислотности [2].
квартета CF3 и соответствующего сигнала 19F. Про-
вести реакцию при комнатной температуре, чтобы
Наличие в молекуле карбоновой кислоты
избежать декарбоксилирования, не удалось даже в
других функциональных групп может менять
присутствии хлористого тионила.
направление реакции; например, в реакции 3-гид-
разинобензойной кислоты с N-сульфинилтрифтор-
Иначе ведут себя в этих условиях янтарная (4) и
метансульфонамидом TfN=S=O (1) (Tf = CF3SO2)
4-нитрофталевая
(8) кислоты. Из реакционных
карбоксильная группа не затрагивается, а проис-
смесей были выделены только янтарный или 4-
ходит перенос группы S=O на терминальный атом
нитрофталевый ангидрид и трифламид. Таким
азота гидразинового остатка [3]. С целью расши-
образом, соединение 1 реагирует с данными кисло-
рения круга карбоновых кислот и изучения воз-
тами исключительно как дегидратирующий агент,
можного взаимного влияния двух карбоксильных
гидролизуясь выделяющейся водой до трифламида.
83
84
ТОЛСТИКОВА и др.
Схема 1.
COOH
CONHSO2CF3
2CF3SO2N=S=O +
(CH2)n
(CH2)n
_SO2
COOH
CONHSO2CF3
1
5, 6, 7
12, 13, 14
n = 3 (5, 12); 4 (6, 13); 8 (7, 14).
методами элементного анализа, ИК и ЯМР 1Н, 13С,
19F спектроскопии и с помощью рентгенострук-
турного анализа. В ИК спектре присутствует
полоса амидной группы NHСО при 1737 см-1, в
спектре ЯМР 13С - сигнал амидного атома угле-
рода около 171 м.д. и квартет CF3, а в спектре ЯМР
19F - сигнал атома фтора около -77 м.д.
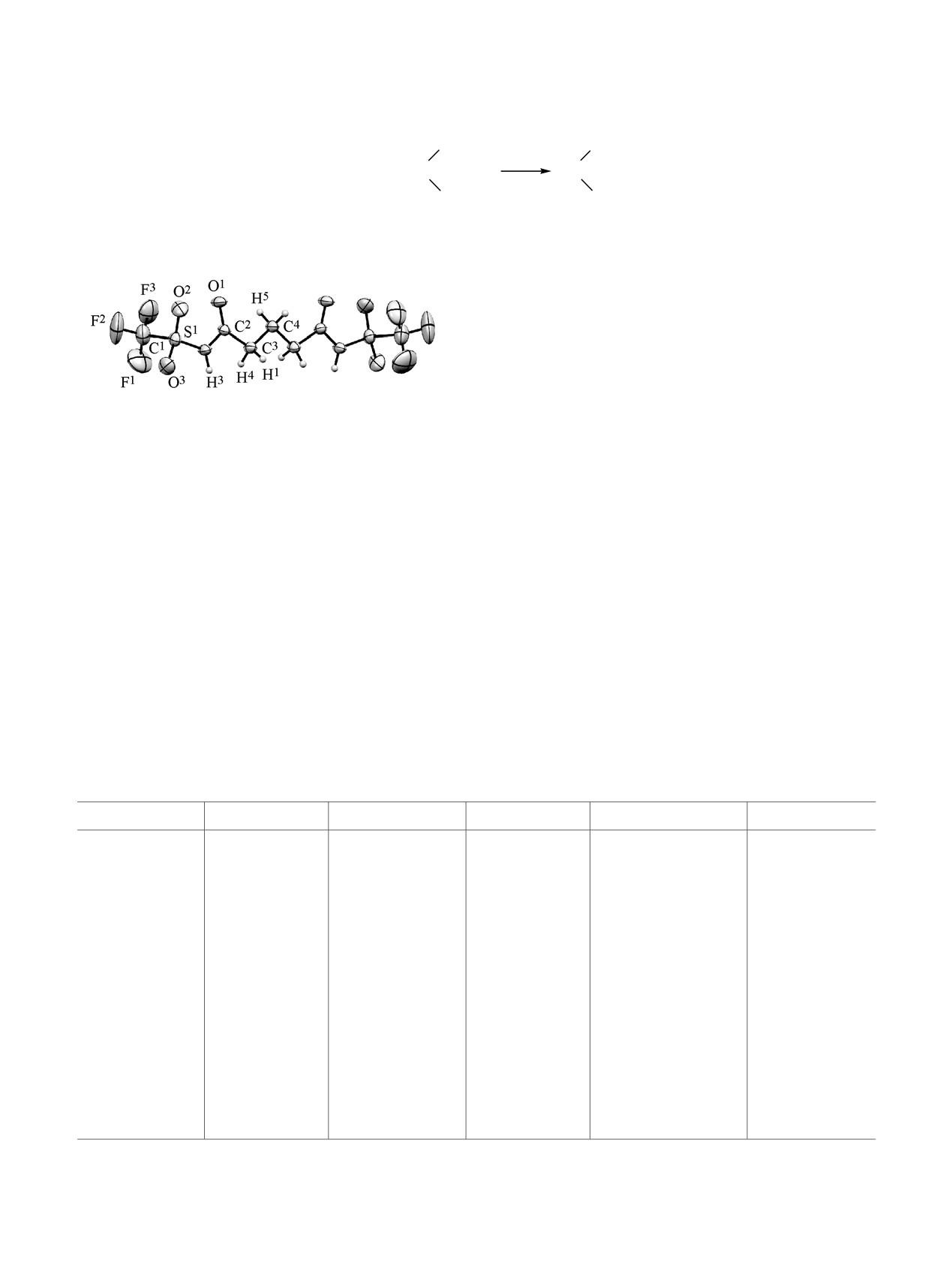
Молекулярная структура N,N'-бис(трифторметилсуль-
фонил)глутарамида (12) (ORTEP, 50% тепловые эллип-
соиды).
Молекулярная структура соединения 12, уста-
новленная методом РСА, приведена на рисунке,
Целевые продукты конденсации N-сульфинил-
основные геометрические параметры - в табл. 1.
трифламида 1 по двум карбоксильным группам
Молекула 12 имеет ось симметрии, проходящую
удалось получить с глутаровой (5), адипиновой (6)
через атом С4. Средние значения длин связей С-F
и себациновой (7) кислотами (схема 1).
и S-O в молекуле амида 12 равны 1.306 и 1.411 Å
Глутаровая кислота 5 гладко реагирует с дву-
соответственно, что на
~0.02 Å ниже, чем в
кратным избытком соединения 1 без растворителя
молекуле трифламида (1.325 и 1.428 Å), остальные
в присутствии каталитических количеств хло-
параметры трифламидного фрагмента очень близки
ристого тионила при комнатной температуре,
к таковым в молекуле трифламида [4]. Кристал-
образуя N,N'-бис(трифторметилсульфонил)глутар-
лическая структура амида 12 формируется за счет
амид (12) с выходом, близким к количественному.
межмолекулярных водородных связей NH···О=C.
В отсутствие катализатора реакция не идет, как и в
Каждая молекула амида 12 связана с 4 соседними
растворе (хлористый метилен, хлороформ, бензол).
молекулами, длины Н-связей равны 1.978 Å, угол
Состав и строение соединения
12 доказаны
N-H···O равен 156.2°.
Таблица 1. Длины связей, некоторые валентные и торсионные углы в соединении 12.
Связь
l, Å
Угол
φ, град
Угол
θ, град
S1-O2
1.407(2)
O2-S1-O3
122.1(1)
O2-S1-N1-C2
-33.5(2)
S1-O3
1.416(2)
O2-S1-N1
111.4(1)
O3-S1-N1-C2
-168.7(2)
S1-N1
1.622(2)
O1-C2-C3
125.6(2)
C1-S1-N1-C2
80.3(2)
S1-C1
1.828(3)
O2-S1-C1
106.4(1)
O2-S1-C1-F3
52.9(3)
F1-C1
1.306(4)
N1-S1-C1
103.1(1)
O3-S1-C1-F3
-176.0(2)
F2-C1
1.312(4)
C2-N1-S1
127.3(1)
N1-S1-C1-F3
-64.5(3)
F3-C1
1.302(4)
F3-C1-F1
107.3(3)
O2-S1-C1-F1
172.3(2)
O1-C2
1.204(2)
F1-C1-S1
110.5(2)
O3-S1-C1-F1
-56.6(3)
N1-C2
1.401(3)
O1-C2-N1
121.3(2)
N1-S1-C1-F1
55.0(3)
C2-C3
1.491(3)
N1-C2-C3
113.1(2)
O2-S1-C1-F2
-66.8(3)
C3-C4
1.513(3)
C2-C3-C4
114.0(2)
S1-N1-C2-O1
-3.6(3)
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020
N,N'-БИС(ТРИФТОРМЕТИЛСУЛЬФОНИЛ)АМИДЫ ДИКАРБОНОВЫХ КИСЛОТ
85
Схема 2.
CF3SO2N=S=O
+
H2C
C COOH
H2C
C CONHSO2CF3
_SO
2
CH3
CH3
1
11
15
Таблица 2. Минимальная ингибирующая концентрация действующих веществ (мкг/мл) в отношении исследованных
микроорганизмов.
Соединение
Enterococcus durans
Bacillus subtilis
Escherichia coli
Penicillium citreoviride
5
62.5
125
>1000
>1000
6
31.2
500
500
>1000
12
125
125
>1000
>1000
13
31.2
31.2
31.2
>1000
16
31.2
31.2
31.2
>1000
Салициловая
31.2
31.2
31.2
>1000
кислота
Адипиновая
(6) и себациновая
(7) кислоты
ностью исходных кислот (табл. 2). Оказалось, что
реагируют с соединением 1 только в присутствии
производное глутарамида 12 ведет себя аналогично
хлористого тионила при нагревании. Состав и
исходной кислоте 5, проявляя активность только в
строение полученных N,N'-бис(трифторметилсуль-
отношении грам-положительных культур. Салици-
фонил)адипамида (13) и N,N'-бис(трифторметил-
ловая кислота и ее производное 16 активны в
сульфонил)себацамида
(14) доказаны данными
отношении всех бактерий в равной степени, тогда
элементного анализа, наличием в ИК спектрах
как производное адипамида
13 существенно
полос амидной группы около 1730 см-1, а в спектре
активнее исходной кислоты 6.
ЯМР 1Н - сигналов NH, CH2СО и (СН2)2 групп в
соотношении, соответствующем составу молекул.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В спектрах ЯМР 13С присутствуют сигналы амид-
ного углерода и квартеты группы CF3, а в спектрах
ИК спектры регистрировали на приборе Varian
ЯМР 19F - сигналы в области -76÷-77 м.д., сов-
3100 FT-IR в тонком слое и в KBr. Спектры ЯМР
падающие или близкие к таковым у продукта 12.
снимали на спектрометре Bruker DPX-400 на
рабочих частотах 400 (1Н), 100 (13С), 376 (19F),
Независимо от температуры, продолжитель-
40.5 МГц в CD3CN, ДМСО-d6 или CDCl3. В
ности реакции и присутствия хлористого тионила,
качестве внутреннего стандарта использовали сиг-
нам не удалось получить продукты взаимодействия
налы остаточных протонов (1Н), или атомов угле-
соединения 1 с малеиновой (9) и фумаровой (10)
рода (13С) растворителя, химические сдвиги приве-
кислотами, возможно, из-за отмеченного выше
дены относительно ТМС (1Н, 13С), CCl3F (19F).
снижения реакционной способности при повы-
шении кислотности. Однако их одноосновный
Рентгеноструктурный анализ соединения
12
аналог, метакриловая кислота (11), реагирует с N-
выполнен на дифрактометре Bruker D8 Venture при
сульфинилтрифламидом
(1) в мягких условиях
T 293 K, MoKα-излучение (λ 0.71073 Å), скани-
(схема 2), образуя 2-метил-N-(трифторметилсуль-
рование по углам ϕ и ω. Структура решена и уточ-
фонил)акриламид (15) с выходом 82%.
нена прямым методом с помощью программного
Учитывая, что многие карбоновые кислоты и их
комплекса SHELX
[5]. Поглощение излучения
производные являются хорошими антисептиками
веществом учитывали с помощью программы
(см., например, [7]), мы изучили антимикробную
SADABS. Кристаллографические данные соеди-
активность соединений
12,
13 и ранее синте-
нения 12 депонированы в Кембриджской базе струк-
зированного N-(2-гидроксибензоил)трифламида
(16)
[3] и сравнили ее с антимикробной актив-
cif), CCDC 1908888.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020
86
ТОЛСТИКОВА и др.
N,N'-Бис(трифторметилсульфонил)глутар-
соединения 1 и 0.20 г (1.00 ммоль) себациновой
амид (12). Смесь 0.40 г (2.05 ммоль) соединения 1,
кислоты (7). Смесь перемешивали при 50-55°С в
0.132 г (1 ммоль) глутаровой кислоты (5) и 0.1 мл
течение 10 мин до полной кристаллизации, про-
SOCl2 перемешивали при комнатной температуре
дукт переосаждали из ацетона гексаном, промы-
20 мин до полной кристаллизации, выдерживали
вали диэтиловым эфиром и сушили в вакууме.
еще 16 ч, затем упаривали досуха, промывали хло-
Выход 0.12 г (26%), т.пл. 192-195°С. ИК спектр,
роформом, сушили в вакууме. Выход 0.37 г (94%),
KBr, ν, cм-1: 3136, 2931, 2858, 1728, 1470, 1398,
т. пл. 213-215°С. ИК спектр (плёнка), ν, cм-1: 3153,
1213, 1135, 1087, 881, 613. Спектр ЯМР 1Н (ДМСО-
1737, 1466, 1396, 1232, 1201, 1140, 1098, 873, 612.
d6), δ, м.д.: 1.24 с (8H, 4CH2), 1.51 уш.т (4H, 2CH2, J
Спектр ЯМР 1Н (CD3CN), δ, м.д.: 1.89 квинтет (2H,
7.2 Гц), 2.37 т (4Н, 2CH2, J 7.2 Гц), 9.08 уш.с (2Н,
CH2, J 7.1 Гц), 2.51 т (4Н, CH2, J 7.1 Гц), 3.34 уш.с (2Н,
NН). Спектр ЯМР 13С (ДМСО-d6), δ, м.д.: 23.84
NН). Спектр ЯМР 13С (CD3CN), δ, м.д.: 18.74 (СН2),
(2СН2), 28.03 (2СН2), 28.34 (2СН2), 36.35 (2СН2),
35.75 (2СН2), 120.28 к (СF3SO2, 1JCF 320.8 Гц), 171.08
119.21 к (СF3SO2, 1JCF 320.5 Гц), 172.21 (C=O).
(C=O). Спектр ЯМР 19F (CD3CN), δ, м.д.: -77.46.
Спектр ЯМР
19F (ДМСО-d6), δ, м.д.:
-76.35.
Найдено, %: С 21.62; Н 2.00; F 28.97; N 6.72; S 15.88.
Найдено, %: С 31.14; Н 3.94; N 5.96; S 13.11.
C7H8F6N2O6S2. Вычислено, %: С 21.32; Н 2.05; F
C12H18F6N2O6S2. Вычислено, %: С 31.04; Н 3.91; N
28.91; N 7.11; S 16.27.
6.03; S 13.81.
РСА соединения 12. C7H8F6NO6S2, М 394.28, бес-
2-Метил-N-(трифторметилсульфонил)акрил-
цветные призмовидные кристаллы, 0.10×0.14×0.50 мм.
амид (15). К 0.58 г (3.00 ммоль) соединения 1
Пространственная группа Pbcn; θмин/θмакс 2.48/30.04;
прибавляли 0.17 г (2.00 ммоль) 2-метакриловой
a 9.4829(5) Å, b 9.2968(4) Å, c 16.4283(7) Å; α = β =
кислоты (11) и 0.1 мл SOCl2, перемешивали при
γ = 90°, V 1448.3(1) Å3, Z 4, dвыч 1.808 г/см3, F(000)
комнатной температуре
3 ч и еще
16 ч при
792; μ 0.467 мм-1; 18093 отражений, из них 2124
температуре -5°С, затем промывали хлороформом
независимых; 105 уточняемых параметров; R 4.62,
и упаривали досуха. Выход 0.68 г (82%). ИК
Rw (по всем накоплениям) 0.093; критерий согласия
спектр, (плёнка), ν, cм-1: 3384, 3276, 1715, 1445,
по F2 1.015; Drмакс/Drмин 0.399/-0.371 e/Å3; весовая
1382, 1202, 1134, 1089, 861, 603. Спектр ЯМР 1Н
схема w = [s2 (F02) + (0.0555P)2+ 0.9268P]-1, где P =
(CDCl3), δ, м.д.: 1.96 с (3H, CH3), 5.80 с (1Н,
(F02 + 2Fc2)/3.
=CHцис), 5.97 с (1Н, =СНтранс), 8.93 уш.с (1Н, NH).
Спектр ЯМР 13С (CDCl3), δ, м.д.: 17.81 (СН3),
N,N'-Бис(трифторметилсульфонил)адипамид
119.10 к (СF3SO2, 1JCF 320.8 Гц), 126.10 (СН2=),
(13). Реакцию проводили как описано выше,
137.48 (С), 164.17 (C=O). Спектр ЯМР 19F (CDCl3),
добавляя 0.1 мл SOCl2 к смеси 0.40 г (2.05 ммоль)
δ, м.д: -75.46. Найдено, %: С 27.42; Н 2.59; N 6.88;
соединения 1 и 0.15 г (1.00 ммоль) адипиновой
S 17.204. C5H6F3NO3S. Вычислено, %: С 27.65; Н
кислоты (6). Смесь перемешивали при 75-80°С в
2.78; N 6.45; S 14.77.
течение 30 мин до полной кристаллизации, промы-
вали хлороформом, продукт переосаждали из аце-
Взаимодействие N-сульфинилтрифторметан-
тона гексаном и сушили в вакууме. Выход 0.22 г
сульфонамида с янтарной кислотой. К 0.40 г
(54%), т.пл. 191-192°С. ИК спектр (плёнка), ν, cм-1:
(2.05 ммоль) соединения
1 прибавляли
0.12 г
3172, 1734, 1457, 1398, 1232, 1205, 1140, 1088, 876,
(1.00 ммоль) янтарной кислоты (4) и 0.1 мл SOCl2,
609. Спектр ЯМР 1Н (CD3CN), δ, м.д.: 1.62-1.65
перемешивали 20 мин при комнатной температуре
м
(4H,
2CH2),
2.44-2.47 м
(4Н,
2CH2),
6.62
и 20 мин при 45°С, охлаждали, упаривали. Остаток
уш.с (2Н, NН). Спектр ЯМР 13С (CD3CN), δ, м.д.:
растворяли в небольшом количестве ацетона и
23.72
(2СН2),
36.89
(2СН2),
120.28 к (СF3SO2,
добавляли гексан. Выпавшие кристаллы отфильт-
1JCF
320.8 Гц),
171.25 (C=O). Спектр ЯМР 19F
ровывали и сушили. Выход янтарного ангидрида
(CD3CN), δ, м.д.: -77.42. Найдено, %: С 23.40; Н
0.065 г (65%). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 3.01
2.44; F 27.34; N 6.78; S 15.23. C8H10F6N2O6S2.
с (CH2) (3.02 м.д. [6]). Спектр ЯМР 13С (CDCl3), δ,
Вычислено, %: С 23.53; Н 2.47; F 27.92; N 6.86;
м.д.: 28.34 (СН2), 170.67 (C=O) (28.38, 170.65 м.д.
S 15.71.
[6]).
N,N'-Бис(трифторметилсульфонил)себацамид
Взаимодействие N-сульфинилтрифторметан-
(14). Реакцию проводили как описано выше,
сульфонамида с 4-нитрофталевой кислотой. К
добавляя 0.1 мл SOCl2 к смеси 0.45 г (2.30 ммоль)
0.40 г (2.05 ммоль) соединения 1 прибавляли 0.21 г
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020
N,N'-БИС(ТРИФТОРМЕТИЛСУЛЬФОНИЛ)АМИДЫ ДИКАРБОНОВЫХ КИСЛОТ
87
(1.00 ммоль) 4-нитрофталевой кислоты (8) и 0.1 мл
БЛАГОДАРНОСТИ
SOCl2, перемешивали при 90-95°С в течение 40 мин,
охлаждали и упаривали в вакууме. Остаток раст-
В работе использовано оборудование Байкальс-
воряли в небольшом количестве ацетона и добав-
кого центра коллективного пользования Сибирс-
ляли гексан. Выпавшие кристаллы отфильт-
кого отделения РАН.
ровывали, промывали эфиром, сушили. Выход 5-
КОНФЛИКТ ИНТЕРЕСОВ
нитро-2-бензофуран-1,3-диона 0.072 г (37%). ИК
спектр (плёнка), ν, cм-1: 3111, 1852, 1791, 1545,
Авторы заявляют об отсутствии конфликта
1348,
1258,
1126,
929,
899,
710. Спектр ЯМР
интересов.
1Н (CD3CN), δ, м.д.: 8.19 д (1H, H7, J 8.4 Гц), 8.59
д (1H, H6, J 8.4 Гц), 8.61 с (1H, H4) {[8.28 д (J
СПИСОК ЛИТЕРАТУРЫ
8.2 Гц), 8.79 д.д (J 8.2, 1.8 Гц), 8.86 д (J 1.4 Гц)
[6]}. Спектр ЯМР 13С (CD3CN), δ, м.д.: 121.65,
1. Shainyan B.A., Tolstikova L.L. Chem. Rev. 2013, 113,
127.99,
132.19,
133.91,
136.80,
153.90,
162.22,
699-733. doi 10.1021/cr300220h
162.49.
2. Zhu S.Z.; Xu B; Zhang J. J. Fluor. Chem. 1995, 74,
203-206. doi 10.1016/0022-1139(95)03282-I
Антимикробную активность соединений изу-
3. Шаинян Б.А., Толстикова Л.Л., Бельских А.В.
чали стандартным диск-диффузионным методом
ЖОрХ.
2008,
44,
1136-1140.
[Shainyan B.A.,
[8] в отношении культур Bacillus subtilis В-406,
Tolstikova L.L., Bel’skykh A.V. Russ. J. Org. Chem.
Enterococcus durans В-603, Penicillium citreoviride
2008, 44, 1121-1125.] doi 10.1134/S1070428008080022
F-1777, Escherichia coli B-1238 (предоставлены
4. Sterkhova I.V., Shainyan B.A. J. Phys. Org. Chem.
ВКМ) в водном растворе с разведением от 15 до
2015, 28, 485-489. doi 10.1002/poc.3441
1000 мкг/мл. Культуры Bacillus subtilis выращи-
5. Sheldrick G.M., Acta Crystallogr. A, 2008, 64, 112-
вали на картофельном агаре, Enterococcus durans -
122. doi 10.1107/S0108767307043930
на модифицированной среде для молочнокислых
6. Kantin G., Chupakhin E., Dar’in D., Krasavin M.
бактерий с Твин-80 (среда № 75 ВКМ), Escherichia
Tetrahedron Lett. 2017, 58, 3160-3163. doi 10.1016/
coli - на мясопептонном агаре, Penicillium citreo-
j.tetlet.2017.06.089
viride - на сусло-агаре. Результаты оценивали по
7. Брель А.К., Крамарь В.С., Лисина С.В. Успехи
появлению зон угнетения роста. Определяли только
современного естествознания 2008, 80.
минимальную ингибирующую концентрацию дейст-
8. Решедько Г.К., Cтецюк О.У. Клиническая микробио-
вующего вещества.
логия и антимикробная химиотерапия 2001, 3, 348.
N,N'-Bis(trifluoromethylsulfonyl)amides
of Dicarboxylic Acids
L. L. Tolstikova*, B. A. Shainyan, I. V. Sterkhova, and L. A. Belovezhets
Favorskii Irkutsk Institute of Chemistry, Siberian Branch, Russian Academy of Sciences,
664033, Russia, Irkutsk, ul. Favorskogo 1
*e-mail: tolstikova@irioch.irk.ru
Received June 26, 2019; revised November 19, 2019; accepted November 22, 2019
Dicarboxylic glutaric, adipic and sebacic acids react with two equivalents of N-sulfinyltriflamide CF3SO2NSO in
the presence of thionyl chloride as a catalyst to give N,N'-bis(trifluoromethylsulfonyl)substituted diamides
CF3SO2NНСO(CH2)nC(O)NHSO2CF3 (n = 3, 4, 8). Under the same conditions, succinic and 4-nitrophthalic acids
are dehydrated to form the corresponding anhydrides.
Keywords: N-sulfinyltriflamide, dicarboxylic acids, bis(trifluoromethylsulfonyl)substituted diamides, antimicro-
bial activity
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 1 2020