ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 10, с. 1485-1494
УДК 547.751 + 717
ОСОБЕННОСТИ ЭПОКСИМЕТИЛИРОВАНИЯ
2-КАРБОНИЛЗАМЕЩЁННЫХ NH-ГЕТЕРОЦИКЛОВ.
СВОЙСТВА ПРОДУКТОВ ЭПОКСИМЕТИЛИРОВАНИЯ
© 2020 г. А. О. Харанеко*, Т. М. Пехтерева, О. И. Харанеко
ГУ «Институт физико-органической химии и углехимии им. Л.М. Литвиненко»,
83114, Украина, г. Донецк, ул. Р. Люксембург 70
*e-mail: antonhar08@rambler.ru
Поступила в редакцию 13 июля 2020 г.
После доработки 26 июля 2020 г.
Принята к публикации 28 июля 2020 г.
Предложен метод синтеза неизвестных ранее пирроло- и индоло-1,4-эпокси[1,4]оксазепинов на основе
реакции эпоксиметилирования 2-бензоилпиррола и 2-бензоилиндола. Изучены пути возможных транс-
формаций продуктов эпоксиметилирования.
Ключевые слова: эпоксиметилирование; 1-фенил-4,5-дигидро-1H,3H-1,4-эпокси[1,4]оксазепино[4,3-a]-
бензимидазол; 7,8,9-триметил-1-фенил-4,5-дигидро-1H,3H-1,4-эпоксипропилпирроло[2,1-c][1,4]окса-
зепин; фенил[3,4,5-триметил-1-(оксиран-2-илметил)-1H-пиррол-2-ил]метанон; 11-метил-1-фенил-4,5-
дигидро-1H,3H-1,4-эпокси[1,4]оксазепино[4,3-a]индол; 6-метил-9-(оксиран-2-илметил)-2,3,4,9-тетра-
гидро-1H-карбазол-1-он; 9-(2-гидрокси-3-пипередин-1-илпропил)-2,3,4,9-тетрагидро-1H-карбазол-1-он.
DOI: 10.31857/S0514749220100018
1-Фенил-4,5-дигидро-1H,3H-1,4-эпокси[1,4]ок-
на схеме 1. Авторы [1] получили оксападол 2 с вы-
сазепино[4,3-a]бензимидазол (2) известен как фар-
ходом 50%.
макологический препарат оксападол [1], обладаю-
Можно предположить, что 2-карбонил-NH-ге-
щий мочегонным, седативным, противоязвенным,
тероциклы, такие как пиррол и индол, в реакции
обезболивающим, противовоспалительным, сер-
эпоксиметилирования будут образовывать анало-
дечным и аналептическим свойствами. Метод его
гичные по структуре соединения, представляю-
синтеза, предложенный в [1], основан на взаимо-
щие фармакологический интерес.
действии натриевой соли 2-бензоилбензимидазола
(1) с эквимольным количеством 2-(хлорметил)-
Цель настоящей работы - усовершенствовать
оксирана (ЭХГ) в абсолютном этаноле и показан
метод синтеза оксападола 2 и показать возмож-
Схема 1.
N Ph
N
Ph
N
Ph
O
Cl
N
O
+
N
O
O
N
O
H
O
1
2
2a
1485
1486
ХАРАНЕКО и др.
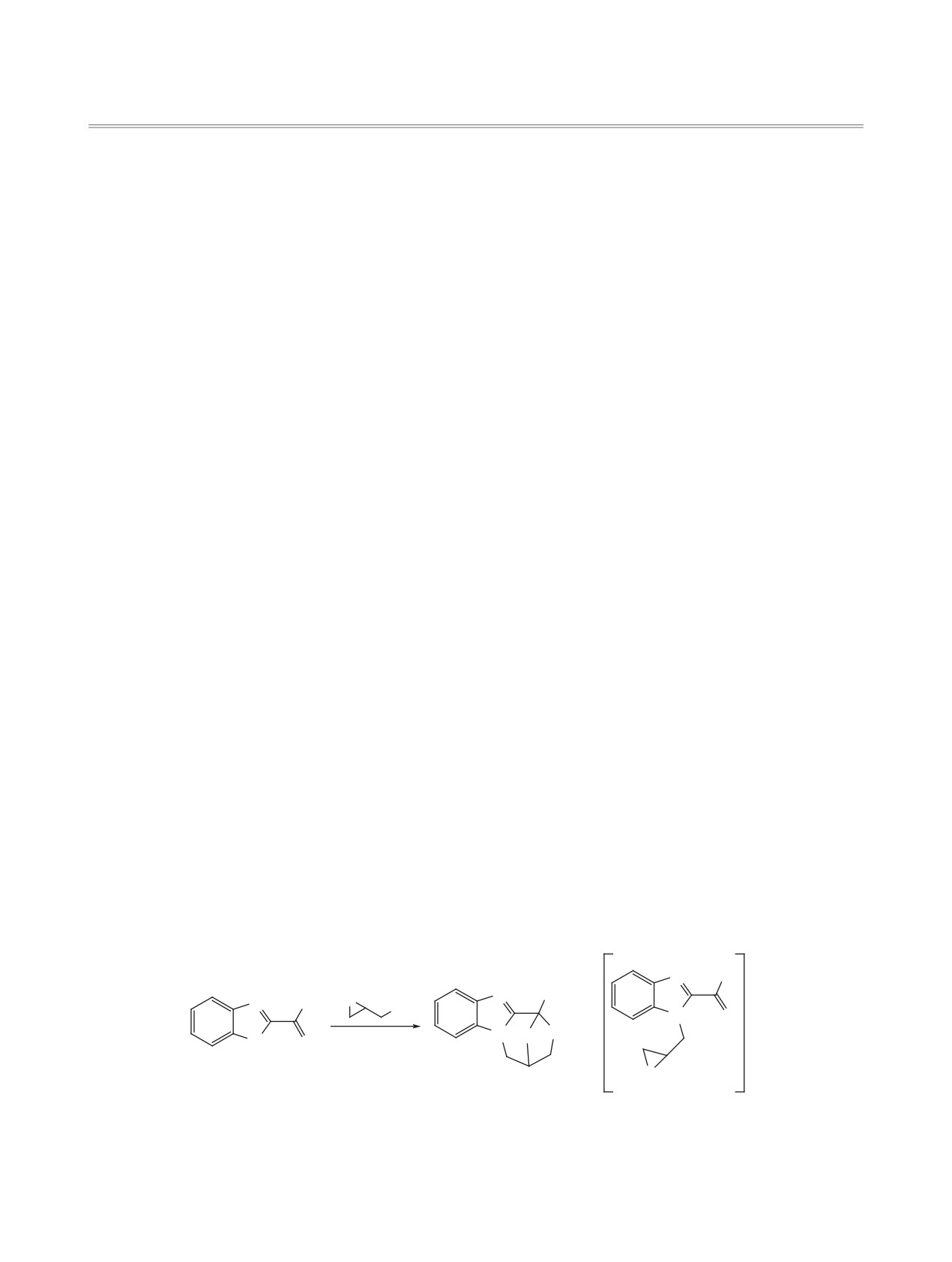
Схема 2.
Me
Me
Me
Me
Ph
O
Me
Ph
Me
Cl
Ph
+
N O
Me
N
O
O
N
O
Me
Me
H
O
3
4
5
ность его применения для синтеза эпокси[1,4]ок-
На схеме 3 показаны результаты эпоксиметили-
сазепинов, аннелированых с ядром пиррола и ин-
рования трёх замещённых индолов.
дола.
При эпоксиметилировании (3-метил-1H-индол-
Мы нашли, что бензимидазол 1 в реакции с
2-ил)(фенил)метанона (6a) образуется 11-метил-1-
10-кратным избытком ЭХГ, 2-х кратным избытком
фенил-4,5-дигидро-1H,3H-1,4-эпокси[1,4]оксазе-
KOH и каталитическими количествами 18-краун-6
пино[4,3-a]индол (7a) с выходом 49% в виде бес-
при 40°С в течение часа даёт оксападол 2 с 63%
цветных кристаллов, а остаток после выделения
выходом.
оксазепина 7a, представляющий некристаллизу-
ющуюся жёлтую смолу, содержал [3-метил-1-(ок-
При использовании этого метода для эпокси-
сиран-2-илметил)-1H-индол-2-ил](фенил)метанон
метилирования 2-бензоил-3,4,5-триметилпиррола
(8a), который в чистом виде не был выделен.
(3) получены два продукта (схема 2), 7,8,9-три-
метил-1-фенил-4,5-дигидро-1H,3H-1,4-эпоксипро-
Для соединения 7а выполнены двумерные го-
пилпирроло[2,1-c][1,4]оксазепин (4) и фенил[3,4,5-
моядерные эксперименты COSY и NOESY. В
триметил-1-(оксиран-2-илметил)-1H-пиррол-2-
эксперименте COSY наблюдаются кросс-пики
ил]метанон (5).
одинаковой интенсивности HС4 протона и прото-
нов H2С3, H2С5 групп, а также кросс-пики между
Спектры ЯМР 1H продуктов 4 и 5 очень по-
орто-протонами и мета-, пара-протонами фени-
хожи, но отличаются тем, что протоны фенила в
ла; между протонами HС7, HС8, HС9, HС10 индо-
оксозепине 4 проявляются двумя мультиплетами
ла. В NOESY эксперименте наблюдали кросс-пики
7.33-7.40 (3H) и 7.55-7.62 (2H) м.д., метиновый
протонов H2С5 с HС7, HС4 с H2С3 и H2С5, H3С11 с
протон соединения 4 даёт мультиплет в обла-
H5С61.
сти 4.95-5.02 м.д., тогда как метиновый протон
эпоксида 5 даёт мультиплет 3.61-3.7 м.д. В спек-
Этил
(2-бензоил-1H-индол-3-ил)ацетат
(6b)
тре ЯМР 13C соединения 4 отсутствует сигнал
превращается в этил
(1-фенил-4,5-дигидро-
186.1 м.д. карбонильного углерода, но есть сигнал
1H,3H-1,4-эпокси[1,4]оксазепино[4,3-a]индол-11-
103.9 м.д., который принадлежит углероду кеталя.
ил)ацетат (7b) и этил [2-бензоил-1-(оксиран-2-ил-
Схема 3.
2
R
R2
3
10
R
R1
R2
R3
9
11
R1
O
1
R3
R1
Cl
8
+
N
O
N
O
O
2
7
6
N
O
3
H
5
4
O
6a-c
7a, b
8a-c
R1 = Ph, R2 = Me, R3 = H (a); R1 = Ph, R2 = CH2C(O)OEt, R3 = H (b); R1-R2 = (CH2)3, R3 = Me (c).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
ОСОБЕННОСТИ ЭПОКСИМЕТИЛИРОВАНИЯ 2-КАРБОНИЛЗАМЕЩЁННЫХ NH-ГЕТЕРОЦИКЛОВ 1487
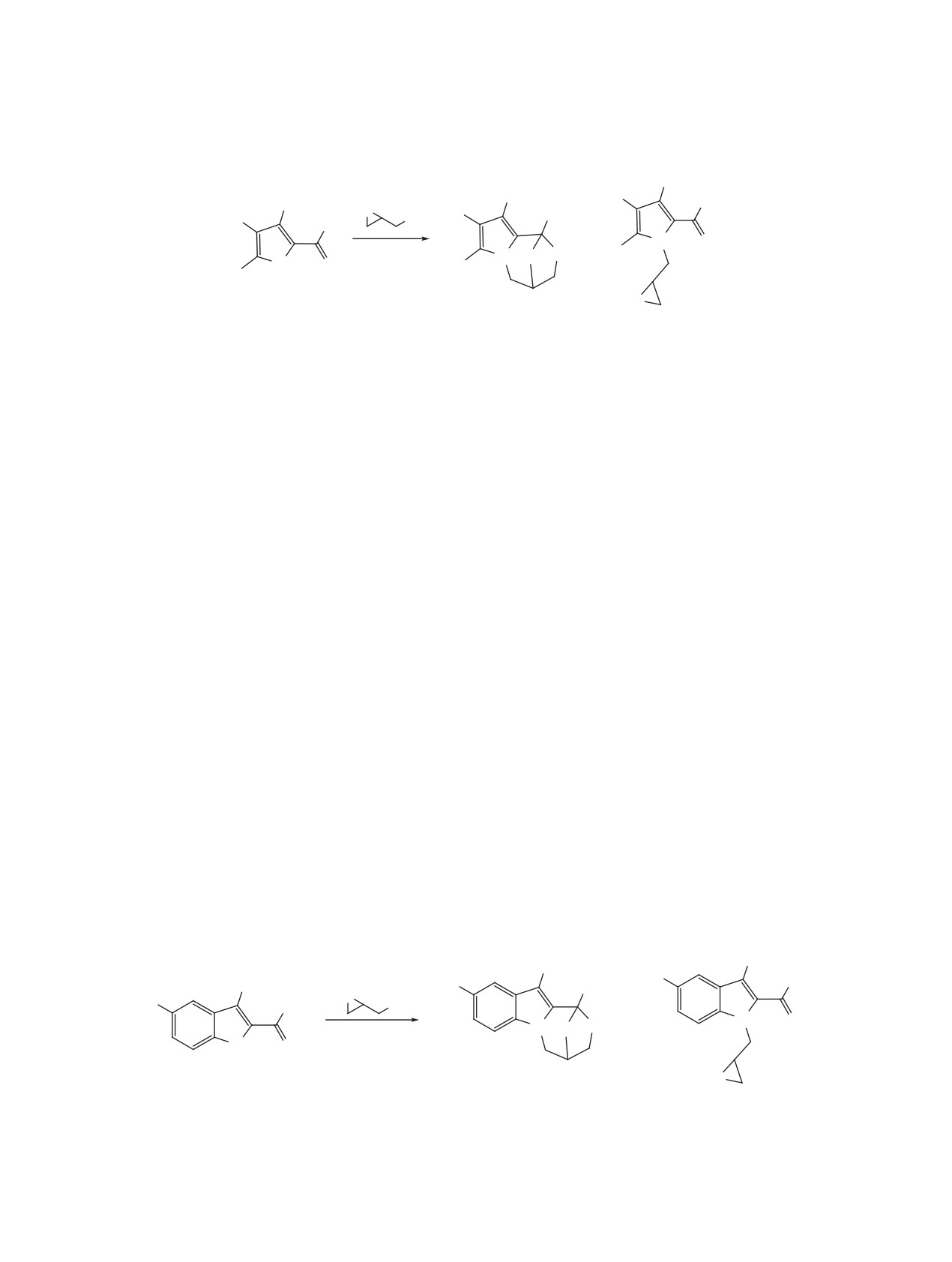
Схема 4.
метил)-1H-индол-3-ил]ацетат (8b) в соотношении
ной группы. Это уменьшает вероятность атаки
~1:1 с общим выходом 82%. При эпоксиметили-
алкоголят-аниона по карбонильному углероду. В
ровании 6-метил-2,3,4,9-тетрагидро-1H-карбазол-
ЯМР 1H спектре пиррола 3 орто-протоны фенила
1-она (6c) был получен только 6-метил-9-(окси-
бензоильной группы дают дублет 7.56 м.д. и на-
ран-2-илметил)-2,3,4,9-тетрагидро-1H-карбазол-
ходятся рядом с сигналами мета- и пара-прото-
1-он (8c) с выходом 86%. Получить ожидаемый
нов, тогда как у бензимидазола 1 и у индолов 6a, b
1,4-эпокси[1,4]оксазепин в данном случае нам
орто-протоны фенила бензоильной группы в спек-
не удалось, по-видимому, в силу жёсткости ше-
тре ЯМР 1H дают дублет в районе 8.0-8.2 м.д. Эти
стичленного каркаса, содержащего карбонильную
данные не позволяют утверждать, что у пиррола 3
группу.
есть бензоильный, а не фенильный, заместитель.
Однако в спектре ЯМР 13C 3 присутствует сигнал с
На схеме 4 приведен возможный механизм
хим. сдвигом 185.9 м.д., который однозначно мож-
эпоксиметилирования соединений 1, 3 и 6a, b, c.
но отнести к углероду карбонильной группы. Эти
Ранее аналогичный механизм был предложен ав-
данные также подтверждают низкую поляризацию
торами [2] для реакции циклизации фенилглици-
карбонильной группы пиррола 3.
дилового эфира с ацетилацетоном.
Общий выход оксазепинов и оксиранов реак-
Выходы оксизепинов 2, 7a и 7b почти рав-
ции эпоксиметилирования высокий, но не коли-
ны выходам оксиранов 2a, 8a и 8b, что говорит
чественный. Это может быть связано с побочной
о равновероятности атаки алкоголят-аниона по
реакцией образовавшегося оксирана с имеющимся
карбонильному углероду или хлорзамещённному
в реакционной массе N-анионом, что приводит к
углероду. Исключение составляют карбазалон 6c
образованию димерного продукта по схеме 5.
и пиррол 3. В случае пиррола 3 выход оксизепи-
на 4 весьма невелик, что можно объяснить низ-
В работе [3] исследовалось эпоксиметилиро-
кой поляризованностью связи C=O карбониль-
вание салицилового альдегида в избытке ЭХГ и
Схема 5.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
1488
ХАРАНЕКО и др.
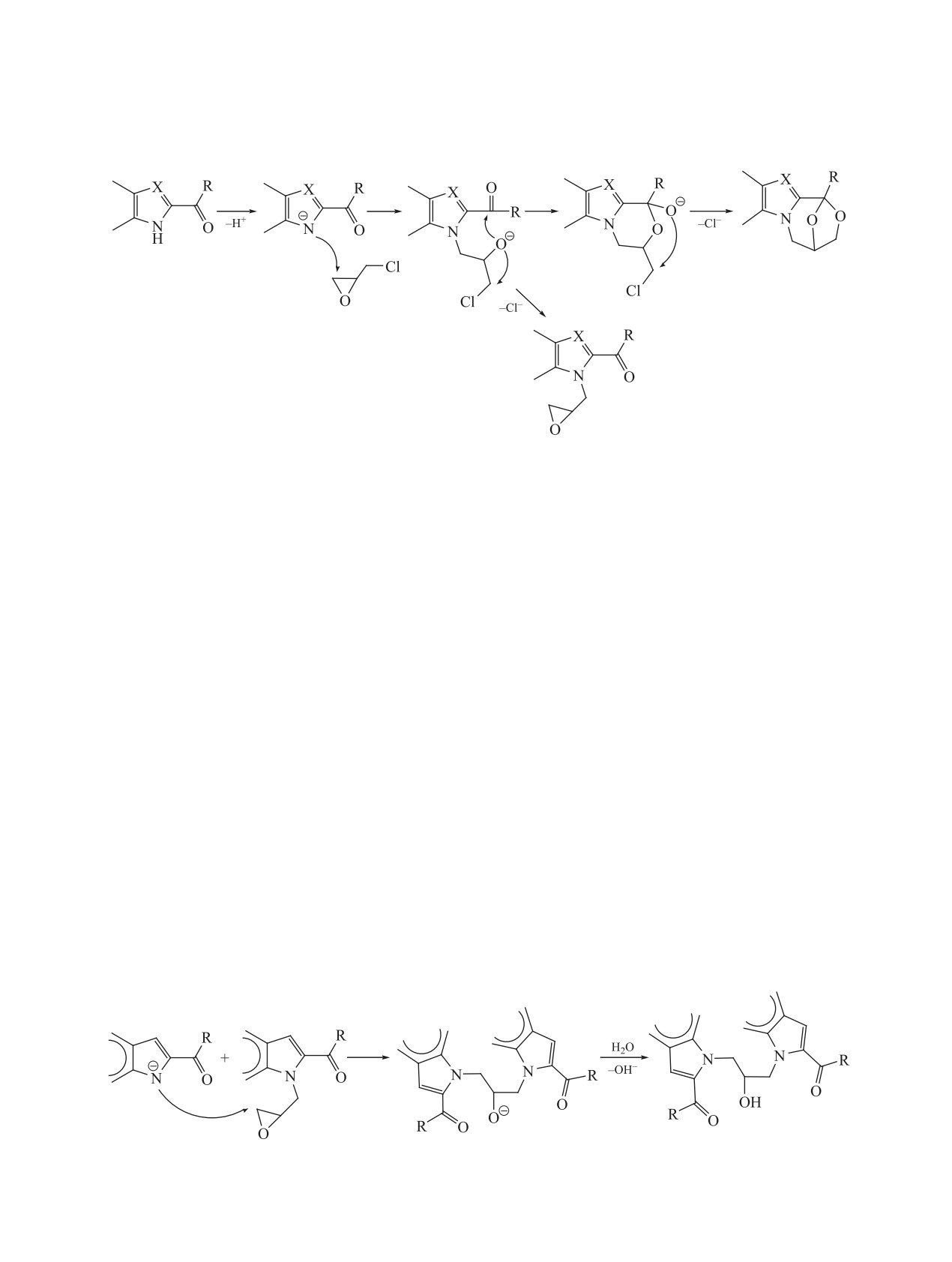
Схема 6.
в присутствии триэтилбензиламмоний хлорида
При попытке получить пиррол 9 присоединением
(TEBACh). Авторы [3] показали, что эпоксимети-
воды к оксирану 5 в присутствии H3PO4 в качестве
лирование салицилового альдегида протекает ко-
катализатора мы столкнулись с побочной реакци-
личественно в течение 10 мин. Дальнейшее нагре-
ей дебензоилирования оксирана 5.
вание реакционной смеси в течение 60 ч приводит
Таким образом, реакция эпоксиметелирования
к количественному превращению эпоксиметиль-
2-карбонилзамещённых NH-гетероциклов явля-
ного производного в 3,4-дигидро-2H,6H-3,6-эпок-
ется удобным методом синтеза производных1,4-
си-1,5-бензодиоксоцин. В этом случае интересную
эпокси[1,4]оксазепинов как с ядром бензимидазо-
роль играет катализатор TEBACh. Можно предпо-
ла, так и с ядром пиррола или индола. Исключение
ложить, что образование бензодиоксацина в этой
составляют производные карбазалона.
системе протекает по механизму, представленно-
му на схеме 6.
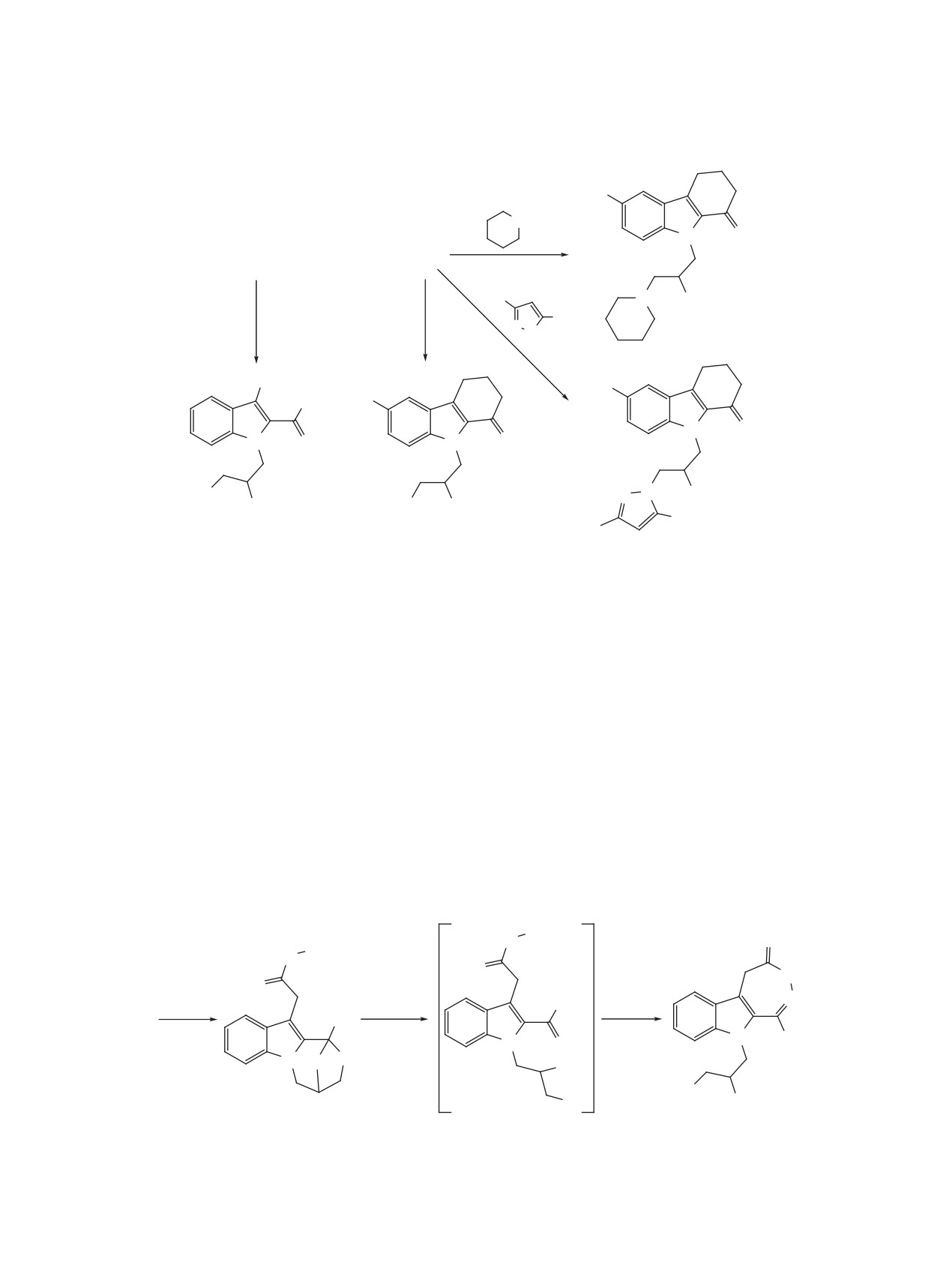
Не меньший интерес представляет и другой
продукт этой реакции - эпоксид. Известно, что
Мы попытались применить этот метод для по-
оксираны вступают в реакции с водой, фенолами,
лучения оксазепина 4 из оксирана 5. При кипя-
первичными и вторичными аминами, спиртами
чении оксирана 5 в ацетонитриле в присутствии
и NH-гетероциклами. Биологический скрининг
катализатора межфазного переноса TEBACh в те-
таких соединений показал их активность в отно-
чение 10 ч нами был получен [1-(2,3-дигидрокси-
шении ЦНС [4]. На схеме 8 приведены некоторые
пропил)-3,4,5-триметил-1H-пиррол-2-yl](фенил)-
реакции с участием оксиранового цикла.
метанон (9), схема 7, т.е. произошло обычное при-
соединение воды, остающейся в ацетонитриле при
Кипячением оксирана 8c с 3,5-диметилпира-
обычном методе очистки, к оксирановому циклу.
золом или пиперидином в этилцеллозольве
Схема 7.
Me
Me
Ph
TEBACh
TEBACh
N
O
4
5
Me
AcCN + H2O
AcCN + H2O
HO
HO
9
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
ОСОБЕННОСТИ ЭПОКСИМЕТИЛИРОВАНИЯ 2-КАРБОНИЛЗАМЕЩЁННЫХ NH-ГЕТЕРОЦИКЛОВ 1489
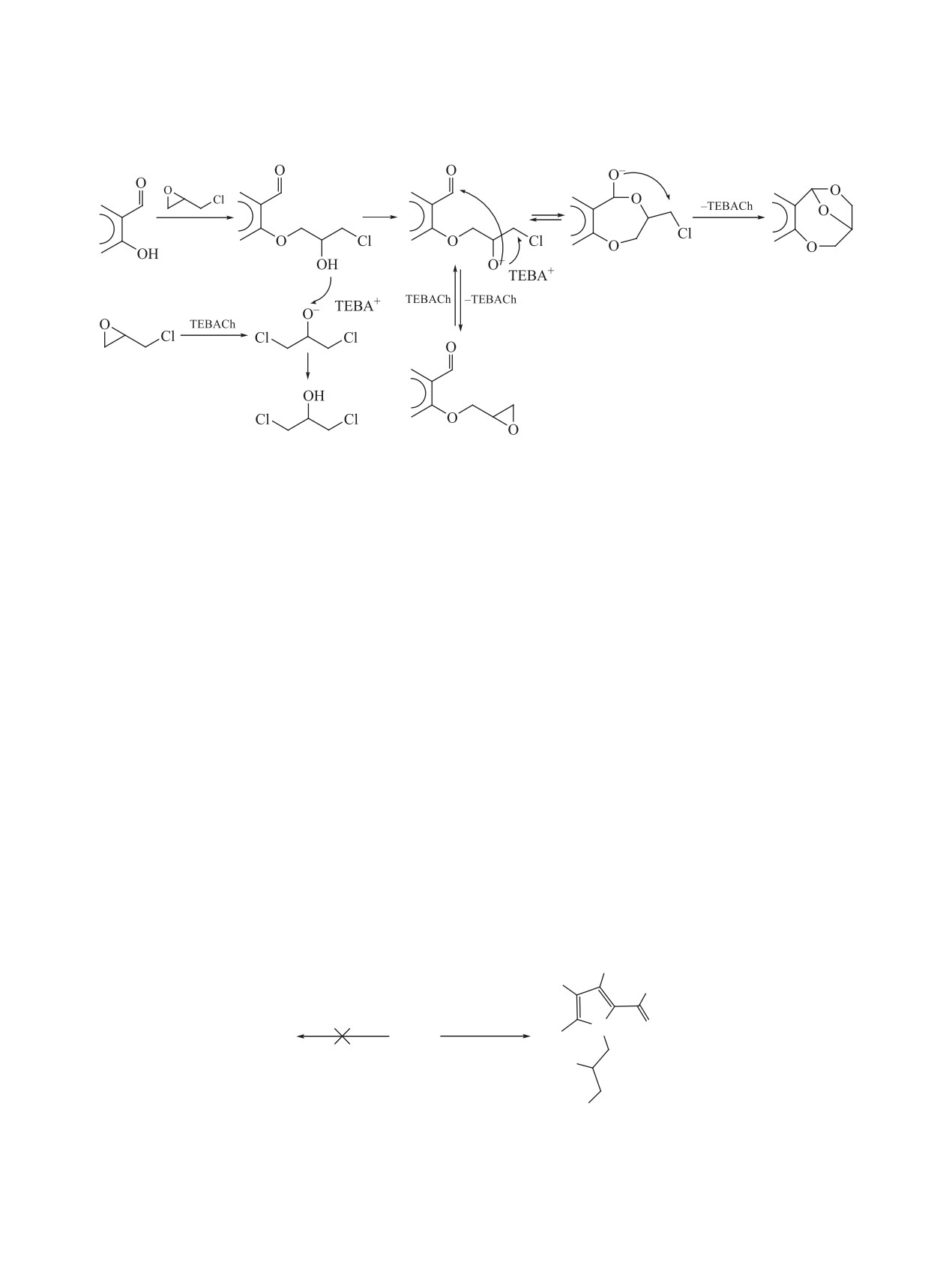
Схема 8.
Me
NH
N
O
7a
8c
Me
N OH
H2O
H2O
H3PO4
Me
H3PO4
N N
H
13
Me
Me
Ph
Me
N
O
N
O
N
O
HO
N
N OH
OH
HO OH
Me
Me
10
11
12
по реакции Струкова были получены
9-[3-
оксазепины 2, 4, и 7a, b не реагируют с фенолами,
(3,5-диметил-1H-пиразол-1-ил)-2-гидроксипро-
первичными и вторичными аминами, спиртами и
пил]-2,3,4,9-тетрагидро-1H-карбазол-1-он
(12) и
NH-гетероциклами, как это свойственно оксира-
9-(2-гидрокси-3-пипередин-1-илпропил)-2,3,-
нам 2a, 5, 8a, b, c. При кипячении оксазепина 7b в
4,9-тетрагидро-1H-карбазол-1-он (13). Кипячение
гидразингидрате реакция идет не по оксазепиномо-
соединения 8c с водой в условиях кислотного ка-
ву циклу, а по карбоксильной группе с образовани-
ем 2-(1-фенил-4,5-дигидро-1H,3H-1,4-эпокси[1,4]-
тализа фосфорной кислотой в диоксане приводит
оксазепино[4,3-a]индол-11-ил)ацетоксигидразида
к раскрытию оксиранового цикла с образованием
(14) (схема 9). Отметим, что при кипячении с из-
9-(2,3-дигидропропил)-2,3,4,9-тетрагидро-1H-кар-
бытком гидразингидрата в метаноле оксазепин 7b
базол-1-она (11). В аналогичных условиях мо-
не реагирует.
жет быть получен [1-(2,3-дигидропропил)-3-ме-
тил-1H-индол-2-ил](фенил)метанон (10) из соеди-
Предполагалось, что в кислой водной среде
нения 7a. Это дает основание рассматривать окса-
произойдет раскрытие оксазепинового цикла со-
зепин 7a как скрытую форму оксирана 8a. Однако
единения 14 с образованием индола 15, которое
Схема 9.
NH2
HN
O
NH2
HN
O
NH
O
Ph
+
N
N2H4
H2O, H+
H
7b
Ph
-H2O
N
Ph
N
O
N
O
O
OH
HO
OH
OH
14
15
16
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
1490
ХАРАНЕКО и др.
можно рассматривать как потенциальное 1,5-ди-
128.8 (CH), 133.8, 134.6, 141.7, 150.1. Найдено,
карбонильное соединение и которое по аналогии
%: С 73.36; Н 5.10; N 10.05. O 11.49. С17Н14N2O2.
с данными [5] в дальнейшем даст производное
Вычислено, %: С 73.37; Н 5.07; N 10.07; O 11.50.
диазепинона
16,
10-(2,3-дигидроксипропил)-1-
М 278.31.
фенил-5,10-дигидро[1,2]диазепино[4,5-b]индол-
7,8,9-Триметил-1-фенил-4,5-дигидро-1H,3H-
4(3H)-он. Однако выделенная из реакционной си-
1,4-эпоксипропилпирроло[2,1-c][1,4]оксазепин
стемы некристаллизующаяся смола жёлтого цвета
(4). К остатку после удаления ЭХГ добавили 70 мл
по ЯМР 1H спектрам не соответствовала продукту
гептана, нагрели при перемешивании до кипения
16 и, возможно, является продуктом димериза-
и добавили 6 г силикогеля. Смесь перемешивали
ции.
при кипении 10 мин и горячей перенесли в пря-
Таким образом, рассмотренный в работе метод
моточный сокслет. После получасовой экстракции
эпоксиметилирования является важным инстру-
гептан на 50% удалили, а колбу охладили до ком-
ментом в синтезе не только производных 1,4-эпок-
натной температуры. Выпавший осадок отфиль-
си[1,4]оксазепинового ряда, но и гетероцикличе-
тровали и промыли гептаном. Выход 10%, бес-
ских соединений с эпоксиметильной группой - ис-
цветные кристаллы, т.пл. 131-132°С. Спектр ЯМР
ходных реагентов в синтезе потенциально биоло-
1H, δ, м.д.: 1.04 с (3H, CH3), 1.76 с (3H, CH3), 2.07 с
гически активных соединений.
(3H, CH3), 3.78 д (1H, CH2, J 12.0 Гц), 3.87 д.д (1H,
CH2, J 7.6, 1.2 Гц), 4.04-4.16 м (2H, CH2), 4.94-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
), 7.55-7.65 м
5.03 м (1H, CH), 7.31-7.41 м (3Hаром
Спектры ЯМР 1Н и 13С записаны на приборе
(2Hаром). Спектр ЯМР 13C, δ, м.д.: 8.7 (CH3), 8.8
Bruker AvanceII (400 и 100 МГц, соответствен-
(CH3), 8.9 (CH3), 47.2 (CH2), 66.7 (CH2), 71.1 (CH),
но) в ДМСО-d6, внутренний стандарт ТМС.
103.9, 111.7, 112.6, 122.1, 126.3 (CH), 128.2 (2CH),
Температуры плавления синтезированных сое-
128.6 (2CH), 129.3, 137.6. Найдено, %: С 75.79; Н
динений определены на нагревательном приборе
7.15; N 5.18; O 11.88. С17Н19NO2. Вычислено, %: С
типа Boetius и не подвергались коррекции.
75.81; Н 7.11; N 5.20; O 11.88. М 269.35.
Получение оксазепинов 2, 4, 7a, b. Смесь
Фенил[3,4,5-триметил-1-(оксиран-2-илме-
25 ммоль бензоилпроизводного 1, 3, 6a, 6b или
тил)-1H-пиррол-2-ил]метанон (5). Сокслетный
6c, 250 ммоль ЭХГ, 2.8 г K2CO3, 50 ммоль KOH и
патрон после экстракции 4 высушили от гептана
5 мол % 18-краун-6 интенсивно перемешивали
и содержимое экстрагировали метанолом. Затем
при 40°С для 1 - 2 ч, для 3 - 6 ч и для 6a, b, c -
метанол почти полностью удалили и оставшийся
4 ч. Неорганический осадок отфильтровали, про-
продукт оставили на ночь. К закристаллизовав-
мыли 10 мл ЭХГ. Затем ЭХГ из маточного раствора
шейся массе добавили немного охлаждённого до
отогнали сначала в токе водоструйного насоса, а
0°С метанола и быстро отфильтровали. Осадок
затем в глубоком вакууме.
промыли небольшим количеством холодного ме-
1-Фенил-4,5-дигидро-1H,3H-1,4-эпокси[1,4]-
танола. Выход 52%, коричневатые кристаллы, т.пл.
оксазепино[4,3-a]бензимидазол (2). Остаток по-
115-117°С. Спектр ЯМР 1H, δ, м.д.: 1.56 с (3H,
сле отгонки ЭХГ перекристаллизовали из пропа-
CH3), 1.89 с (3H, CH3), 2.26 с (3H, CH3), 3.29-3.37
нола-2. Выход 63%, бесцветные кристаллы, т.пл.
м (2H, CH2O), 3.61-3.70 м (1H, CH), 4.05 д.д (1H,
149-150°С. Спектр ЯМР 1H, δ, м.д.: 4.12 д.д (1H,
CH2N, J 14.4, 8.4 Гц), 4.29 д.д (1H, CH2N, J 14.4,
CH2O, J 8.0, 1.6 Гц), 4.28 т (1H, CH2O, J 6.4 Гц),
3.6 Гц), 7.43 т (2Hаром, J 7.2 Гц), 7.51 т (1Hаром, J
4.33 д (1H, CH2N, J 12.0 Гц), 4.53 д.д (1H, CH2N, J
7.2 Гц), 7.60 д (2Hаром, J 7.2 Гц). Спектр ЯМР
12.0, 3.2 Гц), 5.33-5.41 м (1H, CH), 7.20 т (1Hаром,
13C, δ, м.д.: 9.0 (CH3), 10.3 (CH3), 12.0 (CH3), 47.5
J 7.2 Гц), 7.27 т (1Hаром, J 7.2 Гц), 7.41-7.51 м
(CH2), 69.8 (CH2), 72.0 (CH), 115.5, 127.0, 127.6,
(4Hаром), 7.55 д (1Hаром, J 8.0 Гц), 7.71-7.81 м
127.8 (2CH), 128.6 (2CH), 130.8 (CH), 135.0, 141.3,
(2Hаром). Спектр ЯМР 13C, δ, м.д.: 47.5 (CH2), 67.9
186.1 (CO). Найдено, %: С 75.78; Н 7.14; N 5.18; O
(CH2), 71.7 (CH), 103.4, 109.6 (CH), 119.6 (CH),
11.90. С17Н19NO2. Вычислено, %: С 75.81; Н 7.11;
121.7 (CH), 122.6 (CH), 126.9 (2CH), 127.3 (2CH),
N 5.20; O 11.88. М 269.35.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
ОСОБЕННОСТИ ЭПОКСИМЕТИЛИРОВАНИЯ 2-КАРБОНИЛЗАМЕЩЁННЫХ NH-ГЕТЕРОЦИКЛОВ 1491
11-Метил-1-фенил-4,5-дигидро-1H,3H-1,4-
Этил [2-бензоил-1-(оксиран-2-илметил)-1H-
эпокси[1,4]оксазепино[4,3-a]индол (7a). К остат-
индол-3-ил]ацетат (8b). Маточный раствор после
ку после удаления ЭХГ добавили 10 мл пропа-
выделения 7b упарили и оставили на несколько
нола-2, нагрели до кипения и оставили на ночь.
суток открытым. Исходная смола постепенно за-
Выпавшие кристаллы отфильтровали и промыли
кристаллизовалась. К сожалению, 8b содержал
пропанолом-2. Выход 49%, бесцветные кристал-
~ 20% 7b. Подобрать подходящий растворитель для
лы, т.пл. 150-151°С. Спектр ЯМР 1H, δ, м.д.: 1.42 с
разделения нам не удалось и спектры 8b получены
(3H, CH3), 4.03 д.д (1H, CH2O, J 7.6, 1.6 Гц), 4.19 д
методом вычитания. Спектр ЯМР 1H, δ, м.д.: 1.12
(1H, CH2N, J 11.6 Гц), 4.23 д (1H, CH2O, J 6.8 Гц),
т (3H, CH3, J 6.8 Гц), 2.30 т (1H, CH2O, J 2.4 Гц),
4.37 д.д (1H, CH2N, J 11.6, 3.6 Гц), 5.19-5.23 м (1H,
2.65 т (1H, CH2O, J 4.0), 3.22-3.29 м (1H, CH), 3.47
CH), 7.00 т (1Hаром, J 7.2 Гц), 7.15 т (1Hаром, J
с (2H, CH2), 3.95 к (2H, CH2, J 6.8 Гц), 4.38 д.д (1H,
7.6 Гц), 7.28 д (1Hаром, J 8.4 Гц), 7.36 д (1H, J 7.6 Гц),
CH2N, J 15.2, 4.8 Гц), 4.77 д.д (1H, CH2N, J 15.6,
7.40-7.48 м (3Hаром), 7.63-7.71 м (2Hаром). Спектр
2.8 Гц), 7.14 т (1Hаром, J 7.6 Гц), 7.35 т (1Hаром, J
ЯМР 13C, δ, м.д.: 8.1 (CH3), 47.0 (CH2), 67.3 (CH2),
7.6 Гц), 7.51 т (2Hаром, J 7.6 Гц), 7.55-7.66 м
71.4 (CH), 103.9, 105.0, 108.5 (CH), 118.6 (CH),
(3Hаром), 7.78 д (2Hаром, J 8.0 Гц). Спектр ЯМР
118.8 (CH), 121.8 (CH), 127.7 (4CH), 128.0, 128.7
13C, δ, м.д.: 13.8 (CH3), 30.5 (CH2), 44.4 (CH2), 44.9
(CH), 132.2, 134.8, 137.0. Найдено, %: С 78.30; Н
(CH2), 50.7 (CH), 60.0 (CH2), 110.8 (CH), 113.8,
5.92; N 4.80; O 10.98. С19Н17NO2. Вычислено, %: С
120.2 (CH), 124.9 (CH), 126.3 (CH), 127.7, 127.3
78.33; Н 5.88; N 4.81; O 10.98. М 291.35.
(2CH), 128.4, 129.1 (2CH), 132.6 (CH), 138.0, 138.9,
169.6 (C=O), 188.9 (C=O).
Этил
(1-фенил-4,5-дигидро-1H,3H-1,4-эпок-
си[1,4]оксазепино[4,3-a]индол-11-ил)ацетат
6-Метил-9-(оксиран-2-илметил)-2,3,4,9-
тетрагидро-1H-карбазол-1-он
(8c). К остатку
(7b). К остатку после удаления ЭХГ добавили
после удаления ЭХГ добавили 10 мл метанола и
100 мл гептана, нагрели при перемешивании до
нагрели при перемешивании до кипения. Раствор
кипения и добавили 6 г силикогеля. Смесь переме-
оставили на ночь. Выпавшие кристаллы отфиль-
шивали при кипении 10 мин и горячей перенесли
тровали и промыли метанолом. Выход 86%, бес-
в прямоточный сокслет. После трёхчасовой экс-
цветные игольчатые кристаллы, т.пл. 77-78°С.
тракции гептан полностью удалили. Общий выход
Спектр ЯМР 1H, δ, м.д.: 2.18 квинтет (2H, CH2, J
7b и 8b 82%. К остатку добавили 30 мл метанола.
6.4 Гц), 2.43 с (3H, CH3), 2.51-2.60 м (1H, CH2 +
Смесь нагрели до кипения и оставили кристал-
2H, CH2), 2.68 т (1H, CH2, J 6.0 Гц), 2.96 т (2H,
лизоваться. Выпавший осадок отфильтровали и
CH2, J 6.0 Гц), 3.16-3.24 м (1H, CH), 4.42 д.д (1H,
промыли метанолом. Выход 43%, бесцветные кри-
CH2N, J 14.8, 5.2 Гц), 4.88 д.д (1H, CH2N, J 14.8,
сталлы, т.пл. 141-142°С. Спектр ЯМР 1H, δ, м.д.:
3.6 Гц), 7.16 д.д (1Hаром, J 8.4, 1.2 Гц), 7.36 д (1Hаром,
1.15 т (3H, CH3, J 6.8 Гц), 2.67 д (1H, CH2C=O, J
J 8.4 Гц), 7.38 с (1Hаром). Спектр ЯМР 13C, δ, м.д.:
17.2 Гц), 2.98 д (1H, CH2C=O, J 17.2 Гц), 3.86-3.95
21.0 (CH3), 21.2 (CH2), 24.2 (CH2), 39.2 (CH2), 44.5
м (2H, CH2O), 4.09 д.д (1H, CH2N, J 7.6, 1.2 Гц),
(CH2), 45.7 (CH2), 50.7 (CH), 110.7 (CH), 120.0
4.18-4.30 м (2H, CH2), 4.42 д.д (1H, CH2N, J 11.6,
(CH), 1214.5, 128.2 (CH), 128.3,128.7, 129.3, 137.8,
3.2 Гц), 5.21-5.28 м (1H, CH), 7.02 т (1Hаром, J
190 (CO). Найдено, %: С 75.30; Н 6.73; N 5.52; O
8.0 Гц), 7.19 т (1Hаром, J 7.2 Гц), 7.34 д (2Hаром,
12.45. Вычислено, %: С 75.27; Н 6.71; N 5.49; O
J
8.0 Гц),
7.39-7.49 м
(3Hаром),
7.56-7.73 м
12.53 М 255.32.
(2Hаром). Спектр ЯМР 13C, δ, м.д.: 13.9 (CH3),
28.6 (CH2), 47.1 (CH2), 59.4 (CH2), 67.5 (CH2),
[1-(2,3-Дигидроксипропил)-3,4,5-триметил-
71.4 (CH), 102.6, 103.5, 108.8 (CH), 118.8 (CH),
1H-пиррол-2-ил](фенил)метанон
(9).
Смесь
119.2 (CH), 122.0 (CH), 127.5, 127.7 (2CH), 128.8
150 мг (0.56 ммоль) 5 и 100 мг TEBACh кипятили
(CH), 133.8, 134.8, 136.4, 169.9 (C=O). Найдено,
10 ч в 8 мл неабсолютезированного ацетонитрила.
%: С 72.70; Н 5.84; N 3.84; O 17.62. С22Н21NO4.
Ацетонитрил удалили отгонкой и к остатку доба-
Вычислено, %: С 72.71; Н 5.82; N 3.85; O 17.62 М
вили 5 мл воды. Выпавшее масло быстро закри-
363.42.
сталлизовалось. Осадок отфильтровали и промыли
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
1492
ХАРАНЕКО и др.
водой. Продукт чистый и в перекристаллизации не
квинтет (2H, CH2, J 5.6 Гц), 2.42 с (3H, CH3), 2.56
нуждался. Выход 0.147 г (92%). Мелкие бесцвет-
т (2H, CH2, J 6.0 Гц), 2.96 т (2H, CH2, J 5.6 Гц),
ные кристаллы, т.пл. 113-114°С. Спектр ЯМР 1H,
3.28-3.40 м (2H, CH2O), 3.72-3.83 м (1H, CH),
δ, м.д.: 1.55 с (3H, CH3), 1.89 с (3H, CH3), 2.25 с (3H,
4.35 д.д (1H. CH2N, J 14.0, 6.8 Гц), 4.53 д.д (1H,
CH3), 3.26-3.34 м (2H, CH2OH), 3.63 гептет (1H,
CH2N, J 14.0, 5.2 Гц), 7.14 д (1Hаром, J 8.8 Гц), 7.36
CH, J 4.4 Гц), 4.03 д.д (1H, CH2N, J 14.0, 8.4 Гц),
с (1Hаром), 7.43 д (1Hаром, J 8.4 Гц). Спектр ЯМР
4.28 д.д (1H, CH2N, J 14.0, 3.6 Гц), 4.37 т (1H, OH,
13C, δ, м.д.: 21.0 (CH3), 21.3 (CH2), 39.4 (CH2), 47.1
J 5.6 Гц), 4.73 д (1H, OH, J 6.0 Гц), 7.43 т (2Hаром,
(CH2), 63.5 (CH2), 71.4 (CH), 111.2 (CH), 119.7
J 7.2 Гц), 7.51 т (1Hаром, J 7.2 Гц), 7.59 т (2Hаром, J
(CH), 124.3, 127.9 (CH), 128.0, 128.2, 129.7, 138.0,
7.2 Гц). Спектр ЯМР 13C, δ, м.д.: 9.0 (CH3), 10.3
190.4 (CO). Найдено, %: С 70.34; Н 7.04; N 5.09;
(CH3), 12.0 (CH3), 47.4 (CH2), 63.7 (CH2), 71.7
O 17.53. Вычислено, %: С 70.31; Н 7.01; N 5.12; O
(CH), 115.5, 126.9, 127.5, 127.8 (2CH), 128.6 (2CH),
17.56. М 273.33.
130.8 (CH), 135.0, 141.3, 186.1 (CO). Найдено,
9-[3-(3,5-Диметил-1H-пиразол-1-ил)-2-ги-
%: С 71.01; Н 7.42; N 4.82; O 16.75. С17Н19NO2.
дроксипропил]-2,3,4,9-тетрагидро-1H-карба-
Вычислено, %: С 71.06; Н 7.37; N 4.87; O 16.70. М
зол-1-он (12) и 9-(2-гидрокси-3-пипередин-1-ил-
287.36.
пропил)-2,3,4,9-тетрагидро-1H-карбазол-1-он
[1-(2,3-Дигидропропил)-3-метил-1H-индол-
(13). Смесь 1 ммоль 8c и 1.5 ммоль 3,5-диметилпи-
2-ил](фенил)метанона (10). К 0.3 г (1.01 ммоль)
разола или пиперидина кипятили в 2 мл этилцел-
7a добавили 10 мл воды и 2 мл 85% H3PO4. Смесь
лозольва 6 ч. К смеси добавили 8 мл воды и выпав-
кипятили при перемешивании 4 ч, охладили до
шее масло растирали до полной кристаллизации.
Осадок отфильтровали, промыли водой и после
комнатной температуры и нейтрализовали водным
высушивания перекристаллизовали из метанола.
раствором аммиака до рН ≈ 7. Водный раствор от-
декантировали от вязкого жёлтого масла. Масло
Выход 12 - 91%, бесцветные кристаллы, т.пл.
промыли водой и высушили при 110°С. Выход
139-140°С. Спектр ЯМР 1H, δ, м.д.: 2.08 с (3H,
0.30 г (94%). Жёлтая маслянистая вязкая масса.
CH3), 2.19 т (2H, CH2, J 6.0 Гц), 2.21 с (3H, CH3),
Спектр ЯМР 1H, δ, м.д.: 2.02 с (3H, CH3), 3.27-3.36
2.43 с (3H, CH3), 2.57 т (2H, CH2, J 5.6 Гц), 2.97 т
м (2H, CH2O), 3.65-3.75 м (1H, CH), 4.32 д.д (1H,
(2H, CH2, J 6.0 Гц), 3.84 д.д (1H, CH2NN, J 14.0,
CH2N, J 14.8, 8.0 Гц), 4.48 д.д (1H, CH2N, J 14.4,
4.0 Гц), 3.92 д.д (1H, CH2NN, J 14.0, 7.6 Гц), 4.08-
3.6 Гц), 7.10 т (1Hаром, J 7.2 Гц), 7.31 т (1Hаром, J
4.21 м (1H, CH), 4.37 д.д (1H, CH2N, J 14.0, 7.2 Гц),
7.2 Гц), 7.48-7.59 м (4Hаром), 7.62 т (1Hаром, J
4.59 д.д (1H, CH2N, J 14.0, 5.6 Гц), 4.96 уш.с (1H,
7.2 Гц), 7.83 д (2Hаром, J 7.6 Гц). Спектр ЯМР 13C, δ,
OH), 5.68 с (1H, CH), 7.15 д.д (1Hаром, J 8.8, 1.2 Гц),
м.д.: 10.6 (CH3), 46.4 (CH2), 63.6 (CH2), 70.9 (CH),
7.35 д (1Hаром, J 8.4 Гц), 7.37 с (1Hаром). Спектр
110.9 (CH), 116.5, 119.3 (CH), 119.9 (CH), 124.4
ЯМР 13C, δ, м.д.: 10.8 (CH3), 13.2 (CH3), 21.0 (CH3),
(CH), 127.0, 128.2 (2CH), 129.4 (2CH), 132.3 (CH),
21.3 (CH2), 24.3 (CH2), 39.4 (CH2), 48.1 (CH2), 51.7
133.8, 139.5, 189.7 (CO). Найдено, %: С 73.81; Н
(CH2), 70.0 (CH), 104.1 (CH), 111.0 (CH), 119.9
6.21; N 4.50; O 15.48. Вычислено, %: С 73.77; Н
(CH), 124.4, 128.1 (CH), 128.2, 128.4, 129.5, 137.9,
6.19; N 4.53; O 15.51 М 309.37.
139.1, 145.5, 190.4 (CO). Найдено, %: С 71.79; Н
7.20; N 12.00; O 9.01. Вычислено, %: С 71.77; Н
9-(2,3-Дигидропропил)-2,3,4,9-тетрагидро-
7.17; N 11.96; O 9.10. М 351.45.
1H-карбазол-1-он (11). Смесь 1г (3.9 ммоль) 8c,
5 мл 1,4-диоксана, 0.2 мл воды и 0.2 мл H3PO4
Выход 13 - 88%, бесцветные кристаллы, т.пл.
кипятили 2 ч. Охладили до комнатной темпера-
109-110°С. Спектр ЯМР 1H, δ, м.д.: 1.40 квин-
туры и добавили 15 мл воды. Выпавшее подвиж-
тет (2H, CH2, J 5.2 Гц), 1.53 квинтет (4H, 2CH2,
ное масло при растирании закристаллизовалось.
J 5.2 Гц), 2.18 квинтет (2H, CH2, J 6.0 Гц), 2.29 д
Осадок отфильтровали и промыли водой. Выход
(2H, CH2, J 6.0 Гц), 2.35-2.45 м (4H, 2CH2), 2.42
1 г (94%), бесцветные пушистые кристаллы, т.пл.
с (3H, CH3), 2.55 т (2H, CH2, J 6.0 Гц), 2.96 т (2H,
117-118°С. Продукт чистый и в перекристалли-
CH2, J 5.6 Гц), 3.86-3.98 м (1H, CH), 4.23 д.д (1H,
зации не нуждался. Спектр ЯМР 1H, δ, м.д.: 2.18
CH2, J 14.0, 7.6 Гц), 4.62 д.д (1H, CH2, J 14.0,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
ОСОБЕННОСТИ ЭПОКСИМЕТИЛИРОВАНИЯ 2-КАРБОНИЛЗАМЕЩЁННЫХ NH-ГЕТЕРОЦИКЛОВ 1493
4.4 Гц), 7.12 д.д (1Hаром, J 8.8, 1.2 Гц), 7.35 с
127.5, 127.6 (2CH), 128.9 (CH), 133.9, 134.9, 136.3,
(1Hаром), 7.41 д (1Hаром, J 8.8 Гц). Спектр ЯМР
169.0 (CO). Найдено, %: С 68.72; Н 5.51; N 12.06;
13C, δ, м.д.: 21.0 (CH3), 21.3 (CH2), 23.9 (CH2), 24.3
O 13.71. Вычислено, %: С 68.75; Н 5.48; N 12.03; O
(CH2), 25.5 (2CH2), 48.9 (CH2), 54.5 (2CH2), 62.6
13.74. М 349.39.
(CH2), 67.5 (CH), 111.3 (CH), 119.7 (CH), 127.7 (CH),
КОНФЛИКТ ИНТЕРЕСОВ
127.8, 128.1, 129.7, 138.2, 190.3 (CO). Найдено, %:
С 74.05; Н 8.31; N 8.26; O 9.38. Вычислено, %: С
Авторы заявляют об отсутствии конфликта ин-
74.08; Н 8.29; N 8.23; O 9.40. М 340.47.
тересов.
2-(1-Фенил-4,5-дигидро-1H,3H-1,4-эпокси-
СПИСОК ЛИТЕРАТУРЫ
[1,4]оксазепино[4,3-a]индол-11-ил)ацетокси-
1. Fauran C.P., Eberle J.A., Turin M.J., Raynaud G.M.,
гидразид (14). Смешали 2 г (5.49 ммоль) 7b и
Gouret C.J., Meudon. Пат. 3951968 (1974). США.
8 мл (160 ммоль) гидразингидрата. Кипятили
C.A. 1976.
при перемешивании 1 ч. Суспензию охладили до
2. Angelini T., Fringuelli F., Lanari D., Pizzo F., Vaccaro L.
комнатной температуры и разбавили 15 мл воды.
Tetrahedron Lett. 2010, 51, 1566-1569. doi 10.1016/
Выпавший осадок отфильтровали и промыли во-
j.tetlet.2010.01.055
дой. После перекристаллизации из 7 мл мета-
3. Janeliunas D., Daskeviciene M., Malinauskas T.,
нола, выход 1.7 г (88%), бесцветные кристаллы,
Getautis V. Tetrahedron. 2009, 65, 8407-8411. doi
т.пл. 118-119°С. Спектр ЯМР 1H, δ, м.д.: 2.42 д
10.1016/j.tet.2009.07.093
[1H, CH2C(O)NH, J 16.4 Гц], 2.77 д [1H, CH2C(O)
4. MacMillan K.S., Naidoo J., Liang J., Melito L.,
NH, J 16.4 Гц], 4.04-4.15 м (1H, CH2), 4.16-4.29
Williams N.S., Morlock L., Huntington P.J., Estill S.J.,
м (2H, CH2), 4.34-4.48 м (1H, CH2), 5.15-5.30 м
Longgood J., Becker G.L., McKnight S.L., Pieper A.A.,
(1H, CH2), 7.02 т (1Hаром, J 7.2 Гц), 7.18 т (1Hаром,
De Brabander J.K., Ready J.M. J. Am. Chem. Soc.
J 7.2 Гц), 7.32 д (1Hаром, J 8.0 Гц), 7.38 д (1Hаром, J
2011, 133, 1428-1437. doi 10.1021/ja108211m
7.6 Гц), 7.40-7.51 м (3Hаром), 7.55-7.83 м (2Hаром),
5. Харанеко А.О., Пехтерева Т.М., Харанеко О.И.
8.04 уш.с (1H, NH). Спектр ЯМР 13C, δ, м.д.: 28.9
ЖОрХ.
2020,
56,
118-128.
[Kharaneko A.O.,
(CH2), 47.0 (CH2), 67.5 (CH2), 71.4 (CH), 103.4,
Pekhtereva T.M., Kharaneko O.I. Russ. J. Org. Chem.
103.7, 108.7 (CH), 119.1 (2CH), 122.0 (CH), 126.6,
2020, 56, 95-104.] doi 10.1134/S1070428020010169
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
1494
ХАРАНЕКО и др.
Features of Epoxymetilation of 2-Carbonyl Substituted
NH-Heterocycles. Epoxymetilation Products Properties
A. O. Kharaneko*, T. M. Pekhtereva and O. I. Kharaneko
Litvinenko Institute of Physical Organic and Coal Chemistry, 83114, Ukraine, Donetsk, ul. R. Luxemburg 70
*e-mail: antonhar08@rambler.ru
Received July 13, 2020; revised July 26, 2020; accepted July 28, 2020
A method for the synthesis of previously unknown pyrrolo- and indolo-1,4-epoxy[1,4]oxazepines based on the
epoxymethylation of 2-benzoylpyrrole and 2-benzoylindole is proposed. The ways of possible transformations
of epoxymethylation products were studied.
Keywords: epoxymethylation, 1-phenyl-4,5-dihydro-1H,3H-1,4-epoxy[1,4 oxazepino[4,3-a]benzimidazole,
7,8,9-trimethyl-1-phenyl-4,5-dihydro-1H, 3H-1,4-epoxypropylpyrrole[2,1-c][1,4]oxazepine, phenyl[3,4,5-
trimethyl-1-(oxiran-2-ylmethyl)-1H-pyrrol-2-yl]methanone, 11-methyl-1-phenyl-4,5-dihydro-1H,3H-1,4-
epoxy[1,4]oxazepino[4,3-a]indole, 6-methyl-9-(oxiran-2-ylmethyl)-2,3,4,9-tetrahydro-1H-carbazol-1-one,
9-(2-hydroxy-3-piperedin-1-ylpropyl)-2,3,4,9-tetrahydro-1H-carbazol-1-one
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020