ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 10, с. 1509-1515
УДК 547.1′:544.43
КВАНТОВО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ
ПРИСОЕДИНЕНИЯ ВТОРИЧНЫХ
ФОСФИНХАЛЬКОГЕНИДОВ К ВИНИЛСЕЛЕНИДАМ
© 2020 г. Я. А. Верещагинаa, *, Р. Р. Исмагиловаa, Д. В. Чачковb, Н. А. Чернышеваc
a ФГАОУ ВО «Казанский (Приволжский) федеральный университет»,
420008, Россия, Республика Татарстан, г. Казань, ул. Кремлевская 18
*e-mail: yavereshchagina@yahoo.com
b Казанское отделение Межведомственного суперкомпьютерного центра РАН,
филиал ФГУ «Федеральный научный центр «Научно-исследовательский институт системных исследований РАН»,
420111, Россия, Республика Татарстан, г. Казань, ул. Лобачевского 2/31
c ФГБУН «Иркутский институт химии им. А.Е. Фаворского СО РАН»,
664033, Россия, г. Иркутск, ул. Фаворского 1
Поступила в редакцию 02 июня 2020 г.
После доработки 11 июня 2020 г.
Принята к публикации 22 июня 2020 г.
Согласно расчетам методом DFT B3PW91/6-31G(d), реакции присоединения вторичных фосфинсульфи-
дов и фосфинселенидов с алкильными, фенильными и фенилалкильными заместителями к винилпен-
тил- и винилгексилселенидам протекают против правила Марковникова по молекулярному механизму
через энергетически выгодное восьмичленное переходное состояние, приводя к образованию третичных
фосфинхалькогенидов. Вторичные фосфинселениды более реакционноспособны по сравнению с соот-
ветствующими фосфинсульфидами.
Ключевые слова: фосфинсульфиды, фосфинселениды, гидрофосфинилирование, винилселениды,
механизмы реакций, DFT расчеты.
DOI: 10.31857/S0514749220100043
Интерес к третичным фосфинхалькогенидам
нидами без участия катализаторов, инициаторов и
обусловлен их применением в качестве перспек-
растворителей [10].
тивных лигандов для металлокомплексных ката-
Например, атом-экономный зеленый синтез
лизаторов, предшественников фармацевтических
третичных фосфинсульфидов и фосфинселени-
соединений, кроме того, они могут быть исполь-
дов был разработан на основе присоединения вто-
зованы для получения селенсодержащих нано-
ричных фосфинсульфидов и фосфинселенидов
частиц [1-9].
к широкому ряду алкенов (гептен, циклогексен,
Прямое присоединение фрагментов P-H к
стиролы, аллиловый спирт, виниловые эфиры, ви-
непредельным соединениям в присутствии осно-
нилсульфиды, винилселениды, триметил(винил)-
вания и металлического катализатора или ради-
силан, винилимидазол, винилацетат) без участия
кального инициатора в различных органических
катализаторов и растворителей [11, 12]. Реакции
растворителях является традиционным методом
протекают при 80-82°C в течение 4-44 ч, приводя
образования связи C-P. В последние годы возникла
к хемо- и региоселективному образованию соот-
и получила развитие новая эффективная версия
ветствующих аддуктов против правила Мар-
гидрофосфинирования и гидрофосфинилирования
ковникова с хорошим или количественным выхо-
кратных связей C-C фосфинами и их халькоге-
дом [11, 12], причем наиболее реакционно способ-
1509
1510
ВЕРЕЩАГИНА и др.
ными оказался дифенилфосфинсульфид, вероятно
параметры молекул. Соответствие найденных
вследствие низкой энергии разрыва связи P-H [11].
структур минимумам энергии доказывалось
всеми положительными собственными значе-
Было сделано предположение, что такое при-
ниями матрицы Гессе (для устойчивых молекул
соединение происходит по молекулярному ме-
и интермедиатов) и наличием одного отрица-
ханизму через шести- или четырехчленное пере-
тельного собственного значения матрицы Гессе
ходное состояние - с согласованным переносом
в случае переходных состояний. Квантово-хи-
электронных пар (или одного электрона) без пред-
мические расчеты выполнены с использованием
варительного образования ионов или радикалов
программы Gaussian 09 [15]. Полученные резу-
[12]. Движущими силами процесса, вероятно,
льтаты были сопоставлены с имеющимися экспе-
являются способность атома фосфора расширять
риментальными данными: третичные фосфинха-
свою координационную сферу, с одной стороны, и
лькогениды образуются против правила Марковни-
поляризуемость алкенов и алкинов, с другой сто-
кова, хемо- и региоселективно в отсутствии ката-
роны. В таких динамических реакционноспособ-
лизаторов и растворителей [12]. Механизм реак-
ных комплексах (промежуточных или переходных
ций присоединения диметилфосфинсульфида 1,
состояниях) фосфорсодержащий фрагмент может
дифенилфосфинсульфида 2, дифенилэтилфосфин-
играть роль организационного центра в степени,
сульфида 3, диметилфосфинселенида 4, дифенил-
сходной с катализом металлами. Другое предпо-
фосфинселенида 5, дифенилэтилфосфинселенида
ложение связано с не катализируемым присоеди-
6 к винилпентилселениду 7 и винилгексилселениду
нением вторичных фосфинхалькогенидов к ви-
8 по данным квантово-химических расчетов пред-
нилселенидам по молекулярному механизму через
ставлен на схеме 1.
пятичленное переходное состояние, за которым
следует согласованная перегруппировка связей без
Прежде всего, был проведен теоретический
предварительного образования ионов или радика-
конформационный анализ исходных соединений
лов. Движущей силой этого пути может являться
и продуктов реакции, найдены наиболее энер-
частичный положительный заряд на атоме четы-
гетически предпочтительные формы для всех
рехкоординированного фосфора и поляризуемость
структур. Исходными реагентами реакций при-
двойной связи, что обеспечивает частичный отри-
соединения являются вторичные фосфинсульфиды
цательный заряд на β-углероде винильной группы.
и селениды с алкильными, фенильными и
С целью выяснения и теоретического обосно-
фенилалкильными заместителями, существующие
вания механизма присоединения вторичных
в растворе в виде двух таутомерных форм -
фосфинсульфидов 1-3 и фосфинселенидов 4-6
соединений четырехкоординированного 1a-6a и
к алкилвинилселенидам
7,
8 мы исследовали
трехкоординированного
1b-6b атома фосфора.
эти реакции методом DFT с использованием
По результатам теоретических расчетов было
гибридного функционала B3PW91 и базисного
установлено, что предпочтительными таутомерами
набора
6-31G(d), успешно применявшихся в
являются вторичные фосфинхалькогениды с
исследованиях реакций ранее, например [13], а
двойной связью Р=Х (табл. 1), что согласуется с
также основываясь на данных работы [14]. Во
немногочисленными данными по таутомеризации
всех случаях оптимизировали все геометрические
фосфинхалькогенидов со связями P=S и P=Se
Схема 1.
R2
Se
R1
R1
X
R1
X
7-8
P
P
P
XH
2
R
R1
R1
H
Se
R1
1a-6a
1b-6b
9-20
X = S, R1 = Me (1), Ph (2), Ph(CH2)2 (3); X = Se, R1 = Me (4), Ph (5), Ph(CH2)2 (6);
R2 = n-Pent (7), n-Hex (8).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
КВАНТОВО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ ПРИСОЕДИНЕНИЯ
1511
Таблица 1. Энергетические характеристики (кДж/моль) таутомеризации соединений 1-6.
№
Энергия димеризации ΔЕдимер
Энергия активации ΔЕ#
Разность энергий таутомеров ΔЕP=X /P -XH
1
-15.1
64.0
9.7
2
-14.1
76.4
17.3
3
-10.3
85.8
21.4
4
-49.9
45.7
8.2
5
-47.0
34.4
3.9
6
-8.2
30.9
4.9
[16]. Образование некоторого количества халько-
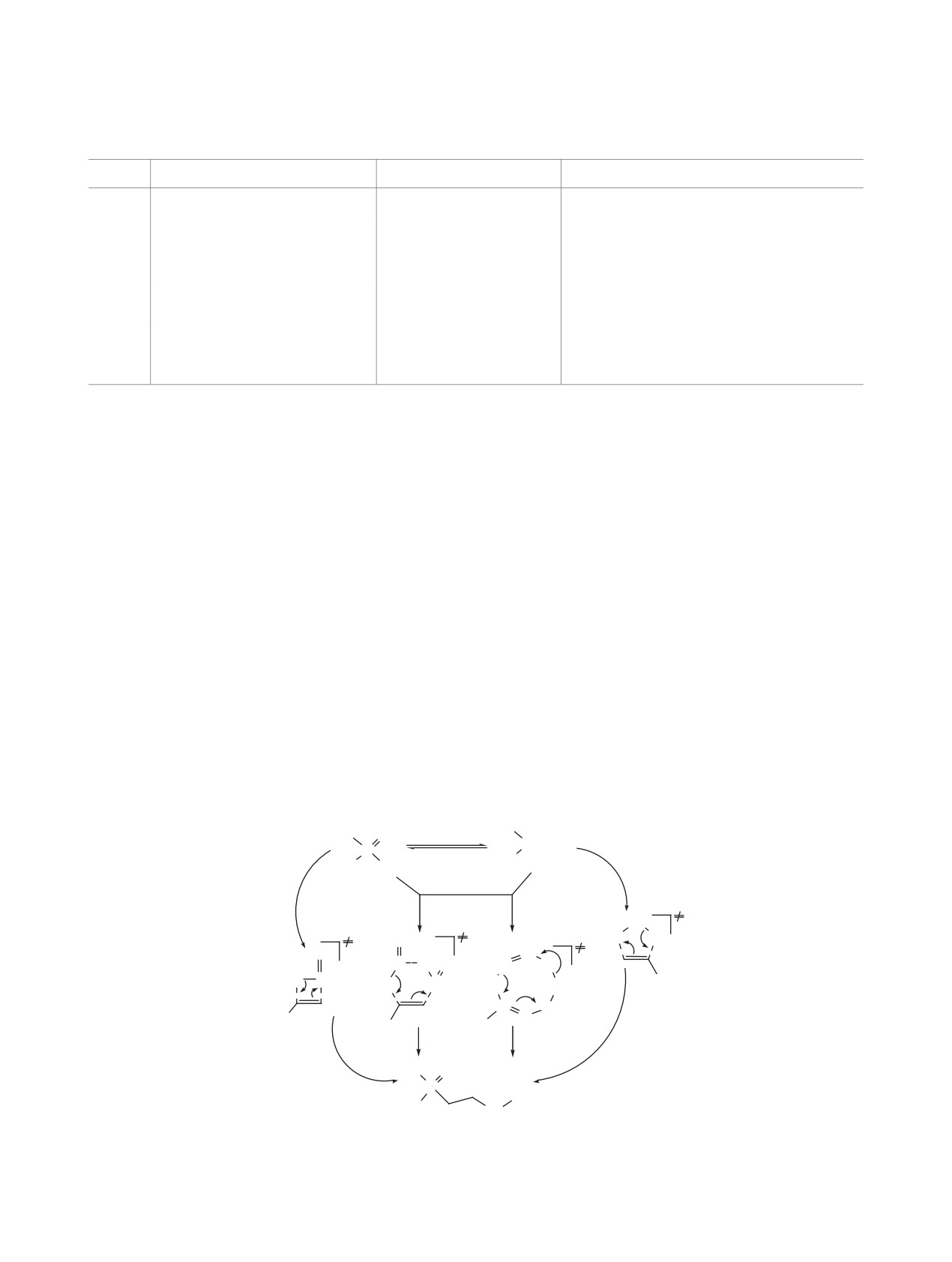
Для более точного установления механизма ре-
генфосфинистых кислот R12P-XH происходит в
акций присоединения было рассмотрено несколько
результате димеризации.
возможных путей их протекания (A-D на схеме 2).
Исследование механизма взаимодействия ка-
Первоначально для ускорения времени рас-
ждой из таутомерных форм с винилселенидами
четов в качестве моделей были взяты таутомеры
показало, что с наименьшими энергетическими
4a Me2P(Se)H, 4b Me2P-SeH и этен CH2=CH2.
затратами протекают реакции с участием Р-ХН
Согласно теоретическим расчетам (табл. 2), наи-
более энергетически предпочтительным является
форм. Так, в случае взаимодействия диметилфос-
финселенида 4a с винилметилселенидом для че-
путь D. Энергия пятичленного переходного со-
стояния, получаемого на данном пути, в 6.5 раз
тырехчленного переходного состояния ΔЕ# равна
ниже энергетического барьера пути А, и в 4 раза -
286 кДж/моль, тогда как аналогичная реакция ги-
энергетического барьера пути В. Путь C также
дроселенодиметилфосфина Me2P-SeH 4b проте-
является теоретическим возможным, посколь-
кает через пятичленное переходное состояние с
ку в этом случае энергетический барьер лишь на
ΔЕ# равной 46.6 кДж/моль. Небольшое количество
20 кДж/моль выше по сравнению с путем D.
таутомера гидроселенодиорганофосфина необхо-
димо для протекания реакции, он участвует в ре-
На следующем этапе было исследовано взаимо-
акции в качестве катализатора и не расходуется.
действие фенил- и фенилэтилзамещенных фосфи-
Схема 2.
1
R1
R
X
P XH
P
R1
2
R1
H
CH2=CHSeR
B
C
D
1-6
CH2=CHSeR2
A
CH2=CHSeR2
X
1
X
R2P H
X
1
X1
2
R12 P
H
X
R12 P
H
1
H
PR12
SeR2
H
PR12
H
X2
1
1
C
P R
R2Se
C
2
2
2
R2Se
R2Se
R2 = n-Pent, n-Hex.
X = S, Se;
R1
X
R1 = Me, Ph, Ph(CH2)2.
P
R2
R1
Se
9-20
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
1512
ВЕРЕЩАГИНА и др.
Таблица 2. Возможные переходные состояния реакции фосфинселенида 4 с этеном.
Путь
Реагенты
ПС
ΔЕ#, кДж/моль
Se
Me
Se
А
P
+
321
H
PMe2
Me H
Me
Se
Me
Se
B
P
+
P
+
195
Me H
Me H
Me
Se
Me
C
P
+
P
SeH
+
69.1
Me H
Me
D
49.3
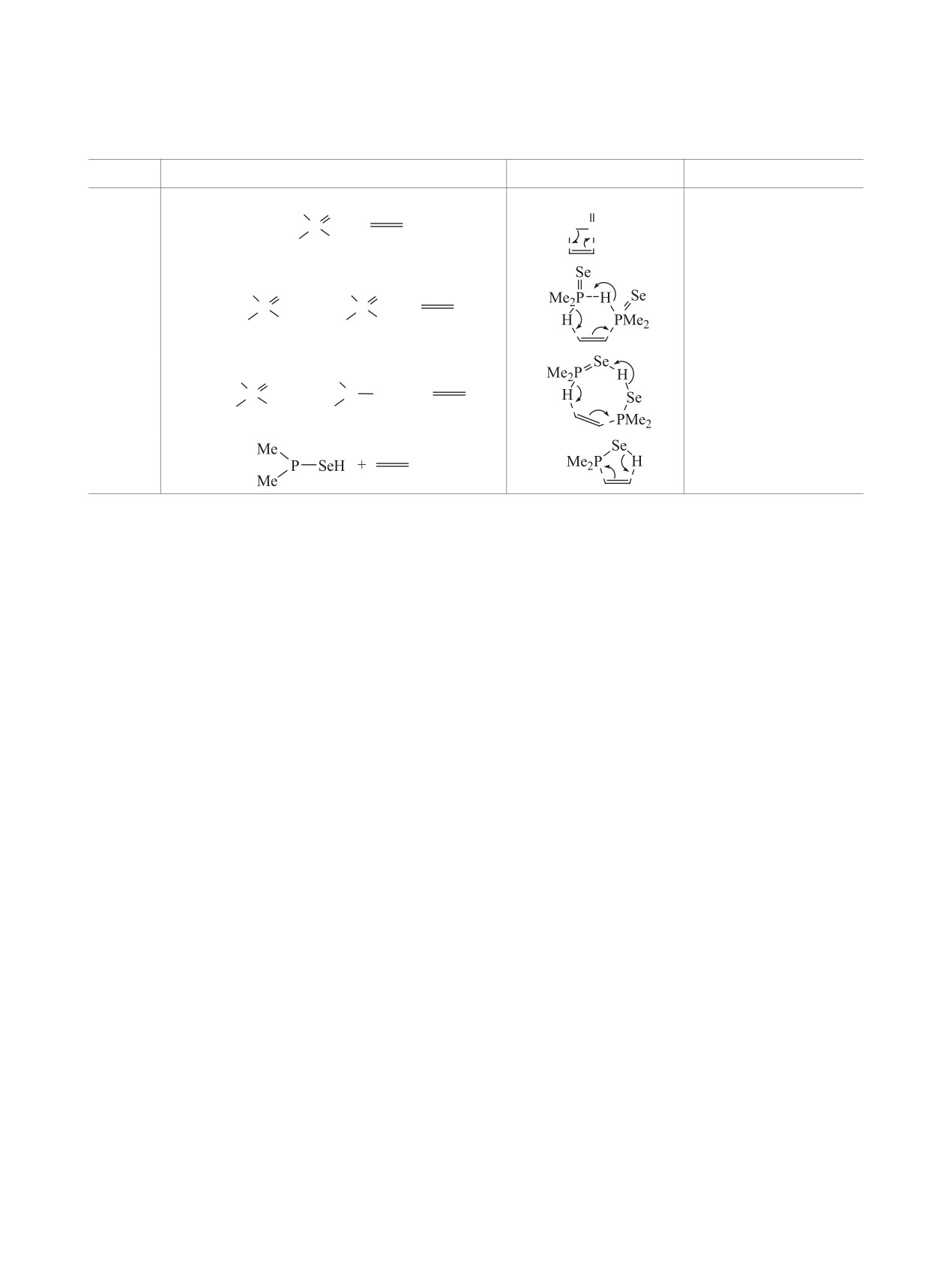
нов 2-6 с винилселенидами 7 и 8. По данным рас-
именно путь С: атом водорода от группы P-Se-H
четов, реакции присоединения протекают в одну
уходит к P=Se, еще один водород - от Н-P=Se ухо-
стадию по пути С, переходные состояния реакций
дит к алкену и затем к P-Se-H (уходит из реакции
(схема 2) представляют собой тримолекулярные
в неизменном виде). В таком случае, оба таутоме-
комплексы, включающие в себя обе таутомерные
ра участвуют в превращении, образуя совместно с
формы фосфинсульфида или фосфинселенида и
молекулой винилселенида переходное состояние,
алкилзамещенный винилселенид, пунктиром по-
трансформирующееся в стабильный продукт ре-
казаны разрывающиеся и возникающие связи,
акции. Восьмичленные переходные состояния на
образующие восьмичленный цикл. В дополни-
пути С (как и предреакционные комплексы) стаби-
тельных материалах представлена схема реакции
лизированы благодаря наличию водородных кон-
присоединения пентил(винил)селана к фосфин-
тактов (табл. 3).
селениду 5 согласно данным теоретических рас-
четов (см. рис. 1 в дополнительных материалах).
Рассчитанные энергии активации реакций при-
Геометрические параметры переходных состоя-
соединения фосфинхалькогенидов 1-6 к винилсе-
ний представлены в табл. 3. Согласно расчетам,
ленидам 7 и 8, а также длины водородных контак-
наблюдаются следующие изменения межатом-
тов в молекулах предпочтительных конформеров
ных расстояний по сравнению с параметрами ис-
образующихся аддуктов 9-20 приведены в табл. 4.
ходных реагентов: длины связей P=S, P=Se, P-H,
Аддукты 9-20 - это третичные фосфинсульфиды
S-H, Se-H и С=С увеличиваются, тогда как P-S и
или фосфинселениды, в молекулах которых атом
P-Se - уменьшаются. Кроме того, в переходных
фосфора имеет пирамидальное строение, заме-
состояниях возникают новые межмолекулярные
стители при нем ориентированы преимуществен-
контакты S∙∙∙H, Se∙∙∙H, С∙∙∙Н и P∙∙∙С.
но гош- или цис- [диэдральные углы X=P-C(R1)
и X=P-C-C]. Конформации молекул аддуктов
Согласно квантово-химическим расчетам для
9-20 стабилизированы внутримолекулярными во-
реагентов 1-6 таутомеры со связью Р=Х энерге-
дородными контактами между атомом серы/
тически предпочтительны, однако энергетический
барьер ниже для реакций присоединения с уча-
селена группы Р=Х (X = S, Se) или атомом селена
стием P-XH форм. Совместный учёт двух факто-
алкил(винил)селанильного фрагмента и различ-
ров - величины барьера переходного состояния
ными атомами водорода алкильных, фенильных
и энергетической предпочтительности таутоме-
и фенилэтильных заместителей у атома фосфора
ров - позволяет выбрать в качестве оптимального
(Se∙∙∙H).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
КВАНТОВО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ ПРИСОЕДИНЕНИЯ
1513
Таблица 3. Межатомные расстояния (Å) в переходных состояниях реакций соединений 1-6 с винилселенидами 7, 8
(путь С)a.
№
P1=X1
P1-H1
P2-X2
X2-H2
X1-H2
C1-H1
P2-C2
1
1.957
1.419
2.151
1.347
1 + 7
2.004
1.657
2.150
1.383
2.283
1.402
2.294
1 + 8
2.004
1.657
2.150
1.383
2.283
1.402
2.295
2
1.959
1.418
2.149
1.348
2 + 7
2.013
1.751
2.101
1.429
2.046
1.355
2.404
2 + 8
2.013
1.752
2.102
1.429
2.048
1.353
2.405
3
1.961
1.421
2.153
1.347
3 + 7
2.012
1.691
2.107
1.427
2.025
1.400
2.355
3 + 8
2.060
1.636
2.060
1.580
2.138
1.445
2.301
4
2.092
1.418
2.275
1.483
4 + 7
2.145
1.632
2.278
1.540
2.271
1.437
2.287
4 + 8
2.145
1.631
2.278
1.540
2.269
1.438
2.287
5
2.094
1.417
2.268
1.484
5 + 7
2.155
1.637
2.227
1.593
2.035
1.503
2.342
5 + 8
2.153
1.596
2.228
1.600
2.085
1.569
2.178
6
2.098
1.420
2.275
1.481
6 + 7
2.143
1.636
2.251
1.561
2.140
1.444
2.302
6 + 8
2.143
1.636
2.251
1.562
2.138
1.445
2.301
a Нумерация атомов в переходных состояниях на пути С приведена на схеме 2.
Вторичные фосфинселениды более реакцион-
ния протекают против правила Марковникова по
носпособны по сравнению с фосфинсульфидами,
молекулярному механизму через энергетически
о чем свидетельствуют значения энергии акти-
выгодное восьмичленное переходное состоя-
вации реакций (табл. 4). Полученные результаты
ние, приводя к образованию третичных фосфин-
хорошо согласуются с известными данными по
сульфидов или фосфинселенидов.
формированию связей С-Р в результате присоеди-
БЛАГОДАРНОСТИ
нения РН-аддендов к алкенам [10-12].
Квантово-химические расчеты выполнены в
Механизм присоединения вторичных фосфин-
вычислительном центре Казанского отделения
сульфидов и фосфинселенидов к алкилзамещен-
Межведомственного суперкомпьютерного центра
ным винилселенидам в отсутствии катализато-
РАН - филиале Федерального государственного
ров и растворителей был изучен методом теории
учреждения «Федеральный научный центр Науч-
дифференциала плотности. Реакции присоедине-
но-исследовательский институт системных иссле-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
1514
ВЕРЕЩАГИНА и др.
Таблица 4. Энергии активации и энтальпии реакции (кДж/моль) и длины Н-контактов (Å) аддуктов 9-20.
№
ΔЕ#
ΔЕреакции
Конформер
X∙∙∙H-C-Se
X∙∙∙H-Cарил
Se∙∙∙H
9
104.1
-140.5
гош,гош,гош
-
-
2.853
10
104.1
-140.5
гош,гош,гош
-
-
2.854
11
100.8
-129.9
гош,цис,цис
2.956
2.776
2.735
12
100.8
-129.9
гош,цис,цис
2.929
2.776
2.635
13
92.8
-129.1
гош,гош,гош
2.982
-
2.823
14
92.9
-129.1
гош,гош,гош
2.981
-
2.820
15
61.0
-144.1
гош,гош,гош
-
-
3.085
16
61.0
-144.2
гош,гош,гош
-
-
3.085
17
72.9
-128.1
гош,цис,цис
2.756
2.794
2.658
18
73.0
-128.0
цис,цис,гош
2.880
2.780
2.861
19
50.8
-148.8
транс,гош,цис
2.813, 2.894
2.988
2.807
20
50.7
-148.9
гош,транс,гош
2.825, 2.917, 2.973
-
2.817
дований Российской академии наук» и в Казанском
6. Chapman C.J., Frost C.G., Gill-Carey M.P., Kociok-
федеральном университете.
Köhn G., Mahon M.F., Weller A.S., Willis M.C.
Tetrahedron Asymmetry.
2003,
14,
705-710. doi
ФОНДОВАЯ ПОДДЕРЖКА
10.1016/S0957-4166(03)00088-0
Работа выполнена при финансовой поддер-
7. Ichikawa E., Suzuki M., Yabu K., Albert M., Kanai M.,
Shibasaki M. J. Am. Chem. Soc. 2004, 126, 11808-
жке Российского фонда фундаментальных иссле-
11809. doi 10.1021/ja045966f
дований (проект № 16-03-00100 а).
8. Gonzalez-Nogal A.M., Cuadrado P., Sarmentero M.A.
КОНФЛИКТ ИНТЕРЕСОВ
Tetrahedron.
2010,
66,
9610-9619. doi
10.1016/
j.tet.2010.10.016
Авторы заявляют об отсутствии конфликта
9. Boercker J.E., Foos E.E., Placencia D., Tischler J.G.
интересов.
J. Am. Chem. Soc. 2013, 135, 15071-15076. doi
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
10.1021/ja404576j
10. Gusarova N.K., Chernysheva N.A., Trofimov B.A.
Дополнительные материалы доступны на
Synthesis. 2017, 49, 4783-4807. doi 10.1055/s-0036-
1588542
СПИСОК ЛИТЕРАТУРЫ
11. Malysheva S.F., Gusarova N.K., Artem’ev A.V., Belo-
gorlova N.A., Albanov A.I., Borodina T.N., Smir-
1. Phosphorus Ligands in Asymmetric Catalysis: Syn-
nov V.I., Trofimov B.A. Eur. J. Org. Chem. 2014, 2014,
thesis and Applications. Ed. A. Börner. Weinheim:
2516-2521. doi 10.1002/ejoc.201301786
Wiley-VCH. 2008.
12. Gusarova N.K., Chernysheva N.A., Yas’ko S.V.,
2. Lühr S., Holz J., Börner A. Chem. Cat. Chem. 2011, 3,
Trofimov B.A. J. Sulfur Chem. 2015, 36, 526-534. doi
1708-1730. doi 10.1002/cctc.201100164
10.1080/17415993.2015.1066375
3. Fan Y.C., Kwon O. Chem. Commun. 2013, 49, 11588-
13. Верещагина Я.А., Исмагилова Р.Р., Чачков Д.В.
11619. doi 10.1039/C3CC47368F
ЖОрХ. 2019, 55, 279-286. [Vereshchagina Ya.A.,
4. Aizawa S., Fukumoto K., Kawamoto T. Polyhedron.
Ismagilova R.R., Chachkov D.V. Russ. J. Org. Chem.
2013, 62, 37-41. doi 10.1016/j.poly.2013.06.013
2019, 55, 227-233.] doi 10.1134/S1070428019020143
5. Canales S., Villacampa M.D., Laguna A., Gimeno M.C.
14. Medvedev M.G., Bushmarinov I.S., Sun J., Perdew J.P.,
J. Organomet. Chem. 2014, 760, 84-88. doi 10.1016/
Lyssenko K.A. Science. 2017, 355, 49-52. doi 10.1126/
j.jorganchem.2013.12.017
science.aah5975
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
КВАНТОВО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ ПРИСОЕДИНЕНИЯ
1515
15. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
ken V., Adamo C., Jaramillo J., Gomperts R., Strat-
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
mann R.E., Yazyev O., Austin A.J., Cammi R., Pomel-
Mennucci B., Petersson G.A., Nakatsuji H., Carica-
li C., Ochterski J.W., Martin R.L., Morokuma K.,
to M., Li X., Hratchian H.P., Izmaylov A.F., Bloino J.,
Zakrzewski V.G., Voth G.A., Salvador P., Dannen-
Zheng G., Sonnenberg J.L., Hada M., Ehara M., Toyo-
berg J.J., Dapprich S., Daniels A.D., Farkas O., Fores-
ta K., Fukuda R., Hasegawa J., Ishida M., Nakajima T.,
man J.B., Ortiz J.V., Cioslowski J., Fox D.J. Gaussian
Honda Y., Kitao O., Nakai H., Vreven T., Montgome-
09, Inc., Wallingford CT, 2009.
ry J.A. Jr., Peralta J.E., Ogliaro F., Bearpark M.,
16. Davies R., Patel L. Chalcogen Chemistry: New Per-
Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N.,
Kobayashi R., Normand J., Raghavachari K., RendellA.,
spectives in Sulfur, Selenium and Tellurium. 2nd Edn.
Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Rega N.,
Eds. F.A. Devillanova, W.-W. du Mont. Cambridge:
Millam J.M., Klene M., Knox J.E., Cross J.B., Bak-
RSC. 2013, 2, 238.
Quantum Chemical Study of Addition of Secondary Phosphine
Chalcogenides to Vinylselenides
Ya. A. Vereshchaginaa, *, R. R. Ismagilovaa, D. V. Chachkovb, and N. A. Chernyshevac
a Kazan Federal University, 420008, Russia, Republic of Tatarstan, Kazan, ul. Kremlevskaya 18
*e-mail: yavereshchagina@yahoo.com
b Kazan Department of Joint Supercomputer Center of Russian Academy of Sciences -
Branch of Federal State Institution “Scientific Research Institute for System Analysis of the RAS”,
420111, Russia, Republic of Tatarstan, Kazan, ul. Lobachevskogo 2/31
c Favorsky Institute of Chemistry, Siberian Branch of Russian Academy of Sciences,
664033, Russia, Irkutsk, ul. Favorskogo 1
Received June 2, 2020; revised June 11, 2020; accepted June 22, 2020
According to the DFT B3PW91/6-31G(d) calculations, the reactions of addition of secondary phosphine sulfides
and phosphine selenides with alkyl, phenyl and phenylalkyl substituents to vinylpentyl- and vinylhexylselenides
proceed via the molecular mechanism in energetically favorable eight-membered transition state, leading to
the formation of anti-Markovnikov tertiary phosphine chalcogenides. Secondary phosphine selenides are more
reactive than corresponding phosphine sulfides.
Keywords: phosphine sulfides, phosphine selenides, hydrophosphinylation, vinylselenides, reaction mechanism,
DFT calculations
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020