ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 10, с. 1583-1589
УДК 547.812.5:547.859
РЕАКЦИЯ БИДЖИНЕЛЛИ В СИНТЕЗЕ
РЕГИОИЗОМЕРНЫХ 5,6-ДИГИДРО-4Н-БЕНЗО[4,5]-
ИМИДАЗО[1,2-a]ПИРАНОПИРИМИДИН-4-ОНОB
© 2020 г. И. В. Каневская*, А. С. Бондарцова, О. В. Федотова
ФГБОУ ВО «Саратовский национальный исследовательский государственный университет им. Н.Г. Чернышевского»,
Институт химии, 410012, Россия, г. Саратов, ул. Астраханская 83
*e-mail: irinastrashilina@mail.ru
Поступила в редакцию 04 июля 2020 г.
После доработки 16 июля 2020 г.
Принята к публикации 20 июля 2020 г.
Изучен модифицированный вариант трехкомпонентной реакции Биджинелли с участием 4-гидрок-
си-6-метил-2Н-пиран-2-она, ароматических альдегидов и 2-аминобензимидазола при термической и
микроволновой активации. В зависимости от характера заместителей в альдегиде получены ангулярно-
сочлененные 5,6-дигидро-4Н-бензо[4,5]имидазо[1,2-а]пиранопиримидин-4-оны или арилбис(4-гидрок-
си-6-метил-2-оксо-2H-пиран-3-ил)метаниды 2-амино-1H-бензо[d]имидазолия. Предложен вероятный
механизм образования продуктов в исследуемых условиях.
Ключевые слова: 2Н-пиран-2-оны, 2-аминобензимидазол, one-pot взаимодействия, реакция Биджинел-
ли, бензоимидазопиранопиримидиноны.
DOI: 10.31857/S0514749220100134
2Н-Пиран-2-оны, проявляя широкий спектр
ароматических альдегидов 2a-d и гетероцикли-
биологической активности, находят свое примене-
ческого полиазануклеофила - 2-аминобензими-
ние как в медицине, так и в сельском хозяйстве.
дазола 3. Последний ранее вводился в эту реакцию
Они обладают противогрибковой [1], противоопу-
с использованием бензаннелированного аналога
холевой [2], антимикробной [3], цито-, фито- и ней-
эфира 1 - 4-гидрокси-2Н-хромен-2-она 4 [6, 9].
ротоксической активностью [4], а также являются
При этом была установлена возможность обра-
регуляторами роста растений [5]. 3-Замещенные
зования и разделения региоизомерных хромено-
4-гидрокси-2Н-пиран-2-оны являются хорошими
пиримидобензимидазолонов - ангулярных 7-(R)-
соединениями-платформами для синтеза различ-
фенил-7,8-дигидро-6H-хромено[3',4':5,6]пири-
ных гетероциклических, в том числе, гибридных
мидо[1,2-a]бензимидазол-6-онов 6а, b и линеар-
структур.
ных
7-(4R)-фенил-7,14-дигидро-6Н-хромено-
[4',3':4,5]пиримидо[1,2-a]бензимидазол-6-онов 7а,
Ранее было выявлено, что 4-гидрокси-2Н-пи-
ран-2-оны и их бензоаналоги могут быть исполь-
b (схема 1), отличающихся сочленением гетеро-
зованы для синтеза гибридных структур с исполь-
фрагментов [6]. В более ранних работах [9] найде-
зованием стратегии мультикомпонентных one-pot
ны условия хемоселективного синтеза лишь лине-
реакций Биджинелли и Ганча [6-8].
арной региоформы продукта реакции Биджинелли
для исследуемых субстратов - соединений 7а, b.
Настоящая работа посвящена исследованию
модифицированного варианта трехкомпонентной
В настоящем исследовании установлено, что
реакции Биджинелли с участием циклического
взаимодействие эфира 1, ароматических альде-
кетоэфира 4-гидрокси-6-метил-2Н-пиран-2-она 1,
гидов 2 и полиазануклеофила 3 в отличие от его
1583
1584
КАНЕВСКАЯ и др.
Схема 1.
R
R
O
OH
O
H
N
ZnCl2
O
H
+
+
+
NH2
O
NH
MWI
N
O
N
R
O O
N N
N
N
2a, c
3
4
H
6a, b
7a, b
R = H (2a, 6a, 7a), 4-Cl (2c, 6c, 7c).
бензаннелированного аналога 4 может приводить
Продукт превращения 8 выделен в виде моно-
как к классическим гибридам по Биджинелли - за-
гидрохлорида, что можно объяснить высокой ос-
мещенным бензоимидазопиранопиримидинонам,
новностью имидазопиримидинового фрагмента и
так и к другим системам по конкурирующему ме-
использованием в качестве катализаторов в тер-
ханизму.
мическом варианте реакции концентрированной
хлороводородной кислоты, а в микроволновом
Так, при one-pot введении в реакцию эфира 1,
варианте - спиртового раствора хлорида цинка,
бензальдегида 2а и полиазанукеофила 3 для тер-
претерпевающего в условиях эксперимента, веро-
мического и микроволнового вариантов, вне зави-
ятно, частичный сольволиз до хлороводородной
симости от способа активации реакционной сме-
кислоты.
си, из двух возможных региоизомеров возника-
ет лишь ангулярный 2-метил-5-фенил-5,6-диги-
Использование 4-метоксибензальдегида 2b и,
дро-4Н-бензо[4,5]имидазо[1,2-а]пиранопирими-
таким образом, введение электронодонорного за-
дин-4-он (8) с выходами 58 и 83% соответственно
местителя в ароматическое ядро альдегида мало
(схема 2).
отражается на направлении протекания превраще-
Схема 2.
N
N NH
R
O
O CH3
10, 11
1 + 2a, b + 3
C2H5OH
HCl
∆
N
nHCl
N NH
ZnCl2
MWI
H3C
O
O
R
8, 9
R = H (2a, 8, 10), OCH3 (2b, 9, 11); n = 1 (8), 2 (9).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
РЕАКЦИЯ БИДЖИНЕЛЛИ В СИНТЕЗЕ РЕГИОИЗОМЕРНЫХ 5,6-ДИГИДРО-4Н-БЕНЗО-...
1585
Схема 3.
R
H
1. ∆, HCl;
N
OH
OH
2. MWI, ZnCl2
NH2
1 + 2c, d + 3
C2H5OH
N
H
H3C
O
O
CH3
O O
12, 13
R = 4-Cl (2c, 12), 3-NO2 (2d, 13).
ния и приводит к образованию аналога ангуляр-
схеме под действием азануклеофила 3 преобразу-
ного региоизомера 8 - 5-(4-метоксифенил)-2-ме-
ется в конечные продукты. Путь В предполагает
тил-5,6-дигидро-4Н-бензо[4,5]имидазо[1,2-а]пи-
взаимодействие на первой стадии процесса альде-
рано[3,4-е]пиримидин-4-она 9, выделенного нами
гида с азакомпонетой, приводящее к образованию
в условиях синтеза в виде дигидрохлорида.
основания Шиффа 16, которое далее, атакуясь эфи-
ром 1, приводит к гибридам 8, 9. Альтернативное
Использование 4-хлорфенильного, в меньшей
направление, приводящее к возникновению ли-
степени донорного заместителя, изменяет на-
нейных региоизомеров 10, 11, в настоящих усло-
правление превращения и приводит к ассоциату -
виях не реализуется.
(4-хлорфенил)бис(4-гидрокси-6-метил-2-оксо-2H-
пиран-3-ил)метаниду 2-амино-1H-бензо[d]имида-
Ассоциаты 12, 13 формируются в результате
конденсации халкона 14 со второй молекулой эфи-
золия (12) (схема 3).
ра 1 по Михаэлю вне зависимости от способа акти-
Подобное наблюдалось и в ранее исследован-
вации реакционной смеси через известный аддукт
ном превращении с участием 4-гидрокси-2Н-хро-
15 [7, 8, 11-13]. Эти продукты можно рассматри-
мен-2-она, бензальдегида и
2-аминобензими-
вать как результат конкурирующего процесса ста-
дазола, где структура образующейся соли была
билизации халконов как интермедиатов превраще-
установлена по данным РСА [10]. Это говорит об
ний.
общем характере поведения бисаддуктов, фраг-
Строение соединений 8, 9, 12, 13 установлено
ментарно содержащих 4-гидроксипиран-2-оновое
на основании комплексной оценки данных ЯМР
кольцо, в том числе 5,6-бензаннелированных.
С спектроскопии с привлечением методов
1Н, 13
Аналогичную картину дает и 3-нитробензаль-
гетероядерной корреляционной спектроскопии
дегид 2d, электроноакцепторные свойства которо-
HSQC, HMBC и ядерного эффекта Оверхаузера в
го, вероятно, способствуют облегчению формиро-
формате гомоядерной одно- и двумерной корреля-
вания бисаддукта 13 за счет увеличения частич-
ции NOESY.
ного положительного заряда на электрофильном
Так, в спектре ЯМР 1Н бензоимидазопиранопи-
атоме углерода халконового интермедиата.
римидинона 8 присутствуют синглеты: трех про-
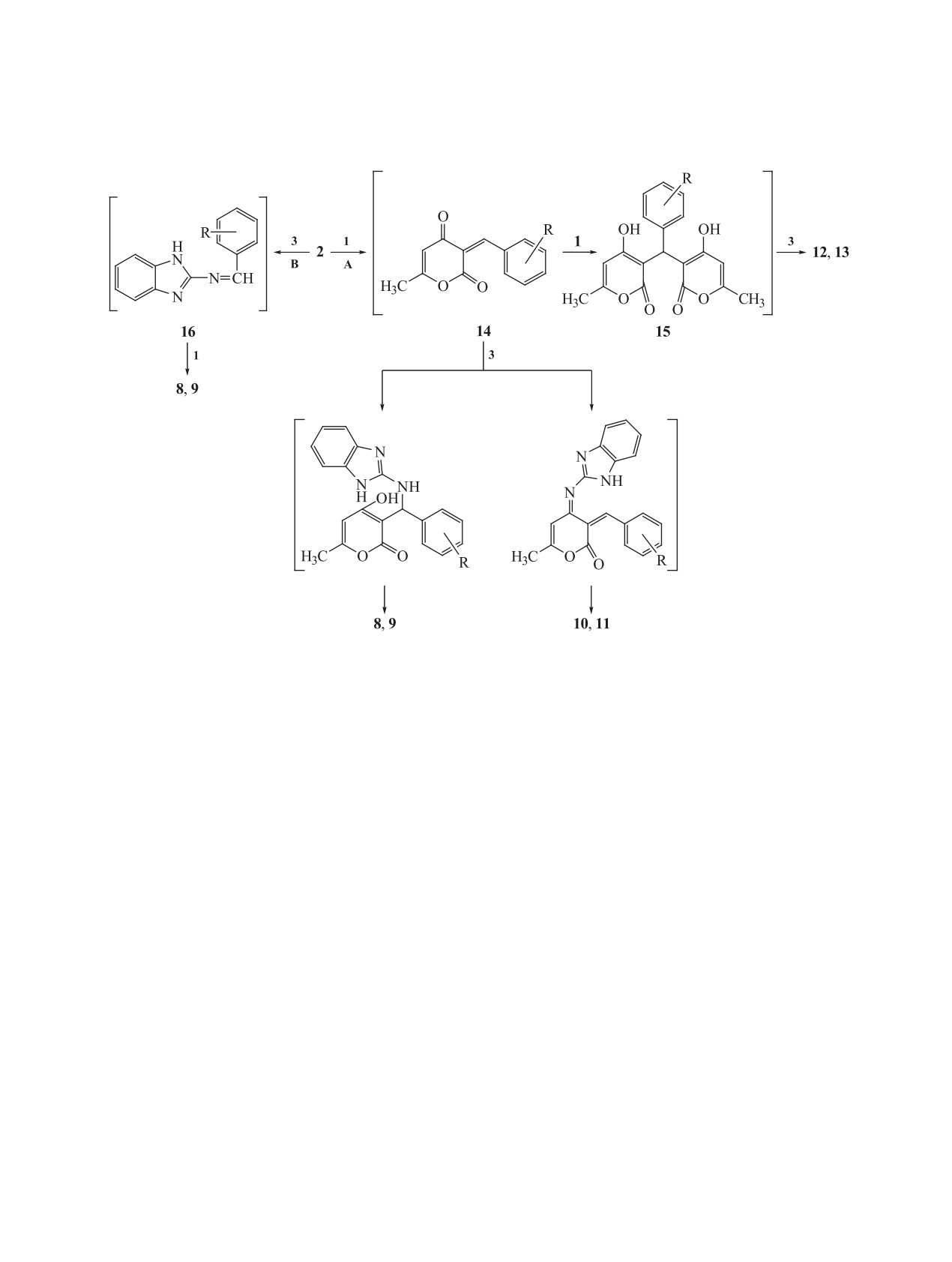
Вероятная схема образования гибридных си-
тонов метильной группы при 2.03 м.д., винильного
стем 8, 9 и ассоциатов 12, 13 может быть представ-
протона пиран-2-онового фрагмента при 5.74 м.д.,
лена следующим образом (схема 4).
метинового протона при 6.16 м.д. Мультиплет
ароматических протонов проявляется в области
Формирование бензоимидазопиранопиримиди-
7.01-7.38 м.д., протону вторичной аминогруппы
нонов 8, 9 в условиях трехкомпонентной реакции
соответствует уширенный синглет при 9.07 м.д.
Биджинелли вероятно по двум альтернативным
направлениям. Первое предполагает первоначаль-
В спектре двумерной гетероядерной корреля-
ное взаимодействие альдегида 2 с эфиром 1 с фор-
ции НМВС соединения 8 обнаружены кросс-пики
мированием халкона 14 (путь А), который далее по
9.07/113.3 м.д. и 9.07/127.8 м.д., отвечающие вза-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
1586
КАНЕВСКАЯ и др.
Схема 4.
имодействию протона вторичной аминогруппы с
Спектральная картина метоксифенилзамещен-
атомами углерода ароматического фрагмента и С3
ного гибрида 9 аналогична таковой для незаме-
пиранонового кольца соответственно. Отсутствие
щенного аналога 8. Следует отметить лишь сме-
иных корреляционных сигналов NH-протона в
щение сигнала NH-протона в более сильное поле
спектре НМВС позволяет предположить присут-
(7.62 м.д) и увеличение его интегральной интен-
ствие ангулярного сочленения пиримидобензи-
сивности до двух протонов, что может быть обу-
мидазольного и пиран-2-онового гетерофрагмен-
словлено тем, что основная часть молекулы ассо-
тов. Подтверждением этому может служить сово-
циирована с двумя молекулами хлороводородной
купность данных гомоядерной корреляционной
кислоты.
спектроскопии с применением ядерного эффекта
В спектре ЯМР 1Н ассоциата 12 отмечены син-
Оверхаузера в формате NOESY.
глеты: шести метильных протонов при 2.00 м.д.,
Так, в спектре NOESY соединения
8 на-
двух винильных протонов при 5.63 м.д., метино-
блюдаются кросс-пики при
9.07/7.26 м.д., и
вого протона при 5.86 м.д. Ароматическим прото-
5.74/7.14 м.д., что говорит о пространственной
нам 4-хлорфенильного фрагмента соответствуют
сближенности ароматических протонов с прото-
два дублета при 7.64 м.д. (J 8.0 Гц) и 7.89 м.д. (J
ном аминогруппы в первом случае и винильным
8.0 Гц).
протоном пиран-2-онового фрагмента во втором.
Катион 2-аминобензимидазолия возникает пу-
Данные пространственные взаимодействия также
могут свидетельствовать об ангулярной структуре.
тем протонирования одного из эндоциклических
Дополнительным подтверждением этому является
атомов азота и стабилизируется за счет делокали-
отсутствие в спектре NOESY корреляции амино-
зации электронной плотности, что согласуется с
группы с винильным протоном как в общем виде,
квантовохимическим B3LYP/6-311++G(d,p) расчё-
так и при селективном возбуждении последнего в
том его геометрии и электронной структуры [10].
рамках метода NOESY1D.
Наличие данного катионного фрагмента в спектре
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
РЕАКЦИЯ БИДЖИНЕЛЛИ В СИНТЕЗЕ РЕГИОИЗОМЕРНЫХ 5,6-ДИГИДРО-4Н-БЕНЗО-...
1587
ЯМР 1Н подтверждается присутствием уширен-
ственно) в ДМСО-d6, внутренний стандарт тетра-
ного синглета двух протонов экзоциклической
метилсилан. Элементный анализ проводили на
аминогруппы при 8.26 м.д., мультиплета четырех
программно-аппаратном анализаторе Vario Micro
ароматических протонов в области 7.11-7.33 м.д.,
Cube. Температуру плавления определяли капил-
а также наличием в спектре соединения 12 уши-
лярным методом. Контроль за ходом реакции и чи-
ренного синглета четырех протонов при 12.36 м.д.,
стотой полученных соединений осуществляли ме-
который включает в себя сигнал двух протонов
тодом тонкослойной хроматографии на пластинах
гидроксильных групп биспирановой системы и
Silufol UV-254, элюент ацетон-этилацетат-н-гек-
резонанс протонов эндоциклических аминогрупп
сан (1:1:3), проявитель - пары иода.
2-аминобензимидазольной части. В пользу ионной
Воздействие микроволнового излучения обе-
структуры выделенного соединения также может
спечивалось автоматической микроволновой уста-
говорить уширение синглета метинового протона
новкой для синтеза NOVA II, рабочая температура
и его малая интегральная интенсивность (0.4), что
180-190°С.
является следствием высокой подвижности и по-
вышения СН-кислотности.
Общая методика. а. В круглодонную колбу
объемом 50 мл, снабженную обратным холодиль-
Спектральная картина для нитрофенилзаме-
ником, помещали 25 мл этанола, в котором при
щенного ассоциата 13 аналогична таковой для си-
нагревании растворяли 0.5 г (4 ммоль) эфира 1, до-
стемы 12.
бавляли 0.53 г (4 ммоль) азануклефила 3, 4 ммоль
Экспериментальные данные о региоселектив-
альдегида 2, 0.1-0.2 мл концентрированной хлоро-
ности рассмотренных превращений с участием в
водородной кислоты и нагревали при температуре
качестве карбонильной компоненты бензальдеги-
78°С. По окончании реакции смесь упаривали на
да и его 4-метоксизамещенного аналога не позво-
воздухе, оставшиеся кристаллы промывали водой
ляют однозначно определить путь превращения
и гексаном, сушили в вакууме.
субстратов. Характер продуктов реакции с уча-
б. В фарфоровый тигель помещали
0.5 г
стием 4-хлор- и 3-нитробензальдегидов дает ос-
(4 ммоль) эфира 1, 0.53 г (4 ммоль) азануклефила
нование для утверждения о протекании этих пре-
3, 4 ммоль альдегида 2 и 0.1-0.2 мл раствора хло-
вращений по пути с формированием халкона и его
рида цинка в этаноле (0.1 г/мл). Смесь гомогени-
преобразованием за счет конкурентной конденса-
зировали и подвергали воздействию микроволно-
ции Михаэля в арилметиленбис-4-гидрокси-6-ме-
вого излучения мощностью 600 Вт. По окончании
тил-2Н-пиран-2-оны 15. Последние могут депро-
реакции смесь растирали, промывали водой и гек-
тонироваться до анионов, стабилизирующихся
саном, сушили в вакууме.
ассоциацией с катионом 2-аминобензимидазолия,
что и наблюдается экспериментально.
2-Метил-5-фенил-5,6-дигидро-4Н-бензо[4,5]-
имидазо[1,2-а]пиранопиримидин-4-она гидрох-
Образование исключительно ангулярных изо-
лорид (8). Синтез проводили по методу а с ис-
меров в случае реализации пути А можно объяс-
пользованием 0.42 г (4 ммоль, 0.41 мл) альдегида
нить, на наш взгляд, тем, что арилиденовый фраг-
2a в течение 12 ч. Выход 0.85 г (58%), бесцветные
мент, вероятно, имеет более активный электро-
кристаллы, т.пл. 201-202°С.
фильный центр, чем карбонильный атом углерода,
и именно он подвергается атаке экзоциклической
По методу б синтез проводили с использовани-
аминогруппой азануклефила.
ем 0.42 г (4 ммоль, 0.41 мл) альдегида 2a в тече-
ние 30 мин. Выход 1.21 г (83%), бесцветные
Однако, несмотря на вышеперечисленные дан-
ные, исключить возможность реализации, «имин-
кристаллы, т.пл.
201-202°С. Спектр ЯМР
1Н
(ДМСО-d6), δ, м.д.: 2.03 с (3Н, СН3), 5.74 с (1Н,
ного» механизма нельзя.
=СН), 6.16 с (1Н, СН), 7.01-7.38 м (9Наром), 9.07
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
уш.с (1Н, NH). Спектр ЯМР 13С (ДМСО-d6), δ, м.д.:
Спектры ЯМР 1Н,13С регистрировали на спек-
19.2 (С13), 35.1 (С5), 105.3 (С1), 109.6 (С4а), 121.1,
трометре Varian 400 (400 и 100 МГц соответ-
121.4, 126.9, 127.3, 127.9, 128.2, 128.6, 139.5, 139.7,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
1588
КАНЕВСКАЯ и др.
143.3, 146.0, 146.3 (Саром),144.3 (С2), 146.8 (С12а),
зо[d]имидазолия (13). Синтез проводили по мето-
159.6 (С6а), 162.7 (С4). Найдено,%: С 65.81; Н 4.68;
ду а с использованием 0.60 г (4 ммоль) альдегида
Cl 10.04; N 11.65. C20H16ClN3O2. Вычислено, %: С
2d в течение 3 ч. Выход 0.79 г (76%), желтые кри-
65.67; H 4.41; Cl 9.69; N 11.49.
сталлы, т.пл. 178-179°С.
5-(4-Метоксифенил)-2-метил-5,6-дигидро-
По методу б синтез проводили с использовани-
4Н-бензо[4,5]имидазо[1,2-а]пирано[3,4-е]пири-
ем 0.60 г (4 ммоль) альдегида 2d в течение 45 мин.
мидин-4-она дигидрохлорид (9). Синтез проводи-
Выход 0.91 г (88%), желтые кристаллы, т.пл. 178-
ли по методу а с использованием 0.54 г (4 ммоль,
179°С. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 2.03
0.49 мл) альдегида 2b в течение 50 ч. Выход 0.62 г
с (6Н, СН3), 5.60 с (2Н, =СН), 5.91 с (0.5Н, СН),
(36%), желтые кристаллы, т.пл. 175-176°С.
6.68-8.50 м (8Наром), 8.65 уш.с (2Н, NH2), 11.86
По методу б синтез проводили с использовани-
уш.с (4Н, NH, OH). Спектр ЯМР 13С (ДМСО-d6), δ,
ем 0.54 г (4 ммоль, 0.49 мл) альдегида 2b в течение
м.д.: 19.7, 19.9 (C7, C7'), 34.6 (C*), 103.2, 103.4 (C5,
1 ч 25 мин. Выход 1.12 г (83%), желтые кристал-
C5'), 123.1, 123.3, 127.5, 127.7, 129.5, 129.8, 131.4,
лы, т.пл. 175-176°С. Спектр ЯМР 1Н (ДМСО-d6),
131.7, 139.5, 142.5, 142.8, 145.1 (Саром), 143.6, 144.0
δ, м.д.: 2.03 с (3Н, СН3), 3.84 с (3Н, ОСН3), 5.58 с
(C6, C6'), 141.4, 1491.7 (C3, C3'), 158.7 (C2''), 159.8,
(1Н, =СН), 5.79 с (1Н, СН), 6.65-7.24 м (8Наром),
160.2 (C2, C2'), 166.1, 166.4 (C4, C4'). Найдено,%: С
7.62 уш.с (2Н, NH). Спектр ЯМР 13С (ДМСО-d6),
59.80; Н 3.93; N 10.50. C26H22N4O8. Вычислено, %:
δ, м.д.: 18.8 (С13), 34.3 (С5), 56.0 (С14), 105.2 (С1),
С 60.23; H 4.28; N 10.81.
110.3 (С4а), 126.8, 127.0, 127.4, 127.3, 127.9, 131.8.
ФОНДОВАЯ ПОДДЕРЖКА
131.9,
139.3,
139.4,
139.6,
141.1,
146.2,
146.8
(Саром),145.3 (С2), 147.2 (С12а), 158.4 (С6а), 163.2
Работа выполнена при поддержке Российского
(С4). Найдено,%: С 58.43; Н 4.86; Cl 16.60; N 9.62.
фонда фундаментальных исследований (грант
C21H19Cl2N3O3. Вычислено, %: С 58.34; H 4.43; Cl
№ 20-03-00446).
16.40; N 9.72.
КОНФЛИКТ ИНТЕРЕСОВ
(4-Хлорфенил)бис(4-гидрокси-6-метил-2-
оксо-2H-пиран-3-ил)метанид
2-амино-1H-бен-
Авторы заявляют об отсутствии конфликта ин-
зо[d]имидазолия (12). Синтез проводили по мето-
тересов.
ду а с использованием 0.56 г (4 ммоль) альдегида
СПИСОК ЛИТЕРАТУРЫ
2c в течение 8 ч. Выход 0.66 г (65%), желтые кри-
сталлы, т.пл. 196-197°С.
1. Altomare C., Pengue R., Favilla M., Evidente A.,
Visconti A. J. Agric. Food. Chem. 2004, 52, 2997-
По методу б синтез проводили с использова-
3001. doi 10.1021/jf035233z
нием 0.56 г (4 ммоль) 4-альдегида 2c в течение
2. Kondoh M., Usui T., Kobayashi S., Tsuchiya K.,
65 мин. Выход 0.76 г (75%), желтые кристаллы,
Nishikawa K., Nishikiori T., Mayumi T., Osada H.
т.пл.
196-197°С. Спектр ЯМР 1Н (ДМСО-d6),
Cancer Lett. 1998, 126, 29-32. doi 10.1016/s0304-
δ, м.д.: 2.00 с (6Н, СН3), 5.57 с (2Н, =СН), 5.79 с
3835(97)00528-4
(0.4Н, СН), 6.90-7.90 м (8Наром), 8.26 уш.с (2Н,
3. Moreno-Manas M.M., Pleixats R. Adv. Heterocycl.
NH2), 12.32 уш.с (4Н, NH, OH). Спектр ЯМР 13С
Chem.
1992,
53,
1-84. doi
10.1016/s0065-
(ДМСО-d6), δ, м.д.: 19.2, 19.3 (C7, C7'), 35.3 (C*),
2725(08)60861-2
105.1, 105.5 (C5, C5'), 120.7, 127.0, 127.2, 128.9,
4. Altomare C., Perrone G. J. Nat. Prod. 2000, 63, 1131-
134.4, 134.9, 138.7, 139.0, 143.2, 146.7, 147.0, 148.4
1135. doi 10.1021/np000023r
(Саром), 141.8, 142.3 (C6, C6'), 149.1, 149.6 (C3, C3'),
5. Goel A., Ram V.J. Tetrahedron. 2009, 65, 7865-7913.
157.4 (C2''), 159.3, 159.8 (C2, C2'), 166.4, 166.6 (C4,
doi 10.1016/j.tet.2009.06.031
C4'). Найдено,%: С 61.08; Н 3.98; Cl 9.81; N 7.80.
6. Мажукина О.А., Платонова А.Г., Федотова О.В.,
C26H22ClN3O6. Вычислено, %: С 61.47; H 4.37; Cl
Васин В.А. ЖОрХ. 2015, 51, 709-713. [Mazhuki-
10.04; N 8.26.
na O.A., Platonova A.G., Fedotova O.V., Vasin V.A.
(3-Нитрофенил)бис(4-гидрокси-6-метил-2-
Russ. J. Org. Chem. 2015, 51, 691-696.] doi 10.1134/
оксо-2H-пиран-3-ил)метанид
2-амино-1H-бен-
s107042801505019x
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020
РЕАКЦИЯ БИДЖИНЕЛЛИ В СИНТЕЗЕ РЕГИОИЗОМЕРНЫХ 5,6-ДИГИДРО-4Н-БЕНЗО-...
1589
7. Страшилина И.В. Мажукина О.А., Федотова О.В.
52,
1338-1346.
[Pankratov A.N., Fedotova O.V.,
ЖОрХ. 2018, 54, 103-106. [Strashilina I.V., Mazhuki-
Ozerova A.G., Mazhukina O.А., Strashilina I.V. Russ.
na O.A., Fedotova O.V. Russ. J. Org. Chem. 2018, 54,
J. Org. Chem. 2016, 52, 1326-1334.] doi 10.1134/
102-106.] doi 10.1134/s1070428018010098
s107042801609013x
8. Страшилина И.В., Арзямова Е.М., Федотова О.В.
11. Cervera M., Moreno-Manas M., Pleixats R.
ЖОрХ.
2018,
54,
1162-1167.
[Strashilina I.V.,
Tetrahedron. 1990, 46, 7885-7892. doi 10.1016/s0040-
Arzyamova E.M., Fedotova O.V. Russ. J. Org.
4020(01)90086-9
Chem.
2018,
54,
1173-1178.] doi
10.1134/
S1070428018080092
12. March de P., Moreno-Manas M., Pi R., Trius A.
J. Heterocycl. Chem. 1982, 19, 335-336. doi 10.1002/
9. Heravi M.M., Saeedi M., Beheshtiha Y.S., Oskooie H.A.
jhet.5570190223
Chem. Heterocycl. Compd. 2011, 47, 737-744. doi
10.1007/s10593-011-0828-7
13. March de P., Moreno-Manas M., Roca J.L.
10. Панкратов А.Н., Федотова О.В., Озерова А.Г.,
J. Heterocycl. Chem.
1984,
21,
1371-1372. doi
Мажукина О.А., Страшилина И.В. ЖОрХ. 2016,
10.1002/jhet.5570210525
Biginelli Reaction in the Synthesis of Regioisomeric 5,6-Dihydro-
4H-benzo[4,5]imidazo[1,2-a]pyranopyrimidine-4-ones
I. V. Kanevskaya*, A. S. Bondartsova, and O. V. Fedotova
Institute of Chemistry, Saratov State University, 410012, Russia, Saratov, ul. Astrakhanskaya 83
*e-mail: irinastrashilina@mail.ru
Received July 4, 2020; revised July 16, 2020; accepted July 20, 2020
A modified variant of the Biginelli ternary reaction with the participation of 4-hydroxy-6-methyl-2H-pyran-
2-one, aromatic aldehydes and 2-aminobenzimidazole was studied under thermal and microwave activation.
Depending on the nature of the substituents in the aldehyde, angularly-joined 5,6-dihydro-4H-benzo[4,5]-
imidazo[1,2-a]pyranopyrimidin-4-ones or arylbis(4-hydroxy-6-methyl-2-oxo-2H-pyran-3-yl)methanides of
2-amino-1H-benzo[d]imidazolium. A probable mechanism of product formation under the studied conditions
is proposed.
Keywords: 2H-pyran-2-ones, 2-aminobenzimidazole, one-pot interaction, Biginelli reaction, benzoimidazo-
pyranopyrimidinones
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 10 2020