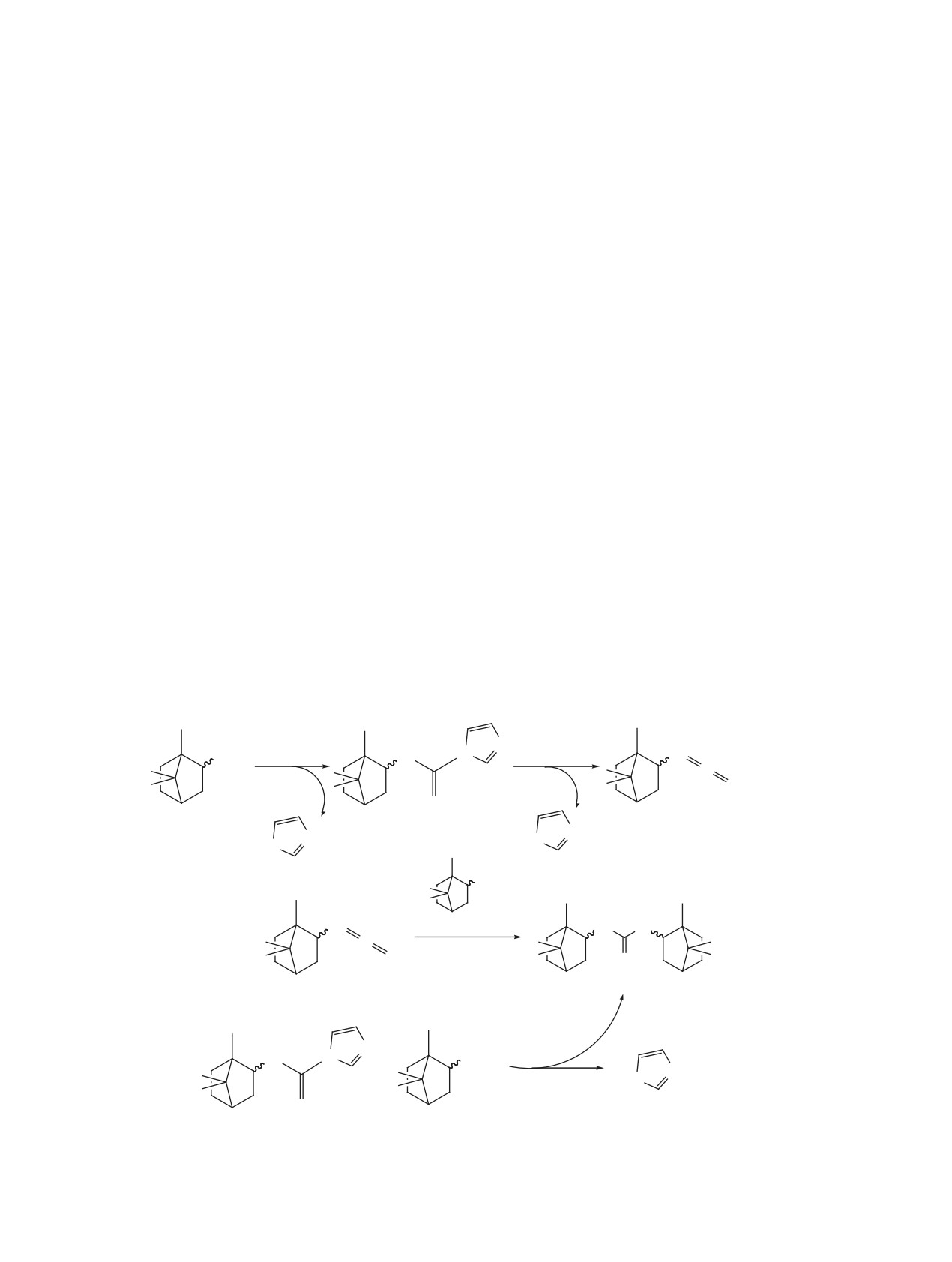ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 11, с. 1680-1692
УДК 547.239
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ
МОЧЕВИН И ИХ ИЗОСТЕРИЧЕСКИХ АНАЛОГОВ,
СОДЕРЖАЩИХ ПОЛИЦИКЛИЧЕСКИЕ ФРАГМЕНТЫ:
V.1 1-(БИЦИКЛО[2.2.1]ГЕПТАН-2-ИЛ)-3-R-
И 1-(1,7,7-ТРИМЕТИЛБИЦИКЛО[2.2.1]ГЕПТАН-2-ИЛ)-
3-R-МОЧЕВИНЫ
© 2020 г. Д. А. Питушкинa, b, В. В. Бурмистровa, b, М. Х. Аббас Саифа,
А. А. Вернигораa, Г. М. Бутовa, b, *
a ФГБОУ ВО «Волгоградский государственный технический университет» ВолгГТУ,
400005, Россия, г. Волгоград, пр. Ленина 28
b ФГБОУ ВО «Волжский политехнический институт» (филиал) ВолгГТУ,
404121, Россия, Волгоградская обл., г. Волжский, ул. Энгельса 42а
*e-mail: butov@post.volpi.ru
Поступила в редакцию 15 июня 2020 г.
После доработки 22 июня 2020 г.
Принята к публикации 23 июня 2020 г.
Серия 1,3-дизамещенных мочевин, содержащих в своей структуре бициклическую липофильную
группу природного происхождения, синтезирована по реакции бицикло[2.2.1]гептaн-2-изоцианата с
аминами с выходами до 82% и по реакции бицикло[2.2.1]гептaн-2-амина и 1,7,7-триметилбицикло[2.2.1]-
гептaн-2-амина с 1,1'-карбонилдиимидазолом с выходами до 94%. Синтезированные мочевины являются
перспективными ингибиторами репликации РНК-вирусов и растворимой эпоксидгидролазы человека.
Ключевые слова: природные соединения, бицикло[2.2.1]гептан, изоцианат, мочевина, галогенсодержа-
щие анилины, растворимая эпоксидгидролаза, коронавирус, SARS-CoV.
DOI: 10.31857/S0514749220110026
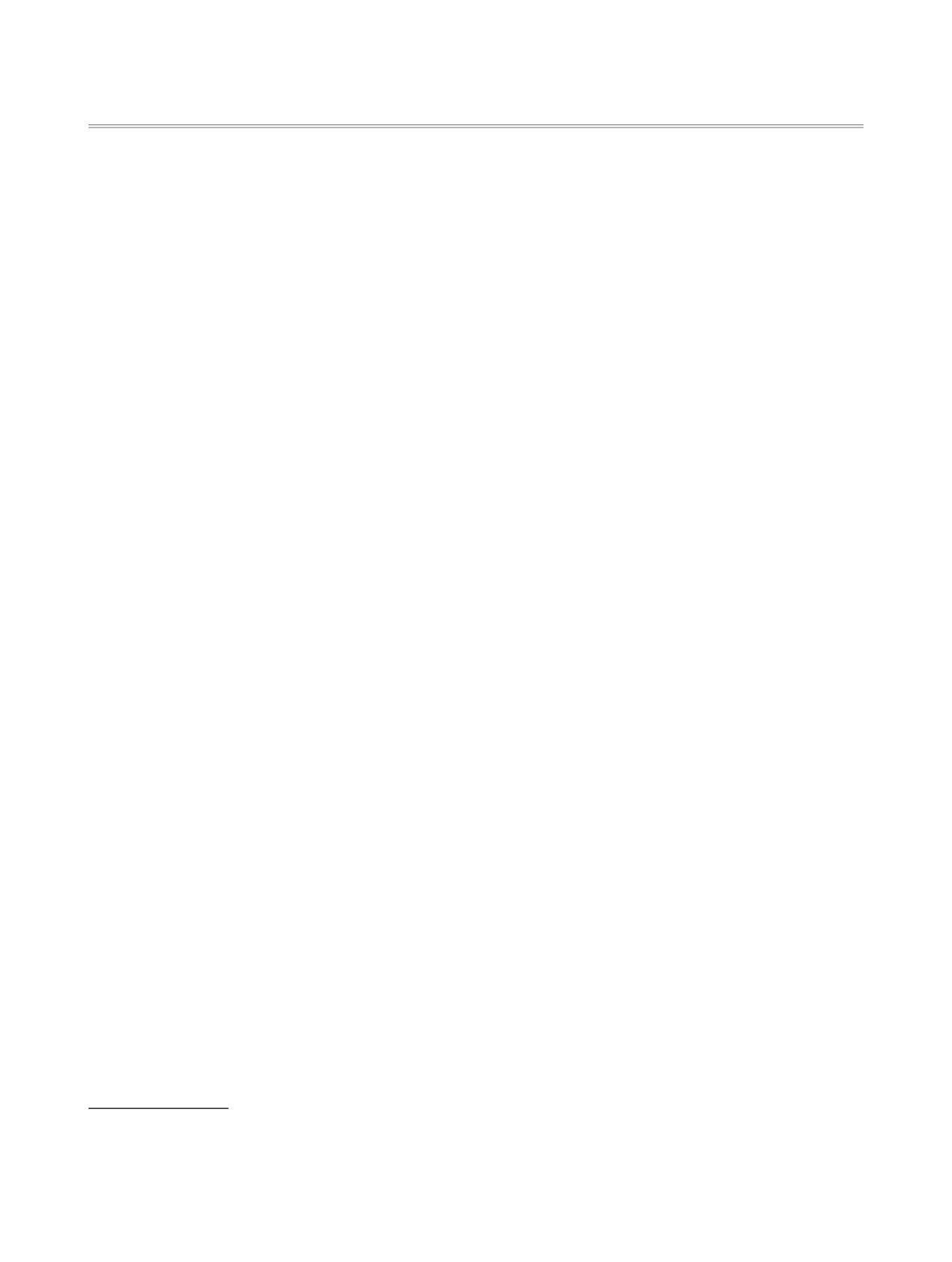
Мочевины являются универсальными струк-
вирусов (рис. 1). Установлено, что мочевины этой
турными блоками для синтеза разнообразных гете-
серии снижают скорость репликации до ~8% от
роциклических соединений и обладают широким
контрольной в концентрации 250 мкмоль/л, что
спектром биологически активных свойств [2]. Так
позволяет рассматривать эти соединения в каче-
наиболее эффективными ингибиторами раствори-
стве потенциальных противовирусных препара-
мой эпоксидгидролазы человека (sEH), перспек-
тов, активных в отношении РНК-вирусов, таких
как SARS-CoV, ВИЧ-1 и ОРВИ [7].
тивной мишени в терапии гипертонии, воспаления
и болевых синдромов, являются 1,3-дизамещен-
Наиболее распространенным методом полу-
ные мочевины [3-6].
чения несимметричных мочевин, известным еще
с середины XIX века, является взаимодействие
Серия
1,3,3-тризамещенных мочевин
[этил-
аминов с изоцианатами, содержащими различные
2-(4-R-1,4-диазепан-1-карбоксамидо)бензоаты] ис-
заместители
[8-11]. Основными недостатками
следована в роли ингибиторов репликации РНК-
данного метода являются токсичность исходных
1 Сообщение IV см. [1].
изоцианатов и их небольшой ассортимент, а также
1680
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : V
1681
S
N
S
S
N
N
N
N
N
N
N
O NH
O
O NH
O
O NH
O
O
O
O
Рис. 1. Этил-2-(4-R-1,4-диазепан-1-карбоксамидо)бензоаты.
образование симметричных мочевин в результа-
Например, описан синтез 1-(нафталин-1-ил)-
те взаимодействия изоцианата с неизбежно при-
3-(пиридин-3-ил) мочевины взаимодействием
сутствующими в любой системе следами влаги.
3-аминопиридина с эквимолярным количеством
В случае синтеза несимметричных мочевин для
1,1'-карбонилдиимидазола при нагревании до
целей медицинской химии присутствие даже не-
50°C в течение 1.5 ч с последующим добавлени-
значительных количеств симметричных мочевин
ем эквимолярного количества 1-аминонафталин в
недопустимо, а отделение таких примесей бывает
ТГФ [12] с выходом 98%.
затруднено ввиду их структурного подобия.
CDI в 10% избытке использован для синте-
В настоящее время используют другой метод
за
[(1-метокси-1-оксо-3-фенилпропан-2-ил)кар-
синтеза несимметричных 1,3-дизамещенных мо-
бамоил]аланина при комнатной температуре.
чевин, заключающийся во взаимодействии двух
Добавление в реакционную массу второго амина
различных по строению и основности аминов с
(гидрохлорида метилового эфира фенилалани-
1,1'-карбонилдиимидазолом (CDI), который явля-
на) осуществлялось через 5 мин после смешения
ется аналогом фосгена в синтезе мочевин из ами-
первого амина (соли бензилового эфира аланина и
нов. Этот метод представляет собой трехкомпо-
п-толуолсульфокислоты) и CDI, реакция проводи-
нентную одно- или двухстадийную реакцию.
лась при комнатной температуре [13].
Схема 1.
CDI, DMF
Et3N
H
N
∆
R1 NH2
N N
R1
N C O
R1
O
N
N
HN
HN
H
H
N
N
R1 N C O
+ R2 NH2
R1
R2
O
H
H
N
N
R1 N C O
+ R1 NH2
R1
R1
O
R1 = alkyl, aryl; R2 = alkyl, aryl.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
1682
ПИТУШКИН и др.
Схема 2.
H2N
R
H
H
F
N
N
3a
R
R
O
F
4a, 5a
R
H2N
H
H
N
N
3b
R
R
O
O
4b, 5b
H2N
OH
R
O
H
H
O
N
N
3c
R
OH
R
R
O
O
CDI, DMF
NH2
4c, 5c
Et3N
H2N
R
R
N
H
H
R
N
N
3d
O
R
1, 2
R
O
N
O
4d, 5d
R
R
H
H
H
H
H2N
(CH2)6
NH2
N
N
N
N
3e
R
R
(CH2)6
R
O
O
R
R
4e, 5e
H2N
R
R
R
H
H
R
N
N
1, 2
R
R
R
O
R
4f, 5f
R = H (1, 4a-f), R = CH3 (2, 5a-f).
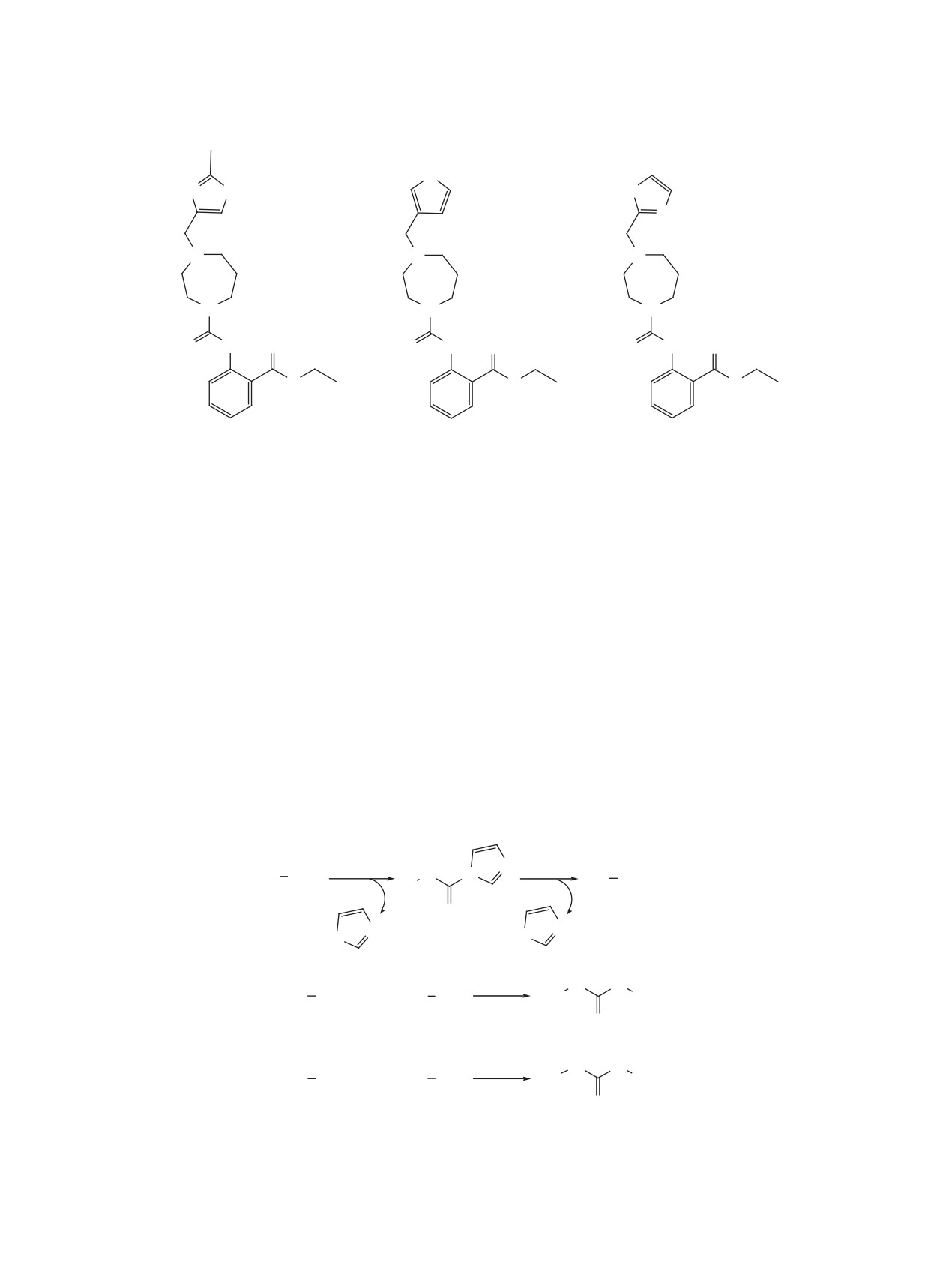
Известно использование 3-кратного избыт-
является реакция непрореагировавшего исходного
ка CDI для получения несимметричных мочевин
амина с образующимся на второй стадии изоциана-
[14]. Так,
1-(6-бром[1,2,4]триазол[1,5-а]пири-
том (схема 1). В этой связи существенное значение
дин-2-ил)-3-метилмочевину получают с выходом
на выход несимметричных мочевин будет влиять
79.6% взаимодействием 6-бром[1,2,4]триазол[1,5-
порядок и условия проведения трехкомпонентной
а]пиридин-2-амина в ДМФА в присутствии ги-
реакции. При этом основность (нуклеофильность)
дрида натрия и 3-кратного избытка CDI при на-
исходных аминов и реакционная способность про-
гревании до 60°C с последующим добавлением
межуточного изоцианата будут определять селек-
3,5-кратного избытка метиламина и нагревании
тивность реакции и выход продуктов.
до 60°C в течение 6 ч. При этом удаление избытка
В этой связи осуществлен синтез серии 1,3-ди-
CDI перед добавлением второго амина в данной
замещенных мочевин 4a-e и 5a-e на основе би-
работе не описано.
цикло[2.2.1]гептан-2-амина (1) и 1,7,7-триметил
По-видимому, одним из факторов, влияющих
бицикло[2.2.1]гептан-2-амина (2), а также аминов,
на образование побочных симметричных мочевин,
на основе которых ранее были получены высоко-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : V
1683
активные ингибиторы растворимой эпоксидгидро-
С учетом изложенного были выполнены иссле-
лазы: 2-фторанилин (3a) [15], 1-аминометилада-
дования реакции амина 2 с CDI без добавления
мантан (3b) [16], транс-4-[(4-аминоциклогексил)-
другого амина. Методом ГХ-МС установлено, что
окси]бензойная кислота (3c) [3], 1-(4-аминопипе-
при смешении амина 2 и CDI реакция образования
ридин-1-ил)пропан-1-он (3d) [4] и 1,6-диамино-
промежуточного карбоксамида 6 (схема 3, реак-
гексан (3e) [5] в присутствии CDI. Кроме того, из
ция 1) протекает достаточно быстро (20 мин,
аминов 1 и 2 были получены симметричные моче-
25°С). Однако она также сопровождается образо-
вины 4f и 5f (схема 2).
ванием симметричной мочевины 5f с выходом 8%,
В результате синтеза соединений 4a-e и 5a-e
что может быть связано с дальнейшим разложени-
в одинаковых условиях была обнаружена зави-
ем карбоксамида 6 до изоцианата 7 и его реакции
симость выхода продуктов реакции от структуры
с исходным амином 2 (схема 3, реакция 2). Таким
исходных аминов (см. таблицу), а также установ-
образом, условия проведения первой стадии трех-
лено образование симметричных мочевин 4f и 5f
компонентной реакции должны исключить веро-
в каждой реакции при введении аминов 1 или 2
ятность дальнейшего разложения карбоксамида 6
первыми. При изменении порядка подачи аминов,
в изоцианат до введения нового амина. При этом
наоборот, наблюдалось образование симметрич-
не исключается возможность образования симме-
ных мочевин из аминов 3а-d.
тричной мочевины 5f дальнейшей реакцией амина
Для изучения влияния основности исходных
2 с карбоксамидом 6 (схема 3, реакция 3).
аминов на селективность реакции с CDI были взя-
При изучении влияния порядка загрузки реа-
ты амины с сильно различающейся основностью
гентов установлено, что при добавлении амина 2
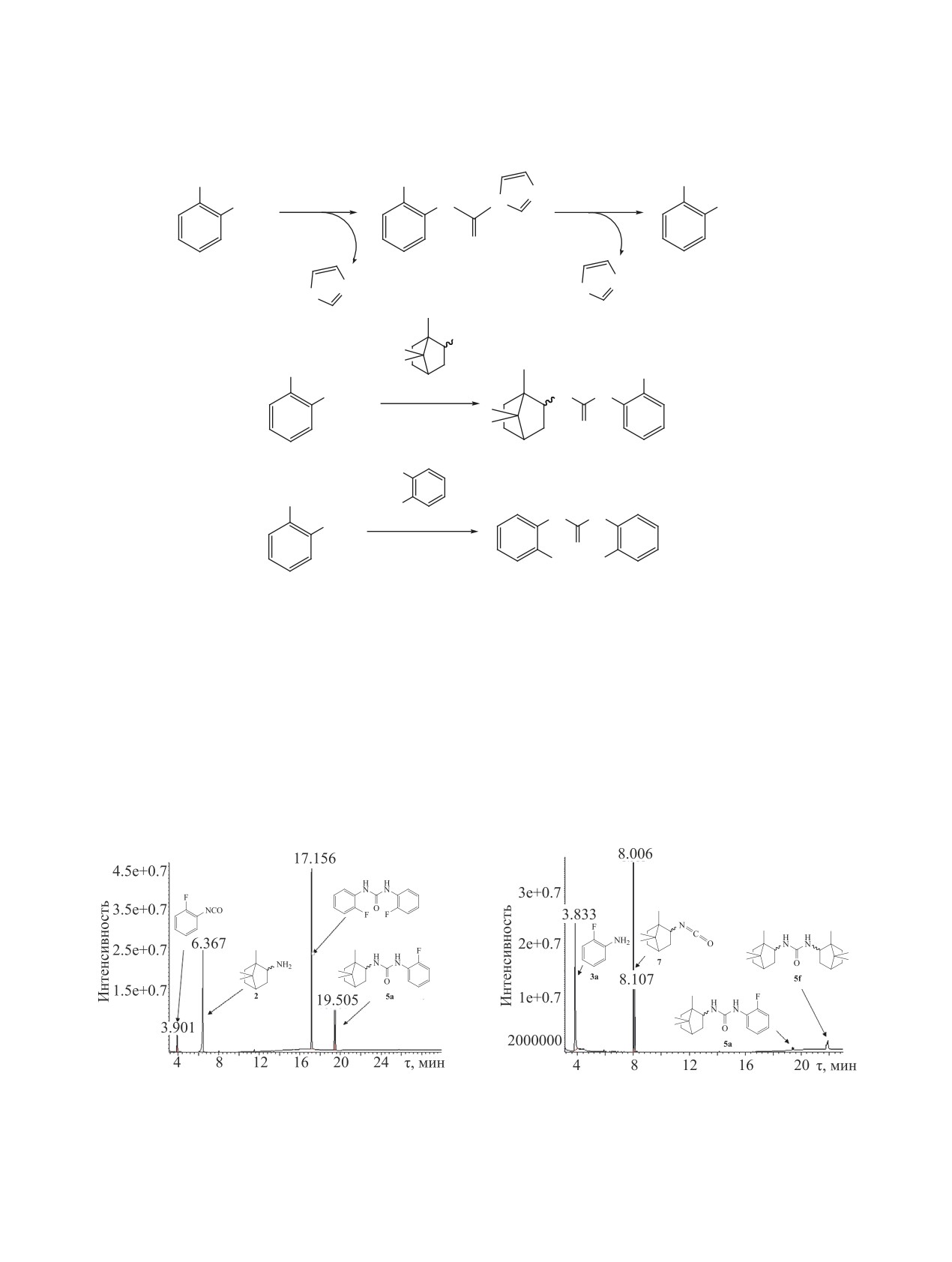
(pKa амина 2 - 9.3 [17], амина 3a - 3.2 [18]). Так
как мочевина 5a не распадается в условиях газо-
(более основный амин) на второй стадии (схема 4)
вой хроматографии (в отличие от адамантановых
мочевина 5f (рис. 2) не образуется, а присутствует
аналогов [19]), было исследовано влияние различ-
симметричная мочевина на основе амина 3a (75%)
ных факторов на протекание реакции.
и несимметричная мочевина 5а (12%).
Схема 3.
CDI, DMF
H
N
NH2
Et3N
N
N
N
(1)
C
O
O
2
6
7
N
N
HN
HN
NH2
H
H
N
2
N
N
(2)
C
O
O
7
5f
H
N
N
N
NH
2
+
(3)
N
HN
O
6
2
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
1684
ПИТУШКИН и др.
Схема 4.
F
CDI, DMF
F
F
H
N
Et3N
∆
NH2
N
N
NCO
O
3a
N
N
HN
HN
NH2
F
F
H
H
NCO
2
N
N
O
5a
H2N
F
H
H
F
3a
N
N
NCO
O
F
F
При изменении порядка введения аминов моче-
Соединения 4a-f также были получены аль-
вины 5а и 5f практически не образуются, в реакци-
тернативным методом из 2-изоцианатобицикло-
онной массе присутствует менее основный исход-
[2.2.1]гептана 8 (схема 5).
ный амин 3а и изоцианат 7 (рис. 3).
Изоцианат 8 был получен действием дифенил-
Однако при добавлении в реакционную мас-
фосфорилазида (ДФФА) на бицикло[2.2.1]-
гептан-2-карбоновую кислоту в толуоле при
су более основного трет-бутиламина (рKа 10.86
перемешивании в присутствии эквимолярного
[20]) происходила его быстрая реакция с изоциана-
количества триэтиламина при температуре 110°C
том 7 с образованием мочевины 5h (рис. 4). Таким
в течение 1 ч (схема 6).
образом, основность амина, вводимого на второй
стадии, играет ключевую роль в получении несим-
Окончание реакции контролировали по
метричной мочевины 5а (рис. 4).
завершению выделения азота из реакционной
Рис. 2. Хроматограмма реакционной массы. Первая
Рис. 3. Хроматограмма реакционной массы. Первая ста-
стадия: 2-фторанилин, CDI и Et3N в ДМФА, 3 ч, 25°С.
дия: 1,7,7-триметилбицикло[2.2.1]гептан-2-амин (2),
Вторая стадия: 1,7,7-триметилбицикло[2.2.1]гептан-2-
CDI и Et3N в ДМФА, 3 ч, 25°С. Вторая стадия: 2-фтор-
амин (2), 8 ч, 60°С.
анилин, 8 ч, 60°С.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : V
1685
массы. Растворитель отгоняли под вакуумом
и продукт 8 отделяли от образовавшейся соли
триэтиламина диэтиловым эфиром.
Структуру полученных соединений подтвер-
ждали методом ЯМР-спектроскопии 1H, 13C, 19F, а
также масс-спектрометрией. В спектрах ЯМР 1H
присутствует характерный сигнал в области 5.75-
5.84 м.д., соответствующий протону NH моче-
винной группы, связанной с бициклическим фраг-
ментом. При этом наличие метильных заместителей
в борнильном радикале не оказывает влияния на
Рис. 4. Хроматограмма реакционной массы. Первая
стадия:
1,7,7-триметилбицикло[2.2.1]гептан-2-амин
химический сдвиг данного сигнала. Исключение
(2), CDI и Et3N в ДМФА, 3 ч, 25°С. Вторая стадия:
составляют соединения 4a и 5a, в спектрах кото-
2-фторанилин, 8 ч, 60°С. Третья стадия: трет-бутил-
рых сигнал NH мочевинной группы, связанной с
амин, 1 ч, 25°С.
Схема 5.
H2N
H
H
F
N
N
3a
O
F
4a, 35%
H2N
H
H
3b
N
N
O
O
H2N
OH
4b, 36%
O
H
H
O
N
N
3c
OH
O
H2N
O
4c, 19%
NCO
N
H
H
N
N
O
3d
8
O
N
4d, 19%
O
H
H
H
H
H2N (CH2)6 NH2
N
N
N
N
3e
(CH2)6
O
O
H2N
4e, 82%
H
H
N
N
1
O
4f, 70%
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
1686
ПИТУШКИН и др.
Схема 6.
O
NH
O
O
Et3N, толуол, 110°C
+
P
+
O
-N
2
O
N3
NCO
OH
P
O
O
O
бициклическим фрагментом, имеет сдвиг 6.75 и
содержащих по две липофильные группы) (см. та-
6.73 м.д. соответственно, что, очевидно, связано с
блицу). Коэффициент липофильности соединения
влиянием атома фтора ароматического кольца.
4c ниже на 1.39 и 1.13 единиц, чем коэффициент
липофильности соединений, содержащих адаман-
В спектрах ЯМР 19F соединений 4a и 5a при-
тильную и
4-трифторметоксифенильную липо-
сутствует сигнал в области -131.32 и -131.39 м.д.
фильные группы.
соответственно, который соответствует атому
фтора в положении 2 ароматического кольца.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Коэффициент липофильности соединений, со-
Исходные 2-фторанилин (≥ 99%, CAS 348-54-9),
держащих бицикло[2.2.1]гептильный фрагмент, на
1,6-диаминогексан (98%, CAS 124-09-4), 1-амино-
1.13 единиц ниже, чем у соединений с 1,7,7-три-
метиладамантан (98%, CAS 17768-41-1), триэтил-
метилбицикло[2.2.1]гептильным фрагментом (на
амин (BioUltra ≥ 99.5%, CAS 121-44-8), ДМФА
2.27 единиц ниже для соединений 4e-5e, 4f-5f,
(Anhydrous 99.8%, CAS 68-12-2) производства
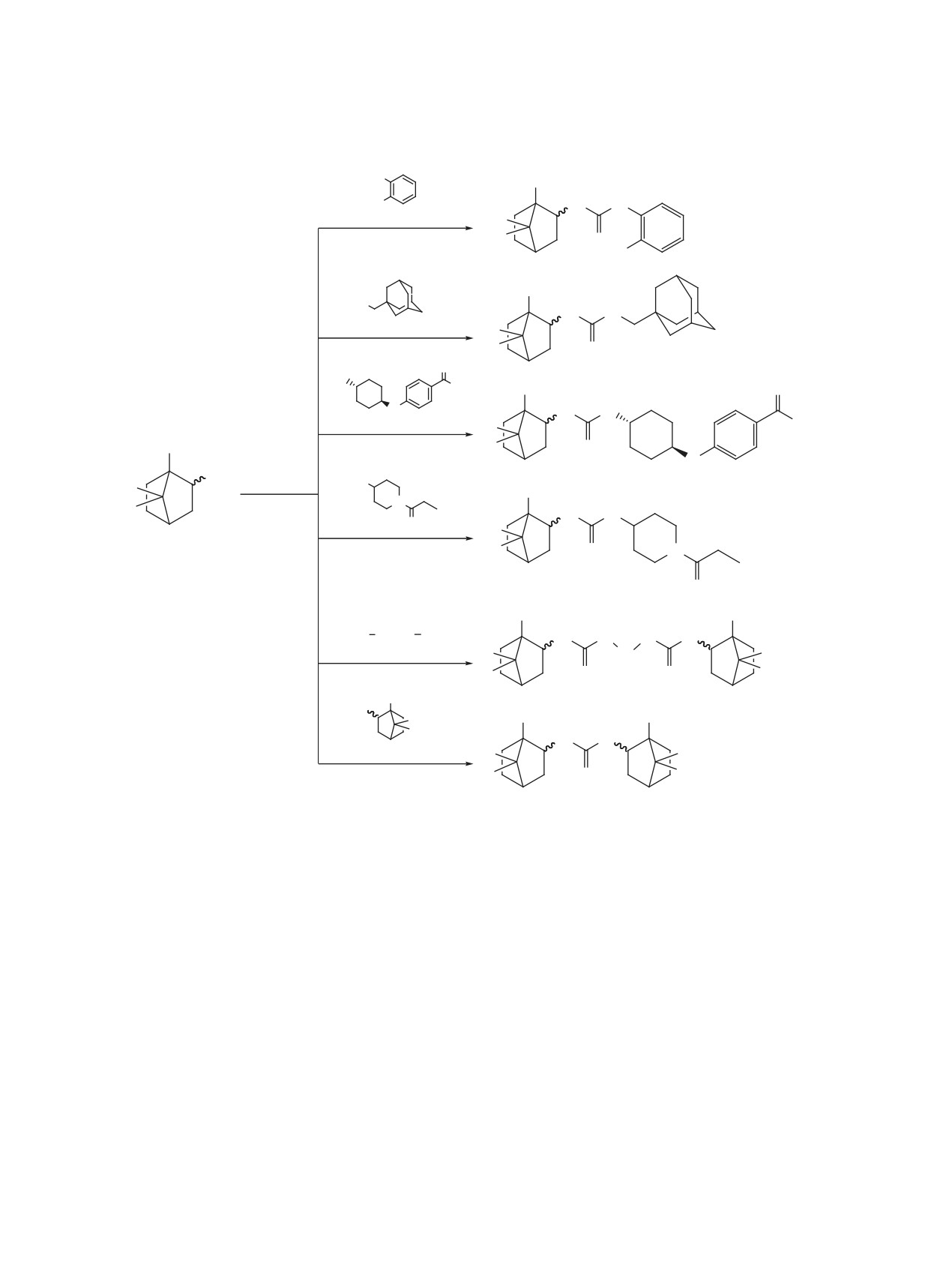
Коэффициенты липофильности, температуры плавления и выходы синтезированных соединений 3a-f и 4a-f.
Соединение
Структура
Mr
logPa
tпл, °C
Выход, %b
4a
248
3.09
189-190
-/22 (35)
4b
302
4.22
228-229
-/35 (36)
4c
372
3.79
324-325
-/18 (19)
412
5.18
250-255 [21]
438
4.92
244-273 [21]
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : V
1687
Таблица. (продолжение).
Соединение
Структура
Mr
logPa
tпл, °C
Выход, %b
4d
293
1.90
111-112
-/3 (19)
4e
390
3.80
185-186
-/73 (82)
4f
248
2.81
258-259
70
5a
290
4.23
224
4/12
5b
344
5.35
296-297
25/26
5c
414
4.92
345-346
94/16
5d
335
3.03
290
3/-
5e
474
6.07
158-159
34/71
5f
332
5.08
332-333
64
b Выход по схеме 2: в порядке понижения основности/в порядке повышения основности, (выход по схеме 5).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
1688
ПИТУШКИН и др.
фирмы «Sigma-Aldrich» использовали без очист-
1-(Бицикло[2.2.1]гептан-2-ил)-3-(2-фторфе-
ки. Исходные транс-[4-(аминоциклогексил)окси]-
нил)мочевина (4a). а. К 0.2 г (1.46 ммоль) би-
бензойная кислота [3], 1-(4-аминопиперидин-1-
цикло[2.2.1]гептан-2-изоцианата (8) в 5 мл без-
ил)пропан-1-он [US2013143925], бицикло[2.2.1]-
водного диэтилового эфира прибавляли 0.162 г
гептан-2-амин
[22] и
1,7,7-триметилбицикло-
(1.46 ммоль)
2-фторанилина
(3а) и
0.21 мл
[2.2.1]гептан-2-амин [22] получены по известным
(1.46 ммоль) триэтиламина. Реакционную смесь
методикам.
перемешивали при комнатной температуре в тече-
ние 12 ч. Растворитель отгоняли при пониженном
Строение полученных соединений подтвержда-
давлении и в реакционную массу добавляли 5 мл
ли с помощью ЯМР 1Н, 13C и 19F спектроскопии,
1 н. HCl и перемешивали еще 30 мин. Выпавший
хроматомасс-спектрометрии и элементного ана-
осадок отфильтровывали и промывали водой.
лиза. Масс-спектры регистрировали на хромато-
Выход 0.13 г (35%).
масс-спектрометре «Agilent GC 5975/MSD 7820»
(Agilent Technologies, США) и «Advion expression»
б. К 0.15 г (1.36 ммоль) 2-фторанилина (3a) в
(Аdvion Inc., США) в режиме full scan (ESI).
5 мл ДМФА прибавляли 0.22 г (1.36 ммоль) CDI
ЯМР 1Н, 13C и 19F выполнены на Bruker Avance
и 0.27 г (2.72 ммоль) триэтиламина. Реакционную
600 (Bruker Corporation, США) в растворителе
массу перемешивали при комнатной темпера-
ДМСО-d6; химические сдвиги 1H приведены от-
туре в течение 3 ч, после чего добавляли 0.2 г
носительно SiMe4. Элементный анализ выполнен
(1.36 ммоль) бицикло[2.2.1]гептан-2-амина ги-
на приборе «Perkin-Elmer Series II 2400» (Perkin-
дрохлорида (1). Реакционную массу перемешива-
Elmer, США).
ли при 60°С еще 8 ч. Далее реакционную массу
охлаждали до комнатной температуры и добав-
Бицикло[2.2.1]гептан-2-изоцианат (8). К 5.0 г
ляли 5 мл 1 н. HCl и перемешивали еще 30 мин.
(35.71 ммоль) бицикло[2.2.1]гептан-2-карбоновой
Выпавший осадок отфильтровывали и промыва-
кислоты, растворенной в 50 мл толуола, прибав-
ли водой. Выход 0.074 г (22%), т.пл. 189-190°C.
ляли 5.15 мл (35.71 ммоль) триэтиламина и 9.82 г
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.04-1.65 м
(35.71 ммоль) дифенилфосфорилазида. Реак-
(8H, 4СH2), 2.17 т (1H, CH, J 4.8 Гц), 2.27 т (1Н,
ционную массу медленно нагревали до кипения
CH, J 4.2 Гц), 3.90 т.д (1Н, CH-NH, J1 8.4, J2
при перемешивании и кипятили 1 ч. Окончание
3.6 Гц), 6.75 т (1H, NH, J 6.0 Гц), 6.90 т.д.д (1H,
реакции контролировали по завершению выделе-
H4аром, J1 8.4, J2 4.2, J3 1.2 Гц), 7.06 т (1H, H5аром,
ния азота из реакционной массы. Спустя 1 ч ре-
J 7.8 Гц), 7.16 д.д.д (1H, H3аром, J1 12.0, J2 8.4, J3
акционную массу охлаждали до комнатной темпе-
1.5 Гц), 8.15 т (1H, H6аром, J 9.6 Гц), 8.02 (1H, NH-
ратуры и отгоняли растворитель при пониженном
Ph). Спектр ЯМР 13C (ДМСО-d6), δ, м.д.: 21.70
давлении. В результате получали маслообразную
(CH2), 29.99 (CH2), 36.68 (CH2-C), 37.76 (CH),
жидкость желтого цвета, из которой продукт экс-
38.11 (CH2), 42.63 (CH-C), 50.88 (C-NCO), 115.08
трагировали диэтиловым эфиром (2 раза по 15 мл).
(C3аром), 115.20 (C1аром), 120.18 (C6аром),
121.67
После отгонки эфира под вакуумом получали про-
(C4аром), 124.80 (C5аром), 151.04 (C=O), 155.08 д
зрачную маслянистую жидкость. Выход 4.20 г
(C-F, J 245.0 Гц). Спектр ЯМР 19F (ДМСО-d6), δ,
(86%). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.02-
м.д.: -131.32. Масс-спектр, m/z (Iотн, %): 248 (5.0)
1.11 м (2H, CH2), 1.44-1.63 м (2H, CH2), 1.77-1.82
[М]+, 137 (3.0) [F-Ph-NCO]+, 111 (100) [F-Ph-
м (1H, CH), 2.01-2.07 м (1H, CH), 2.25 т (1H, CH2,
NH2]+. Найдено, %: С 67.70; Н 6.93; N 11.25; F
J 4.8 Гц), 2.35 т (1H, CH2, J 4.8 Гц), 3.87 д.т.д (1H,
7.66. C14H17FN2О. Вычислено, %: С 67.72; Н 6.90;
CH-NCO, J1 10.8, J2 4.2, J3 3.0 Гц). Спектр ЯМР
N 11.28; F 7.65. М 248.30.
13C (ДМСО-d6), δ, м.д.: 21.86 (CH2), 29.53 (CH2),
36.79 (CH2-C), 37.36 (CH), 39.32 (CH2), 42.30 (CH-
1-(Бицикло[2.2.1]гептан-2-ил)-3-[(адаман-
C), 55.11 (C-NCO), 129.08 (NCO). Масс-спектр,
тан-1-ил)метил]мочевина (4b). а. Получена ана-
m/z (Iотн, %): 137 (15.0) [М]+, 95 (100) [М - NCO]+.
логично соединению 4a из 0.2 г (1.46 ммоль)
Найдено, %: С 70.08; Н 8.05; N 10.22. C8H11NО.
бицикло[2.2.1]гептан-2-изоцианата
(8),
0.293 г
Вычислено, %: С 70.04; Н 8.08; N 10.21. М 137.08.
(1.46 ммоль) 1-адамантилметиламина гидрохло-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : V
1689
рида (3b) и 0.42 мл (2.92 ммоль) триэтиламина.
пан-1-она (3d) и 0.21 мл (1.46 ммоль) триэтилами-
Выход 0.157 г (36%).
на. Выход 0.081 г (19%).
б. Получена аналогично соединению 4a из
б. Получена аналогично соединению 4a из
0.27 г (1.36 ммоль) 1-адамантилметиламина ги-
0.21 г
1-(4-аминопиперидин-1-ил)пропан-1-она
дрохлорида (3b), 0.22 г (1.36 ммоль) CDI, 0.41 г
(3d), 0.22 г (1.36 ммоль) CDI, 0.27 г (2.72 ммоль)
(4.08 ммоль) триэтиламина и 0.2 г (1.36 ммоль)
и 0.2 г (1.36 ммоль) бицикло[2.2.1]гептан-2-амина
бицикло[2.2.1]гептан-2-амина гидрохлорида
(1).
гидрохлорида (1). Выход 0.01 г (3%), т.пл. 111-
Выход 0.144 г (35%), т.пл. 228-229°C. Спектр ЯМР
112°C. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.98 т
1Н (ДМСО-d6), δ, м.д.: 1.04-1.65 м (8H, 4СH2), 1.40
(3H, CH3, J 7.8 Гц), 1.05-1.92 м (12H, 6СH2), 2.11
д (6H, Ad, J 1.8 Гц), 1.63 д.д (6H, Ad, J1 53.4, J2
т (1H, CH, J 4.8 Гц), 2.18 т (1Н, CH, J 4.2 Гц), 2.30
10.8 Гц), 1.91 с (3H, Ad), 2.11 т (1H, CH, J 4.8 Гц),
к [2Н, CH2-C(O), J 7.5 Гц], 2.77 т (1H, CH2-N, J
2.18 т (1Н, CH, J 4.2 Гц), 2.69 т.д (1Н, CH-NH, J1
11.4 Гц), 3.09 т (1H, CH2-N, J 12.6 Гц), 3.55-3.61
8.4, J2 3.6 Гц), 3.78 к (2H, CH2-Ad, J 4.8 Гц), 5.65
м (1H, СH2-N), 3.71 д (1H, CH-NH, J 14.4 Гц),
т (1H, NH-Ad, J 6.0 Гц), 5.84 д (1H, NH-norbornyl,
3.77-3.81 м (1H, СH2-N), 4.12 д (1H, CH-NH, J
J 7.8 Гц). Масс-спектр, m/z (Iотн, %): 302 (45.0)
13.8 Гц), 5.75 с (2H, 2 NH). Масс-спектр, m/z (Iотн,
[М]+, 191 (6.0) [Ad-CH2-NCO]+, 149 (12.0) [Ad-
%): 293 (18.0) [М]+. Найдено, %: С 65.54; Н 9.31; N
CH2]+, 135 (100) [Ad]+, 111 (100) [C7H11-NH2]+.
14.29. C16H27N3О2. Вычислено, %: С 65.50; Н 9.28;
Найдено, %: С 75.47; Н 10.04; N 9.22. C19H30N2О.
N 14.32. М 293.41.
Вычислено, %: С 75.45; Н 10.00; N 9.26. М 302.24.
1,1'-(1,6-Гексан-1,1-диил)бис{3-(бицикло-
4-[(4-{3-(Бицикло[2.2.1]гептан-2-ил)уреидо}-
[2.2.1]гептан-2-ил)мочевина} (4e). а. Получена
циклогексил)окси]бензойная кислота (4c). а.
аналогично соединению 4a из 0.2 г (1.46 ммоль)
Получена аналогично соединению 4a из 0.2 г
бицикло[2.2.1]гептан-2-изоцианата
(8),
0.085 г
(1.46 ммоль) бицикло[2.2.1]гептан-2-изоциана-
(0.73 ммоль) гексан-1,6-диамина (3e) и 0.21 мл
та (8), 0.343 г (1.46 ммоль) 4-[(4-аминоцикло-
(1.46 ммоль) триэтиламина. Выход 0.236 г (82%).
гексил)окси]бензойной кислоты (3c) и 0.42 мл
б. Получена аналогично соединению 3a из
(2.92 ммоль) триэтиламина. Выход 0.103 г (19%).
0.08 г (1.36 ммоль) гексан-1,6-диамина (3e), 0.22 г
б. Получена аналогично соединению 4a из
(1.36 ммоль) CDI, 0.41 г (4.08 ммоль) триэтиламина
0.32 г
(1.36 ммоль)
4-[(4-аминоциклогексил)-
и 0.2 г (1.36 ммоль) бицикло[2.2.1]гептан-2-амина
окси]бензойной кислоты (3c), 0.22 г (1.36 ммоль)
гидрохлорида (1). Выход 0.193 г (73%), т.пл. 185-
CDI, 0.41 г (4.08 ммоль) триэтиламина и 0.2 г
186°C. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.02-
(1.36 ммоль) бицикло[2.2.1]гептан-2-амина ги-
1.92 м (12H, 6СH2), 1.22-1.26 м (4H, 2CH2), 1.33
дрохлорида (1). Выход 0.091 г (18%), т.пл. 324-
д (4H, 2CH2, J 8.4 Гц), 2.11 т (2H, 2CH, J 4.8 Гц),
325°C. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.02-
2.18 т (2Н, 2CH, J 4.2 Гц), 2.92-3.00 м (4H, 2CH2-
2.05 м (16H, 8СH2), 2.11 т (1H, CH, J 4.8 Гц), 2.17
NH), 3.75-3.81 м (2H, 2СH-NH), 5.65 т (1H, NH,
т (1Н, CH, J 4.2 Гц), 3.76-3.81 м (2H, 2СH-NH),
J 5.4 Гц), 5.82 д (1H, NH, J 7.4 Гц). Масс-спектр,
4.40-4.45 м (1H, CH-O), 5.79 т (1H, 2NH, J 8.4 Гц),
m/z (Iотн, %): 425 (100) [М + Cl]+. Найдено, %: С
7.02 д (2Hаром, J 9.0 Гц), 7.86 д (2Hаром, J 9.0 Гц),
67.69; Н 9.80; N 14.34. C22H38N4О2. Вычислено, %:
12.56 уш.с (1H, COOH). Масс-спектр, m/z (Iотн, %):
С 67.66; Н 9.81; N 14.35. М 390.57.
371 (71.8) [М]+. Найдено, %: С 67.75; Н 7.60; N
1,3-Ди(бицикло[2.2.1]гептан-2-ил)мочеви-
7.49. C21H28N2О4. Вычислено, %: С 67.72; Н 7.58;
на (4f). Получена аналогично соединению 3a из
N 7.52. М 372.47.
0.4 г (2.72 ммоль) бицикло[2.2.1]гептан-2-амина
1-(Бицикло[2.2.1]гептан-2-ил)-3-(1-пропио-
гидрохлорида (1), 0.22 г (1.36 ммоль) CDI, 0.41 г
нилпиперидин-4-ил)мочевина (4d). а. Получена
(4.08 ммоль) триэтиламина. Выход 0.236 г (70%),
аналогично соединению 4a из 0.2 г (1.46 ммоль)
т.пл. 258-259°C. Спектр ЯМР 1Н (ДМСО-d6), δ,
бицикло[2.2.1]гептан-2-изоцианата
(8),
0.228 г
м.д.: 1.06-1.59 м (16H, 8СH2), 1.99 т (2H, 2CH, J
(1.46
ммоль)
1-(4-аминопиперидин-1-ил)про-
4.8 Гц), 2.18 т (2Н, 2CH, J 4.2 Гц), 3.35 т.д (2Н,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
1690
ПИТУШКИН и др.
2CH-NH, J1 8.4, J2 3.6 Гц), 5.52 д (2H, 2NH, J
6.0 Гц), 5.82 д (1H, NH-bornyl, J 8.7 Гц). Масс-
9.0 Гц). Масс-спектр, m/z (Iотн, %): 248 (37.0) [М]+,
спектр, m/z (Iотн, %): 344 (85.0) [М]+, 191 (17.0)
137 (4.0) [C7H11-NCO]+, 111 (100) [C7H11-NH2]+,
[Ad-CH2-NCO]+, 153 (33.0) [C11H17-NH2]+, 135
94 (70.0) [C7H12]. Найдено, %: С 72.51; Н 9.76; N
(100) [Ad]+. Найдено, %: С 76.72; Н 10.55; N 8.09.
11.32. C15H24N2О. Вычислено, %: С 72.54; Н 9.74;
C22H36N2О. Вычислено, %: С 76.69; Н 10.53; N
N 11.28. М 248.37.
8.13. М 344.54.
1-(1,7,7-Триметилбицикло[2.2.1]гептан-2-
4-[(4-{3-(1,7,7-Триметилбицикло[2.2.1]геп-
ил)-3-(2-фторфенил)мочевина (5a). К 0.175 г
тан-2-ил)уреидо}циклогексил)окси]бензойная
(1.58 ммоль) 2-фторанилина (3a) в 7 мл диметил-
кислота (5c). Получена аналогично соединению
формамида прибавляли 0.256 г (1.58 ммоль) CDI
5a из 0.3 г (1.58 ммоль) 1,7,7-триметилбицик-
и 0.32 г (3.16 ммоль) триэтиламина. Реакционную
ло[2.2.1]гептан-2-амина гидрохлорида (2), 0.256 г
массу перемешивали при комнатной темпера-
(1.58 ммоль) CDI, 0.48 г (4.74 ммоль) триэтилами-
туре в течение 3 ч, после чего добавляли 0.3 г
на и 0.37 г (1.58 ммоль) 4-[(4-аминоциклогексил)-
(1.58 ммоль)
1,7,7-триметилбицикло[2.2.1]геп-
окси]бензойной кислоты (3c). Выход 0.43 г (94%),
тан-2-амина гидрохлорида (2). Реакционную мас-
т.пл.
345-346°C. Спектр ЯМР 1Н (ДМСО-d6),
су перемешивали при 60°С еще 8 ч. Далее реакци-
δ, м.д.: 0.70 с (3H, CH3), 0.83 с (3H, CH3), 0.88
онную массу охлаждали до комнатной температу-
с (3H, CH3), 1.04-1.72 м (6H, 3СH2), 1.88 д (4H,
ры и добавляли 5 мл 1 н. HCl и перемешивали еще
2CH2, J 13.2 Гц), 2.03 д (4H, 2CH2, J 13.2 Гц), 2.18
30 мин. Выпавший осадок отфильтровывали и про-
т (1Н, CH, J 4.2 Гц), 3.85-3.91 м (2H, 2СH-NH),
мывали водой. Выход 0.054 г (12%), т.пл. 224°C.
4.40-4.47 м (1H, CH-O), 5.86 д (1H, NH, J 7.8 Гц),
5.76 д (1H, NH, J 9.0 Гц), 7.02 д (2Hаром, J 9.0 Гц),
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.76 с (3H,
CH3), 0.81 с (3H, CH3), 0.86 с (3H, CH3), 1.11-1.79
7.86 д (2Hаром, J 9.0 Гц), 12.55 уш.с (1H, COOH).
Масс-спектр, m/z (Iотн, %): 449 (69.6) [М + Cl]+,
м (6H, 3СH2), 2.22-2.28 м (1Н, CH), 3.95-3.99 м
413 (34.6) [M - 1]+. Найдено, %: С 69.50; Н 8.23; N
(1Н, CH-NH), 6.73 д (1H, NH, J 8.4 Гц), 7.00-7.08
6.80. C24H34N2О4. Вычислено, %: С 69.54; Н 8.27;
м (1H, H4аром), 7.15 т (1H, H5аром, J 7.8 Гц), 7.16 д.д.д
N 6.76. М 414.55.
(1H, H3аром, J1 11.7, J2 8.4, J3 1.2 Гц), 8.18 т (1H,
H6аром, J 8.2 Гц), 9.02 с (1H, NH-Ph). Спектр ЯМР
1-(1,7,7-Триметилбицикло[2.2.1]гептан-
19F (ДМСО-d6), δ, м.д.: -131.39. Масс-спектр, m/z
2-ил)-3-(1-пропионилпиперидин-4-ил)мочеви-
(Iотн, %): 290 (5.0) [М]+, 179 (3.0) [C11H17-NCO]+,
на (5d). Получена аналогично соединению 5a
153 (2.0) [C11H17-NH2]+, 137 (3.0) [F-Ph-NCO]+,
из 0.3 г (1.58 ммоль) 1,7,7-триметилбицикло-
111 (100) [F-Ph-NH2]+. Найдено, %: С 70.35; Н
[2.2.1]гептан-2-амина гидрохлорида (2), 0.256 г
8.01; N 9.69; F 6.59. C17H23FN2О. Вычислено, %: С
(1.58 ммоль) CDI, 0.32 г (3.16 ммоль) триэтила-
70.32; Н 7.98; N 9.65; F 6.54. М 290.38.
мина и 0.24 г (1.58 ммоль) 1-(4-аминопипери-
дин-1-ил)пропан-1-она (3d). Выход 0.015 г (3%),
1-(1,7,7-Триметилбицикло[2.2.1]гептан-2-
т.пл. 290°C. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.:
ил)-3-[(адамантан-1-ил)метил]мочевина
(5b).
0.74 с (3H, CH3), 0.83 с (3H, CH3), 0.88 с (3H, CH3),
Получена аналогично соединению 5a из 0.317 г
0.88 т (3H, CH3, J 7.8 Гц), 1.05-1.72 м (10H, 5СH2),
(1.58 ммоль) 1-адамантилметиламина гидрохлори-
2.17 т (1Н, CH, J 4.2 Гц), 2.30 к [2Н, CH2-C(O), J
да (3b), 0.256 г (1.58 ммоль) CDI, 0.48 г (4.74 ммоль)
7.5 Гц], 2.77 т (1H, CH2-N, J 11.4 Гц), 3.08-3.13
триэтиламина и 0.3 г (1.58 ммоль) 1,7,7-триметил-
м (1H, СH2-N), 3.55-3.62 м (1H, СH2-N), 3.71 д
бицикло[2.2.1]гептан-2-амина гидрохлорида
(1).
(1H, CH-NH, J 14.4 Гц), 3.85-3.91 м (1H, СH2-N),
Выход 0.14 г (26%), т.пл. 296-297°C. Спектр ЯМР
4.12 д (1H, CH-NH, J 13.8 Гц), 5.79 с (2H, 2NH).
1Н (ДМСО-d6), δ, м.д.: 0.69 с (3H, CH3), 0.83 с (3H,
Масс-спектр, m/z (Iотн, %): 370 (100) [М + Cl]+.
CH3), 0.88 с (3H, CH3), 1.05-1.65 м (6H, 3СH2),
Найдено, %: С 68.22; Н 9.88; N 12.55. C19H33N3О2.
1.40 д (6H, Ad, J 1.8 Гц), 1.63 д.д (6H, Ad, J1 53.4,
Вычислено, %: С 68.20; Н 9.91; N 12.53. М 335.49.
J2 10.8 Гц), 1.93 с (3H, Ad), 2.17 т.т (1Н, CH, J1 11.4,
J2 3.9 Гц), 2.69 т.д (1Н, CH-NH, J1 8.4, J2 3.6 Гц),
1,1'-(1,6-Гексан-1,1-диил)бис[3-(1,7,7-триме-
3.85-3.91 м (2H, CH2-Ad), 5.67 т (1H, NH-Ad, J
тилбицикло[2.2.1]гептан-2-ил)мочевина]
(5e).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
СИНТЕЗ И СВОЙСТВА 1,3-ДИЗАМЕЩЕННЫХ МОЧЕВИН ... : V
1691
Получена аналогично соединению 5a из 0.092 г
КОНФЛИКТ ИНТЕРЕСОВ
(1.58 ммоль) гексан-1,6-диамина
(3e),
0.256 г
Авторы заявляют об отсутствие конфликта ин-
(1.58 ммоль) CDI, 0.32 г (3.16 ммоль) триэтила-
тересов.
мина и 0.3 г (1.58 ммоль) 1,7,7-триметилбицик-
ло[2.2.1]гептан-2-амина гидрохлорида (2). Выход
СПИСОК ЛИТЕРАТУРЫ
0.26 г (71%), т.пл. 158-159°C. Спектр ЯМР 1Н
1.
Питушкин Д.А., Бурмистров В.В., Бутов Г.М. ЖОрХ.
), 0.83 с (6H,
(ДМСО-d6), δ, м.д.: 0.69 с (6H, 2CH3
2020, 56, 1167-1179. [Pitushkin D.A., Burmistrov V.V.,
2CH3), 0.88 с (6H, 2CH3), 1.05-1.71 м (12H, 6СH2),
Butov G.M. Russ. J. Org. Chem. 2020, 56, 1336-1346.]
1.21-1.27 м (4H, 2CH2), 1.34 д (4H, 2CH2, J 8.4 Гц),
doi 10.1134/S1070428020080023
2.16 т.т (2Н, 2CH, J1 12.0, J2
3.9 Гц), 2.93-3.01 м
2.
Ghosh A.K., Brindisi M. J. Med. Chem. 2020, 63,
(4H, 2CH2–NH), 3.85-3.91 м (2H, 2СH-NH), 5.44
2751-2788. doi 10.1021/acs.jmedchem.9b01541
т (1H, NH, J 8.4 Гц), 5.79 д (1H, NH, J 6.6 Гц).
3.
Hwang S.H., Wecksler A.T., Zhang G., Morisseau C.,
Масс-спектр, m/z (Iотн, %): 510 (100) [М + Cl]+.
Nguyen L.V., Fu S.H., Hammock B.D. Bioorg. Med.
Найдено, %: С 70.86; Н 10.60; N 11.83. C28H50N4О2
Chem. Lett.
2013,
23,
3732-3737. doi
10.1016/
Вычислено, %: С 70.84; Н 10.62; N 11.80. М
j.bmcl.2013.05.011
474.73.
4.
Lee K.S.S., Liu J.Y., Wagner K.M., Pakhomova S.,
Dong H., Morisseau C., Fu S.H., Yang J., Wang P.,
1,3-Ди(1,7,7-бицикло[2.2.1]гептан-2-ил)моче-
Ulu A., Mate C.A., Nguyen L.V., Hwang S.H.,
вина (5f). Получена аналогично соединению 5a
Edin M.L., Mara A.A., Wulff H., Newcomer M.E.,
из 0.6 г (3.16 ммоль) 1,7,7-триметилбицикло-
Zeldin D.C., Hammock B.D. J. Med. Chem. 2015, 57,
[2.2.1]гептан-2-амина гидрохлорида (2), 0.256 г
7016-7030. doi 10.1021/jm500694p
(1.58 ммоль) CDI, 0.48 г (4.74 ммоль) триэтилами-
5.
Burmistrov V., Morisseau C., Lee K.S.S., Shihadih D.S.,
на. Выход 0.33 г (64%), т.пл. 332-333°C. Спектр
Harris T.R., Butov G.M., Hammock B.D. Bioorg.
ЯМР 1Н (ДМСО-d6), δ, м.д.: 0.69 д (6H, 2CH3,
Med. Chem. Lett. 2014, 24, 2193-2197. doi 10.1016/
J 3.0 Гц), 0.83 с (6H, 2CH3), 0.88 с (6H, 2CH3),
j.bmcl.2014.03.016
1.04-1.76 м (12H, 6СH2), 2.17 уш.с (2Н, 2CH),
6.
Shihadih D.S., Harris T.R., Yang J., Merzlikin O.,
3.84-3.91 м (2Н, 2CH-NH), 5.80 т (2H, 2NH, J
Lee K.S.S., Hammock B.D., Morisseau C. Bioorg.
9.0 Гц). Масс-спектр, m/z (Iотн, %): 332 (68.0) [М]+,
Med. Chem. Lett. 2015, 25, 276-279. doi 10.1016/
180 (8.0) [C11H17-NCO]+, 153 (56.0) [C11H17-NH2]+,
j.bmcl.2014.11.053
136 (22.0) [C11H17-NH2], 82 (100). Найдено, %: С
7.
Park S.J., Kim Y.G., Park H.J. J. Am. Chem. Soc.
75.81; Н 10.88; N 8.46. C21H36N2О. Вычислено, %:
2011, 133, 10094-10100. doi 10.1021/ja1098325
С 75.85; Н 10.91; N 8.42. М 332.53.
8.
Cahours A., Hofmann A.W. Liebigs Ann. 1857, 102,
285-311.
ВЫВОДЫ
9.
Kreutzberger A., Tantawy A. J. Fluor. Chem. 1981, 18,
Таким образом, синтезированы две серии
177-183. doi 10.1016/s0022-1139(00)82314-3
1,3-дизамещенных мочевин, содержащих в сво-
10.
Codony S., Valverde E., Leiva R., Brea J., Loza M.I.,
ей структуре бициклические липофильные груп-
Morisseau C., Hammock B.D., Vázquez S. Bioorg.
пы природного происхождения: бицикло[2.2.1]-
Med. Chem.
2019,
27,
115078. doi
10.1016/
гептaн-2-ильную и 1,7,7-триметилбицикло[2.2.1]-
j.bmc.2019.115078
гептaн-2-ильную. Синтезированные мочевины яв-
11.
Wills R.J., Choma N., Buonpane G., Lin A., Keig-
ляются перспективными ингибиторами реплика-
her N. J. Pharm. Sci. 1987, 76, 886-888. doi 10.1002/
ции РНК-вирусов и растворимой эпоксидгидрола-
jps.2600761208
зы человека.
12.
Gray A.P., Platz R.D., Henderson T.R., Chang T.C.P.,
Takahashi K., Dretchen K.L. J. Med. Chem. 1988, 31,
ФОНДОВАЯ ПОДДЕРЖКА
807-814. doi 10.1021/jm00399a022
Исследование выполнено при финансовой под-
13.
Zhang X., Rodrigues J., Evans L., Hinkle B., Ballanty-
держке РФФИ в рамках научного проекта № 19-
ne L., Peña M. J. Org. Chem. 1997, 62, 6420-6423. doi
33-60024.
10.1021/jo970514p
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
1692
ПИТУШКИН и др.
14. Wang X.M., Mao S., Cao L., Xie X.X., Xin M.H.,
18. Asghar B.H. Monatsh. Chem. 2008, 139, 1191-1195.
Lian J.F., Cao Y.X., Zhang S.Q. Bioorg. Med. Chem.
doi 10.1007/s00706-008-0913-5
2015, 23, 5662-5671. doi 10.1016/j.bmc.2015.07.017
19. Кузнецов Д.В., Бурмистров В.В., Бутов Г.М. Изв.
ВолгГТУ. 2018, 222, 7-13.
15. Burmistrov V., Morisseau C., D’yachenko V., Ryba-
20. Bunting J., Stefanidis D. J. Am. Chem. Soc. 1990, 112,
kov V.B., Butov G.M., Hammock B.D. J. Fluor.
779-786. doi 10.1021/ja00158a043
Chem.
2019,
220,
48-53. doi
10.1016/j.
21. Hwang S.H., Tsai H.J., Liu J.Y., Morisseau C.,
jfluchem.2019.02.005
Hammock B.D. J. Med. Chem. 2007, 50, 3825-3840.
16. Burmistrov V., Morisseau C., Harris T.R., Butov G.,
doi 10.1021/jm070270t
Hammock B.D. Bioorg. Chem. 2018, 76, 510-527. doi
22. Novakov I.A., Nawrozkij M.B., Mkrtchyan A.S.,
10.1016/j.bioorg.2017.12.024
Voloboev S.N., Vostrikova O.V., Vernigora A.A.,
17. Zahradnik R. Collect. Czech. Chem. Commun. 1959,
Brunilin R.V. Russ. J. Org. Chem. 2019, 55, 1742-
24, 3422-3433. doi 10.1135/cccc19593422
1748. doi 10.1134/S1070428019110162
Synthesis and Properties of 1,3-Disubstituted Urea
and its Isosteric Analogs Containing Polycyclic Fragments:
V. 1-(Bicyclo[2.2.1]heptan-2-yl)-3-R
and 1-(1,7,7-Bicyclo[2.2.1]heptan-2-yl)-3-R Ureas
D. A. Pitushkina, b, V. V. Burmistrova, b, M. H. Abbas Saeefa,
A. A. Vernigoraa, and G. M. Butova, b, *
a Volgograd State Technical University (VSTU), 400005, Russia, Volgograd, pr. Lenina 28
b Volzhsky polytechnic institute (branch) VSTU,
404121, Russia, Volgograd obl., Volzhsky, ul. Engelsa 42a
*e-mail: butov@post.volpi.ru
Received June 15, 2020; revised June 22, 2020; accepted June 23, 2020
By the reaction of bicyclo[2.2.1]heptane-2-yl isocyanate with amines on the basis of which powerful inhibitors
of soluble epoxide hydrolase were previously obtained, a series of 1,3-disubstituted ureas containing in their
structure a bicyclic lipophilic group of natural origin were synthesized with a yield up to 94%. Synthesized ureas
are promising inhibitors of RNA virus replication and human soluble epoxide hydrolase.
Keywords: natural compounds, bicyclo[2.2.1]heptan, isocyanate, urea, halogen containing anilines, soluble
epoxide hydrolase, coronavirus, SARS-CoV
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020