ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 11, с. 1761-1767
УДК 547.833 + 547.859
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
ЧАСТИЧНО ГИДРОГЕНИЗИРОВАННЫХ
ПРОИЗВОДНЫХ 1-АМИНОПИРИМИДО-
[4,5-c]ИЗОХИНОЛИНОВ
© 2020 г. Е. Г. Пароникян, Ш. Ш. Дашян*, Г. М. Степанян
Научно-технологический центр Органической и Фармацевтической химии НАН Республики Армении,
0014, Республика Армения, г. Ереван, пр. Азатутян 26
*e-mail: Shdashyan@gmail.com
Поступила в редакцию 20 августа 2020 г.
После доработки 28 августа 2020 г.
Принята к публикации 29 августа 2020 г.
Разработан однореакторный метод синтеза 3-амино-2-арил-1,2,5,6,7,8-гексагидроизохинолин-1-онов
нуклеофильным замещением в положении 1 пиридинового кольца. На основе последних синтезированы
производные 1-амино-7,8,9,10-тетрагидропиримидо[4,5-c]изохинолина. Исследованы биологические
свойства синтезированных соединений.
Ключевые слова: тетрагидроизохинолин, пиридо[2,3-d]пиримидин, пиримидо[4,5-c]изохинолин, анти-
бактериальная и противоопухолевая активность.
DOI: 10.31857/S0514749220110117
Гетероциклическая система пиримидо[4,5-c]-
изучению их антибактериальной и противоопухо-
изохинолина состоит из пиридо[2,3-d]пиримиди-
левой активности.
на, конденсированного с циклогексановым коль-
В качестве исходных веществ для синтеза
цом, и представляет интерес с точки зрения биоло-
целевых соединений служили
3-амино-2-арил-
гической активности.
1,2,5,6,7,8-гексагидроизохинолинтионы 5a-h [5].
Производные пиридо[2,3-d]пиримидина нашли
Нами было реализовано взаимодействие пириди-
применение в медицине. Так, пипемидовая (1) и
нотионов 5a-h с гидразингидратом, приведшее к
пиромидовая (2) кислоты являются антибактери-
перегруппировке пиридинового кольца с образо-
альными средствами [1, 2], а пиритрексим (3) -
ванием 1-гидразино-3-ариламино-5,6,7,8-тетраги-
противоопухолевым препаратом [3].
дроизохинолинов [5]. В настоящей работе иссле-
дованы свойства пиридинтионов 2a-h в среде
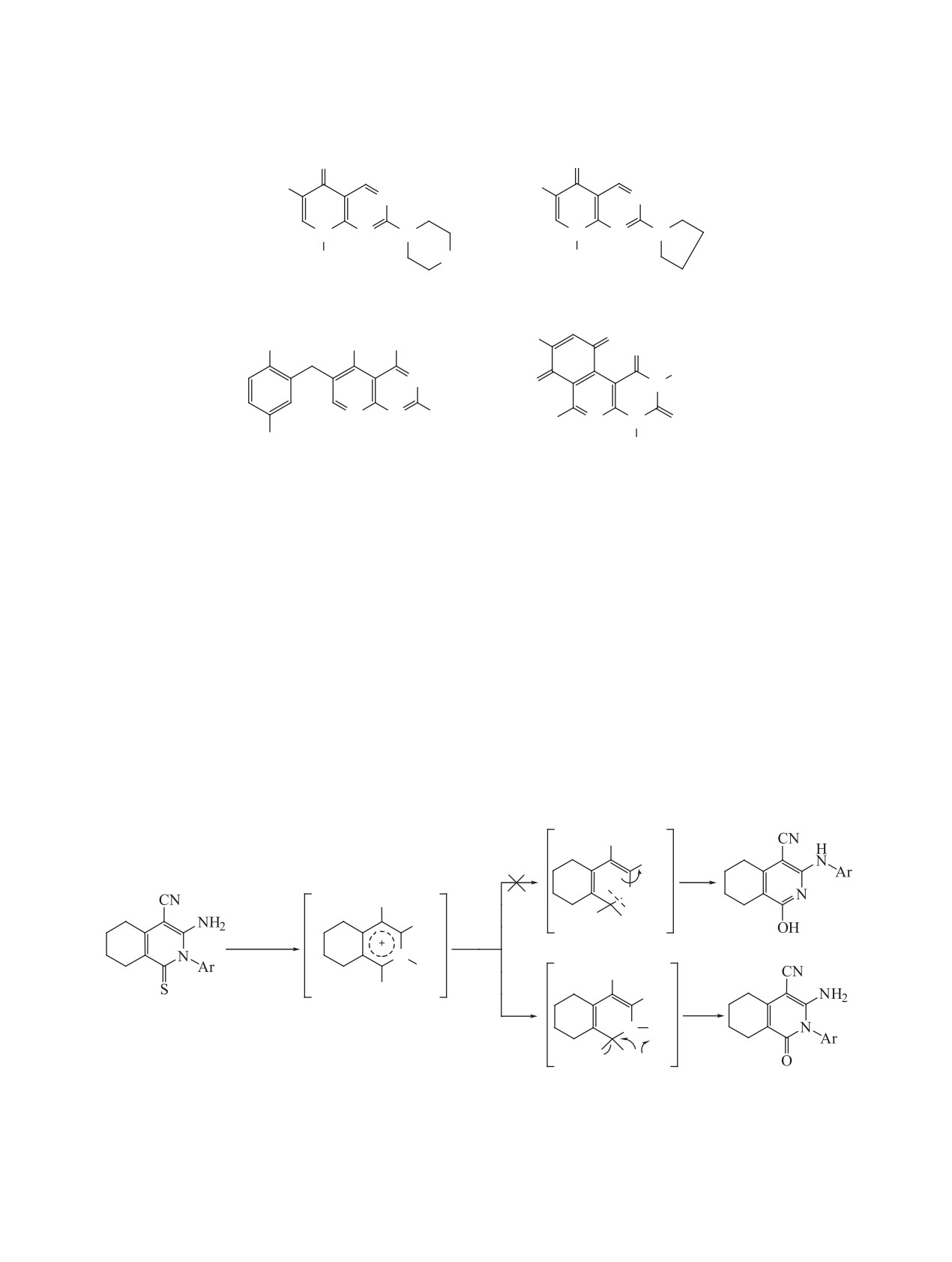
Данных о производных пиримидо[4,5-c]изо-
гидроксида калия. В данном случае потребова-
хинолинов в литературе очень мало. Нам удалось
лось повышение электрофильности атома C1 пи-
найти лишь одну работу, посвященную синтезу
ридинового кольца переходом к пиридинниевым
производных 8-фениламино[4,5-c]изохинолинов 4
солям 6a-h за счет взаимодействия пиридинтио-
(см. рисунок), обладающих противоопухолевой
нов 5a-h с диметильсульфатом. Далее осущест-
активностью [4].
влено взаимодействие пиридиниевых солей 6a-h
Предлагаемое исследование посвящено полу-
однореакторным методом без выделения послед-
чению производных 5,6,7,8-тетрагидроизохиноли-
них с метанольным раствором гидроксида калия.
на, пиримидо[4,5-c]изохинолинов на их основе и
Предполагалось, что, как и в случае с гидразинги-
1761
1762
ПАРОНИКЯН и др.
O
O
HOOC
HOOC
N
N
N N
N
N N
N
C2H5
NH
C2H5
1
2
ArHN
O
OCH3
CH3
NH2
O
CH3
N
O
N
N N
NH2
R
N N O
OCH3
CH3
3
4
Структурные формулы некоторых активных препаратов (1, 2, 3, 4).
дратом, взаимодействие приведет к образованию
6.18 м.д., а в спектре ЯМР 13C - сигналы CO-
3-ариламинозамещенных пиридинов 7. Однако ока-
группы при 159.7-160.3 м.д.
залось, что реакция протекает без перегруппиров-
Конденсацией
2-арилзамещенных
3-амино-
ки пиридинового кольца по механизму нуклео-
пиридин-1-онов 8a-h с формамидом с высокими
фильного замещения с образованием соответству-
выходами синтезированы производные
1-ами-
ющих 2-арилзамещенных 3-аминопиридин-1-онов
но-7,8,9,10-тетрагидропиримидо[4,5-c]изохиноли-
8a-h (схема 1).
на 9a-h (схема 2).
В ИК спектрах соединений 8a-h присутству-
ют полосы поглощений NH2, CN и CO групп в
В ИК спектрах соединений 9a-h имеются по-
области 3209-3446, 2195-2220 и 1660-1665 см-1,
лосы поглощения в области 3310-3480 и 1650-
соответственно. В спектре ЯМР 1H последних сиг-
1670 см-1, характерные для NH2- и CO-групп, со-
налы протонов NH2-групп наблюдаются при 5.89-
ответственно, и отсутствуют полосы поглощения,
Схема 1.
CN
NH2
N Ar
CN
NH2
KOH,
MeS OH
(CH3)2SO4
MeOH
7
10 мин,
N
∆, 1.5 ч
Ar
100-110°C
CN
-
CH3SO4
SCH3
NH2
5a-h
6a-h
N
Ar
MeS O H
8a-h
Ar = C6H5 (а); 2-CH3C6H4 (b); 3-CH3C6H4 (c); 4-CH3C6H4 (d); 2-CH3OC6H4 (e);
3-CH3OC6H4 (f); 4-CH3OC6H4 (g); 4-ClC6H4 (h).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЧАСТИЧНО ГИДРОГЕНИЗИРОВАННЫХ
1763
Схема 2.
CN
NH2
NH2
HCONH2
N
N
∆, 4 ч
Ar
O
N N
O
Ar
8a-h
9a-h
Ar = C6H5 (а); 2-CH3C6H4 (b); 3-CH3C6H4 (c); 4-CH3C6H4 (d); 2-CH3OC6H4 (e);
3-CH3OC6H4 (f); 4-CH3OC6H4 (g); 4-ClC6H4 (h).
характерные для CN-группы. В спектрах ЯМР 1H
мышей - саркоме 180 [7]. В химиотерапевтических
сигналы протонов NH2-групп находятся в области
опытах соединения испытали в виде взвеси в 0.5%
6.67-7.06 м.д., а в спектре ЯМР 13C сигналы CO-
растворе карбоксиметилцеллюлозы в дозах 1/15 от
группы при - 160.7-161.6 м.д.
ЛД100. Испытуемые вещества вводили животным
внутрибрюшинно спустя 48 ч после перевивки
На основании литературных данных о выра-
женной антибактериальной и противоопухолевой
опухоли ежедневно в течение 6 дней. Контрольные
активности пиридо[2,3-d]пиримидинов [1-3] все
животные в те же сроки опыта получали эквива-
синтезированные соединения протестированы на
лентный объем растворителя. Противоопухолевую
антибактериальную и противоопухолевую актив-
активность оценивали через 48 ч после последней
ность.
инъекции по проценту торможения роста опухоли
(Т, %) по отношению к контролю.
Антибактериальную активность изучали по
методу «диффузия в агаре» [6]. В опытах исполь-
При изучении острой токсичности испытуемых
зовали грамположительные (Staphylococcus aureus
соединений установлено, что они малотоксичны,
209p) и грамотрицательные (Sh. Flexneri 6858, E.
их ЛД100 колеблется в пределах 2000-2500 мг/кг,
coli 0-55) бактерии. Исследования показали, что
а максимальная переносимая доза (МПД) - 1200-
2-арилзамещенные 3-аминопиридин-1-оны 8a-h
1500 мг/кг. Химиотерапевтические опыты показа-
и
1-амино-7,8,9,10-тетрагидропиримидо[4,5-c]-
ли, что в ряду 2-арилзамещенных 3-аминопири-
изохинолины 9a-h проявляют слабую антибакте-
дин-1-онов 8a-h умеренную противоопухолевую
риальную активность в отношении всех использо-
активность проявляют 8d, e, h, угнетая рост сар-
ванных штаммов (d = 10-20 мм).
комы 180 на 48.6-50.5% (р = 0.05), a в ряду пири-
Противоопухолевую активность синтезирован-
мидо[4,5-c]изохинолинов 9a-h соединения 9d, e, h
ных соединений изучали на перевиваемой опухоли
обладают 35.2-44.8% активностью (см. таблицу).
Противоопухолевая активность 2-арилзамещенных 3-аминопиридин-1-онов (8d, e, h) и 1-амино-7,8,9,10-тетрагидро-
пиримидо[4,5-c]изохинолинов (9d, e, h).
Токсичность, мг/кг
Противоопухолевая активность на саркоме 180
Соединение
Ar
ЛД100
МПД
Доза, мг/кг
Т, %
р
8d
4-CH3C6H4
2500
1500
200
49.6
<0.05
8e
2-OCH3C6H4
2000
1200
150
48.6
<0.05
8h
4-ClC6H4
2500
1500
200
50.5
<0.05
9d
4-CH3C6H4
2500
1500
200
44.8
<0.05
9e
2-OCH3C6H4
2500
1500
150
35.2
=0.05
9h
4-ClC6H4
2500
1500
200
42.8
=0.05
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
1764
ПАРОНИКЯН и др.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1660 (C=O). Спектр ЯМР 1Н (ДМСО-d6-CCl4,
1:3), δ, м.д.: 1.68-1.85 м (4H, 6,7-CH2), 2.10 с (3H,
ИК спектры регистрировали на спектрометре
CH3), 2.27-2.34 м (2H, 8-CH2), 2.57-2.65 м (2H,
Nicolet Avatar 330 FT-IR (США) в вазелиновом
5-CH2), 5.92 уш.с (2H, NH2), 7.05-7.11 м (1Hаром),
масле. Спектры ЯМР 1Н и 13С (δ, м.д.; КССВ J,
7.34-7.44 м (3Hаром). Спектр ЯМР 13C (ДМСО-d6-
Гц) зарегистрированы на приборе Mercury 300
CCl4, 1:3), δ, м.д.: 16.7, 21.5, 21.7, 22.5, 27.5, 70.2,
Vx (США) с частотой 300 и 75.462 МГц, соот-
113.0, 116.4, 127.2, 128.2, 129.0, 131.1, 133.8, 135.9,
ветственно, внутренний стандарт - ТМС. При
146.3, 153.1, 159.7. Найдено, %: C 73.03; H 6.17; N
отнесении сигналов в спектрах ЯМР 1H и 13C ис-
14.96. С17Н17N3O. Вычислено, %: C 73.10; H 6.13;
пользован метод DEPT. Элементный анализ вы-
N 15.04.
полнен на приборе Elemental Analyzer Euro EA
3000 (Германия). Температуры плавления опре-
3-Амино-2-(3-метилфенил)-1-оксо-1,2,5,-
делены на микронагревательном столике Boetius
6,7,8-гексагидроизохинолин-4-карбонитрил
(Германия). В работе использовали коммерческие
(8c). Выход 2.01 г (72%), т.пл. 247-248°C. ИК
реактивы фирм «Fluka» (Германия), «Aldrich»,
спектр, ν, см-1: 3444, 3327, 3214 (NH2), 2200 (CN),
1665 (C=O). Спектр ЯМР 1Н (ДМСО-d6-CCl4, 1:3),
«Sigma» (США). Растворители очищали по стан-
дартным методикам.
δ, м.д.: 1.66-1.82 м (4H, 6,7-CH2), 2.24-2.31 м (2H,
),
8-CH2), 2.44 с (3H, CH3), 2.54-2.61 м (2H, 5-CH2
2-Арилзамещенные 3-аминопиридин-1-оны
5.94 уш.с (2H, NH2), 6.93-7.00 м (2Hаром), 7.30 уш.д
8a-h (общая методика). Смесь 10 ммоль соот-
(1Hаром, J 7.7 Гц), 7.44 т (1Hаром, J 7.7 Гц). Спектр
ветствующего 3-амино-2-арил-1,2,5,6,7,8-гексаги-
ЯМР 13C (ДМСО-d6-CCl4, 1:3), δ, м.д.: 20.7, 21.5,
дроизохинолинтиона 5a-h и 1.51 г (12 ммоль) ди-
21.7, 22.6, 27.5, 70.3, 113.0, 116.5, 125.2, 128.8,
метилсульфата нагревали 10 мин при 100-110°C.
129.3, 129.4, 129.5, 134.6, 139.3, 146.1, 153.4, 160.3.
В результате реакции получали пиридиниевые
Найдено, %: C 73.17; H 6.09; N 15.12. С17Н17N3O.
соли 6a-h, к которым добавляли раствор 1.20 г
Вычислено, %: C 73.10; H 6.13; N 15.04.
(30 ммоль) едкого кали в 20 мл метанола. Смесь
3-Амино-2-(4-метилфенил)-1-оксо-1,2,5,-
кипятили с обратным холодильником 1.5 ч. После
6,7,8-гексагидроизохинолин-4-карбонитрил
охлаждения к смеси прибавляли 15 мл воды, обра-
(8d). Выход 2.10 г (75%), т.пл. 306-307°C. ИК
зовавшиеся кристаллы отфильтровывали, промы-
спектр, ν, см-1: 3440, 3325, 3209 (NH2), 2195 (CN),
вали водой, сушили и перекристаллизовывали из
1663 (C=O). Спектр ЯМР 1Н (ДМСО-d6-CCl4, 1:3),
нитрометана.
), 2.25-2.31 м (2H,
δ, м.д.: 1.67-1.82 м (4H, 6,7-CH2
3-Амино-1-оксо-2-фенил-1,2,5,6,7,8-гекса-
8-CH2), 2.45 с (3H, CH3), 2.55-2.61 м (2H, 5-CH2),
гидроизохинолин-4-карбонитрил
(8а). Выход
5.89 уш.с (2H, NH2), 7.03-7.09 м (2Hаром), 7.32-
2.07 г (78%), т.пл. 278-279°C. ИК спектр, ν, см-1:
7.38 м (2Hаром). Спектр ЯМР 13C (ДМСО-d6-CCl4,
3441, 3328, 3215 (NH2), 2205 (CN), 1662 (C=О).
1:3), δ, м.д.: 20.7, 21.5, 21.7, 22.6, 27.5, 70.3, 113.1,
Спектр ЯМР 1Н (ДМСО-d6-CCl4, 1:3), δ, м.д.: 1.67-
116.5, 128.0, 130.2, 132.0, 138.3, 146.1, 153.5, 160.3.
1.82 м (4H, 6,7-CH2), 2.28 т (2H, 8-CH2, J 5.9 Гц),
Найдено, %: C 72.98; H 6.18; N 15.15. С17Н17N3O.
2.58 т (2H, 5-CH2, J 5.8 Гц), 5.94 уш.с (2H, NH2),
Вычислено, %: C 73.10; H 6.13; N 15.04.
7.16-7.21 м (2Hаром), 7.47-7.60 м (2Hаром). Спектр
3-Амино-2-(2-метоксифенил)-1-оксо-1,2,5,-
ЯМР 13C (ДМСО-d6-CCl4, 1:3), δ, м.д.: 21.5, 21.7,
6,7,8-гексагидроизохинолин-4-карбонитрил
22.5, 27.5, 70.4, 113.1, 116.5, 128.4, 128.7, 129.5,
(8е). Выход 2.24 г (76%), т.пл. 224-225°C. ИК
134.7, 146.2, 153.4, 160.2. Найдено, %: C 72.51; H
спектр, ν, см-1: 3437, 3331, 3214 (NH2), 2216 (CN),
5.64; N 15.71. C16H15N3O. Вычислено, %: C 72.43;
1665 (C=O). Спектр ЯМР 1Н (ДМСО-d6-CCl4,
H 5.70; N 15.84.
1:3), δ, м.д.: 1.69-1.85 м (4H, 6,7-CH2), 2.26-2.34
3-Амино-2-(2-метилфенил)-1-оксо-1,2,5,-
м (2H, 8-CH2), 2.55-2.64 м (2H, 5-CH2), 3.83 с (3H,
6,7,8-гексагидроизохинолин-4-карбонитрил
OCH3), 5.91 уш.с (2H, NH2), 7.04-7.19 м (3Hаром),
(8b). Выход 2.12 г (76%), т.пл. 239-240°C. ИК
7.43-7.52 м (1Hаром). Спектр ЯМР 13C (ДМСО-d6-
спектр, ν, см-1: 3446, 3330, 3211 (NH2), 2196 (CN),
CCl4, 1:3), δ, м.д.: 21.5, 21.7, 22.6, 27.5, 55.2, 70.1,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЧАСТИЧНО ГИДРОГЕНИЗИРОВАННЫХ
1765
112.5, 112.8, 116.7, 120.8, 122.9, 129.5, 130.4, 146.1,
1-Амино-5-фенил-7,8,9,10-тетрагидропи-
153.6, 154.8, 159.9. Найдено, %: C 69.21; H 5.83; N
римидо[4,5-c]изохинолин-6(5H)-он (9a). Выход
14.17. С17Н17N3O2. Вычислено, %: C 69.14; H 5.80;
2.37 г (81%), т.пл. 340-342°C. ИК спектр, ν, см-1:
N 14.23.
3450, 3348, 3315 (NH2), 1650 (C=O). Спектр ЯМР
1Н (ДМСО-d6), δ, м.д.: 1.66-1.78 м (4H, 8,9-CH2),
3-Амино-2-(3-метоксифенил)-1-оксо-1,2,5,-
2.42-2.50 м (2H, 7-CH2), 3.00-3.08 м (2H, 10-
6,7,8-гексагидроизохинолин-4-карбонитрил
CH2), 7.06 уш.с (2H, NH2), 7.12-7.17 м (2Hаром),
(8f). Выход 2.33 г (79%), т.пл. 238-239°C. ИК
7.36-7.50 м (3Hаром), 8.00 с (1H, 3-CH). Спектр
спектр, ν, см-1: 3441, 3325, 3216 (NH2), 2218 (CN),
ЯМР 13C (ДМСО-d6), δ, м.д.: 20.8, 22.0, 24.4, 28.7,
1662 (C=O). Спектр ЯМР 1Н (ДМСО-d6-CCl4, 1:3),
97.7, 126.0, 127.5, 128.7, 128.9, 137.9, 142.9, 154.3,
δ, м.д.: 1.70-1.83 м (4H, 6,7-CH2), 2.24-2.31 м (2H,
155.4, 160.5, 161.5. Найдено, %: C 69.74; H 5.46; N
8-CH2), 2.53-2.60 м (2H, 5-CH2), 3.85 с (3H, OCH3),
19.28. С17Н16N4O. Вычислено, %: C 69.85; H 5.52;
5.95 уш.с (2H, NH2), 6.76-6.82 м (2Hаром), 7.03-
N 19.17.
7.09 м (1Hаром), 7.42-7.48 м (1Hаром). Найдено, %:
C 69.08; H 5.85; N 14.15. С17Н17N3O2. Вычислено,
1-Амино-5-(2-метилфенил)-7,8,9,10-тетра-
гидропиримидо[4,5-c]изохинолин-6(5H)-он (9b).
%: C 69.14; H 5.80; N 14.23.
Выход 2.36 г (77%), т.пл. 278-280°C. ИК спектр,
3-Амино-2-(4-метоксифенил)-1-оксо-1,2,5,-
ν, см-1: 3467, 3383, 3324 (NH2), 1660 (C=O).
6,7,8-гексагидроизохинолин-4-карбонитрил
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.75-1.87 м
(8g). Выход 2.16 г (73%), т.пл. 290-291°C. ИК
(4H, 8,9-CH2), 1.95 с (3H, CH3), 2.49-2.55 м (2H,
спектр, ν, см-1: 3439, 3327, 3220 (NH2), 2215 (CN),
7-CH2), 3.03-3.09 м (2H, 10-CH2), 6.76 уш.с (2H,
1660 (C=O). Спектр ЯМР 1Н (ДМСО-d6-CCl4,
NH2), 6.91-6.95 м (1Hаром), 7.23-7.32 м (3Hаром),
1:3), δ, м.д.: 1.70-1.79 м (4H, 6,7-CH2), 2.25-2.33
7.92 с (1H, 3-CH). Спектр ЯМР 13C (ДМСО-d6), δ,
м (2H, 8-CH2), 2.56-2.62 м (2H, 5-CH2), 3.83 с (3H,
м.д.: 17.2, 20.7, 22.0, 24.2, 28.6, 97.7, 125.9, 126.1,
OCH3), 5.93 уш.с (2H, NH2), 7.02-7.18 м (4Hаром).
127.3, 128.2, 129.8, 135.1, 136.9, 142.3, 153.7, 155.0,
Найдено, %: C 69.25; H 5.76; N 14.31. С17Н17N3O2.
160.3, 160.7. Найдено, %: C 70.48; H 5.97; N 18.17.
Вычислено, %: C 69.14; H 5.80; N 14.23.
С18Н18N4O. Вычислено, %: C 70.57; H 5.92; N
3-Амино-2-(4-хлорфенил)-1-оксо-1,2,5,6,7,8-
18.29.
гексагидроизохинолин-4-карбонитрил (8h). Вы-
1-Амино-5-(3-метилфенил)-7,8,9,10-тетра-
ход 2.43 г (81%), т.пл. 258-260°C. ИК спектр, ν,
гидропиримидо[4,5-c]изохинолин-6(5H)-он (9c).
см-1: 3445, 3338, 3224 (NH2), 2218 (CN), 1662
Выход 2.39 г (78%), т.пл. 280-282°C. ИК спектр, ν,
(C=O). Спектр ЯМР 1Н (ДМСО-d6-CCl4, 1:3), δ,
см-1: 3474, 3368, 3320 (NH2), 1665 (C=O). Спектр
м.д.: 1.66-1.82 м (4H, 6,7-CH2), 2.23-2.32 м (2H,
ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.75-1.86 м (4H, 8,9-
8-CH2), 2.53-2.62 м (2H, 5-CH2), 6.18 уш.с (2H,
CH2), 2.43 с (3H, CH3), 2.45-2.54 м (2H, 7-CH2),
NH2), 7.13-7.20 м (2Hаром), 7.50-7.57 м (2Hаром).
3.00-3.09 м (2H, 10-CH2), 6.72 уш.с (2H, NH2),
Спектр ЯМР 13C (ДМСО-d6-CCl4, 1:3), δ, м.д.:
6.81-6.90 м (2Hаром), 7.19 уш.д (1Наром, J 7.6 Гц),
21.5, 21.7, 22.5, 27.5, 70.4, 112.8, 116.5, 129.7, 130.2,
7.33 т (1Наром, J 7.6 Гц), 7.91 с (1H, 3-CH). Спектр
133.5, 134.1, 146.5, 153.5, 160.2. Найдено, %: C
ЯМР 13C (ДМСО-d6), δ, м.д.: 20.7, 22.0, 24.2, 28.6,
64.19; H 4.75; N 13.93. С16Н14ClN3O. Вычислено,
97.7, 125.5, 126.1, 127.7, 128.0, 129.0, 137.4, 137.5,
%: C 64.11; H 4.71; N 14.02.
142.1, 154.2, 154.8, 160.2, 161.1. Найдено, %: C
70.65; H 5.88; N 18.21. С18Н18N4O. Вычислено, %:
1-Амино-7,8,9,10-тетрагидропиримидо-
C 70.57; H 5.92; N 18.29.
[4,5-c]изохинолины
9a-h (общая методика).
Смесь 10 ммоль соответствующего соединения
1-Амино-5-(4-метилфенил)-7,8,9,10-тетра-
8a-h и 20 мл формамида кипятили с обратным
гидропиримидо[4,5-c]изохинолин-6(5H)-он (9d).
холодильником 4 ч. После охлаждения образо-
Выход 2.33 г (76%), т.пл. 275-277°C. ИК спектр,
вавшиеся кристаллы отфильтровывали, промыва-
ν, см-1: 3465, 3357, 3323 (NH2), 1667 (C=O).
ли водой, этанолом и перекристаллизовывали из
Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.75-1.85 м
ДМФА.
(4H, 8,9-CH2), 2.45 с (3H, CH3), 2.48-2.52 м (2H,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
1766
ПАРОНИКЯН и др.
7-CH2), 3.00-3.06 м (2H, 10-CH2), 6.70 уш.с (2H,
1-Амино-5-(4-хлорфенил)-7,8,9,10-тетра-
NH2), 6.90-6.92 м (2Hаром), 7.22-7.28 м (2Наром),
гидропиримидо[4,5-c]изохинолин-6(5H)-он (9h).
7.89 с (1H, 3-CH). Спектр ЯМР 13C (ДМСО-d6), δ,
Выход 2.56 г (78%), т.пл. 325-327°C. ИК спектр, ν,
м.д.: 20.7, 20.8, 22.0, 24.4, 28.6, 97.7, 125.9, 128.5,
см-1: 3480, 3356, 3310 (NH2), 1650 (C=O). Спектр
129.2, 135.2, 136.7, 142.8, 154.4, 155.3, 160.5, 161.6.
ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.75-1.85 м (4H, 8,9-
Найдено, %: C 70.51; H 5.96; N 18.37. С18Н18N4O.
CH2), 2.47-2.53 м (2H, 7-CH2), 3.00-3.06 м (2H,
Вычислено, %: C 70.57; H 5.92; N 18.29.
10-CH2), 6.79 уш.с (2H, NH2), 7.05-7.10 м (2Наром),
7.43-7.47 м (2Hаром), 7.90 с (1H, 3-CH). Спектр
1-Амино-5-(2-метоксифенил)-7,8,9,10-тетра-
ЯМР 13C (ДМСО-d6), δ, м.д.: 20.7, 21.9, 24.4, 28.7,
гидропиримидо[4,5-c]изохинолин-6(5H)-он (9e).
97.7, 125.9, 128.8, 130.9, 132.2, 136.7, 143.1, 154.2,
Выход 2.42 г (75%), т.пл. 279-281°C. ИК спектр, ν,
155.4, 160.5, 161.4. Найдено, %: C 62.55; H 4.58;
см-1: 3478, 3360, 3273 (NH2), 1670 (C=O). Спектр
N 17.06. С17Н15ClN4O. Вычислено, %: C 62.48; H
ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.75-1.88 м (4H, 8,9-
4.63; N 17.15.
CH2), 2.47-2.53 м (2H, 7-CH2), 3.01-3.08 м (2H,
10-CH2), 3.71 с (3H, CH3), 6.67 уш.с (2H, NH2),
ВЫВОДЫ
6.95-7.08 м (3Hаром), 7.37 д.д.д (1Наром, J1 8.2, J2
В ходе исследования на основе 3-амино-2-
7.1, J3 2.1 Гц), 7.90 с (1H, 3-CH). Спектр ЯМР 13C
арил-1,2,5,6,7,8-гексагидроизохинолинтионов
(ДМСО-d6), δ, м.д.: 20.7, 22.0, 24.2, 28.6, 55.0, 97.7,
5a-h разработан эффективный однореакторный
111.6, 120.0, 125.9, 126.4, 128.7, 129.5, 142.4, 154.1,
метод синтеза 2-арилзамещенных 3-аминопири-
154.5, 155.0, 160.3, 160.9. Найдено, %: C 67.15; H
дин-1-онов 8a-h. Конденсацией последних с фор-
5.68; N 17.29. С18Н18N4O2. Вычислено, %: C 67.07;
мамидом синтезированы новые производные пи-
H 5.63; N 17.38.
римидо[4,5-c]изохинолинов 9a-h. Изучение био-
1-Амино-5-(3-метоксифенил)-7,8,9,10-тетра-
логической активности синтезированных соедине-
гидропиримидо[4,5-c]изохинолин-6(5H)-он (9f).
ний позволило выделить вещества, оказывающие
Выход 2.45 г (76%), т.пл. 268-270°C. ИК спектр, ν,
противоопухолевую активность. Кроме того, уста-
см-1: 3480, 3384, 3310 (NH2), 1658 (C=O). Спектр
новлено, что образование пиримидинового цикла
ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.74-1.84 м (4H, 8,9-
(соединения 9d, e, h) приводит к уменьшению про-
CH2), 2.49-2.54 м (2H, 7-CH2), 3.01-3.06 м (2H, 10-
тивоопухолевой активности.
CH2), 3.81 с (3H, CH3), 6.59-6.66 м (2Hаром), 6.75
КОНФЛИКТ ИНТЕРЕСОВ
уш.с (2H, NH2), 6.93 д.д (1Наром, J1 8.2, J2 2.2 Гц),
7.34 т (1Наром, J 8.2 Гц), 7.93 с (1H, 3-CH). Спектр
Авторы заявляют об отсутствии конфликта ин-
ЯМР 13C (ДМСО-d6), δ, м.д.: 20.8, 22.0, 24.2, 28.6,
тересов.
54.6, 97.7, 112.8, 114.3, 120.7, 126.1, 128.7, 138.5,
СПИСОК ЛИТЕРАТУРЫ
142.1, 154.1, 157.8, 159.5, 160.2, 161.0. Найдено, %:
1. Машковский М.Д. Лекарственные средства. М.:
C 67.18; H 5.59; N 17.31. С18Н18N4O2. Вычислено,
Новая волна, 2010.
%: C 67.07; H 5.63; N 17.38.
2. Shimazaki T., Kondo H. Пат. 7916096 (1980). Япо-
1-Амино-5-(4-метоксифенил)-7,8,9,10-тетра-
ния, C.A., 1980, 93, 46709m.
гидропиримидо[4,5-c]изохинолин-6(5H)-он (9g).
3. Reddy M.V.R., Akula B., Cosenza S.C., Athuluridiva-
Выход 2.45 г (76%), т.пл. 277-279°C. ИК спектр, ν,
kar S., Mallireddigari M.R., Pallela V.R., Billa V.K.,
см-1: 3474, 3368, 3314 (NH2), 1667 (C=O). Спектр
Subbaiah D.R.C.V., Bharathi E.V., Carpio R.V.,
ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.75-1.84 м (4H, 8,9-
Padgaonkar A., Baker S.J., Reddy E.P. J. Med. Chem.
CH2), 2.46-2.52 м (2H, 7-CH2), 2.99-3.07 м (2H,
2014, 57, 578-599. doi 10.1021/jm401073p
10-CH2), 3.85 с (3H, CH3), 6.72 уш.с (2H, NH2),
4. Vásquez D., Rodríguez J.A., Theoduloz C., Verrax J.,
6.93-7.00 м (4Наром), 7.90 с (1H, 3-CH). Спектр
Calderon P.B., Valderrama J.A. Bioorg. Med. Chem. Lett.
ЯМР 13C (ДМСО-d6), δ, м.д.: 20.8, 22.0, 24.3, 28.6,
2009, 19, 5060-5062. doi 10.1016/j.bmcl.2009.07.041
54.9, 97.7, 113.7, 125.9, 129.4, 130.1, 142.4, 154.4,
5. Paronikyan E.G., Dashyan Sh.Sh., Noravyan A.S.,
154.9, 158.2, 160.3, 161.5. Найдено, %: C 68.96; H
Tamazyan R.A., Ayvazyan A.G., Panosyan H.A.
5.67; N 17.27. С18Н18N4O2. Вычислено, %: C 67.07;
Tetrahedron.
2015,
71,
2686. doi
10.1016/
H 5.63; N 17.38.
j.tet.2015.03.040
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020
СИНТЕЗ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЧАСТИЧНО ГИДРОГЕНИЗИРОВАННЫХ
1767
6. Руководство по проведению доклинических иссле-
7. Софьина З.П., Сыркин А.В., Голдин А., Кляйн А.
дований лекарственных средств. Ред. А.Н. Миро-
Экспериментальная оценка противоопухолевых
нов. М.: Медицина, 2012, 1.
препаратов в СССР и США. М: Медицина, 1980.
Synthesis and Biological Activity of Partially Hydrogenated
Derivatives of 1-Aminopyridino[4,5-c]isoquinolines
E. G. Paronikyan, Sh. Sh. Dashyan*, and H. M. Stepanyan
The Scientific and Technological Center of Organic and Pharmaceutical Chemistry,
National Academy of Science of the Republic of Armenia,
0014, Republic of Armenia, Yerevan, pr. Azatutyana 26
*e-mail: Shdashyan@gmail.com
Received August 20, 2020; revised August 28, 2020; accepted August 29, 2020
A one-pot method for the synthesis of 3-amino-2-aryl-1,2,5,6,7,8-hexahydroisoquinolin-1-ones by nucleop-
hilic substitution at position 1 of the pyridine ring has been developed. On the basis of the latter, derivatives
of 1-amino-7,8,9,10-tetrahydropyrimido[4,5-c]isoquinoline were synthesized. The biological properties of the
synthesized compounds were studied.
Keywords: tetrahydroisoquinoline, pyrido[2,3-d]pyrimidine, pyrimido[4,5-c]isoquinoline, antibacterial and
antitumor activity
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 11 2020