ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 12, с. 1813-1823
ДИСКУССИЯ
УДК 547.12
ИЗУЧЕНИЕ ПРОЦЕССА ОДНОЭЛЕКТРОННОГО
ПЕРЕНОСА В РЕАКЦИЯХ СТАБИЛЬНЫХ
ОРГАНИЧЕСКИХ РАДИКАЛОВ С КИСЛОРОДОМ
© 2020 г. О. Б. Томилин*, О. В. Бояркина, Б. С. Танасейчук
ФГБОУ ВО «Национальный исследовательский Мордовский государственный университет им. Н.П. Огарёва»,
430005, Россия, Республика Мордовия, г. Саранск, ул. Большевистская 68
*e-mail: tomilinob@mail.ru
Поступила в редакцию 02 октября 2020 г.
После доработки 10 октября 2020 г.
Принята к публикации 12 октября 2020 г.
Механизмы окисления молекулярным кислородом стабильных органических радикалов обусловлены
фундаментальным физическим взаимодействием - кулоновским взаимодействием. При определенном
структурном соответствии между молекулой кислорода и атакуемым атомом радикала в реакционной
системе осуществляетсяодноэлектронный перенос посредством квантового явления - туннельного эф-
фекта. Электроннаяструктура неустойчивого трирадикального состояния, образующегося в реакционной
системе в результате одноэлектронного переноса, перестраивается в более энергетически выгодную
монорадикальную структуру.
Ключевые слова: стабильные органические радикалы, окисление, одноэлектронный перенос, кулонов-
ское взаимодействие, координата реакции.
DOI: 10.31857/S0514749220120010
ВВЕДЕНИЕ
использующей величины парциальной электрон-
ной плотности на атомах реагирующих молекул,
Образование веществ в химических реакциях
оцениваемой на основе верхней занятой и нижней
обусловлено реализацией одного из фундамен-
вакантной молекулярных орбиталей. Отметим, что
тальных физических взаимодействий - электро-
в этом случае фундаментальное физическое взаи-
магнитного взаимодействия, то есть кулоновского
модействие заменяется иными представлениями
взаимодействия зарядов на атомах реагирующих
образования новой химической связи, и существу-
молекул. Такой подход активно используется в тео-
ет ряд экспериментальных данных, показываю-
рии реакционной способности, используя теорети-
щих частный характер возможностей постулируе-
ческие оценки распределения эффективных заря-
мых новых подходов.
дов на атомах реагирующих молекул, найденные
для изолированных состояний. Разноименность
Альтернативный подход в теории реакционной
эффективных зарядов и их абсолютные величи-
способности, избегающий прямого обращения
ны - необходимые условия для образования новой
к фундаментальному физическому взаимодей-
ковалентной связи. Неудовлетворительное соот-
ствию, основывается на нахождении поверхности
ветствие теоретических предсказаний и экспери-
потенциальной энергии реагирующей системы,
ментальных данныхвосполнялось новыми подхо-
построенной как функции от координат реакции
дами, например, теорией граничных орбиталей,
и отражающей всю совокупность возможных фи-
1813
1814
ТОМИЛИН и др.
зических взаимодействий. Такой универсальный
Для молекулярных систем процесс одноэлек-
подход обеспечивает достаточно удовлетворитель-
тронного переноса изучался, в основном, между
ное описание экспериментальных данных, однако
комплексообразователями координационных со-
оставляет вне описания качественную картину ме-
единений, например, в реакции между комплекса-
ханизма взаимодействия реагирующих молекул.
ми трисэтилендиамина ионов Со2+ и Со3 + [5]. Как
показали исследования, процесс переноса электро-
Возвращаясь к использованию фундаменталь-
нов происходит с участием лигандов внутренней и
ного физического взаимодействия в описании
внешней сфер и молекул растворителя, выполня-
реакционной способности молекул, отметим, что
ющих функцию «мостика» для перехода электро-
проблемы использования кулоновского взаимо-
нов. Естественно, что на скорость переноса элек-
действия обусловлены трудностями описания ди-
тронов в таких системах во многом будут влиять
намики изменения распределения эффективных
ориентация электронных облаков неподеленных
зарядов на атомах реагирующих молекулярных
пар лигандов внутренней сферы при образовании
систем при их сближении. Это изменение, вызыва-
координационных связей, динамические свойства
емое действием потенциальных полей реагентов, в
среды, химическая и симметричная идентичность
зависимости от собственного электронного строе-
орбиталей донора и акцептора, участвующих в пе-
ния реагирующих молекул может быть достаточ-
реносе электрона. В связи с этим известны такие
но незначительным. В этом случае интерпретация
молекулярные модели переноса электронов, как
экспериментальных данных успешна, исходя из
модель упругих искажений Рэндлса [6], учитыва-
характеристик электронного строения молекул в
ющая искажения радиусов внутренних сольват-
исходном изолированном состоянии.
ных оболочек ионов переходных металлов, модели
Но на изменение распределения эффективных
Флэтчера [7], Маркуса [8] и Зусмана [9].
зарядов на атомах реагирующих молекул может
Согласно теории Маркуса и его последователей,
оказывать существенное влияние возможное в
электронный перенос между донором и акцепто-
рамках фундаментального физического взаимо-
ром происходит при пересечении потенциальных
действия явление - перенос электрона от одной
поверхностей начального и конечного состояний,
реагирующей молекулы А к другой В.
которые отражают гармоническое молекулярное
движение с равновесным смещением ядерных ко-
А→е→В
ординат и линейным откликом окружающей среды
вакуум
в виде энергии реорганизации.
Явление переноса электронов от одного ве-
Отметим, что представленные модели одно-
щества в вакуум - полевая эмиссия электронов
электронного переноса в химических соединени-
не только изучена экспериментально на примере
ях относятся к системам, изменение электронного
различных катодных материалов, но и стала осно-
состояния которых происходит благодаря учету
вой многочисленных приборов электровакуумной
колебательных состояний атомов и ионов, образу-
техники. Теоретическое описание этого явления
ющих систему.
представлено в теориях туннелирования электро-
Реакции одноэлектронного переноса доста-
нов Хунда [1], Фаулера и Нордхейма [2].
точно многочисленны в органической химии: об-
Разнообразие концепций электронного тун-
разование анион-радикалов при взаимодействии
нелирования в различных системах обусловлено
конденсированных углеводородов с расплавами
различными подходами к моделированию потен-
щелочных металлов, образование катион-радика-
циального барьера на границе раздела при на-
лов при действии окислителей на замещенные фе-
хождении характеристик туннельного эффекта,
нолы, при взаимодействии ароматических аминов
использующих такие приближения, как принцип
с сильными акцепторами, и др. [10-12]. Несмотря
Франка-Кондона, нестационарная теория воз-
на это, к настоящему времени неизвестны даже
мущения, теория переходных состояний, теория
полуколичественные модели описания переноса
Дебая-Хюккеля и др. [3, 4].
электронов, особенно в радикальных реакциях.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
ИЗУЧЕНИЕ ПРОЦЕССА ОДНОЭЛЕКТРОННОГО ПЕРЕНОСА
1815
Описание процесса одноэлектронного перено-
нил-5-фенокси-метилфуран и 2,5-дифенил-3-фе-
са в терминах туннельного эффекта затрудняется
ноксиметилфуран, и ≈ 30% от смеси продуктов
проблемой построения обоснованного потен-
реакции оказались неидентифицированными. В
циального барьера, учитывающего электронное
работе [16] с помощью методов квантовой химии
строение реагирующих молекул. Кроме того, труд-
показано, что образование указанных продуктов
ностью является определение apriori направления
из радикала 4 в результате различных перегруппи-
одноэлектронного переноса.
ровок возможно из пероксидного радикала ROО•.
В связи с вышеизложенным в настоящей работе
Радикалы 2,4,6-трифенилфеноксил 2 и N-ме-
рассмотрены реакции окисления стабильных орга-
тил-9-цианакридинил 5 устойчивы к действию мо-
нических радикалов молекулярным кислородом.
лекулярного кислорода [17].
ОПИСАНИЕ МОДЕЛИ
Взаимодействие радикалов 1-5 с молекулой
Рассмотрим взаимодействие стабильных орга-
кислорода будем рассматривать как трансформа-
нических радикалов R∙1-5 (схема 1) с молекулой
цию единой реакционной системы, представлен-
кислорода.
ной на схеме 2.
В работах [13, 14] изучены механизмы окис-
В качестве координаты реакции в рассматри-
ления кислородом трифенилметильного
1 и
ваемых реакционных системах выбрана величи-
2,4,6-три-трет-бутилфеноксильного 3 радикалов,
на RCO• Величина RCO изменялась в интервале
конечными продуктами которых являются трифе-
1.40 Å ≤ RCO ≤ 4.0 Å с шагом 0.072 Å. В каждой
нилметилпероксид и 1,3,5-три-трет-бутилцикло-
точке фиксированного значения координаты ре-
гексадиенонпероксид. Продукты окисления и их
акции проводилась оптимизация геометрии реак-
свойства свидетельствуют об их образовании из
ционной системы и определялись полная энергия
соответствующих оксидных радикалов.
системы Еtot, эффективные заряды qi и величины
Согласно [15] в результате реакции 2,4,6-трифе-
спиновой плотности pi на атомах, вычисленные
нилпиранильного радикала 4 с кислородом была
по Малликену. Расчеты электронной структуры
получена смесь продуктов, основными из которых
систем проводились методом функционала плот-
были 1,3,5-трифенил-2-пентен-1,5-дион, 2,4-дифе-
ности с использованием гибридного функциона-
Схема 1.
4
9O
3
5
1
7
9O
Ph
6
2
1
7
2
t-Bu
6
2
7
5
3
1
6
4
5
3
8
4
8
1
2
3
9CN
7
1
6
8
8
2
4
5
3
10
3
5
2
N
4
6
Ph
O
7
1
CH3
4
5
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
1816
ТОМИЛИН и др.
Схема 2.
8
9
8
9
RCO
8
9
O O
RCO O
O
O O
RCO
RCO
RCO
8
9
8
9
O O
O O
ла для открытых систем UB3LYP [18] и базиса
из полученных данных, можно полагать, что атака
6-31G [19] в пакете прикладных программ Orca
молекулы О2 по атому С2 невозможна из-за возни-
[20].
кающего суммарного кулоновского отталкивания.
В реакциях молекулярный кислород имеет три-
Из данных рис. 1 следует, что суммарное ку-
плетное состояние (бирадикал). В связи с этим в
лоновское отталкивание достигается и при атаке
рассматриваемых реакционных системах имеют-
молекулы О2 по атомам С3-С5 радикала 1 (рис.
ся 3 неспаренных электрона, потому полагалась
1b-1d). Однако, представленное обсуждение сум-
мультиплетность M = 4.
марного кулоновского взаимодействия атомов ра-
дикала 1 и молекулы кислорода носит качествен-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ный характер. Более полный учет возможных
При сближении радикала и молекулы кислоро-
кулоновских взаимодействий осуществляется в
да по координате реакции происходит возмущение
величине полной энергии Etot (RCO) реагирующей
системы эффективных зарядов на атомах обоих
системы. Величины Etot (RCO) при атаке молекулы
реагентов. Это возмущение может не только изме-
О2 по атомам С3-С5 радикала 1 монотонно увели-
нять величины qi, но в определенных случаях даже
чиваются с уменьшением RCO.
менять знаки эффективных зарядов.
Иная ситуация возникает при атаке молекулы
Рассмотрим присоединение молекулы кисло-
О2 по атому С1. Если величина qi для атома С1 на
рода по атомам С1-С5 радикала 1. Будем пола-
всем интервале изменения RCO имеет отрицатель-
гать, что на закономерности окисления оказывают
ное значение, то значения qна атомах С2, С6 и С7
влияние взаимодействие молекулы О2 не только с
имеют положительные значения, которые увели-
атакуемым атомом углерода, но и с атомами, кова-
чиваются с уменьшением RCO. Можно полагать,
лентносвязанными с ним.
что устойчивое кулоновское притяжение атомов
кислорода на расстояние, необходимое для пере-
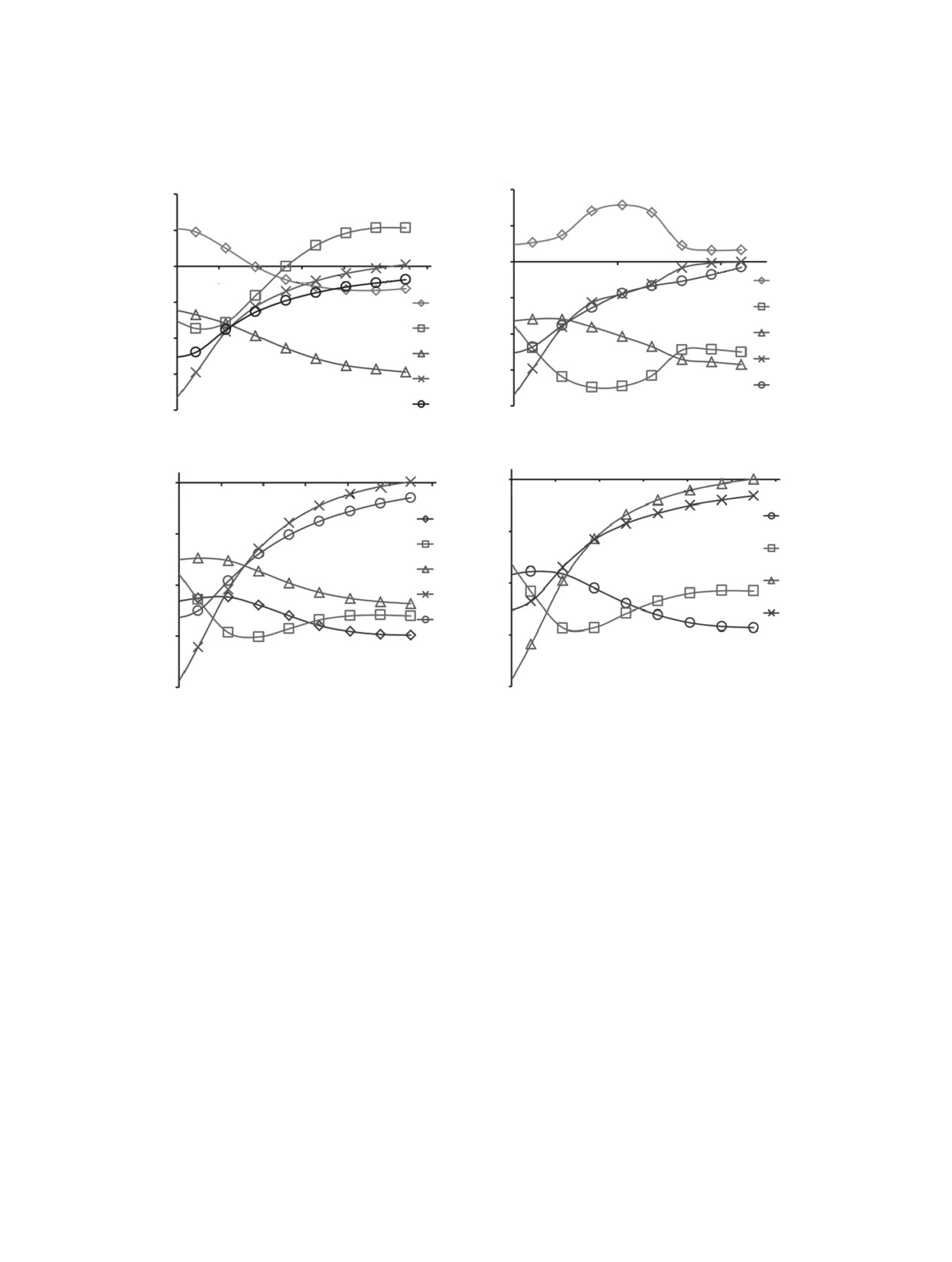
Как видно из рис. 1а, при атаке по атому С2 в
носа электрона, обеспечивают ковалентносвязан-
интервале 2.20 Å ≤ RСО ≤ 2.70 Å величины эффек-
ные с атомом С1 атомы С2, С6 и С7. Действительно,
тивных зарядов qi на атомах С1 и С3 имеют отри-
как видно из рис. 2а, функция Etot (RC1O) в интер-
цательные значения, на атоме С2 - положитель-
вале 1.617 Å ≤ RCO ≤ 1.905 Å достигает своего мак-
ное значение. Однако, при RCO< 2.20 Å знак qi на
симума с величиной энергии активации, равной
атакуемом атоме С2 меняется на отрицательный.
0.071 а.е. (1.92 эВ).
Благодаря высокой электроотрицательности ато-
мы кислорода O8 и O9 при сближении с радикалом
Для нахождения причин такого поведения пол-
приобретают отрицательные значения q. Исходя
ной энергии реакционной системы рассмотрим
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
ИЗУЧЕНИЕ ПРОЦЕССА ОДНОЭЛЕКТРОННОГО ПЕРЕНОСА
1817
(a)
(b)
qi, а.е.з.
qi, а.е.з.
0.1
0.1
0.05
0.05
RC2O
, Å
RC3O, Å
0
0
2.1
2.6
1.8
2
2.2
2.4
2.6
2.8
qC2
-0.05
–0.05
qC1
qC3
qC2
-0.1
qC4
-0.1
qC3
qO8
-0.15
-0.15
qO8
qO9
qO9
-0.2
-0.2
(c)
(d)
qi, а.е.з.
qi, а.е.з.
RC4O, Å
RC5O, Å
0
0
1.8
2
2.2
2.4
2.6
1.8
2
2.2
2.4
2.6
qC3
qC4
-0.05
-0.05
qC4
qC5
qC5
-0.1
qO8
-0.1
qO8
9
qO9
qO
-0.15
-0.15
-0.2
-0.2
Рис. 1. Графические зависимости эффективных зарядов qi на атомах радикала 1 и молекулы кислорода от величины: (а) -
RC2O (Å); (b) - RC3O (Å); (c) - RC4O (Å); (d) - RC5O (Å).
изменение распределения спиновой плотности
pi, которое можно в целом характеризовать, как
pi неспаренного электрона на атомах при атаке мо-
перенос электрона с молекулы радикала 1 на мо-
лекулы кислорода по атому С1 (см. рис. 2b).
лекулу О2.
В начале сближения молекулы кислорода и
Образующийся трирадикал на двухатомном
радикала в положении С1 неспаренный электрон
фрагменте О-О рассматриваемой системы являет-
радикала делокализован на атоме C1 и на атомах
ся нестабильным. Его релаксация сопровождается
углерода фенильных колец. При уменьшении рас-
следующими процессами. Во-первых, как видно
стояния RC1O происходит смещение неспаренных
из рис. 3, происходит существенное увеличение
электронов к атому кислорода O9. В этом же интер-
длины связи О-О, что может говорить о ее гете-
вале происходит увеличение отрицательного эф-
ролитическом разрыве с образованием атомарно-
фективного заряда на атоме кислорода O8 за счет
го кислорода (резкое уменьшение порядка связи
поляризации валентных электронов, обеспечивая
N(О8-O9), и происходит появление значительной
тем самым увеличение кулоновского притяжения,
величины порядка связи N(С1-O8), которое свиде-
а при RC1O = 1.617 Å происходит появление спи-
тельствует об образовании связи С1-О8.
новой плотности, равной 3, на атомах молекулы
кислорода. Как видно из представленных данных,
Во-вторых, одноэлектронный перенос вызы-
в интервале 1.617 Å ≤ RCO ≤ 1.833 Å происходит
вает перестройку электронной структуры кисло-
существенное изменение распределения величин
родного фрагмента с образованием монорадикаль-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
1818
ТОМИЛИН и др.
(a)
(b)
Etot, а.е.
pi, а.е.з.
RCO, Å
-882.53
1.7
2.2
2.7
3.2
3.7
4.2
1.7
pC1
–882.55
pC2
1.2
pC3
pC4
-882.57
4
pC
0.7
pO8
-882.59
pO9
0.2
RC1O, Å
-882.61
1.8
2.3
2.8
3.3
3.8
4.3
–0.3
Рис. 2. Зависимости величин полной энергии реагирующей системы Etot (а) и спиновой плотности pi (b) атомов радикала
1 и молекулы кислорода от величины RC1O.
ной реакционной системы с мультиплетностью
Резюмируя вышеизложенное, можно предста-
М = 2 в реакционной системе при RCO = 1.617 Å.
вить происходящие процессы схемой 3.
Подобная перестройка энергетически выгодна, так
В итоге атака молекулы О2 атома С1 радикала
как при RCO = 1.617 Å и М = 4 полная энергия си-
1 приводит к образованию оксидного радикала,
стемы R-O-O равна Etot = -882.5492 а.е., при М =
который при дальнейшей димеризации образует
2 - Etot= -882.6219 а.е.
трифенилметильный пероксид, что подтверждает-
В-третьих, существующая величина спиновой
ся экспериментальными данными [13].
плотности на атомах исходного радикала характе-
Предварительные расчеты показывают, что в
ризует не более как потенциальную возможность
радикалах 2 и 3 предпочтительными для атаки мо-
участия атома в процессе переноса электрона. Это
лекулой кислорода являются положения С2 и С4
соответствует экспериментальным данным, что
реакционная способность и спиновая плотность
феноксильного ядра, имеющие величины pi, соот-
на атомах в ряде реакций не коррелирует друг с
ветственно, 0.277, 0.285 и 0.337, 0.393 а.е. Анализ
другом. Так, например, скорость реакции ДФПГ и
изменения эффективных зарядов qi на атомах С2 и
его аналогов [21], замещенных вердазилов [22] с
С4 радикала 2 при атаке по ним молекулы О2 пока-
СН-кислотами не зависит от величины спиновой
зывает, что при RСО ≤ 2.20 Å величины qi принима-
плотности на атоме азота.
ют отрицательные значения. Таким образом, окис-
(a)
(b)
d(O8-O9), Å
N, a.e.
2
1.75
2.2
1.5
1.25
C1-O8
1
1.7
O8-O9
0.75
0.5
0.25
1.2
0
1.2
2.2
RCO, Å
1.2
2.2
RCO, Å
Рис. 3. Графические зависимости: (а) - длины связи d(О8-О9); (b) - значения порядка связей N(О8-O9) и N(С1-О8) от ве-
личины RC1O для радикала 1.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
ИЗУЧЕНИЕ ПРОЦЕССА ОДНОЭЛЕКТРОННОГО ПЕРЕНОСА
1819
Схема 3.
Ph
+δ
Ph
Ph
Ph
–δ
Ph
+
O O
Ph
O O
Ph
O
O
Ph
O
O
Ph
Ph
Ph
Ph
ление радикала 2 не происходит, что соответствует
4, которая подтверждается экспериментальными
экспериментальным данным [17].
данными [14].
В радикале 3 при атаке молекулой кислорода
Атомы С2 и С4 радикала 4 имеют наибольшее
положений С2 и С4 феноксильного эффективные
значение спиновой плотности (0.273 и 0.458 а.е.)
заряды на этих атомах в интервале 1.617 Å ≤ RCO ≤
и положительные значения эффективных зарядов
1.833 Å имеют положительные значения, что пред-
(0.241 и 0.023 а.е.з.). При RC4O < 2.2 Å эффектив-
полагает возможное суммарное кулоновское при-
ный заряд на атоме С4 приобретает отрицательный
тяжение реагирующих молекул. Однако, как видно
знак, и, таким образом, взаимодействие молекулы
из рис. 4а, величина Etot (RC2O) монотонно увели-
кислорода по положению С4 радикала 4 не проис-
чивается с уменьшением RCO, тогда как величина
ходит.
Etot (RC4O) в рассматриваемой области достигает
Атом С2 на всем интервале изменения значения
своего максимума с величиной энергии активации,
RC2O имеет положительное значение эффективно-
равной 0.09 а.е. (2.46 эВ).
го заряда, что способствует кулоновскому взаимо-
действию с атомами кислорода. Исследование из-
Анализ зависимости спиновой плотности
менения спиновой плотности на атомах реакцион-
pi от RC4O (см. рис. 4b) показывает, что проис-
ной системы показывает (рис. 5а), что в интервале
ходящие изменения величины pi в интервале
1.544 Å ≤ RC2O ≤ 2.122 Å осуществляется перенос
1.617 Å ≤ RC4O ≤ 1.833 Å можно интерпретиро-
электрона от молекулы кислорода на атомы угле-
вать, как перенос электрона от радикала 3 к мо-
рода пиранильного кольца.
лекуле кислорода. Этот вывод подтверждают зави-
симости длины связи d(О10-О11) и порядка связи
Релаксация образующегося трирадикала проис-
N(О10-O11) и N(С4-О10) от величины RCO, имею-
ходит за счет образования связи между атомом С2
щие вид аналогичный сходным зависимостям для
пиранильного кольца и пероксидным фрагментом
радикала 1 (рис. 3). Суммируя вышеизложенное,
с образованием радикала ROO•, как это показано
окисление радикала 3 можно представить схемой
на схеме 5.
(a)
(b)
Etot, a.e.
RCO, Å
pi, а.е.з.
–927.99
pC1
2
1.6
2.1
2.6
3.1
3.6
4.1
-928
pC2
-928.01
Etot(RC4O)
1.5
pC3
-928.02
Etot(RC2O)
pC4
-928.03
1
-928.04
pO9
-928.05
pO10
0.5
-928.06
pO11
-928.07
RC4O, Å
-928.08
0
2
2.5
3
3.5
4
-928.09
–928.1
-0.5
Рис. 4. Зависимости величин: (а) полной энергии Etot (RC2O) и Etot (RC4O); (b) спиновой плотности pi (RC4O) на атомах
радикала 3.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
1820
ТОМИЛИН и др.
Схема 4.
O
O
O
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
t-Bu
+
O O
O O
+δ
-δ
t-Bu
O O
t-Bu
t-Bu
O
O
t-Bu
t-Bu
t-Bu
t-Bu
+
O
O O
O
t-Bu
t-Bu
Описанный процесс сопровождается измене-
ния конечных продуктов реакции, найденных экс-
нием мультиплетности реагирующей системы.
периментально [15].
Как видно из рис. 5b, зависимость Etot (RC2O) в ин-
В радикале 5 наибольшее значение спино-
тервале 1.544 Å ≤ RC2O ≤ 2.122 Å имеет «плечо».
вой плотности имеют атомы С7 (0.517 а.е.), С3
Если считать, что на левом крае «плеча» заверша-
(0.149 а.е.), С1 (0.139 а.е.) и С5 (0.103 а.е.). Вели-
ется описанный процесс релаксации трирадикала,
чины эффективных зарядов на атомах С1, С3 и С7
то дальнейший расчет Etot (RC2O) при 1.544 Å ≤
в интервале 1.40 Å ≤ RCO ≤ 2.12 Å имеют отри-
RC2O необходимо проводить при мультиплетно-
цательные значения, поэтому кулоновское оттал-
сти М = 2, результаты которого показаны рис 5b.
кивание препятствует взаимодействию молекулы
Полученные данные позволяют оценить энергию
кислорода с атомами С1 и С3 радикала 5.
активации, которая равна 0.07 a.e. (1.92 эВ).
Эффективный заряд на атоме С5 радикала 5
Представленная схема окисления пираниль-
имеет положительное значение на всем интерва-
ного радикала 4 подтверждается зависимостями
ле изменения RCO, что предполагает возможность
длины связи d(О9-О10) и величины порядка связи
кулоновского взаимодействия этого атома и моле-
N(О9-O10) и N(С2-О9) от величины RC2O, которые
кулы кислорода. Однако, этому взаимодействию
представлены на рис. 6. Как показано в [16], об-
будет препятствовать значительный отрицатель-
разование пероксидного радикала по указанной
ный эффективный заряд на соседнем атоме азота
выше схеме является необходимым для объясне-
(-0.80 a.e.з.). Расчеты показывают, что величина
(a)
(b)
Etot, a.e.
pi, а.е.з.
RC2O
, Å
pC1
–1111.18
2
1.8
2.3
2.8
3.3
3.8
pC
0.95
-1111.19
pC3
-1111.2
0.75
pC4
-1111.21
pC
5
Etot, M = 4
0.55
-1111.22
pC6
Etot, M = 2
-1111.23
0.35
pO9
-1111.24
10
pO
0.15
-1111.25
RC2O, Å
-1111.26
-0.05
1.8
2.3
2.8
3.3
3.8
–1111.27
–0.25
-1111.28
Рис. 5. Зависимости величин: (а) спиновой плотности pi (RC2O) на атомах; (b) полной энергии Etot (RC2O) для радикала 4.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
ИЗУЧЕНИЕ ПРОЦЕССА ОДНОЭЛЕКТРОННОГО ПЕРЕНОСА
1821
Схема 5.
Ph
Ph
Ph
Ph
+δ
+
O O
-δ
O O
O O
O O
Ph
O
Ph
Ph
O
Ph
O
Ph
O
Ph
Ph
Ph
(a)
(b)
d(O9-O10), Å
N, a.e.
1.4
1.6
1.36
1.2
C2-O9
1.32
0.8
O9-O10
1.28
0.4
1.24
0
1.3
1.5
1.7
1.9
2.1
2.3
2.5
RCO, Å
1.3
1.8
2.3
2.8
RCO, Å
Рис. 6. Графические зависимости от величины RC2O: (а)
- длины связи d(О9-О10); (b) - величины порядка связей
N(O9-O10) и N(С2-О9) для радикала 4.
Etot (RC5O) монотонно увеличивается с уменьше-
ным открывает перспективу использования пред-
нием величины RC5O. Таким образом, кулоновское
ложенного подхода к описанию реакций одноэлек-
отталкивание между молекулой кислорода и ато-
тронного переноса, занимающих важное место в
мами радикала 5 препятствует его окислению, что
органической химии.
соответствует имеющимся экспериментальным
КОНФЛИКТ ИНТЕРЕСОВ
данным [17].
Авторы заявляют об отсутствии конфликта ин-
ВЫВОДЫ
тересов.
Резюмируя вышеизложенное, можно отметить,
СПИСОК ЛИТЕРАТУРЫ
что все механизмы окисления молекулярным кис-
1. Hund F. Z. Physik. 1927, 40, 742-764. doi 10.1007/
лородом рассмотренных радикалов обусловле-
BF01400234
ны фундаментальным физическим взаимодейст-
2. Fowler R.H., Nordheim L. Proc. R. Soc. Lond, Ser. A.
вием - кулоновским взаимодействием. При опре-
1928, 119, 173-181. doi 10.1098/rspa.1928.0091
деленном структурном соответствии между моле-
3. Fletcher S.J. Solid State Electrochem. 2010, 14, 705-
кулой кислорода и атакуемым атомом радикала в
739. doi 10.1007/s10008-009-0994-z
реакционной системе реализуется одноэлектрон-
4. Likhtenshtein G.I. Solar Energy Conversion: Chemical
ный перенос, как квантовое явление - туннельный
Aspects. New York: J. Wiley and Sons Inc., 2012, 1.
эффект. Для одноэлектронного переноса на атомы
5. Lewis W.B., Coryell C.D., Irvine J.W. J. Chem. Soc.
радикала величина RCO составляет ~ 2 Å, для пе-
1949, 2, S386-S392. doi 10.1039/JR949000S386
реноса электрона на атомы молекулы O2 ~ 1.6 Å.
6. Randles J.E.B. Trans. Faraday Soc. 1952, 48, 828-832.
Электроннаяструктура неустойчивого трира-
doi 10.1039/TF9524800828
дикального состояния, образующегося в реак-
7. Fletcher S. Solid State Electrochem. 2007, 11, 965-969.
ционной системе в результате одноэлектронного
doi 10.1007/s10008-007-0313-5
переноса, перестраивается в более энергетически
8. Маrcus R.A. J. Electroanal. Chem. 1997, 438, 251-
выгодную монорадикальную структуру.
259. doi 10.1016/S0022-0728(97)00091-0
Установленное соответствие полученных тео-
9. Zusman L.D. Chem. Phys. 1980, 49, 295-304. doi
ретических результатов экспериментальным дан-
10.1016/0301-0104(80)85267-0
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
1822
ТОМИЛИН и др.
10. Билевич К.А., Охлобыстин О.Ю. Усп. хим. 1968,
17. Розанцев Э.Г., Шолле В.Д. Органическая химия сво-
37, 2162-2191. [Bilevich K.A., Okhlobystin O.Yu.
бодных радикалов. М.: Химия, 1979.
Russ. Chem. Rev. 1968, 37, 954-968.] doi 10.1070/
18. Stephens P.J., Devlin F.J., Chablowski C.F., Frisch M.J.
RC1968v037n12ABEH001716
J. Phys. Chem. 1994, 98, 11623-11627.doi 10.1021/
11. Нонхибел Д., Уолтон Дж. Химия свободных радика-
j100096a001
лов. М.: Мир, 1977.
19. Hehre W.J., Ditchfield R., Pople J.A. J. Chem. Phys.
12. Ashby E.C. Acc. Chem. Res. 1988, 21, 414-421.
1972, 56, 2257-2261. doi 10.1063/1.1677527
doi10.1021/ar00155a005
20. Neese F. Wiley Interdiscip. Rev. Comput. Mol. Sci.
13. Походенко В.Д., Ганюк Л.Н., Бродский А.И. ДАН
2012, 2, 73-78. doi 10.1002/wcms.81
СССР. 1963, 149, 321-323.
21. Танасейчук Б.С., Томилин О.Б., Пряничнико-
14. Походенко В.Д., Хижный В.А., Бидзиля В.А. Усп.
ва М.К., Бояркина О.В., Буртасов А.А. ЖOрХ.
хим. 1968, 37, 998-1024. [Pokhodenko V.D., Khi-
2017, 53, 672-677. [Tanaseichuk B.S., Tomilin O.B.,
zhnyi V.A., Bidzilya V.A. Russ. Chem. Rev. 1968, 37,
Pryanichnikova M.K., Boyarkina O.V., Burtasov A.A.
435-448.] doi 10.1070/RC1968v037n06ABEH001651
Russ. J. Org. Chem. 2017, 53, 679-685.] doi 10.1134/
15. Танасейчук Б.С., Пряничникова М.К., Тихонова Л.Г.
S1070428017050062
ЖОрХ. 1999, 35, 466-468. [Tanaseichuk B.S., Prya-
nichnikova M.K., Tikhonova L.G. Russ. J. Org. Chem.
22. Танасейчук Б.С., Томилин О.Б., Пряничнико-
1999, 35, 442-444.]
ва М.К., Цебулаева Ю.В., Бояркина О.В. ЖOрХ.
16. Томилин О.Б., Бояркина О.В., Танасейчук Б.С.
2017, 53, 751-755. [Tanaseichuk B.S., Tomilin O.B.,
ЖОрХ. 2018, 54, 716-722. [Tomilin O.B., Boyarki-
Pryanichnikova M.K., Tsebulaeva Y.V., Boyarkina O.V.
na O.V., Tanaseichuk B.S. Russ. J. Org. Chem. 2018,
Russ. J. Org. Chem. 2017, 53, 764-768.] doi 10.1134/
54, 719-725.] doi 10.1134/S1070428018050081
S1070428017050189
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
ИЗУЧЕНИЕ ПРОЦЕССА ОДНОЭЛЕКТРОННОГО ПЕРЕНОСА
1823
Study of the One-Electron Transfer Process in Reactions
of Stable Organic Radicals with Oxygen
O. B. Tomilin*, O. V. Boyarkina, and B. S. Tanaseichuk
Mordovian State University, 430005, Russia, Saransk, ul. Bolshevistskaya 68
*e-mail: tomilinob@mail.ru
Received October 2, 2020; revised October 10, 2020; accepted October 12, 2020
The mechanisms of stable organic radicals oxidation by molecular oxygen are due to a fundamental physical
interaction - the Coulomb interaction. With a certain structural correspondence between the oxygen molecule
and the attackedatom of the radical, one-electron transfer occurs in the reaction system by means of a quantum
phenomenon - the tunneling effect. The electronic structure of an unstable triradical state formed in a reaction
system as a result of one-electron transfer is rearranged into a more energetically favorable monoradical struc-
ture.
Keywords: stable organic radicals, oxidation, one-electron transfer, Coulomb interaction, reaction coordinate
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020