ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 12, с. 1845-1851
УДК 547.816 + 547.642 + 546.47 + 547.592.12
ВЗАИМОДЕЙСТВИЕ 1-АРИЛ-3-(2-ГИДРОКСИФЕНИЛ)-
ПРОП-2-ЕН-1-ОНОВ С МЕТИЛОВЫМ ЭФИРОМ
1-БРОМЦИКЛОГЕКСАНКАРБОНОВОЙ КИСЛОТЫ
И ЦИНКОМ
© 2020 г. Е. А. Никифорова*, Д. В. Байбародских, Н. Ф. Кириллов,
М. В. Дмитриев, Д. П. Зверев
ФГБОУ ВО «Пермский государственный национальный исследовательский университет»,
614990, Россия, г. Пермь, ул. Букирева 15
*e-mail: vikro@ya.ru
Поступила в редакцию 15 августа 2020 г.
После доработки 21 августа 2020 г.
Принята к публикации 23 августа 2020 г.
1-Арил-3-(2-гидрокси-5-R-фенил)проп-2-ен-1-оны взаимодействуют с реактивом Реформатского,
полученным из метилового эфира 1-бромциклогексанкарбоновой кислоты и цинка, с образованием
4-(2-арил-2-оксоэтил)-6-R-спиро[хроман-3,1'-циклогексан]-2-онов. Образование последних происходит
посредством внутримолекулярной циклизации первоначальных продуктов присоединения цинкоргани-
ческого реагента в результате нуклеофильной атаки фенолятного атома кислорода на карбонильный атом
углерода сложноэфирной группы. Продукты циклизации в результате атаки енолятного атома кислорода
на карбонильный атом углерода не обнаружены.
Ключевые слова: реакция Реформатского, 1-бромциклоалканкарбоксилаты, 1-бромциклогексанкарбок-
силат, спирогетероциклы, хроман-2-оны, гидроксихалконы, спирохроманоны.
DOI: 10.31857/S0514749220120046
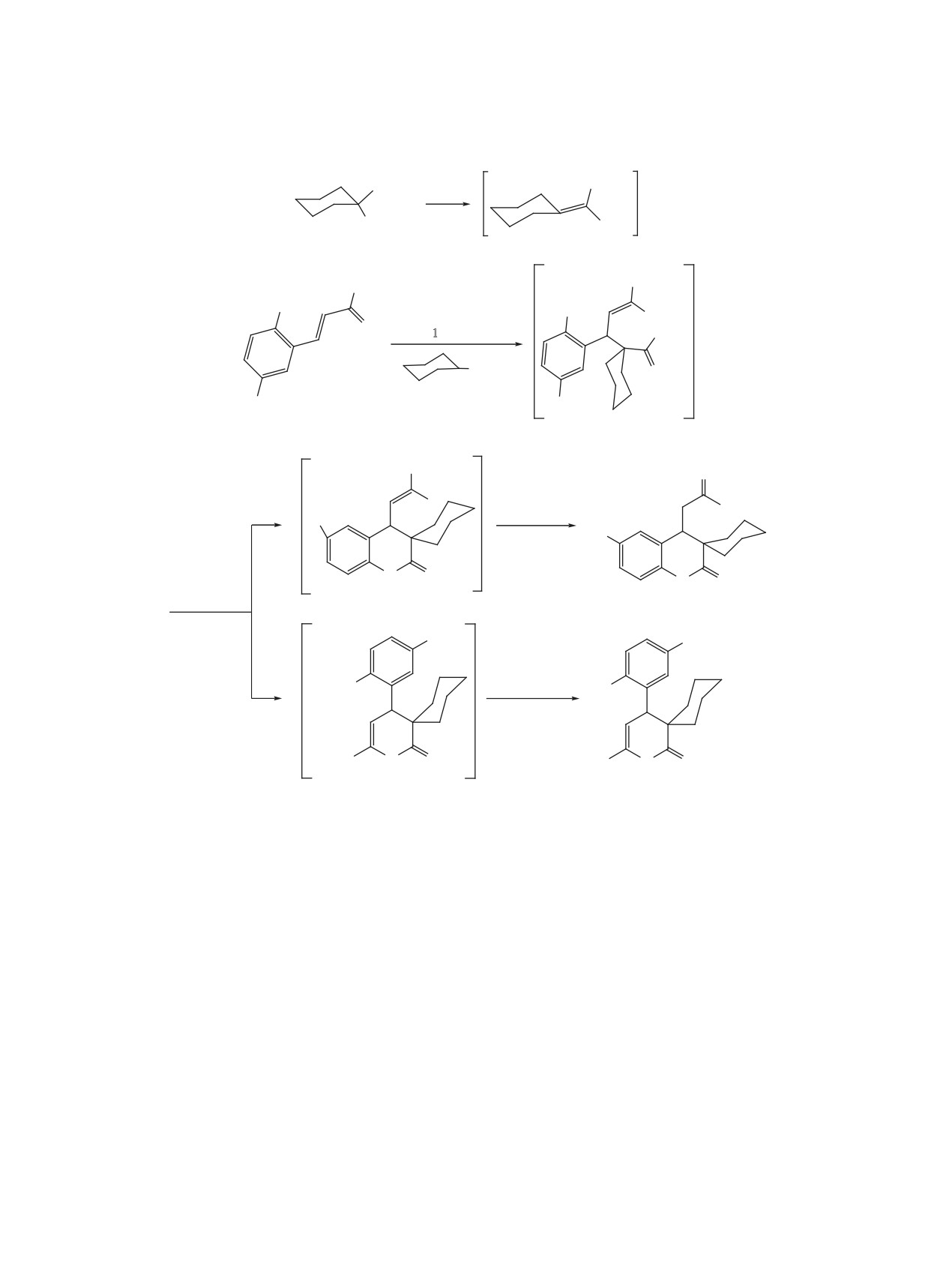
Карбоциклические реактивы Реформатского
объясняется большей нуклеофильностью фено-
взаимодействуют с халконами, присоединяясь в
лятного атома кислорода по сравнению с енолят-
положение 1-4 сопряженной системы C=C-C=O с
ным [4].
образованием соответствующих интермедиатов А
Полученные 4-(2-арил-2-оксоэтил)-6-R-спиро-
(схема 1), которые циклизуются в результате ну-
[хроман-3,1'-циклопентан]-2-оны также обладают
клеофильной атаки енолятного атома кислорода на
анальгетической активностью [4].
карбонильный атом углерода с образованием заме-
щенных спиродигидропиран-2-онов, обладающих
С целью получения новых биологически ак-
анальгетической активностью [1-3].
тивных соединений и изучения влияния на про-
текание реакции размера цикла алициклического
Взаимодействие реактива Реформатского,
реактива Реформатского нами было исследовано
полученного из метил-1-бромциклопентанкар-
взаимодействие реактива Реформатского 1, полу-
боксилата и цинка, с 1-арил-3-(2-гидрокси-5-R-
ченного из метил-1-бромциклогексанкарбокси-
фенил)проп-2-енонами приводит к 4-(2-арил-2-
лата и цинка, с 1-арил-3-(2-гидрокси-5-R-фенил)-
оксоэтил)-6-R-спиро[хроман-3,1'-циклопентан]-2-
проп-2-ен-1-онами 2a-i.
онам в результате циклизации интермедиата B
(схема 2) посредством атаки фенолятного атома
Как показали наши исследования, реакция про-
кислорода на карбонильный атом углерода, что
исходит по схеме, аналогичной описанной ранее
1845
1846
НИКИФОРОВА и др.
Схема 1.
Ar2
Ar1
(CH2)
n
OZnBr
OMe
O
A
n = 1, Ar1 = Ph, Ar2 = Ph, 4-ClC6H4, 4-BrC6H4; Ar1 = 4-BrC6H4, Ar2 = 4-MeOC6H4; Ar1 = Ar2 = 4-ClC6H4;
n = 2, Ar1 = Ph, Ar2 = Ph, 4-ClC6H4, 4-BrC6H4; Ar1 = 4-BrC6H4, Ar2 = Ph; Ar1 = 4-MeOC6H4, Ar2= 4-ClC6H4;
n = 3, Ar1 = Ph, Ar2 = Ph, 4-BrC6H4, 4-ClC6H4, 4-MeOC6H4; Ar1 = 4-MeC6H4, Ar2 = 4-BrC6H4;
Ar1 = 4-MeOC6H4, Ar2 = 4-BrC6H4; Ar1 = Ar2 = 4-ClC6H4; n = 4, Ar1 = Ph,
Ar2 = Ph, 4-BrC6H4, 4-ClC6H4, 4-MeOC6H4; Ar1 = 4-BrC6H4, Ar2 = Ph.
[4]: реактив Реформатского 1 присоединяется к
в области 1765-1750 см-1, обусловленные валент-
фрагменту (С=С-С=О) халконов 2a-i в положе-
ными колебаниями лактонных карбонилов С2=О и
ние 1-4, образуя промежуточные соединения 3a-i.
полосы в области 1689-1661 см-1, принадлежащие
Далее из двух возможных направлений реакции
кетонным карбонилам фрагментов ArC=O. В спек-
реализуется атака атома кислорода бромцинкфено-
трах ЯМР 1Н наиболее характерными являются
лята на карбонильный атом углерода сложноэфир-
двойные дублеты протонов хромановых циклов
С4-Н в области 3.66-3.72 м.д. и двойные дублеты
ной группы с образованием через интермедиаты
неэквивалентных метиленовых протонов С4Н-
4a-i замещенных спирохроман-2-онов, а именно
СН2-СО в областях 2.91-3.01 м.д. и 3.17-3.23 м.д.
4-(2-арил-2-оксоэтил)спиро[хроман-3,1'-циклогек-
Интересно, что для подобных соединений, со-
сан]-2-онов 5a-i (схема 3).
держащих спиро[хроман-3,1'-циклопентановый]
Продукты циклизации по второму пути не об-
фрагмент протоны этой метиленовой группы об-
наружены, как и в случае взаимодействия халко-
ладают значительно более близкими химическими
нов 2 с реактивом Реформатского, полученным из
сдвигами в пределах 3.09-3.16 м.д., а в некоторых
метилового эфира 1-бромциклопентанкарбоновой
случаях оказываются эквивалентыми и проявля-
кислоты и цинка [4].
ются в спектре ЯМР 1H в виде дублетов [4].
Состав и строение синтезированных соеди-
С целью более точного установления структу-
нений 5a-i подтверждено данными элементно-
ры синтезированных соединений был проведен
го анализа, ИК и ЯМР 1Н спектроскопии. В ИК
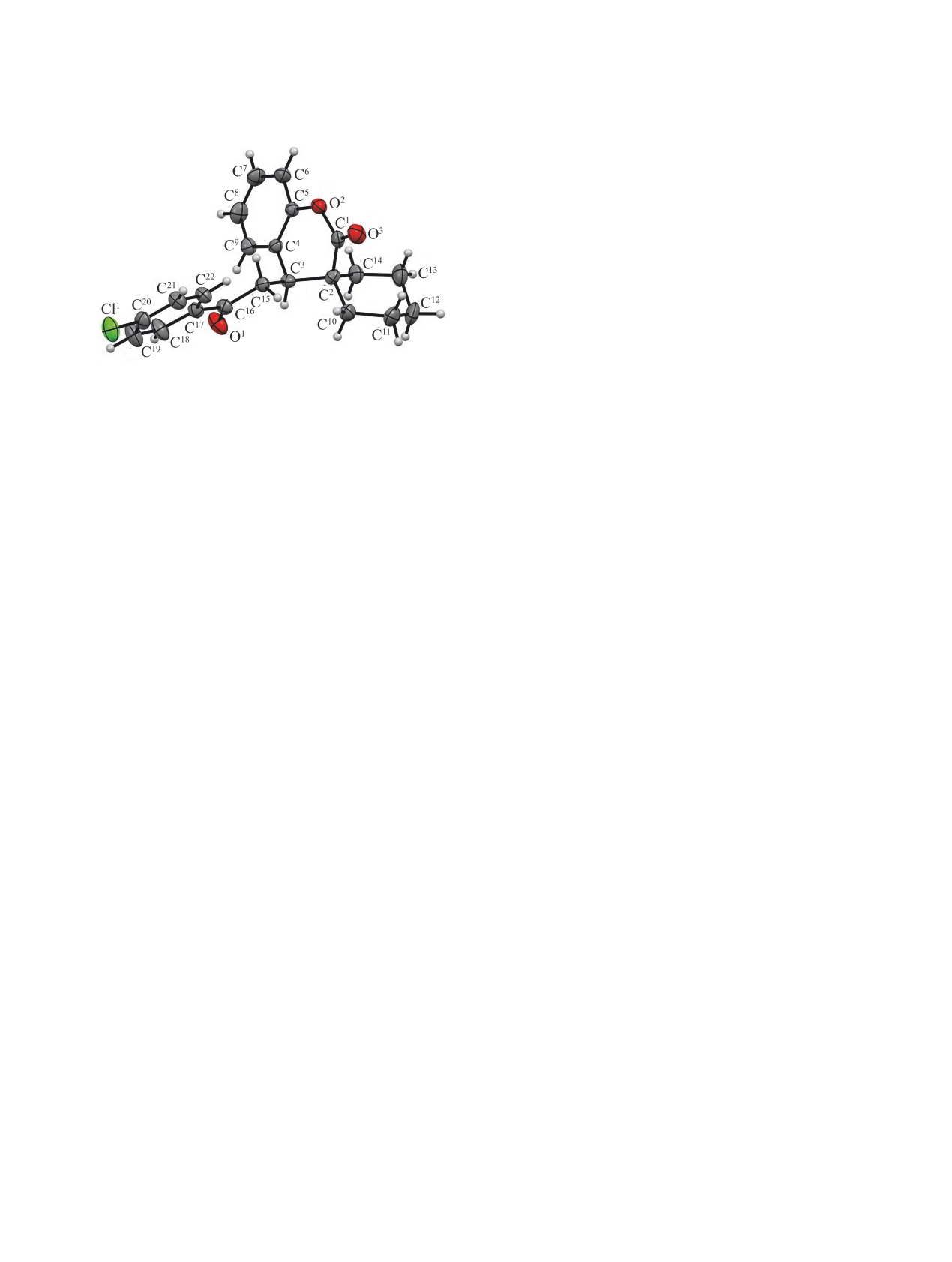
рентгеноструктурный анализ (РСА) соединения
спектрах соединений 5a-i присутствуют полосы
5a (см. рисунок).
Схема 2.
R
Ar
OZnBr
BrZnO
OMe
O
B
R = H, Ar = Ph, 4-BrC6H4, 4-ClC6H4, 4-MeOC6H4; R = Br, Ar = Ph, 4-MeC6H4,
2,4-Me2C6H4, 2,5-Me2C6H4, 4-BrC6H4, 4-ClC6H4, 4-MeOC6H4; 4-EtOC6H4.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
ВЗАИМОДЕЙСТВИЕ 1-АРИЛ-3-(2-ГИДРОКСИФЕНИЛ)-ПРОП-2-ЕН-1-ОНОВ
1847
Схема 3.
Br
OZnBr
Zn
COOMe
OMe
1
Ar
Ar
OH
OZnBr
OZnBr
O
1 (2 экв)
OMe
COOMe
O
R
R
2a-i
3a-i
OZnBr
O
Ar
H2O (H+)
Ar
R
-Zn(Br)OH
R
O O
O
O
4a-i
5a-i
-MeOZnBr
R
R
BrZnO
H2O (H+)
HO
-Zn(Br)OH
Ar
O O
Ar
O O
6
7
2-7: R = H, Ar = 4-ClC6H4 (a), 4-BrC6H4 (b), 4-MeOC6H4 (c); R = Br, 4-ClC6H4 (d), 4-BrC6H4 (e),
3,4-(MeO)2C6H3 (f); 4-EtOC6H4 (g), 4-MeC6H4 (h), 2,5-Me2C6H4 (i).
Согласно данным РСА, соединение 5a кристал-
Соединения 5c, g проявляют анальгетическую
лизуется в нецентросимметричной пространствен-
активность, превышающую таковую для препара-
ной группе ромбической сингонии. Стоит отме-
та сравнения анальгина.
тить, что при кристаллизации произошло самопро-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
извольное разделение рацемата. Исследованный
кристалл состоит из молекул одного энантиомера
Температуры плавления измерены на прибо-
с S-конфигурацией хирального центра. Длины
ре MP-70 фирмы Mettler Toledo (Швейцария). ИК
связей и валентные углы в молекуле находятся в
спектры синтезированных соединений сняты в ва-
интервале ожидаемых значений. Циклогексановое
зелиновом масле на Фурье-спектрометре Spectrum
кольцо принимает конформацию кресло, пира-
Two фирмы Perkin Elmer (США). Спектры ЯМР
новый цикл - конформацию искаженная ванна.
1H растворов этих соединений в CDCl3 сняты на
Атомы C1 и C2 выходят из плоскости C3C4C5O2 на
спектрометре Mercury Plus-300 (Varian, США)
0.34 и 0.91 Å соответственно. Специфические уко-
(300 МГц), внутренний стандарт - ТМС (5a-e, g-i),
роченные контакты в кристалле отсутствуют.
cпектры ЯМР 1H и 13C - на спектрометре Bruker
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
1848
НИКИФОРОВА и др.
и метанолом по ранее описанным методикам
[9]. 1-Арил-3-(2-гидрокси-5-R-фенил)проп-2-ен-1-
оны 2 получали взаимодействием салицилового
или бромсалицилового альдегидов с соответству-
ющими замещенными ацетофенонами по извест-
ной методике [10]. Все исходные соединения были
синтезированы из коммерчески доступных реа-
гентов (Acros Organics, Alfa Aesar, Sigma Aldrich,
ВЕКТОН).
Синтез 4-(2-арил-2-оксоэтил)спиро[хроман-
3,1'-циклогексан]-2-онов 5a-i (общая методи-
Общий вид молекулы соединения 5a по данным РСА в
тепловых эллипсоидах 30% вероятности.
ка). К смеси 3 г цинка, 0,5 г метилового эфира
1-бромциклогексанкарбоновой кислоты, катали-
тического количества HgCl2 и 5 мл толуола после
Avance III HD 400 (Швейцария) [рабочая частота
начала реакции прикапывали смесь 10 ммоль 1-
400 (1Н) и 100 (13С) МГц], внутренний стандарт -
арил-3-(2-гидроксифенил)проп-2-ен-1-она
(2a-i),
ГМДС (5f). Элементный анализ выполнен на ана-
22 ммоль (4.55 г) метилового эфира 1-бромцикло-
лизаторе vario MICRO cube (Германия).
гексанкарбоновой кислоты, 3 мл ГМФТА и 20 мл
РСА выполнен на монокристальном дифрак-
толуола. Затем реакционную смесь кипятили 4 ч,
тометре Xcalibur Ruby (Agilent, США) с ССD-
охлаждали, сливали с избытка цинка, гидролизо-
детектором по стандартной методике
[MoKα-
вали 5%-ной уксусной кислотой, органический
излучение, 295(2) K, ω-сканирование с шагом 1°].
слой отделяли, из водного слоя продукты реакции
Поглощение учтено эмпирически с использовани-
дважды экстрагировали этилацетатом. После вы-
ем алгоритма SCALE3 ABSPACK [5]. Сингония
сушивания экстракта безводным сульфатом натрия
кристалла (C22H21ClO3, M 368.84) ромбическая,
растворители отгоняли и синтезированные соеди-
пространственная группа P212121, a 10.058(4) Å, b
нения перекристаллизовывали из этилацетата.
11.363(3) Å, c 16.781(5) Å, V 1917.8(10) Å3, Z 4, dвыч
4-[2-Оксо-2-(4-хлорфенил)этил]спиро[хро-
1.277 г/см3; μ 0.217 мм-1. Структура расшифрова-
ман-3,1'-циклогексан]-2-он (5a). Выход 2.55 г
на с помощью программы Superflip [6] и уточнена
(69%), т.пл. 119-120°С. ИК спектр, ν, см-1: 1760,
полноматричным методом наименьших квадратов
1689 (C=O). Спектр ЯМР 1H, δ, м.д.: 1.23-2.20 м
по F2 в анизотропном приближении для всех не-
[10H, (CH2)5], 3.01 д.д (1H, CH2, J 9.3, 16.5 Гц),
водородных атомов с использованием программы
3.19 д.д (1H, CH2, J 4.5, 16.5 Гц), 3.70 д.д (1H,
SHELXL [7] с графическим интерфейсом OLEX2
C4Hхроман, J 4.5, 9.3 Гц), 6.94-7.23 м (4Наром), 7.34
[8]. При уточнении атомов водорода использова-
д, 7.71 д (4Н, 4-ClC6H4, J 8.4 Гц). Найдено, %: C
на модель наездника. Окончательные параметры
71.80; H 5.83; Cl 9.50. C22H21ClO3. Вычислено, %:
уточнения: R1 0.0665, wR2 0.1636 [для 2654 отра-
C 71.64; H 5.74; Cl 9.61.
жений с I > 2σ(I)], R1 0.1006, wR2 0.2042 (для всех
4-[2-(4-Бромфенил)-2-оксоэтил]спиро[хро-
4081 независимых отражений), S 1.054, параметр
ман-3,1'-циклогексан]-2-он (5b). Выход 2.68 г
Флэка 0.07(7). Результаты РСА зарегистрированы
(65%), т.пл. 117-118°С. ИК спектр, ν, см-1: 1750,
в Кембриджском центре кристаллографических
1688 (C=O). Спектр ЯМР 1H, δ, м.д.: 1.30-2.21 м
данных под номером CCDC 2038652 и могут быть
[10H, (CH2)5], 3.00 д.д (1H, CH2, J 9.3, 16.5 Гц),
3.19 д.д (1H, CH2, J 4.2, 16.5 Гц), 3.69 д.д (1H,
request/cif.
C4Hхроман, J 4.2, 9.3 Гц), 6.97 т, 6.98 д, 7.19 т, 7.20
Исходный метиловый эфир 1-бромциклогек-
д (4Наром, J 7.5 Гц), 7.50 д, 7.63 д (4Н, 4-BrC6H4,
санкарбоновой кислоты (1) синтезировали по-
J 8.7 Гц). Найдено, %: C 64.06; H 5.19; Br 19.08.
следовательным взаимодействием циклогексан-
C22H21BrO3. Вычислено, %: C 63.93; H 5.12; Br
карбоновой кислоты с тионилхлоридом, бромом
19.33.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
ВЗАИМОДЕЙСТВИЕ 1-АРИЛ-3-(2-ГИДРОКСИФЕНИЛ)-ПРОП-2-ЕН-1-ОНОВ
1849
4-[2-(4-Метоксифенил)-2-оксоэтил]спи-
117.83,
122.89,
128.39,
130.06,
131.52,
132.26,
ро[хроман-3,1'-циклогексан]-2-он
(5c). Выход
149.40, 149.90, 153.92 (Cаром), 171.95, 195.79 (СО).
2.37 г (65%), т.пл. 108-109°С. ИК спектр, ν, см-1:
Найдено, %: C 60.82; H 5.40; Br 17.04. C24H25BrO5.
1759, 1676 (C=O). Спектр ЯМР 1H, δ, м.д.: 1.30-
Вычислено, %: C 60.90; H 5.32; Br 16.88.
2.20 м [10H, (CH2)5], 2.98 д.д (1H, CH2, J 9.0,
6-Бром-4-[2-оксо-2-(4-этоксифенил)этил]-
16.5 Гц), 3.17 д.д (1H, CH2, J 4.2, 16.5 Гц), 3.72 д.д
спиро[хроман-3,1'-циклогексан]-2-он (5g). Вы-
(1H, C4Hхроман, J 4.2, 9.0 Гц), 3.82 c (3H, MeO), 6.97
ход 2.20 г (58%), т.пл. 184-185°С. ИК спектр, ν,
т, 6.98 д, 7.17 т, 7.23 д (4Наром, J 7.8 Гц), 6.84 д, 7.77
см-1: 1761, 1669 (C=O). Спектр ЯМР 1H, δ, м.д.:
д (4Н, 4-MeOC6H4, J 9.0 Гц). Найдено, %: C 75.94;
1.34-2.19 м [10H, (CH2)5], 1.41 т (3H, Me, J 6.9 Гц),
H 6.58. C23H24O4. Вычислено, %: C 75.80; H 6.64.
2.96 д.д (1H, CH2CO, J 9.0, 17.1 Гц), 3.20 д.д (1H,
6-Бром-4-[2-оксо-2-(4-хлорфенил)этил]спи-
CH2CO, J 4.2, 17.1 Гц), 3.69 д.д (1H, C4Hхроман, J 4.2,
ро[хроман-3,1'-циклогексан]-2-он
(5d). Выход
9.0 Гц), 4.06 к (2Н, ОСН2СН3, J 6.9 Гц), 6.84 д, 7.78
2.87 г (64%), т.пл. 141-142°С. ИК спектр, ν, см-1:
д (4Н, 4-EtOC6H4, J 9.0 Гц). 6.85 д (1Н, C8Hхроман, J
1761, 1680 (C=O). Спектр ЯМР 1H, δ, м.д.: 1.33-
8.4 Гц), 7.29 д.д (1Н, C7Hхроман, J 8.4, 2.4 Гц), 7.41
2.18 м [10H, (CH2)5], 2.97 д.д (1H, CH2, J 9.0,
д (1Н, C5Hхроман, J 2.4 Гц). Найдено, %: C 63.12;
17.1 Гц), 3.22 д.д (1H, CH2, J 4.2, 17.1 Гц), 3.67 д.д
H 5.58; Br 17.41. C24H25BrO4. Вычислено, %: C
(1H, C4Hхроман, J 4.2, 9.0 Гц), 6.85 д (1Н, C8Hхроман,
63.03; H 5.51, Br 17.47.
J 9.0 Гц), 7.30 д.д (1Н, C7Hхроман, J 9.0, 2.1 Гц),
6-Бром-4-[2-(4-метилфенил)-2-оксоэтил]спи-
7.39 д (1Н, C5Hхроман, J 2.1 Гц), 7.37 д, 7.75 д (4Н,
ро[хроман-3,1'-циклогексан]-2-он
(5h). Выход
4-ClC6H4, J 8.7 Гц). Найдено, %: C 58.87; H 4.57.
2.91 г (68%), т.пл. 153-154°С. ИК спектр, ν, см-1:
C22H20BrClO3. Вычислено, %: C 59.02; H 4.50.
1761, 1674 (C=O). Спектр ЯМР 1H, δ, м.д.: 1.32-
6-Бром-4-[2-(4-бромфенил)-2-оксоэтил]спи-
2.17 м [10H, (CH2)5], 2.37 c (3H, Me), 2.91 д.д
ро[хроман-3,1'-циклогексан]-2-он
(5e). Выход
(1H, CH2, J 9.0, 17.1 Гц), 3.23 д.д (1H, CH2, J 3.9,
2.76 г (56%), т.пл. 170-171°С. ИК спектр, ν, см-1:
17.1 Гц), 3.69 д.д (1H, C4Hхроман, J 3.9, 9.0 Гц), 6.85
1757, 1682 (C=O). Спектр ЯМР 1H, δ, м.д.: 1.30-
д (1Н, C8Hхроман, J 8.4 Гц), 7.28 д.д (1Н, C7Hхроман,
2.18 м [10H, (CH2)5], 2.97 д.д (1H, CH2, J 9.0,
J 8.4, 2.4 Гц.), 7.41 д (1Н, C5Hхроман, J 2.4 Гц.), 7.19
17.1 Гц), 3.20 д.д (1H, CH2, J 3.9, 17.1 Гц), 3.66 д.д
д, 7.71 д (4Н, 4-MeC6H4, J 7.8 Гц). Найдено, %: C
(1H, C4Hхроман, J 3.9, 9.0 Гц), 6.85 д (1Н, C8Hхроман,
64.76; H 5.29; Br 18.33. C23H23BrO3. Вычислено,
J 9.0 Гц), 7.30 д.д (1Н, C7Hхроман, J 9.0, 1.8 Гц),
%: C 64.65; H 5.43; Br 18.70.
7.39 д (1Н, C5Hхроман, J 1.8 Гц.), 7.53 д, 7.67 д (4Н,
6-Бром-4-[2-(2,5-диметилфенил)-2-оксо-
4-BrC6H4, J 8.4 Гц). Найдено, %: C 53.37; H 4.19;
этил]спиро[хроман-3,1'-циклогексан]-2-он (5i).
Br 32.68. C22H20Br2O3. Вычислено, %: C 53.69; H
Выход 2.25 г (51%), т.пл. 134-135°С. ИК спектр,
4.10; Br 32.47.
ν, см-1: 1765, 1677 (C=O). Спектр ЯМР 1H, δ, м.д.:
6-Бром-4-[2-(3,4-диметоксифенил)-2-оксо-
1.34-2.20 м [10H, (CH2)5], 2.30 c (3H, Me), 2.36 c
этил]спиро[хроман-3,1'-циклогексан]-2-он (5f).
(3H, Me), 2.91 д.д (1H, CH2, J 9.0, 17.1 Гц), 3.18 д.д
Выход 2.32 г (59%), т.пл. 142-143°С. ИК спектр,
(1H, CH2, J 4.2, 17.1 Гц), 3.69 д.д (1H, C4Hхроман,
ν, см-1: 1766, 1753, 1671, 1661 (C=O). Спектр ЯМР
J 4.2, 9.0 Гц), 6.86 д (1Н, C8Hхроман, J 9.0 Гц),
1H, δ, м.д.: 1.34-2.17 м [10H, (CH2)5], 2.97 д.д
7.31 д.д (1Н, C7Hхроман, J 9.0, 2.4 Гц.), 7.41 д (1Н,
(1H, CH2, J 8.8, 16.8 Гц), 3.21 д.д (1H, CH2, J 4.4,
C5Hхроман, J 2.4 Гц), 7.07 д (1Н, 2,5-Me2C6H3, J
16.8 Гц), 3.67 д.д (1H, C4Hхроман, J 4.4, 8.8 Гц), 3.90
7.8 Гц), 7.14 д (1Н, 2,5-Me2C6H3, J 7.8 Гц), 7.16 с
с (3H, MeO), 3.91 с (3H, MeO), 6.80 д [1Н, C5H в
(1Н, 2,5-Me2C6H3). Найдено, %: C 65.54; H 5.77; Br
3,4-(MeO)2C6H3, J 8.0 Гц]. 6.85 д (1Н, C8Hхроман, J
17.92. C24H25BrO3. Вычислено, %: C 65.31; H 5.71;
8.4 Гц), 7.29 д.д (1Н, C7Hхроман, J 8.4, 2.4 Гц), 7.37-
Br 18.10.
7.41 м [3Н, C5Hхроман, C2H и C6H в 3,4-(MeO)2C6H3].
ВЫВОДЫ
Спектр ЯМР 13С, δ, м.д.: 21,83, 21.91, 25.55, 30.22,
32,84, 43.87 (Cциклогексан), 39.24 (CH2CO), 40.12
Взаимодействие халконов на основе салицило-
(С4), 56.21, 56.25 (2МеО), 110.28, 110.45, 116.92,
вого альдегида с реактивом Реформатского, полу-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
1850
НИКИФОРОВА и др.
ченным из метилового эфира 1-бромциклогексан-
Gen. Chem. 2008, 78, 1422-1424.] doi 10.1134/
карбоновой кислоты и цинка, происходит анало-
S1070363208070244
гично их взаимодействию с подобным реактивом,
2.
Кириллов Н.Ф., Гаврилов А.Г. ЖОрХ. 2008, 44, 975-
полученным из метил-1-бромциклопентанкар-
976. [Kirillov N.F., Gavrilov A.G. Russ. J. Org. Chem.
боксилата и цинка, с образованием замещенных
2008, 44, 963-964.] doi 10.1134/S1070428008070051
спиро[хроманоциклоалкан]-2-онов. Образование
3.
Кириллов Н.Ф., Махмудов Р.Р., Гаврилов А.Г., Мар-
продуктов происходит посредством внутримоле-
данова Л.Г., Вахрин М.И. Хим.-фарм. ж. 2013, 47,
кулярной циклизации первоначальных продуктов
41-42. [Kirillov N.F., Makhmudov R.R., Gavrilov A.G.,
присоединения цинкорганического реагента к суб-
Mardanova L.G., Vakhrin M.I. Pharm. Chem. J. 2013,
страту, в результате атаки более нуклеофильного
47, 40-41.] doi 10.1007/s11094-013-0892-7
фенолятного атома кислорода на карбонильный
4.
Никифорова Е.А., Байбародских Д.В., Кирил-
атом углерода сложноэфирной группы. Проведено
лов Н.Ф., Дмитриев М.В., Шуров С.Н. ЖОрХ.
исследование анальгетической активности полу-
2019, 55, 395-401. [Nikiforova E.A., Baibarods-
ченных соединений и установлено, что продуты
kikh D.V., Kirillov N.F., Dmitriev M.V., Shurov S.N.
5c, g проявляют анальгетическую активность, пре-
Russ. J. Org. Chem. 2019, 55, 339-344.] doi 10.1134/
S1070428019030114
восходящую активность препарата сравнения.
5.
CrysAlisPro,
Agilent
Technologies,
Version
ФОНДОВАЯ ПОДДЕРЖКА
1.171.37.33 (release 27-03-2014 CrysAlis171.NET).
Работа выполнена при финансовой поддерж-
6.
Palatinus L., Chapuis G. J. Appl. Cryst. 2007, 40, 786-
ке Российского фонда фундаментальных иссле-
790. doi 10.1107/S0021889807029238
дований (грант № 18-33-00509) и Правительства
7.
Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
Пермского края.
3-8. doi 10.1107/S2053229614024218
КОНФЛИКТ ИНТЕРЕСОВ
8.
Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
ward J.A.K., Puschmann H. J. Appl. Cryst. 2009, 42,
Авторы заявляют об отсутствии конфликта ин-
339-341. doi 10.1107/S0021889808042726
тересов.
9.
Beilst. EII, 9. 9.
СПИСОК ЛИТЕРАТУРЫ
10.
Xiong G., Liao Y., Liu X.-H., Tang X., Gong Y.
1. Кириллов Н.Ф., Гаврилов А.Г. ЖОХ. 2008, 78,
Tetrahedron.
2018,
74,
1486-1491. doi
10.1016/
1189-1191. [Kirillov N.F., Gavrilov A.G. Russ. J.
j.tet.2018.02.010
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
ВЗАИМОДЕЙСТВИЕ 1-АРИЛ-3-(2-ГИДРОКСИФЕНИЛ)-ПРОП-2-ЕН-1-ОНОВ
1851
Interaction of 1-Aryl-3-(2-hydroxyphenyl)prop-2-en-1-ones
with Methyl 1-Bromocyclohexanecarboxylate and Zinc
E. A. Nikiforova*, D. V. Baibarodskikh, N. F. Kirillov, M. V. Dmitriev, and D. P. Zverev
Perm State National Research University, 614990, Russia, Perm, ul. Bukireva 15
*e-mail: vikro@ya.ru
Received August 15, 2020; revised August 21, 2020; accepted August 23, 2020
1-Aryl-3-(2-hydroxy-5-R-phenyl)prop-2-en-1-ones interact with Reformatsky reagent derived from methyl
1-bromocyclohexanecarboxylate and zinc to give 4-(2-aryl-2-oxoethyl)-6-R-spiro[chromane-3,1'-cyclohe-
xan]-2-ones. The latter are formed by intramolecular cyclization of the initial adducts via nucleophilic attack
of the phenolate oxygen atom on the ester carbonyl carbon atom. Cyclization products which can be formed by
cyclization via attack of the enolate oxygen atom on the ester carbonyl carbon atom were not observed.
Keywords: Reformatsky reaction, 1-bromocycloalkanecarboxylates, 1-bromocyclohexanecarboxylate, spiro-
heterocycles, chroman-2-ones, hydroxychalkones, spirochromanones
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020