ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 12, с. 1852-1861
УДК 547.3 + 547.493 + 547.781.1
ДИАЛКИЛ- И АЛКИЛЕНКАРБОНАТЫ В РЕАКЦИИ
N-АЛКИЛИРОВАНИЯ ИМИДАЗОЛОВ
© 2020 г. И. С. Габовa, Л. А. Хамидуллинаa, b, И. С. Пузыревb,
М. А. Ежиковаb, М. И. Кодессa, b, А. В. Пестовa, b, *
a ФГАОУ ВО «Уральский федеральный университет им. первого Президента России Б.Н. Ельцина»,
620002, Россия, г. Екатеринбург, ул. Мира 19
b ФГБУН «Институт органического синтеза им. И.Я. Постовского Уральского отделения РАН» (ИОС УрО РАН),
620137, Россия, г. Екатеринбург, ул. Софьи Ковалевской 22/20
*е-mail: pestov@ios.uran.ru
Поступила в редакцию 18 августа 2020 г.
После доработки 26 августа 2020 г.
Принята к публикации 28 августа 2020 г.
Взаимодействие имидазолов с рядом диалкил- и алкиленкарбонатов приводит к образованию N-алкил- и
N-гидроксиалкилимидазолов с высоким выходом, соответственно. Реакционная способность диалкил-
карбонатов убывает в ряду диметил- > диэтил- > дибутилкарбонат. Этиленкарбонат эффективнее ги-
дроксиалкилирует имидазолы по сравнению с триметиленкарбонатом. Проведено квантово-химическое
изучение механизма реакций алкилирования имидазола диметилкарбонатом и этиленкарбонатом методом
DFT-B3LYP/6-311++G(d,p).
Ключевые слова: диалкилкарбонаты, алкиленкарбонаты, имидазолы, алкилирование.
DOI: 10.31857/S0514749220120058
Органические карбонаты эффективно исполь-
с галогенпроизводными, органические карбонаты
зуются в качестве практически полезных сырья и
становятся важнейшими химическими реагентами
материалов, таких как технические растворители,
в органическом синтезе. Это требует пристального
теплоносители [1, 2]. Низкая реакционная способ-
изучения закономерностей протекания реакций с
ность данных производных угольной кислоты не
участием органических карбонатов в зависимости
способствовала бурному исследованию их хими-
от их строения, условий реакции и природы ре-
ческих свойств, за исключением участия в процес-
агента-нуклеофила.
сах поликонденсации [3]. Тем не менее последние
Диалкилкарбонаты используются как алкили-
исследования показывают, что данный класс про-
рующие агенты в реакциях с пиразолами [5], пир-
изводных представляет спектр эффективных ре-
ролами [6], индолами [7-11], карбазолами [12, 13],
агентов в органическом синтезе [4]. Амбидентная
бензимидазолами [14] и тетразолами [15]. Следует
электрофильность органического карбоната по-
отметить, что реакции с циклическими карбоната-
зволяет использовать его как в качестве ацилиру-
ми практически не изучались, нами найдено лишь
ющего реагента, так и алкилирующего. При этом
единичное упоминание в литературе [16]. При
реакционная способность карбоната зависит не
этом как реакции алкилирования, так и ацилиро-
только от его строения, но и от природы реаген-
вания с использованием нециклического карбо-
та-нуклеофила. В сочетании с высокой экологи-
ната - диметилкарбоната - широко исследованы
ческой безопасностью и низкой токсичностью
для различных классов органических соединений
современного промышленного производства без
[4]. Меньшая реакционная способность диал-
использования фосгенов, например, по сравнению
килкарбонатов по сравнению с алкилирующими
1852
ДИАЛКИЛ- И АЛКИЛЕНКАРБОНАТЫ В РЕАКЦИИ
1853
хлорсодержащими реагентами требует проведе-
без отгонки с использованием стандартной проце-
ния реакции при более высокой температуре или
дуры в делительной воронке с последующей пере-
в присутствии катализаторов. Так взаимодействие
гонкой продукта при уменьшенном давлении. Как
диалкилкарбонатов с N-гетероароматическими со-
следует из полученных данных (табл. 1), имидазо-
единениями зачастую проводят в присутствии
лы и 1,2,3-бензотриазол эффективно подвергаются
органического [12, 13] или неорганического [17]
гидроксиалкилированию. Этиленкарбонат, являю-
основания в полярном апротонном растворителе.
щийся по своему строению пятичленным циклом,
Как отмечается [5], диметилкарбонат может быть
в большинстве случаев реагирует эффективнее по
использован в качестве метилирующего агента для
сравнению с шестичленным триметиленкарбона-
том, что аналогично проявляется и в реакции по-
морфолина и пиперазина без участия катализатора
или дополнительных растворителей при темпера-
лимеризации [18, 19].
туре от 110 до 170°C и атмосферном давлении.
Состав полученных продуктов охаракте-
ризован данными элементного анализа и ИК-
Изучение реакционной способности цикличе-
спектроскопии, строение доказано методом ЯМР
ских и нециклических карбонатов позволяет не
1Н спектроскопии. Возможные побочные процес-
только получать новые реагенты и, тем самым,
сы кватернизации атома азота в положении 3 ими-
разрабатывать методы синтеза органических со-
дазола, полимеризация алкиленкарбоната и обра-
единений, но и расширяет теоретические пред-
зование олигоалкиленгликолей не происходят.
ставления о зависимости свойств органических
соединений от их строения. В настоящей работе
Структурным нециклическим аналогом этилен-
проведено сравнение реакционной способности
карбоната является диметилкарбонат. Сравнение
диалкилкарбонатов и алкиленкарбонатов с имида-
их реакционной способности при взаимодействии
золами и их структурными аналогами.
с имидазолом позволяет проследить влияние
строения органического карбоната на его хими-
Взаимодействие этиленкарбоната и тримети-
ческие свойства. Действительно, как следует из
ленкарбоната с имидазолом и его производными
полученных данных, реакционная способность
проводили в среде толуола при кипячении с обрат-
диметилкарбоната в реакции метилирования
ным холодильником (схема 1).
имидазола (схема 2) ниже, чем этиленкарбоната,
Экспериментальным преимуществом данного
несмотря на одинаковое количество атомов угле-
метода получения аминоспиртов является просто-
рода в их составе (табл. 2, опыт 1). Попытка уве-
та проведения взаимодействия, в результате кото-
личить выход 1-метилимидазола за счет проведе-
рого реакционная масса превращается из гомоген-
ния реакции в более высококипящем растворителе
ной в двухфазную. Это позволяет отделить толуол
(табл. 2, опыты 2-4) не увенчалась успехом, по-
Схема 1.
O
O
O
n
N
–CO2
N
H
CH2(CH2)nOH
CH3
N
N
N
N
N
N
:
;
;
;
;
N
; N
;
N
CH3
N
N
N
N
N
N
N
N
H
H
H
H
H
H
H
H
1
2
3
4
5
6
7
n = 1 (a), 2 (b).
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
1854
ГАБОВ и др.
Таблица 1. Выходы продуктов гидроксиалкилирования имидазола и его производных, толуол, Δ, 5 ч.
Выход, %
Реагент
a
b
1
68
51
2
63
42
3
64
51
4
68
36
5
39
38
6
0
н/д
7
0
н/д
скольку разделить продукт и растворитель фракци-
Первоначально происходит нуклеофильная
онной перегонкой не удалось. Более эффективный
атака атомом азота по типу SN2 через образование
результат получилось достигнуть при использова-
переходного состояния TS-1a с энергетическим
нии избытка диметилкарбоната без растворителя
барьером 36.5 ккал/моль. Данное переходное со-
(табл. 2, опыт 5). Для увеличения выхода продукта
стояние характеризуется удлинением связи C-O в
необходимо использовать каталитические коли-
диметилкарбонате на 0.6 Å. В образующейся ион-
чества основания (табл. 2, опыт 6). В ряду диме-
ной паре 3 (схема 3) происходит самопроизвольная
тилкарбонат, диэтилкарбонат и дибутилкарбонат
миграция протона с иона N-метилимидазолиния
реакционная способность уменьшается, несмотря
к карбметоксильной группе с образованием ин-
на увеличение температуры кипения карбоната
термедиатного комплекса IC-1, состоящего из
(табл. 2, опыты 6-8).
N-метилимидазола и метилкарбамата. Затем про-
В настоящей работе проведено сравнение ме-
исходит внутримолекулярный перенос протона в
ханизма взаимодействия этиленкарбоната и ди-
метилкарбонате через переходное состояние TS-2a
метилкарбоната с имидазолом c использованием
с энергетическим барьером 37.0 ккал/моль с обра-
квантово-химических расчетов с учетом амби-
зованием углекислого газа и метанола. Суммарная
дентной электрофильности органических карбо-
энергия продуктов реакции на 30.0 ккал/моль
натов [4], позволяющей получать продукты как
ниже, чем реагентов. Экспериментальный кон-
алкилирования, так и ацилирования. Следует от-
троль реакционной массы в конце реакции дей-
метить, что в литературе не удалось найти данные
ствительно показал лишь присутствие метанола.
о каком-либо квантово-химическом описании про-
Результаты квантово-химических расчетов ре-
цессов алкилирования аминов органическими кар-
акции алкилирования имидазола диметилкарбо-
бонатами.
натом, полученные в настоящей работе, частично
Теоретическое изучение механизма реакции ал-
отличаются от результатов [5], предложенных ра-
килирования имидазола этилен- и диметилкарбо-
нее, в отношении механизма реакции. Высказано
натом в рамках теории функционала электронной
Схема 2.
плотности (DFT) в газовой фазе проводили соглас-
но процессам, представленным на схемах 3 и 4.
O
N
N
RO
Энергетические профили последовательных реак-
OR
ций метилирования имидазола и элиминирования
N
-CO2, ROH
N
углекислого газа из метилкарбоната, рассчитан-
H
R
ные для газовой фазы, а также пространственное
1
1c-e
строение локализованных переходных состояний
R = Me, Et, Bu.
приведены на рис. 1.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
ДИАЛКИЛ- И АЛКИЛЕНКАРБОНАТЫ В РЕАКЦИИ
1855
Таблица 2. Результаты взаимодействия имидазола с диалкилкарбонатами.
Эксперимент
Продукт
Растворитель
Основание
Время, ч
Выход (конверсия), %
1
1с
Толуол
5
18
2
1с
Диглим
5
(27)
3
1с
Триглим
Без основания
5
(31)
4
1с
Декалин
5
29
5
1с
Диметилкарбонат
10
26
6
1с
Диметилкарбонат
10
38
7
1d
Диэтилкарбонат
КОН
10
27
8
1e
Дибутилкарбонат
10
10
предположение о том, что на первой стадии реак-
строение локализованных переходных состояний
ции происходит образование диоксида углерода
приведены на рис. 2.
и частицы CH3O-, которая впоследствии отни-
Как видно из схемы 4 и рис. 2, атака имида-
мает протон от иона N-метилимидазолиния. Нам
золом этиленкарбоната с образованием цвит-
не удалось подтвердить данный процесс in silico
тер-иона 6 происходит с энергетическим барье-
ввиду того, что образование диоксида углерода и
ром, находящемся по значению немного выше
высокоэнергетического метоксид-иона сопрово-
(40.3 ккал/моль), чем в случае диметилкарбона-
ждается сильным повышением энергии системы
та. Разрыв связи C-O в переходном состоянии
и происходит без переходного состояния, которое
TS-1b сопровождается ее удлинением почти на
можно было бы зафиксировать.
0.7 Å по сравнению с аналогичной C-O связью в
Полученные результаты квантово-химического
молекуле этиленкарбоната. После миграции про-
моделирования для процесса алкилирования ими-
тона образуется
2-(имидазол-1-ил)этилкарбонат
дазола этиленкарбонатом в газовой фазе представ-
7, который разлагается с образованием продуктов.
лены на схеме 4. Энергетические диаграммы по-
Элиминирование диоксида углерода происходит
следовательных реакций алкилирования и элими-
через переходное состояние TS-2b с барьером
нирования углекислого газа и пространственное
37.5 ккал/моль.
Схема 3.
O
O
O
CH3
HN
C O
δ+
δ-
HN
N
C
C
+
N
CH3
O
N
CH3
+
O O
O O
CH3
CH3
HN
CH3
1
2
TS-1a
3
~H+
N
N CH
3
O
+
N
N
C
O
N CH3
+ CO2 + CH3OH
N
CH3
+
HO O
C
HO O
CH3
CH3
4
TS-2a
IC-1
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
1856
ГАБОВ и др.
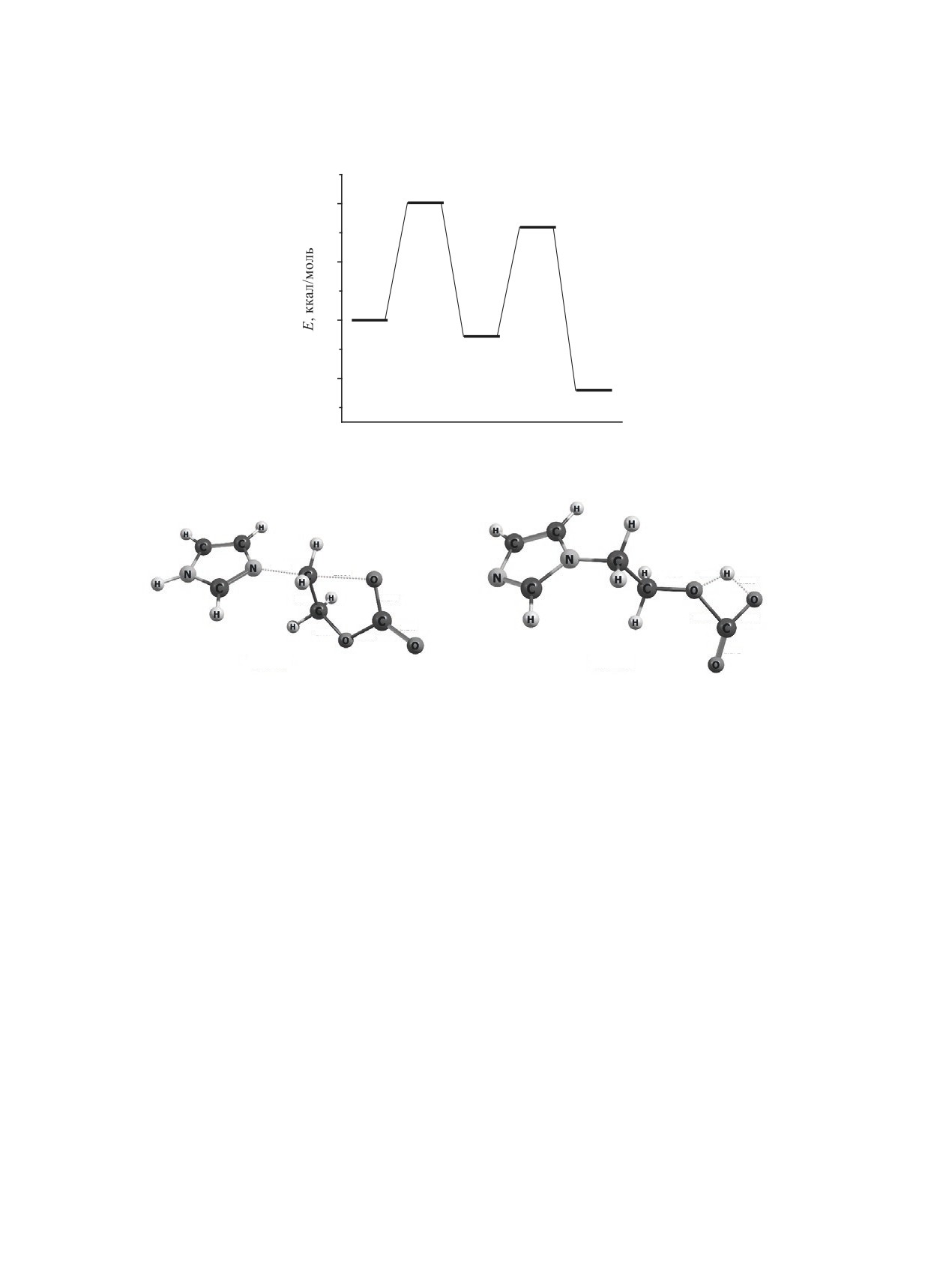
(a)
40
TS-1a
36.5
TS-2a
30.4
20
1+2
1+2
0
0.0
IC-1
-6.6
-20
4+CO2+
MeOH
-30.0
-40
Координата реакции
(b)
2.384
1.449
1.240
1.875
1.380
1.427
1.210
2.057
1.578
1.272
2.406
1.183
1.265
TS-1a
TS-2a
Рис. 1. Энергетическая диаграмма (a) и пространственное строение (b) переходных состояний последовательных реак-
ций метилирования имидазола (TS-1a) и элиминирования углекислого газа из метилкарбоната (TS-2a) в газовой фазе.
Расстояния приведены в Å.
Схема 4.
O
O
O
CH2
CH2
HN
C O
C O
δ+
δ-
N
C
+
N
CH2
O
N
CH2
O
O O
H2C CH2
HN
HN
1
5
TS-1b
6
~H+
OH
O
O
CH2
CH2
C O
CH2
C O
N CH2
+ CO2
N
O
O
CH2 H
N
CH2
H
N
N
N
8
TS-2b
7
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
ДИАЛКИЛ- И АЛКИЛЕНКАРБОНАТЫ В РЕАКЦИИ
1857
(a)
TS-1b
40
40.3
TS-2b
31.9
20
1+5
0
7
0.0
-5.6
-20
8+CO2
-24.1
Координата реакции
(b)
1.852
1.232
2.084
1.433
1.253
1.525
1.274
1.665
1.209
1.257
1.407
1.443
1.172
TS-1b
TS-2b
Рис. 2. Энергетическая диаграмма (a) и пространственное строение (b) переходных состояний последовательных реак-
ций алкилирования имидазола этиленкарбонатом (TS-1a) и элиминирования углекислого газа (TS-2a) в газовой фазе.
Расстояния приведены в Å.
Таким образом, квантово-химические расчеты
тельно Ме4Si, растворитель ДМСО-d6. ИК спек-
показывают, что алкилирование имидазола диме-
тры получены на спектрофотометре Perkin Elmer
тил- и этиленкарбонатом протекает через образо-
Spectrum One (США) в интервале 400-4000 см-1
вание соответственно ионной пары или цвиттер-
методом неполного внутреннего отражения
иона, в которых происходит миграция протона к
(НПВО). Элементный анализ выполнен на автома-
карбоксильной группе и последующее элиминиро-
тическом анализаторе Perkin Elmer CHN РЕ 2400
вание CO2 с образованием продуктов реакции.
(США). Квантово-химические расчеты проводили
с использованием программы ORCA версии 4.2.1
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
[20]. Поиск переходных состояний (TS) осущест-
Имидазол (98%), 2-метилимидазол (98%), 4-ме-
вляли методом релаксированного сканирования по
тилимидазол (98%), бензимидазол (98%), 1,2,3-
координате реакции. Для окончательного расчета
бензтриазол (98%), этиленкарбонат (97%), диме-
энергии реагентов, продуктов реакции и переход-
тилкарбонат (97%), диэтилкарбонат (97%) произ-
ных состояний, а также гармонического колеба-
водства Alfa Aesar использовали без дополнитель-
тельного анализа использовали гибридный функ-
ной очистки.
ционал B3LYP и базисный набор 6-311++G(d,p).
Спектры ЯМР 1Н зарегистрированы на спек-
Для переходных состояний число отрицательных
трометре Bruker DRX-400 (Германия) относи-
собственных значений матрицы Гессе λ = 1, в то
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
1858
ГАБОВ и др.
время как для оптимизированных структур реаген-
охлаждения смеси нижний слой отделяли и пере-
тов и продуктов реакции значение λ = 0. Такие зна-
гоняли при уменьшенном давлении. Выход 3.65 г
чения λ свидетельствуют о том, что все рассчитан-
(60%), т.кип. 189-192°С (5 мм рт.ст). Спектр ЯМР
ные структуры являются стационарными точками
1Н, δ, м.д.: 3.75 т.д (2Н, СН2О, J 5.4, 5.0 Гц), 4.29 т
на поверхности потенциальной энергии (ППЭ).
(2Н, СН2N, J 5.4 Гц), 5.02 уш.т (1H, OH, J 5.0 Гц),
7.27-7.17 м (2H, H-5, H-6), 7.66-7.59 м (2H, H-4,
1-(2-Гидроксиэтил)имидазол
(1a). Смесь
H-7), 8.17 с (1H, H-2). Найдено, %: С 66.60; Н 6.16;
10.2 г (0.15 моль) имидазола, 13.2 г (0.15 моль)
N 17.18. C9H10N2O. Вычислено, %: С 66.65; Н 6.21;
этиленкарбоната и 24 мл толуола кипятили с об-
N 17.21.
ратным холодильником 5 ч. После охлаждения
смеси нижний слой отделяли и перегоняли при
1-(2-Гидроксиэтил)-1,2,3-бензотриазол
(5a).
уменьшенном давлении. Выход 11.44 г (68%),
Смесь 1.12 г (9.38 ммоль) 1,2,3-бензотриазола,
т.кип. 165-166°С (5 мм рт.ст). Спектр ЯМР 1Н, δ,
0.83 г (9.38 ммоль) этиленкарбоната и 3 мл толуо-
м.д.: 3.65 т (2Н, CH2O, J 5.5 Гц), 3.99 т (2Н, CH2N,
ла кипятили с обратным холодильником 5 ч. После
J 5.5 Гц), 5.16 уш.c (1H, OH), 6.88 т (1H, H-4, J
охлаждения смеси нижний слой отделяли и пере-
гоняли при уменьшенном давлении. Выход 2.41 г
1.1 Гц), 7.16 т (1H, H-5, J 1.1 Гц),7.60 уш.т (1H,
H-2, J 1.1 Гц). Найдено, %: С 53.50; Н 7.12; N 24.90.
(39%), т.кип. 190-192°С (5 мм рт.ст). Спектр ЯМР
1Н, δ, м.д.: 3.83-3.91 м (2Н, СН2О), 4.75 т (2Н,
C5H8N2O. Вычислено, %: С 53.56; Н 7.19; N 24.98.
N, J 5.4 Гц), 5.01 уш.с (1H, OH), 7.39 д.д.д (1H,
СН2
1-(2-Гидроксиэтил)-2-метилимидазол
(2a).
H-5, J 8.3, 7.0, 1.1 Гц), 7.53 д.д.д (1H, H-6, J 8.3, 7.0,
Смесь
6.15 г
(0.075 моль)
2-метилимидазола,
1.1 Гц), 7.87 д (1H, H-7, J 8.3 Гц), 8.03 д (1H, H-4,
6.6 г (0.075 моль) этиленкарбоната и 12 мл толуола
J 8.3 Гц). Найдено, %: С 58.81; Н 5.52; N 25.70.
кипятили с обратным холодильником 5 ч. После
C8H9N3O. Вычислено, %: С 58.88; Н 5.56; N 25.75.
охлаждения смеси нижний слой отделяли и пере-
1-(3-Гидроксипропил)имидазол
(1b).
гоняли при уменьшенном давлении. Выход 5.99 г
Смесь 2.55 г (0.0375 моль) имидазола, 3.83 г
(63%), т.кип. 169-170°С (5 мм рт.ст). Спектр ЯМР
(0.0375 моль) триметиленкарбоната и 6 мл толуо-
1Н, δ, м.д.: 2.27 с (3Н, CH3), 3.62 т (2Н, CH2O, J
ла кипятили с обратным холодильником 5 ч. После
5.6 Гц), 3.90 т (2 Н, CH2N, J 5.6 Гц), 5.13 уш.с (1H,
охлаждения смеси нижний слой отделяли и пере-
OH), 6.70 д (1H, H-4, J 1.3 Гц), 7.02 д (1H, H-5,
гоняли при уменьшенном давлении. Выход 2.41 г
J 1.3 Гц). Найдено, %: С 56.53; Н 8.07; N 24.015.
(51%), т.кип. 190-193°С (5 мм рт.ст). Спектр ЯМР
C6H10N2O. Вычислено, %: С 57.12; Н 7.99; N 22.91.
, J 6.5 Гц), 3.36 т (2Н,
1Н, δ, м.д.: 1.83 к (2Н, СН2
1-(2-Гидроксиэтил)-4-метилимидазол
(3a).
СН2О, J 6.1 Гц), 4.01 т (2Н, СН2N, J 7.1 Гц), 4.71
Смесь
6.15 г
(0.075 моль)
4-метилимидазола,
уш.с (1H, OH),6.88 т (1H, H-4, J 1.3 Гц), 7.15 т (1H,
6.6 г (0.075 моль) этиленкарбоната и 12 мл толуола
H-5, J 1.3 Гц), 7.60 уш.с (1H, H-2). Найдено, %: С
кипятили с обратным холодильником 5 ч. После
57.18; Н 8.03; N 22.18. C6H10N2O. Вычислено, %:
охлаждения смеси нижний слой отделяли и пере-
С 57.12; Н 7.99; N 22.21.
гоняли при уменьшенном давлении. Выход 6.02 г
1-(3-Гидроксипропил)-2-метилимидазол
(63%), т.кип. 168-169°С (5 мм рт.ст).Спектр ЯМР
(2b). Смесь 4.62 г (0.056 моль) 2-метилимида-
1Н, δ, м.д.: 2.06 д (3Н, CH3, J 1.0 Гц), 3.61 т (2Н,
зола, 5.4 г (0.056 моль) триметиленкарбоната и
CH2O, J 5.5 Гц), 3.90 т (2Н, CH2N, J 5.5 Гц), 5.08
9 мл толуола кипятили с обратным холодильни-
уш.с (1H, OH), 6.83 д.к (1H, H-5, J 1.3, 1.0 Гц), 7.43
ком 5 ч. После охлаждения смеси нижний слой
д (1H, H-2, J 1.3 Гц). Найдено, %: С 56.64; Н 7.87;
отделяли и перегоняли при уменьшенном дав-
N 23.10. C6H10N2O. Вычислено, %: С 57.12; Н 7.99;
лении. Выход 3.99 г (76%), т.кип. 155-157°С
N 22.91.
(5 мм рт.ст). Спектр ЯМР 1Н, δ, м.д.: 1.78 к (2Н,
1-(2-Гидроксиэтил)-бензимидазол
(4a).
СН2, J 6.6 Гц), 2.26 с (3Н, СН3), 3.34-3.40 м (2Н,
Смесь 4.43 г (0.0375 моль) бензимидазола, 3.3 г
СН2О), 3.91 т (2Н, CH2N, J 7.1 Гц), 4.76 уш.с (1H,
(0.0375 моль) этиленкарбоната и 6 мл толуола
OH), 6.71 д (1H, H-4, J 1.3 Гц), 7.01 д (1H, H-5,
кипятили с обратным холодильником 5 ч. После
J 1.3 Гц). Найдено, %: С 60.01; Н 8.69; N 20.01.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
ДИАЛКИЛ- И АЛКИЛЕНКАРБОНАТЫ В РЕАКЦИИ
1859
C7H12N2O. Вычислено, %: С 59.98; Н 8.63; N
лаждения первую фракцию отгоняли при атмос-
19.98.
ферном давлении, вторую - при уменьшенном
давлении. Выход 0.78 г (38%), т.кип. 66-69°С
1-(3-Гидроксипропил)-4-метилимидазол
(5 мм рт.ст). Спектр ЯМР 1Н, δ, м.д.: 3.64 с (3Н,
(3b). Смесь 3.08 г (0.0375 моль) 4-метилимида-
СН3N), 6.87 т (1H, H-4, J 1.1 Гц), 7.09 т (1H, H-5, J
зола, 3.60 г (0.0375 моль) триметиленкарбоната и
1.3 Гц), 7.55 уш.с (1H, H-2). Найдено, %: С 58.58;
6 мл толуола кипятили с обратным холодильником
Н 7.30; N 34.09. C4H6N2. Вычислено, %: С 58.51; Н
5 ч. После охлаждения смеси нижний слой отде-
7.37; N 34.12.
ляли и перегоняли при уменьшенном давлении.
Выход 5.49 г (70%), т.кип. 168-170 °С (5 мм рт.ст).
1-Этилимидазол (1d). Смесь 1.7 г (0.025 моль)
Спектр ЯМР 1Н, δ, м.д.: 1.80 к (2Н, СН2, J 6.6 Гц),
имидазола, 9.09 мл (0.075 моль) диэтилкарбоната,
2.06 д (3Н, СН3, J 1.0 Гц), 3.36 т (2Н, СН2ОН, J
0.01 г 18-дибензокрауна-6 и 0.4 г КОН кипятили
6.2 Гц), 3.92 т (2Н, CH2N, J 7.0 Гц), 4.70 уш.с
с обратным холодильником 10 ч. После охлажде-
(1H, OH), 6.79-6.85 м (1H, H-5), 7.44 д (1H, H-2,
ния первую фракцию отгоняли при атмосферном
J 1.3 Гц). Найдено, %: С 59.92; Н 8.60; N 19.93.
давлении, вторую - при уменьшенном давлении.
C7H12N2O. Вычислено, %: С 59.98; Н 8.63; N 19.98.
Выход 0.65 г (27%), т.кип. 76-80°С (5 мм рт.ст).
Спектр ЯМР 1Н, δ, м.д.: 1.32 т (3Н, СН3, J 7.3 Гц),
1-(3-Гидроксипропил)бензимидазол
(4b).
3.98 к (2H, СН2N, J 7.3 Гц), 6.87 т (1H, H-4, J
Смесь 4.43 г (0.0375 моль) бензимидазола, 3.83 г
1.0 Гц), 7.17 т (1H, H-5, J 1.3 Гц), 7.62 уш.с (1H,
(0.0375 моль) триметиленкарбоната и 6 мл то-
H-2). Найдено, %: С 62.51; Н 8.49; N 29.21. C5H8N2.
луола кипятили с обратным холодильником 5 ч.
Вычислено, %: С 62.47; Н 8.39; N 29.14.
После охлаждения смеси нижний слой отделяли
и перегоняли при уменьшенном давлении. Выход
1-Бутилимидазол (1e). Смесь 1.7 г (0.025 моль)
2.41 г (36%), т.кип. 193-194°С (5 мм рт.ст). Спектр
имидазола, 14.14 мл (0.075 моль) дибутилкарбона-
ЯМР 1Н, δ, м.д.: 1.94 к (2Н, СН2, J 6.5 Гц), 3.39 т
та, 0.01 г 18-дибензокрауна-6 и 0.4 г КОН кипятили
(2Н, СН2О, J 6.1 Гц), 4.31 т (2Н, CH2N, J 7.0 Гц),
с обратным холодильником 10 ч. После охлажде-
6.50-4.50 уш.с (1H, OH), 7.27-7.16 м (2H, H-5,
ния первую фракцию отгоняли при атмосферном
H-6), 7.59-7.61 м (1H, H-7), 7.65-7.67 м (1H, H-4),
давлении, вторую - при уменьшенном давлении.
8.20 с (1H, H-2). Найдено, %: С 68.18; Н 6.92; N
Выход 0.31 г (10%), т.кип. 98-100°С (5 мм рт.ст).
19.56. C10H12N2O. Вычислено, %: С 68.12; Н 6.86;
Спектр ЯМР 1Н, δ, м.д.: 0.88 т (3Н, CH3, J 7.4 Гц),
N 19.50.
1.30-1.34 м (2Н, CH2), 1.54-1.58 м (2Н, CH2), 4.06
т (2Н, СН2N, J 6.6 Гц), 6.94 уш.с (1H, H-4), 7.48 т
1-(3-Гидроксипропил)-1,2,3-бензотриазол
(1H, H-5, J 1.4 Гц),7.83 с (1H, H-2). Найдено, %: С
(5b). Смесь 1.12 г (9.38 ммоль) 1,2,3-бензотриа-
67.55; Н 9.62; N 22.31. C7H12N2. Вычислено, %: С
зола, 0.96 г (9.378 ммоль) триметиленкарбоната и
67.70; Н 9.74; N 22.56.
1.5 мл толуола кипятили с обратным холодильни-
ком 5 ч. После охлаждения смеси нижний слой от-
ВЫВОДЫ
деляли и перегоняли при уменьшенном давлении.
Этиленкарбонат является эффективным ал-
Выход 0.63 г (38%), т.кип. 151-153°С (5 мм рт.ст).
килирующим реагентом ряда имидазолов.
Спектр ЯМР 1Н, δ, м.д.: 2.20 к (2Н, СН2, J 6.6 Гц),
Триметиленкарбонат, структура которого пред-
3.48 т (2Н, СН2О, J 6.1 Гц), 4.6 уш.с (1H, OH), 4.83
ставляет собой шестичленный цикл, и нецикли-
т (2Н, CH2N, J 7.1 Гц), 7.47-7.41 м (2H, H-5, H-6),
ческие диалкилкарбонаты показывают меньшую
7.96-7.91 м (2H, H-4, H-7). Найдено, %: С 60.95; Н
реакционную способность. В ряду диметил- >
6.19; N 23.66. C9H11N3O. Вычислено, %: С 61.00;
диэтил- > дибутилкарбонат реакционная способ-
Н 6.26; N 23.71.
ность уменьшается. Квантово-химическое иссле-
1-Метилимидазол (1c). Смесь 1.7 г (0.025 моль)
дование механизмов алкилирования имидазола
имидазола, 6.32 мл (0.075 моль) диметилкарбона-
диметилкарбонатом и этиленкарбонатом показало,
та, 0.01 г 18-дибензокрауна-6 и 0.4 г КОН кипяти-
что реакции представляют собой согласованные
ли с обратным холодильником 10 ч. После ох-
процессы с одновременным образованием связей
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
1860
ГАБОВ и др.
N-O и разрывом связей O-C и по своему механиз-
7.
Zhao S.Y., Zhang H.Q., Zhang D.Q., Shao Z.Y.
му являются SN2 нуклеофильным замещением.
Synth. Commun. 2012, 42, 128-135. doi 10.1080/
00397911.2010.523151
БЛАГОДАРНОСТИ
8.
Shieh W.C., Dell S., Bach A., Repič O., Blacklock T.J.
Работа выполнена с использованием обо-
J. Org. Chem. 2003, 68, 1954-1957. doi 10.1021/
рудования Центра коллективного пользования
jo0266644
«Спектроскопия и анализ органических соедине-
9.
Shieh W.C., Lozanov M., Loo M., Repič O., Black-
ний». При проведении работ был использован су-
lock T.J. Tetrahedron Lett. 2003, 44, 4563-4565. doi
перкомпьютер «Уран» ИММ УрО РАН.
10.1016/S0040-4039(03)00992-4
10.
Shieh W.C., Lozanov M., Repič O. Tetrahedron
ФОНДОВАЯ ПОДДЕРЖКА
Lett.
2003,
44,
6943-6945. doi
10.1016/S0040-
Работа выполнена в рамках государствен-
4039(03)01711-8
ного задания Института органического син-
11.
Jiang X., Tiwari A., Thompson M., Chen Z., Clea-
теза им. И.Я. Постовского УрО РАН, а также
ry T.P., Lee T.B.K. Org. Process Res. Dev. 2001, 5,
при поддержке Министерства науки и высше-
604-608. doi 10.1021/op0102215
го образования Российской Федерации (задание
12.
Carafa M., Mele V., Quaranta E. Green Chem. 2012,
№ АААА-А20-120061990010-7).
14, 217-225. doi 10.1039/c1gc15984d
КОНФЛИКТ ИНТЕРЕСОВ
13.
Carafa M., Iannone F., Mele V., Quaranta E. Green
Chem. 2012, 14, 3377-3385. doi 10.1039/c2gc36103e
Авторы заявляют об отсутствии конфликта ин-
14.
Shieh W.C., Dell S., Repič O. Org. Lett. 2001, 3, 4279-
тересов.
4281. doi 10.1021/ol016949n
СПИСОК ЛИТЕРАТУРЫ
15.
Hu X., Dong W., Xie A., Feng L., Zhang Q., Liu Y.
J. Heterocycl. Chem.
2014,
52,
1483-1487. doi
1. Арико Ф., Тундо П. Усп. хим. 2010, 79, 532-543.
10.1002/jhet.2179
[Aricò F., Tundo P. Russ. Chem. Rev. 2010, 79, 479-
489.] doi 10.1070/rc2010v079n06abeh004113
16.
Banfi A., Sala A., Soresinetti P.A., Russo G. J. Hete-
rocycl. Chem.
1990,
27,
215-219. doi
10.1002/
2. Kalhoff J., Eshetu G.G., Bresser D., Passerini S.
ChemSusChem. 2015, 8, 2154-2175. doi 10.1002/
jhet.5570270219
cssc.201500284
17.
Tilstam U. Org. Process Res. Dev. 2012, 16, 1974-
3. Clagett D.C., Shafer S.J. Polym. Eng. Sci. 1985, 25,
1978. doi 10.1021/op3002068
458-461. doi 10.1002/pen.760250805
18.
Kamber N.E., Jeong W., Waymouth R.M., Pratt R.C.,
4. Tundo P., Musolino M., Aricò F. Green Chem. 2018,
Lohmeijer B.G.G., Hedrick J.L. Chem. Rev. 2007, 107,
20, 28-85. doi 10.1039/c7gc01764b
5813-5840. doi 10.1021/cr068415b
5. Ouk S., Thiébaud S., Borredon E., Chabaud B.
19.
Nederberg F., Lohmeijer B.G.G., Leibfarth F.,
Synth. Commun. 2005, 35, 3021-3026. doi 10.1080/
Pratt R.C., Choi J., Dove A.P., Waymouth R.M.,
00397910500278578
Hedrick J.L. Biomacromolecules. 2007, 8, 153-160.
doi 10.1021/bm060795n
6. Carafa M., Distaso M., Mele V., Trani F., Quaranta E.
Tetrahedron Lett. 2008, 49, 3691-3696. doi 10.1016/
20.
Neese F. Wiley Interdiscip. Rev. Comput. Mol. Sci.
j.tetlet.2008.03.129
2012, 2, 73-78. doi 10.1002/wcms.81
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
ДИАЛКИЛ- И АЛКИЛЕНКАРБОНАТЫ В РЕАКЦИИ
1861
Dialkyl- and Alkylene Carbonates
in the N-Alkylation of Imidazoles
I. S. Gabova, L. A. Khamidullinaa, b, I. S. Puzyrevb, M. A. Ezhikovab,
M. I. Kodessa, b, and A. V. Pestova, b, *
a Ural Federal University named after the first President of Russia B.N. Yeltsin,
620002, Russia, Ekaterinburg, ul. Mira 19
b Postovsky Institute of Organic Synthesis, Ural Branch of the Russian Academy of Sciences,
620108, Russia, Ekaterinburg, ul. S. Kovalevskoy/Academicheskaya 22/20
*е-mail: pestov@ios.uran.ru
Received August 18, 2020; revised August 26, 2020; accepted August 28, 2020
The interaction of imidazoles with a number of dialkyl- and alkylene carbonates leads to the formation of N-
alkyl- and N-hydroxyalkylimidazoles in high yield, respectively. The reactivity of dialkyl carbonates decreases
in the order dimethyl-> diethyl-> dibutyl carbonate. Hydroxyalkylation of imidazoles by ethylene carbonate is
more efficient than in the case of the using of trimethylene carbonate. A quantum-chemical study of the mecha-
nism of the reactions of imidazole alkylation with dimethyl carbonate and ethylene carbonate using the method
DFT-B3LYP/6-311++G(d,p) was carried out.
Keywords: dialkyl carbonates, alkylene carbonates, imidazoles, alkylation
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020