ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 12, с. 1943-1947
КРАТКИЕ СООБЩЕНИЯ
УДК 547.821; 547.333
НОВЫЕ РЕАКЦИИ СОЛЕЙ ТРОПИЛИЯ
С ГИДРАЗИДАМИ п-НИТРОБЕНЗОЙНОЙ, ТИО-
И КАРБАМИНОВОЙ КИСЛОТ
ИЛИ БЕНЗИЛКАРБАМИДОМ
© 2020 г. Л. П. Юнникова*, Т. А. Акентьева, Ю. Е. Лихарева
ФГБОУ ВО «Пермский государственный аграрно-технологический университет им. академика Д.Н. Прянишникова»,
614990, Россия, Пермский край, г. Пермь, ул. Петропавловская 23
*е-mail: yunnikova@yahoo.com
Поступила в редакцию 27 августа 2020 г.
После доработки 10 сентября 2020 г.
Принята к публикации 12 сентября 2020 г.
Для получения потенциально биологически активных соединений изучено взаимодействие тетрафтор-
бората тропилия с гидразидами п-нитробензойной, тио- и карбаминовой кислот или бензилкарбамидом.
Получены продукты моно- или дитропилирования - N'-(циклогепта-2,4,6-триен-1-ил)-4-нитробензгидра-
зид, N',N'-ди(циклогепта-2,4,6-триен-1-ил)-4-нитробензгидразид, 2,2-ди(циклогепта-2,4,6-триен-1-ил)-
гидразинкарбоксамид, N-2-ди(циклогепта-2,4,6-триен-1-ил)гидразинкарботиоамид, 1-бензил-3-(цикло-
гепта-2,4,6-триен-1-ил)карбамид.
Ключевые слова: гидразид п-нитробензойной кислоты, семикарбазид, семитиокарбазид, N-бензилкар-
бамид, тетрафторборат тропилия.
DOI: 10.31857/S0514749220120174
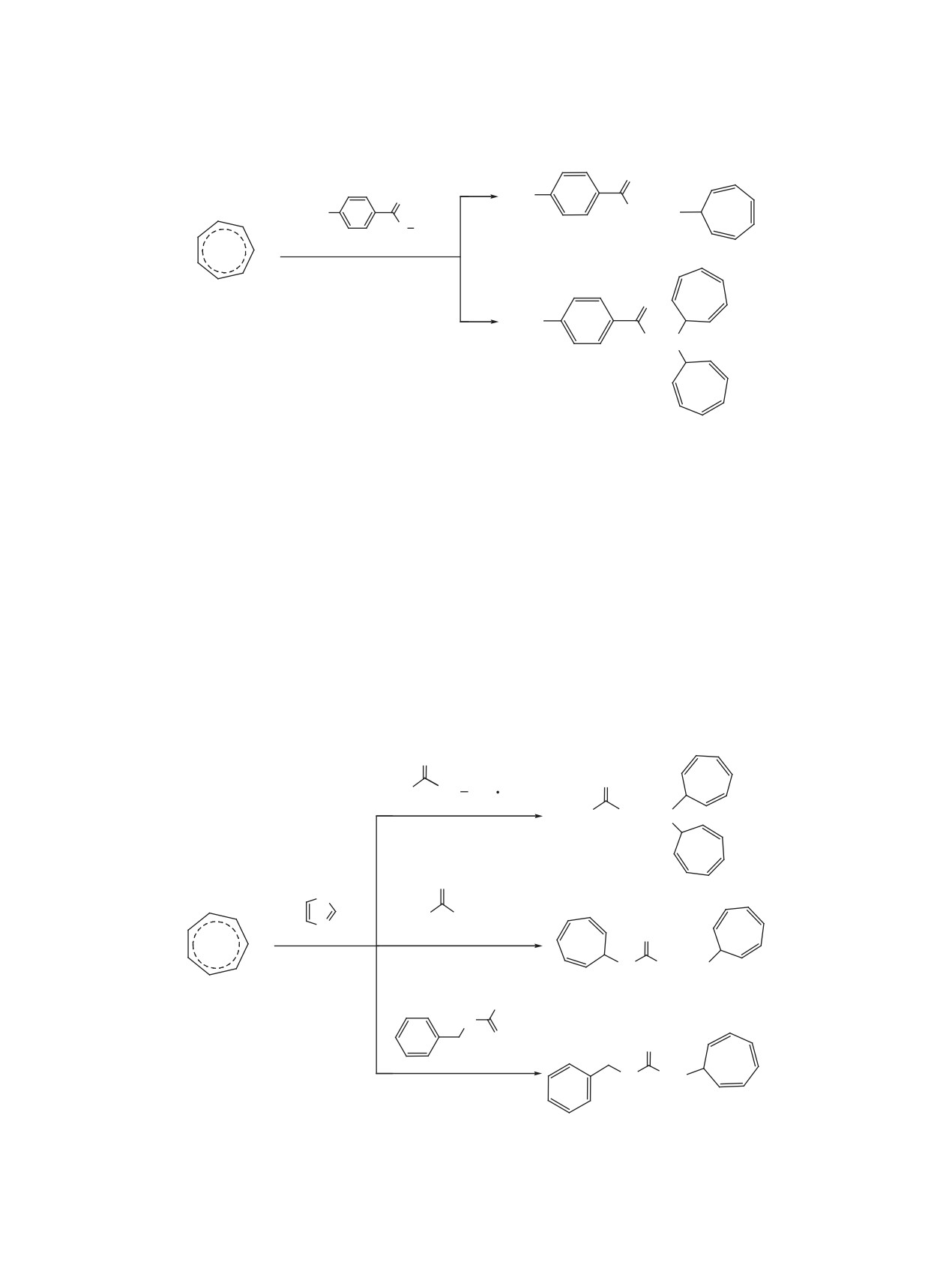
Ранее описано получение
4-(7-циклогепта-
ными. Взаимодействие тетрафторбората тропилия
1,3,5-триенил)анилина [1] и 4-(7-циклогепта-1,3,5-
с 2,5-диамино-1,3,4-тиадиазолом или 3,5-диами-
триенил)-N-(1-циклогепта-2,4,6-триенил)анилина
но-1,2,4-тиадиазолом протекает как дизамещение
по двум аминогруппам [6]. Аналогично протекает
[2], обладающих противомикробной активностью
взаимодействие тетрафторбората тропилия с кар-
в отношении St. aureus и микроскопических грибов
бамидом, тиокарбамидом и сульфаниламидом [7].
рода Candida. В продолжение этих исследований
изучено взаимодействие солей тропилия с фарма-
Гидразиды бензойных кислот
[8], а также
кофорными 2-аминопиридином [3], 2-аминопири-
производные мочевины и тиомочевины занима-
мидином [4] и 4,6-дизамещенными пиримидинами
ют важное место среди лекарственных средств.
[5], которое протекает селективно по экзоцикличе-
Интерес к их производным - N-бензилкарбамиду,
скому атому азота аминогруппы как монозамеще-
семикарбазиду и семитиокарбазиду - обусловлен
выраженной биологической активностью этих со-
ние. Новый результат получен при взаимодействии
единений [9-13].
тетрафторбората тропилия с 2,6-диаминопирими-
дином, заключающийся в образовании 3,5-ди(ци-
С целью получения потенциально биологиче-
клогепта-2,4,6-триен-1-ил)пиридин-2,6-диамина
ски активных соединений изучено взаимодействие
[6], в котором две аминогруппы остаются свобод-
тетрафторбората тропилия с гидразидами п-ни-
1943
1944
ЮННИКОВА и др.
Схема 1.
O
1:1
O
O2N
O2N
HN NH
HN NH2
2
3a
+
EtOH, H2O
-
BF4
O
2:1
1
O2N
HN N
3b
тробензойной, тио- и карбаминовой кислот или
триен-1-ил)-4-нитробензгидразида (3b) с высоким
бензилкарбамидом.
выходом (схема 1).
В данном сообщении обсуждаются резуль-
Реакция соли 1 с семикарбазидом (4) протекает
таты взаимодействия тетрафторбората тропи-
как дизамещение двух атомов водорода в группе
лия (1) с гидразидом п-нитробензойной кислоты
NH-NH2 на фрагменты тропилия. Реакция соли
(2), семикарбазидом (4), семитиокарбазидом (5),
1 с семитиокарбазидом (5) протекает иначе. В
N-бензилкарбамидом (6). Установлено, что вза-
этом случае образуется продукт 8, содержащий по
имодействие соли 1 с гидразидом п-нитробен-
одному тропилиевому фрагменту в амидной и
зойной кислоты (2) в зависимости от соотно-
гидразидной группах. Реакция соли 1 с N-бен-
шения исходных реагентов протекает как моно-
зилкарбамидом (6) протекает как монозамещение
или дитропилирование с образованием соеди-
в амидной группе соединения 6. Реакции схемы 2
нений N'-(циклогепта-2,4,6-триен-1-ил)-4-нитро-
протекают при участии имидазола, используемого
бензгидразида (3а) или N',N'-ди(циклогепта-2,4,6-
в качестве переносчика катиона тропилия.
Схема 2.
O
O
H2N
NH NH2 HCl
4
H2N NH N
S
7
H
N
H2N
NH NH2
N
5
S
+
EtOH, H2O
N
NH N
-
H
H
BF4
NH2
8
1
HN
O
O
6
N
NH
H
9
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
НОВЫЕ РЕАКЦИИ СОЛЕЙ ТРОПИЛИЯ С ГИДР
АЗИДАМИ
1945
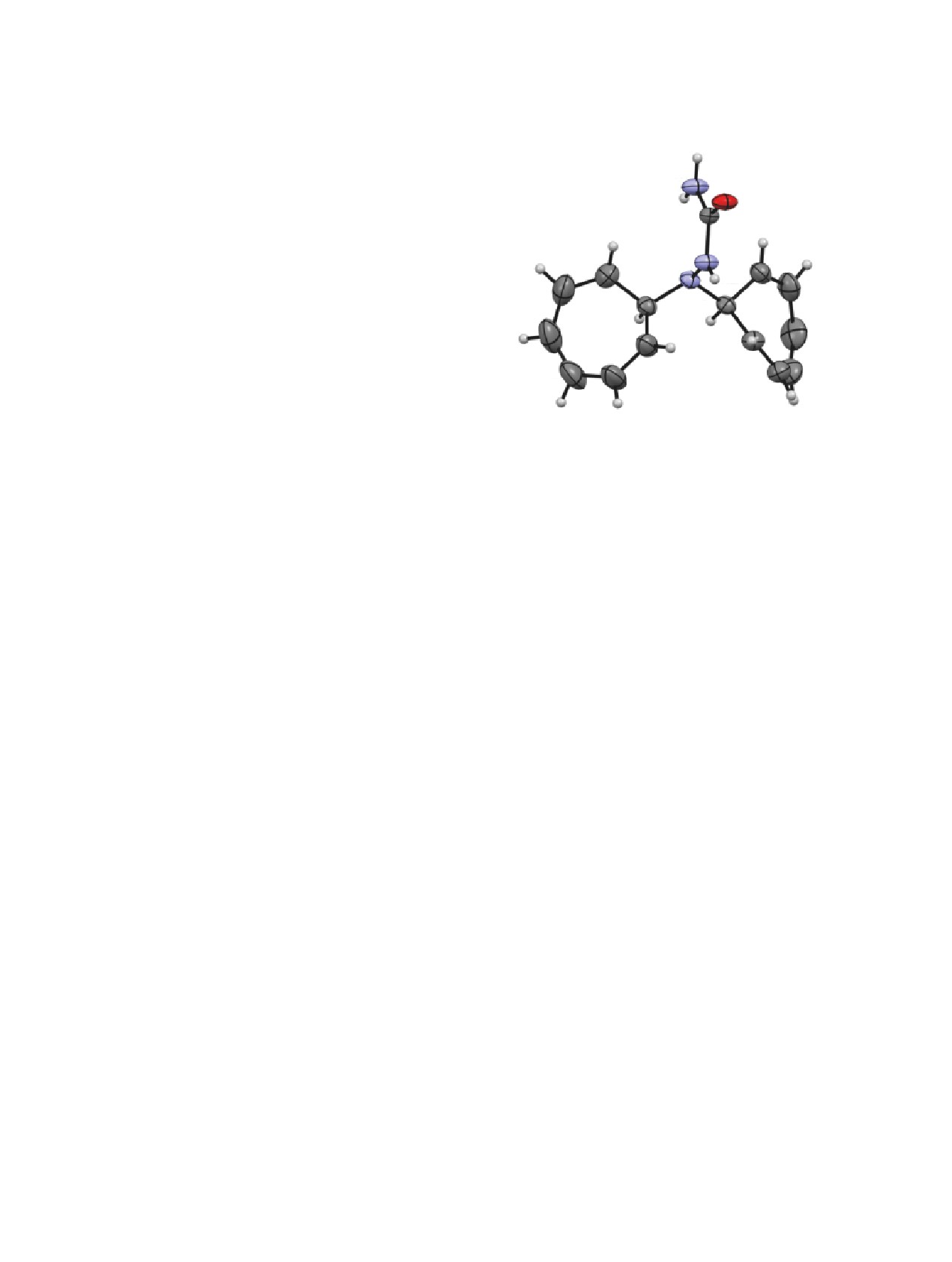
Строение полученных соединений установлено
H1B
на основании данных масс-спектрометрии, ЯМР
N1
1Н спектроскопии, рентгеноструктурного анализа
H1A
O1
(РСА) для соединения 7.
C1
Для однозначного установления структуры
N2
соединения 7 выполнен РСА его монокристалла.
C4
C10
C3
N3
H2A
Согласно данным РСА, соединение 7 кристалли-
C2
C11
зуется в центросимметричной пространствен-
C9
C5
ной группе триклинной сингонии. Фрагмент
C8
C12
семикарбазида плоский в пределах
0.01 Å.
C15
Циклогептатриеновые циклы принимают кон-
C14
C13
C6
C7
формацию ванна и расположены приблизитель-
но симметрично относительно семикарбазидного
фрагмента. Диэральные углы между плоскостью
Общий вид молекулы соединения 7 по данным РСА в
данного фрагмента и плоскостями C14C15C10C11 и
тепловых эллипсоидах 50% вероятности.
C3C4C7C8 составляют 57.9° и 58.3° соответствен-
но. В кристалле молекулы связаны в цепи, вытя-
нутые вдоль оси 0a, за счет межмолекулярных
data_request/cif.
водородных связей N1-H1B∙∙∙O1 [2-x, -y, -z] и N2-
N'-(Циклогепта-2,4,6-триен-1-ил)-4-нитро-
H2A∙∙∙O1 [1-x, -y, -z].
бензгидразид (3а). К суспензии 90 мг (0.5 ммоль)
Рентгеноструктурное исследование
2,2-ди-
гидразида 2 в 2 мл этанола добавляли раствор соли
(циклогепта-2,4,6-триен-1-ил)гидразин-кар-
1 90 мг (0.5 ммоль) в 2 мл воды. Перемешивали в
боксамида (7). РСА соединения 7 (см. рисунок)
течение 0.75 ч, затем добавляли 10%-ный NH4OH
выполнен на монокристальном дифрактометре
(до рН 8.0). Выход 120 мг (88%), светло-желтые
Xcalibur Ruby с ССD-детектором по стандартной
кристаллы, т.пл. 134-135 °С (этанол). Спектр ЯМР
методике (MoKα-излучение, 295(2) K, ω-скани-
1Н (400 МГц, ДМСО-d6), δ, м.д.: 10.49 д (1H, J
рование с шагом 1°). Поглощение учтено эмпи-
6.2 Гц), 8.46-8.20 м (2H), 8.00-8.14 м (2H), 6.54-
рически с использованием алгоритма SCALE3
6.75 м (2H), 6.16 д.д.д.д (2H, J 1.7, 2.6, 4.0, 9.1 Гц),
ABSPACK [14]. Сингония кристалла (C15H17N3O,
5.45 д.д.т (2H, J 0.8, 4.6, 9.2 Гц), 5.73-5.97 м (1H),
M 255.31) триклинная, пространственная группа
3.05 д.т.д (1H, J 1.6, 4.6, 6.3 Гц). Масс-спектр, m/z
P-1, a 7.2328(17) Å, b 9.1746(19) Å, c 12.002(2) Å, α
(Iотн, %): 272.1028 [М + Н]+. С14Н13N3O3. 272.1030
69.530(19), β 78.388(18), γ 69.70(2)°, V 696.9(3) Å3,
[С14Н14N3O3]+.
Z 2, μ 0.079 мм-1. Структура расшифрована с помо-
N',N'-Ди(циклогепта-2,4,6-триен-1-ил)-4-
щью программы SHELXS [15] и уточнена полно-
нитробензгидразид
(3b). К суспензии
90 мг
матричным МНК (Метод наименьших квадратов)
(0.5 ммоль) гидразида 2 в 2 мл этанола добавля-
по F2 в анизотропном приближении для всех не-
ли раствор соли 1 180 мг (1 ммоль) в 3 мл воды.
водородных атомов с использованием программы
Перемешивали в течение 0.75 ч, затем добавляли
SHELXL [16] с графическим интерфейсом OLEX2
10%-ный NH4OH (до рН 8.0). Выход 160 мг (89%),
[17]. Атомы водорода групп NH и NH2 уточне-
желтые кристаллы, т.пл. 155°С (с разл., этанол).
ны независимо в изотропном приближении. При
Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ, м.д.: 9.85
уточнении остальных атомов водорода использо-
с (1H), 8.34 д (2H, J 8.8 Гц), 8.04 д (2H, J 8.9 Гц),
вана модель наездника. Окончательные параметры
6.53-6.77 м (4H), 6.09-6.31 м (4H), 5.53 д (4H, J
уточнения: R1 0.0599 [для 2265 отражений с I >
4.4 Гц), 3.15 д.д.т (2H, J 1.6, 3.5, 5.0 Гц).
2σ(I)], wR2 0.1774 (для всех 3219 независимых от-
ражений), S 1.050. Результаты РСА зарегистриро-
2,2-Ди(циклогепта-2,4,6-триен-1-ил)гидра-
ваны в Кембриджском центре кристаллографиче-
зинкарбоксамид (7). К раствору 360 мг (2 ммоль)
ских данных под номером CCDC 2041359 и могут
соли 1 в 5 мл воды и 5 мл этанола прибавляли
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
1946
ЮННИКОВА и др.
210 мг (3 ммоль) имидазола и 120 мг (1 ммоль)
спектры получены на приборе Agilent Technolo-
солянокислого карбазида 4 в один прием. При
gies
6890N/5975B (США), колонка НР-5ms
перемешивании образуется белый раствор, кото-
(30 мм×0.25 мм, 0.25 мкм), газ носитель - гелий,
рый выдерживали в течение 1.5 ч при комнатной
ионизация электронным ударом 70 эВ, температу-
температуре и нейтрализовали 10%-ным NH4OH
ра термостата колонки 100°С. Температура испа-
(до рН 8.0). Выход 140 мг (51%), белые кристал-
рителя - 260, 270°С.
лы, т.пл. 169-172°С (этанол). Спектр ЯМР 1Н
ВЫВОДЫ
(400 МГц, ДМСО-d6), δ, м.д.: 7.61 с (1H), 6.67 к
(4H, J 3.5 Гц), 6.33-6.05 м (6H), 5.62 д.д (2H, J 10.1,
Установлена высокая реакционная способность
5.2 Гц), 5.31 д.т (2H, J 9.8, 4.2 Гц), 3.01 т (2H, J
гидразидов п-нитробензойной, карбаминовой и
5.2 Гц). Масс-спектр, m/z (Iотн, %): 256.1444 [М +
тиокарбаминовой кислот в реакции с тетрафтор-
Н]+. С15Н17N3O. 256.1444 [С15Н18N3O]+.
боратом тропилия, сопровождающейся замещени-
ем атома или атомов водорода только в гидразид-
N-2-Ди(циклогепта-2,4,6-триен-1-ил)гидра-
ном фрагменте (для гидразидов п-нитробензойной
зинкарботиоамид (8). К раствору 180 мг (1 ммоль)
кислоты или семикарбазида), или в гидразидном и
соли 1 в 5 мл воды и 2 мл этанола прибавляли
амидном фрагментах семитиокарбазида. Реакция с
68 мг (1 ммоль) имидазола и 45 мг (0.5 ммоль) се-
N-бензилкарбамидом протекает как монотропили-
митиокарбазида 5 в один прием. При перемеши-
рование по амидной группе.
вании образуется раствор, который выдерживали
в течение 0.5 ч при комнатной температуре и ней-
ФОНДОВАЯ ПОДДЕРЖКА
трализовали 10%-ным NH4OH (до рН 8.0). Выход
Исследование выполнено при финансовой под-
170 мг (58%), белые кристаллы, т.пл. 151-152°С
держке РФФИ в рамках научного проекта № 19-
(этанол). Спектр ЯМР 1Н (400 МГц, ДМСО-d6), δ,
03-00888.
м.д.: 9.28-8.99 м (1H), 7.97 д (1H, J 3.3 Гц), 7.62
д (1H, J 3.5 Гц), 6.91-6.45 м (4H), 6.30-6.02 м
КОНФЛИКТ ИНТЕРЕСОВ
(4H), 5.61 д.д (2H, J 9.8, 5.2 Гц), 5.22 д.д (2H, J 9.7,
Авторы заявляют об отсутствии конфликта ин-
5.2 Гц), 3.09 т.д (2H, J 5.2, 2.6 Гц). Масс-спектр, m/z
тересов.
(Iотн, %): 272.1213 [М + Н]+. С15Н17N3S. 272.1216
[С15Н18N3S]+.
СПИСОК ЛИТЕРАТУРЫ
1-Бензил-3-(циклогепта-2,4,6-триен-1-ил)-
1. Юнникова Л.П., Акентьева Т.А. Пат. 2479571C1
карбамид (9). К раствору 230 мг (1.29 ммоль)
(2013). РФ. Б.И. 2013, № 11.
соли 1 в 7 мл дистиллированной воды прибавляли
2. Юнникова Л.П., Акентьева Т.А., Эсенбаева В.В.
63 мг (1.27 ммоль) имидазола и 190 мг (1.27 ммоль)
Хим.-фарм. ж. 2015, 49, 33-35. [Yunnikova L.P.,
Akent’eva T.A., Ésenbaeva V.V. Pharm. Chem. J.
бензилмочевины 2 в один прием. При перемеши-
2015, 49, 243-245.] doi 10.1007/s11094-015-1263-3
вании образуется раствор, который выдерживали в
течение 40 мин при комнатной температуре и ней-
3. Юнникова Л.П., Лихарева Ю.Е., Акентьева Т.А.
ЖОХ. 2017, 87, 333-335. [Yunnikova L.P., Likhare-
трализовали 10%-ным NH4OH (до рН 8.0). Выход
va Y.E., Akent’eva T.A. Russ. J. Gen. Chem. 2017, 87,
170 мг (56%), белые кристаллы, т.пл. 154-155°С
347-349.] doi 10.1134/S1070363217020323
(этанол). Спектр ЯМР 1Н (400 МГц, ДМСО-d6),
4. Юнникова Л.П., Эсенбаева В.В. ЖОрХ. 2018, 54,
δ, м.д.: 7.46-7.15 м (5H), 6.71-6.60 м (2H), 6.52
1015-1018. [Yunnikova L.P., Esenbaeva V.V. Russ.
д (1H, J 7.6 Гц), 6.34 т (1H, J 6.0 Гц), 6.13 д.д.д.д
J. Org. Chem. 2018, 54, 1018-1022.] doi 10.1134/
(2H, J 9.1, 3.9, 2.6, 1.4 Гц), 5.30 д.д.т (2H, J 9.2, 5.1,
S1070428018070084
0.9 Гц), 4.22 д (2H, J 5.8 Гц), 3.58 д.т.т (1H, J 7.9,
5. Yunnikova L.P., Esenbaeva V.V., Shklyaeva E.V. Изв.
5.2, 1.5 Гц). Масс-спектр, m/z (Iотн, %): 241.1337
вузов. Сер. Хим. и хим. технол. 2018, 61, 47-52. doi
[М + Н]+. С15Н16N2O. 241.1339 [С15Н17N2O]+.
10.6060/ivkkt.20186108.5817
Спектры ЯМР 1Н сняты на приборе Bruker
6. Эсенбаева В.В., Юнникова Л.П., Кудаярова Т.В.,
Avance III HD (400 МГц) (США) в растворе
Данилова Е.А. ЖОХ. 2018, 88, 2087-2090. [Esenbae-
ДМСО-d6, внутренний стандарт ГМДС. Масс-
va V.V., Yunnikova L.P., Kudayarova T.V., Danilo-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020
НОВЫЕ РЕАКЦИИ СОЛЕЙ ТРОПИЛИЯ С ГИДР
АЗИДАМИ
1947
va E.A. Russ. J. Gen. Chem. 2018, 88, 2691-2694.] doi
12. Николаева Л.Л., Ланцова А.В. Саранова Е.В., По-
10.1134/S0044460X18120235
лозкова А.П., Орлова О.Л., Оборотова Н.А., Му-
сияк В.В., Левит Г.Л., Краснов В.П., Бунятян Н.Д.
7. Эсенбаева В.В., Юнникова Л.П. ЖОХ. 2018, 88,
Росс. биотер. ж. 2015, 14, 113.
683-685.
[Esenbaeva V.V., Yunnikova L.P. Russ.
J. Gen. Chem. 2018, 88, 829-831.] doi 10.1134/
13. Газиева Г.А., Стручкова М.И., Колотыркина Н.Г.
S107036321804031X
ХГС. 2011, 47, 266-270. [Gazieva G.A., Struchko-
va M.I., Kolotyrkina N.G. Chem. Heterocycl. Compd.
8. Chandrasekhar T., Kumar L.V., Reddy A.B., Naik P.J.,
2011, 47, 210-214.] doi 10.1007/s10593-011-0742-z
Swamy G.N. Chem. Pharm. Res. 2012, 4, 2795-2802.
14. CrysAlisPro,
Agilent
Technologies,
Version
9. Sriram D., Yogeeswazy P., Thirumurugan R., Pava-
na R.K. J. Med. Chem. 2006, 49, 3448-3450. doi
1.171.37.33 (release 27-03-2014 CrysAlis171 .NET).
10.1021/jm060339h
15. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
ward J.A.K., Puschmann H. J. Appl. Cryst. 2009, 42,
10. Gate L., Tew K.D. Cancer Management in Man:
339-341. doi 10.1107/S0021889808042726
Chemotherapy, Biological Therapy, Hyperthermia
and Supporting Measures. Ed. B. Minev. Dordrecht:
16. Sheldrick G.M. Acta Crystallogr., Sect. A. 2008, 64,
Springer. 2011, 13, 61-85.
112-122. doi 10.1107/S0108767307043930
11. Beauchesne P. Cancers. 2012, 4, 77-87. doi 10.3390/
17. Sheldrick G.M. Acta Crystallogr., Sect. C. 2015, 71,
cancers4010077
3-8. doi 10.1107/S2053229614024218
New Reactions of Tropylium Salts with p-Nitrobenzoic
Hydrazides, Thio and Carbamic Acid or Benzyl Carbamide
L. P. Yunnikova*, T. A. Akent’eva, and Yu. E. Likhareva
Perm State Agro-technological University named after Academician D.N. Pryanishnikov,
614990, Russia, Perm, ul. Petropavlovskaya 23
*e-mail: yunnikova@yahoo.com
Received August 27, 2020; revised September 10, 2020; accepted September 12, 2020
In order to obtain potentially biologically active compounds, the interaction of tropylium tetrafluoroborate
with hydrazides of p-nitrobenzoic, thio- and carbamic acids or benzyl carbamide was studied. Mono- or
ditropylation products were obtained - N-(cyclohepta-2,4,6-trien-1-yl)-4-nitrobenzhydrazide, Nʹ,Nʹ-di(cyclo-
hepta-2,4,6-trien-1-yl)-4-nitrobenzhydrazide, 2,2-di(cyclohepta-2,4,6-trien-1-yl)hydrazinecarboxamide, N-2-
di(cyclohepta-2,4,6-trien-1-yl)hydrazinecarbothioamide, 1-benzyl-3-(cyclohepta-2,4,6-trien-1-yl)carbamide.
Keywords: p-nitrobenzoic acid hydrazide, semicarbazide, semithiocarbazide, N-benzyl carbamide, tropylium
tetrafluoroborate
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 12 2020