ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 2, с. 173-181
УДК 547-304.4
СИНТЕЗ И СТРУКТУРНЫЕ ИССЛЕДОВАНИЯ
ДИХЛОРДИАЗАДИЕНОВ НА ОСНОВЕ
4-МЕТОКСИБЕНЗАЛЬДЕГИДА
© 2020 г. Н. Г. Шихалиевa, *, У. Ф. Аскероваa, С. Г. Мухтароваa, A. A. Ниязоваa,
A. M. Mагеррамовa, П. В. Дороватовскийb, В. Н. Хрусталевc, d, **, В. Г. Ненайденкоe, ***
a Бакинский государственный университет, 1148, Республика Азербайджан, г. Баку, ул. З. Халилова 23
*e-mail: namiqst@gmail.com
b Национальный исследовательский центр «Курчатовский институт»,
123182, Россия, г. Москва, ул. Академика Курчатова 1
c ФГАОУ ВО «Российский университет дружбы народов», 117198, Россия, г. Москва, ул. Миклухо-Маклая 6
**e-mail: vnkhrustalev@gmail.com
d ФГБУН «Институт органической химии им. Н.Д. Зелинского РАН», 119991, Россия, г. Москва, Ленинский пр. 47
e ФГБОУ ВО «Московский государственный университет им. М.В. Ломоносова»,
119991, Россия, г. Москва, Ленинские горы 1
***e-mail: nenajdenko@gmail.com
Поступила в редакцию 02 сентября 2019 г.
После доработки 14 октября 2019 г.
Принята к публикации 20 декабря 2019 г.
Изучено превращение N-замещенных гидразонов 4-метоксибензальдегида в соответствующие 1,2-
диазабута-1,3-диены под действием четыреххлористого углерода в присутствии хлорида меди(I).
Показано, что в реакцию могут быть вовлечны гидразоны различной природы, содержащие в
гидразинном фрагменте как донорные, так и акцепторные заместители. На основе производного 3,5-
бистрифторметилфенил гидразина получены дополнительные подтверждения радикального механизма
данного превращения. Особенности строения некоторых из полученных продуктов изучены с помощью
РСА.
Ключевые слова: каталитическое олефинирование, диазабутадиены, гидразон.
DOI: 10.31857/S0514749220020019
Недавно мы показали, что катализируемая
Данное исследование направлено на расши-
солями меди реакция с гидразонами носит общий
рение понимания механизма данного превращения.
характер и в нее также могут быть вовлечены не
Мы сфокусировались на синтезе производных 4-
только N-незамещенные гидразоны [1-10], но и
метоксибензальдегида в качестве альдегидной
производные, содержащие заместитель на атоме
компоненты превращения. Наше предположение
азота. В результате нами разработана новая
состояло в том, что наличие сильно донорного
реакция образования углерод-углеродных связей
заместителя может повышать электронную
N-монозамещенных гидразонов с полигалоген-
плотность на карбонильном атоме гидразона, влияя
алканами с образованием 1,2-диазабута-1,3-диенов
на протекание реакции. Первоначально нами была
[11]. Это высокоэффективное превращение, ката-
получена серия гидразонов данного альдегида с
лизируемое медью, имеет широкие синтетические
варьированием заместителей в гидразинной части
возможности. Следует отметить, что получаемые
(схема 2). Затем данные субстраты были вовлечены
этим методом диазадиены представляют собой
в реакцию с четыреххлористым углеродом в
очень интересный класс соединений, обладающий
присутствии хлорида меди(I) как катализатора.
богатым синтетическим потенциалом (схема
1)
Таким образом нам удалось получить серию ранее
[12-17].
неописанных дихлордиазадиенов с выходами до 80%.
173
174
ШИХАЛИЕВ и др.
Схема 1.
Hal
X
H
H
CXHal3, CuCl (1%)
N
R
N
R N
Ar
TMEDA (2.5 equiv)
DMSO, rt
N
Ar
выходы до 97%
Hal = Cl, Br; X = Cl, Br, CN, CO2Et, CF3.
Схема 2.
Cl
R
O
Cl
NHNH2
CCl4, CuCl (1%)
O
O
R
CH3COOH,
N
TMEDA (2.5 eq)
N N
O
N
DMSO, rt
EtOH, reflux
H
R
1-7
9-15
R = 4-CN, 4-OCH3, 4-CH3, 4-NO2, 3,5-(CH3)2, 4-F, 2,4-(Cl)2.
Ранее мы показали, что данная реакция имеет
ранее механизмом реакции, который включает
самый общий характер и лишь природа замес-
присоединение трихлорметильного радикала по
тителей в гидразинной части накладывает ограни-
атому углерода гидразонного фрагмента (схема 3).
чения на ее протекания. Например, ранее нам не
При проведении реакции с гидразоном, полу-
удалось вовлечь в реакцию производные гидра-
ченным на основе
3,5-бистрифторметилфенил
зинов, содержащих сильные электронакцепторные
гидразина наблюдалось образование нового типа
группы (производные
2,4-динитрофенил гидра-
продукта. В этом случае нами был выделен
зина, ацил- и сульфонилгидразина). В рамках
продукт сшивки двух молекул гидразона, образо-
данной работы мы исследовали взаимодействие с
вание которого можно объяснить в рамках
гидразонами, содержащими такие акцепторные
радикального механизма реакции (схема 4).
заместители как циано, нитро и трифторметильная
группы.
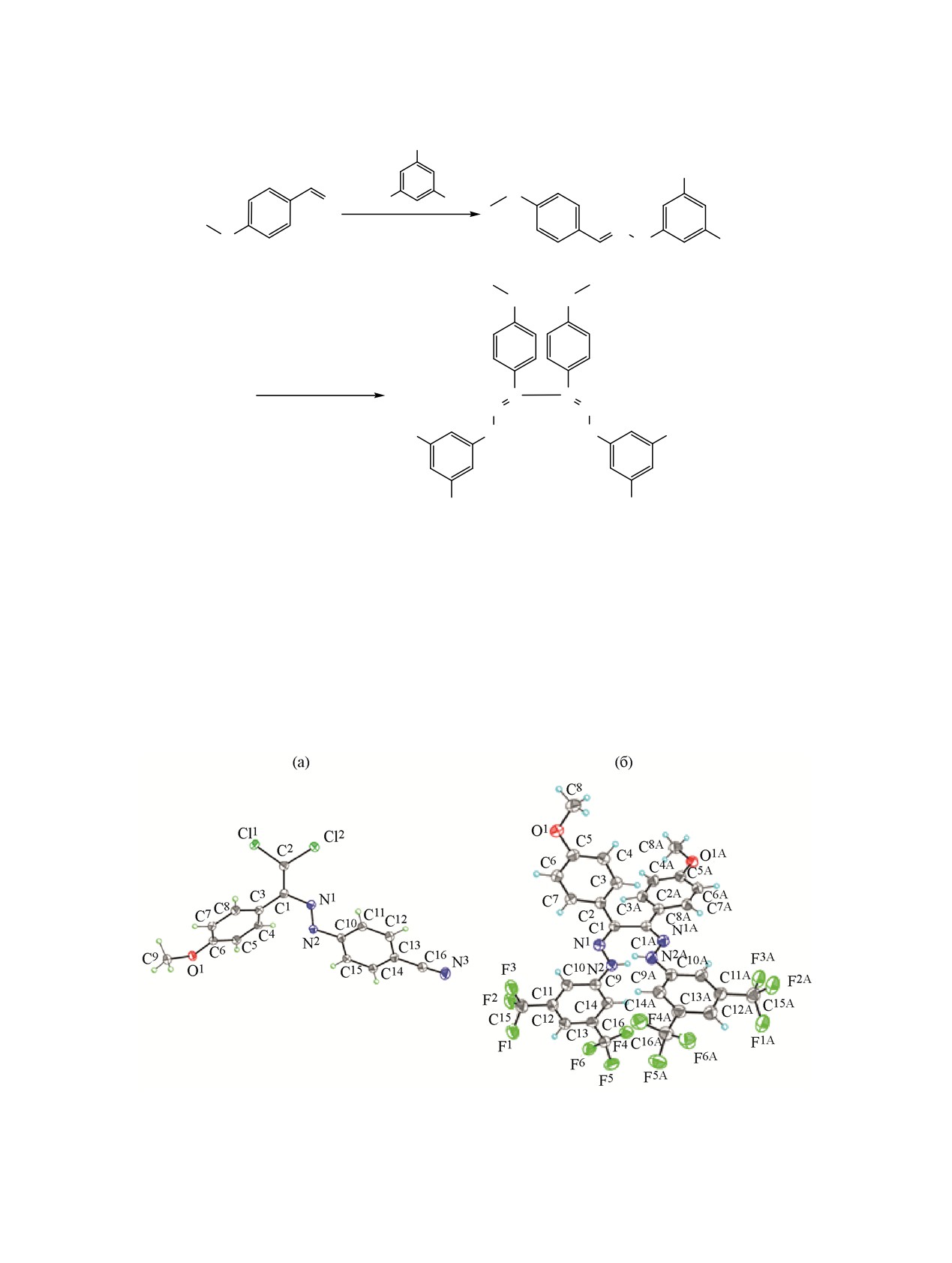
Для однозначного установления строения новых
продуктов рассмотренных выше реакций прове-
Оказалось, что наличие в пара-положении
дено рентгеноструктурное исследование соедине-
альдегидного фрагмента гидразона донорной
ний 9 и 16. Их молекулярное строение и исполь-
метокси группы позволяет осуществить реакцию
зуемая нумерация атомов показаны на рис.
1.
практически с любыми комбинациями замести-
Полные значения геометрических параметров
телей. Так, нам удалось получить соответствующие
приведены в сопроводительных материалах.
продукты с гидразонами пара-циано и пара-нитро-
фенил гидразина, что значительно расширяет
Молекулы исследованных соединений имеют
синтетический потенциал изучаемой реакции. Эти
достаточно жесткую конформацию, определяемую,
данные хорошо коррелируют с предложенным
по-видимому, двумя противоположно направлен-
Схема 3.
CCl4
CuCl2 L
CuCl L
L =TMEDA
Cl
CCl3
Cl
3C
N Ar
Cl
N
TMEDA
Cl3C
HN Ar
N
HN Ar
R H
_HCl TMEDA
N
E
R
N Ar
N
R H
_HCl TMEDA
R
CuCl2 L
D
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
СИНТЕЗ ДИХЛОРДИАЗАДИЕНОВ НА ОСНОВЕ 4-МЕТОКСИБЕНЗАЛЬДЕГИДА
175
Схема 4.
CF3
CF3
O
O
H2NHN
CF3
CH3COOH, EtOH,
N
O
reflux
N
CF3
H
8
O
O
CCl4, CuCl (1%)
C
C
TMEDA (2.5 equiv)
N
N
DMSO, rt
F
NH
HN
CF3
3C
CF3
CF3
16
ными факторами
- стремлением к уплощению
результате действия указанных факторов реали-
вследствие наличия длинной цепи сопряженных
зуются равновесные скрученные конформации
связей
[C6H4-C(=CCl2)-N=N-C6H4-C≡N в
9 и
молекул (рис. 1).
(C6H4-C=N-NH-C6H4)2 в 16], с одной стороны, и
стерическим отталкиванием между атомами хлора
Молекула 9 включает три плоских фрагмента -
и арильными заместителями (в 9) или между двумя
центральный
2,2-дихлор-1-винил-диазенильный
замещенными арильными заместителями и три-
(A) (среднеквадратичное отклонение атомов от
фторметильными группами (в 16), с другой. В
плоскости равно 0.036 Å) и два терминальных 4-
Рис. 1. Молекулярные структуры соединений 9 (а) и 16 (б, индекс A обозначает симметрически эквивалентный атом
относительно поворотной оси второго порядка). Атомы представлены 50%-эллипсоидами анизотропных смещений.
Альтернативные позиции разупорядоченных CF3-групп с меньшими заселенностями в 16 не показаны.
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
176
ШИХАЛИЕВ и др.
Кристаллоструктурные данные для соединений 9 и 16.
Соединение
9
16·CH2Cl2
Элементный состав
C16H11N3OCl2
C33H24N4O2F12Cl2
Размеры монокристалла, мм
0.03×0.05×0.25
0.10×0.12×0.18
λ, нм
0.80246
0.78790
Сингония
Моноклинная
Ромбическая
Пространственная группа
P21/c
Pbcn
a, Å
3.9117(8)
13.479(3)
b, Å
25.109(5)
11.213(2)
c, Å
14.968(3)
22.552(5)
α, град
90
90
β, град
97.07(3)
90
γ, град
90
90
V, Å3
1459.0(5)
3408.5(12)
Z
4
4
dвыч, г·см-3
1.512
1.574
μ, мм-1
0.621
0.385
F(000)
680
1632
Размер монокристалла, мм
0.08×0.12×0.25
0.24×0.18×0.15
θмакс, град
30.86
31.03
Количество измеренных отражений
22735
34331
Количество независимых отражений (Rint)
3141 (0.068)
3971 (0.062)
Количество наблюденных отражений с I > 2σ(I)
2975
2478
количество уточняемых параметров
201
237
GOF по F2
1.065
1.018
R1; wR2 [для отражений с I > 2σ(I)]
0.045; 0.118
0.079; 0.190
R1; wR2 (все измеренные отражения)
0.047; 0.121
0.115; 0.215
Коэффициент экстинкции
0.048(5)
0.0077(7)
Tmin/Tmax
0.850/0.975
0.920/0.960
Δρmax/Δρmin, e.Å-3
0.298/-0.436
0.521/-0.561
метоксифенильный (B) (исключая атомы водорода
Молекула 16 имеет собственную симметрию C2
метильной группы, среднеквадратичное отклоне-
(2) и занимает в кристалле частное положение на
ние атомов от плоскости равно 0.021 Å) и бензо-
поворотной оси второго порядка. Следовательно,
нитрильный (C) (среднеквадратичное отклонение
она включает четыре попарно эквивалентных
атомов от плоскости равно 0.016 Å). Углы между
плоских фрагмента - два 3,5-бис[(трифторметил)-
плоскостями A/B и A/C равны 52.23(4) и 27.76(5)°,
фенил]-гидразилидиновых (A, A') (исключая атомы
соответственно.
фтора трифторметильных групп, среднеквадра-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
СИНТЕЗ ДИХЛОРДИАЗАДИЕНОВ НА ОСНОВЕ 4-МЕТОКСИБЕНЗАЛЬДЕГИДА
177
Рис. 2. Кристаллические структуры соединений 9 (а) и 16 (б). Межмолекулярные водородные связи и невалентные F···F
взаимодействия показаны штриховыми линиями.
тичное отклонение атомов от плоскости равно
(x-½, y+½, -z+1½) [N···O 3.041(4) Å, H···O 2.32(4) Å,
0.018 Å) и два 4-метоксифенильных (B, B') (исклю-
N-H···O 152(4)°]. Далее слои связаны в трех-
чая атомы водорода метильной группы, среднеквад-
мерный каркас посредством слабых невалентных
ратичное отклонение атомов от плоскости равно
взаимодействий F1···F6 с расстояниями 2.864(2)
0.048 Å). Углы между плоскостями A/B (A'/B'), A/A'
(рис. 2).
и B/B' равны 12.69(11), 86.24(3) и 84.82(6)°, соот-
ветственно.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Важно отметить, что молекула 9 представляет
Параметры элементарных ячеек и интенсив-
E-изомер относительно двойной связи N=N, в то
ности отражений для 9 и 16 измерены на синх-
время как молекула 16 - Z,Z-изомер относительно
ротронной станции «РСА» Национального иссле-
двух двойных связей C=N.
довательского центра «Курчатовский институт»,
В кристалле соединения 9, молекулы образуют
используя двухкоординатный детектор Rayonix
SX165 CCD (T 100 K, j-сканирование с шагом 1.0°).
стопки вдоль кристаллографической оси a (рис. 2).
Обработка экспериментальных данных проведена с
Молекулы в стопках связаны друг с другом
слабыми π-π стекинговыми взаимодействиями
помощью программы iMOSFLM, входящей в
комплекс программ CCP4 [18]. Для полученных
(расстояния между плоскостями соответствующих
данных проведен учет поглощения рентгеновского
бензольных колец равны 3.405(4) и 3.468(4) Å;
кратчайшие расстояния между атомами углерода
излучения по программе Scala
[19]. Основные
кристаллоструктурные данные и параметры уточ-
равны - C4···C8 [x+1, y, z] 3.436(3), C5···C7 [x+1, y, z]
нения представлены в табл. 1. Структуры опре-
3.447(3) и C10···C12 [x+1, y, z] 3.512(3) Å), а также
делены прямыми методами и уточнены полно-
слабыми водородными связями C8-H8···Cl1 (x-1, y, z)
матричным методом наименьших квадратов по F2 в
[C···Cl 3.704(2) Å, H···Cl 2.88 Å, C-H···Cl 146°].
анизотропном приближении для неводородных
Далее стопки связаны в гофрированные слои,
атомов. Одна из двух кристаллографически незави-
параллельные плоскости
(010), за счет слабых
симых CF3-групп разупорядочена по трем положе-
водородных связей С12-H12···O1 (x-1, -y+1½, z+½)
ниям с заселенностями 0.6:0.2:0.2. Кристалл соеди-
[C···O 3.391(3) Å, H···O 2.47 Å, C-H···Cl 165°].
нения 16 содержал сольватные молекулы дихлор-
Интересно отметить, что межмолекулярные нева-
метана в соотношении 1:1 к основному соеди-
лентные галоген-галоген взаимодействия в струк-
нению, т.е., общий состав кристалла описывается
туре 9 не наблюдаются.
формулой 16·CH2Cl2. Поскольку сольватные моле-
В кристалле соединения 16, молекулы образуют
кулы дихлорметана были значительно разупоря-
H-связанные слои, параллельные плоскости (001),
дочены, их вклад в рассеяние рентгеновского излу-
за счет прочных водородных связей N2-H2···O1
чение был учтен с помощью программы SQUEEZE,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
178
ШИХАЛИЕВ и др.
входящей в комплекс программ PLATON 09 [20].
(300 МГц, ДМСО-d6), δ, м.д.: 3.86 с (3H, OCH3),
Атом водорода NH-группы в соединении 9 выяв-
6.94 д (2Hаром, J 8.7 Гц), 7.12 д (2Hаром, J 8.6 Гц),
лен объективно в разностных Фурье-синтезах и
7.53 д (2Hаром, J 8.6 Гц), 7.63 д (2Hаром, J 8.7 Гц),
уточнен изотропно с фиксированными парамет-
7.73 с (1H, CH), 7.88 с (1H, NH). Спектр ЯМР 13C
рами смещения [Uизо(H) = 1.2Uэкв(N)]. Положения
(75 МГц, ДМСО-d6), δ, м.д.: 50.8, 96.7, 107.8, 109.6,
остальных атомов водорода в обоих соединениях
115.6, 122.5, 123.5, 129.1, 135.6, 143.4, 156.0.
рассчитаны геометрически и включены в уточ-
(E)-1-(4-Метоксибензилидин)-2-(4-метоксифе-
нение с фиксированными позиционными парамет-
нил)гидразин (2). Выход 85%, порошок темно-
рами (модель
«наездника») и изотропными
желтого цвета, т.пл. 119-120°C. Спектр ЯМР 1H
параметрами смещения [Uiso(H) = 1.5Ueq(C) для
(300 МГц, ДМСО-d6), δ, м.д.: 3.68 с (3H, CH3), 3.77
CH3-групп и Uiso(H) = 1.2Ueq(C) для остальных
с (3H, ОCH3), 6.82 д (2Hаром, J 8.9 Гц), 6.96 т (4Hаром,
групп]. Все расчеты проведены с использованием
J 9.5 Гц), 7.55 д (2H, J 8.7 Гц), 7.77 с (1H, CH), 9.92
комплекса программ SHELXTL
[21]. Таблицы
с (1H, NH). Спектр ЯМР 13C (75 МГц, ДМСО-d6), δ,
координат атомов, длин связей, валентных и тор-
м.д.: 55.6, 113.2, 114.5, 115.0, 127.2, 129.1, 135.9,
сионных углов и анизотропных параметров сме-
140.1, 152.7, 159.5, 162.3.
щения для соединений
9 и
16·CH2Cl2 депо-
нированы в Кембриджском Банке Структурных
(E)-1-(4-Метоксибензилидин)-2-(п-толил)гид-
Данных, номера депонирования - CCDC 1944939 и
разин (3). Выход 83%, порошок светло-перламут-
1944940, соответственно.
рового цвета, т.пл. 105-106°C. Спектр ЯМР 1H
(300 МГц, ДМСО-d6), δ, м.д.: 3.68 с (3H, CH3), 3.77
Спектры ЯМР 1H и 13C соединений сняты на
с (3H, ОCH3), 6.82 д (2Hаром, J 8.9 Гц), 6.96 т (4Hаром,
спектрометре Bruker Avance 300 (с рабочей часто-
J 9.5 Гц), 7.55 д (2Hаром, J 8.7 Гц), 7.77 с (1H, CH),
той 300 MГц) в растворителях CDCl3 и ДМСО. В
9.92 с (1H, NH). Спектр ЯМР 13C (75 MГц, ДМСО-
качестве внутреннего стандарта использовали
d6) δ, м.д.: 20.6, 55.6, 112.2, 114.6, 127.3, 129.0,
SiMe4. ТСХ ставили на пластинках Silufol УФ-254,
129.9, 136.3, 143.8, 157.7, 159.6.
для ясной видимости образованных пятен исполь-
зовали подкисленный раствор KMnO4 и лампы УФ
(E)-1-(4-Метоксибензилидин)-2-(4-нитрофе-
лучей. Колоночная хроматография осуществлена
нил)гидразин(4). Выход 87%, порошок бордового
на силикагели фирмы Merk (63-200).
цвета, т.пл. 152-155°C. Спектр ЯМР 1H (300 МГц,
ДМСО-d6), δ, м.д.: 3.80 с (3H, OCH3), 7.00 д (2Hаром,
Общая методика синтеза гидразонов. В трех-
J 8.6 Гц), 7.14 д (2Hаром, J 8.8 Гц), 7.68 д (2Hаром, J
горлую круглодонную колбу с фенилгидразином
8.5 Гц), 8.02 с (1H, CH), 8.11 д (2Hаром, J 9.0 Гц),
(5 ммоль) добавляют этанол (20-50 мл) и 0.820 г
11.25 с (1H, NH). Спектр ЯМР 13C (75 МГц, ДМСО-
CH3COONa. Колба снабжается обратным холо-
d6), δ, м.д.: 55.7, 111.4, 114.7, 126.6, 127.7, 128.5,
дильником, капельной воронкой и термометром. С
138.3, 142.4, 151.3, 160.7.
помощью капельной воронки к реакционной смеси
добавляют 5 ммоль альдегида и нагревают при
(E)-1-(3,5-Диметилфенил)-2-(4-метоксибензи-
перемешивании. При достижении температуры 78°С
лидин)гидразин (5). Выход 91%, порошок караме-
смесь кипятят
5-10 мин. Впоследствии реак-
льного цвета, т.пл. 112-115°C. Спектр ЯМР 1H
ционную смесь охлаждают до комнатной темпера-
(300 МГц, ДМСО-d6), δ, м.д.: 2.32 с (6H, CH3), 3.86
туры и к нему добавляют 50 мл воды. Интен-
с (3H, OCH3), 6.54 с (1Hаром), 6.75 с (2H, CH, NH),
сивным перемешиванием температуру снова повы-
6.93 д (3Hаром, J 8.5 Гц), 7.62 д (3Hаром, J 7.4 Гц).
шают до 60°С и нагревание прекращают. Охлаж-
Спектр ЯМР 13C (75 МГц, ДМСО-d6), δ, м.д.: 21.1,
денную до комнатной температуры реакционную
55.5, 114.1, 120.9, 124.3, 131.7, 133.9, 139.2, 152.4,
смесь фильтруют. При необходимости остаток
152.7, 159.9, 162.3.
продукта промывают водой. Полученный гидразон
(E)-1-(4-Фторфенил)-2-(4-метоксибензили-
сушат при комнатной температуре
(15-20 ч).
дин)гидразин (6). Выход 69%, порошок перламут-
Спектры ЯМР 1H и 13C соответствуют литера-
рового цвета, т.пл. 142-145°C. Спектр ЯМР 1H
турным данным.
(300 МГц, ДМСО-d6), δ, м.д.: 3.78 с (3H, OCH3),
(E)-4-[2-(4-Метоксибензилидин)гидразинил]-
6.95 д (2Hаром, J 8.7 Гц), 7.07-6.99 м (4Hаром), 7.58 д
бензонитрил (1). Выход 82%, порошок перламут-
(2Hаром, J 8.7 Гц), 7.81 с (1H, CH), 10.13 с (1H, NH).
рового цвета, т.пл. 185-187°C. Спектр ЯМР 1H
Спектр ЯМР 13C (75 МГц, ДМСО-d6), δ, м.д.: 55.6,
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
СИНТЕЗ ДИХЛОРДИАЗАДИЕНОВ НА ОСНОВЕ 4-МЕТОКСИБЕНЗАЛЬДЕГИДА
179
113.0, 113.1, 114.6, 115.8, 116.1, 127.5, 128.8, 137.1,
(E)-1-[2,2-Дихлор-1-(4-метоксифенол)винил]-
142.7.
2-(4-метоксифенил)диазин
(10). Выход
80%,
кристаллы оранжевого цвета, т.пл.
136-138°C.
(E)-1-(2,4-Дихлорфенил)-2-(4-метоксибензи-
Спектр ЯМР 1H (300 МГц, CDCl3), δ, м.д.: 3.87 с
лидин)гидразин (7). Выход 71%, вещество белого
(3H, OCH3), 3.88 с (3H, OCH3), 7.01-6.91 м (4Hаром),
цвета, т.пл. 141-144°C. Спектр ЯМР 1H (300 МГц,
7.14 д (2Hаром, J 8.7 Гц), 7.79 д (2Hаром, J 9.0 Гц).
ДМСО-d6), δ, м.д.: 3.75 с (3H, OCH3), 6.95 д (2Hаром,
Спектр ЯМР 13C (75 МГц, CDCl3), δ, м.д.: 50.9,
J 8.7 Гц), 7.07-7.00 м (4Hаром), 7.58 д (2Hаром, J 8.7 Гц),
51.5, 109.5, 110.5, 119.9, 120.8, 128.1, 142.4, 147.6,
7.81 с (1H, CH), 10.13 с (1H, NH). Спектр ЯМР 13C
155.2, 157.7, 158.3.
(75 МГц, ДМСО-d6), δ, м.д.: 55.6, 113.1, 114.6, 115.8,
116.1, 127.5, 128.8, 137.1, 142.7, 154.5, 157.6, 159.7.
(E)-1-[2,2-Дихлор-1-(4-метоксифенил)винил]-
2-(п-толил)диазин (11). Выход 78%, кристаллы
(E)-1-(3,5-Бис(трифторметил)фенил)-2-(4-ме-
темно оранжевого цвета, т.пл. 122-124°C Спектр
токсибензилидин)гидразин (8). Выход 77%, поро-
ЯМР 1H (300 МГц, CDCl3), δ, м.д.: 2.34 с (3H,CH3),
шок перламутрового цвета, т.пл.
125-127°C.
3.87 с (3H, OCH3), 6.98-6.90 м (1Hаром), 7.15 д.т
Спектр ЯМР 1H (300 МГц, ДМСО-d6), δ, м.д.: 3.79 с
(5Hаром, J 18.8, 9.4 Гц), 7.63 д (2Hаром, J 8.6 Гц).
(3H, OCH3), 6.99 д (2Hаром, J 8.8 Гц), 7.27 с (1Hаром),
Спектр ЯМР 13C (75 МГц, CDCl3), δ.., м.д.: 14.2,
7.52 с (2Hаром), 7.66 д (2Hаром, J 8.8 Гц), 7.93 с (1H,
20.7, 29.7, 55.3, 60.9, 113.3, 113.9, 114.0, 129.7,
CH), 10.85 с (1H, NH). Спектр ЯМР 13C (75 МГц,
129.8, 129.9.
ДМСО-d6), δ, м.д.: 55.6, 113.0, 113.1, 114.6, 115.8,
116.1, 127.4, 128.8, 137.1, 142.7, 159.7.
(E)-1-(2,2-Дихлор-1-(4-метоксифенил)винил)-
2-(4-нитрофенил)диазин
(12).
Выход
75%,
Общая методика синтеза {[(2,2-дихлор-1-фе-
кристаллы темно бордового цвета, т.пл. 170-173°C.
нилвинил)диазенил]фенил}метанов. В колбу
Спектр ЯМР 1H (300 МГц, CDCl3), δ, м.д.: 3.88 с
помещают 1 ммоль исходного гидразона, добав-
(3H, OCH3), 6.99 д (Hаром, J 8.7 Гц), 7.13 д (2Hаром, J
ляют сначала 10-12 мл ДМСО, а затем ТМЕДА
8.7 Гц), 7.91 д (2Hаром, J 8.9 Гц), 8.33 д (2Hаром, J
(290 мг, 1.25 моль/экв). Затем добавляют CuCl (6 мг,
8.9 Гц). Спектр ЯМР 13C (75 МГц, CDCl3), δ, м.д.:
3 моль %), а в конце - CCl4 (4-5 моль/экв, 1.5 г).
14.1, 22.6, 29.7, 55.2, 113.8, 123.7, 124.6, 148.8,
Магнитную мешалку приводят в рабочее сос-
155.9, 160.0, 162.3.
тояние. За реакцией следят с помощью ТСХ.
Обычно реакция заканчивается через 1.5-3 ч. По
(E)-1-[2,2-Дихлор-1-(4-метоксифенил)винил]-
окончании реакции смесь переводят в дели-
2-(3,5-диметилфенил) диазин (13). Выход 73%,
тельную воронку и добавляют 50-60 мл воды.
кристаллы оранжевого цвета, т.пл.
124-126°C.
Проводят экстракцию реакционной смеси метилен-
Спектр ЯМР 1H (300 МГц, CDCl3), δ, м.д.: 2.32 с
хлоридом
(3×15 мл). После промывки водой
(6H, CH3), 3.80 с (3H, CH3), 6.99 д (2Hаром, J 8.8 Гц),
органическую фазу (3×50 мл) промывают еще один
7.20-7.10 м (3Hаром), 7.31 с (2Hаром). Спектр ЯМР
раз насыщенным раствором NaCl (1×50 мл). Высу-
13C (75 МГц, CDCl3), δ, м.д.: 21.1, 55.5,114.1, 120.9,
шивают Na2SO4 (MgSO4), фильтруют и дихлор-
124.3, 131.7, 133.9, 139.2, 152.4, 152.8, 159.9.
метан отгоняют с помощью вакуумного ротора-
испарителя. Остаок снова очищают методом коло-
(E)-1-[2,2-Дихлор-1-(4-метокфенил)винил]-2-
ночной хроматографии (эльюент - дихлорметан-
(4-фторфенил)диазин (14). Выход 71%, кристаллы
гексан, 1:5). Разделенные с помощью ТСХ фракции
оранжевого цвета, т.пл. 155-156°C. Спектр ЯМР 1H
основных продуктов реакции снова отгоняют в
(300 МГц, CDCl3), δ, м.д.: 3.84 с (3H, OCH3), 6.95 д
роторе и вычисляют выход продукта реакции.
(2Hаром, J 8.6 Гц), 7.16-7.06 м (4Hаром), 7.79 д.д
(2Hаром, J 8.7, 5.4 Гц). Спектр ЯМР 13C (75 МГц,
(E)-4-{[2,2-Дихлор-1-(4-метоксифенил)винил]-
CDCl3), δ, м.д.: 50.6, 109.0, 111.3, 111.6, 119.6,
диазенил}бензонитрил (9). Выход 73%, кристаллы
120.6, 120.7, 126.7, 155.1, 157.7.
оранжевого цвета, т.пл. 197-198°C. Спектр ЯМР 1H
(300 МГц, CDCl3), δ, м.д.: 3.93-3.83 м (3H), 7.07-
(E)-1-[2,2-Дихлор-1-(4-метоксифенил)этил]-2-
6.89 м (2Hаром), 7.17-7.08 м (2Hаром), 7.44-7.30 м
(2,4-дихлорфенил)диазин
(15).
Выход
68%,
(2Hаром), 7.54 д (1Hаром, J 7.0 Гц), 7.70-7.59 м
кристаллы оранжевого цвета, т.пл.
151-152°C.
(1Hаром). Спектр ЯМР 13C (75 МГц, CDCl3), δ, м.д.:
Спектр ЯМР 1H (300 МГц, CDCl3), δ, м.д.: 3.87 с
14.1, 29.7, 55.5, 113.8, 115.0, 115.4, 130.3, 130.3,
(3H, OCH3), 6.94 д.д (2Hаром, J 17.0, 8.8 Гц), 7.18 д
130.5, 133.1, 133.8, 153.8.
(2Hаром, J 8.8 Гц), 7.31 д (1Hаром, J 2.1 Гц), 7.54-7.48
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
180
ШИХАЛИЕВ и др.
м (1Hаром), 7.64-7.56 м (1Hаром). Спектр ЯМР 13C
8. Muzalevskiy V.N., Shastin A.V., Demidovich A.D.,
(75 МГц, CDCl3), δ, м.д.: 14.1, 22.7, 29.7, 31.9, 55.2,
Shikhaliev N.G., Magerramov A.M., Khrustalev V.N.,
Rakhimov R.D., Vatsadze S.Z., Nenajdenko V.G.
113.5, 113.8, 118.4, 127.7, 128.0, 130.0, 130.4, 131.5.
Beilstein J. Org. Chem. 2015, 11, 2072-2078. doi
(1Z,2Z)-1,2-Бис{2-[3,5-бис(трифторметил)фе-
10.3762/bjoc.11.223
нил]гидранилидин}-1,2-бис(4-метоксифенил)-
9. Muzalevskiy V.M., Shikhaliev N.G., Magerramov A.M.,
этан
(16). Выход
65%, кристаллы коралового
Gurbanova N.V., Geydarova S.D., Balenkova E.S.,
цвета, т.пл. 118-120°C. Спектр ЯМР 1H (300 МГц,
Shastin A.V., Nenajdenko V.G. Russ. Chem. Bull. 2013,
CDCl3), δ, м.д.: 3.89 д (6Hаром, J 1.3 Гц), 7.00 д
62, 678-682. doi 10.1007/s11172-013-0091-4
(4Hаром, J 8.7 Гц), 7.13 д (4Hаром, J 8.7 Гц), 7.52 м
10. Muzalevskiy V.M., Magerramov A.M., Shikhaliev N.G.,
(2Hаром), 7.96 с (2Hаром), 8.23 с (4H). Спектр ЯМР
Balenkova E.S., Shastin A.V., Dorovatoskii P.V.,
Zubavitchus Y.V., Khrustalev V.N., Nenajdenko V.G.
13C (75 МГц, CDCl3), δ, м.д.: 25.1, 50.6, 109.2, 118.6,
Russ. Chem. Bull. Int. Ed. 2016, 65, 1541-1549. doi
118.9, 119.5, 125.4, 126.6, 127.8, 148.5, 155.4.
10.1007/s11172-016-1480-2
11. Nenajdenko V.G., Shastin A.V., Gorbachev V.M.,
ФОНДОВАЯ ПОДДЕРЖКА
Shorunov S.V., Muzalevskiy V.M., Lukianova A.I.,
Dorovatovskii P.V. ACS Catal. 2017, 7, 205-209. doi
Работа выполнена при финансовой поддержке
10.1021/acscatal.6b03196
РФФИ (грант
№ 16-29-10669), Министерства
12. Shastin A.V., Tsyrenova B.D., Sergeev P.G.,
образования и науки РФ (проект № 4.1154.2017/4.6)
Roznyatovsky V.A., Smolyar I.V., Khrustalev V.N.,
и при финансовой поддержке Фонда Развития
Nenajdenko V.G. Org. Lett. 2018, 20, 7803-7806. doi
Науки при Президенте Азербайджанской Республике
10.1021/acs.orglett.8b03227
EİF-BGM-4-RFTF-1/2017-21/13/4.
13. Shastin A.V., Sergeev P.G., Lukianova A.I.,
Muzalevskiy V.M., Khrustalev V.N., Dorovatovskii P.V.,
КОНФЛИКТ ИНТЕРЕСОВ
Nenajdenko V.G. Eur. J. Org. Chem. 2018, 36, 4996-
5006. doi 10.1002/ejoc.201800441
Авторы заявляют об отсутствии конфликта
14. Shikhaliyev N.G., Ahmadova N.E., Gurbanov A.V.,
интересов.
Maharramov A.M., Mammadova G.Z., .Nenajdenko V.G.,
Zubkov F.I., Mahmudov K.T., Pombeiro A.J.L. Dyes Pigm.
СПИСОК ЛИТЕРАТУРЫ
2018, 150, 377-381. doi 10.1016/j.dyepig.2017.12.033
15. Maharramov A.M., Shikhaliyev N.G., Suleymanova G.T.,
1. Shastin A.V., Korotchenko V.N., Nenaidenko V.G.,
Gurbanov A.V., Babayeva G.V., Mammadova G.Z.,
Balenkova E.S. Russ. Chem. Bull. 1999, 48, 2184-2188.
Zubkov F.I., Nenajdenko V.G., Mahmudov K.T.,
doi 10.1007/s11172-006-0030-8
Pombeiro A.J.L. Dyes Pigm. 2018, 159, 135-289. doi
10.1016/j.dyepig.2018.06.022
2. Shastin A.V., Korotchenko V.N., Nenaidenko V.G.,
Balenkova E.S. Tetrahedron. 2000, 56, 6557-6563. doi
16. Shikhaliyev N.G., Kuznetsov M.L., Maharramov A.M.,
10.1016/S0040-4020(00)00606-2
Gurbanov A.V., Ahmadova N.E., Nenajdenko V.G.,
3. Shastin A.V., Korotchenko V.N., Nenaidenko V.G.,
Mahmudov K.T., Pombeiro A.J.L. Cryst. Eng. Comm.
2019, 21, 5032-5038. doi 10.1039/C9CE00956F
Balenkova E.S. Synthesis.
2001,
2081-2088. doi
10.1007/s11172-011-0359-5
17. Shikhaliyev N.G., Suleymanova G.T., İsrayilova A.A.,
Ganbarov Kh.G., Babayeva G.V., Garazadeh Kh.A.,
4. Korotchenko V.N., Shastin A.V., Nenajdenko V.G.,
Balenkova E.S. J. Chem. Soc. Perkin Trans. 1. 2002,
Mammadova G.Z., Nenajdenko V.G. Arkivoc. 2019, vi,
64-73. doi 10.24820/ark.5550190.p010.979
883-887. doi 10.1039/B201131J
5. Korotchenko V.N., Shastin A.V., Nenajdenko V.G.,
18. Battye T.G., Kontogiannis L., Johnson O., Powell H.R.,
Leslie A.G.W. Acta Cryst. 2011, D67, 271-281.doi
Balenkova E.S. Org. Biomol. Chem. 2003, 1906-1908.
doi 10.1039/B303221C
10.1107/S0907444910048675
19. Spek A.L. PLATON, A Multipurpose Crystallographic
6. Nenajdenko V.G., Shastin A.V., Korotchenko V.N.,
Varseev G.N., Balenkova E.S. Eur. J. Org. Chem. 2003,
Tool, Utrecht University, the Netherlands, 2009.
302-308. doi 10.3103/S0027131411060071
20. Evans P. Acta Cryst. 2006, D62, 72-82. doi 10.1107/
7. Nenajdenko V.G., Varseev G.N., Korotchenko V.N.,
s0907444905036693
Shastin A.V., Balenkova E.S. J. Fluorine Chem. 2003,
21. Sheldrick G.M. Acta Cryst. 2015, C71, 3-8.doi 10.1107/
124, 115-118. doi 10.1016/S0022-1139(03)00199-4
S2053229614024218
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
СИНТЕЗ ДИХЛОРДИАЗАДИЕНОВ НА ОСНОВЕ 4-МЕТОКСИБЕНЗАЛЬДЕГИДА
181
Synthesis and Structural Study of Dichlorodiazadienes Derived
from 4-Methoxybenzaldehyde
N. G. Shikhaliyeva, *, U. F. Askerovaa, S. H. Mukhtarova, A. A. Niyazovaa,
A. M. Magerramova, P. V. Dorovatovskyb, V. N. Khrustalevc, d, **, and V. G. Nenajdenkoe, ***
a Baku State University, 1148, Republic of Azerbaijan, Baku, ul. Z. Khalilov 23
*e-mail: namiqst@gmail.com
b National Research Center Kurchatov Institute, 123182, Russia, Moscow, ul. Akademika Kurchatova 1
c Russian University of Peoples' Friendship, 117198, Russia, Moscow, ul. Mikluho-Maklaya 6
**e-mail: vnkhrustalev@gmail.com
d Zelinsky Institute of Organic Chemistry RAS, 119991, Russia, Moscow, Leninsky pr. 47
e Moscow State University, 119991, Russia, Moscow, Leninskie Gory 1
***e-mail: nenajdenko@gmail.com
Received September 2, 2019; revised October 14, 2019; accepted December 20, 2019
The transformation of N-substituted hydrazones of 4-methoxybenzedehyde into the corresponding 1,2-diazabute-
1.3-dienes under the influence of carbon chloride in the presence of copper chloride(I) has been studied. It was
shown that hydrazones of different nature, containing both donor and acceptor groups in the hydrazine fragment
can be involved in the reaction. An additional evidence of the radical mechanism of this transformation was
obtained on the base of derivative of 3,5-bistrifluoromethylphenyl hydrazine. The features of the structure of the
products are studied using X-ray.
Keywords: catalytic olefination, 1,2-diazabute-1.3-dienes, hydrazone
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020