ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2020, том 56, № 2, с. 253-258
УДК 547.473.2 + 547.514.4
ПРОМОТИРУЕМОЕ DBU ОКИСЛЕНИЕ КИСЛОРОДОМ
ВОЗДУХА ЦИКЛОПЕНТАНОВОГО АЛЛИЛСИЛАНА
С γ-ФОРМИЛЬНОЙ ГРУППОЙ
© 2020 г. А. М. Гимазетдинов, А. З. Альмухаметов, М. С. Мифтахов*
ФГБНУ «Уфимский Институт химии Уфимского федерального исследовательского центра РАН»,
450054, Россия, Республика Башкортостан, г.Уфа, пр. Октября 71
*e-mail: bioreg@anrb.ru
Поступила в редакцию 21 августа 2019 г.
После доработки 10 октября 2019 г.
Принята к публикации 02 декабря 2019 г.
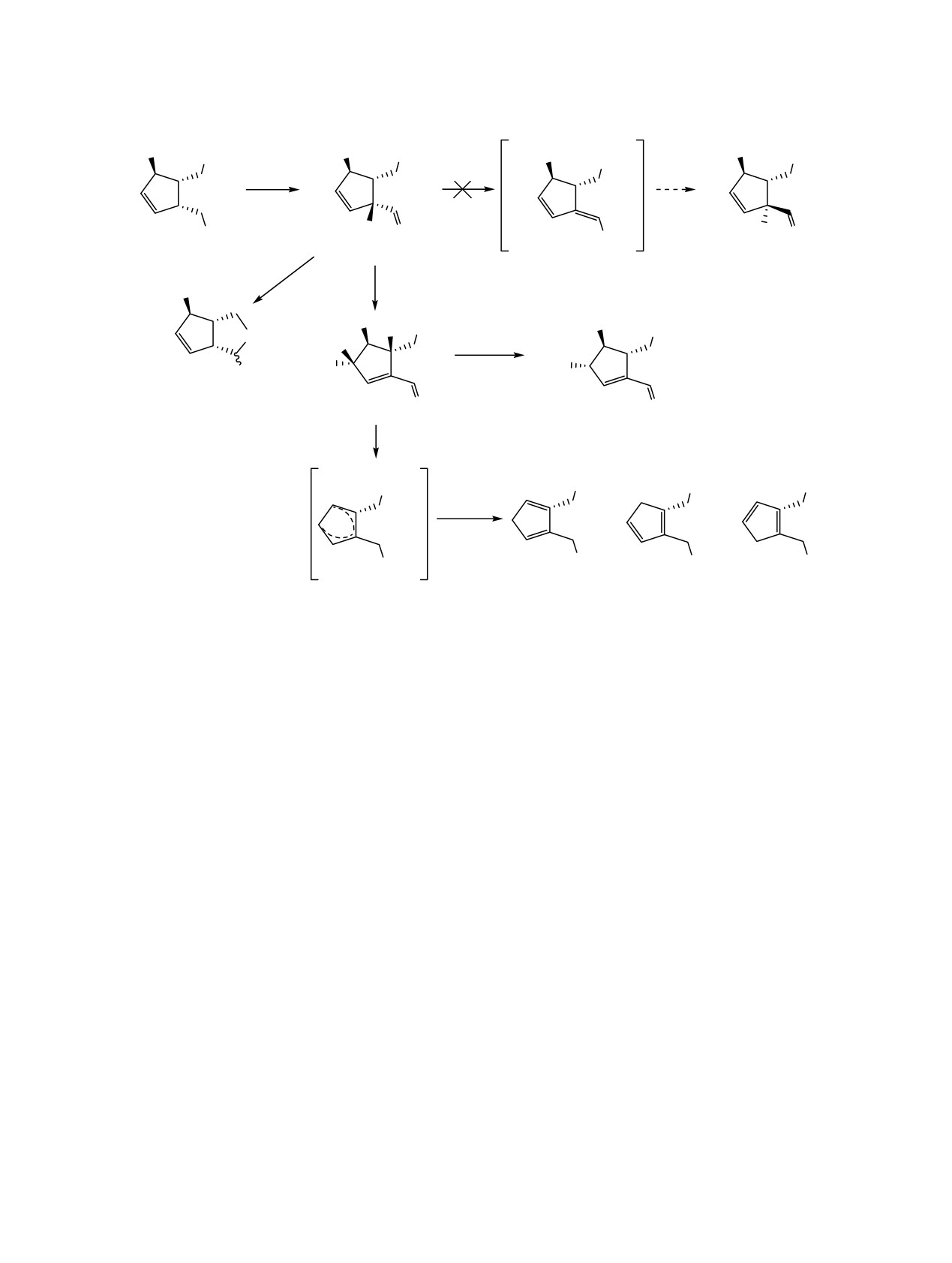
(1R,4R,5S)-5-{[(трет-Бутилдиметилсилил)окси]метил}-4-(триметилсилил)-циклопент-2-ен-1-карбаль-
дегид в среде толуол-DBU-O2 претерпевает тандемного типа превращение «изомеризация-окисление»,
приводя с хорошим выходом к (3S,4S,5S)-5-{[(трет-бутилдиметилсилил)окси]метил}-3-гидрокси-4-
(триметилсилил)циклопент-1-ен-1-карбальдегиду. Предложены возможные пути образования продукта
C3-окисления исходного аллилсилана по «карбанион-енолятному» механизму.
Ключевые слова: диазабициклоундецен, «карбанион/енолят»-окисление, γ-гидрокси-α,β-непредельные
альдегиды, β,γ-непредельные альдегиды, аллилсиланы.
DOI: 10.31857/S0514749220020123
γ-Оксигенированные енали представляют инте-
ления по Десс-Мартину спирта
2, в данное
рес как реакционноспособные синтетические блоки
превращение вовлекалось после стандартной
в направленном синтезе [1-3]. Эти соединения
обработки и без предварительной очистки. Причи-
легкодоступны, например, из реакций олефиниро-
на этого заключалась в десилилировании и образо-
вания по Виттигу α,β-эпоксиальдегидов с метокси-
вании лактола
4 при хроматографировании.
метилидентрифенилфосфораном [4]; окисления γ-
Поэтому в реакцию с DBU в толуоле был запущен
эпоксиспиртов реагентом Сверна
[5] и др
[6].
сырой альдегид 1, при этом вместо ожидаемого
Также γ-гидроксиенали могут быть получены
процесса эпимеризации с образованием 5 происх-
непосредственно из α,β-непредельных альдегидов
одило постепенное накопление аллилового спирта
региоселективным оксигенированием TEMPO-
3 (схема 1). Структура данного соединения была
радикалом в рацемическом [7] и энантиоселектив-
подтверждена данными спектров ЯМР и ИК. О
ном [8, 9] вариантах. Образование γ-оксигени-
взаимном транс-расположении гидроксильной и
рованных еналей наблюдается в реакциях окисли-
триметилсилильной групп свидетельствует нали-
тельной фрагментации полиненасыщенных жир-
чие NOE-взаимодействий между протонами H3 и
ных кислот in vivo, в частности из линолевой кис-
H5 с метильными протонами силановой группы и
лоты автоокислением генерируется цитотоксичный
отсутствие такового с протоном H4 согласно спект-
γ-гидроксиноненаль [10].
рам NMR 2D. Однако, в масс-спектрах полученных
при химической ионизации отсутствовали пики
В ходе изучения реакции изомеризации цикло-
соответствующие молекулярному иону, но в
пентенового альдегида 1 [11, 12] действием диаза-
области положительных ионов имелся пик с моле-
бициклоундецена (DBU) в кипящем толуоле, мы
кулярной массой 311+, который мог быть образо-
наблюдали нетривиальный вариант регио- и
ван в результате отщепления гидроксильной
стереоселективного оксигенирования в его аллил-
группы после ионизации. Несмотря на высокий
силановом фрагменте с образованием гидрокси-
выход данного соединения, оно оказалось заметно
еналя
3. Необходимо отметить то, что само
лабильным при хранении его как в индиви-
исходное соединение 1, полученное в ходе окис-
дуальном виде, так и в виде растворов (хлороформ,
253
254
ГИМАЗЕТДИНОВ и др.
Схема 1.
Me3Si
Me3Si
Me3Si
OTBS
OTBS
Me3Si
OTBS
OTBS
DBU
[O]
+H+
crude
[5, 6]
_H+
_
OH
H O
H
O
O
2
1
5
SiO2
DBU
85%
Me3Si
[5, 6]
Me3Si
Me3Si
H
OTBS
OTBS
O
4
H
Ac2O-Py
5
HO
3
92%
AcO
OH
4
O
O
3
6
NaBH4
OTBS
OTBS
OTBS
OTBS
Ac2O-Py
+
+
79%
(2 steps)
OAc
OAc
OAc
OH
7
8
9
1.5:1.1:1
хлористый метилен, ацетон). Поэтому для более
татом данного процесса является сдвиг кратной
точного подтверждения наличия в структуре
связи и образование в разных случаях перекисей,
гидроксильной группы, а также для повышения
спиртов или карбонильных соединений [13, 14].
стабильности оно было обработано ацилирующей
Выделяют два возможных механизма данных
смесью до соединения 6. Стабильность получен-
превращений: «оксиген-еновый» [15] и «енолят-
ного соединения была несколько выше, однако, в
ный»
[16]. Первого придерживаются во всех
масс-спектре все также детектировался пик с
случаях самопроизвольного окисления на воздухе
молекулярной массой 311+. Другим возможным
и он заключается в атаке синглетным кислородом
вариантом стабилизации являлось борогидридное
по кратной связи. При этом в случае α,β-непре-
восстановление альдегида 1, однако, в результате
дельных соединений образуются соответствующие
происходило быстрое образование нестабильного
γ-гидропероксопроизводные
[17]. Что касается
при хранении и в условиях колоночной хрома-
окисления простых двойных связей, то здесь
тографии соединения (контроль методом ТСХ).
направление атаки и вид конечного продукта
Ацилирование этого продукта без выделения
сильно зависит от характера замещенности и
приводила к (1.5-1.1-1)-смесь ацетатов 7 + 8 + 9. В
стереохимии самой связи [18, 19]. Так, например у
отнесении
7-9 характеристично наличие в их
E-аллилсилана происходит сдвиг двойной связи к
структурах кольцевого метиленового звена, что
силановой группе, а в случае Z-производного от
отчетливо проявляется в виде соответствующих
нее [21]. «Енолятное» окисление характерно для
сигналов CH2-групп в спектрах ЯМР 13C (dept135).
карбонильных соединений и протекает в при-
сутствии оснований, при этом атаке кислорода
Полученные результаты указывали на протека-
подвергается β-положение двойной связи енолизи-
ние автоокисления кислородом, реакции доста-
рованной формы [21-23]. Если рассматривать β,γ-
точно известной в органическом синтезе, особенно,
непредельные карбонильные соединения, то
для ненасыщенных соединений, в том числе и для
известные случае касаются
«оксиген-енового»
β,γ-ненасыщенных альдегидов. Итоговым резуль-
окисления, при этом региоселективность процесса
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
ПРОМОТИРУЕМОЕ DBU ОКИСЛЕНИЕ КИСЛОРОДОМ ВОЗДУХА ЦИКЛОПЕНТАНОВОГО
255
сильно зависит от типа соединений. Так в случае
шалось и после исчезновения исходного практи-
эфиров преимущественно окисляется β-положение
чески не детектировалось. Основной причиной
карбонильной группы [15], а альдегидов и кетонов
роста содержания продукта, видимо, является
γ-положение [24, 25].
начальное содержание кислорода в растворе, а
расходование его, вероятно, происходит в ходе
Что касается получения соединения
3, то
катализируемой основанием фрагментации по
принципиально оно согласуется с механизмом
Петерсену, особенно характерной для транс-виц-
«оксиген-енового» окисления как β,γ-непредель-
гидроксисиланов [27-29]. Отсутствие подобного
ных карбонильных соединений, так и Z-аллилиси-
для случая с DBU мы связываем прежде всего с его
ланов. Однако, длительное выдерживание соеди-
малой нуклеофильностью. Использование в
нения
1 в кипящем толуоле при обеспечении
качестве основания триэтиламина, оказалось мало-
доступа воздуха не приводило к видимым изме-
эффективно и в толуоле, и в среде ацетонитрил-
нениям согласно ТСХ реакционной массы. Таким
метанол. Кипячение, вследствие летучести осно-
образом, очевидно, что DBU в этом процессе
вания, было заменено на циклический нагрев-
выступает в качестве основания, инициируя
охлаждение под обратным холодильником, но,
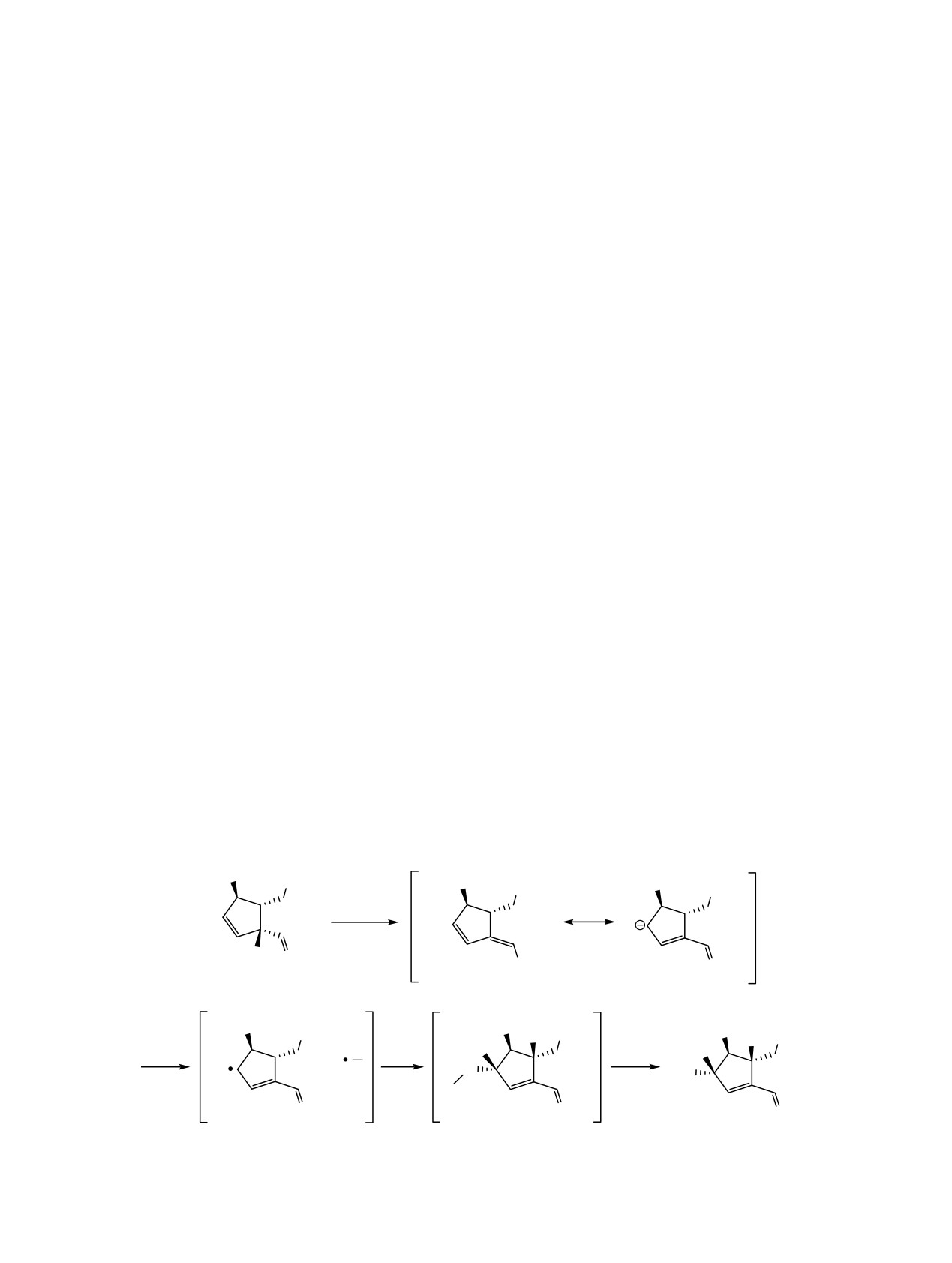
вариант «карбанион-енолятного» окисления. При
даже при использовании большого избытка, накоп-
этом вначале происходит енолизация альдегидной
ление продукта происходило очень медленно.
функции 1 с генерированием диенолята 10 и далее
через интермедиат
11, окисляется до
12 O2 с
Таким образом, в данной статье мы на примере
переносом электрона и образованием пероксид-
карбонильного соединения 1 описали стерео- и
аниона 13, стабилизирующегося протонированной
региоселективный вариант «карбанион-енолятно-
формой DBU до 3 (схема 2). Движущей силой
го» окисления, протекающего при катализе ненук-
оксигенирования 1 также является и стабилизация
леофильного основания, сопровождающееся сдви-
α-карбаниона 11 близлежащей силильной группой
гом двойной связи в сопряжение и приводящее к γ-
(α-эффект) [26]. Кроме того пространственное рас-
гидроксипроизводному.
положение этой группы оказывает непосредст-
венное влияние на стереселективность данного
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
превращения. Кроме DBU были испытаны и
другие основания, так, при использовании сильных
ИК спектры получены на спектрофотометре
оснований (KOH, NaOH или MeONa) в среде
UR-20 в тонком слое или в виде суспензии в
ацетонитрил-метанол происходило достаточно
нуйоле. Спектры ЯМР 1H и 13С записаны на спектро-
быстрое расходование исходного соединения
метре Bruker AM-300 [300 (1Н) и 75.47 (13С) МГц]
(согласно ТСХ). Что касается продукта 3, то его
или BrukerAvanceIII [500 (1Н) и 125 (13С) МГц]; для
появление в реакционной массе проявлялось очень
растворов в CDCl3 внутренний стандарт CHCl3 или
быстро, однако, видимым накоплением не сопро-
ТМС, для растворов в CH3OD внутренний стандарт
вождалось. Напротив его содержание лишь умень-
ТМС. Масс-спектры сняты в этаноле на спектро-
Схема 2.
Me3Si
OTBS
Me3Si
Me3Si
OTBS
OTBS
DBU
_
H O
O
O
1
10
11
Me3Si
Me3Si
OTBS
H
OTBS
Me3Si
H
OTBS
H
H
O
2
H+
+ O2
O
_
DBU
HO
O
O
O
O
12
13
3
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
256
ГИМАЗЕТДИНОВ и др.
метре Shimadzu LCMS-2010 EV. Для ТСХ анализа
чением 0.24 г (85% в расчете на спирт 2) титуль-
применяли хроматографические пластины Sorbfil.
ного соединения в виде прозрачной желтоватой
Углы вращения измерены на приборе Perkin-Elmer
маслообразной жидкости. Rf (петролейный эфир-
241 МС. Элементный анализ выполнен на приборе
этилацетат, 5:1) 0.4. [α]
20 +13.4 (c 0.85, CH2Cl2). ИК
EuroEA 3000 CHNS-analyzer. Чистоту исходных
спектр, ν, см-1 (жидкая плёнка): 3443, 2955, 2930,
соединений контролировали методом ГЖХ на
2857, 1686, 1471, 1251, 1092, 837. Спектр ЯМР 1H,
приборе CHROM 5.
δ, м.д.: 0.00 с [9H, (CH3)3Si], 0.03 с [6H, (CH3)2Si],
0.89 с [9H, (CH3)3C], 1.29 т (1H, H4, J 2.7 Гц), 2.87 с
(1R,4R,5S)-5-{[(трет-Бутилдиметилсилил)-
(1H, OH), 2.92-2.96 м (1H, H5), 3.70 д.д (1H, J 3.1,
окси]метил}-4-(триметилсилил)цикло-пент-2-
9.5 Гц, CHαHβ-O), 3.86 д.д (1H, CHαHβ-O, J 4.7, 9.5 Гц),
ен-1-карбальдегид (1). К перемешиваемому раст-
4.66 с (1H, H3), 6.91 с (1H, H2), 9.85 с (1H, CHO).
вору 1.05 г (2.55 ммоль) реагента Десс-Мартина и
Спектр ЯМР 13С, δ, м.д.: -6.16 [(CH3)2Si], -3.94
50 мл хлористого метилена при 0°C добавляли
[(CH3)3Si], 18.12 [(CH3)3C], 25.45 [(CH3)3C], 37.52
0.53 г (1.7 ммоль) спирта 2 в 50 мл хлористого
(C4), 45.92 (C5), 64.45 (CH2O), 76.04 (C3), 146.83
метилена. Температуру поднимали до комнатной и
(C1), 153.11 (C2), 190.38 (CHO). Масс-спектр, m/z
перемешивали 5 ч при этой температуре (контроль
(Iотн, %): 311 (100) [M - OH]+. Найдено, %: C 58.31;
методом ТСХ), добавили
20 мл насыщенного
H 9.75. C16H32O3Si2. Вычислено, %: C 58.48; H 9.82.
раствора тиосульфата натрия, перемешивали еще
30 мин. Органический слой отделяли, водную часть
(1S,4S,5S)-4-{[(трет-Бутилдиметилсилил]-
экстрагировали хлористым метиленом 3×50 мл.
окси}метил)-3-формил-5-(триметилсилил)цик-
Объединенные органические экстракты сушили
лопент-2-ен-1-ил ацетат (6). К перемешиваемому
над MgSO4, упаривали при пониженном давлении
раствору 0.2 г (0.6 ммоль) альдегида 3 и 3 мл пири-
и вакуумировали. Получили 1.1 г сырого альдегида
дина при комнатной температуре добавляли 1 мл
в виде оранжевой аморфной массы, содержащего
уксусного ангидрида. Полученную смесь переме-
около 50% примеси продукта разложения реагента
шивали 6 ч (контроль методом ТСХ), органический
Десс-Мартина (согласно ЯМР 1H). В дальнейших
растворитель упаривали при пониженном давле-
превращениях сырой альдегид использовался без
нии, остаток чистили колоночной хроматографией
очистки. C16H32O2Si2. Rf (петролейный эфир-этил-
на силикагеле системой петролейный эфир-этил-
ацетат, 40:1) 0.6. ИК спектр, ν, см-1 (жидкая плёнка):
ацетат (10:1) с получением 0.22 г (92%) титульного
2954, 2855, 1723, 1700, 1683, 1465, 1249, 1173, 838,
соединения в виде прозрачной желтоватой масло-
775. Спектр ЯМР 1H, δ, м.д.: 0.03 с [9H, (CH3)3Si],
образной жидкости. Rf (петролейный эфир-этил-
20
0.05 с [6H, (CH3)2Si], 0.89 с [9H, (CH3)3C], 1.83 квинт
ацетат, 10:1) 0.4. [α]
+47.2 (c 1.0, CH2Cl2). ИК
(1H, H4, J 2.6 Гц), 2.73-2.79 м (1H, H5), 3.45-3.50 м
спектр, ν, см-1 (жидкая плёнка): 2955, 2930, 2857,
(1H, H1), 3.57 д.д (1H, CHαHβ-O, J 5.2, 10.2 Гц), 3.65
1739, 1693, 1252, 1237, 838, 776. Спектр ЯМР 1H, δ,
д.д (1H, CHαHβ-O, J 8.4, 10.0 Гц), 5.51 д.т (1H, H3, J
м.д.: 0.03 с [9H, (CH3)3Si], 0.06 с [6H, (CH3)2Si], 0.89
2.6, 5.7 Гц), 5.93 д.т (1H, H2, J 2.8, 5.7 Гц), 9.73 д
с [9H, (CH3)3C], 1.58 т (1H, H5, J 3.1 Гц), 2.00 с (3H,
(1H, CHO, J 3.0 Гц). Спектр ЯМР 13С, δ, м.д.: -6.15
OAc), 2.93-3.01 м (1H, H4), 3.65 д.д (1H, CHαHβ-
[(CH3)2Si], -3.85 [(CH3)3Si], 17.79 [(CH3)3C], 25.27
OSi, J 7.0, 9.4 Гц), 3.79 д.д (1H, CHαHβ-OSi, J 3.7,
[(CH3)3C], 38.12 (C5), 45.63 (C4), 60.70 (C1), 63.49
9.5 Гц), 5.68 т (1H, H1, J 2.7 Гц), 6.86-6.92 м (1H,
(CH2O), 128.07 (C2), 135.93 (C3), 201.04 (CHO).
H2), 9.88 с (1H, CHO). Спектр ЯМР 13С, δ, м.д.:
Масс-спектр, m/z (Iотн, %): 313 (100) [M + H]+.
–6.08 [(CH3)2Si], -3.91 [(CH3)3Si], 18.00 [(CH3)3C],
20.21 (CH3C=O), 25.40 [(CH3)3C], 33.06 (C5), 46.68
(3S,4S,5S)-5-{[(трет-Бутилдиметилсилил)-
(C4), 64.97 (CH2OSi), 79.12 (C1), 147.45 (C3), 150.34
окси]метил}-3-гидрокси-4-(триметилсилил)-
(C2), 169.68 (CH3C=O), 189.99 (CHO). Масс-спектр,
циклопент-1-ен-1-карбальдегид (3). К перемеши-
m/z (Iотн, %): 311 (100) [M - CH3CO-]+. Найдено, %:
ваемому раствору 0.55 г сырого альдегида 1 и
C 58.15; H 9.08. C18H34O4Si2. Вычислено, %: C
20 мл толуола при комнатной температуре добав-
58.33; H 9.25.
ляли 50 мг 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU)
и полученную смесь кипятили
5 ч (контроль
(5-{[(трет-Бутилдиметилсилил)окси]метил}-
методом ТСХ). Органический растворитель упари-
циклопента-1,4-диен-1-ил)метил ацетат (11), (2-
вали при пониженном давлении, остаток чистили
{[(трет-бутилдиметилсилил)окси]метил}цик-
колоночной хроматографией на силикагеле систе-
лопента-1,4-диен-1-ил)метил ацетат (12) и (2-
мой петролейный эфир-этилацетат (10:1) с полу-
{[(трет-бутилдиметилсилил)окси]метил}цикло-
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
ПРОМОТИРУЕМОЕ DBU ОКИСЛЕНИЕ КИСЛОРОДОМ ВОЗДУХА ЦИКЛОПЕНТАНОВОГО
257
пента-1,3-диен-1-ил)метил ацетат (13). К переме-
[(CH3)2Si], 17.93 [(CH3)3C], 19.83 (CH3C=O), 25.35
шиваемому раствору 0.15 г (0.45 ммоль) альдегида
[(CH3)3C],
43.16 (C5),
58.48 (CH2OSi),
59.06
3 и 15 мл абсолютного метанола при 0°C добав-
(CH2OAc), 131.20 (C4), 133.44 (C3), 144.73 (C1),
ляли 35 мг борогидрида натрия и полученную
145.74 (C2), 171.91 (CH3C=O).
смесь перемешивали 15 мин (контроль методом
ТСХ). Органический растворитель упаривали, к
БЛАГОДАРНОСТИ
остатку добавляли 5 мл воды и экстрагировали
этилацетатом (3×10 мл). Объединенные органи-
Спектральная часть исследования и теорети-
ческие экстракты сушили над MgSO4, упаривали
ческие вычисления проведены на оборудовании
при пониженном давлении и вакуумировали. К
ЦКП «Химия» УфИХ УФИЦ РАН.
полученному лабильному сырому спирту без выде-
ления добавляли 4 мл смеси Ac2O-Py (1:3) и пере-
ФОНДОВАЯ ПОДДЕРЖКА
мешивали при комнатной температуре 2 ч (конт-
роль методом ТСХ). После этого органический
Работа выполнена по государственному зада-
растворитель упаривали при пониженном давле-
нию № AAAA-A20-120012090021-4 (АААА-А17-
нии, остаток чистили колоночной хроматографией
117011910032-4) и при частичной финансовой
на силикагеле системой петролейный эфир-
поддержке Российского Фонда Фундаментальных
этилацетат (5:1) с получением 0.1 г (79%) 1.5:1.1:1-
Исследований (гранты РФФИ №№ 17-43-020326-а
смеси (согласно ЯМР 1H) соединений 7 + 8 + 9 в
и 18-53-00011-Бел_а).
виде прозрачной желтоватой маслообразной жид-
кости. Rf (петролейный эфир-этилацетат, 10:1) 0.7.
КОНФЛИКТ ИНТЕРЕСОВ
ИК спектр, ν, см-1 (жидкая плёнка): 2955, 2930,
2857, 1743, 1472, 1375, 1249, 1232, 1086, 838, 776.
Авторы заявляют об отсутствии конфликта
Масс-спектр, m/z (Iотн, %): 283 (100) [M + H]+, 223
интересов.
(80) [M - CH3COO-]+. Найдено, %: C 63.60; H 9.17.
C15H26O3Si. Вычислено, %: C 63.79; H 9.28.
СПИСОК ЛИТЕРАТУРЫ
Соединение 11. Спектр ЯМР 1H, δ, м.д.: 0.08 с
1. Гарибян О.А., Ованесян А.Л., Макарян Г.М.,
[6H, (CH3)2Si], 0.89 с [9H, (CH3)3C], 2.03 с (3H,
Петросян А.Л., Хобанян Ж.А. ЖОрХ. 2010, 46, 412-
OAc),
2.90-2.94 м
(2H, H3), 4.52-4.55 м
(2H,
415. [Garibyan O.A., Ovanesyan A.L., Makaryan G.M.,
CH2OSi), 4.89-4.91 м (2H, CH2OAc), 6.25-6.28 м
Petrosyan A.L., Chobanyan Zh.A. Russ. J. Org. Chem.
(1H, H4), 6.32-6.36 м (1H, H2). Спектр ЯМР 13С, δ, м.д.:
2010, 46, 406-409.] doi 10.1134/S1070428010030188
-6.09 [(CH3)2Si], 17.93 [(CH3)3C], 19.88 (CH3C=O),
2. Soulere L., Queneau Y., Doutheau A. Chem. Phys.
25.35 [(CH3)3C], 39.08 (C3), 60.06 (CH2OSi), 60.68
Lipids.
2007,
150,
239-243. doi
10.1016/
(CH2OAc), 128.76 (C4), 131.20 (C2), 135.28 (C1),
j.chemphyslip.2007.07.003
142.38 (C5), 169.82 (CH3C=O).
3. Tolstikov A.G., Prokopenko O.F., Yamilov R.Kh.,
Tolstikov G.A. Mendeleev Commun. 1991, 2, 64-65.
Соединение 12. Спектр ЯМР 1H, δ, м.д.: 0.08 с
doi 10.1070/MC1991v001n02ABEH000038
[6H, (CH3)2Si], 0.89 с [9H, (CH3)3C], 2.01 с (3H,
4. Yu L., Wang Z. Chem. Commun. 1993, 3, 232-234. doi
OAc), 3.08-3.10 м (2H, H3), 4.58 уш.с (2H, CH2OSi),
10.1039/C39930000232
4.86 уш.с (2H, CH2OAc), 6.32-6.36 м (1H, H4), 6.42-
5. Masao M., Kobayashi Y. J. Org. Chem. 2018, 83,
6.45 м (1H, H5). Спектр ЯМР 13С, δ, м.д.: -6.09
3906-3914. doi 10.1021/acs.joc.8b00256
[(CH3)2Si], 17.93 [(CH3)3C], 19.83 (CH3C=O), 25.35
6. White N.A., Rouis T., J. Am. Chem. Soc. 2014, 136,
[(CH3)3C],
42.63 (C3),
58.57 (CH2OSi),
58.79
14674-14677. doi 10.1021/ja5080739
(CH2OAc), 132.74 (C4), 133.31 (C5), 134.97 (C1),
7. Ho X.-H., Jung W.-J., Shyam P.K., Jang H.Y. Catal.
148.51 (C5), 170.03 (CH3C=O).
Sci. Techol.
2014,
4,
1914-1919. doi
10.1039/
Соединение 13. Спектр ЯМР 1H, δ, м.д.: 0.08 с
C4CY00271G
[6H, (CH3)2Si], 0.89 с (9H, [(CH3)3C], 2.00 с (3H, OAc),
8. Chen J.S., Abeykoon G.A. Org. Lett. 2015, 134, 6050-
3.06-3.08 м (2H, H5), 4.55-4.57 м (2H, CH2OSi),
6053. doi 10.1021/acs.orglett.5b03050
4.89-4.91 м (2H, CH2OAc), 6.37-6.40 м (1H, H4),
9. Mo J., Chen X., Chi Y.R. J. Am. Chem. Soc. 2012, 134,
6.51-6.53 м (1H, H3). Спектр ЯМР 13С, δ, м.д.: -6.09
8810-8813. doi 10.1021/ja303618z
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020
258
ГИМАЗЕТДИНОВ и др.
10. Sun M., Salomon R.G. J. Am. Chem. Soc. 2004, 126,
19. Park S., Yang D., Kim K.T., Jeon H.B. Tetrahedron
5699-5708. doi 10.1021/ja038756w
Lett. 2011, 52, 6578-6580. doi 10.1016/j.tetlet.2011.09.127
11. Гимазетдинов А.М., Альмухаметов А.З., Спири-
20. Dussault P.H., Eary C.T., Lee R.J., Zope U.R. J. Chem.
хин Л.В., Мифтахов М.С. ЖОрХ. 2017, 53, 821-829.
Soc., Perkin Trans. 1. 1999, 2189-2204. doi 10.1039/
[Gimazetdinov A.M., Al’mukhametov A.Z., Spirikhin L.V.,
A901243E
Miftakhov M.S. Russ. J. Org. Chem. 2017, 53, 836-
21. Sucrow W. Chem. Ber.
1967,
100,
259-264. doi
845.] doi 10.1134/S1070428017060057
10.1002/cber.19671000130
12. Gimazetdinov A.M., Al’mukhametov A.Z., Spirikhin L.V.,
22. Frimer A.A., Hameiri-Buch J., Ripshtos S., Gilinsky-
Miftakhov M.S. Tetrahedron Lett. 2017, 58, 3242-
Sharon P. Tetrahedron. 1986, 42,
5693-5706. doi
3245. doi 10.1016/j.tetlet.2017.07.023
10.1016/S0040-4020(01)88175-8
13. Clennan E.L. Tetrahedron. 2000, 56, 9151-9179. doi
23. Coburn C.E., Anderson D.K., Swenton J.S. J. Org.
10.1016/S0040-4020(00)00794-8
Chem. 1983, 48, 1455-1461. doi 10.1021/jo00157a014
14. Weyerstahl P., Wahlburg H.-C., Kaul V.K., Lochynski S.
24. Griesbeck A.G., Goldfuss B., Leven M., de Kiff A.
Liebigs Ann. Chem.
1992,
279-281. doi
10.1002/
Tetrahedron Lett. 2013, 54, 2938-2941. doi 10.1016/
jlac.199219920148
j.tetlet.2013.03.099
15. Adam W., Saha-Möller C.R., Weichold O. Monatshefte
25. Shimozu Y., Hirano K., Shibata T., Shibata N., Uchida K.
für Chemie.
2000,
131,
697-705. doi
10.1007/
J. Biol. Chem. 2011, 286, 29313-29324. doi 10.1074/
s007060070098
jbc.M111.255737
16. Li M., Chen B., Monteiro S., Rustum A.M. Tetrahedron
26. Chan T.H., Wang D. Chem. Rev. 1995, 95, 1279-1292.
Lett.
2009,
50,
4575-4581. doi
10.1016/
doi 10.1021/cr00037a007
j.tetlet.2009.05.074
27. Masse C.E., Panek J.S. Chem. Rev. 1995, 95, 1293-
17. Sugamoto K., Matsushita Y.-i., Yamamoto T., Matsui T.
1316. doi 10.1021/cr00037a008
Synth. Commun. 2005, 35, 1865-1874. doi 10.1081/
28. Fleming I., Barbero A., Walter D. Chem. Rev. 1997, 97,
SCC-200064901
2063-2192. doi 10.1021/cr941074u
18. Alberti M.N., Orfanopoulos M. Synlett. 2010, 7, 999-
29. Chabaud L., James P., Landais Y. Eur. J. Org. Chem.
1026. doi 10.1055/s-0029-1219790
2004, 3173-3199. doi 10.1002/ejoc.200300789
DBU-Promoted Oxidation by Atmospheric Oxygen
Cyclopentanoic Allylsilane with γ-Formyl Froup
A. M. Gimazetdinov, A. Z. Al’mukhametov, and M. S. Miftakhov*
Ufa Institute of Chemistry UFRS RAS, 450054, Russia, Republic of Bashkortostan, Ufa, pr. Oktyabrya 71
*e-mail: bioreg@anrb.ru
Received August 21, 2019; revised October 10, 2019; accepted December 2, 2019
(1R,4R,5S-5-{[(tert-Butyldimethylsilyl)oxy]methyl}-4-(trimethylsilyl)-cyclopent-2-en-1-carbaldehyde in
toluene-DBU-O2 medium undergoes a tandem-type transformation “isomerization/oxidation”, resulting in good
yield to (3S,4S,5S)-5-{[(tert-butyldimethylsilyl)oxy]methyl}-3-hydroxy-4-(trimethylsilyl)cyclopent-1-en-1-car-
baldehyde. Possible way of formation of product by C3-oxidation of the starting allylsilane via the “carbanion-
enolate” mechanism was proposed.
Keywords: diazabicycloundecene, “carbanion/enolate”-oxidation, γ-hydroxy-α,β-unsaturated aldehydes, β,γ-un-
saturated aldehydes, allylsilane
ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ том 56 № 2 2020